黄瓜在我国大部分地区以及全球广泛种植,其营养价值高,富含糖类、氨基酸、维生素等多种营养成分。但是在贮运过程中,黄瓜因其含水量极高,易受自身蒸腾作用的影响导致瓜身易失水皱缩[1],品质下降。黄瓜采后还会因为叶绿素降解而发生黄化现象[2],影响其商品特性。低温冷藏是黄瓜最常见也是比较简单的保存方法,适当的低温可以有效延长黄瓜的保存时间,但温度过低,可能会导致黄瓜出现冷害现象[3],如呼吸增强,表面塌陷,腐烂加重等症状。果实在受到逆境胁迫的时候会产生活性氧攻击果蔬细胞膜,导致细胞内容物外渗,相对电导率和丙二醛(malondialdehyde,MDA)含量也会因此升高[4],而MDA含量增加之后还会进一步的对细胞膜进行攻击,造成细胞功能丧失。所以控制活性氧的含量以及保持相关抗氧化酶的活性在果蔬保鲜中起着重要作用。
微孔膜包装通过调节包装膜上的孔数和孔径来控制包装内的气体成分,使果蔬处于适宜保鲜的气体比例中,比不打孔的普通包装保鲜效果更好,比需要专用机器和气体的气调包装技术成本更低,更适宜推广应用。俞静芬等[5]通过微孔膜结合1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理对水蜜桃进行贮藏,发现与对照组相比,果实的腐烂率、失重明显降低,保持了果实硬度,延长了果实的货架期。目前关于微孔膜延长黄瓜保鲜的机理,特别是细胞膜脂过氧化方面的研究文献比较缺乏。
主成分分析(principal component analysis,PCA),是一种可以实现数据降维的方法,它将原始的数据中具有相关性的自变量收集到不同主成分当中,使各主成分之间互不相关,从而对原始数据进行综合和简化,能够分析出各种处理方式的综合效果,以及对各指标的影响程度[6]。目前PCA已经广泛应用于果蔬的品质分析当中,如桃[7]、李子[8]、芹菜[9]等,而应用于黄瓜保鲜方面却鲜有报道。本实验采用微孔膜对冷藏黄瓜进行包装,利用PCA研究细胞膜脂过氧化及品质劣变情况,探讨微孔膜包装对冷藏黄瓜冷害抑制及品质保护的效果,为低成本的微孔膜技术在黄瓜冷藏保鲜中的推广应用提供理论支撑。
黄瓜采购于重庆市北碚区天生农贸市场,所购黄瓜大小、长度均匀,表皮无破损,个体坚挺,八成熟。购买之后立即送往实验室处理。聚丙烯(polypropylene,PP)防雾膜(厚度25 μm,O2透过率1 256.5 cm3/(m2·2 4 h·atm),23 ℃),河南前瞻包装材料有限公司。所有化学试剂均为分析纯。
UV-2450PC紫外可见分光光度计,日本岛津公司;DDS-307A电导率仪,上海雷磁公司;RXZ-8000智能人工气候箱,宁波东南仪器有限公司;GY-4数显式果实硬度计,浙江乐清艾德堡仪器有限公司。
1.3.1 样品准备
将购买的黄瓜用清水洗净之后晾干备用。用PP防雾膜进行不同孔数的防雾膜的包装,包装袋长宽为40 cm×30 cm,用孔径为0.3 mm的小针均匀地打孔。试验周期设置为2周(在4 ℃冷藏条件下冷藏1周后移入23 ℃室温下贮存1周),模拟冷藏及常温流通销售的温度条件。试验组为4组,且每组6根黄瓜,具体处理如下:(1)对照组:不进行包装;(2)膜包装无孔组:PP防雾膜包装不打孔;(3)微孔膜8孔组:PP防雾膜包装并在袋上打8个孔;(4)微孔膜16孔组:PP防雾膜包装并在袋上打16个孔。将处理好的各组样品放入人工气候箱中,冷藏环境设置为4 ℃、相对湿度85%~95%,每个组别设置3个重复。每2 d随机取样1次,分别进行各项指标的测定。
1.3.2 指标测定
1.3.2.1 感官评价
请10位经培训过的食品科学学院学生为各组样品打分,根据果实的果皮、果肉、气味、腐烂程度进行评定,分值8~1分别代表极好、非常好、好、一般、较差、差、非常差、极差,各项结果记总分后取其平均值。评分标准和计分方法如表1所示。
表1 感官评定标准
Table 1 Standard of sensory evaluation

分值/分果皮果肉气味腐烂程度7~8深绿色,有色泽,无褶皱透明、浅绿色、含水量大清新的黄瓜气味无霉变现象5~6浅绿色,光泽暗淡,稍有褶皱表皮周围果肉呈白色,稍有失水有黄瓜气味、稍带酸味有腐烂现象无霉变4淡黄色,无光泽,褶皱较严重横截面大部分果呈白色、失水较严重酸味严重腐烂较严重,有白色絮状的霉斑1~2黄色,无光泽,褶皱严重横截面全部呈白色,失水严重酸臭味腐烂严重,有大量白色絮状的霉斑
1.3.2.2 相对电导率
参考赵普莹[10]的方法并作适当修改,根据水浴前后2次测定的电导率计算其相对电导率(γe),计算公式见公式(1):
(1)
1.3.2.3 呼吸强度
参考曹建康等[11]的静置法进行测定,根据滴定结果计算黄瓜的呼吸强度,单位以mg CO2/(kg·h)表示。
1.3.2.4 果实硬度
用硬度计进行测定,在瓜身和两头分别随机取3个点[12] ,用3.5 mm直径的探头进行测定,单位为N,计算3点测量结果的平均值和标准差。
1.3.2.5 脂氧合酶(lipoxygenase,LOX) 活性
参考TODD等[13]的方法并稍作修改,以每克黄瓜鲜重每分钟吸光度增加0.01为1个LOX活性单位,以0.01ΔOD234/(min·g) mF表示。
1.3.2.6 MDA含量
参考CHEN等[12]的方法并稍作修改,每克黄瓜鲜样中的MDA含量用μmol/g mF表示。
1.3.2.7 超氧阴离子自由基![]() 产生速率
产生速率
参照曹建康等[11]的方法进行测定,以每克黄瓜样品每分钟产生的![]() 的物质的量作为
的物质的量作为![]() 的产生速率,表示为μmol/(min·g)。
的产生速率,表示为μmol/(min·g)。
1.3.2.8 过氧化物酶(peroxidase,POD)活性
参考CHEN等[12]的方法并作适当修改,以每克黄瓜鲜样每分钟吸光度变化1为1个POD活性单位,表示为ΔOD470/(min·g)。
1.3.2.9 超氧化物歧化酶(superoxide dismutase,SOD)活性
参照曹建康等[11]的方法并作适当修改,用氮蓝四唑还原法测定,以每克黄瓜鲜样在560 nm处每分钟对氮蓝四唑光化还原抑制达50%为1个SOD活性单位(U)。
1.3.2.10 过氧化氢酶(catalase,CAT)活性
参照曹建康等[11]的方法,并稍作修改,以每克黄瓜样品每分钟吸光度变化0.01为1个CAT酶活性单位,表示为0.01ΔOD240/(min·g)。
1.3.2.11 叶绿素含量
参考ARNON[14]的方法并稍作修改,计算每克样品中所含叶绿素的质量,用mg/g表示。
采用Microsoft Excel 2016对试验数据进行整理计算,使用SPSS18.0单因素方差分析和Duncan多重比较分析对各项指标进行显著性分析,用Origin 8.6对数据结果进行作图,用The UnscramblerX10.4对各项数据进行PCA。
本次实验将感官评价得分低于6分的黄瓜判定为失去商品性。如图1所示,各组感官评价得分均随贮藏时间的延长呈现出下降趋势,其中,CK组在第4天明显出现表面变软,腐烂加重等冷害症状,移入室温后腐烂霉变情况更加严重,在第6天时感官评价得分降为5.9,与实验组均有显著性差异(P<0.05),与LURIE等[15]的研究结果一致。这表明微孔包装可以在一定程度上抑制黄瓜果实的品质劣变;自贮藏第8天起,实验组感官评分下降速率均增大,但8孔组的感官评分仍为6.1,与无孔、16孔2组差异显著(P<0.05);16孔组与无孔组在12 d时得分分别为5.6、5.3,均失去商品性。无孔组移入室温后发生了霉变现象,可能是由于包装袋内气体交换率低,袋中相对湿度达到饱和,使得无孔组黄瓜发生了腐败现象,或是袋中O2含量低于黄瓜的耐受程度从而发生了无氧呼吸[16];16孔组移入室温后黄瓜虽未出现霉变但发生了黄化老化现象,可能是因为气体交换速率高,使得包装袋内气体环境与外界空气相似;8孔组黄瓜品质则始终保持在高水平,原因可能是微孔膜孔数适宜,维持了适宜的湿度和气体环境,因而使得黄瓜品质保持最佳。综上所述,8孔数微孔膜组在维持黄瓜感官品质效果上最优。
在整个贮藏期间,由于黄瓜的低温胁迫和自然衰老,各组相对电导率随贮藏时间的延长而增大(图2)。CK组4 d起与8孔、16孔组差异不显著(P>0.05),第8天后与8孔组差异显著(P<0.05),这可能是因为CK组受到冷害影响之后细胞膜结构遭到破坏,内容物渗出,导致相对电导率增大;8孔、16孔组相对电导率增加幅度最小,在贮藏结束时数值分别为38.97%、43.09%,相对电导率是细胞膜透性的表现,也是细胞膜受损程度的反映,所以8孔组、16孔组可能是因为氧气较其他2组充足,未产生无氧呼吸,使细胞膜免受无氧呼吸产物(如乙醇等)攻击,保护了细胞膜的透性,抑制了相对电导率的上升。蔡佳昂等[17]的研究苕尖的微孔包装中得到了相同的结果。由上可知,各微孔膜处理组均可以显著抑制黄瓜相对电导率的增大,降低了黄瓜膜透性的增大,但无孔组抑制效果明显较弱,8孔数微孔膜组综合抑制效果最好。

图1 不同微孔膜包装处理对黄瓜物流过程中感官评价的影响
Fig.1 Effect of different microporous film packaging treatments on sensory scores during cucumber logistics
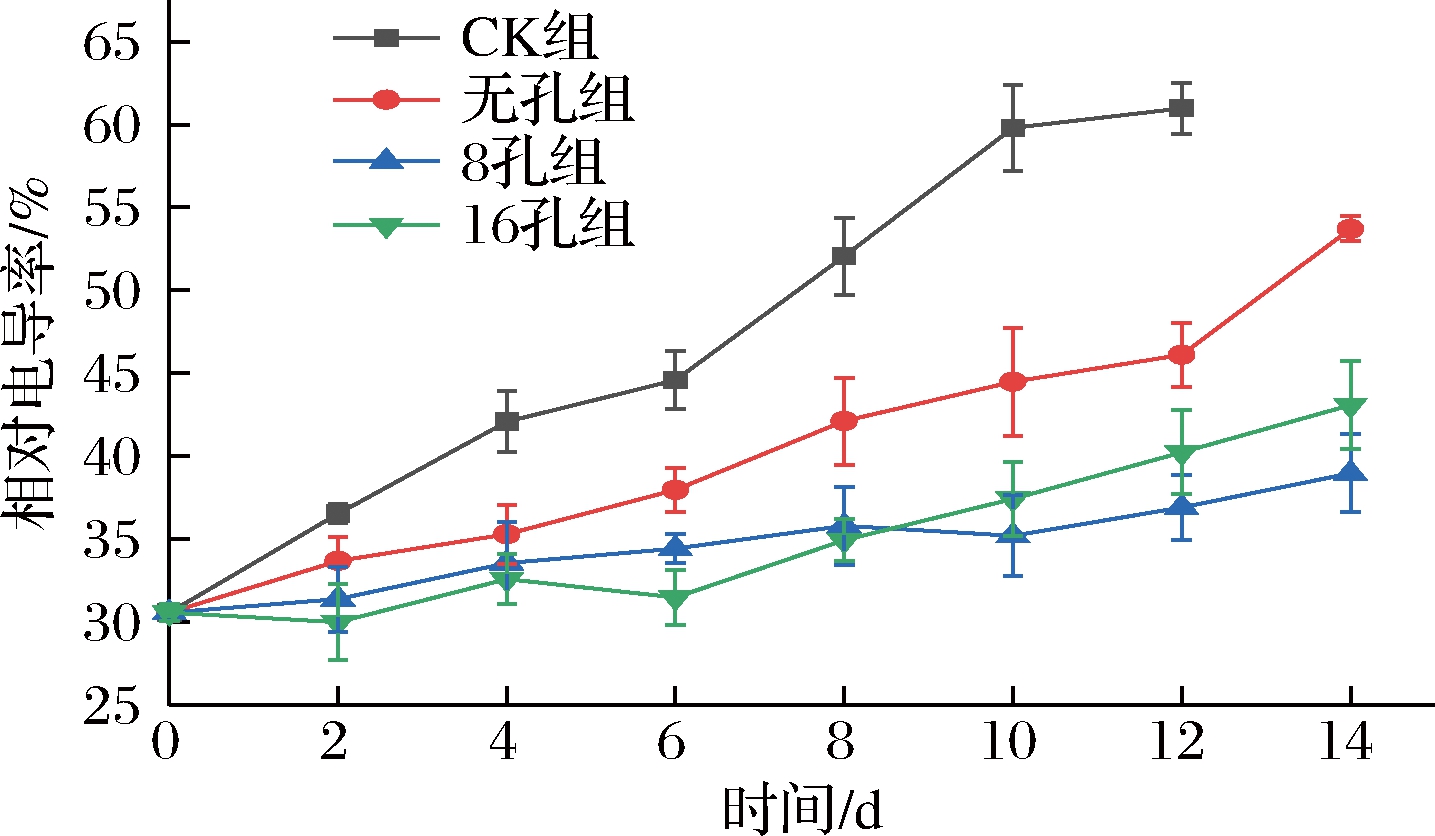
图2 不同微孔膜包装处理对黄瓜物流过程中相对电导率的影响
Fig.2 Effect of different microporous film packaging treatments on the relative conductivity during cucumber logistics
如图3所示,各组呼吸强度随时间延长整体呈现先下降后上升的趋势,其中8孔、16孔2组呼吸强度趋向平稳。CK组在第4天时呼吸强度迅速上升后在第6天稍有下降,并在移入室温后呼吸强度持续上升,第8天后与8孔、16孔2组差异极显著(P<0.01),这可能是CK组出现了冷害症状而导致的,实验组在贮藏前6 d呼吸强度均在缓慢下降,各组间无显著差异(P>0.05);移入室温后,无孔组呼吸强度持续上升,并在第10天后与8孔、16孔2组有极显著差异(P<0.01),可能是由于随着袋内呼吸强度的增加,O2含量逐渐降低并造成了黄瓜的无氧呼吸作用或由于无孔组出现了冷害症状,腐败霉变导致呼吸急剧增强;8孔、16孔2组呼吸强度在移入室温后有短期内的上升,第8天后变化幅度减弱,因为低温对呼吸同样具有抑制作用,温度升高导致呼吸相关酶活性增强。但是8孔组呼吸强度始终低于16孔组,且两组在第10天后产生显著差异(P<0.05)。由此可见,无孔组虽然在前期对于抑制呼吸强度的极速上升有抑制和延缓作用,但并不能保持贮藏后期的低呼吸强度;8孔、16孔2组在整个贮藏期间都未出现呼吸强度的异常升高,使得黄瓜呼吸受到抑制,并且8孔组在后期抑制效果更好。综合而言,8孔数微孔膜组能更好地控制黄瓜的呼吸强度。

图3 不同微孔膜包装处理对黄瓜物流过程中呼吸强度的影响
Fig.3 Effect of different microporous film packaging treatments on respiratory intensity during cucumber logistics
果实的硬度是果实对抗外界压力的直接表现,如图4所示,各组硬度随贮藏时间的延长逐渐降低,其中CK组下降速度最快,从第6天起与其他组差异显著(P<0.05)。无孔组在第6天与8孔、16孔2组出现显著差异(P<0.05),在整个贮藏期间,8孔组的硬度保持效果始终最佳,并在8 d后与其他2组实验组差异显著(P<0.05)。由此可知,各组微孔膜包装在冷藏期间整体差异不明显,而移入室温后,由于外部温度的上升,使得各组呼吸强度升高,呼吸强度的升高导致活性氧生成速率加快,由此加重了对细胞膜的攻击,导致硬度下降速度变快,而CK组可能由于前期冷害的影响,使得果实表皮出现受损,造成后期硬度急速下降。实验组之间可能是由于微孔数的不同造成的差异。其中,无孔组因为与外界气体交换较慢,不能得到充足的氧气供给呼吸,造成无氧呼吸的出现,产生乙醇、乙醛,伤害了组织细胞,使硬度下降。16孔组可能是由于孔数较多,与外界气体交换较快造成后期呼吸强度增大,产生的活性氧较多,攻击了细胞膜结构,导致硬度下降。相对来说,8孔数微孔膜组形成了较为合适的气体环境,在抑制呼吸强度的同时避免了无氧呼吸的产生,保护了细胞结构,保持了黄瓜的硬度。

图4 不同微孔膜包装处理对黄瓜物流过程中硬度的影响
Fig.4 Effect of different microporous film packaging treatments on the hardness of cucumber during logistics
LOX是一种含非血红素铁或锰的加氧酶,植物组织膜脂过氧化的启动需要LOX,LOX及其过氧化产物直接参与组织的衰老进程[18],MAO等[19]的研究结果也表明LOX可能是黄瓜果实低温损伤诱导过程中主要的脂质降解酶。如图5所示,各组LOX活性随贮藏时间的延长呈先上升后下降的趋势,其中CK组活性始终高于其他各组。CK组在贮藏第2天至冷藏期结束LOX活性迅速上升,与其他各组产生极显著差异(P<0.01),可能是由于CK组受到低温胁迫后细胞膜系统遭到破坏造成的;实验组在冷藏期间(0~6 d)活性持续下降,且各组间差异不显著(P>0.05),表明微孔膜处理可以显著抑制冷藏期间LOX活性的上升;第6天后,实验组LOX活性开始上升,各组在第8天共同到达最高峰,可能是由于贮藏温度升高,使得各组代谢水平上升。贮藏后期LOX活性逐渐下降的原因可能是由于脂质过氧化反应的增加提高了脂质的不饱和水平,同时减少了LOX的反应底物造成的[20]。由此可知,各微孔膜处理组均能抑制LOX活性的增大,防止细胞膜透性升高,其中8孔数微孔膜组效果最好。

图5 不同微孔膜包装处理对黄瓜物流过程中LOX活性的影响
Fig.5 Effects of different microporous film packaging treatments on LOX activity during cucumber logistics
在果蔬采后衰老过程中,细胞内会积累越来越多的活性氧类物质。活性氧对细胞膜上的脂类物质具有较强的氧化作用,氧化的同时生成MDA等产物,使细胞膜的结构遭到破坏,膜透性增加。因此,MDA含量是判断果蔬衰老程度的重要指标[21]。如图6所示,各组MDA含量随贮藏时间的延长而增大,并且CK组上升最快,在贮藏期间与其他各组差异极显著(P<0.01)这与相对电导率的变化趋势一致,原因可能是CK组受到低温胁迫发生膜质过氧化作用,MDA作为最终产物被分解出来;无孔组MDA含量自贮藏第6天起与其他各组差异极显著(P<0.01);8孔、16孔2组MDA含量上升速度在前期较慢,但16孔组自第12天起升高较快,与8孔组产生极显著差异(P<0.01)。这表明各微孔膜处理组均可以显著抑制MDA含量的上升,可能是因为微孔膜提高了细胞膜的稳定性,使其完整性保持较好,从而提高了其细胞膜的抗逆性,但综合而言,8孔数微孔膜组对于抑制黄瓜MDA含量上升的效果最佳。

图6 不同微孔膜包装处理对黄瓜物流过程中MDA含量的影响
Fig.6 Effect of different microporous film packaging treatments on MDA content in cucumber logistics
如图7所示,各组![]() 产生速率总体呈上升趋势。第2天后,CK组
产生速率总体呈上升趋势。第2天后,CK组![]() 产生速率开始快速上升,至贮藏第12天时数值达到2.44 μmol/(min·g),与其他各组差异极显著(P<0.05),这与CK组的呼吸强度变化一致,说明活性氧的产生大部分来源于果实的呼吸作用,呼吸强度增大时,
产生速率开始快速上升,至贮藏第12天时数值达到2.44 μmol/(min·g),与其他各组差异极显著(P<0.05),这与CK组的呼吸强度变化一致,说明活性氧的产生大部分来源于果实的呼吸作用,呼吸强度增大时,![]() 产生速率也随之增大,后期可能是由于CK组受到低温胁迫后黄瓜活性氧系统遭到破坏,并且常温期间冷害症状加剧及微生物侵染,细胞内产生大量活性氧及有毒物质对抗外界侵染所致,但同时这种对抗机制也伤害了果实细胞本身。实验组
产生速率也随之增大,后期可能是由于CK组受到低温胁迫后黄瓜活性氧系统遭到破坏,并且常温期间冷害症状加剧及微生物侵染,细胞内产生大量活性氧及有毒物质对抗外界侵染所致,但同时这种对抗机制也伤害了果实细胞本身。实验组![]() 产生速率在冷藏期间持续降低,第6天后开始持续上升,表明微孔膜处理可以显著抑制冷藏期间
产生速率在冷藏期间持续降低,第6天后开始持续上升,表明微孔膜处理可以显著抑制冷藏期间![]() 产生速率的上升;8孔组
产生速率的上升;8孔组![]() 产生速率在第10天起处于最低水平,并与其他各组差异显著(P<0.05),至贮藏结束,速率仅为1.18μmol/(min·g)。除了呼吸的影响,还有可能是8孔组果实的活性氧清除体系中的相关酶活性相对保持较好共同作用。由此说明,各微孔膜处理组均明显可以推迟并抑制
产生速率在第10天起处于最低水平,并与其他各组差异显著(P<0.05),至贮藏结束,速率仅为1.18μmol/(min·g)。除了呼吸的影响,还有可能是8孔组果实的活性氧清除体系中的相关酶活性相对保持较好共同作用。由此说明,各微孔膜处理组均明显可以推迟并抑制![]() 产生速率的上升,减缓了细胞膜的受损程度,且其中8孔组的效果最佳。
产生速率的上升,减缓了细胞膜的受损程度,且其中8孔组的效果最佳。

图7 不同微孔膜包装处理对黄瓜物流过程中![]() 产生速率的影响
产生速率的影响
Fig.7 Effect of different microporous film packaging treatments on ![]() production rate during cucumber logistics
production rate during cucumber logistics
POD在抗氧化系统中具有重要的作用,主要起清除过氧化氢的作用。如图8所示,各组POD活性随贮藏时间的延长整体呈现先上升后下降的趋势。在第2天时除CK外3组的POD活性均上升,而CK组下降至最低值2.11ΔOD470/(min·g),可能是由于CK组POD活性受温度和呼吸速率影响较大;第2天后各组POD活性持续上升,原因可能是活性氧开始增多,抗氧化清除系统启动,POD活性增强,清除因低温胁迫产生的活性氧以保证果实免受伤害。实验组则在第8天时各自到达高峰,其中8孔组在第10天后与其他组差异显著(P<0.05)。8 d后各组活性开始下降,这与SOD的变化趋势一致,原因可能是底物活性氧物质H2O2在8 d出现了高峰之后随时间延长逐渐下降导致。总体来说,各微孔膜处理组均可以明显提高贮藏前期POD活性并延缓其在贮藏后期下降,减轻了细胞膜被活性氧物质攻击的程度,且8 孔数微孔膜组对POD 活性的维持效果最佳。

图8 不同微孔膜包装处理对黄瓜物流过程中POD活性的影响
Fig.8 Effect of different microporous film packaging treatments on POD activity during cucumber logistics
如图9所示,各组SOD活性在第1天均下降,之后随贮藏时间的延长SOD活性呈先上升后下降的趋势,研究认为这可能是抗氧化防卫反应的一种机制[22]。CK组在第6天开始SOD活性处于最低水平,并与其他各组差异显著(P<0.05);实验组之间在冷藏期间(第0~6天)SOD活性无显著差异(P>0.05),且基本高于CK组,表明微孔膜处理可以诱导SOD活性的升高。从第8天开始CK、无孔、16孔3组SOD活性逐渐下降,并且自第10天起与8孔组差异显著(P<0.05),而8孔组自第10天后活性才开始降低。结果说明,各微孔膜处理组均可以显著抑制SOD活性的降低,增强了黄瓜清除氧自由基的能力,并且由于8孔数微孔膜组形成了适宜的气体环境,降低了黄瓜的呼吸速率并减缓了活性氧伤害,因而效果最好。

图9 不同微孔膜包装处理对黄瓜物流过程中SOD活性的影响
Fig.9 Effect of different microporous film packaging treatments on SOD activity during cucumber logistics
过氧化氢酶CAT作为抗氧化系统的重要酶类之一,是清除过氧化氢主要酶类之一。如图10所示,各组CAT活性整体呈现先上升后下降的趋势,在贮藏第4天时,由于CK组出现冷害症状导致呼吸强度上升使得CAT活性抵抗性增大而出现降低趋势;移入室温后,各组CAT活性由于温度的上升随之升高,在第8天时各自到达最高峰,与CK、无孔组差异极显著(P<0.01);第8天后各组CAT活性开始下降,且8孔组保持在最高水平。这与POD、SOD的变化趋势一致,可能是因为SOD歧化超氧阴离子酶活达到高峰使得其产生的H2O2达到高峰,随着底物浓度增大,CAT活性随即达到高峰。第12天,8孔组与无孔、16孔出现显著性差异(P<0.05),原因是8孔组维持了适宜的气体环境,既没有如无孔组因O2浓度过低造成无氧呼吸现象,也没有如16孔组因为CO2浓度与大气持平而增大了呼吸强度,使得后期活性氧物质产生速率降低现象。由此可知,各微孔膜处理组均可以明显提升黄瓜的CAT活性,保护细胞膜免受活性氧攻击,且其中8孔数微孔膜组效果最佳,在贮藏后期与其他组差异显著。

图10 不同微孔膜包装处理对黄瓜物流过程中CAT活性的影响
Fig.10 Effect of different microporous film packaging treatments on CAT activity during cucumber logistics
由图11可知,各组叶绿素含量随贮藏时间的延长逐渐降低,这是由于黄瓜表皮的叶绿素逐渐分解破坏,造成叶绿体的崩坏和黄瓜表皮的颜色变化。其中,CK组下降速度最快,与其他各组差异显著(P<0.05),在第0~6天,实验组之间差异均不显著(P>0.05);自第8天后,8孔组叶绿素含量开始高于16孔组并且之后始终高于其他组,孙志文[23]也发现微孔包装内的高CO2使得叶绿素降解酶的活性受到抑制,缓解了叶绿素的分解,但随着孔数的增加,包装内的气体环境没有得到良好的调节使得其呼吸作用和蒸腾失水较快,而活性氧物质的累积达到阈值之后会影响叶绿素的生物功能,在贮藏过程中出现了变黄的趋势。本实验中实验组和CK组叶绿素含量的变化趋势和呼吸强度保持一致,也有可能是因为膜包装组通过更好的控制了果实的呼吸,控制了CO2含量,减少了![]() 的生成,减缓了叶绿素的降解。综上表明,无孔、8孔、16孔3组均能抑制叶绿素含量的降低,其中8孔组抑制效果最好。证明微孔包装可以通过维持黄瓜叶绿体中活性氧代谢的平衡来延缓叶绿素降解。
的生成,减缓了叶绿素的降解。综上表明,无孔、8孔、16孔3组均能抑制叶绿素含量的降低,其中8孔组抑制效果最好。证明微孔包装可以通过维持黄瓜叶绿体中活性氧代谢的平衡来延缓叶绿素降解。

图11 不同微孔膜包装处理对黄瓜物流过程中
叶绿素含量的影响
Fig.11 Effect of different microporous film packaging treatments on chlorophyll content during cucumber logistics
利用PCA对贮藏期间不同微孔膜包装黄瓜指标进行全面分析。由图12可知,PC1和PC2的累计贡献率为80%,说明可以代表原数据的变化趋势[24]。从载荷图中可以发现,整体感官评分、硬度的相关系数最高,是黄瓜果实在贮藏过程中品质下降最直观的表现,其次为相对电导率、MDA含量。相对电导率高,说明贮藏期间细胞膜受损之后膜透性增大,细胞内容物外渗,而MDA含量正是膜质过氧化程度的直接反映,所以MDA含量也就升高。结合图13能看出在8 d时,8孔组和16孔组的POD和CAT的活性达到了最高,说明2组的活性氧清除速率正值高峰,极大程度地保护了细胞膜免受攻击。
从得分图(图13)中发现,不同天数的不同各组被主要被分割成了2个区域,并且以6 d为分割点,图中0点为初始黄瓜样品,越接近0点说明各指标与初始样品越接近,6 d前的各处理组在图中相邻较近,说明各个指标以及果实品质差距不大,各处理组在第6天之后都出现了较大的变化,但是8孔组各天数的变化幅度最小,在图中与0 d的位置相对更接近,表明在保持黄瓜的品质方面,8孔组要明显优于CK组及其他处理组。

图12 主成分载荷图
Fig.12 Principal component loading diagram

A-无孔组;B-8孔组;C-16孔组
图13 PCA得分图
Fig.13 Principal component analysis score chart
本实验探究了基于PCA下微孔膜包装对黄瓜膜脂过氧化作用和对贮藏保鲜的影响。通过PCA,较直观全面地反映出黄瓜的综合品质,发现所有包装组均能延缓黄瓜的品质下降,其中8孔组的效果最佳。膜包装组中通过控制孔数来控制气体的交换速率,从而实现呼吸的控制,有效减缓了![]() 产生,降低了MDA的生成速率和电导率的上升,并抑制了LOX活性,减缓了膜脂过氧化反应,保护了细胞膜的完整性。同时还增强了抗氧化酶CAT、POD、SOD的活性,提高了黄瓜的抗逆性。
产生,降低了MDA的生成速率和电导率的上升,并抑制了LOX活性,减缓了膜脂过氧化反应,保护了细胞膜的完整性。同时还增强了抗氧化酶CAT、POD、SOD的活性,提高了黄瓜的抗逆性。
微孔膜包装作为气调包装的一种,具有比其他包装更经济,操作性更好的特点,对于产品的生理控制可以通过孔径大小及孔数调节。微孔膜包装的打孔数差异会造成其冷害抑制效果的不同,低打孔数可能会造成包装内的气体交换率低,导致无氧呼吸的发生,加速果蔬腐烂,高打孔数可能会造成气体交换率过高,导致包装内外气体成分相似,保鲜效果不佳,因此,只要调整好适量的孔数,微孔膜包装可以通过调节包装内的气体成分很好地抑制黄瓜膜质过氧化,降低品质劣变的发生。而且微孔膜成本低,操作简单,是一种非常适合在实际贮运过程中推广使用的技术。后续研究中,由于黄瓜在不同贮藏温湿度条件、不同贮藏时长、冷藏转物流的温差不同变化等情况下的膜脂氧化程度也不同,应注意研究微孔膜技术,以及微孔膜与其他控制膜脂氧化与品质的技术的协同使用,对这些情况下黄瓜的膜脂氧化及品质的控制作用。
[1] LI J, LI Q, LEI X J, et al.Effects of wax coating on the moisture loss of cucumbers at different storage temperatures[J].Journal of Food Quality, 2018, 2018:9351821.
[2] 刘雪雪, 程智慧, 孟焕文.黄瓜商品果采后品质与果皮色素变化及其相关性研究[J].西北农林科技大学学报(自然科学版), 2019, 47(5):78-84;91.
LIU X X, CHENG Z H, MENG H W.Changes in quality and pericarp pigment content of postharvest commercial cucumber fruit and their correlations[J].Journal of Northwest A&F University (Natural Science Edition), 2019, 47(5):78-84;91.
[3] ZHANG Y Z, ZHANG M L, YANG H Q.Postharvest chitosan- g -salicylic acid application alleviates chilling injury and preserves cucumber fruit quality during cold storage[J].Food Chemistry, 2015, 174:558-563.
[4] K RKÖNEN A, KUCHITSU K.Reactive oxygen species in cell wall metabolism and development in plants[J].Phytochemistry, 2015, 112:22-32.
RKÖNEN A, KUCHITSU K.Reactive oxygen species in cell wall metabolism and development in plants[J].Phytochemistry, 2015, 112:22-32.
[5] 俞静芬, 卢宇广, 尚海涛, 等.微孔膜结合1-MCP对水蜜桃果实品质的影响研究[J].农产品加工, 2021(6):26-28.
YU J F, LU Y G, SHANG H T, et al.Effect of preservative film combined with 1-methylcyclopropene on quality of nectarine[J].FarmProductsProcessing, 2021(6):26-28.
[6] GHOSH D, CHATTOPADHYAY P.Application of principal component analysis (PCA) as a sensory assessment tool for fermented food products[J].Journal of Food Science & Technology, 2012, 49(3):328-334.
[7] 张春岭,刘慧,刘杰超, 等.基于主成分分析与聚类分析的中、早熟桃品种制汁品质评价[J].食品科学, 2019, 40(17):141-149.
ZHANG C L, LIU H, LIU J C, et al.Evaluation of juice quality of midearly ripening peach varieties based on principal component analysis and cluster analysis[J].Food Science, 2019, 40(17):141-149.
[8] 郝麒麟, 黄先智, 贺燕, 等.基于主成分分析法评价巫山脆李食用品质[J].食品与发酵工业, 2020, 46(19):251-257.
HAO Q L, HUANG X Z, HE Y, et al.Evaluation of Wushan plum edible quality based on principal component analysis[J].Food and Fermentation Industries,2020,46(19):251-257.
[9] 高云, 郁志芳.基于主成分分析的芹菜品质评价[J].食品工业科技, 2020, 41(3):308-314;320.
GAO Y, YU Z F.Quality evaluation of celery based on principal component analysis[J].Science and Technology of Food Industry, 2020, 41(3):308-314;320.
[10] 赵普莹. ERFs调控黄瓜果实贮藏冷害及其与膜脂代谢关系研究[D].广州:华南农业大学, 2018.
ZHAO P Y.The mechanism of ERF tstranscription factors in regulating the membrane lipid metabolism of cucumber fruit during cold storage[D].Guangzhou:South China Agricultural University,2018.
[11] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Experimental Guidance on Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[12] CHEN A Q, YANG Z, ZHANG N, et al.Quantitative evaluation and prediction for preservation quality of cold shocked cucumber based on entropy[J].Innovative Food Science and Emerging Technologies, 2016, 35:58-66.
[13] TODD J F, PALIYATH G, THOMPSON J E.Effect of chilling on the activities of lipid degrading enzymes in tomato fruit microsomal membranes[J].Plant Physiology and Biochemistry (Montrouge), 1993, 30(5):517-522.
[14] ARNON D I.Copper enzymes in isolated chloroplasts.Polyphenoloxidase in beta vulgaris[J].Plant Physiology, 1949, 24(1):1-15.
[15] LURIE S, CRISOSTO C H.Chilling injury in peach and nectarine[J].Postharvest Biology and Technology, 2005, 37(3):195-208.
[16] FAHMY K, NAKANO K.Optimal design of modified atmosphere packaging for alleviating chilling injury in cucumber fruit[J].Environmental Control in Biology, 2014, 52(4):233-240.
[17] 蔡佳昂, 赵霞, 周静, 等.1-甲基环丙烯与微孔气调包装复合技术对红苕尖保鲜品质的影响[J].食品与发酵工业, 2018, 44(7):199-206.
CAI J A, ZHAO X, ZHOU J, et al.Effects of1-MCP and microporous films on quality of sweet potato leaves[J].Food and Fermentation Industries,2018, 44(7):199-206.
[18] PESIS E.The role of the anaerobic metabolites, acetaldehyde and ethanol, in fruit ripening, enhancement of fruit quality and fruit deterioration[J].Postharvest Biology and Technology, 2005, 37(1):1-19.
[19] MAO L C, PANG H Q, WANG G Z, et al.Phospholipase D and lipoxygenase activity of cucumber fruit in response to chilling stress[J].Postharvest Biology & Technology, 2007, 44(1):42-47.
[20] BOONSIRI K, KETSA S, VAN DOORN W G.Seed browning of hot peppers during low temperature storage[J].Postharvest Biology and Technology, 2007, 45(3):358-365.
[21] 宦晨.桃果实发育和贮藏期间抗氧化系统对活性氧水平的调控机理[D].南京:南京农业大学, 2018.
HUAN C.Regulation mechnism of antioxidant system on reactive oxygen species during development and postharvest storage of peach fruit[D].Nanjing:Nanjing Agricultural University, 2018.
[22] BARTOLI C G, SIMONTACCHI M, GUIAMET J J, et al.Antioxidant enzymes and lipid peroxidation during aging of Chrysanthemum morifolium RAM petals[J].Plant Science, 1995, 104(2):161-168.
[23] 孙志文.气调和活性氧对西兰花叶绿素降解的影响及其调控[D].淄博:山东理工大学, 2017.
SUN Z W.Effects of controlled atmosphere and reactive oxygen species on chlorophyll degradation and its regulation[D].Zibo:Shandong University of Technology, 2017.
[24] PERESTRELO R, BARROS A S, ROCHA S M, et al.Optimisation of solid-phase microextraction combined with gas chromatography-mass spectrometry based methodology to establish the global volatile signature in pulp and skin of Vitis vinifera L.grape varieties[J].Talanta, 2011, 85(3):1 483-1 493.