近30年来,水产养殖业规模年均增长已达到6%[1]。中国的水产品产量占全球产量的60%以上,成为了世界水产养殖大国[2]。2000—2014年,中国水产养殖产量从2 460万t增长到4 750万t,增长率为93.1%[3],由此可见,中国水产养殖业产量呈现逐年递增的趋势。在水产养殖和运输的过程中,一些兽药会被用于治疗或预防疾病,因此有时可能会出现兽药滥用的现象。近些年,在水产品消费中虾类占比较大,为了确保食品安全,需要对虾中可能残留的一些兽药进行分析。
氟喹诺酮类药物于1980年代首次引入并迅速成为最受欢迎的抗生素药物之一[4]。氟喹诺酮类药物可以治疗人类呼吸道、泌尿道和消化道感染,这也有助于扩大这类药物在预防动物感染方面的应用。与其他抗生素相比,氟喹诺酮类药物不易分解,并且与土壤的相互作用有高度特异性[5]。食品中残留的氟喹诺酮类药物会引起过敏反应、中毒反应以及抗菌素的耐药性等,从而对人体健康造成潜在危害[6]。在农业部2292号公告中明确禁止诺氟沙星和氧氟沙星作为兽药使用。但是由于诺氟沙星和氧氟沙星价格便宜、效果好,存在养殖人员违规使用这2种兽药的风险,从而引发食品安全问题。地西泮和安眠酮是重要的抗精神病药。地西泮用于治疗焦虑症[7]和作为抗肿瘤抗生素[8]。安眠酮可以用于治疗失眠症状[9]。在水产品的运输过程中,地西泮和安眠酮有减轻压力、抑制水产品活动、催眠、降低代谢的作用,以防止水产品身体损伤和体重减少[10]。但是残留在虾中的地西泮和安眠酮可能会对人体健康造成危害,我国已经规定在虾中不能检出安眠酮和地西泮。近些年,在国家食品安全抽检中,多次被检测出这4种兽药,因此这几种物质成为重点监测的兽药残留物。目前为止,高效液相色谱[11-13]、液相色谱串联质谱[14-17]以及气相色谱串联质谱[18-20]已经应用于分别检测安眠酮、地西泮、诺氟沙星以及氧氟沙星,但目前仍然缺乏能灵敏、准确地同时分析这4种需要重点监控兽药的方法,使得在实际检测当中需要用到2种及以上的分析方法才能对这4种兽药进行全面的分析检测。
因此,本文建立了一种同时检测虾肉中安眠酮、地西泮、诺氟沙星以及氧氟沙星的方法,为虾肉中这些兽药残留风险监测提供有效的技术手段。本研究使用的高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)比液相色谱法更加灵敏,且具备可以同时检测虾肉中这4种兽药化合物的优势,从而缩短了分析时间并提高了分析效率。同时,分析了虾肉中这些残留物在加热过程中是否存在分解或者转化的现象,对了解这4种兽药残留的稳定性和转化规律可提供参考。
1 材料与方法
1.1 材料与试剂
氧氟沙星(ofloxacin,纯度98%)标准品、诺氟沙星(norfloxacin,纯度98%)标准品(均为固体)、甲醇、甲酸(均为色谱纯),百灵威科技有限公司;地西泮(diazepam,溶于甲醇,100 μg/mL)、安眠酮(methaqualone,溶于甲醇,100 μg/mL),天津阿尔塔科技有限公司;乙腈(色谱纯),美国Thermo Fisher Scien- tific公司;盐酸(分析纯),国药集团化学试剂有限公司;无水硫酸钠(分析纯),上海麦克林生化科技有限公司;C18固相萃取柱(500 mg/6mL),天津博纳艾杰尔科技有限公司;超纯水系统,美国Millipore公司;虾肉,北京市各大超市。
1.2 仪器与设备
1260 infinity-6460高效液相色谱-串联质谱仪,美国安捷伦科技公司;ME204/02电子天平(万分之一天平220 g/0.1mg),梅特勒-托利多仪器(上海)有限公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;QL-861涡旋振荡器,海门市其林贝尔仪器制造有限公司;OSB-2100/N-1100旋转蒸发仪,上海爱朗仪器有限公司;H1750R医用离心机,湘仪离心机仪器有限公司;HH-2数显恒温水浴锅,荣华仪器制造有限公司。
1.3 实验方法
1.3.1 标准溶液的配制
称取适当氧氟沙星和诺氟沙星,用甲醇配制成质量浓度为1 mg/mL的单一标准品储备溶液,溶解较慢可加入适量甲酸并超声辅助溶解。取适量安眠酮和地西泮的液体标准品、氧氟沙星和诺氟沙星的单一标准品储备液,用甲醇配制成为1 μg/mL的单一标准品工作溶液,储存于-20 ℃冰箱中备用。
称取空白虾肉样品5 g,分别加入适量单一标准品标准工作溶液,按照1.3.2与试样同时进行提取和净化,得到质量浓度为0.05~40 ng/mL的基质混标标准工作溶液。
1.3.2 样品预处理
1.3.2.1 提取
将虾肉用绞肉机绞碎成肉泥后,称取5 g虾肉泥于50 mL离心管中,加入2 g无水硫酸钠和25 mL乙腈,将混合物涡旋提取30 s,充分分散混匀后,超声提取15 min,3 500 r/min离心5 min,取出上清液转移至圆底烧瓶中,重复上述步骤1次,合并上清液,上清液在50 ℃条件下减压旋转蒸发至干。
1.3.2.2 净化
取C18固相萃取柱,先后用5 mL甲醇和5 mL水进行活化,用5 mL 0.01 mol/L的盐酸水溶液溶解1.3.2.1 中圆底烧瓶中的上清液残留物,将残留物混合液通过C18固相萃取柱,流速控制在1 mL/min内,弃去滤液。再用5 mL 0.01 mol/L的盐酸水溶液溶解圆底烧瓶中的剩余物,将溶解后的混合物溶液通过C18固相萃取柱,弃去滤液。用10 mL 0.01 mol/L的盐酸甲醇溶液洗脱固相萃取柱,收集洗脱液,经50 ℃ 条件下减压旋转蒸发至干,加入1 mL甲醇复溶,用0.22 μm尼龙针头过滤器进行过滤,滤液用于高效液相色谱-串联质谱分析。
1.3.3 阳性样品制备
称取空白虾肉5 g(精确至0.01 g),用研磨钵研磨至肉泥状,注射标准品溶液,制备成为诺氟沙星加标量为60 μg/kg、氧氟沙星加标量为30 μg/kg以及安眠酮和地西泮加标量为10 μg/kg的样品。将加标后的虾肉样品放置在4 ℃冰箱中平衡6 h,模拟样品被兽药污染,备用。
1.3.4 加热处理
将1.3.3中平衡6 h后的虾肉样品,加入10 mL超纯水,放入90 ℃水浴中分别加热15、30、45、60 min,取出后冷却、研磨,加热后的虾肉样品按照 1.3.2 进行处理,虾肉水煮液用滤纸过滤去除部分杂质。虾肉提取液经过C18固相萃取柱除杂之后,将对应的虾肉水煮液加入相同的固相萃取柱过滤,弃去滤液,随后按照1.3.2.2中方法处理,得到滤液,备用。
将1.3.3中平衡6 h后的虾肉样品,加入10 mL超纯水,放入90 ℃水浴中分别加热15、60 min,取出后冷却、研磨,加热后的虾肉按照1.3.2进行处理,得到滤液,备用。
1.3.5 HPLC-MS/MS条件
1.3.5.1 色谱条件
Eclipse XDB-C18柱(2.1 mm×150 mm,3.5 μm);流速为0.2 mL/min;柱温40 ℃;进样量10 μL;流动相:A相为0.1%(体积分数)甲酸水溶液,B相为0.1%(体积分数)甲酸甲醇溶液,洗脱梯度如表1所示。
表1 梯度洗脱程序
Table 1 Gradient elution conditions
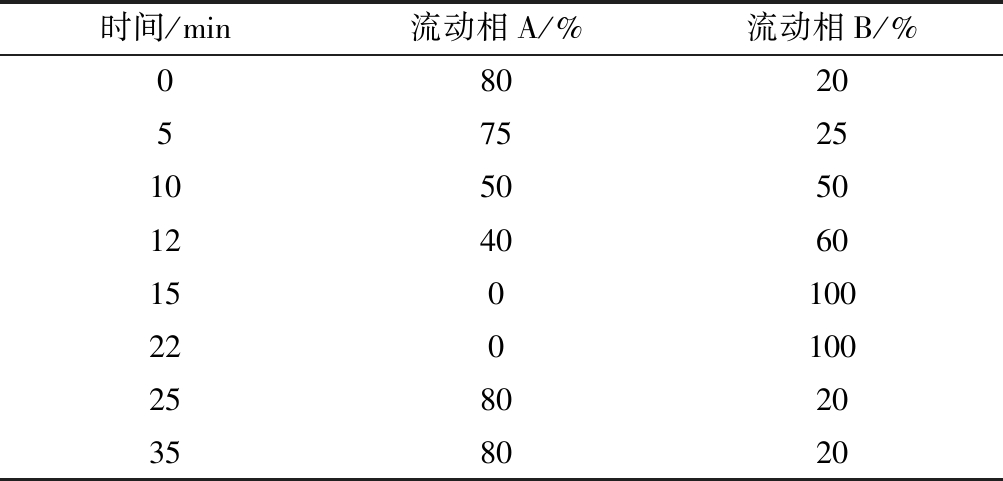
时间/min流动相A/%流动相B/%0802057525105050124060150100220100258020358020
1.3.5.2 质谱条件
选择电喷雾离子源,正离子模式(electrospray ionization,ESI+);所有分析物检测均在多反应监测(multiple reaction monitoring,MRM)模式下进行;碰撞气体和鞘气均为高纯氮气;雾化器压力为310.3 kPa;鞘气温度为400 ℃ ;鞘气流量为12 L/min;毛细管电压为3 800 V。4种化合物在该色谱以及质谱条件下的MRM色谱图如图1所示。
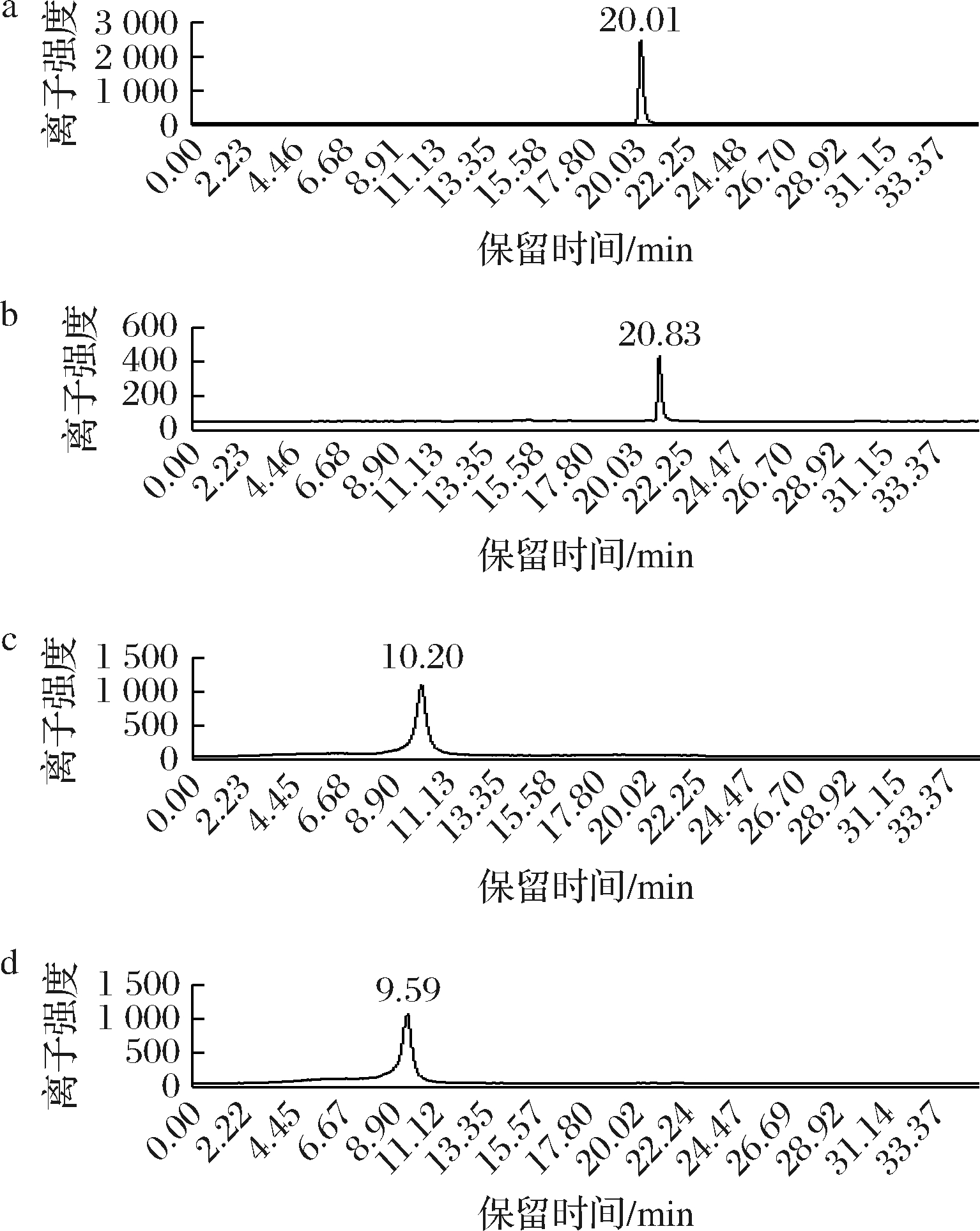
a-安眠酮;b-地西泮;c-诺氟沙星;d-氧氟沙星
图1 四种兽药基质加标溶液的MRM色谱图
Fig.1 The MRM chromatograms of four veterinary drugs in spiked sample matrices
1.3.6 C18固相萃取柱净化条件优化方法
称取4份5 g空白样品,以安眠酮0.1 μg/kg、地西泮0.1 μg/kg、诺氟沙星3.8 μg/kg、氧氟沙星2.4 μg/kg的浓度进行加标,经过1.3.2.1步骤提取后,4份加标样品分别用不同的洗脱液进行复溶、洗脱,洗脱液包括:甲醇-水(1∶4,体积比)、甲醇-水(1∶9,体积比)、0.01 mol/L甲酸甲醇溶液和0.01 mol/L盐酸水溶液,除洗脱液不同外,其他净化步骤与1.3.2.2中一致,随后将净化后的4份样品溶液用HPLC-MS/MS方法进行分析。
2 结果与分析
2.1 仪器参数的优化
2.1.1 色谱参数的优化
根据这4 种化合物的分子极性差异,当用甲醇-水作为流动相时,地西泮和安眠酮的保留时间较长[21] ,而诺氟沙星氧氟沙星的保留时间明显较地西泮和安眠酮短,因此流动相比例选择先用高比例水相对2种沙星进行分离,再用高比例甲醇洗脱出地西泮和安眠酮,通过优化的色谱条件能够有效地将这4种兽药进行色谱分离。同时在流动相中加入0.1%甲酸,有助于4种化合物分子在正离子模式下进行离子化。因此,通过优化后选择0.1%甲酸水溶液-0.1%甲酸甲醇溶液作为流动相,当洗脱梯度如表1所示时,4 种兽药物质的分离效果较好。
2.1.2 质谱参数的优化
对4种化合物分子通过质谱PRODUCT模式进行分析,首先确定母离子后再通过二级质谱扫描,对母离子碎裂后产生的子离子进行筛选,选择响应最强、灵敏性好的子离子作为定量离子,与特征结构相关的子离子作为定性离子。4种化合物的母、子离子以及相应的碰撞能量和碎裂电压详见表2。
表2 四种分析物的MRM模式分析参数
Table 2 MRM conditions for four analytes
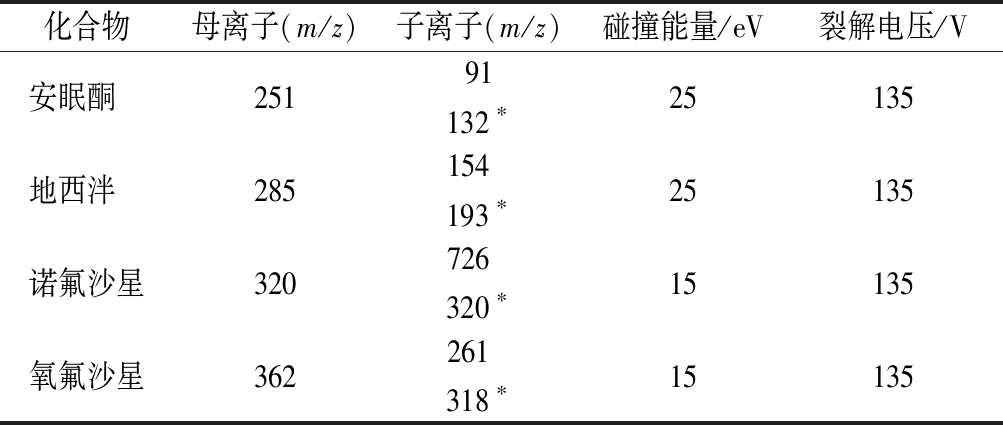
化合物母离子(m/z)子离子(m/z)碰撞能量/eV裂解电压/V安眠酮 25191 132∗25135地西泮 285154 193∗25135诺氟沙星320726 320∗15135氧氟沙星362261 318∗15135
注:*为定量子离子
2.2 C18固相萃取柱净化条件优化
为了分析确定目标化合物在C18固相萃取柱上的保留率,对净化步骤中的洗脱液进行了优化。经4种不同洗脱液净化后的加标回收率如表3所示。结果表明,对诺氟沙星和氧氟沙星而言,使用0.01 mol/L 盐酸水溶液进行洗脱后的回收率高于使用其他3种溶液洗脱后的回收率;对安眠酮和地西泮而言,使用0.01 mol/L盐酸水溶液进行洗脱后的回收率也高于使用甲醇-水(1∶4,体积比)以及甲醇-水(1∶9,体积比)进行洗脱后的回收率,同时,采用0.01 mol/L盐酸水溶液进行洗脱后,4种兽药残留加标回收率为90.75%~103.99%,相对标准偏差(relative standard deviation,RSD)值为1.23%~3.91%,因此,本研究选择0.01 mol/L盐酸水溶液作为净化步骤中的洗脱液。在该洗脱液条件下,不仅能够起到净化作用而且目标化合物保持了良好的回收率。
表3 不同洗脱液中4种兽药分析物的回收率 单位:%
Table 3 The recoveries of four veterinary drugs washed by different eluents

洗脱液安眠酮地西洋诺氟沙星氧氟沙星甲醇-水(1∶9,体积比)81.81(1.83)55.67(4.44)81.64(1.23)66.51(4.86)甲醇-水(1∶4,体积比)83.65(2.86)62.95(3.29)38.87(2.54)37.36(2.46)0.01 mol/L盐酸水溶液93.26(1.25)103.99(2.77)96.73(2.76)90.75(3.91)0.01 mol/L甲酸甲醇溶液97.34(2.72)84.91(3.61)50.37(2.65)52.82(1.69)
注:括号中为RSD值(下同)
2.3 线性范围、检出限和定量限
为了消除虾肉中存在的基质效应,利用空白虾肉加标制作为质量浓度在0.05~40 ng/mL的5个基质混标标准工作溶液,按照确定的HPLC-MS/MS参数进行分析,混标中各个化合物的标准曲线以工作溶液浓度为x,以定量离子的峰面积为y。结果表明,4种兽药质量浓度在0.05~40 ng/mL线性关系良好,R2均>0.99。将基质标准溶液不断稀释,通过信噪比S/N=3和S/N=10分别计算该方法的检出限(limit of detection,LOD)和定量限(limit of quantita- tion,LOQ),4种兽药的线性方程、线性范围、相关系数R2、LOD以及LOQ如表4所示。
表4 线性方程、线性范围、R2、LOD以及LOQ
Table 4 Calibration curve, linear range, R2,limit of detection, and limit of quantitation
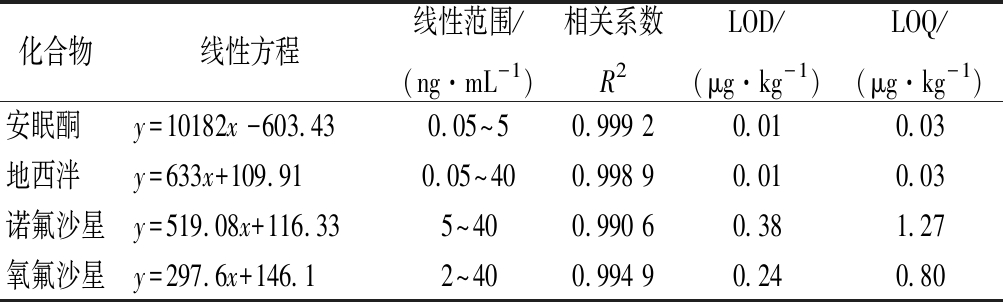
化合物线性方程线性范围/(ng·mL-1)相关系数R2LOD/(μg·kg-1)LOQ/(μg·kg-1)安眠酮 y=10182x -603.430.05~50.999 20.010.03地西泮 y=633x+109.910.05~400.998 90.010.03诺氟沙星y=519.08x+116.335~400.990 60.381.27氧氟沙星y=297.6x+146.12~40 0.994 90.240.80
2.4 准确度和精密度
在空白虾肉中,根据LOD的3、5、10倍(低、中、高浓度)为加标水平进行回收率验证,回收率和RSD见表5。方法的平均回收率为78%~119%,RSD为1.14%~4.76%,该方法的准确度和精密度满足虾肉中安眠酮、地西泮、诺氟沙星以及氧氟沙星的检测需求。
表5 基质加标回收率和RSD(n=3)
Table 5 Average recoveries and relative standard deviation(n=3)

标准品低浓度中浓度高浓度加标量/(μg·kg-1)回收率(RSD)/%加标量/(μg·kg-1)回收率(RSD)/%加标量/(μg·kg-1)回收率(RSD)/%安眠酮 0.0393(2.05)0.0594(1.14)0.1078(1.28)地西泮 0.0393(4.76)0.0584(1.19)0.1078(1.41)诺氟沙星1.1478(3.90)1.90112(3.47)3.8096(3.53)氧氟沙星0.72100(3.38)1.20119(2.01)2.4099(2.45)
2.5 样品分析
在北京市3家不同的超市购买到5种虾,应用优化的样品前处理方法和液质分析方法对这5种虾肉进行检测,在这些样品中均未检测出安眠酮、地西泮、诺氟沙星以及氧氟沙星。此外,本研究利用质量控制的方法来验证这些样品分析结果的准确性。在这5种虾肉中以4种兽药的5倍LOD加标水平进行验证,结果如表6所示。4种化合物的加标样品回收率为(106.22±0.89)%~(117.89±1.21)%,加标回收率良好,进一步验证了样品分析结果的准确性。
表6 样品回收率
Table 6 The average recoveries in samples
化合物安眠酮地西泮诺氟沙星氧氟沙星回收率/%117.89±1.21106.22±0.89115.32±1.48111.40±4.50
2.6 加热过程中稳定性分析
虾肉常用烹饪方法多为白灼,因而选择在90 ℃下进行水浴加热,研究不同加热时间对于4种兽药残留物含量的影响。按照1.3.3中的方法制备虾肉样品,按照1.3.4中的方法处理后,经过提取、净化以及HPLC-MS/MS方法分析,得到安眠酮、地西泮、诺氟沙星以及氧氟沙星的浓度随时间变化的结果,结果如图2所示。由图2可以看出,随着加热时间的延长,4种化合物在虾肉中的含量保持稳定。虾肉中的安眠酮、地西泮、诺氟沙星以及氧氟沙星在90 ℃加热15、30、45、60 min后的含量与未加热处理虾肉中的含量没有显著性差异(P>0.05)。同时,由表7中数据可推断,虾肉与虾肉水煮液合并检测相对于只测定虾肉中的兽药残留数值没有显著性差异(P>0.05),表明在水煮过程中,虾肉中的这4种兽药不易迁移到虾肉水煮液中,大部分仍保留在虾肉中,说明通过水煮加热的方式并不能除去虾肉中的这些兽药残留。虾肉基质中的安眠酮、地西泮、诺氟沙星以及氧氟沙星在食品常用的水煮烹饪方式下,表现出良好的稳定性,很难因为分解或者与虾肉中的蛋白等基质相互作用而减少。
王綪[22]研究了在水浴60、80、100 ℃加热条件下,牛肉中沙拉沙星和二氟沙星的降解率分别为30.75%~37.00%以及3.5%~9.50%。鸡肉中的盐霉素和莫能菌素在100 ℃水煮条件下,降解率可以达到72.5%和61.4%,但当温度在20~80 ℃时,盐霉素的降解速率会变低[23]。本研究中的4种兽药在虾肉中的热稳定性较高,与这些化合物的稳定环状结构密切相关。

a-安眠酮;b-地西泮;c-诺氟沙星;d-氧氟沙星
图2 虾肉中4种兽药含量随加热时间的变化
Fig.2 The content of four veterinary drugs in shrimp with heating time
表7 加热后4种兽药在虾肉中的含量 单位:μg/kg
Table 7 The content of four veterinary drugs in shrimp after heating
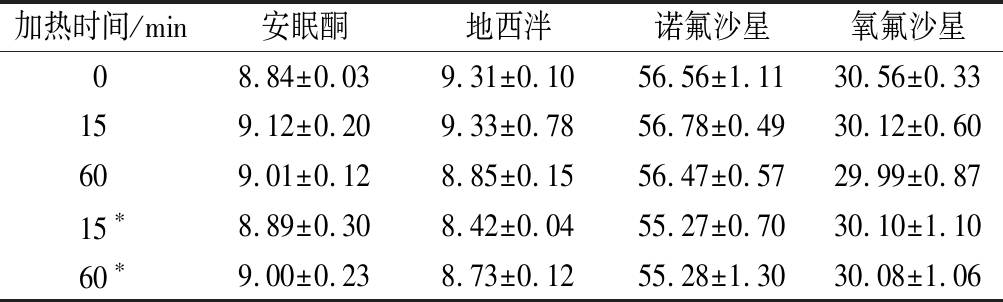
加热时间/min安眠酮地西泮诺氟沙星氧氟沙星08.84±0.039.31±0.1056.56±1.1130.56±0.33159.12±0.209.33±0.7856.78±0.4930.12±0.60609.01±0.128.85±0.1556.47±0.5729.99±0.8715∗8.89±0.308.42±0.0455.27±0.7030.10±1.1060∗9.00±0.238.73±0.1255.28±1.3030.08±1.06
注:*代表只测虾肉中的结果
3 结论
本研究建立了以乙腈为提取溶剂,C18固相萃取柱净化,同时对虾肉中安眠酮、地西泮、诺氟沙星和氧氟沙星进行检测的高效液相色谱串联三重四级杆质谱的分析方法,在0.05~40 ng/mL的线性范围内,相关系数R2均>0.99,LOD为0.01~0.38 μg/kg,4种化合物的回收率为78%~119%,RSD为1.14%~4.76%,该方法适合虾肉中这4种兽药残留的分析,为虾肉中同时分析氟喹诺酮类药物以及镇静类药物提供了参考方法。此外,利用建立的分析方法,对模拟水煮烹饪条件下虾肉中安眠酮、地西泮、诺氟沙星和氧氟沙星的热稳定性进行了研究,结果表明虾肉中这4种兽药在90 ℃水煮条件下,加热15、30、45、60 min后的含量相较于未经过加热处理样品的含量没有显著变化(P>0.05),证明这4种兽药在虾肉中的热稳定性较高,不能通过水煮加热的方式除去虾肉中的这些残留物。
[1] FISHERIES AND AQUACULTURE DEPARTMENT.The State of World Fisheries and Aquaculture 2012[M].Rome:FAO,2012.
[2] ZHANG R L, KANG Y R, ZHANG R J, et al.Occurrence, source, and the fate of antibiotics in mariculture ponds near the Maowei sea, South China:Storm caused the increase of antibiotics usage[J].Sci-ence of the Total Environment, 2021, 752:141882.
[3] HAN D, SHAN X J, ZHANG W B, et al.A revisit to fishmeal usage and associated consequences in Chinese aquaculture[J].Reviews in Aquaculture, 2018, 10(2):493-507.
[4] HE K, BLANEY L.Systematic optimization of an SPE with HPLC-FLD method for fluoroquinolone detection in wastewater[J].Journal of Hazardous Materials, 2015, 282:96-105.
[5] RUSU A, HANCU G, UIVARO I V.Fluoroquinolone pollution of food, water and soil, and bacterial resistance[J].Environmental Chemistry Letters, 2015, 13(1):21-36.
I V.Fluoroquinolone pollution of food, water and soil, and bacterial resistance[J].Environmental Chemistry Letters, 2015, 13(1):21-36.
[6] YU K L, YUE M E, XU J, et al.Determination of fluoroquinolones in milk, honey and water samples by salting out-assisted dispersive liquid-liquid microextraction based on deep eutectic solvent combined with MECC[J].Food Chemistry, 2020, 332:127371.
[7] ZAYED M A, FAHMEY M A, HAWASH M F.Investigation of diazepam drug using thermal analyses, mass spectrometry and semi-empirical MO calculation[J].Spectrochimica Acta Part A:Molecular & Biomolecular Spectroscopy, 2005, 61(5):799-805.
[8] CABRERA G C, WAISBAUM R G D, NUDELMAN N S.Kinetic and mechanistic studies on the hydrolysis and photodegradation of diazepam and alprazolam[J].Journal of Physical Organic Chemistry, 2005, 18(2):156-161.
[9] ZHANG L J, ZHANG S F, WAN Y Z.Voltammetric behavior of methaqualone and its determination by single-sweep oscillopolarography[J].Talanta, 2003, 59(5):1 009-1 013.
[10] ZHANG L Q, WU P G, ZHANG Y M, et al.A GC/MS method for the simultaneous determination and quantification of chlorpromazine and diazepam in pork samples[J].Analytical Methods, 2014, 6(2):503-508.
[11] V ZQUEZ M M P, V
ZQUEZ M M P, V ZQUEZ P P, GALERA M M, et al.Determination of eight fluoroquinolones in groundwater samples with ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction prior to high-performance liquid chromatography and fluorescence detection[J].Analytica Chimica Acta, 2012, 748:20-27.
ZQUEZ P P, GALERA M M, et al.Determination of eight fluoroquinolones in groundwater samples with ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction prior to high-performance liquid chromatography and fluorescence detection[J].Analytica Chimica Acta, 2012, 748:20-27.
[12] WU H, LIU Y L, CHANG J Z, et al.Extraction of five fluoroquinolones in eggs by magnetic solid-phase extraction with Fe3O4-MoS2 and determination by HPLC-UV[J].Food Analytical Methods, 2019, 12(3):712-721.
[13] FERN NDEZ P, LAFUENTE N, BERMEJO A M, et al.HPLC determination of cocaine and benzoylecgonine in plasma and urine from drug abusers[J].Journal of Analytical Toxicology, 1996, 20(4):224-228.
NDEZ P, LAFUENTE N, BERMEJO A M, et al.HPLC determination of cocaine and benzoylecgonine in plasma and urine from drug abusers[J].Journal of Analytical Toxicology, 1996, 20(4):224-228.
[14] BAGHERI N, AI LAWATI H A J, AI SHARJI N A, et al. Mag-etic zinc based 2D-metal organic framework as an efficient adsorbent for simultaneous determination of fluoroquinolones using 3D printed microchip and liquid chromatography tandem mass spectrometry[J].Talanta, 2021, 224:121796.
[15] BANASZKIEWICZ L, ![]() NIAK M K, KATA M, et al.Rapid and simple multi-analyte LC-MS/MS method for the determination of benzodiazepines and Z-hypnotic drugs in blood samples:Development, validation and application based on three years of toxico- logical analyses[J].Journal of Pharmaceutical and Biomedical Analysis, 2020, 191:113569.
NIAK M K, KATA M, et al.Rapid and simple multi-analyte LC-MS/MS method for the determination of benzodiazepines and Z-hypnotic drugs in blood samples:Development, validation and application based on three years of toxico- logical analyses[J].Journal of Pharmaceutical and Biomedical Analysis, 2020, 191:113569.
[16] WANG H, ZHAO X Y, XU J W, et al.Determination of quinolones in environmental water and fish by magnetic metal organic frameworks based magnetic solid-phase extraction followed by highperformance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2021, 1651:462286.
[17] SOFALVI S, LAVINS E S, KASPAR C K, et al.Development and validation of an LC-MS-MS method for the detection of 40 benzodiazepines and three Z-drugs in blood and urine by solid-phase extrac- tion[J].Journal of Analytical Toxicology, 2020, 44(7):708-717.
[18] DE BAIRROS A D, DE ALMEIDA R D, PANTALE O L, et al.Determination of low levels of benzodiazepines and their metabolites in urine by hollow-fiber liquid-phase microextraction(LPME)and gas chromatography-mass spectrometry(GC-MS)[J].Journal of Chromatography B:Analytical Technologies in the Biomedical and Life Sciences, 2015, 975:24-33.
O L, et al.Determination of low levels of benzodiazepines and their metabolites in urine by hollow-fiber liquid-phase microextraction(LPME)and gas chromatography-mass spectrometry(GC-MS)[J].Journal of Chromatography B:Analytical Technologies in the Biomedical and Life Sciences, 2015, 975:24-33.
[19] CHENG L L, ZHANG Y J, SHEN J Z, et al.GC-MS method for simultaneous determination of four sedative hypnotic residues in swine tissues[J].Chromatographia, 2010, 71(1-2):155-158.
[20] FAMIGLINI G, CAPRIOTTI F, PALMA P, et al.The rapid measurement of benzodiazepines in a milk-based alcoholic beverage using QuEChERS extraction and GC-MS analysis[J].Journal of Analytical Toxicology, 2015, 39(4):306-312.
[21] 刘家阳, 黄旭, 贾宏新.固相萃取/超高效液相色谱-串联质谱法测定畜肉中16种镇静剂类兽药残留[J].分析测试学报, 2017, 36(3):305-311.
LIU J Y, HUANG X, JIA H X.Simultaneous determination of 16 sedative residues in livestock products by solid phase extraction/ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2017, 36(3):305-311.
[22] 王綪.贮藏和加工工艺对牛肉品质及氟喹诺酮类药物残留的影响[D].天津:天津农学院, 2015.
WANG Q.Effects of storage and processing technic on quality and fluoroquinolones residues in beef[D].Tianjin:Tianjin Agricultural University, 2015.
[23] 霍晓荣.加工过程对鸡肉和鸡蛋中盐霉素和莫能菌素残留影响的研究[D].南京:南京农业大学, 2006.
HUO X R.Study on effect of processing on salinomycin and monensin residues in eggs and chicken[D].Nanjing:Nanjing Agricultural University, 2006.