啤酒花(Humulus lupulus L.)是桑科葎草属多年生缠绕植物,雌雄异株,又名蛇麻花、忽布、唐草花[1-2]。啤酒花的雌性球穗花序通常被称为啤酒花,具有酿造价值,被誉为“啤酒的灵魂”[3-5]。啤酒花中的树脂类、挥发油、黄酮类等重要成分主要来源于雌花的蛇麻腺[6],其中黄腐酚作为啤酒花特有的天然异戊烯基黄酮类化合物而备受关注[7-8]。此外,由于啤酒花具有抑菌、抗炎、抗氧化、雌激素样作用等功效[9-10],在制药、制糖、食品防腐等领域也得到广泛应用[2,11-12]。本文所指的啤酒花,是沿用人们的惯称,为啤酒花植物的雌性球穗花序。
指纹图谱作为一种综合的、可量化的鉴定方法[13],近年来已应用于啤酒花的质量评价,如董志敏等[1]、刘晓燕等[14]在358 nm下建立了单一波长的啤酒花反相高效液相色谱(high performance liquid chromatography,HPLC)指纹图谱分析方法,对啤酒花中的中等极性、弱极性成分进行了分离,但对啤酒花强极性成分的研究还有待完善。此外,有机酸类物质是啤酒中重要的风味和口味物质,啤酒花作为啤酒的“灵魂”,其中强极性物质如有机酸的研究鲜有报道,目前仅有S NCHEZ-MATA等[15]对未开花的啤酒花枝叶进行了有机酸研究。强极性物质在常规的C18反相色谱柱上很难实现分离,因为在100%水作为流动相的条件下易发生色谱填料的塌陷[16-17]。前期的研究发现XAqua C18反相色谱柱的填料由于键合了3-氯丙基极性官能团,可以用纯水做为流动相,成功用于异麦芽酮糖酶解液的预处理[18]。受此启发,本文采用XAqua C18色谱柱,对啤酒花强极性、中等极性及弱极性成分同时进行分离,完善对啤酒花强极性成分的研究。利用紫外检测器,双波长切换法,于215、360 nm下建立了啤酒花指纹图谱的HPLC分析方法,0~12 min,215 nm下分离有机酸等强极性物质;12~66 min,360 nm下分离酚酸、黄酮等中等极性和弱极性物质,对14批啤酒花进行指纹图谱分析。由于对啤酒花中的强极性物质进行了有效分离,首次发现啤酒花中含有苹果酸。测定了啤酒花中苹果酸、黄腐酚的含量,结合化学计量学方法对啤酒花进行鉴别分析。本文建立的啤酒花HPLC指纹图谱分析方法可以更全面、综合地反映啤酒花的品质,为啤酒花的质量鉴定提供一种科学的评价方法。
NCHEZ-MATA等[15]对未开花的啤酒花枝叶进行了有机酸研究。强极性物质在常规的C18反相色谱柱上很难实现分离,因为在100%水作为流动相的条件下易发生色谱填料的塌陷[16-17]。前期的研究发现XAqua C18反相色谱柱的填料由于键合了3-氯丙基极性官能团,可以用纯水做为流动相,成功用于异麦芽酮糖酶解液的预处理[18]。受此启发,本文采用XAqua C18色谱柱,对啤酒花强极性、中等极性及弱极性成分同时进行分离,完善对啤酒花强极性成分的研究。利用紫外检测器,双波长切换法,于215、360 nm下建立了啤酒花指纹图谱的HPLC分析方法,0~12 min,215 nm下分离有机酸等强极性物质;12~66 min,360 nm下分离酚酸、黄酮等中等极性和弱极性物质,对14批啤酒花进行指纹图谱分析。由于对啤酒花中的强极性物质进行了有效分离,首次发现啤酒花中含有苹果酸。测定了啤酒花中苹果酸、黄腐酚的含量,结合化学计量学方法对啤酒花进行鉴别分析。本文建立的啤酒花HPLC指纹图谱分析方法可以更全面、综合地反映啤酒花的品质,为啤酒花的质量鉴定提供一种科学的评价方法。
1 材料与方法
1.1 材料
1.1.1 试剂
苹果酸标准品、色谱级乙醇,上海阿拉丁生化科技股份有限公司;黄腐酚标准品,上海源叶生物科技有限公司;色谱级乙腈、色谱级甲醇,安徽天地高纯溶剂有限公司;色谱级磷酸,北京伊诺凯科技有限公司。水为超纯水。
1.1.2 仪器与设备
Agilent 1260 Infinity高效液相色谱系统(包括泵、二极管阵列检测器、自动进样器、柱恒温系统、Chemostation色谱工作站)、Agilent 1290 Infinity LC/6545 Q-TOF液质联用系统(包括电喷雾离子源、二极管阵列检测器、自动进样器、柱恒温系统、Agilent Mass Hunter软件),美国安捷伦科技公司;XAqua C18色谱柱(4.6 mm×250 mm,5 μm),华谱科仪(大连)科技有限公司;KQ520DE数控超声波清洗器,昆山市超声仪器有限公司;AB204-N电子分析天平,梅特勒-托利多(上海)有限公司;H1750R台式高速冷冻离心机,湖南湘仪集团;Milli-Q超纯水净化系统,美国Millipore公司。
1.1.3 供试品
供试样品为啤酒花雌性球穗花序制品,共14批,S1~S9为真空密封、避光保存的新鲜酒花(新鲜组),由新疆三宝乐农业科技开发有限公司提供,S10~S14为露天存放的酒花(氧化组),购自河北安国中药材市场。14批啤酒花的品种、产地、生产时间详见表1。
表1 十四批啤酒花样品信息
Table 1 Sample information of 14 batches of Humulus lupulus L.
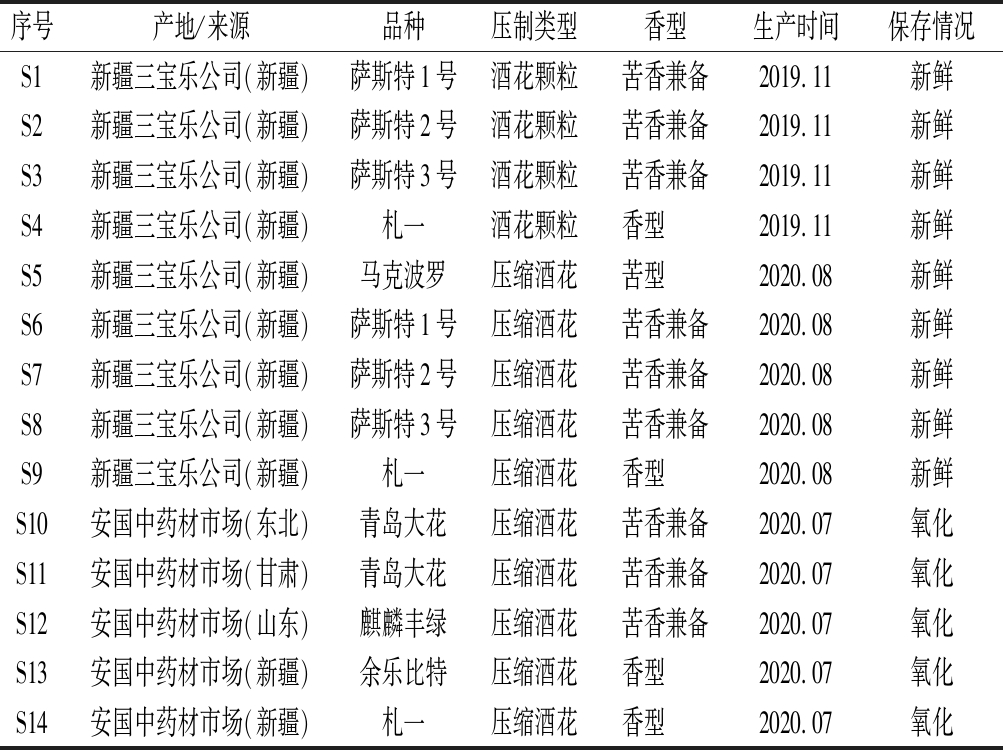
序号产地/来源品种压制类型香型生产时间保存情况S1新疆三宝乐公司(新疆)萨斯特1号酒花颗粒苦香兼备2019.11新鲜S2新疆三宝乐公司(新疆)萨斯特2号酒花颗粒苦香兼备2019.11新鲜S3新疆三宝乐公司(新疆)萨斯特3号酒花颗粒苦香兼备2019.11新鲜S4新疆三宝乐公司(新疆)札一酒花颗粒香型 2019.11新鲜S5新疆三宝乐公司(新疆)马克波罗压缩酒花苦型 2020.08新鲜S6新疆三宝乐公司(新疆)萨斯特1号压缩酒花苦香兼备2020.08新鲜S7新疆三宝乐公司(新疆)萨斯特2号压缩酒花苦香兼备2020.08新鲜S8新疆三宝乐公司(新疆)萨斯特3号压缩酒花苦香兼备2020.08新鲜S9新疆三宝乐公司(新疆)札一压缩酒花香型 2020.08新鲜S10安国中药材市场(东北)青岛大花压缩酒花苦香兼备2020.07氧化S11安国中药材市场(甘肃)青岛大花压缩酒花苦香兼备2020.07氧化S12安国中药材市场(山东)麒麟丰绿压缩酒花苦香兼备2020.07氧化S13安国中药材市场(新疆)余乐比特压缩酒花香型 2020.07氧化S14安国中药材市场(新疆)札一压缩酒花香型 2020.07氧化
1.2 试验方法
1.2.1 样品的制备
1.2.1.1 啤酒花提取液的制备
将啤酒花粉碎后过40~60目筛备用。称取0.500 g过筛后的样品于50 mL具塞锥形瓶中,精密加入50%(体积分数)乙醇25 mL,密塞,称重,超声(200 W,40 kHz)提取30 min,冷却至室温,再称重,用50%乙醇补足损失的重量,摇匀,上清液过0.22 μm有机滤膜,备用。
1.2.1.2 标准品溶液的配制
精确称取150 mg的苹果酸标准品,加入75%(体积分数)乙醇制成3.000 mg/mL的母液。精确称取6 mg黄腐酚标准品,加入75%(体积分数)甲醇制成0.120 mg/mL的母液备用。稀释母液,得到一系列浓度的标准品溶液。
1.2.2 色谱条件
1.2.2.1 液相色谱条件
流动相:A相为水(含0.03%磷酸,体积分数),B相为乙腈(含0.03%磷酸,体积分数),梯度洗脱:0~12 min,0% B;12~13 min,0%~20% B;13~23 min,20 %~30% B;23~41 min,30%~63% B;41~45 min,63% B;45~60 min,63%~80% B;60~61 min,80%~90% B;61~66 min,90% B。流速1 mL/min;进样量10 μL;柱温30 ℃;检测波长:0~12 min,215 nm;12~66 min,360 nm。
1.2.2.2 液质联用条件
流动相:A相为水(含0.1%甲酸,体积分数),B相为乙腈(含0.1%甲酸,体积分数),XAqua C18色谱柱(2.1 mm×150 mm,5 μm),华谱科仪(大连)科技有限公司,柱温30 ℃,流速0.2 mL/min,进样量2 μL,梯度洗脱:0~10 min,0% B;10~30 min,100% B。Dual AJS ESI离子源,负离子模式,气帘气20 psi,温度325 ℃,干燥气流速5 L/min,毛细管电压 3 500 V,喷嘴电压2 000 V,全扫描范围m/z 50~1 700。
1.2.3 啤酒花指纹图谱的相似度分析
将啤酒花提取液按照1.2.2.1的液相色谱分离条件进行液相色谱分析,得到不同批次啤酒花的指纹图谱。将图谱导入2012版“中药色谱指纹图谱相似度评价系统”,将S3设定为参照图谱,采用中位数法,时间窗宽度设定0.1 min进行自动匹配,得到啤酒花的对照图谱,并进行相似度分析。
1.2.4 数据分析
利用Agilent Chemostation色谱工作站提取色谱数据,利用SIMCA 14.1进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least square discriminant analysis,OPLS-DA)。
2 结果与分析
2.1 指纹图谱的建立及相似度评价
利用2012版“中药色谱指纹图谱相似度评价系统”对各批次啤酒花指纹图谱进行分析,14批啤酒花的指纹图谱如图1所示。从14批啤酒花指纹图谱中共确定了31个共有峰。进一步计算14批啤酒花的相似度,如表2所示,14批啤酒花的相似度>0.890,除S5外,其他13批不同产地、不同年份以及不同保存形式的啤酒花相似度均>0.978,说明各批次啤酒花之间化学成分差异较小,而S5与其他批次之间的相似度偏低,说明马克波罗(S5)与其他品种的啤酒花间存在一定的差异。

图1 十四批啤酒花HPLC指纹图谱
Fig.1 HPLC fingerprint of 14 batches of Humulus lupulus L.
表2 十四批啤酒花相似度
Table 2 Similarity evaluation result of 14 batches of Humulus lupulus L.

批次号S1S2S3S4S5S6S7S8S9S10S11S12S13S14S11S20.9961S30.9990.9971S40.9970.9890.9941S50.9370.9580.9470.9121S60.9940.9840.9910.9950.9001S70.9980.9920.9960.9980.9180.9981S80.9990.9930.9970.9980.9230.99711S90.9950.9880.9930.9990.9060.9970.9980.9981S100.9920.9830.9890.9980.8970.9940.9960.9960.9991S110.9930.9840.9900.9990.9000.9950.9960.9970.99911S120.9910.9820.9880.9980.8970.9930.9950.9950.9970.9990.9991S130.9880.9780.9850.9940.8900.9920.9930.9920.9950.9980.9970.9971S140.9910.9810.9870.9970.8930.9930.9950.9950.9980.9990.99910.9981
通过“中药色谱指纹图谱相似度评价系统”对14批啤酒花指纹图谱进行分析,得到啤酒花的对照指纹图谱如图2所示,本研究所建立的啤酒花指纹图谱可以将啤酒花的组成明显分为几个组分:0~10 min的1~7号共有峰为以纯水(含0.03% H3PO4,体积分数)做流动相进行分离的强极性组分,15~45 min的8~26号共有峰为中等极性组分,45~66 min的27~31号共有峰为极性较弱的组分。与之前报道的啤酒花指纹图谱相比[1,14],本研究所建立的啤酒花指纹图谱分析方法可以将啤酒花中的成分进行更好地分离,获得更多的色谱峰,降低了因色谱峰重叠而产生的对啤酒花质量评价的影响。
采用高效液相色谱-四极杆飞行时间质谱对啤酒花的化学组成进行定性分析,通过与对照品比对、一级精确相对分子质量比对,鉴定得到2号峰为苹果酸([M-H]-:133.013 0),26号峰为黄腐酚([M-H]-:353.088 7),保留时间分别为4.11、44.37 min。由于采用了极性反相C18色谱柱,对啤酒花中的强极性成分进行了较好的分离,首次从啤酒花中鉴定到苹果酸。
2.2 定量分析
2.2.1 线性关系
取一系列浓度梯度的苹果酸与黄腐酚的标准品溶液,进行色谱分析,得到不同浓度标准品溶液对应的峰面积,以标准品质量浓度(mg/mL)为横坐标(x),对应浓度的峰面积为纵坐标(y),绘制标准曲线。结果表明在0.015 0~3.000 mg/mL的苹果酸的浓度与峰面积呈线性关系,线性回归方程为y=577.03x+9.713,R2为0.999 6;在0.000 120~0.120 mg/mL的黄腐酚的质量浓度与峰面积呈线性关系,线性回归方程为y=52 863x+4.655 1,R2为1。
2.2.2 十四批啤酒花苹果酸、黄腐酚含量测定
对14批啤酒花中的苹果酸、黄腐酚含量进行测定,结果如表3所示。14批啤酒花的苹果酸含量为2.42 1~12.248 g/kg,黄腐酚的含量为0.092 0~4.73 4 g/kg。由表3中密封保存酒花的苹果酸含量可以看出,香花(S4、S9)的苹果酸含量最高,苦香兼备型酒花(S1~S3、S6~S8)次之,苦型花(S5)的苹果酸含量最低。

a-啤酒花对照指纹图谱3~6 min局部放大图;b-啤酒花对照
指纹图谱19~25 min局部放大图;c-啤酒花对照指纹图谱
34~43 min局部放大图
图2 啤酒花对照指纹图谱
Fig.2 Reference fingerprint of Humulus lupulus L.
表3 十四批酒花的苹果酸、黄腐酚含量 单位:g/kg
Table 3 The content of malic acid and xanthohumol in 14 batches of Humulus lupulus L.

批次号苹果酸黄腐酚S110.141±0.0691.307±0.026S29.431±0.0531.320±0.035S39.473±0.0571.354±0.043S49.612±0.0410.981±0.039S58.335±0.0344.734±0.020S610.614±0.0630.297±0.045S710.964±0.0510.669±0.037S88.874±0.0371.089±0.033S912.248±0.0750.363±0.039S1011.962±0.0620.477±0.057S118.778±0.0530.566±0.049S122.421±0.0660.508±0.034S135.203±0.0780.092±0.053S143.803±0.0800.194±0.056
啤酒花的新鲜程度对黄腐酚的含量影响较大,密封保存组(新鲜组)啤酒花的黄腐酚含量普遍大于露天保存组(氧化组)。PRENCIPE等[19]对啤酒花中的黄腐酚进行了含量测定,其含量为0.8~5 g/kg,与本文中新鲜组酒花的黄腐酚含量一致。进一步从表3中的数据可知,除新鲜程度外,黄腐酚的含量还受到啤酒花的香型以及压制类型的影响。同种压制类型,香花品种(S4、S9)的黄腐酚含量要低于苦香兼备型酒花(S1~S3、S6~S8)或苦型酒花(S5),苦型酒花(S5)的黄腐酚含量最高。除压缩马克波罗(S5)、压缩萨斯特3号(S8)外,酒花颗粒(S1~S4)的黄腐酚含量均高于压缩啤酒花(S6、S7、S9~S14),由此可见,啤酒花以酒花颗粒形式可以更好地进行保存。
2.3 化学模式识别研究
2.3.1 PCA
以14批啤酒花的共有峰峰面积为变量,使用SIMCA14.1软件进行无监督的主成分分析,得到PCA得分图,如图3所示。其中模型参数R2X代表了模型拟合的程度,数值即为对模型的解释率,Q2表示模型预测数据的效果,Q2>0.5表示模型具有良好的预测性[20-21]。本研究所构建的模型R2X=0.985,Q2=0.562,说明该模型可以解释98.5%的样本信息,且具有良好的预测性。
通过PCA得分图可以看出,14批啤酒花可按新鲜程度明显区分,聚为两类。其中新鲜组的S1~S9聚为一类,S5因其品种为苦型花,故在散点图中距离其他新鲜酒花较远,氧化组的S10~S14聚为一类。说明酒花的新鲜程度差异可以通过指纹图谱的差异进行表征。

图3 十四批啤酒花PCA得分图
Fig.3 PCA scatter plot for 14 batches of Humulus lupulus L.
2.3.2 OPLS-DA
将14批啤酒花共有峰峰面积数据及分组信息导入SIMCA 14.1软件中继续进行有监督的OPLS-DA,得到OPLS-DA得分图,如图4所示。模型参数R2X=0.610、R2Y=0.962、Q2=0.882,说明模型稳定可靠[22]。由图4可知,14批啤酒花明显分为两类,与PCA结果相一致。
由建立的OPLS-DA模型得到14批啤酒花的31个共有峰的变量投影值(variable importance for the projection,VIP),以VIP>1为条件[23]筛选出可区分啤酒花新鲜程度的差异性化合物,如图5所示。按差异性化合物贡献程度进行排序:4号峰(VIP=1.236)>1号峰(VIP=1.171)>15号峰(VIP=1.142)>14号峰(VIP=1.137)>21号峰(VIP=1.134)>13号峰(VIP=1.104)>20号峰(VIP=1.088)>26号峰(VIP=1.085)>27号峰(VIP=1.070)>18号峰(VIP=1.060)>28号峰(VIP=1.053)>29号峰(VIP=1.035)>2号峰(VIP=1.006)。这13个色谱峰可作为评价啤酒花新鲜程度的标志性指纹谱峰。

图4 十四批啤酒花OPLS-DA得分图
Fig.4 OPLS-DA scores plot for 14 batches of Humulus lupulus L.
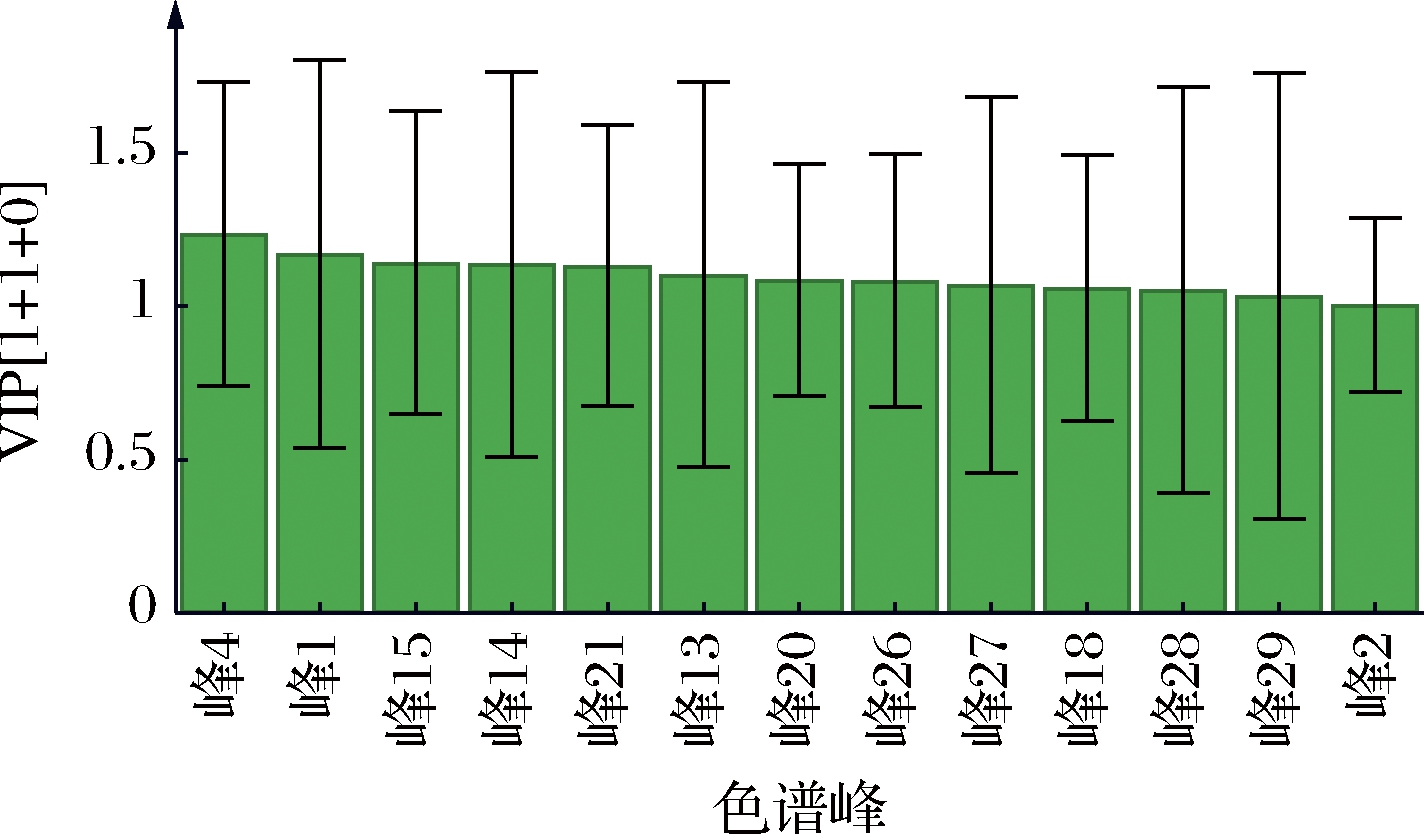
图5 啤酒花样品的VIP值预测图(VIP >1)
Fig.5 VIP predicted values plot of Humulus lupulus L.(VIP>1)
3 结论
本实验采用键合有极性官能团的反相C18色谱柱建立了啤酒花的切换波长HPLC指纹图谱分析方法,实现了同时对啤酒花强极性、中等极性及弱极性物质的分离。对14批啤酒花进行指纹图谱分析,共确定31个共有峰,相似度>0.890,表明不同产地、不同品种、不同压缩方式及保存方式的啤酒花样品间差异不大。首次基于HPLC技术确认啤酒花中存在苹果酸,为2号指纹谱峰,同时指认出26号指纹谱峰为黄腐酚。测定了14批啤酒花中苹果酸和黄腐酚的含量,苹果酸的含量为2.421~12.248 g/kg,黄腐酚的含量为0.092 0~4.734 g/kg,表明不同样品间存在一定的差异。PCA和OPLS-DA结果表明,14批啤酒花可按新鲜程度分为新鲜酒花和氧化酒花,并确定了1号、2号、4号、13~15号、18号、20号、21号、26~29 号这13个色谱峰可作为啤酒花质量控制的标志性指纹谱峰。综上所述,本研究发展的HPLC指纹图谱分析方法为啤酒花的质量评价提供了有效的方法依据。
在后续的实验中,可通过多维液相色谱分离分析,联合质谱技术对啤酒花中的未知化学成分进行指认,以期对啤酒花有更加深入的了解。
[1] 董志敏, 许月明, 闻俊, 等.啤酒花HPLC指纹图谱研究[J].药学实践杂志, 2019, 37(1):42-45;54.
DONG Z M, XU Y M, WEN J, et al.Study on fingerprint of Humulus lupulus by HPLC[J].Journal of Pharmaceutical Practice, 2019, 37(1):42-45;54.
[2] 刘景雪, 姜玉, 谢和辉, 等.中药啤酒花药理作用的研究进展[J].药学实践杂志, 2019, 37(1):5-8;13.
LIU J X, JIANG Y, XIE H H, et al.Advances in pharmacological effects of traditional Chinese medicine hops[J].Journal of Pharmaceutical Practice, 2019, 37(1):5-8;13.
[3] MAIETTI A, BRIGHENTI V, BONETTI G, et al. Metabolite profiling of flavonols and in vitro antioxidant activity of young shoots of wild Humulus lupulus L.(hop)[J].Journal of Pharmaceutical and Biomedical Analysis, 2017, 100(142):28-34.
[4] 蒋培基, 王德良, 江伟, 等.基于竞争性等位基因特异性PCR技术对啤酒花进行纯度检测[J].食品与发酵工业, 2018, 44(1):211-216.
JIANG P J, WANG D L, JIANG W, et al.Based on Kompetitive allele specific PCR methodology for the purity detection of Humulus lu- pulus varieties[J].Food and Fermentation Industries, 2018, 44(1):211-216.
[5] 周煜, 薛璐, 吴子健, 等.啤酒挥发性风味成分研究进展[J].食品研究与开发, 2021, 42(1):210-219.
ZHOU Y, XUE L, WU Z J, et al.Research progress on beer volatile flavor components[J].Food Research and Development, 2021, 42(1):210-219.
[6] 刘晓燕, 夏天爽, 董志敏, 等.啤酒花抗骨质疏松的应用及展望[J].药学实践杂志, 2020, 38(6):492-495.
LIU X Y, XIA T S, DONG Z M, et al.Application and prospect of Humulus lupulus L.in anti-osteoporosis[J].Journal of Pharmaceutical Practice, 2020, 38(6):492-495.
[7] 刘泽畅, 刘玉梅.啤酒苦味与啤酒花苦味物质[J].中国酿造, 2019, 38(1):13-19.
LIU Z C, LIU Y M.Bitterness of beer and bitterness substance in hops[J].China Brewing, 2019, 38(1):13-19.
[8] V ZQUEZ LOUREIRO P, HERN
ZQUEZ LOUREIRO P, HERN NDEZ JIMÉNEZ I, SEND
NDEZ JIMÉNEZ I, SEND N R, et al.Determination of xanthohumol in hops, food supplements and beers by HPLC[J].Foods(Basel, Switzerland), 2019, 8(10):E435.
N R, et al.Determination of xanthohumol in hops, food supplements and beers by HPLC[J].Foods(Basel, Switzerland), 2019, 8(10):E435.
[9] 陆鸿远, 李想, 王常丽, 等.啤酒花提取物对原代棕色脂肪细胞功能的影响及其机制[J].中草药, 2017, 48(7):1 374-1 379.
LU H Y, LI X, WANG C L, et al.Effects of Humulus lupulus ex- tract on function of primary brown adipose tissue cells and its mechanisms[J].Chinese Traditional and Herbal Drugs, 2017, 48(7):1 374-1 379.
[10] 杨静文, 刘泽畅, 陈培, 等. 啤酒花中不同比例β-酸同系物的抗氧化及抑菌活性[J].食品科学,2020,41(23):83-90.
YANG J W, LIU Z C, CHEN P, et al.Antioxidant and antibacterial activities of β-acid homologue mixtures with different ratios from hops[J].Food Science, 2020, 41(23):83-90.
[11] SCHULZ C, CHIHEB C, PISCHETSRIEDER M.Quantification of co-, n-, and ad-lupulone in hop-based dietary supplements and phytopharmaceuticals and modulation of their contents by the extraction method[J].Journal of Pharmaceutical and Biomedical A- nalysis, 2019, 168:124-132.
[12] 杜亚楠.啤酒花中α-酸的提取及其防腐性在豆腐储藏中的应用[D].呼和浩特:内蒙古农业大学, 2017.
DU Y N.The extracting of α-acids in hops and the application of Tofu during storage[D].Hohhot:Inner Mongolia Agricultural University, 2017.
[13] 宁井铭, 颜玲, 宛晓春, 等.基于HPLC技术的普洱生茶指纹图谱[J].食品与发酵工业, 2015, 41(2):200-206.
NING J M, YAN L, WAN X C, et al.Study on fingerprints of Pu′er raw tea based on high performance liquid chromatography[J].Food and Fermentation Industries, 2015, 41(2):200-206.
[14] 刘晓燕, 蒋益萍, 张嘉宝, 等.啤酒花的HPLC指纹图谱建立及其抗氧化作用谱效关系研究[J].中国药房, 2020, 31(2):138-143.
LIU X Y, JIANG Y P, ZHANG J B, et al.Establishment of HPLC fingerprint and its spectrum-effect relationship study of Humulus lupulus[J].China Pharmacy, 2020, 31(2):138-143.
[15] S NCHEZ-MATA M C, CABRERA LOERA R D, MORALES P, et al.Wild vegetables of the mediterranean area as valuable sources of bioactive compounds[J].Genetic Resources and Crop Evolution, 2012, 59(3):431-443.
NCHEZ-MATA M C, CABRERA LOERA R D, MORALES P, et al.Wild vegetables of the mediterranean area as valuable sources of bioactive compounds[J].Genetic Resources and Crop Evolution, 2012, 59(3):431-443.
[16] CAI J F, XIN H X, CHENG L P, et al.Preparative separation of the polar part from the rhizomes of Anemarrhena asphodeloides using a hydrophilic C18 stationary phase[J].Journal of Chromatography B, 2017, 1 063:149-155.
[17] LIU D, JIN H L, WANG J X, et al.Offline preparative 2-D polarcopolymerized reversed-phase chromatography×zwitterionic hydrophilic interaction chromatography for effective purification of polar compounds from Caulis Polygoni Multiflori[J].Journal of Chromatography B, 2019, 1 118-1 119:70-77.
[18] FU D M, ZHANG X, ZHANG H, et al.Simple and efficient prep- aration of high-purity trehalulose from the waste syrup of isomaltulose production using solid-phase extraction followed by hydrophilic interaction chromatography[J].Journal of Separation Science, 2021, 44(12):2 334-2 342.
[19] PRENCIPE F P, BRIGHENTI V, RODOLFI M, et al.Development of a new high-performance liquid chromatography method with diode array and electrospray ionization-mass spectrometry detection for the metabolite fingerprinting of bioactive compounds in Humulus lupulus L.[J].Journal of Chromatography A, 2014, 1 349:50-59.
[20] 梁慧, 潘晓君, 吕渭升, 等.不同基原藁本药材的指纹图谱建立及其化学计量学分析[J].中国药房, 2021, 32(19):2 358-2 362.
LIANG H, PAN X J, LYU W S, et al.Fingerprint establishment of rhizoma ligustici from different origins and their chemometrics anal- ysis[J].China Pharmacy, 2021, 32(19):2 358-2 362.
[21] 李振雨, 何嘉莹, 童培珍, 等.基于UPLC指纹图谱和多成分定量的辛夷药材产地差异性研究[J].中草药, 2021, 52(1):234-240.
LI Z Y, HE J Y, TONG P Z, et al.Differences of Magnoliae Flos from different producing areas based on fingerprint and multi-components determination[J].Chinese Traditional and Herbal Drugs, 2021, 52(1):234-240.
[22] 张妍,赵昕琪,王天琪,等.非靶向代谢组技术研究饮料发酵前后物质变化[J].食品与发酵工业, 2021, 47(22):115-120.
ZHANG Y, ZHAO X Q, WANG T Q, et al.Component changes in corn beverage before and after fermentation analyzed by non-targe- ted metabolomics technique[J].Food and Fermentation Industries, 2021, 47(22):115-120.
[23] 张继光, 吴万富, 吕世懂.基于脂肪酸组成的茶叶籽油和油茶籽油模式识别分析[J].食品与发酵工业, 2020, 46(17):247-252.
ZHANG J G, WU W F, LYU S D, et al.Pattern recognition analysis of Camellia seed oil and oil-tea Camellia seed oil based on fatty acid composition[J].Food and Fermentation Industries, 2020, 46(17):247-252.