传统烧鸡风味独特、营养全面,深受当地消费者的青睐。烧鸡制作一般经过生鸡预处理、整形、油炸、卤煮等工艺[1-2]。静宁烧鸡有别于传统烧鸡,作为甘肃百年老字号,其主要使用陈年老卤汤卤煮,卤制过程中老汤赋予鸡肉独特的风味[3]。由于卤煮时间长,加之老汤重复使用,静宁烧鸡中可能会产生一定量的杂环胺(heterocyclic aromatic amines,HAAs)[4]。HAAs是由富含蛋白质的食品经过热加工由蛋白质、氨基酸热解产生的一类具有多环芳香族结构的致癌致突变化合物[5-6]。HAAs能够诱导人体发生氧化应激,以及细胞生物活性功能损害,最终增加人体慢性疾病发生的概率[7]。因此,有必要研究静宁烧鸡中HAAs的检测方法。
肉制品中由于HAAs含量低(ng/g)、种类多,且成分复杂,因此准确定量肉制品中的每种HAAs化合物及其困难[8]。此外,HAAs类化合物水溶性强,挥发性低,有部分HAAs缺乏紫外生色团结构,还有部分HAAs没有荧光特性,如何快速、准确、高效检测并定量HAAs一直是近几年研究的热点[9-10]。目前,我国发布的关于食品中HAAs含量检测标准仅有GB 5009.243—2016 《食品安全国家标准 高温烹调食品中杂环胺类物质的测定》,其主要适用于烤鱼、烤肉及其制品中5种HAAs的测定。2021年11月由中国农业农村部发布的NY/T 3904—2021 《肉及肉制品中杂环胺检测液相色谱-串联质谱法》主要适用于肉及肉制品中13种HAAs的测定。我国现阶段对于食品中HAAs的限量标准还尚未建立,同时也缺乏对酱卤肉制品中的HAAs专一的测定方法研究。
目前,食品中检测HAAs的方法主要有气相色谱(gas chromatography,GC)、气相色谱-质谱联用(gas chromatograph-mass spectrometer,GC-MS)、液相色谱(liquid chromatograph,LC)、液相色谱-质谱联用(liquid chromatograph mass spectrometer,LC-MS)等[11-13]。由于HAAs大多不具有挥发性,应用GC或GC-MS方法检测,须先将其衍生为挥发性物质再进行检测,而目前衍生化技术操作繁琐,检测灵敏度较差,限制了上述检测方法的普及[14]。LC-MS灵敏度高,选择性强,是当前用于测定HAAs的首选方法[15]。
李可等[7]采用LC-MS技术对酱卤鸡腿老汤中的HAAs进行检测。结果表明,10种HAAs标准品在2~200 μg/L线性范围良好,在不同浓度标准品的添加水平下回收率为55.6%~100.2%。魏晋梅等[16]建立了LC-MS快速检测酱卤肉制品中5种HAAs的方法,5种HAAs的加标回收率为76.9%~127.7%,检出限为0.01~0.1 μg/kg,定量限为0.025~0.25 μg/kg,能满足酱卤肉制品中HAAs的检测需求。目前采用LC-MS检测静宁烧鸡中HAAs的方法未见文献报道。因此,本文旨在通过固相萃取-液相色谱/质谱法(solid-phase extraction-liquid chromatography mass spectrometry,SPE-LC/MS)建立静宁烧鸡中14种HAAs的检测方法,以便为HAAs控制研究奠定理论基础。
1 材料与方法
1.1 材料与仪器
标准品:Harman(1-甲基-9 H-吡啶并[3,4-b]吲哚)、Norharman(9 H-吡啶并[3,4-b]吲哚)、PhIP(2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶)、Trp-P-1(3-氨基-1,4-二甲基-5 H-吡啶并[4,3-b]吲哚)、Trp-P-2(3-氨基-1,4-二甲基-5 H-吡啶[4,3-b]吲哚乙酸)、MeIQx(2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉)、4,8-DiMeIQx(2-氨基-3,4,8-三甲基咪唑并[4,5 -f]喹喔啉)、AαC(2-氨基-9 H-吡啶并[2,3-b]吲哚)、IQ(2-氨基-3-甲基咪唑并[4,5-f]喹啉)、Glu-p-1(2-氨基-6-甲基二吡啶并[1,2-a:3′,2′-d]咪唑)、IQx(2-氨基-3-甲基咪唑并[4,5-f]喹喔啉)、7,8-DiMeIQx(2-氨基-3,7,8-三甲基咪唑并[4,5-f]喹喔啉)、DMIP(2-氨基-1,6-二甲基咪唑并[4,5-b]吡啶)、MeIQ(2-氨基-3,4-二甲基咪唑并[4,5-f]喹喔),纯度均不低于99.9%,加拿大Toronto Research Chemicals公司;乙酸乙酯、甲醇、乙腈、甲酸、二氯甲烷均为色谱纯,天津市科密欧化学试剂有限公司。
样品采集:静宁烧鸡购买自甘肃静宁县烧鸡店。肉样采集后,将鸡胸部位鸡肉与鸡皮分开,分别用组织捣碎机捣碎成肉糜,在-18 ℃下保存待用。
LC-MS/MS Agilent 1290—6460液相色谱串联三重四极杆质谱仪,配有电喷雾离子源(electrospray ionization,ESI),美国安捷伦公司;RE-52C旋转蒸发仪,郑州市亚荣仪器有限公司;FSH-2A型可调高速匀浆机,江苏省金坛市友联仪器研究所;TGL-16MC型冷冻离心机,湖南湘仪集团;KH3200B型超声波清洗器昆山禾创超声仪器有限公司;Milli-Q超纯水系统,Millipore公司;固相萃取柱Cleanert PS(500 mg/6mL)、Cleanert MCX(500 mg/3mL)、Strata-X(500 mg/3mL)、Cleanert PRS(500 mg/3mL)、Cleanert S C18(500 mg/6mL),天津博纳艾杰尔科技有限公司。
1.2 实验方法
1.2.1 标准溶液的配制
准确称取14种HAAs标准品各5 mg,标准品用甲醇溶解,并在棕色容量瓶中定容至50 mL,配制成质量浓度均为100 mg/L的单标储备液。按实际检测要求,准确移取相同体积的各储备液制备成混合标准品溶液,用甲醇将混标液分别稀释成10、20、50、100、500 μg/L。所有的标准溶液保存在-18 ℃。
1.2.2 样品前处理方法
样品前处理根据董学文[11]的方法稍作修改。称取2 g肉样与10 mL乙酸乙酯和2 mL 1 mol/L的NaOH混合,在冰浴条件下均质30 s(10 000 r/min)后以6 000×g的转速离心10 min。将上清液收集,沉淀按上述步骤重复提取2次并合并上清液。除去位于上清液下层的水溶液后,将上清液在旋转蒸发仪中浓缩,浓缩完成后使用6 mL二氯甲烷重新溶解提取物。将5 mL二氯甲烷加入丙磺酸(propanesulfonic acid,PRS)柱使之活化,将提取物加入活化后的PRS柱中。随后,依次加入4 mL 0.1 mol/L HCl,6 mL甲醇盐酸混合液[V(甲醇)∶V(0.1 mol/L HCl)=1∶1]和2 mL蒸馏水洗脱PRS柱,收集含有非极性HAAs的部分。将收集的洗脱液加入0.26 mL氨水后,将其加入活化后的C18柱中(活化:2 mL甲醇、5 mL蒸馏水)。仍然留在PRS柱中的极性杂环胺使用20 mL 0.5 mol/L乙酸铵(pH 8.5)洗脱。最后,吸取溶液1.5 mL[V(甲醇)∶V(氨水)=19∶1]分别冲洗2个C18柱。将收集的3 mL洗脱液通过0.22 μm有机滤膜后收集,待LC-MS上机检测。
1.3 检测条件
1.3.1 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18色谱柱(150 mm×2.1 mm,5 μm),柱温35 ℃,流动相A为0.1%(体积分数)甲酸水溶液,流动相B为甲醇-0.1%(体积分数)甲酸,流速0.3 mL/min,进样量2 μL,梯度洗脱程序见表1。
表1 十四种HAAs分离的梯度洗脱程序
Table 1 Gradient elution program for 14 kinds of HAAs
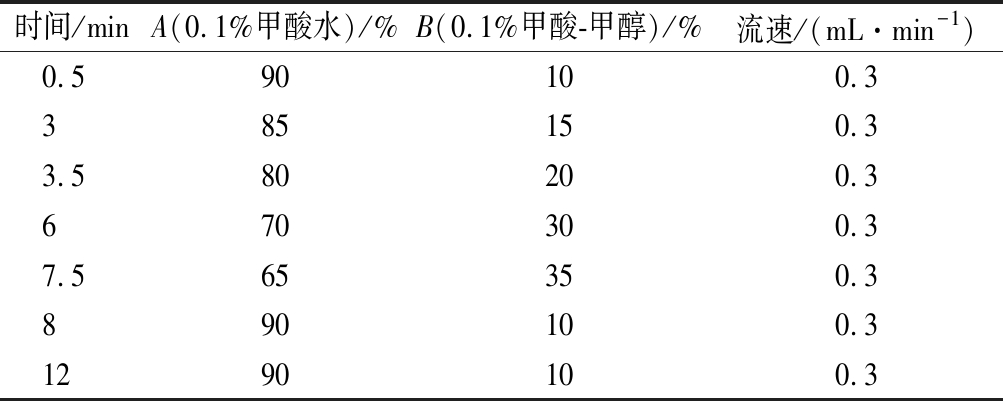
时间/minA(0.1%甲酸水)/%B(0.1%甲酸-甲醇)/%流速/(mL·min-1)0.590100.3385150.33.580200.3670300.37.565350.3890100.31290100.3
1.3.2 质谱检测条件
质谱检测条件参考魏晋梅等[16]的方法并做修改。电喷雾离子源(ESI),正离子扫描、多反应监测(multiple reaction monitoring,MRM)模式;毛细管电压+ 3.2 kV;锥孔电压+1 kV;离子源温度120 ℃;脱溶剂温度350 ℃;喷雾气为氮气(0.31 MPa);载气流速10 L/min,350 ℃;鞘气流速11 L/min,350 ℃;脱溶剂气流速500 L/h;锥孔反吹气流速50 L/h;质量扫描范围(m/z):80~1 000;扫描时间0.05 ms,其他质谱信息见表2。
表2 十四种HAAs优化的特征离子与质谱参数
Table 2 MS parameters of the characterization of14 HAAs

化合物名称定性离子对Q1(m/z)定量离子对Q1(m/z)碎裂电压/V碰撞能量CE/VGlu-p-1199.1184/156.712029/41TRP-P-2198.1154/12711533/45MeIQ213.1131/77.122529/57Harman183.1115/89.19541/60MeIQx214.1199/13114029/45Nor Harmane169.1115/89.113041/60IQ199.1184/15712029/417,8-DiMeIQx228.1213/13115529/45PhIP225.1210/14014022/60TRP-P-1212.1167/1959041/25IQx200.1185/15812529/41DMIP163.1148/105.113029/45A&C184.1157/15620025/334,8-DiMeIQx228.1213.1/13114529/45
1.4 方法学评价
本研究对LC-MS检测方法线性范围、检测限(limit of detection,LODs)、定量限(limit of quantita- tion、LOQs)、加标回收率、精密度等方法学参数进行分析。HAAs加标回收率:在静宁烧鸡空白样品中添加20、50、100 μg/L 3个浓度的HAAs混合标准溶液,按照1.2 和1.3节方法检测分析,计算回收率和精密度。以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)为该方法对各种HAAs的LODs和LOQs,单位为ng/g。
1.5 数据分析
采用仪器自带的Agilent MassHunter软件对LC- MS所得的数据进行采集和峰面积积分处理。试验数据使用SPSS 20.0试验统计软件对数据进行显著性分析(P<0.05),并使用Origin 2017作图,每组试验重复3次。
2 结果与分析
2.1 质谱条件的优化
取质量浓度为1 μg/mL的14种HAAs标准品在LC-MS上以0.3 mL/min的流速进样,调节毛细管电压和碰撞电压,考察14种HAAs标准品最佳的质谱条件。由于HAAs中含有氨基和亚氨基,根据其电离特性,本研究选择正离子模式进行检测[17]。通过LC-MS自带的Masslynx 4.1自动调谐功能进行调谐,分别对14种HAAs的MRM参数进行优化。在MRM模式下,质谱通常通过筛选目标化合物的母离子和定量离子来定性并且定量待测化合物,以提高质谱检测的选择性和灵敏度。因此,基于肉样品基质的复杂性,为更好地对静宁烧鸡中痕量HAAs进行检测,本研究通过比较各定性定量碎片离子所产生的质谱信号的强弱,选择相对丰度最高的离子碎片作为定量离子,14种HAAs的定性与定量特征离子及优化的质谱参数见表2。
2.2 色谱条件的优化
2.2.1 色谱柱的选择
反相色谱柱是LC-MS/MS分析中最常用的柱子,实验选取了ZORBAX Eclipse XDB-C18色谱柱,对比了两种规格(150 mm×2.1 mm,5 μm)、(50 mm×2.1 mm,5 μm)对14种HAAs实际分离效果,结果表明,50 mm规格的色谱柱响应值低、峰形不能区别开,150 mm的色谱柱具有良好的分离效果,可供检测14种HAAs。
2.2.2 流动相的选择
流动相的比例能够在一定程度影响目标化合物在色谱柱上的分离和保留行为。14种HAAs大多为弱碱性化合物,其在流动相中的分离能力和溶解性因流动相的变化而变化。在流动相中添加有机酸类溶液如甲酸、甲酸铵和乙酸铵等能够提高HAAs的离子化效率,改善峰形,提高检测的灵敏度[10]。根据LC-MS仪器自身条件的局限,本研究分别考察了甲醇、乙腈、0.1%甲酸水、甲酸铵(2.5、5、10 mmol/L)对14种HAAs分离效果的影响,同时还对有机相中添加甲酸进行研究,结果发现,0.1%甲酸水和甲醇-0.1%甲酸作为流动相进行梯度洗脱时,色谱峰峰形尖锐,对称性好,在12 min内能够完全快速分离HAAs,因此,本研究选取0.1%甲酸水和甲醇-0.1%甲酸作为流动相条件。
2.2.3 柱温的选择
柱温箱能够通过调控温度维持色谱柱的稳定性,有利于色谱峰分离的程度,确保待测化合物检测结果的准确性和重现性。为此,本研究考察了不同的柱温箱温度(25、30、35、40 ℃)对14种HAAs标准品的分离效果。结果表明在35 ℃条件下,14种HAAs混标峰形尖锐,分离度好,并且具有较高的响应值,因此,本研究将柱温箱温度设定为35 ℃进一步研究。
2.3 样品前处理条件的优化
2.3.1 固相萃取柱的选择
不同的提取溶剂所得的提取液往往会产生不同程度的基质干扰,影响定量的准确性。因此,在优化提取方法的同时,必须选择与之配套的固相萃取条件[18]。如图1所示,基于检测样品可能存在的基质差异,本研究分别对比了PS、MCX、Strata-X、PRS 4种固相萃取柱与C18固相萃取柱串联使用来选择回收率最高的固相萃取柱。结果表明,当PRS固相萃取柱与C18柱串联使用其加标回收率显著高于其他3种串联使用的固相萃取柱,这可能是由于PRS柱中的填料丙磺酸键合硅胶对弱碱性化合物HAAs具有良好的保留能力。因此本研究选用PRS柱(60 mg/3mL)与C18柱进行富集、净化。

图1 固相萃取柱种类对HAAs回收率的影响
Fig.1 Influences of different solid phase extraction columns on recoveries of HAAs
注:不同小写字母表示差异显著(P<0.05)(下同)
2.3.2 提取溶剂的选择
HAAs属于碱性有机化合物,其亲水性或疏水性取决于所处介质的酸碱性,当pH <3时,HAAs上的氨基带正电荷,使其表现为亲水性,随后,HAAs随着所处介质pH的升高逐渐表现出疏水性[11]。因此在静宁烧鸡肉样提取HAAs的过程中先用NaOH碱化处理后,再通过有机溶剂进行提取。HAAs化合物在有机溶剂和水中均可以溶解,如图2所示,本研究考察了二氯甲烷、乙酸乙酯、甲醇及乙腈作为提取溶剂并加入NaOH溶液(1 mol/L)进行提取时的加标回收率。结果表明,二氯甲烷由于密度较大,与肉样均质混合离心后分层效果不明显,乙腈提取回收率较低且不易挥发,用乙酸乙酯提取时大部分HAAs化合物的回收率显著高与其他的提取溶剂,且在浓缩时挥发速度快,对人体危害较小。因此,本试验确定乙酸乙酯作为HAAs的提取溶剂。

图2 提取溶剂种类对HAAs回收率的影响
Fig.2 Influences of different extraction solvents on recoveries of HAAs
2.3.3 PRS柱洗脱液比例的选择
本研究主要是检测静宁烧鸡中的HAAs,而静宁烧鸡中主要在100 ℃以下的卤汤中熟制,其主要存在非极性HAAs,因此本试验对非极性HAAs的洗脱过程进行优化。PRS柱作为强阳离子极性交换柱,乙酸乙酯将HAAs溶解后通过该固相萃取柱,从而将HAAs吸附在丙基磺酸钠中,此时为正相萃取模式,而试验中的非极性HAAs要想被洗脱下来必须在反相洗脱条件下,因此要先用盐酸淋洗转换洗脱模式,再以甲醇/盐酸洗脱得到非极性HAAs[11]。本试验分别采用2、3、4、6 mL盐酸(0.1 mol/L)以及3、5、6、9 mL V(甲醇)∶V(盐酸)=1∶1对固相萃取柱进行洗脱,对比其回收率,如图3所示。结果表明,洗脱液为4 mL盐酸和6 mL甲醇/盐酸时HAAs的回收率达到最高,随着添加比例加大,部分HAAs的回收率反而有所降低,这可能是由于洗脱液体积过多,导致在C18柱中洗脱时不能很好保留而被损失。因此本试验在洗脱过程以4 mL盐酸和6 mL甲醇/盐酸对PRS柱进行洗脱,以便进一步优化。

2∶3、3∶5、4∶6、6∶9为盐酸∶甲醇/盐酸(体积比)
图3 PRS柱洗脱液比例对HAAs回收率的影响
Fig.3 Influences of different eluent ratio of PRS solid phase extraction column on recoveries of HAAs
2.3.4 C18柱洗脱液种类的选择
洗脱液是影响净化效果和回收率的重要因素,如图4所示,本研究考察了二氯甲烷-氨水、甲醇-氨水、二氯甲烷以及甲醇对HAAs回收率的影响,结果表明,氨水作为碱性溶液与甲醇结合用作洗脱液洗脱后的杂质较少,且回收率显著高于其他3种洗脱液。因此,本研究以V(甲醇)∶V(氨水)=19∶1作为C18固相萃取柱的洗脱液。

图4 C18柱洗脱液种类对HAAs回收率的影响
Fig.4 Influences of different C18 solid phase extraction column eluent on recoveries of HAAs
2.4 方法学评价
2.4.1 标准曲线、方法的检出限和定量限
以各种HAAs的浓度为横坐标,峰面积为纵坐标绘制标准曲线,其线性关系如表3。结果显示,各HAAs标准曲线的决定系数r2均大于0.999,各组化合物在1~500 μg/L范围内线性良好,可以满足定量分析的需要。
表3 十四种HAAs的线性范围、回归方程、决定系数及检测限
Table 3 Linear ranges,regression equations,correlation coefficients(r2),limits of detection and quantitation of 14 HAAs

化合物名称保留时间/min浓度范围线性回归方程决定系数LODs/(μg·kg-1)LOQs/(μg·kg-1)Glu-p-16.0421~500/(μg·L-1)y=11.801 695x+4.302 9710.999 141 50.130.43TRP-P-28.1361~500/(μg·L-1)y=30.284 226x-26.828 9950.999 909 980.110.36MeIQ4.4241~500/(μg·L-1)y=65.019 338x-67.786 8790.999 583 070.100.34Harman8.781~500/(μg·L-1)y=124.066 097x+7.478 2210.999 387 280.110.36MeIQx7.0561~500/(μg·L-1)y=44.421 033x-0.192 8680.999 436 150.060.20Nor Harmane7.7471~500/(μg·L-1)y=69.766 712 x-13.610 5230.999 003 450.100.33IQ3.6181~500/(μg·L-1)y=49.877 125x-30.486 8710.999 449 230.060.217,8-DiMeIQx8.3831~500/(μg·L-1)y=45.278 779x+29.865 7930.999 061 810.140.46PhIP5.961~500/(μg·L-1)y=99.766 380x-58.771 1320.999 592 430.060.19TRP-P-18.2731~500/(μg·L-1)y=58.680 927x-172.094 0220.999 379 050.170.58IQx5.5021~500/(μg·L-1)y=43.856 323x+27.284 6060.999 222 30.070.23DMIP4.0391~500/(μg·L-1)y=33.558 181x-0.188 800 40.999 119 860.120.40A&C7.5981~500/(μg·L-1)y=87.332 256x+37.435 6590.999 825 10.080.274,8-DiMeIQx8.3741~500/(μg·L-1)y=86.217 176x+38.386 5860.999 391 880.070.25
注:y表示峰面积;x表示标准品质量浓度(μg/L)
2.4.2 回收率和精密度
回收率采用在不含待测组分的空白肉样中添加测定,添加3个质量浓度水平(20、50、100 μg/L)100 μL体积混合标准液,每个水平重复测6次,结果见表4,结果表明,14种HAAs的加标回收率为83.04%~103.78%,相对标准偏差均低于10%,精密度良好,能够满足静宁烧鸡中HAAs含量的检测要求。
表4 十四种HAAs的回收率和精密度(n=6)
Table 4 Recoveries and precisions of14 HAAs in meat samples(n=6)

化合物名称20 μg/L50 μg/L100 μg/L回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%Glu-p-188.512.2796.972.4686.691.04TRP-P-292.021.8791.664.6983.712.29MeIQ92.791.48101.170.66103.781.79Harman93.851.4793.920.6784.802.02MeIQx96.325.9399.150.74102.641.84Nor Harmane88.558.0489.474.4187.371.99IQ95.163.4395.836.80100.931.287,8-DiMeIQx93.316.4585.951.9883.041.99PhIP99.142.1899.722.2099.132.26TRP-P-194.241.69100.924.45100.461.74IQx94.570.8893.180.7894.371.31DMIP86.515.2296.341.1995.464.18A&C85.754.9998.940.6895.213.144,8-DiMeIQx91.472.2197.451.4894.012.06
2.5 实际样品分析
采用上述优化出来的HAAs检测方法对3家烧鸡店静宁烧鸡中的HAAs进行检测,结果如表5所示。结果表明,静宁烧鸡中共检测出9种HAAs,3家烧鸡的HAAs总量为8.38~12.35 ng/g。李可等[7]通过检测市售传统肉制品中4种HAAs的含量发现,酱卤鸡肉HAAs总量在2.53~3.65 ng/g,邵斌[19]采用优化后的HAAs检测方法对国内6种烧鸡中的HAAs进行检测,结果表明HAAs总含量高达108.84 ng/g。本试验结果与上述研究报道相近,静宁烧鸡中HAAs含量的生成可能是由于卤煮过程中卤汤的反复使用以及添加酱油导致的。
表5 不同购买来源静宁烧鸡中HAAs的含量 单位:ng/g
Table 5 Content of HAAs in different sources of Jingning traditional braised chicken

化合物名称烧鸡1烧鸡2烧鸡3鸡皮鸡肉鸡皮鸡肉鸡皮鸡肉Glu-p-1NDNDNDNDNDNDTRP-P-21.21 ± 0.011.36 ± 0.341.28 ± 0.021.28 ± 0.061.46 ± 0.021.35 ± 0.11MeIQNDNDNDNDNDNDHarman2.2 ± 0.011.7 ± 0.022.28 ± 0.081.59 ± 0.012.01 ± 0.052.46 ± 0.06MeIQxNDNDNDNDNDNDNor Harmane3.86 ± 0.012.75 ± 0.053.98 ± 0.012.49 ± 0.054.18 ± 0.052.26 ± 0.03IQNDNDNDNDNDND7,8-DiMeIQxNDNDNDNDNDNDPhIP0.62 ± 0.010.64 ± 0.050.64 ± 0.030.6 ± 0.030.64 ± 0.030.58 ± 0.01TRP-P-11.61 ± 0.212.23 ± 0.362.59 ± 0.041.71 ± 0.162.82 ± 0.051.29 ± 0.05IQx0.34 ± 0.020.23 ± 0.010.28 ± 0.030.19 ± 0.010.19 ± 0.010.24 ± 0.05DMIP0.61 ± 0.150.35 ± 0.020.6 ± 0.070.21 ± 0.010.4 ± 0.050.36 ± 0.06A&C0.45 ± 0.040.44 ± 0.020.43 ± 0.050.32 ± 0.020.5 ± 0.020.34 ± 0.024,8-DiMeIQxNDNDNDNDNDND总HAAs11.129.712.178.3812.358.9
注:数值表示为“平均值±标准差”(n=3);ND表示未检出
3 结论
以静宁烧鸡中鸡皮和鸡肉作为检测样本,优化和选择了SPE-LC/MS对14种HAAs检测的仪器参数和样品前处理方法。该方法线性关系良好,加标回收率为83.04%~103.78%,相对标准偏差为0.42%~7.66%,且前处理提取HAAs操作简单,用时较短,安全性较高,检测仪器LC-MS的灵敏性强,定量准确,应用范围广,能够满足静宁烧鸡中HAAs的检测要求,可为静宁烧鸡中HAAs的形成规律以及控制等相关研究提供理论基础。
[1] 邵斌, 张雅玮, 彭增起, 等.传统烧鸡加工业面临的挑战和机遇[J].肉类研究, 2011, 25(5):33-36.
SHAO B, ZHANG Y W, PENG Z Q, et al.Challenges and opportunities for the traditional carbonado processing industry[J].Meat Research, 2011, 25(5):33-36.
[2] ALAM SHAH S, SELAMAT J, HAQUE AKANDA M J, et al.Effects of different types of soy sauce on the formation of heterocyclic amines in roasted chicken[J].Food Additives & Contaminants.Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2018, 35(5):870-881.
[3] 赵菁, 李军.静宁饮食文化探析[J].粮食科技与经济, 2019, 44(10):145-148.
ZHAO J, LI J.Investigation and research on food culture in Jingning[J].Grain Science and Technology and Economy, 2019, 44(10):145-148.
[4] 魏秋红, 李艳秋, 韩文凤, 等.烧鸡加工过程中杂环胺的影响因素及抑制措施研究进展[J].肉类研究, 2021, 35(2):56-61.WEI Q H, LI Y Q, HAN W F, et al.Recent progress in research on factors affecting the formation of heterocyclic amines and approaches to inhibit it during roast chicken processing[J].Meat Research, 2021, 35(2):56-61.
[5] 杜洪振, 陈倩, 刘骞, 等.肉制品中杂环胺的形成及其机制[J].中国食品学报, 2020, 20(9):323-336.
DU H Z, CHEN Q, LIU Q, et al.Formation and mechanism of heterocyclic amines in meat products[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):323-336.
[6] TURESKY R J, TAYLOR J, SCHNACKENBERG L, et al.Quantitation of carcinogenic heterocyclic aromatic amines and detection of novel heterocyclic aromatic amines in cooked meats and grill scrapings by HPLC/ESI-MS[J].Journal of Agricultural & Food Chemistry, 2005, 53(8):3 248-3 258.
[7] 李可, 韩雪, 谢美娟, 等.SPE-UPLC-MS/MS法测定酱卤鸡腿老汤中10种杂环胺[J].食品工业, 2017, 38(8):306-310.
LI K, HAN X, XIE M J, et al.Determination of10 heterocyclic aromatic amines in halogen soup of drumstick products by ultra-high performance liquid chromatography tandem mass spectrometry[J].The Food Industry, 2017, 38(8):306-310.
[8] JINAP S, JAAFAR S N, HASNOL N D S, et al.Effect of a different mobile phase on LC-ESI-MS/MS performance for the identification and quantitation of polar and nonpolar heterocyclic amines in cooked chicken[J].Journal of Food Measurement and Characterization, 2020, 14(1):262-271.
[9] PAN H, WANG Z Y, GUO H T, et al.Heterocyclic aromatic amines in meat products consumed in China[J].Food Science & Biotechnology, 2014, 23(6):2 089-2 095.
[10] 张晨霞, 马宇翔, 赵天培, 等.超高效液相色谱-三重四极杆质谱法检测油脂和油炸食品中7种杂环胺类物质[J].色谱, 2020, 38(2):224-231.
ZHANG C X, MA Y X, ZHAO T P, et al.Determination of seven heterocyclic aromatic amines in oils and fried foods by ultra performance liquid chromatography-triple quadrupole mass spectrometry[J].Chinese Journal of Chromatography, 2020, 38(2):224-231.
[11] 董学文.酱牛肉中杂环胺的控制及其品质影响因素研究[D].长春:吉林大学, 2020.
DONG X W.Research on control and quality factors of heterocyclic amines in braised sauce beef[D].Changchun:Jilin University, 2020.
[12] ZHANG Y, WU W J, ZHOU W E, et al.Determination of 14 heterocyclic aromatic amines in meat products using solid-phase extraction and supercritical fluid chromatography coupled to triple quadrupole mass spectrometry[J].Journal of Separation Science, 2020, 43(7):1 372-1 381.
[13] YAN Y, ZHANG S, TAO G J, et al.Acetonitrile extraction coupled with UHPLC-MS/MS for the accurate quantification of 17 heterocyclic aromatic amines in meat products[J].Journal of Chromatography, B.Analytical technologies in the biomedical and life sciences, 2017, 1 068-1 069:173-179.
[14] 张峰, 吕泉福, 储晓刚, 等.固相萃取-超高效液相色谱-电喷雾串联质谱法同时测定烤鱼中15种杂环胺含量[J].分析化学, 2011, 39(4):501-505.
ZHANG F, LYU Q F, CHU X G, et al.Simultaneous determination of 15 heterocyclic amines in grilled fish using solid phase extraction and ultra performance liquid chromatography with electrospray ionization tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2011, 39(4):501-505.
[15] 岑明桦, 许莹盈, 叶培辉, 等.热加工肉制品中杂环胺的分析检测技术研究进展[J].肉类研究, 2020, 34(9):96-104.
CEN M H, XU Y Y, YE P H, et al.Progress in analytical techniques for heterocyclic aromatic amines in heat-processed meat products[J].Meat Research, 2020, 34(9):96-104.
[16] 魏晋梅, 张丹, 李雪, 等.固相萃取-液相色谱-串联质谱法测定市售卤肉制品中5种杂环胺含量[J].食品工业科技, 2020, 41(3):259-263;269.
WEI J M, ZHANG D, LI X, et al.Determination of 5 kinds of heterocyclic amines in stewed meat using solid phase extraction and liquid chromatography-tandem mass spectrometry[J].Science and Technology of Food Industry, 2020, 41(3):259-263;269.
[17] 林翠苹.肉制品中杂环胺的LC-MS/MS检测方法的研究[D].天津:天津科技大学, 2012.
LIN C P.Study on simultaneous determination of heterocyclic aromatic amines in meat products by LC-MS/MS[D].Tianjin:Tianjin University of Science and Technology, 2012.
[18] 丁晓倩.多酚对羊肉炭烤过程杂环胺形成的抑制作用[D].北京:中国农业科学院, 2021.
DING X Q.Inhibitory effect of polyphenols on the formation of hetrocyclic amines during lamb charcoal roasting[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[19] 邵斌.传统烧鸡中9种杂环胺类化合物形成规律研究[D].南京:南京农业大学, 2012.
SHAO B.Study on the formation discipline of 9 heterocyclic aromatic amines in Chinese traditional braised chicken[D].Nanjing:Nanjing Agricultural University, 2012.