苹果酸乳酸发酵(malolactic fermentation, MLF)可以将葡萄汁中尖锐的二元羧酸苹果酸转化为柔和的一元羧酸乳酸和二氧化碳,是葡萄酒酿造中一个重要的过程[1]。MLF的顺利进行使葡萄酒的酸度降低,随着碳源的消耗微生物稳定性得以提高,此外,MLF会改变葡萄酒的香气结构,增加葡萄酒的果香味,丰富葡萄酒的结构感等。因此被认为是酿造优质红葡萄酒必需的步骤[2]。
酒酒球菌(Oenococcus oeni)作为苹果酸乳酸发酵的主要启动者,其生长繁殖和苹果酸乳酸发酵的进行都会受到葡萄酒多种生理生化特性的抑制[3]。葡萄酒中影响苹果酸乳酸发酵进行的4种主要因素分别为乙醇(10%~16%,体积分数)、低pH(3.0~3.5)、SO2(超过10 mg/L)和低温(可能低于12 ℃)[4]。在这些胁迫因素中,低pH是限制微生物在葡萄酒中生长的关键因素。目前许多研究都集中在酒酒球菌胁迫应答机制方面,提出了多种相关机制,例如膜成分和流动性、pH内外平衡、氧化应激反应、DNA和蛋白质损伤修复机制[5]。但酒酒球菌胁迫适应性的具体机制仍需进一步研究。本文主要从酒酒球菌酸胁迫应答机制及提高酒酒球菌抗胁迫能力的方法进行综述。
1 酒酒球菌胁迫应答与防御机制
1.1 阻隔氢离子
在胁迫条件下微生物需要维持细胞膜的主要功能,以控制离子通透性,调节细胞与外界环境间的物质交换。酒酒球菌是革兰氏阳性细菌,没有完整的细胞结构,直接由细胞膜包被,所以细胞膜是其抵御不良环境的第一道屏障。酒酒球菌主要通过调节细胞膜的流动性和组成成分来阻隔外界胁迫环境中的氢离子。
pH作为影响微生物生长的重要因素之一,也是影响MLF顺利进行的重要因素。在较高pH处理(pH 3.2)酸胁迫瞬时处理后,细胞膜轴向流动性发生微弱的增大,随着培养时间的延长,细胞膜流动性会逐渐恢复[6]。较低pH处理(pH 3.0)后,会引发细胞膜轴向扩散速率降低,随着pH的降低这种影响越显著,当细胞培养环境pH恢复正常时,这种状态不会恢复,这说明酸胁迫对细胞膜的影响是不可逆的[7-8]。
细胞质膜脂肪酸组成的修饰是微生物对逆境最重要的适应性反应之一,其中细菌的反应包括饱和度、碳链长度、分支位置、顺式/反式异构化,以及不饱和脂肪酸转化为环状脂肪酸等[9]。pH 3.5和pH 3.2处理对细胞生物量的影响不大,但可以明显提高细胞的接种活力和冷冻干燥活力,随着pH的降低,不饱和脂肪酸(C18∶1)转化为环状脂肪酸(C19cyc11),短时间酸胁迫处理会显著降低不饱和脂肪酸与饱和脂肪酸比值,但长时间的酸胁迫培养会增加细胞膜脂中不饱和脂肪酸与饱和脂肪酸的比值,这说明细胞在应对短时间与长时间酸胁迫处理时会采用不同的应对策略,短时间通过降低细胞膜流动性阻止胞外氢离子对细胞的侵害,随着酸胁迫处理时间的延长,细胞通过调整胞内生化反应状态,逐渐适应低pH侵害,细胞膜流动性恢复,加速胞内外物质交换[10-11]。
近期有研究表明,在胁迫环境中,酒酒球菌的细胞壁合成相关的基因的表达和蛋白含量也有显著的变化,说明细胞壁可能同样具有阻碍环境胁迫的屏障作用[12]。
1.2 排出氢离子
通常微生物调控胞内pH的方式有:(1)转运质子的ATP酶;(2)胞内生成碱;(3)消耗胞内质子等[13-14]。其中,H+-ATP酶在维持胞内pH稳定方面起着最为重要的作用,它通过消耗ATP将胞内的H+泵出胞外。H+-ATP酶是酒酒球菌胁迫适应性机制研究的一个重要方面。研究发现,ATP酶的缺失会导致苹果酸-乳酸操纵子也不发生转录,使细胞无法进行MLF[15],且在低pH条件下,H+-ATP酶活性会显著提高[16],在酸胁迫处理1 h时,H+-ATP酶活性显著低于对照组,在胁迫处理3 h后,酸胁迫处理组H+-ATP酶活性与对照组无显著差异,说明在酸胁迫处理较短时间内,H+-ATP酶的活性可以恢复到正常水平[8],这一机制可以在短时间内通过消耗能量的方式将大量氢离子排出胞外,从而使细胞内pH稳定在较高水平,降低氢离子对细胞内酶与DNA等分子及生化反应的影响,维持细胞的正常功能,为细胞做出胁迫响应争取时间。
与生理数据报道相比,关于转运基因的报道要多一些。在O.oeni 的酸胁迫转录组研究中发现了121个与ABC转运体相关差异表达基因,说明ABC转运体发挥了重要作用[4]。ATP酶基因在酸胁迫处理1 h和3 h时均发生上调表达,但在模拟酒环境中,该基因呈现先下降后上升的趋势,在长时间模拟酒环境下,随着苹果酸的消耗,ATP酶基因表达逐渐被激活[12]。
1.3 中和氢离子
另一种抵抗酸胁迫的方法是细胞质碱化。在酒酒球菌中消耗氢离子的代谢途径主要有氨基酸合成和代谢、苹果酸乳酸发酵、柠檬酸代谢等途径。苹果酸乳酸发酵是酒酒球菌维持细胞内外pH稳定的重要途径,苹果酸乳酸发酵主要由苹果酸渗透酶和苹果酸乳酸酶完成,苹果酸渗透酶负责将胞外的苹果酸转运进入细胞,二元羧酸苹果酸在苹果酸乳酸酶的催化作用下转换成一元酸乳酸,这一过程可以降低胞外氢离子含量。在酸胁迫耐受酒酒球菌突变菌株中,发现在酸胁迫培养条件下,苹果酸乳酸酶基因发生突变且呈现出高表达趋势,说明该基因在酒酒球菌胁迫耐受性中的重要作用[17]。与培养条件下不同的是,酸胁迫瞬时处理时,苹果酸乳酸酶基因发生下调,而苹果酸脱氢酶基因显著上调,使苹果酸更多的转化为丙酮酸进入三羧酸循环(tricarboxylic acid cycle,TCA),产生能量,而不是乳酸[8]。这与模拟酒和葡萄酒环境下(酸和乙醇胁迫同时存在)酒酒球菌的表现类似,在模拟酒瞬时胁迫处理8 h过程中,苹果酸渗透酶和苹果酸脱氢酶基因均上调表达[12],葡萄酒环境中,酒酒球菌也上调了苹果酸渗透酶和苹果酸脱氢酶基因表达量[18]。
柠檬酸裂解酶是柠檬酸代谢的关键酶,在柠檬酸裂解酶的催化作用下,柠檬酸裂解形成草酰乙酸、乙酰辅酶A和磷酸盐,并产生ADP。柠檬酸代谢会诱导香气挥发物的产生,如双乙酰和乙氨酸。酸胁迫处理几乎不影响柠檬酸裂解酶基因的表达量,而在乙醇胁迫、模拟酒和葡萄酒环境下,柠檬酸裂解酶基因会大幅度上调表达[4, 12, 19],说明柠檬酸途径基因的表达主要受乙醇的影响,pH的影响较小[20]。
氨基酸作为葡萄酒风味成分的重要前体,其合成代谢不仅对葡萄酒香气改善,而且对细胞生长繁殖具有重要作用。在酸胁迫(pH 3.0)处理1 h和3 h时,与精氨酸、亮氨酸、异亮氨酸、蛋氨酸、半胱氨酸、丝氨酸、赖氨酸生物合成关键酶均保持较高表达水平,精氨酸代谢途径的3个关键酶(精氨酸脱亚胺酶、鸟氨酸转氨甲酰化酶和氨基甲酸激酶)保持正常表达水平,缬氨酸、亮氨酸和异亮氨酸的降解途径的关键酶上调表达,这些过程上调表达可以代谢产生ATP,供细胞利用[8, 14, 17]。
1.4 修复DNA和蛋白质损伤
酸胁迫对细胞带来的损伤很大程度上是通过破坏或影响DNA和蛋白质活性产生的,细菌常见应对DNA和蛋白质损伤的机制是错配修复和伴侣蛋白的合成。在酒酒球菌中已经发现19个与基因错配修复相关的基因(表1),这些基因在酸胁迫瞬时处理条件下,大部分未表现出差异表达,少数基因发生下调表达[8],这些基因的正常表达可以降低在基因复制过程中出现碱基突变的概率。除了错配修复机制外,分子伴侣蛋白可以促进胁迫环境下微生物蛋白质的正确合成,降低发生错误的几率,从而增强微生物胁迫耐受性[21]。在酸胁迫瞬时处理条件下,O.oeni SD-2a大部分分子伴侣蛋白基因都在1 h时呈现出上调表达,且在3 h时这些基因的表达量均显著增加,说明分子伴侣蛋白在应对酸胁迫瞬时处理时持续发挥着关键作用,且hsp20和groES 在O.oeni SD-2a酸胁迫应答反应中的响应时间要早于其他分子伴侣蛋白(表2)。
表1 与酒酒球菌DNA损伤修复相关的基因
Table 1 Genes associated with DNA damage repair in O. oeni

基因名称基因描述uvrA ABC-ATP酶UvrAuvrB ABC切补核酸酶亚基BuvrC ABC切补核酸酶亚基CuvrD, pcrA依赖ATP的DNA解旋酶ligA, ligBDNA连接酶(NAD(+)) LigADPO1, polA依赖DNA的DNA聚合酶Imfd转录修复偶联因子lexA阻遏蛋白LexArecADNA重组/修复蛋白RecArecG依赖ATP的DNA解旋酶RecGrecFDNA重组蛋白RecFrecR重组蛋白RecRrecODNA修复蛋白RecOrecNDNA修复蛋白RecNradA, smsDNA修复蛋白RadAmutS2DNA错配修复蛋白MutSrecJ单链DNA核酸外切酶RecJDPO3E, dnaQ核酸外切酶ssb单链DNA结合蛋白质
表2 酒酒球菌中分子伴侣蛋白基因
Table 2 Genes encoded molecular chaperones in O. oeni
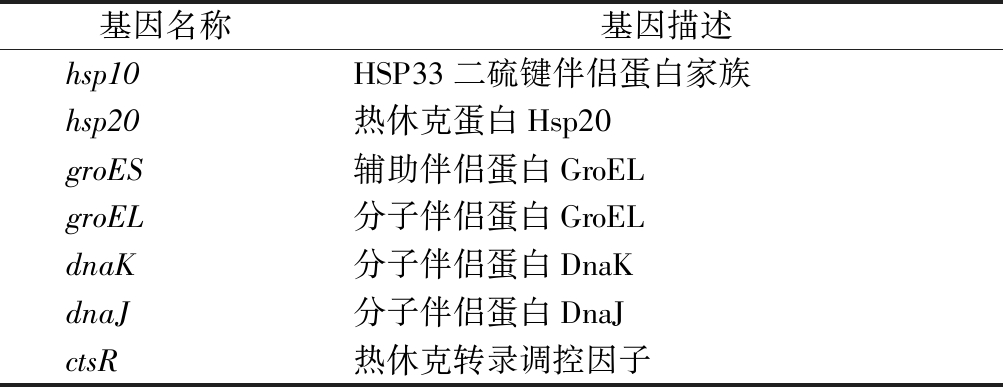
基因名称基因描述hsp10HSP33二硫键伴侣蛋白家族hsp20热休克蛋白Hsp20groES辅助伴侣蛋白GroELgroEL分子伴侣蛋白GroELdnaK分子伴侣蛋白DnaKdnaJ分子伴侣蛋白DnaJctsR热休克转录调控因子
1.5 能量产生
在苹果酸乳酸发酵过程中,酒酒球菌除了要抵御胁迫造成的损伤,还要从营养匮乏的葡萄酒生境中获得能量。由于营养物质匮乏,酒酒球菌难以直接利用碳源产生能量,其获得能量来源主要依靠细胞跨膜pH梯度(ΔpH)和电位差Δψ这两种质子推动力,在质子推动力的作用下,细胞膜H+-ATP酶可以合成ATP[22]。细胞跨膜pH梯度在苹果酸乳酸发酵早期增大,随着苹果酸的消耗,逐渐降低直至内外电位平衡,细胞内pH逐渐降低至等于培养基pH值。这说明ΔpH越大,O.oeni 的苹果酸乳酸发酵过程越短[22]。
此外,苹果酸和柠檬酸代谢也与质子的消耗、跨膜电位和跨膜pH梯度的形成有关,因此可以促进胞内和胞外ATP的合成[20]。在酸胁迫瞬时处理过程中,ATP酶的4个亚基(α、β、γ和ε)基因均呈现上调表达,而糖酵解和TCA循环的关键基因均未出现差异表达,说明在酸胁迫条件下,酒酒球菌可以快速启动苹果酸乳酸发酵,其主要能量来源于跨膜质子推动力[4]。在模拟酒环境中,ATP酶基因亚基均呈现出下调表达,直至苹果酸乳酸发酵开始才有所回升,说明在酸和乙醇胁迫同时存在的情况下,苹果酸乳酸发酵的启动时间会延迟[12]。
2 提高酒酒球菌抗胁迫能力的方法
2.1 预适应和交叉保护
预适应是将菌株暴露到致命或亚致死剂量的胁迫条件下一定时间,它可以强化菌株再次暴露于胁迫条件下的适应与恢复能力。有研究表明,低强度的胁迫预适应可以提高酒酒球菌在复合胁迫条件下的耐受性,且酒酒球菌存在着胁迫交叉保护现象,经酸胁迫预培养的菌体细胞接种到葡萄酒后,可以增强对其他胁迫的耐受性[23]。酸性条件下预培养可以提高酒酒球菌在高浓度SO2存在条件下或冷冻干燥后细胞的恢复与存活能力,且对SO2的胁迫应答会启动pH内外稳定及胁迫应答蛋白合成等机制,以此消除胁迫带来的影响[24-25]。除了酸胁迫预培养外,培养时加入低浓度乙醇(体积分数为10%)可以显著提高细胞冷冻干燥后的存活率[26]。此外,在胁迫预培养阶段添加谷胱甘肽,可以显著提高细胞在模拟酒环境(乙醇体积分数12%,pH 3.4)下的生存能力,并且MLF速率比未添加谷胱甘肽预培养的菌株高[27]。
2.2 外源添加物
已有报道表明,通过外源添加一些物质,提高乳酸菌的抗胁迫能力。其中还原型谷胱甘肽(Reduced glutathione, GSH)可以促进O.oeni SD-2a在酸胁迫(pH 3.4)和乙醇胁迫(乙醇体积分数12%)环境中的生长能力,且不同的添加浓度可以刺激不同胁迫应答相关基因的表达, 显著提高苹果酸乳酸发酵速率[27]。MARGALEF-CATAL 等[28] 也有相似的发现,在培养时加入谷胱甘肽可以增加细胞膜环丙烷脂肪酸含量,从而提高酒酒球菌在高乙醇(体积分数为14%)和其他条件下(pH 4、pH 3.4和体积分数为6%的乙醇)的生存能力和生长速度。此外,在研究乳酸菌胁迫应答过程中,发现添加一些外源氨基酸可以提高乳酸菌酸胁迫耐受性,例如添加亮氨酸可以显著提高菌体酸胁迫后的存活率[29],显著提高了其酸胁迫耐受性。此外,也有添加谷氨酸、精氨酸、赖氨酸和瓜氨酸提高细菌酸胁迫耐受性的报道[30-32]。
等[28] 也有相似的发现,在培养时加入谷胱甘肽可以增加细胞膜环丙烷脂肪酸含量,从而提高酒酒球菌在高乙醇(体积分数为14%)和其他条件下(pH 4、pH 3.4和体积分数为6%的乙醇)的生存能力和生长速度。此外,在研究乳酸菌胁迫应答过程中,发现添加一些外源氨基酸可以提高乳酸菌酸胁迫耐受性,例如添加亮氨酸可以显著提高菌体酸胁迫后的存活率[29],显著提高了其酸胁迫耐受性。此外,也有添加谷氨酸、精氨酸、赖氨酸和瓜氨酸提高细菌酸胁迫耐受性的报道[30-32]。
2.3 菌种改良
菌种改良的方法主要分为基因重组法和非基因重组法2种,各有优缺点。基因重组技术通常具有较高的精度,通常侧重于特定基因的添加或删除,它的应用需要对菌株的遗传背景与基因功能有清楚的认识。相比之下,非基因重组方法通常不需要事先了解某一性状的遗传基础,但它的突变一般是随机发生的,需要花费大量时间进行特定性状突变株的筛选[33]。目前,已有成功在酒酒球菌中进行转化实验的报道[34-35],但由于转化率较低,这些实验尚未在其他实验室完成重现。加之,政府及消费者对转基因微生物直接应用于食品生产的限制,因此,酒酒球菌生产菌株改良主要采用非基因重组方法。
非基因重组方法,包括诱变、传统菌株筛选法和定向进化等方法,这些方法不需要特定的遗传知识,但需要经过繁琐的筛选过程来选择最佳突变菌株。紫外诱变技术已成功应用于葡萄酒酿造菌株筛选中,且从经过紫外照射处理的菌株中筛选出了苹果酸乳酸发酵优良菌株[36]。尽管诱变操作容易实现,但其缺点是突变位点的随机性,目标表型出现突变的概率较低。传统菌株筛选法一般是从与葡萄酒生产相关环境中(葡萄表皮、葡萄汁、自然发酵葡萄酒等)分离和筛选酒酒球菌。许多具有应用前景的酒酒球菌菌株都是来自于传统菌株筛选法[37-38]。定向进化可以直接利用胁迫条件下大量传代培养,利用微生物自发有益突变在胁迫条件下的逐渐积累,获得所需表型的优良突变菌株,但是,这一过程一般耗时较长。BETTERIDGE等[39]对酒酒球菌进行了乙醇胁迫下的定向进化研究,试验获得的突变菌株A90在20%(体积分数)的酒精存在情况,其存活数量比对照菌株提高了3个数量级。JIANG等[40]以A90为出发菌株,进行了酒精、二氧化硫和酸多重胁迫因素的定向进化实验,经过350代的筛选,获得了3株在极端模拟酒条件下发酵性能显著提升的突变菌株。
3 展望
葡萄酒是由多种物理、化学胁迫因子组成的液体环境,这些胁迫因素的存在,常常造成苹果酸乳酸发酵启动的延迟甚至是失败,因此越来越多的研究者将目光转向酒酒球菌胁迫应答机制研究中,以期寻找高效方案解决苹果酸乳酸发酵启动稳定性的问题。随着测序技术及质谱技术的发展,研究者利用基因组学、转录组学、蛋白质组学及代谢组学等技术,初步解析了酒酒球菌胁迫应答机制,但目前研究主要集中在酒酒球菌乙醇胁迫应答机制中,少有对酸、冷冻干燥、二氧化硫等胁迫因素的应答机制系统性的研究,需要进一步拓展。
本文通过总结已报道酒酒球菌酸胁迫应答研究,绘制酒酒球菌酸胁迫应答机制示意图(图1),酒酒球菌细胞暴露在酸胁迫环境中时,细胞通过改变细胞膜脂肪酸组分、降低细胞膜流动性和细胞膜损伤修复等阻隔氢离子向细胞内部流动,H+-ATP酶等氢离子转运蛋白将流向胞内的氢离子转运出细胞,苹果酸、柠檬酸、氨基酸代谢等过程消耗胞内氢离子,产生ATP,ATP酶借助细胞跨膜pH梯度(ΔpH)和电位差Δψ产生能量,受损伤的DNA和蛋白质在错配修复基因和伴侣蛋白作用下保持正常的复制过程与催化活性。

图1 酒酒球菌酸胁迫应答机制示意图
Fig.1 The schematic diagram of acid stress response mechanism in Oenococcus oeni
虽然酒酒球菌酸胁迫应答机制已经取得一定的研究进展,但仍然缺乏系统性,多数研究者侧重于利用组学技术发掘差异表达基因,但这些基因在其酸胁迫应答机制中的具体作用,酒酒球菌在酸胁迫条件下连续的生理、生化变化,酒酒球菌酸胁迫反应的启动顺序等方面,仍需要研究者进行系统性的研究。通过解析酒酒球菌酸胁迫应答机制,可以促进苹果酸乳酸发酵启动的稳定性,促进苹果酸乳酸发酵菌剂的国产化与规模化,有利于我国葡萄酒产业的健康与可持续发展。
[1] MATSUMOTO S, BRENIAUX M, CLAISSE O, et al.The production of preconditioned freeze-dried Oenococcus oeni primes its metabolism to withstand environmental stresses encountered upon inoculation into wine[J].International Journal of Food Microbiology, 2022,369:109617.
[2] BALMASEDA A, ROZ S N, BORDONS A, et al.Molecular adaptation response of Oenococcus oeni in non-Saccharomyces fermented wines:A comparative multi-omics approach[J].International Journal of Food Microbiology, 2022, 362:109490.
S N, BORDONS A, et al.Molecular adaptation response of Oenococcus oeni in non-Saccharomyces fermented wines:A comparative multi-omics approach[J].International Journal of Food Microbiology, 2022, 362:109490.
[3] LORENTZEN M P G,LUCAS P M.Distribution of Oenococcus oeni populations in natural habitats[J].Applied Microbiology and Biotechnology, 2019, 103(7):2 937-2 945.
[4] LIU L X, ZHAO H Y, PENG S, et al.Transcriptomic analysis of Oenococcus oeni SD-2a response to acid shock by RNA-seq[J].Frontiers in Microbiology, 2017, 8:1586.
[5] DARSONVAL M, MSADEK T, ALEXANDRE H, et al.The antisense RNA approach:A New application for in vivo investigation of the stress response of Oenococcus oeni, a wine-associated lactic acid bacterium[J].Applied and Environmental Microbiology, 2015, 82(1):18-26.
[6] TOURDOT-MARÉCHAL R, GABORIAU D, BENEY L, et al. Membrane fluidity of stressed cells of Oenococcus oeni[J].International Journal of Food Microbiology, 2000, 55(1-3):269-273.
[7] CHU-KY S, TOURDOT-MARECHAL R, MARECHAL P A, et al. Combined cold, acid, ethanol shocks in Oenococcus oeni:Effects on membrane fluidity and cell viability[J].Biochimica et Biophysica Acta (BBA) -Biomembranes, 2005, 1 717(2):118-124.
[8] 刘龙祥, 彭帅, 赵红玉, 等.基于RNA-seq分析酒酒球菌SD-2a酸胁迫应答机制[J].食品科学, 2022, 43(12):153-162.
LIU L X, PENG S, ZHAO H Y, et al.Acid stress response mechanism in Oenococcus oeni SD-2a analyzed by RNA sequencing[J].Food Science, 2022, 43(12):153-162.
[9] TO T M H, GRANDVALET C, ALEXANDRE H, et al.Cyclopropane fatty acid synthase from Oenococcus oeni:Expression in Lactococcus lactis subsp.cremoris and biochemical characterization[J].Archives of Microbiology, 2015, 197(9):1 063-1 074.
[10] ZHAO W Y, LI H, WANG H, et al.The effect of acid stress treatment on viability and membrane fatty acid composition of Oenococcus oeni SD-2 [J].Agricultural Sciences in China, 2009, 8(3):311-316.
[11] ZHANG G Q, FAN M T, LYU Q, et al.The effect of cold, acid and ethanol shocks on synthesis of membrane fatty acid, freeze-drying survival and malolactic activity of Oenococcus oeni[J].Annals of Microbiology, 2013, 63(2):477-485.
[12] MARGALEF-CATAL M, ARAQUE I, BORDONS A, et al.Transcriptomic and proteomic analysis of Oenococcus oeni adaptation to wine stress conditions[J].Frontiers in Microbiology, 2016, 7:1554.
M, ARAQUE I, BORDONS A, et al.Transcriptomic and proteomic analysis of Oenococcus oeni adaptation to wine stress conditions[J].Frontiers in Microbiology, 2016, 7:1554.
[13] COTTER P D, HILL C.Surviving the acid test:Responses of grampositive bacteria to low pH[J].Microbiology and Molecular Biology Reviews:MMBR, 2003, 67(3):429-453.
[14] QI Y M, WANG H, CHEN X D, et al.Altered metabolic strategies:Elaborate mechanisms adopted by Oenococcus oeni in response to acid stress[J].Journal of Agricultural and Food Chemistry, 2021, 69(9):2 906-2 918.
[15] TOURDOT-MARÉCHAL R, FORTIER L C, GUZZO J, et al.Acid sensitivity of neomycin-resistant mutants of Oenococcus oeni:A relationship between reduction of ATPase activity and lack of malolactic activity[J].FEMS Microbiology Letters, 1999, 178(2):319-326.
[16] FORTIER L C, TOURDOT-MARÉCHAL R, DIVI S C, et al.Induction of Oenococcus oeni H+-ATPase activity and mRNA transcription under acidic conditions[J].FEMS Microbiology Letters, 2003, 222(2):165-169.
S C, et al.Induction of Oenococcus oeni H+-ATPase activity and mRNA transcription under acidic conditions[J].FEMS Microbiology Letters, 2003, 222(2):165-169.
[17] CHEN Q L, YANG X K, MENG Q, et al.Integrative multiomics analysis of the acid stress response of Oenococcus oeni mutants at different growth stages[J].Food Microbiology, 2022, 102:103905.
[18] STERNES P R, COSTELLO P J, CHAMBERS P J, et al.Whole transcriptome RNAseq analysis of Oenococcus oeni reveals distinct intra-specific expression patterns during malolactic fermentation, including genes involved in diacetyl metabolism[J].International Journal of Food Microbiology, 2017, 257:216-224.
[19] OLGU N N, CHAMPOMIER-VERG
N N, CHAMPOMIER-VERG S M, ANGLADE P, et al.Tran-scriptomic and proteomic analysis of Oenococcus oeni PSU-1 response to ethanol shock[J].Food Microbiology, 2015, 51:87-95.
S M, ANGLADE P, et al.Tran-scriptomic and proteomic analysis of Oenococcus oeni PSU-1 response to ethanol shock[J].Food Microbiology, 2015, 51:87-95.
[20] OLGU N N, BORDONS A, REGUANT C.Influence of ethanol and pH on the gene expression of the citrate pathway in Oenococcus oeni [J].Food Microbiology, 2009, 26(2):197-203.
N N, BORDONS A, REGUANT C.Influence of ethanol and pH on the gene expression of the citrate pathway in Oenococcus oeni [J].Food Microbiology, 2009, 26(2):197-203.
[21] BR GIDO C, ALEXANDRE A, OLIVEIRA S.Transcriptional analysis of major chaperone genes in salt-tolerant and salt-sensitive mesorhizobia[J].Microbiological Research, 2012, 167(10):623-629.
GIDO C, ALEXANDRE A, OLIVEIRA S.Transcriptional analysis of major chaperone genes in salt-tolerant and salt-sensitive mesorhizobia[J].Microbiological Research, 2012, 167(10):623-629.
[22] BOUIX M, GHORBAL S.Rapid assessment of Oenococcus oeni activity by measuring intracellular pH and membrane potential by flow cytometry, and its application to the more effective control of malolactic fermentation[J].International Journal of Food Microbiology, 2015, 193:139-146.
[23] JIN G, WANG H, ZHANG C H, et al.Characterization and amino acid metabolism performances of indigenous Oenococcus oeni isolated from Chinese wines[J].European Food Research and Technology, 2014, 238(4):597-605.
[24] GUZZO J, JOBIN M P, DIVI S C.Increase of sulfite tolerance in Oenococcus oeni by means of acidic adaptation[J].FEMS Microbiology Letters, 1998, 160(1):43-47.
S C.Increase of sulfite tolerance in Oenococcus oeni by means of acidic adaptation[J].FEMS Microbiology Letters, 1998, 160(1):43-47.
[25] YANG K, DAI X J, FAN M T, et al.Influences of acid and ethanol stresses on Oenococcus oeni SD-2a and its proteomic and transcriptional responses[J].Journal of the Science of Food and Agriculture, 2021, 101(7):2 892-2 900.
[26] 赵文英, 李华, 王华.乙醇胁迫处理对酒酒球菌SD-2a生理特性的影响[J].微生物学通报, 2011,38(1):51-56.
ZHAO W Y, LI H, WANG H.The effects of alcohol stress treatment on physiological properties of Oenococcus oeni SD-2a[J].Microbiology China, 2011, 38(1):51-56.
[27] MARGALEF-CATAL M, ARAQUE I, BORDONS A, et al.Genetic and transcriptional study of glutathione metabolism in Oeno- coccus oeni[J].International Journal of Food Microbiology, 2017, 242:61-69.
M, ARAQUE I, BORDONS A, et al.Genetic and transcriptional study of glutathione metabolism in Oeno- coccus oeni[J].International Journal of Food Microbiology, 2017, 242:61-69.
[28] MARGALEF-CATAL M, ARAQUE I, WEIDMANN S, et al.Protective role of glutathione addition against wine-related stress in Oenococcus oeni[J].Food Research International, 2016, 90:8-15.
M, ARAQUE I, WEIDMANN S, et al.Protective role of glutathione addition against wine-related stress in Oenococcus oeni[J].Food Research International, 2016, 90:8-15.
[29] 张梦汝, 张娟, 堵国成, 等.外源添加亮氨酸提高乳酸乳球菌酸胁迫抗性[J].食品与生物技术学报, 2015, 34(2):134-139.
ZHANG M R, ZHANG J, DU G C, et al.Exogenous leucine improved the acid tolerance of Lactococcus lactis under acid stress[J].Journal of Food Science and Biotechnology, 2015, 34(2):134-139.
[30] BOURDINEAUD J P.Both arginine and fructose stimulate pH-independent resistance in the wine bacteria Oenococcus oeni.[J].International Journal of Food Microbiology, 2006, 107(3):274-280.
[31] SENOUCI-REZKALLAH K, SCHMITT P, JOBIN M P.Amino acids improve acid tolerance and internal pH maintenance in Bacillus cereus ATCC14579 strain[J].Food Microbiology, 2011, 28(3):364-372.
[32] CUSUMANO Z T, CAPARON M G.Citrulline protects Streptococcus pyogenes from acid stress using the arginine deiminase pathway and the F1Fo-ATPase.[J].Journal of Bacteriology, 2015, 197(7):1 288-1 296.
[33] BETTERIDGE A, GRBIN P, JIRANEK V.Improving Oenococcus oeni to overcome challenges of wine malolactic fermentation[J].Trends in Biotechnology, 2015, 33(9):547-553.
[34] DARSONVAL M, ALEXANDRE H, GRANDVALET C.Genetically engineered Oenococcus oeni strains to highlight the impact of estA2 and estA7 esterase genes on wine ester profile[J].Food Microbiology, 2016, 60:21-28.
[35] DARSONVAL M, JULLIAT F, MSADEK T, et al.CtsR, the master regulator of stress-response in Oenococcus oeni, is a heat sensor interacting with ClpL1[J].Frontiers in Microbiology, 2018, 9:3135.
[36] LI N, DUAN J T, GAO D W, et al.Mutation and selection of Oenococcus oeni for controlling wine malolactic fermentation[J].European Food Research and Technology, 2015, 240(1):93-100.
[37] CAPOZZI V, RUSSO P, BENEDUCE L, et al.Technological properties of Oenococcus oeni strains isolated from typical southern Italian wines[J].Letters in Applied Microbiology, 2010, 50(3):327-334.
[38] LI H, ZHANG C H, LIU Y L.Species attribution and distinguishing strains of Oenococcus oeni isolated from Chinese wines[J].World Journal of Microbiology and Biotechnology, 2006, 22(5):515-518.
[39] BETTERIDGE A L, SUMBY K M, SUNDSTROM J F, et al.Application of directed evolution to develop ethanol tolerant Oenococcus oeni for more efficient malolactic fermentation[J].Applied Microbiology and Biotechnology, 2018, 102(2):921-932.
[40] JIANG J, SUMBY K M, SUNDSTROM J F, et al.Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment[J].Food Microbiology, 2018, 73:150-159.