糖尿病(diabetes mellitus,DM)是临床常见病、多发病,现已逐步成为世界范围内最主要的慢性非传染性疾病之一,发病率逐年上升。据国际糖尿病联盟统计[1],2019年在全球4.63亿患者中,中国糖尿病患者数排名第一,总人数约为1.164亿人,占比全球25%,糖尿病是中国第一大慢性病。糖尿病以高血糖和碳水化合物、蛋白质、脂肪代谢紊乱为特征[2]。持续性高血糖常导致并发症,影响患者的视觉、神经、肾脏等系统[3]。糖尿病心脑血管病变、糖尿病神经病变、糖尿病足、糖尿病肾病、糖尿病眼病,是糖尿病五大并发症,对生活质量有极大影响。
现在临床应用上具有抗糖尿病作用的降糖药有多种,但由于商品化药物成本高,且观察到大量的药物相互作用和不良反应[4],而传统草药可能对糖尿病有多种疗效[5],耐受性更强,副作用更少,因此越来越需要从天然植物中寻找更天然的治疗剂,所以治疗糖尿病及其并发症的药用植物的研究倍受关注。
异荭草素属于黄酮类化合物,广泛存在于多种植物中,具有多种生理功能。现有研究表明,异荭草素可以通过调节血糖的生理水平,缓解胰岛素抵抗,保护机体免受氧化应激的作用,减少脂质积累,促进线粒体生物发生,进而改善一型和二型糖尿病,而且可以改善一部分糖尿病并发症。本文系统地综述异荭草素调控糖尿病的作用及分子机制,并谈及异荭草素调控糖尿病并发症的相关结果,以期为异荭草素治疗糖尿病及其并发症的进一步研究及应用提供一定的参考。
1 异荭草素的介绍
异荭草素(isoorientin, ISO),3′,4′,5,7-四羟基- 6-吡喃葡萄糖基黄酮,又称木犀草素-6-C-葡萄糖苷,分子式为C21H20O11,分子质量为448.38,分子结构见图1。异荭草素广泛存在于藜麦[6]、小麦[7]、荞麦芽[8]、莲子[9]、西番莲[10]、玉米丝[11]、荆条叶[12]、葫芦巴籽[13]、葛根[14]等多种植物的药用或食用部位。
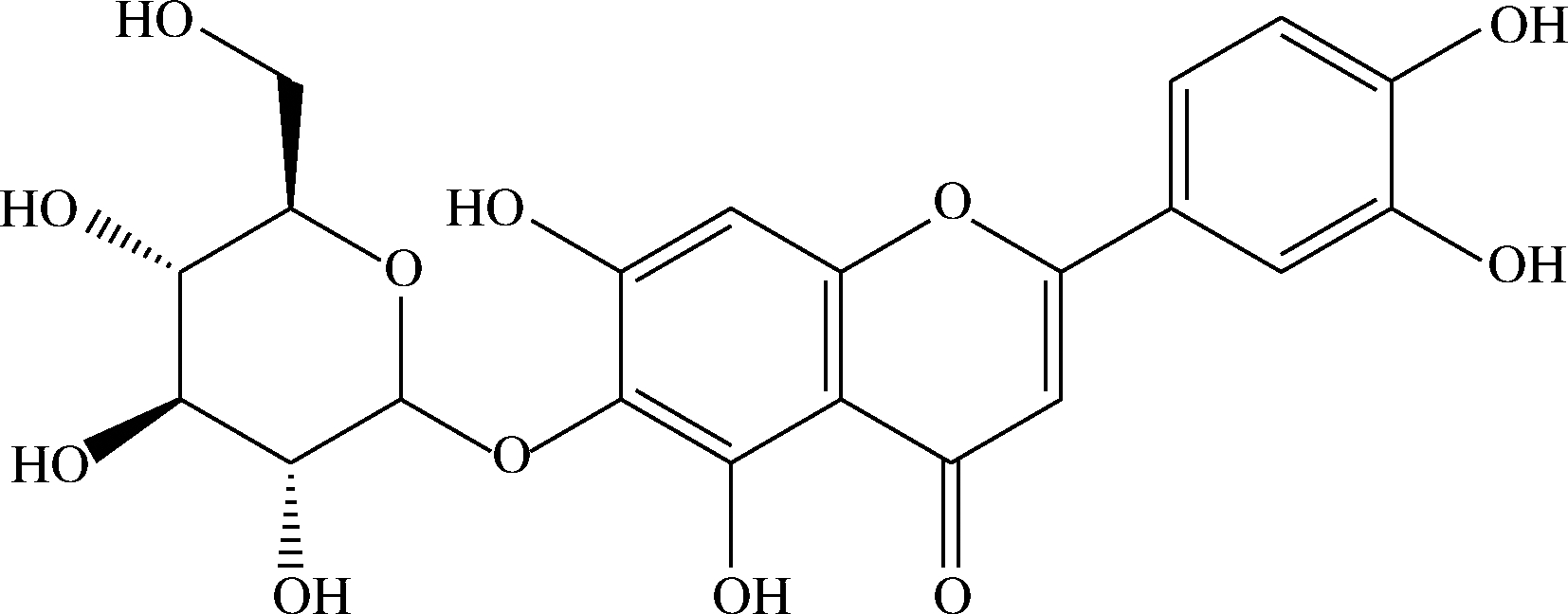
图1 异荭草素
Fig.1 Isoorientin
异荭草素是一种天然的黄酮类物质,属于木犀草素C-糖苷类化合物[15]。研究表明,黄酮类C-糖苷比黄酮类O-糖苷更稳定,且具有更高的抗炎、抗氧化和抗糖尿病能力[16-17],异荭草素作为其典型C-糖苷类黄酮化合物,根据其化学结构预测异荭草素具有较好的抗炎、抗氧化及抗糖尿病活性。
近年来的研究成果表明,异荭草素具有抗肿瘤[18-19]、抑制炎性疾病[20]、抗病毒[21]、改善糖尿病[22]和神经保护潜力[23]等药理效果。从分子机制的研究可以看出,异荭草素的抗炎功能为其通过抗氧化、降低炎症因子表达而改善糖尿病提供理论依据,并且异荭草素改善糖尿病及保护神经的作用为其调控糖尿病神经病变这一并发症提供理论依据。
2 异荭草素调控糖尿病的作用机制
2.1 异荭草素通过调控血糖紊乱改善糖尿病
现有研究结果从血糖及相关生理指标的调控、糖耐量及急性降糖效果等方面验证了以异荭草素为主要成分的提取物具有降血糖的效果。XU等[24]研究发现木棉叶标准乙醇提取物(主要成分为异荭草素)能显著降低二型糖尿病(diabetes mellitus type 2,T2DM)模型大鼠的空腹血糖、糖化血红蛋白、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、血清胰岛素和丙二醛(malondialdehyde,MDA)浓度,提高口服葡萄糖耐量、高密度脂蛋白胆固醇和超氧化物歧化酶水平。ANDRADE-CETTO等[25]对Cecropia pachystachya提取物(主要成分为异荭草素)的降糖作用进行了不同时长的研究,发现其对四氧嘧啶诱导的一型糖尿病大鼠有明显的降糖作用,12 h后血糖下降68%。在糖尿病大鼠中,给予该提取物也能显著降低血糖水平,急性降糖效果为90 min时更为明显(降幅为60%)。120 min后,该提取物与标准药物(二甲双胍和格列本脲)组大鼠的血药浓度无明显差异。
这些实验大部分都是以混合提取物为研究对象,只有少部分研究异荭草素单体。SEZIK等[26]从龙胆中提取分离纯化出异荭草素,发现其降糖、降脂作用似乎不呈剂量依赖性,15 mg/kg剂量时作用最强,较高剂量时作用减弱。第15天末次给药后,停止给药,并在动物舍内继续以普通大鼠饲料和自由饮水维持10 d,第25天进行血糖、胆固醇和甘油三酯浓度的最终测定,发现显著效果持续存在。LUAN等[13]发现异荭草素可以通过促进蛋白激酶B(protein kinase B,AKT)和腺苷酸激活蛋白激酶[adenosine 5′-monophosphate(AMP)-activated protein kinase,AMPK]磷酸化,促进代谢,恢复胰岛素抵抗的脂肪细胞对葡萄糖的摄取。ALONSO-CASTRO等[27]发现在胰岛素敏感细胞中,异荭草素诱导免疫应答(immune response, IR)、胰岛素受体底物1(insulin receptor substrate1,IRS1)、胰岛素受体底物2(insulin receptor substrate2,IRS2)和磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase,PI3K)基因的表达高于胰岛素,且促进了IR、PI3K和AKT的磷酸化。并通过胰岛素信号通路抑制剂作用于异荭草素诱导的3T3-F442A细胞和人脂肪细胞,发现4种胰岛素信号通路抑制剂HNMPA-(AM)3(用于IR),Wortmannin(用于PI3 K),AKT抑制剂VIII(用于AKT1/2),Indinavir(用于GLUT4)都抑制了细胞的葡萄糖转运,证明异荭草素可以通过调控胰岛素信号通路调控糖尿病。
虽然已有少数实验证明异荭草素单体对高血糖有调控效果,但研究结果仅限于特征生理指标的变化,相对于混合物在糖化血红蛋白、血清胰岛素和MDA浓度等生理指标的测定及急性降糖方面研究较少,在生理指标测定及急性降糖方面仍需进行进一步的探究。此外,通过体内动物实验,证明异荭草素可调控血糖紊乱来改善糖尿病,但它主要把生理指标作为测定指标,仍缺少分子机制层面的探究。体外细胞实验证明异荭草素通过激活AKT和AMPK的磷酸化,进而恢复机体对葡萄糖的摄取和转运。但是异荭草素调控葡萄糖的机理摄取和转运的机理仍待研究,比如异荭草素调控转运过程是否是通过调控蛋白激酶(protein kinase Cλ /ξ, PKCλ /ξ)的级联反应、分解代谢基因活化蛋白(catabolite gene activator protein,CAP)等来实现的。
2.2 异荭草素通过抑制糖异生作用改善糖尿病
有少量研究关于异荭草素调控糖异生。葡萄糖- 6-磷酸酶(glucose-6-phosphatase, G6 Pase)是一种水解葡萄糖-6-磷酸的酶,它会产生磷酸基团和游离葡萄糖。然后葡萄糖通过膜葡萄糖转运蛋白从细胞中输出。这种催化作用完成了糖异生和糖原分解的最后步骤,因此在血糖水平的动态平衡调节中起着关键作用,在禁食状态下尤其如此[28]。这种肝脏葡萄糖的输出是二型糖尿病患者空腹血糖浓度升高的主要决定因素。ANDRADE-CETTO等[29]以二型糖尿病大鼠为体内模型,以完整的大鼠肝微粒体为体外模型,从两方面探究Cecropia提取物(主要成分为异荭草素)对G6 Pase活性的影响,实验证明其对G6 Pase活性有明显的抑制作用,可以通过阻断肝脏的葡萄糖输出来改善血糖控制。KASANGANA等[30]发现异荭草素能促进AMPK磷酸化,进而降低G6 Pase活性,同时AMPK活化引起糖原合成酶激酶-3(glycogen syn- thase kinase-3,GSK-3)磷酸化,刺激糖原合成酶(gly- cogen synthase,GS)活性,抑制肝脏糖异生进而降低血糖。
糖异生是个复杂的过程,葡萄糖-6-磷酸酶只是调节糖异生的激素中的一种,除此之外糖异生的主要限速酶还有丙酮酸羧化酶(pyruvate carboxylase, PC)、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxykinase, PEPCK)、果糖二磷酸酶(fructose 1,6-bisphosphatase)。另外,在糖异生过程中,代谢物的调节对其也很重要,比如血浆中甘油、乳酸和氨基酸浓度。同时,乙酰辅酶A的浓度对糖异生也有影响,其决定了丙酮酸的代谢方向。
2.3 异荭草素通过调控氧化损伤改善糖尿病
异荭草素的抗氧化性使其可缓解胰岛素抵抗、减少脂质积累、影响某些酶的活力,进而改善糖尿病。LUAN等[13]研究发现异荭草素显著抑制脂肪细胞特异性基因过氧化物酶体增殖物激活型受体γ (peroxi- some proliferators-activated receptors-γ,PPARγ)、CCAAT/增强子结合蛋白α(CCAAT/enhancer binding proteins alpha, C/EBPα)、脂肪细胞脂结合蛋白(adi- pocyte lipid binding protein, AP2)、胆固醇调节元件结合蛋白-1c(sterol-regulatory element binding proteins,SREBP1c)和脂肪酸合成酶(fatty acid synthase, Fas)的转录,缓解胰岛素抵抗。过氧化物酶体增殖物激活型受体(peroxisome proliferators-activated receptors, PPARs)在炎症反应、细胞凋亡、胰岛素抵抗、糖脂代谢、肿瘤中起到重要的调节作用[31]。异荭草素通过下调脂肪因子和脂质代谢相关基因,如PPARγ、C/EBP 和Fas等,上调胰岛素诱导基因1和2(insulin induced gene,INSIG 1、2),减少脂肪细胞中脂滴的积聚[32]。其中PPARα /PPARγ /UCP1(UCP1为棕色脂肪产热蛋白1,uncoupling protein 1)的调控与AMPK磷酸化类似,PPARγ 在激活后,可以通过表达UCP1来调节脂肪褐变。而异荭草素可以促进脂肪细胞对葡萄糖的摄取,这与增加UCP1的表达和氧耗率有关[33]。
四氧嘧啶诱导的一型糖尿病通过降低血清中还原型谷胱甘肽(glutathione, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)和谷胱甘肽还原酶(glutathione reductase, GR)等抗氧化剂水平而引起氧化应激。MALIK等[34]研究发现在异荭草素治疗后,糖尿病大鼠的SOD活性得到了改善,CAT、GSH和GPX也得到了改善。并采用计算机模拟技术,将目标蛋白G蛋白偶联受体40(G Protein-Coupled Receptor 40, GPR40)、G6 Pase、棕色脂肪产热蛋白2(uncoupling protein 2, UCP2)、糖原磷酸化酶(glycogen phosphorylase, GP)、醛糖还原酶(aldose reductase, AR)和葡萄糖转运蛋白-4(glu- cose transporter 4, GLUT4)与异荭草素对接。对接结果表明,其与所有6种靶蛋白都有很强的活性,证明可以有效地抑制糖尿病蛋白的活性。
目前,已发现异荭草素可以提高抗氧化剂的水平,并借助生物信息的技术给予证明。但并没有探究异荭草素是如何调控各种抗氧化剂,接下来可以以此为切入点,探究异荭草素调控抗氧化剂的作用通路。另外,调节脂肪酸和胆固醇的合成除了与PPARs、SREBP、Fas 等有重要联系,还与上游刺激因子1(upstream stimulatoty factor1, USF1)和细胞核受体(liver X receptor, LXR)有着密不可分的关系,胰岛素信号转导可以通过激活USF1 和LXR 促进脂肪酸的合成。
2.4 异荭草素通过调控线粒体功能改善糖尿病
线粒体是一种双膜结合的细胞器,通常被认为是细胞的“动力单元”[35]。研究表明,线粒体在脂肪细胞的脂肪生成和脂解过程中都起着重要作用。在脂肪细胞中,线粒体产生超过95%的细胞ATP,是细胞代谢和其他一般细胞过程所必需的,而基质金属蛋白酶(matrixmetalloproteinase, MMP)是产生ATP的一个重要因素[36]。氧化磷酸化是细胞内活性氧(reactive oxygen species, ROS)的主要来源,在氧化磷酸化过程中,形成MMP。LUAN等[13]研究发现异荭草素可降低细胞内ROS水平,同时升高细胞内ATP水平和MMP水平。同时,耗氧速率与线粒体有着密切关系,AMPK的激活与线粒体能量学过程有关系。ZIQUBU等[37]证明异荭草素可以通过刺激ATP的产生和耗氧速率来增强线粒体的呼吸,这是与有效线粒体功能相关的一个重要过程。因此,异荭草素可以通过促进线粒体生物发生而影响糖脂代谢,但对于异荭草素在线粒体功能和调节机制中的作用研究偏少。
2.5 异荭草素通过抑制α-葡萄糖苷酶改善糖尿病
α-葡萄糖苷酶是治疗二型糖尿病的重要酶靶点。这种酶存在于小肠的刷状缘膜中,催化α-D-葡萄糖(游离单糖)中双糖的α-(1→ 4)-糖苷键的水解[38]。释放的单糖被肠道吸收,导致血液中的血糖和胰岛素水平增加[39]。因此,抑制α-葡萄糖苷酶可以降低碳水化合物的消化率,从而降低血液中的血糖水平,抑制餐后高血糖[40]。SHIBANO等[41]发现从鸭趾草中分离提取出的异荭草素等成分对大鼠肠道α-葡萄糖苷酶有抑制作用,证明异荭草素具有降糖的功效。BORGES[42]通过体外抑制酵母菌α-葡萄糖苷酶活性实验证明异荭草素对α-葡萄糖苷酶有抑制作用,并对所测试的黄酮类化合物进行了分子对接,以研究其与α-葡萄糖苷酶口袋的可能相互作用,对接研究表明,糖基和A或B环的相互作用主要是通过氢键实现的。
2.6 异荭草素通过抑制钠-葡萄糖共转运蛋白-2(sodium-dependent glucose transporters 2,SGLT2)改善糖尿病
长期使用多种药物控制糖尿病,会导致副作用,如体重增加和低血糖。治疗糖尿病患者需要新的、无风险的药物来治疗高血糖,其中新的靶点通过抑制小肠中的葡萄糖转运和减少肾脏对葡萄糖的重吸收来解决这些问题。SGLT2抑制剂能竞争性抑制肠道和肾脏的葡萄糖摄取[43],已成为一种有效的治疗T2DM的策略,那么筛选SGLT2抑制剂成为该项治疗方法的重点。ANNAPURNA等[44]通过电子对接的方法,探究异荭草素与SGLT2相互作用,其与SGLT2的Gln 295和Asp 294残基的相互作用已被证明与III期药物Dapagliflzin的相互作用相当,证明异荭草素可以作为潜在的SGLT2抑制剂治疗糖尿病。
综上所述,异荭草素能够在血糖紊乱后使其恢复至正常水平,同时能促进细胞对葡萄糖的摄取,并改善氧化损伤及炎症反应,以及通过促进线粒体生物发生而促进糖脂代谢。由此可见,异荭草素调节糖尿病的作用机制主要涉及摄入葡萄糖后的反应,异荭草素调节葡萄糖进入血液后的反应主要通过抑制炎症反应及其抗氧化作用,以胰岛素信号通路AKT和能量代谢通路AMPK为主,通过AKT、AMPK的磷酸化促进代谢,并引起血糖调节、抗氧化活性、线粒体功能等下游作用通路,图2汇总了上述分子机制。虽然明确异荭草素可以调节血糖,但AKT和AMPK信号通路还有很多的分支是异荭草素相关研究所没有探究到的,其中关键位点的转录因子(forkhead box, FoxO)和雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)对糖尿病的调控也很重要,FoxO通过调控转录过程进而调节代谢,AKT可磷酸化并直接抑制FoxO,AMPK可直接调控FoxO3并激活转录活性。mTOR及其下游成分进行蛋白质合成,胰岛素信号转导通过破坏CREB/CBP/mTOR的结合抑制肝脏中的糖异生。

图2 异荭草素调节糖尿病的作用通路
Fig.2 Pathway of isoorientin regulating diabetes mellitus
3 异荭草素调控糖尿病并发症的研究
3.1 异荭草素改善糖尿病引起的血小板聚集
一些研究表明,血小板聚集增加可能与ROS产生的改变有关,ROS的产生可能直接影响血小板聚集、活化以及血栓形成和血管损伤[45]。SALLES等[46]研究发现西番莲叶提取物对二型糖尿病动物的治疗降低了血小板聚集,并抑制了血小板中这些氧化性物质的产生。另外,考虑到之前证明西番莲提取物抗氧化性能的研究[47],西番莲提取物对血小板聚集的影响也可能与该提取物的抗氧化作用有关,从而清除ROS。证明西番莲叶提取物对糖尿病患者的健康有益,可防止其并发症的出现。其作用可能与类黄酮有关,其中包括黄酮类C糖苷——异荭草素,但并未进行单体验证,接下来应分离纯化出单体探究其对血小板聚集的作用。
3.2 异荭草素改善糖尿病引起的肝损伤
YUAN等[48]发现异荭草素可以通过调节脂质代谢、抗氧化能力和炎性细胞因子的释放来预防高果糖诱导的肝损伤发生。肝脏组织病理学观察发现,饲喂高果糖的小鼠出现严重的脂滴沉积、坏死、细胞质空泡化、细胞膜和细胞核碎裂,而异荭草素可保护肝组织免受高果糖诱导的脂肪肝和肝损伤。生化分析与肝组织病理学改变的结果一致,高果糖饮食显著提高了谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)和碱性磷酸酶(alkaline phosphatase, ALP)水平,异荭草素治疗显著减轻了这种改变。MDA是肝组织氧化损伤的特征性指标。高果糖喂养的小鼠肝脏MDA水平升高,给予异荭草素有效地降低了肝组织中的MDA水平。另外,给予异荭草素抑制炎性细胞因子(TNF-α、IL-1、IL-6)的释放,消除肝脏的炎症反应。虽然已证明异荭草素可以改善肝损伤,但目前实验结果仅局限于体内实验,并且缺少在糖尿病动物模型中的验证,后续可以在糖尿病动物模型中进行进一步验证,并补充体外实验,如以肝脏细胞为模型进行探究。
4 展望
与合成药物相比,草药通常被认为具有较少的副作用。上述研究已经证实含有异荭草素的植物提取物和草药制剂具有抗高血糖作用,它们有可能用作抗糖尿病滋补品,但是其多数以植物提取物,也就是以含异荭草素的混合物作为研究对象,单体只有少量研究。混合物之间可能存在拮抗或促进作用,而研究单体可以清晰地确定其作用效果。通过体内动物实验,证明异荭草素可调控糖脂代谢及抗氧化剂来改善糖尿病,但它主要把生理指标作为测定指标,仍缺少分子机制层面的探究,而体外实验补充了异荭草素调控糖尿病的分子机制,发现异荭草素通过调控胰岛素信号通路及能量代谢通路进而改善糖尿病,为后续异荭草素的研究与应用提供理论支持。
目前中西医[49-50]治疗糖尿病的机制主要涉及促进胰岛素分泌,增强胰岛素作用,修复受损的胰岛β细胞,增强葡萄糖的利用,提高对糖类物质的代谢,抑制消化道对糖类的吸收。目前,许多体外研究以及动物实验都证明了异荭草素具有调控糖尿病及其并发症的作用,但大部分分子机制的研究仍以细胞层面为主,缺少动物体内实验的验证,并且异荭草素在糖尿病并发症方面的研究过少。为了拓展异荭草素在糖尿病领域的应用,明确异荭草素在糖尿病方面的调控作用,以下几项工作的开展将很有意义:
(1)探究异荭草素能否调控葡萄糖的运输过程,验证异荭草素能否调控AMPK、AKT其他下游通路,进而完善异荭草素调控糖尿病的作用机制;
(2)在动物模型中进一步探究验证异荭草素调控糖尿病的分子机制,与体外实验相辅相成,为临床应用提供更有效的理论支持;
(3)探究异荭草素对糖尿病各种其他并发症,如糖尿病神经病变、糖尿病足、糖尿病眼病的调控作用及其机理。
[1] SAEEDI P, PETERSOHN I, SALPEA P, et al.Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:Results from the international diabetes federation diabetes atlas, 9th edition[J].Diabetes Research and Clinical Practice, 2019, 157:107843.
[2] NARAIN N.Potential of passion (Passiflora spp.) fruit in control of type Ⅱ diabetes[J].Current Research in Diabetes & Obesity Journal, 2018, 7(3):555712.
[3] D AZ-AMADOR R, CA
AZ-AMADOR R, CA IZARES-CARMENATE Y, TABOADA-CRISPI A, et al.Computational modeling of aldose reductase inhibitory activity of flavonoids derivatives for diabetic complications treatment[J].Letters in Drug Design and Discovery, 2021, 18(11):1 094-1 105.
IZARES-CARMENATE Y, TABOADA-CRISPI A, et al.Computational modeling of aldose reductase inhibitory activity of flavonoids derivatives for diabetic complications treatment[J].Letters in Drug Design and Discovery, 2021, 18(11):1 094-1 105.
[4] 杜伟奇, 施秀芳, 邱明艳, 等.治疗糖尿病药物的研究进展[J].中国医院药学杂志, 2005, 25(1):67-69.
DU W Q, SHI X F, QIU M Y, et al.Research progress of drugs for treating diabetes mellitus[J].Chinese Journal of Hospital Pharmacy, 2005, 25(1):67-69.
[5] EDDOUKS M, BIDI A, EL BOUHALI B, et al.Antidiabetic plants improving insulin sensitivity[J].Journal of Pharmacy and Pharmacology, 2014, 66(9):1 197-1 214.
[6] 魏丽娟, 易倩, 张曲, 等.一测多评法测定藜麦中6种酚类成分[J].食品工业科技, 2018, 39(19):232-236;242.
WEI L J, YI Q, ZHANG Q, et al.Determination of six polyphenols in Chenopodium quinoa eilld(quinoa)by quantitative analysis of multi-components by single marker method[J].Science and Tech- nology of Food Industry, 2018, 39(19):232-236;242.
[7] LUYEN B T T, THAO N P, TAI B H, et al.Chemical constituents of Triticum aestivum and their effects on adipogenic differentiation of 3T3-L1 preadipocytes[J].Archives of Pharmacal Research, 2015, 38(6):1 011-1 018.
[8] NAM T G, LIM T G, LEE B H, et al.Comparison of anti-inflammatory effects of flavonoid-rich common and tartary buckwheat sprout extracts in lipopolysaccharide-stimulated RAW 264.7 and peritoneal macrophages[J].Oxidative Medicine & Cellular Longevity, 2017, 2017:9658030.
[9] KUMARAN A, HO C C, HWANG L S.Protective effect of Nelumbo nucifera extracts on beta amyloid protein induced apoptosis in PC12 cells, in vitro model of Alzheimer's disease[J].Journal of Food and Drug Analysis, 2018, 26(1):172-181.
[10] SALLES B C C, DA SILVA M A, TANIGUTHI L, et al.Passiflora edulis leaf extract:Evidence of antidiabetic and antiplatelet effects in rats[J]. Biological and Pharmaceutical Bulletin, 2020, 43(1):169-174.
[11] LEE C W, SEO J Y, KIM S L, et al.Corn silk maysin ameliorates obesity in vitro and in vivo via suppression of lipogenesis, differentiation, and function of adipocytes[J].Biomedicine & Pharmacotherapy, 2017, 93:267-275.
[12] MOHANBABU A V R, KISHORE M K K, CHANDRASHEKAR B R, et al. Evaluation of potential antiamnesic activities of aqueous extract of Vitex trifolia leaves against scopolamine induced amnesia and in normal rats [J]. Journal of Basic and Clinical Physiology and Pharmacology, 2015, 26(2):201-209.
[13] LUAN G X, WANG Y W, WANG Z H, et al. Flavonoid glycosides from fenugreek seeds regulate glycolipid metabolism by improving mitochondrial function in 3T3-L1 adipocytes in vitro[J]. Journal of Agricultural & Food Chemistry, 2018, 66(12):3 169-3 178.
[14] ANILKUMAR K, REDDY G V, AZAD R, et al.Evaluation of anti-inflammatory properties of isoorientin isolated from tubers of Pueraria tuberosa[J].Oxidative Medicine and Cellular Longevity, 2017.DOI:10.1155/2017/5498054.
[15] L PEZ-L
PEZ-L ZARO M. Distribution and biological activities of the flavonoid luteolin [J]. Mini Reviews in Medicinal Chemistry, 2009, 9(1):31-59.
ZARO M. Distribution and biological activities of the flavonoid luteolin [J]. Mini Reviews in Medicinal Chemistry, 2009, 9(1):31-59.
[16] XIAO J B, CAPANOGLU E, JASSBI A R, et al.Advance on the flavonoid C-glycosides and health benefits [J]. Critical Reviews in Food Science & Nutrition, 2016, 56(Suppl1):S29-S45.
[17] CHOI J S, ISLAM M N, ALI M Y, et al.The effects of C-glycosylation of luteolin on its antioxidant, anti-Alzheimer′s disease, anti-diabetic, and anti-inflammatory activities [J]. Archives of Pharmacal Research, 2014, 37(10):1 354-1 363.
[18] 袁莉, 吴雨晨, 任骁萌, 等. 荭草素和异荭草素抗氧化活性及对肝癌细胞增殖的影响[ J]. 食品科学技术学报, 2013, 31(6):21-27.
YUAN L, WU Y C, REN X M, et al.Comparison of antioxidant ac-tivities and cytotoxicity in HepG 2 cells of orientin and isoorientin[J]. Journal of Food Science and Technology, 2013, 31 ( 6 ):21-27.
[19] 张琴. 异荭草素对人宫颈癌hela 细胞凋亡的影响[D]. 衡阳:南华大学, 2018.
ZHANG Q. Effects of isoorientin on hela cells apoptosis in cervical cancer[D]. Hengyang:University of South China, 2018.
[20] TEIXEIRA F M, COELHO M N, JOSÉ-CHAGAS F D N, et al.Oral treatments with a flavonoid-enriched fraction from Cecropia hololeuca and with rutin reduce articular pain and inflammation in murine zymosan-induced arthritis [J]. Journal of Ethnopharmacology, 2020, 260:112841.
[21] 朱秀珍, 申文伟, 龚翠莹, 等. 异荭草苷体内外抗呼吸道合胞病毒活性研究[J]. 中山大学学报( 医学科学版), 2015, 36(3):352-359.
ZHU X Z, SHEN W W, GONG C Y, et al. Antiviral activity of isoorientin against respiratory syncytial virus in vitro and in vivo [J]. Journal of Sun Yat-Sen University (Medical Sciences), 2015, 36(3):352-359.
[22] IBRAHIM R M, EL-HALAWANY A M, SALEH D O, et al.HPLC-DAD-MS/ MS profiling of phenolics from Securigera securidaca flowers and its anti-hyperglycemic and anti-hyperlipidemic ac-tivities[J]. Revista Brasileira de Farmacognosia, 2015, 25(2):134-141.
[23] GASPAR M C, FONSECA D A, ANTUNES M J, et al.Polyphenolic characterisation and bioactivity of an Oxalis pes-caprae L. leaf extract [J].Natural Product Research, 2018, 32(6):732-738.
[24] XU G K, QIN X Y, WANG G K, et al. Antihyperglycemic, antihyperlipidemic and antioxidant effects of standard ethanol extract of Bombax ceiba leaves in high-fat-diet- and streptozotocin-induced Type 2 diabetic rats [J]. Chinese Journal of Natural Medicines, 2017, 15(3):168-177.
[25] ANDRADE-CETTO A, WIEDENFELD H. Hypoglycemic effect of Cecropia obtusifolia on streptozotocin diabetic rats [J]. Journal of Ethnopharmacology, 2001, 78(2-3):145-149.
[26] SEZIK E, ASLAN M, YESILADA E, et al.Hypoglycaemic activity of Gentiana olivieri and isolation of the active constituent through bioassay-directed fractionation techniques [J]. Life Sciences, 2005, 76(11):1 223-1 238.
[27] ALONSO-CASTRO A J, ZAPATA-BUSTOS R, G MEZ-ESPINOZA G, et al.Isoorientin reverts TNF-α-induced insulin resistance in adipocytes activating the insulin signaling pathway [J].Endocrinology, 2012, 153(11):5 222-5 230.
MEZ-ESPINOZA G, et al.Isoorientin reverts TNF-α-induced insulin resistance in adipocytes activating the insulin signaling pathway [J].Endocrinology, 2012, 153(11):5 222-5 230.
[28] WAN H, WANG B, CUI Y K, et al. Low-level lead exposure promotes hepatic gluconeogenesis and contributes to the elevation of fasting glucose level [J].Chemosphere, 2021, 276(71):130111.
[29] ANDRADE-CETTO A, V ZQUEZ R C. Gluconeogenesis inhibition and phytochemical composition of two Cecropia species[J].Journal of Ethnopharmacology, 2010, 130(1):93-97.
ZQUEZ R C. Gluconeogenesis inhibition and phytochemical composition of two Cecropia species[J].Journal of Ethnopharmacology, 2010, 130(1):93-97.
[30] KASANGANA P B, EID H M, NACHAR A, et al. Further isolation and identification of anti-diabetic principles from root bark of Myrianthus arboreus P. Beauv. :The ethyl acetate fraction contains bioactive phenolic compounds that improve liver cell glucose homeostasis[J].Journal of Ethnopharmacology, 2019, 245:112167.
[31] ROSEN E D, SARRAF P, TROY A E, et al.PPAR γ is required for the differentiation of adipose tissue in vivo and in vitro[J]. Molecular Cell, 1999, 4(4):611-617.
[32] POUDEL B, NEPALI S, XIN M J, et al. Flavonoids from Triticum aestivum inhibit adipogenesis in 3T3-L1 cells by upregulating the insig pathway [J]. Molecular Medicine Reports, 2015, 12 (2): 3 139-3 145.
[33] MAZIBUKO-MBEJE S E, ZIQUBU K, DLUDLA P V, et al. Isoorientin ameliorates lipid accumulation by regulating fat browning in palmitate-exposed 3T3-L1 adipocytes [J]. Metabolism Open, 2020, 6:100037.
[34] MALIK A, JAMIL U, BUTT T T, et al. In silico and in vitro studies of lupeol and iso-orientin as potential antidiabetic agents in a rat model [J]. Drug Design, Development and Therapy, 2019, 13:1 501-1 513.
[35] GOLDENTHAL M J, MAR N-GARC
N-GARC A J.Mitochondrial signaling pathways:A receiver/ integrator organelle [J]. Molecular and Cellular Biochemistry, 2004, 262(1-2):1-16.
A J.Mitochondrial signaling pathways:A receiver/ integrator organelle [J]. Molecular and Cellular Biochemistry, 2004, 262(1-2):1-16.
[36] KAAMAN M, SPARKS L M, VAN HARMELEN V, et al. Strong association between mitochondrial DNA copy number and lipogenesis in human white adipose tissue [J]. Diabetologia, 2007, 50(12):2 526-2 533.
[37] ZIQUBU K, MULLER C J F, DLUDLA P V, et al. Impact of isoorientin on metabolic activity and lipid accumulation in differentiated adipocytes [J]. Molecules (Basel, Switzerland), 2020, 25(8):1773.
[38] ABUELIZZ H A, ANOUAR E H, AHMAD R, et al. Triazoloquinazolines as a new class of potent α-glucosidase inhibitors:In vitro evaluation and docking study[J].PLoS One, 2019, 14(8):e0220379.
[39] ZHANG X L, LI G L, WU D, et al.Emerging strategies for the activity assay and inhibitor screening of alpha-glucosidase [J]. Food Function, 2020, 11(1):66-82.
[40] DE LAAR F A V. Alpha-glucosidase inhibitors in the early treatment of type 2 diabetes [J]. Vascular Health and Risk Management, 2008, 4(6):1 189-1 195.
[41] SHIBANO M, KAKUTANI K, TANIGUCHI M, et al.Antioxidant constituents in the dayflower (Commelina communis L.) and their alpha-glucosidase-inhibitory activity [J]. Journal of Natural Medicines, 2008, 62(3):349-353.
[42] BORGES P H O, PEDREIRO S, BAPTISTA S J, et al. Inhibition of α-glucosidase by flavonoids of Cymbopogon citratus (DC) stapf[J].Journal of Ethnopharmacology, 2021, 280:114470.
[43] MULLER C J F, MALHERBE C J, CHELLAN N, et al. Potential of rooibos, its major C-glucosyl flavonoids, and Z-2-(beta-D-glucopyranosyloxy)- 3-phenylpropenoic acid in prevention of metabolic syndrome [J]. Critical Reviews in Food Science and Nutrition, 2018, 58(2):227-246.
[44] ANNAPURNA H V, APOORVA B, RAVICHANDRAN N, et al. Isolation and in silico evaluation of antidiabetic molecules of Cynodon dactylon (L.)[J].Journal of Molecular Graphics and Modelling, 2013, 39:87-97.
[45] WOODWARD C, MAGWENZI S G, WRAITH K S, et al. Oxidised LDL activates blood platelets through CD36-NADPH oxidasemediated inhibition of the cgmp/protein kinase g signalling cascade[J].Atherosclerosis, 2015, 241(1):e5-e6.
[46] SALLES B C C, LEME K C, DA SILVA M A, et al.Protective effect of flavonoids from Passiflora edulis Sims on diabetic complications in rats[J].Journal of Pharmacy and Pharmacology, 2021, 73(10):1 361-1 368.
[47] KANDANDAPANI S, BALARAMAN A K, AHAMED H N.Extracts of passion fruit peel and seed of Passiflora edulis (Passifloraceae) attenuate oxidative stress in diabetic rats [J]. Chinese Journal of Natural Medicines, 2015, 13(9):680-686.
[48] YUAN L, HAN X, LI W F, et al. Isoorientin prevents hyperlipidaemia and liver injury by regulating lipid metabolism, antioxidant capability and inflammatory cytokine release in high-fructose-fed mice [J]. Journal of Agricultural & Food Chemistry, 2016, 64(13):2 682-2 689.
[49] 周岚. 姜德友教授治疗2型糖尿病的用药规律研究[D].哈尔滨:黑龙江中医药大学, 2021.
ZHOU L.Study on the medication regularity of professor Jiang Deyou in the treatment of type 2 diabetes mellitus [D]. Harbin:Heilongjiang University of Chinese Medicine, 2021.
[50] 李芸芳. 中药抗糖尿病活性筛选及作用机制研究[D]. 武汉: 武汉大学, 2017.
LI Y F.Anti-diabetic activity screening of traditional Chinese medicines and the molecular mechanism[D].Wuhan:Wuhan University, 2017.