庚二酸,又称蒲桃酸,是一种重要的七碳二元羧酸,主要用作生物素合成的前体,除此以外还可用于聚酰胺、表面活性剂及杀虫剂[1] 的制备。目前,工业上主要是通过水杨酸的裂解来合成庚二酸[2] ,但该方法有着工艺复杂、收率较低等缺点。
随着现代生物技术的不断发展,最早在部分微生物的培养过程中发现了微量庚二酸的存在[3-5]。随后,利用代谢工程及合成生物学等方法,对庚二酸的生物合成进行了研究。CHEONG等[6]在大肠杆菌JC01中过表达了5 个基因(paaJ、paaH、paaF、tdTer和cat1),构建了一种二元羧酸的生物合成途径,成功通过非脱羧克莱森缩合反应合成了庚二酸。IKEDA等[7]在Corynebacterium glutamicum中表达细胞色素P450 酶的编码基因bioI,通过氧化裂解长链脂肪酸,同时阻断生物素合成途径,获得了微量的庚二酸。但是上述研究中庚二酸的产量均较低,不利于后续的工业化生产,因此有必要筛选获得1 株高产庚二酸的菌株并进行发酵工艺优化,以期提高庚二酸的产量。
本实验室前期研究时[8-9],在部分微生物的培养液中发现了少量庚二酸的存在。据此,本研究以实验室现有的菌株为基础,利用48 孔板及摇瓶进行筛选,成功筛选得到了1 株高产庚二酸的霍氏肠杆菌Bpa-3,同时分别对碳源种类、氮源种类、接种量及外加的无机盐种类和浓度进行了优化,进一步提高了庚二酸的产量,为其生物法合成提供了新思路。
1 材料与方法
1.1 实验材料
1.1.1 菌株
本研究所用的菌株为霍氏肠杆菌(Enterobacter hormaechei),命名为Bpa-3,由本实验室保藏。
1.1.2 培养基
LB培养基(g/L):NaCl 10,胰蛋白胨10,酵母粉5(如需制备固体培养基,加入20 g/L 琼脂粉),pH 7.0。
SOB培养基(g/L):胰蛋白胨20,葡萄糖4,酵母粉5,MgCl2·6H2 O 2.03,NaCl 0.5,KCl 0.186,pH 7.0。
最优组分培养基(g/L):胰蛋白胨25,甘油4,MgCl2·6H2 O 2.03,NaCl 0.5,KCl 0.186,pH 7.0。
1.1.3 试剂与仪器
胰蛋白胨及酵母提取物,英国oxoid公司;庚二酸标准品,美国sigma公司;琼脂粉、葡萄糖、NaCl、MgCl2·6H2O、KCl,上海国药试剂集团。
UV-1800紫外可见分光光度计,翱艺仪器(上海)有限公司;1260 Ⅱ高效液相色谱系统,美国安捷伦有限公司;HYL-C3组合式摇床,太仓市强乐实验设备有限公司;5424台式高速离心机,德国Eppendorf(艾本德)公司;G154DWS立式压力蒸汽灭菌锅,美国致微有限公司。
1.2 菌株活化及筛选
1.2.1 菌株活化
将-80 ℃冰箱保藏的菌种取出,在LB固体平板上划线,于37 ℃恒温培养箱培养12 h。
1.2.2 菌种初筛
种子液制备:挑取LB平板的单菌落接种于含有1 mL LB液体培养基的48孔板中,37 ℃,250 r/min培养12 h制备一级种子液。将一级种子液以2%(体积分数)的接种量继续转接至48孔板,37 ℃,250 r/min 培养12 h制备二级种子液。
孔板筛选:菌种初筛在48孔板中进行,具体方法如下:将制备的二级种子液以2%的接种量接种于含有1 mL SOB培养基的48孔板中,30 ℃,250 r/min发酵72 h,最后利用高效液相色谱(high performance liquid chromatography,HPLC)对发酵液进行分析。
1.2.3 摇瓶复筛
种子液制备:将初筛得到的菌株接种于含有50 mL LB培养基的250 mL三角瓶中,37 ℃,250 r/min培养12 h制备一级种子液。将一级种子液以2%的接种量继续转接至三角瓶中,37 ℃,250 r/min培养12 h制备二级种子液。
摇瓶发酵:以2%的接种量将二级种子液接种于含有50 mL SOB培养基的250 mL三角瓶中,30 ℃,250 r/min发酵72 h,每隔12 h取1次样,冻存于-20 ℃冰箱中,利用HPLC对发酵液进行分析,每次实验设置3个平行,最终结果计算其平均值。
1.3 代谢物含量测定及定性分析
摇瓶发酵时,细胞的生长情况通过600 nm处的光密度(OD600)来衡量,每次取样时记录数据以绘制菌株生长曲线。
对于孔板发酵得到的发酵液,以4 000 r/min离心4 min获得上清液;对于摇瓶发酵得到的发酵液,以10 000 r/min离心2 min获得上清液,随后将制备的上清液过水系滤膜,经由HPLC检测代谢物的含量。检测所用流动相为5 mmol/L H2SO4,流速为0.6 mL/min,色谱柱为Bio-Rad HPX-87 H色谱柱,柱温为35 ℃,进样量为20 μL。通过紫外检测器(218 nm)对发酵液中的有机酸进行定量[10],通过示差检测器对发酵液中的葡萄糖进行定量。
为了对发酵液中的庚二酸进行定性分析,本研究采用液质联用(liquid chromatograph-mass spectrometer,LC-MS)对发酵液进行分析[11]。检测所用色谱柱为BEH C18色谱柱(2.1 mm×150 mm,1.7 μm),所用检测器为Waters Acquity PDA检测器(200~400 nm),流动相A为甲酸(0.1%),流动相B为乙腈,进样量为5 μL。通过Waters Acquity超高效液相色谱仪在45 ℃下进行梯度洗脱,梯度洗脱程序如表1所示,同时将负模式电喷雾电离(ESI-)应用于质谱仪。
表1 LC-MS梯度洗脱程序
Table 1 Gradient elution program for LC-MS

时间/minφ(0.1%甲酸)/%φ(乙腈)/%010007.370308.220809.10100101000
1.4 庚二酸生产菌株发酵优化
碳源种类优化:分别用4 g/L的蔗糖及甘油替换SOB培养基中的葡萄糖,以2%的接种量将种子液接种于培养基,30 ℃,250 r/min发酵72 h,每隔12 h取样,利用HPLC对发酵液进行分析,每次实验设置3个平行,最终结果计算其平均值。
氮源种类优化:分别用25 g/L的有机氮源(酵母膏、大豆蛋白胨、鱼粉蛋白胨、酵母粉、牛肉浸粉、胰蛋白胨)或无机氮源[乙酸铵、(NH4)2SO4、NH4Cl、尿素、(NH4)2HPO4]替换SOB培养基中的混合氮源(酵母粉和胰蛋白胨),以2%的接种量将种子液接种于培养基,30 ℃ ,250 r/min 发酵72 h,每隔12 h取样,利用HPLC对发酵液进行分析,每次实验设置3个平行,最终结果计算其平均值。
碳氮源组合优化:对培养基中的碳源(葡萄糖、甘油及蔗糖)及氮源[胰蛋白胨及(NH4)2HPO4]进行组合,与SOB培养基中的碳氮比保持一致(C/N=4),以2%的接种量将种子液接种于培养基,30 ℃,250 r/min发酵72 h,每隔12 h取样,利用HPLC对发酵液进行分析,每次实验设置3个平行,最终结果计算其平均值。
接种量优化:分别以1%、2%、4%、6%、8%、10%的接种量转接二级种子液,利用最优组分培养基进行摇瓶发酵,30 ℃,250 r/min发酵72 h,每隔12 h取样,利用HPLC对发酵液进行分析,每次实验设置3个平行,最终结果计算其平均值。
无机盐种类优化:以最优组分培养基为基础,发酵前向培养基中分别外加不同终浓度的KCl(25 mmol/L)、MnCl2(0.5 mmol/L)、MgSO4(5 mmol/L)及KH2PO4 (20 mmol/L)溶液,以4%的接种量将种子液接种于培养基,30 ℃ ,250 r/ min 发酵72 h,每隔12 h取样,利用HPLC 对发酵液进行分析,每次实验设置3 个平行,最终结果计算其平均值。
KH2PO4浓度优化:以最优组分培养基为基础,发酵前向培养基中分别外加终浓度分别为5、10、20、30、50 mmol/L的KH2PO4母液,接种量为4%,30 ℃,250 r/min发酵72 h,每隔12 h取样,利用HPLC对发酵液进行分析,每次实验设置3个平行,最终结果计算其平均值。
2 结果与分析
2.1 庚二酸生产菌株筛选
对本实验室保藏的菌株进行划线后挑取单菌落,通过48孔板进行初筛,利用HPLC检测庚二酸。最终从挑取的960个单菌落中筛选得到了12株能够生产庚二酸的菌株。随后将初筛得到的12株菌利用摇瓶进行复筛,得到了1株庚二酸产量最高的菌株,将其命名为Bpa-3。如图1-a所示,菌株Bpa-3在发酵12 h时已有少量庚二酸生成,随着发酵时间的不断延长,庚二酸的产量也不断提高,发酵72 h时产生了115.4 mg/L的庚二酸。对该样品进行液质联用检测,结果发现菌株Bpa-3的发酵液在4.72 min有一明显的出峰,与庚二酸标准品的出峰时间相一致;同时,质谱的特征离子碎片也显示该物质为庚二酸[7](图1-b、图1-c),进一步表明菌株Bpa-3在发酵过程中生产了庚二酸。

a-菌株Bpa-3的生长曲线及庚二酸产量;b-发酵72 h样品及庚二酸标准品液相图谱;c-发酵72 h样品及庚二酸标准品质谱检测图谱
图1 菌株Bpa-3庚二酸的产量及其发酵液液质联用检测分析
Fig.1 Production of pimelic acid in strain Bpa-3 and its fermentation broth analysis by LC-MS
2.2 发酵条件优化
2.2.1 碳源种类
为了提高菌株Bpa-3的庚二酸产量,对SOB培养基中的碳源种类进行了优化,结果如图2所示。与葡萄糖相比,甘油更适合作为菌株生产庚二酸的碳源,这可能是因为葡萄糖是速效碳源,在发酵过程中会产生过多杂酸,不利于产物的合成[12-13];而当蔗糖作为碳源时,菌株的庚二酸产量有所降低,可能是由于蔗糖是二糖,在微生物体内需要分解为单糖才能被利用,从而导致庚二酸的产量降低;因此,后续研究中选择甘油作为碳源。
2.2.2 氮源种类
在发酵过程中,培养基中的氮源对产物的合成有积极的影响[14-15]。因此,在本研究中,对氮源的种类进行了优化,分别用相同浓度的有机氮源或无机氮源替换培养基中的混合氮源,结果如图3所示。除胰蛋白胨和(NH4)2HPO4外,其他种类的氮源均降低了庚二酸的产量;当胰蛋白胨作为氮源时,庚二酸的产量最高;因此,在本实验中以胰蛋白胨作为氮源进行发酵。
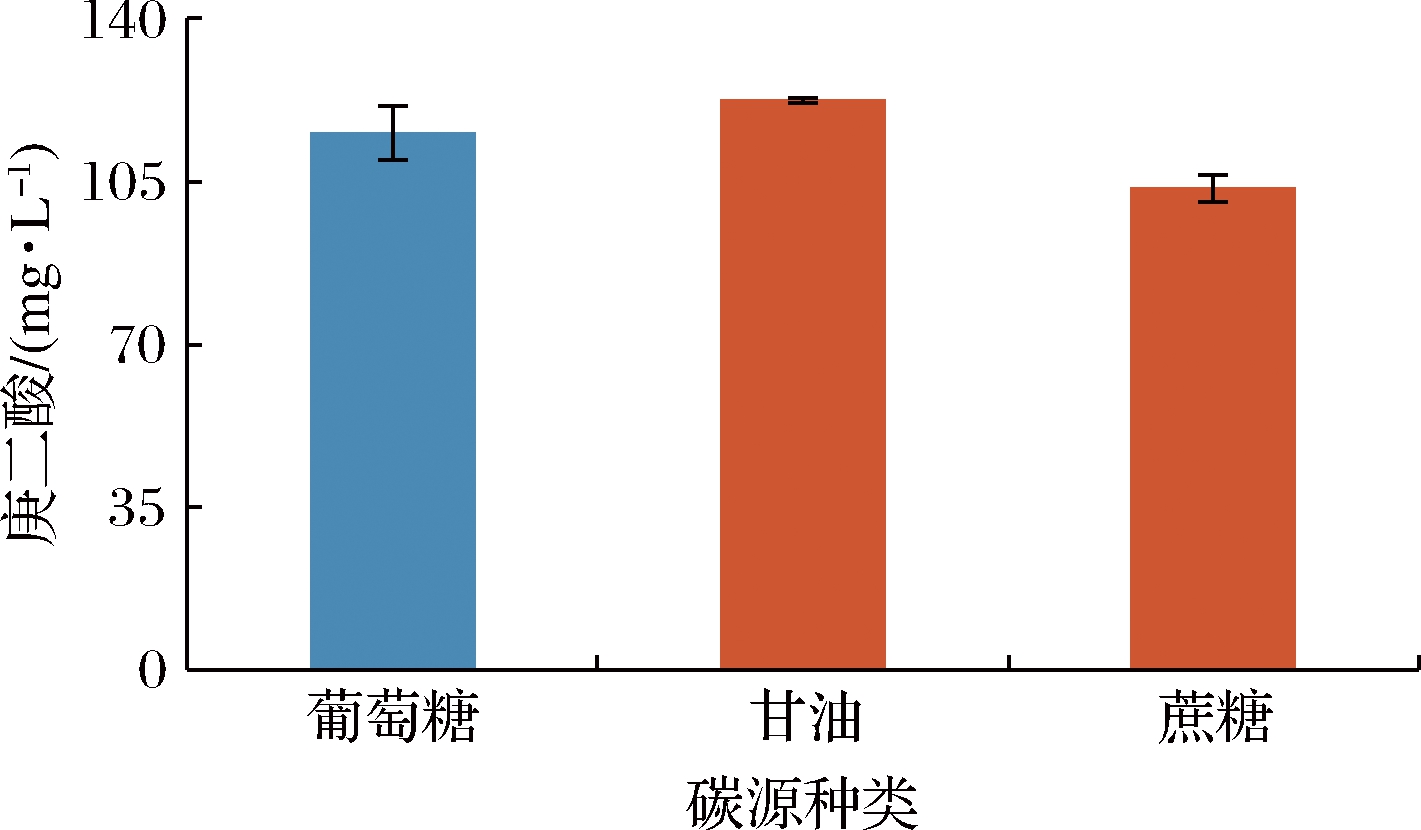
图2 碳源对菌株Bpa-3庚二酸产量的影响
Fig.2 Effects of carbon sources on the pimelic acid production of strain Bpa-3

图3 氮源对菌株Bpa-3庚二酸产量的影响
Fig.3 Effects of nitrogen sources on the pimelic acid production of strain Bpa-3
2.2.3 碳氮源组合优化
为了探究碳源与氮源的协同作用,结合前期结果,选择葡萄糖、甘油及蔗糖3种碳源,胰蛋白胨及(NH4)2HPO4 2种氮源,对其进行组合,研究不同碳氮源组合对菌株Bpa-3产庚二酸的影响,结果如图4所示。在6个组合中,胰蛋白胨作为氮源时的庚二酸产量均高于(NH4)2HPO4,这可能是因为(NH4)2HPO4是无机氮源,相较于胰蛋白胨成分单一,对于菌株产庚二酸的贡献较小;同样地,甘油作为碳源时的庚二酸产量比葡萄糖和蔗糖高,这与2.2.1的结果相一致。庚二酸的产量最高的碳氮源组合是甘油和胰蛋白胨。因此,结合上述结果,在本研究中,选择甘油作为碳源,胰蛋白胨作为氮源。
2.2.3 接种量
接种量的大小影响着菌株的生长速度,接种量过大或过小都不利于菌株合成产物[16]。在本研究中,分别采用不同的接种量来转接二级种子液进行发酵,以2%的接种量作为对照,结果如图5所示。当接种量<4%时,庚二酸的产量随着接种量的增加而增加;当接种量>4%时,庚二酸的产量随着接种量的增加而降低;因此,在本实验中选择4%的接种量进行发酵。

图4 不同碳氮源组合对菌株Bpa-3庚二酸产量的影响
Fig.4 Effects of different combinations of carbon and nitrogen sources on the pimelic acid production of strain Bpa-3

图5 接种量对菌株Bpa-3庚二酸产量的影响
Fig.5 Effects of inoculum amount on the pimelic acid production of strain Bpa-3
2.3 外源无机盐的添加
无机盐离子对菌体的生长和产物的合成往往都有一定作用[17],如镁离子能够激活某些酶的活性[18],从而促进菌体生长;锰离子和磷酸盐也能够促进菌体的基础代谢[19]。在本研究中,分别向最优组分培养基中添加不同种类的无机盐离子,如图6所示。结果发现,除MgSO4外,其他无机盐均能够促进庚二酸的合成。其中,KH2PO4对于菌株产庚二酸的作用最大,当外加20 mmol/L KH2 PO4时,菌株Bpa-3的庚二酸产量为205.1 mg/L,比对照组提高了78%。
为了进一步提高庚二酸的产量,对外加KH2PO4的浓度进行了优化,结果如图7-a所示。随着KH2PO4浓度的不断增加,庚二酸的产量先升高后降低,当外加30 mmol/L KH2PO4时,庚二酸的产量最高,为217.3 mg/L,是优化前的1.89倍,其原因可能是K+和![]() 对菌株的生长和产酶都有一定的促进作用[20],随着KH2PO4浓度的不断增加,菌株Bpa-3生长的稳定期也在不断延长,有助于持续合成产物(图7-b),因此,庚二酸的产量会相对提高,这也与张由恒等[21]的研究结果相一致。
对菌株的生长和产酶都有一定的促进作用[20],随着KH2PO4浓度的不断增加,菌株Bpa-3生长的稳定期也在不断延长,有助于持续合成产物(图7-b),因此,庚二酸的产量会相对提高,这也与张由恒等[21]的研究结果相一致。

图6 无机盐种类对菌株Bpa-3庚二酸产量的影响
Fig.6 Effects of inorganic salt types on the pimelic acid production of strain Bpa-3

a-不同KH2PO4浓度下的庚二酸产量;b-不同KH2PO4浓度下菌株Bpa-3的生长曲线
图7 KH2PO4浓度对菌株Bpa-3庚二酸产量的影响
Fig.7 Effects of KH2 PO4 concentration on the pimelic acid production of strain Bpa-3
3 结论
本研究通过筛选获得了1株高产庚二酸的霍氏肠杆菌Bpa-3,通过发酵工艺优化,庚二酸的产量达到217.3 mg/L,是目前报道的最高值,为后续生物法生产庚二酸及其他有机酸提供了有益借鉴。除此之外,本研究所用的菌株霍氏肠杆菌为野生菌,可以通过合成生物学的手段对其进行改造,如利用基因编辑敲除庚二酸的下游竞争途径或异源表达庚二酸生物合成的相关基因等,以期进一步提高庚二酸的产量,增强其生物法合成效率。
[1] 朱平华. 1,7_庚二酸的合成研究[J].精细化工中间体,2005(4):58-59;69.
ZHU P H. Synthesis of1,7-pimelic acid[J].Fine Chemical Intermediates,2005(4):58-59;69.
[2] 林晓霖,袁斌,段博.庚二酸的研究进展[J].化工中间体,2007(11):16-19.
LIN X L, YUAN B, DUAN B.Study on the development of the application of pimelic acid[J].Chemical Intermediates,2007(11):16-19.
[3] JANOTA-BASSALIK L,WRIGHT L D.Pimelic acid as a by-product of azelaic acid degradation by Pseudomonas sp.[J].Nature,1964,204(4 957):501-502.
[4] OHSUGI M, MIYAUCHI K, INOUE Y. Pimelic acid as a degradation product of azelaic acid by yeasts[J].Agricultural and Biological Chemistry,1984,48(7):1 881-1 882.
[5] OHSUGI M,MIYAUCHI K,TACHIBANA K,et al.Formation of a biotin precursor,pimelic acid,in yeasts from C18 fatty acids[J].Journal of Nutritional Science and Vitaminology,1988,34(4):343-352.
[6] CHEONG S,CLOMBURG J M,GONZALEZ R.Energy-and car-bon-efficient synthesis of functionalized small molecules in bacteria using non-decarboxylative Claisen condensation reactions[J].Nature Biotechnology,2016,34(5):556-561.
[7] IKEDA M,NAGASHIMA T,NAKAMURA E,et al.In vivo roles of fatty acid biosynthesis enzymes in biosynthesis of biotin and α-lipoic acid in Corynebacterium glutamicum[J].Applied and Environmental Microbiology,2017,83(19):e01322-e01317.
[8] SUI X, ZHAO M, LIU Y L, et al.Enhancing glutaric acid production in Escherichia coli by uptake of malonic acid[J].Journal of Industrial Microbiology and Biotechnology,2020,47(3):311-318.
[9] ZHAO M, HUANG D X, ZHANG X J, et al.Metabolic engineering of Escherichia coli for producing adipic acid through the reverse adi- pate-degradation pathway[J].Metabolic Engineering,2018,47:254-262.
[10] 蒲跃进, 刘波, 周占琴, 等.RP-HPLC测定发酵液中庚二酸的含量[J].安徽农业科学,2006,34(13):2 952-2 953;2 955.
PU Y J,LIU B,ZHOU Z Q,et al.Determination of aimelic acid in broth system by reversed-phase high performance liquid chromatography[J].Journal of Anhui Agricultural Sciences,2006,34(13):2 952-2 953;2 955.
[11] LI Y T, GEORGE E J. Analysis of perchlorate in water by reversed-phase LC/ESI-MS/MS using an internal standard technique[J].Analytical Chemistry 2005,77(14):4 453-4 458.
[12] SHI X J, XIE J C, LIAO S Y, et al.High-level expression of re- combinant thermostable β-glucosidase in Escherichia coli by regula- ting acetic acid[J].Bioresource Technology,2017,241:795-801.
[13] ZHANG Y, DAI X F, JIN H N, et al.The effect of optimized carbon source on the synthesis and composition of exopolysaccharides produced by Lactobacillus paracasei[J].Journal of Dairy Science,2021,104(4):4 023-4 032.
[14] SU Q H,ZHANG Z C,LIU X C,et al.The transcriptome analysis on urea response mechanism in the process of ergosterol synthesis by Cordyceps cicadae[J].Scientific Reports,2021,11:10927.
[15] LIANG C H, WU C Y, HO W J, et al.Influences of carbon and nitrogen source addition,water content,and initial pH of grain medium on hispidin production of Phellinus linteus by solid-state fermentation[J].Journal of Bioscience and Bioengineering,2020,130(6):616-621.
[16] 黎青华, 堵国成, 李江华, 等.红曲色素高产菌的诱变选育与发酵优化[J].食品与生物技术学报,2020,39(11):18-24.
LI Q H, DU G C, LI J H, et al.Mutation breedingand fermentation optimization of the strain with high-yield of Monascus red pigment[J].Journal of Food Science and Biotechnology,2020,39(11):18-24.
[17] LI Y, CHEN Y, TIAN X W,et al.Advances in sophorolipid-producing strain performance improvement and fermentation optimization technology[J].Applied Microbiology and Biotechnology,2020,104(24):10 325-10 337.
[18] LI R X, JIN M J, DU J, et al.The magnesium concentration in yeast extracts is a major determinant affecting ethanol fermentation performance of Zymomonas mobilis[J].Frontiers in Bioengineering and Biotechnology,2020,8(31):957.
[19] KAMZOLOVA S V, MORGUNOV I G. Optimization of medium composition and fermentation conditions for α-ketoglutaric acid production from biodiesel waste by Yarrowia lipolytica [J].Applied Microbiology and Biotechnology,2020,104(18):7 979-7 989.
[20] 苟万晓, 范延超, 胡元森, 等.甲醇蛋白联产木聚糖酶发酵培养基优化[J].轻工学报,2021,36(4):1-8.
GOU W X,FAN Y C,HU Y S,et al.Optimization of fermentation culture medium for methanol protein co-production xylanase[J].Journal of Light Industry,2021,36(4):1-8.
[21] 张由恒, 刘红雪, 陈宏, 等.无机盐对多杀菌素发酵产量影响[J].中国抗生素杂志,2016,41(9):658-665.
ZHANG Y H, LIU H X, CHEN H,et al.Effect of inorganic salts on the fermentation yield of spinosad by Saccharopolyspora spinosa [J].Chinese Journal of Antibiotics,2016,41(9):658-665.