姜黄素是一种提取于姜科、天南星科植物根茎中的二酮类化合物,作为天然色素广泛应用于食品行业。已有研究表明姜黄素具有良好的抗氧化性、抑菌性、抗炎性、抗肿瘤、抗病毒等生物活性[1-3]。目前基于姜黄素水溶性差引起的生物利用度低的问题,已有大量研究通过包埋的方式以提升其在食品体系的溶解性[4-5]。静电纺丝技术作为一种微纳米载运体系的制备技术已被许多研究者应用于姜黄素载运缓释,提升其在体内和体外的生物利用度[6]。已有研究将姜黄素包埋于各种不同的高分子纳米纤维体系中,研究了纳米纤维膜物理化学性质的差异,对其抑菌性、抗氧化性、抗炎效果等进行了表征[7-11]。改变纳米纤维的组成成分、形态结构和成分间的交联状态能够改变其包埋的姜黄素的释放行为及功能发挥,但是交联方式对姜黄素功能特性影响的研究鲜有报道。
通常天然高分子纳米纤维膜的应用研究均需要对其进行交联,可以通过化学法或者酶法交联[12]。最常见的交联方式是戊二醛熏蒸,但是研究表明戊二醛残留具有细胞毒性。考虑到交联剂的毒性可能对其后期应用在食品行业或者组织工程有影响,必须选择更加安全的交联方式。虽然前期研究表明由2种或2种以上性质不同的高聚物原料混合电纺制备复合纳米纤维可一定程度改善单一组分纳米纤维的物化性质、功能特性等,但其对纳米纤维膜综合性能提升效果还不足以将其实际应用。研究表明通过添加葡萄糖诱导的美拉德反应能够提升天然高分子纳米纤维膜的综合性能[13-16]。然而高温条件进行美拉德反应会使得生物活性物质不稳定[13,17-19],因此本文采用低温控湿的条件进行美拉德反应。
虽然静电纺丝技术广泛应用于制备纳米纤维[20-22],但是基于常规静电纺丝设备制备纤维的产率较低,通常采用的流速仅0.1~2 mL/h,其中高分子浓度通常低于30%,尤其一些多糖类分子浓度通常不高于5%[23-24]。为了提升静电纺丝效率,本研究采用气流辅助静电纺丝技术制备负载姜黄素的明胶/玉米醇溶蛋白纳米纤维。UM等[25]在2004年首次提出静电溶吹技术,相较于传统电纺,能够提高电纺速率和改善纳米纤维性能。气流辅助静电纺丝设备主要由供样系统、高压系统、收集系统、供气系统、喷丝头组成,相较于传统电纺系统,增添了供气系统,改变了喷丝头结构。CANBAY-GOKCE等[26]利用热塑性聚氨酯封装香菇提取物制备抗菌敷料,溶吹总流量能达到10.0 mL/h,效率高,成膜性良好,透气性与抗菌功能良好。
本文旨在通过气流辅助静电纺丝技术制备负载姜黄素的明胶/玉米醇溶蛋白/葡萄糖纳米纤维并研究控温控湿条件下的美拉德反应对纳米纤维微观形貌、宏观性质和功能特性的影响。通过扫描电子显微镜观察纳米纤维微观形态变化。通过傅里叶红外光谱、示差量热扫描/热重扫描、X射线衍射研究组分间的分子间相互作用和纳米纤维结晶性的变化。通过水接触角的测定分析纳米纤维亲疏水性的变化。通过抗氧化、抗菌测试研究美拉德反应对姜黄素纳米纤维的生物活性影响。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白,西格玛奥德里奇(上海)贸易有限公司;明胶、姜黄素、DPPH、ABTS、2,4,6-三吡啶基三嗪[2,4,6-tris(2-pyridyl)-s-triazine,TPTZ]、新亚铜试剂,上海阿拉丁试剂有限公司;大肠杆菌ATCC 25922、金黄色葡萄球菌CMCC(B)26003,北京生物保藏中心;葡萄糖、乙酸及其他试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
JDF05静电纺丝机,长沙纳仪仪器科技有限公司;恒温恒湿箱、S4800扫描电子显微镜,日本日立;iS5傅里叶红外光谱仪,美国Nicolet;STA449F3DSC/TG同步热分析仪,德国NETZSCHN;X射线衍射仪,荷兰PA Analytical;视频接触角测试仪,德国Dataphysics。
1.3 实验方法
1.3.1 溶液配制
参考前期研究选取明胶和玉米醇溶蛋白质量比为1∶1的溶液进行静电纺丝[17],分别称取1.5 g明胶、1.5 g玉米醇溶蛋白和0.5 g葡萄糖于容器中,加入10 mL体积分数为80%乙酸水溶液后搅拌过夜使其充分溶胀。然后在上述配比基础上添加相比于蛋白质量0.1%、0.5%和1.0%的姜黄素于溶液中。
1.3.2 纳米纤维制备
采用气流辅助法静电纺丝制备纳米纤维(图1)。将上述溶液转移至10 mL螺口注射器中,设定进料流速为10.0 mL/h,电压15 kV,针尖接受距离15 cm,辅助气流流速为400 L/h。将含有相比于蛋白质量0%、0.1%、0.5%和1.0%姜黄素的纳米纤维分别记为C0、C0.1、C0.5、C1.0。将制备好的纳米纤维放入温度50湿度60%的恒温恒湿箱中,美拉德反应2 d的纳米纤维记为C0M2、C0.1M2、C0.5M2、C1.0M2,美拉德反应5 d的纳米纤维记为C0 M5、C0.1M5、C0.5 M5、C1.0 M5。

图1 气流辅助静电纺丝设备示意图
Fig.1 The illustration of the air-assisted electrospinning set up
1.3.3 纳米纤维膜表征
剪取纳米纤维膜,经真空喷金处理后,于扫描电子显微镜上观察纳米纤维的微观形貌。使用软件Nano Measure从纳米纤维的扫描电子显微镜图中随机选取40根纤维,对其直径进行统计,根据所得数据拟合得出纤维平均直径并计算标准差。
采用傅里叶变换衰减全反射法进行红外光谱扫描,扫描范围为4 000~600 cm-1,分辨率为2 cm-1,累加32次,以空气为背景,每次扫描前扣除背景。
利用梅特勒差示扫描量热仪对纳米纤维膜进行热特性分析。准确称取6~10 mg样品放入铝坩埚中,密封。用相同条件的空坩埚作参比。以10 ℃/min的升温速度从20 ℃升温至600 ℃。整个过程均在干燥N2下进行。
采用接触角测量仪(OCA-20,德国)测定水接触角。将样品固定在载玻片上,采用去离子水作为探针溶剂在室温下进行测量。每个样品重复测量3次。
采用X射线光电子能谱仪(XPS,美国)用于分析膜表面元素。光源为Al Kα X射线光源(1 486.6 eV)。宽扫范围为0~1 000 eV,扫描频率为1.0 eV。精细扫描的频率为0.1 eV。采用Origin pro9软件拟合C1 s精细扫描光谱图。以284.8 eV作为C—C/C—H的特征峰,进行光谱校正[15]。
将电纺膜剪成2 cm×2 cm的片状,在X-pert Powder衍射仪上进行检测分析,Cu Kα(λ =1.540 6 Å),倾角0.02 °,扫描速度1(°)/min,扫描范围2 θ=5 °~90 °,电压40 kV,电流200 mA。
1.3.4 抗氧化活性
1.3.4.1 DPPH自由基清除率测定
称取0.019 5 g DPPH,乙醇定容至100 mL得到500 μmol/L DPPH乙醇溶液,铝箔纸包裹置于冰箱冷藏备用。称量5 mg样品置于10 mL离心管中,平行3次,加入2 mL 500 μmol/L DPPH乙醇溶液避光反应30 min,在517 nm测定吸光度。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A0为对照组吸光度,A1为样品组吸光度。
1.3.4.2 ABTS阳离子自由基清除率测定
称取0.038 4 g ABTS溶于10 mL去离子水得到ABTS溶液,称取0.013 4 g 过硫酸钾溶于10 mL 去离子水得到过硫酸钾溶液,将2种试剂以体积比1∶1混合均匀,避光反应12 h,得到ABTS工作液。采用pH 值为7.4的磷酸盐缓冲溶液(PBS溶液)稀释ABTS工作液在734 nm处吸光度为0.7±0.02的ABTS/PBS溶液。称量5 mg样品置于10 mL离心管中,平行3次,加入2 mL ABTS/PBS溶液,避光反应30 min,在734 nm测定吸光度。ABTS阳离子自由基清除率的计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A0为对照组吸光度,A1为样品组吸光度。
1.3.4.3 FRAP总抗氧化能力测定
吸取浓盐酸0.5 mL, 加水定容至150 mL得到40 mmol/L HCl溶液;称取0.540 6 g六水氯化铁,加水定容至100 mL得到20 mmol/L FeCl3溶液;称取三水醋酸钠16.922 1 g,量取冰醋酸40 mL,加水定容至500 mL得到0.3 mol/L醋酸钠缓冲液(pH 3.6);称取0.031 23 g TPTZ,用40 mmol/L HCl定容至10 mL得到TPTZ溶液。将醋酸钠缓冲液、FeCl3溶液、TPTZ溶液以体积比10∶1∶1的比例混合得到TPTZ工作液。称量5 mg样品置于10 mL离心管中,平行3次,加入2 mL TPTZ工作液于37 ℃反应30 min后,在592 nm测定吸光度,以OD值表示还原能力。
1.3.4.4 CUPRAC抗氧化能力测定
称取0.426 2 g的二水氯化铜,定容至250 mL得到0.01 mol/L Cu2+溶液;称取19.27 g的醋酸铵,定容至250 mL得到1 mol/L醋酸铵溶液;称取0.040 6 g新亚铜试剂,用95%乙醇溶解后,再用无水乙醇定容至25 mL得到7.5×10-3 mol/L新亚铜试剂溶液。称量5 mg样品置于10 mL离心管中,平行3次,加入2 mL体积比1∶1∶1铜离子溶液,醋酸铵溶液和新亚铜试剂溶液,常温反应30 min后,在450 nm测定吸光度,以OD值表示还原能力。
1.3.5 抑菌活性
采用抑菌圈法考察包埋有抑菌性分子的纳米纤维膜的抑菌特性。选用革兰氏阴性菌(大肠杆菌Escherichia coli)和革兰氏阳性菌(金黄色葡萄球菌Staphylococcus aureus)作为研究对象。用打孔器将纤维膜制成直径5 mm的圆片在紫外灯下灭菌30 min。取100 μL菌悬液(1×106 CFU/mL)均匀涂布于已灭菌的培养基上,然后将纤维膜贴于培养基表面,37 ℃恒温培养箱中培养24 h,用游标卡尺测量抑菌圈大小。
1.4 数据分析
统计学分析使用t分布检验单因素方差分析(ANOVA one way),后续使用Tukey分析进行检验,分析软件为Origin 8.0。当P<0.05时,结果被认为具有显著性差异。
2 结果与分析
2.1 纤维形态
图2为负载姜黄素的明胶/玉米醇溶蛋白美拉德反应前和反应2 d、5 d后的电镜图。由图2可知通过气流辅助法制备得到的纳米纤维形态良好,与前期研究中通过普通静电纺丝制备得到的纳米纤维形态无显著差异[17]。但是前期研究中的进料流速仅1.0 mL/h,而气流辅助法可将其流速提升至10.0 mL/h,显著提升静电纺丝的效率,并且通过气流辅助使得纤维直径可调控的范围更广。崔柄元等[27]以聚丙烯腈为原料,采用气流辅助纺丝工艺,在溶液的推进速度为50 μL/h,气流速度为90 m/s条件下,成功制得直径为1 μm的聚丙烯腈纳米纤维。如图2所示,C0、C0.1、C0.5和C1.0的直径分别为(573.5±172.28)、(703.5±54.89)、(733.27±75.65)、(752.25±144.34) nm。研究表明常规静电纺丝明胶/玉米醇溶蛋白(1∶1)纳米纤维的直径约500 nm,说明气流辅助静电纺丝所能达到的直径范围与常规静电纺丝无显著差异[17]。美拉德反应2 d和5 d对纳米纤维的形态和直径无显著影响,说明该条件下对明胶/玉米醇溶蛋白进行美拉德反应能够保持纳米纤维膜的孔隙率和较大的比表面积。ZHANG等[28]制备了谷朊蛋白/玉米醇溶蛋白/木糖纳米纤维并在温度60 ℃湿度40%条件下反应24 h后发现纤维直径增大并发生了一定程度的溶并,可能是由于纤维中的蛋白吸水发生了润胀。

图2 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的扫描电镜图和纤维直径分布
Fig.2 The SEM images and diameter distribution of gelatin/zein nanofibers before and after 2 d,5 d Maillard reaction
2.2 傅里叶变换红外(Fourier transform infrared,FTIR)分析
FITR用于表征纳米纤维膜C0、C0.1、C0.5和C1.0分别进行0、2和5 d美拉德反应后的官能团的变化。纳米纤维膜的FITR光谱如图3所示,3 277~3 287 cm-1内的吸收峰对应N—H 和O—H的伸缩振动,2 932~2 934 cm-1左右的吸收峰对应C—H的伸缩振动。随着姜黄素的加入,对应N—H和O—H伸缩振动的峰从3 277 cm-1(C0)移动到了3 287 cm-1(C1.0),说明明胶/玉米醇溶蛋白与姜黄素之间存在着一定的氢键相互作用。MENG等[29]研究发现,玉米醇溶蛋白/羧甲基葡聚糖纳米纤维与玉米醇溶蛋白相比,振动峰值从3 300 cm-1移动到3 310 cm-1,证实玉米醇溶蛋白与羧甲基葡聚糖之间形成了氢键。1 640、1 530、1 448 cm-1处的特征峰是由于明胶、玉米醇溶蛋白分子中的C—N、C![]() O键振动伸缩和N—H弯曲所引起。CANBAY-GOKCE等[26]研究表明,单一的姜黄素在812 cm-1出现特征峰。但在研究中发现812 cm-1并未出现该特征峰,表明姜黄素在明胶/玉米醇溶蛋白中呈现均相的分布。对比图3-a~图3-c可以发现代表葡萄糖C—O振动的1 034 cm-1的峰强显著减弱,说明纳米纤维中发生了美拉德反应,并且随着反应时间的延长,美拉德反应程度加深[13,17-18] 。
O键振动伸缩和N—H弯曲所引起。CANBAY-GOKCE等[26]研究表明,单一的姜黄素在812 cm-1出现特征峰。但在研究中发现812 cm-1并未出现该特征峰,表明姜黄素在明胶/玉米醇溶蛋白中呈现均相的分布。对比图3-a~图3-c可以发现代表葡萄糖C—O振动的1 034 cm-1的峰强显著减弱,说明纳米纤维中发生了美拉德反应,并且随着反应时间的延长,美拉德反应程度加深[13,17-18] 。
2.3 差示扫描量热(differential scanning calorimeter,DSC)分析
纳米纤维膜的DSC图如图4所示,热力学数据列于表1。T1表示导致纳米纤维膜结构的解聚温度,而T2对应于纳米纤维膜的降解温度。随着美拉德反应进行增加了T1的温度,说明美拉德反应体系有更好的热稳定性。张洪才[30]在α-壳聚糖-果糖美拉德反应产物研究中显示,随着果糖的加入,美拉德反应后解聚温度增加。岁鲁姗等[31]也在研究中得出,紫薯蛋白-葡萄糖美拉德产物的变性峰温度有所提高,这表明美拉德反应改变了蛋白的结构和构象。

a-反应前;b-反应2 d;c-反应5 d
图3 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的红外光谱图
Fig.3 The FTIR spectra of gelatin/zein nanofibers before and after 2 d,5 d Maillard reaction

a-反应前;b-反应2 d;c-反应5 d
图4 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的DSC谱图
Fig.4 The DSC curves of gelatin/zein nanofibers before and after 2 d, 5 d Maillard reaction
表1 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的热力学数据
Table 1 The DSC spectra data of gelatin/zein nanofibers before and after 2 d,5 d Maillard reaction
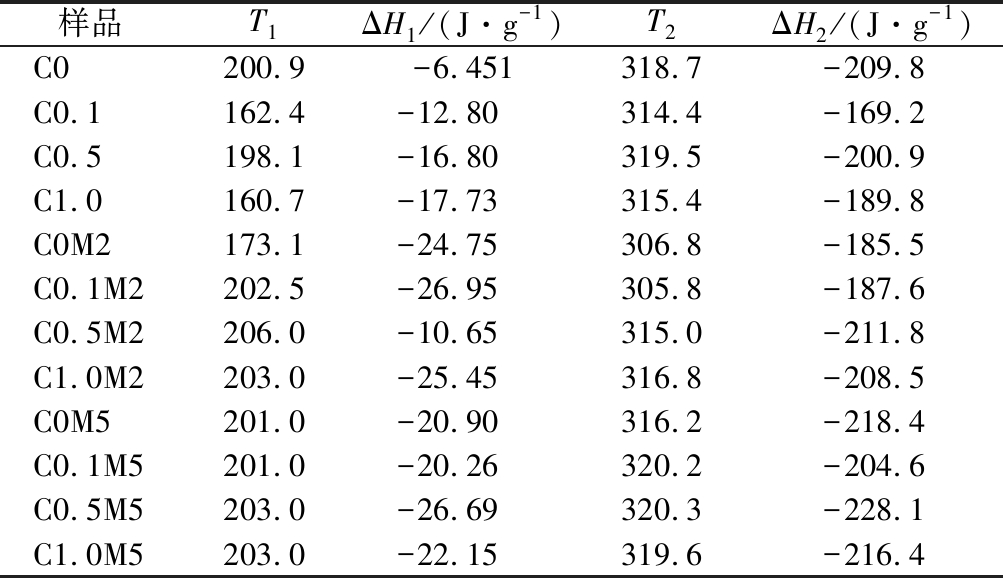
样品T1ΔH1/(J·g-1)T2ΔH2/(J·g-1)C0200.9-6.451318.7-209.8C0.1162.4-12.80314.4-169.2C0.5198.1-16.80319.5-200.9C1.0160.7-17.73315.4-189.8C0M2173.1-24.75306.8-185.5C0.1M2202.5-26.95305.8-187.6C0.5M2206.0-10.65315.0-211.8C1.0M2203.0-25.45316.8-208.5C0M5201.0-20.90316.2-218.4C0.1M5201.0-20.26320.2-204.6C0.5M5203.0-26.69320.3-228.1C1.0M5203.0-22.15319.6-216.4
2.4 X射线衍射(X-ray diffraction,XRD)分析
通过XRD对纳米纤维膜的结晶性进行研究,结果如图5所示。根据研究表明,明胶/玉米醇溶蛋白在8.5和21.2处出现宽衍射峰,其结晶性是由其α-螺旋结构产生的[17]。陈建平等[32]研究发现,单一的姜黄素在8.78、17.2和21.01等多处存在结晶衍射峰。但不同姜黄素添加量及美拉德反应的纳米纤维膜具有相同的散射模式,表明姜黄素均匀包埋于明胶/玉米醇溶蛋白中,无结晶形成。
2.5 接触角分析
接触角用来衡量润湿程度,由表2 可知,接触角均大于90(θ>90),说明纳米纤维膜表面表现为疏水状态。由于姜黄素不溶于水,随着姜黄素的加入,一定程度上增加了纳米纤维膜的疏水性。对于不含姜黄素的明胶/ 玉米醇溶蛋白纳米纤维,含0.1%和0.5%姜黄素的纳米纤维膜随着美拉德反应进行接触角减小,结合电镜图来看,最小接触角为C0.1M2[(138.40±0.26)°],原因为纳米纤维膜在美拉德反应中暴露出的OH基团残留导致。ZHANG等[28]研究表明通过美拉德反应可以破坏氢键和非极性疏水性基团来提高静电纺丝薄膜的疏水性,但未消耗的糖中暴露出的残留OH基团对薄膜的表面亲水性有较大的促进作用。
2.6 抑菌抗氧化分析
本研究采用了DPPH、ABTS、FRAP和CUPRAC法评价C0、C0.1、C0.5和C1.0分别进行0、2、5 d美拉德反应后的抗氧化效果。由图6可知,不同样品之间的抗氧化效果有显著性差异。由图6-a可知,随着姜黄素含量增加,对DPPH自由基清除率逐渐增大,当姜黄素含量为1.0%时,其自由基清除率达到58.99%。在同一浓度下,伴随着美拉德反应时间延长,试样对DPPH自由基清除率降低,是由于随着美拉德反应交联进行,使得姜黄素释放受到限制,从而降低其抗氧化活性。由图6-b可以看出,姜黄素含量和美拉德反应程度对ABTS阳离子自由基清除率没有显著影响。由图6-c可以看出,不同的姜黄素添加在美拉德反应2 d时对Fe3+还原能力最强,且随着姜黄素含量增加而增大,随着美拉德反应继续进行至5 d,美拉德反应中间产物被分解,从而使得其抗氧化效果降低[33]。图6-d纳米纤维膜对Cu2+还原能力结果与图6-b和图6-c基本一致。

a-反应前;b-反应2 d;c-反应5 d
图5 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的XRD谱图
Fig.5 The XRD spectra of gelatin/zein nanofibers before and after 2 d, 5 d Maillard reaction
表2 明胶/玉米醇溶蛋白纳米纤维膜美拉德反应前和反应2 d、5 d后接触角
Table 2 The water contact angle of gelatin/zein nanofibrous film before and after 2 d,5 d Maillard reaction

反应时间/d0%/°0.1%/°0.5%/°1.0%/°0139.60±1.56142.33±1.01146.07±2.15141.20±0.352141.10±0.60143.70±1.14140.10±0.50142.60±0.465142.97±1.95138.40±0.26142.73±1.46145.03±0.31
纳米纤维膜对大肠杆菌和金黄色葡萄球菌的平板抑菌效果如图7所示,姜黄素纳米纤维膜对大肠杆菌和金黄色葡萄球菌均具有显著抑制效果,负载 0.1%、0.5%和1.0%姜黄素的纳米纤维膜对大肠杆菌抑菌圈直径分别为9.51、17.55和19.86 mm,对金黄色葡萄球菌抑菌圈直径分别为6.23、12.15和13.07 mm,抑菌效果随着姜黄素浓度增加而增强,存在量效关系。但随着美拉德反应的发生,抑菌效果不显著,归因于蛋白的氨基酸残基与葡萄糖发生美拉德反应增加了网络结构的联结,从而限制姜黄素的释放,降低其抑菌效果,这一结果与DPPH的抗氧化效果一致。

a-DPPH法;b-ABTS法;c-FRAP法;d-CUPRAC法
图6 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的抗氧化效果
Fig.6 The antioxidant activity of gelatin/zein nanofibers before and after 2 d,5 d Maillard reaction

图7 明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后的抑菌圈结果
Fig.7 The inhibition zones of gelatin/zein nanofibers before and after 2 d,5 d Maillard reaction
3 结论
本文研究了负载0%、0.1%、0.5%、1.0%姜黄素的明胶/玉米醇溶蛋白纳米纤维美拉德反应前和反应2 d、5 d后纳米纤维性能的变化。气流辅助静电纺丝技术显著提升纳米纤维的制备效率并对其纤维形态无影响,姜黄素含量和美拉德反应程度对纳米纤维直径无显著影响。负载姜黄素的明胶/玉米醇溶蛋白纳米纤维具有较好的抑菌抗氧化性能,具有作为活性包装的应用前景。美拉德反应后的纳米纤维具有较高的热稳定性,但抑制了姜黄素的快速释放,表现为较低的DPPH自由基清除能力和抗菌能力。但是美拉德反应增加了纳米纤维的Fe3+和Cu2+还原能力,可归因于美拉德产物对金属离子具有较好的螯合作用。
[1] HEWLINGS S J, KALMAN D S.Curcumin:A review of its effects on human health[J].Foods(Basel, Switerland), 2017, 6(10):92-102.
[2] 陈帅, 孙翠霞, 代蕾, 等.基于生物来源和纳米技术的姜黄素传递载体的研究进展[J].中国食品学报, 2019, 19(8):294-302.
CHEN S, SUN C X, DAI L, et al.Research progress of delivery carriers of curcumin based on biopolymers and nanotechnology[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(8):294-302.
[3] 朱秀清, 衣程远, 刘琳琳, 等.超声诱导大豆亲脂蛋白复合姜黄素及其特性研究[J].食品与发酵工业, 2022, 48(3):115-122.
ZHU X Q, YI C Y, LIU L L, et al.Embedding curcumin with soybean lipophilic protein induced by ultrasonic treatment and the analysis of its properties[J].Food and Fermentation Industries, 2022, 48(3):115-122.
[4] SLIKA L, PATRA D.A short review on chemical properties, stability and nano-technological advances for curcumin delivery[J].Expert Opinion on Drug Delivery, 2020, 17(1):61-75.
[5] 舒心, 郭擎, 高彦祥.以蛋白质为基础物质的姜黄素传递体系研究进展[J].中国食品学报, 2022, 22(5):383-398.
SHU X, GUO Q, GAO Y X.Research progress on protein-based delivery systems for curcumin[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):383-398.
[6] 邓伶俐.静电纺丝技术包埋姜黄素研究进展[J].中国食品学报, 2022, 22(3):378-387.
DENG L L.Research progress of curcumin entrapment by electrospinning[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(3):378-387.
[7] MUNEESA M F, BARKI R R, SHAIKH S B, et al.Curcumin intervention during progressive fibrosis controls inflammatory cytokines and the fibrinolytic system in pulmonary fibrosis[J].Toxicology and Applied Pharmacology, 2022, 449:116116.
[8] LIU Y H, LIU M Y, ZHANG L L, et al.Preparation and properties of biodegradable films made of cationic potato-peel starch and loaded with curcumin[J].Food Hydrocolloids, 2022, 130:107690.
[9] YAN J K, WANG Z W, ZHU J, et al.Polysaccharide-based nanoparticles fabricated from oppositely charged curdlan derivatives for curcumin encapsulation[J].International Journal of Biological Macromolecules, 2022, 213:923-933.
[10] LI Y X, WANG D Y, YAN E Y, et al.Biodegradable and biocompatible Xylan/Polycaprolactone core-shell nanofibers via coaxial electrospinning for antibacterial applications[J].Materials Letters, 2022, 316:132049.
[11] 刘鑫岳, 陈晓平, 焦丽蓉, 等.脂质包衣的姜黄素/玉米醇溶蛋白纳米粒的制备及性能表征[J].食品与发酵工业, 2022, 48(5):130-135.
LIU X Y, CHEN X P, JIAO L R, et al.Fabrication and characterization of lipid coated curcumin/zein nanoparticles[J].Food and Fermentation Industries, 2022, 48(5):130-135.
[12] 邓伶俐, 李阳, 张辉.静电纺丝食品级天然高分子研究进展[J].中国食品学报, 2020, 20(7):278-288.
DENG L L, LI Y, ZHANG H.Research progress of food-grade natural biopolymer by electrospinning[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):278-288.
[13] SIIMON K, REEMANN P, P DER A, et al.Effect of glucose con- tent on thermally cross-linked fibrous gelatin scaffolds for tissue engineering[J].Materials Science and Engineering:C, 2014, 42:538-545.
DER A, et al.Effect of glucose con- tent on thermally cross-linked fibrous gelatin scaffolds for tissue engineering[J].Materials Science and Engineering:C, 2014, 42:538-545.
[14] 董潇, 黄国清, 肖军霞.玉米醇溶蛋白-葡萄糖美拉德反应产物制备姜黄素纳米颗粒[J].中国食品学报, 2021, 21(3):118-127.
DONG X, HUANG G Q, XIAO J X.Preparation of curcumin nano- particles by zein-glucose Maillard reaction products[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(3):118-127.
[15] FENG N J, WU H, XIE Y M, et al.A novel drug delivery system obtained from hydrophobic modified amphiphilic polymers by Maillard reaction[J].International Journal of Biological Macromolecules, 2020, 157:146-150.
[16] NAIK R R, WANG Y, SELOMULYA C.Improvements of plant protein functionalities by Maillard conjugation and Maillard reaction products[J].Critical Reviews in Food Science and Nutrition, 2022, 62(25):7 036-7 061.
[17] DENG L L, LI Y, FENG F Q, et al.Study on wettability, mechanical property and biocompatibility of electrospun gelatin/zein nanofibers cross-linked by glucose[J].Food Hydrocolloids, 2019, 87:1-10.
[18] KWAK H W, PARK J, YUN H, et al.Effect of crosslinkable sugar molecules on the physico-chemical and antioxidant properties of fish gelatin nanofibers[J].Food Hydrocolloids, 2021, 111:106259.
[19] KUTZLI I, GRIENER D, GIBIS M, et al.Influence of Maillard reaction conditions on the formation and solubility of pea protein isolate-maltodextrin conjugates in electrospun fibers[J].Food Hydrocolloids, 2020, 101:105535.
[20] 刘旖旎, 刘芳, 王德宝, 等.纳米抗菌纤维的静电纺丝制备技术及其抗菌活性研究进展[J].中国食品学报, 2021, 21(12):358-368.
LIU Y N, LIU F, WANG D B, et al.Research progress of electrospinning preparation technology and antibacterial activity of nano antibacterial fibers[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):358-368.
[21] QIN Z, JIA X, LIU Q, et al.Enhancing physical properties of chitosan/pullulan electrospinning nanofibers via green crosslinking strategies[J].Carbohydrate Polymers, 2020, 247:116734.
[22] KUTZLI I, BELJO D, GIBIS M, et al.Effect of maltodextrin dextrose equivalent on electrospinnability and glycation reaction of blends with pea protein isolate[J].Food Biophysics, 2020, 15(2):206-215.
[23] LI L, KANG W M, ZHUANG X P, et al.A comparative study of alu- mina fibers prepared by electro-blown spinning (EBS) and solution blowing spinning (SBS)[J].Materials Letters, 2015, 160:533-536.
[24] LUO S Y, SAADI A, FU K, et al.Fabrication and characterization of dextran/zein hybrid electrospun fibers with tailored properties for controlled release of curcumin[J].Journal of the Science of Food and Agriculture, 2021, 101(15):6 355-6 367.
[25] UM I C, FANG D F, HSIAO B S, et al.Electro-spinning and electro-blowing of hyaluronic acid[J].Biomacromolecules, 2004, 5(4):1 428-1 436.
[26] CANBAY-GOKCE E, AKGUL Y, GOKCE A Y, et al.Characterization of solution blown thermoplastic polyurethane nanofibers modified with Szygium aromaticum extract[J].The Journal of the Textile Institute, 2020, 111(1):10-15.
[27] 崔柄元, 温习, 吴宇峰, 等.碳纳米纤维的气流纺丝制备及电磁屏蔽应用[J].北京邮电大学学报, 2022,45(3):26-31;63.
CUI B Y, WEN X, WU Y F, et al.Preparation of carbon nanofibers by airflow spinning and electromagnetic interference shielding application[J].Journal of Beijing University of Posts and Telecommunications, 2022, 45(3):26-31;63.
[28] ZHANG Y P, DENG L L, ZHONG H, et al.Impact of glycation on physical properties of composite gluten/zein nanofibrous films fabricated by blending electrospinning[J].Food Chemistry, 2022, 366:130586.
[29] MENG R, WU Z Z, XIE Q T, et al.Preparation and characteriza- tion of zein/carboxymethyl dextrin nanoparticles to encapsulate curcumin:Physicochemical stability, antioxidant activity and controlled release properties[J].Food Chemistry, 2021, 340:127893.
[30] 张洪才.壳聚糖纳米粒子的制备和功效评价及其在生物活性物质载体中的应用[D].上海:上海交通大学, 2015.
ZHANG H C.Preparation and effectiveness evaluation of chitosan nanoparticles, and their biological properties and applications as carrier of bioactive compounds[D].Shanghai:Shanghai Jiao Tong University, 2015.
[31] 岁鲁姗, 詹少颖, 李佳, 等.紫薯蛋白-葡萄糖美拉德产物制备及其与花色苷相互作用研究[J].食品工业科技, 2019, 40(19):49-54;60.
SUI L S, ZHAN S Y, LI J, et al.Study on preparation of purple sweet potato protein-glucose Maillard reaction product and its interaction with anthocyanin[J].Science and Technology of Food Industry, 2019, 40(19):49-54;60.
[32] 陈建平, 彭莞仪, 秦小明, 等.姜黄素超分子包合物的结构鉴定及其抗氧化活性[J].食品工业科技, 2017, 38(21):21-25.
CHEN J P, PENG G Y, QIN X M, et al.Structural identification of curcumin/β-cyclodextrin polymer inclusion complex and its antioxidant activity[J].Science and Technology of Food Industry, 2017, 38(21):21-25.
[33] SHAKOOR A, ZHANG C P, XIE J C, et al.Maillard reaction chemistry in formation of critical intermediates and flavour compounds and their antioxidant properties[J].Food Chemistry, 2022:133416.