植物乳杆菌常分布于各种发酵食品中,如蔬果、肉类、乳制品及葡萄酒等,同时也是人体肠道正常菌群成员,对人体健康具有促进作用[1]。大量研究表明,植物乳杆菌能够定植于人体肠道内,发挥调节免疫、调节肠道菌群平衡、缓解慢性代谢性疾病、降低胆固醇水平等多种健康功效[2] 。众所周知,益生菌发挥益生功效的前提之一是需在肠道内达到足够的定植数量[3]。部分植物乳杆菌稳定性较差,进入消化道后难以忍受胃酸、消化酶、胆汁酸等作用,限制了其益生功效的发挥。近几年,益生菌的稳定性和生物利用率的提高已成为功能性食品研究中的主要关注点之一[4]。微胶囊技术是指以天然或人工合成的高分子材料作为壁材,将固体、液体或气体等包裹形成一种微小液滴或颗粒状态的技术,被包裹的物质在酸性条件下耐受性提高,而在适宜环境中能够释放出来发挥作用[5] 。
近年来,海藻酸钠微胶囊的相关研究主要集中于微胶囊对芯材的保护、粒径的控制以及微生物包埋率等方面,常用的制备方法有挤压法、乳化法等[6]。李洪波等[7]采用乳化法制备干酪乳杆菌微胶囊,包埋率可达61.73%。FRAKOLAKI等[8]采用挤压法制备海藻酸钠双歧杆菌微胶囊,包埋率可达到76.5%。但是,上述方法也存在一定程度的局限性,例如挤压法制备微胶囊粒径较大,乳化法则因搅拌速度剪切力较大,导致微胶囊形态不规则。采用微胶囊造粒仪制备微胶囊则可从根本解决上述问题。使用微胶囊造粒仪可在温和条件下将微生物或动植物细胞包埋在聚合物基质中,形成颗粒均匀、粒径适中的微胶囊,与挤压法或乳化法等传统制备方法相比,包埋效果稳定高效,得到了广泛认可[9]。
本研究以海藻酸钠为壁材通过微胶囊造粒仪制备植物乳杆菌IMAU10120-1微胶囊,通过检测不同浓度海藻酸钠、CaCl2和固化时间对植物乳杆菌微胶囊包埋率的影响,优化其制备工艺,并对所得微胶囊的肠溶性、人工胃肠液耐受性等进行评价,可为乳杆菌微胶囊的制备提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
植物乳杆菌IMAU10120-1是经次级感染法筛选获得的自发突变植物乳杆菌抗噬菌体菌株,保存于内蒙古农业大学乳品生物技术与工程教育部重点实验室。将植物乳杆菌IMAU10120-1以2%的接种量接种于MRS液体培养基中,37 ℃培养18 h。连续活化3代后待用。
1.1.2 试剂
人工模拟胃液:在100 mL PBS缓冲溶液中加入0.3 g胃蛋白酶,用0.1 mol/L的HCl调整pH值为2.5,0.22 μm无菌滤膜过滤后备用。
人工模拟肠液:配制0.65%(质量分数)的磷酸二氢钾溶液100 mL,使用NaOH溶液(0.1 mol/L)将此溶液的pH值调节至8.0,加入0.1 g胰蛋白酶和1.8 g的牛胆盐,0.22 μm无菌滤膜过滤后备用。
解囊剂:配制0.06 mol/L的柠檬酸钠溶液,121 ℃灭菌15 min后备用。
1.2 实验方法
1.2.1 菌体收集
以2%的接种量将植物乳杆菌IMAU10120-1接种于MRS液体培养基中,经37 ℃、18 h培养后,离心(4 000 r/min、5 min),菌泥用适量无菌生理盐水重悬,制得植物乳杆菌IMAU10120-1浓缩菌悬液,使其菌体浓度约达109 CFU/mL。
1. 2. 2 植物乳杆菌微胶囊的制备
把收集的菌泥和海藻酸钠溶液按体积比1∶10混合均匀后倒入耐压瓶中,使用微胶囊造粒仪(B-390型;步琦实验室设备贸易(上海)有限公司)经高频振荡将海藻酸钠和菌悬液的混合液体滴加到一定浓度的CaCl2溶液中,调整参数使液滴颗粒无连结且均匀,造粒结束后固化一定时间。离心得到样品,用生理盐水洗去微胶囊表面的CaCl2残留液,制得成品微胶囊,置于-20 ℃保存。
1.2.3 植物乳杆菌微胶囊制备条件的优化
1.2.3.1 海藻酸钠浓度的优化
选取质量分数为0.8%、1.2%、1.5%、1.8%、2.0%的海藻酸钠作为壁材,在CaCl2质量分数2%,固化时间10 min的条件下制备微胶囊,测定微胶囊包埋率,确定海藻酸钠的最佳浓度。
1.2.3.2 CaCl2浓度的确定
以最优浓度的海藻酸钠为壁材,CaCl2质量分数选择1%、1.5%、2%、2.5%、3%,固化时间10 min 的条件下进行微胶囊的制备,测定微胶囊包埋率,确定CaCl2 的最佳浓度。
1.2.3.3 固化时间的确定
选取最优浓度的海藻酸钠和CaCl2 溶液,固化时间选择10、20、30、40、50 min 进行微胶囊制备,测定微胶囊包埋率,确定微胶囊包埋的最佳固化时间。
1.2.3.4 正交试验
在单因素基础上,选择海藻酸钠浓度、CaCl2浓度以及固化时间为试验因素,通过正交分析法以植物乳杆菌微胶囊的包埋率为评价指标确定植物乳杆菌微胶囊的最佳制备工艺条件。
1.2.3.5 植物乳杆菌微胶囊包埋率的测定
将1 g植物乳杆菌微胶囊加入9 mL 0.06 mol/L的柠檬酸钠溶液内,置于摇床,37 ℃、180 r/min的条件下温育3 h后,进行活菌计数,包埋率的计算如公式(1)所示:
包埋率![]()
(1)
式中:N1为益生菌包埋后微胶囊中的总活菌数(每克微胶囊的含菌量与收集得到微胶囊总质量的乘积);N0为包埋前的总活菌数(每毫升浓缩菌液的含菌量与浓缩菌液体积的乘积)。
1.2.4 植物乳杆菌微胶囊形态的观察
通过光学显微镜观察微胶囊的结构:取少量微胶囊分散在载玻片中央,分摊均匀,在光学显微镜100倍的条件下观察微胶囊形态并拍照。
1.2.5 植物乳杆菌微胶囊在连续胃肠液条件的存活率
参考陈美瑄[10]的方法并加以改进:分别取1 g制备好的植物乳杆菌微胶囊和1 mL未包埋的游离菌液(空白对照)放入到9 mL的人工胃液内,在37 ℃ ,180 r/ min的条件下摇床振荡处理3 h后,测定活菌数,再将微胶囊和游离菌转入人工肠液内继续消化8 h 后取样测定存活率,存活率的计算如公式(2)、公式(3)所示:
人工胃液存活率![]()
(2)
人工肠液存活率![]()
(3)
式中:N0为0 h 的活菌数;N1为人工胃液处理3 h后的活菌数;N2为人工肠液处理8 h后的活菌数。
1.2.6 植物乳杆菌微胶囊在人工肠液中的释放率
参考TIAN等[11]的方法:取1 g制备好的植物乳杆菌微胶囊加入到9 mL的人工肠液内,在37 ℃、180 r/min的条件下摇床温育2. 5 h,并在0、30、60、90、120、150 min时取样计数。
1.3 数据统计与分析
以上实验都经过3次以上的重复实验验证,所有的数据均采用8.6 Origin lab数据分析软件进行分析。并且使用IBM SPSS Statistics 20以显著性水平为0.05进行数据分析,P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析
2.1 海藻酸钠浓度的确定
由图1可知,微胶囊的包埋率随着海藻酸钠浓度的增加,呈先升高后降低的趋势(P<0.05)。当海藻酸钠质量分数<1.8%时,植物乳杆菌微胶囊的包埋率较低,原因是海藻酸钠浓度较低,制得的微胶囊机械强度弱,菌体容易从微胶囊内流出[12]。当海藻酸质量分数为1.8%时,包埋率达到最高(56.08%)。当海藻酸钠质量分数>1.8%的时候,包埋率下降14.48%,可能是由于随着海藻酸钠添加量的增加,溶液黏度增大,制作微胶囊时难以从喷嘴中滴落,随着海藻酸钠质量分数的增大,壁材液密度和黏度也变大,不利于菌体的分散和包埋[13]。CH VARRI等[14]在制备双歧杆菌微胶囊的时发现,海藻酸钠质量分数为2%时包埋率最高(40.2%)。而本实验海藻酸钠质量分数为1.8%时包埋率最好,原因可能是由于不同制备方法造成的。本实验使用的微胶囊造粒仪喷嘴孔径较小,仅有300 μm,海藻酸钠浓度较大时黏度增加,制备过程中难以形成连续的球型液珠。综上所述,海藻酸钠最适添加量选择1.8%(质量分数)。
VARRI等[14]在制备双歧杆菌微胶囊的时发现,海藻酸钠质量分数为2%时包埋率最高(40.2%)。而本实验海藻酸钠质量分数为1.8%时包埋率最好,原因可能是由于不同制备方法造成的。本实验使用的微胶囊造粒仪喷嘴孔径较小,仅有300 μm,海藻酸钠浓度较大时黏度增加,制备过程中难以形成连续的球型液珠。综上所述,海藻酸钠最适添加量选择1.8%(质量分数)。

图1 不同海藻酸钠浓度对植物乳杆菌微胶囊包埋率的影响
Fig.1 The influence of different sodium alginate concentrations on the embedding rate of Lactobacillus plantarum microencapsules
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 CaCl2浓度的确定
由图2可知,随着CaCl2浓度的增加,微胶囊的包埋率呈先升高后降低的趋势(P<0.05),当CaCl2<2.5%时,包埋率逐渐升高;当质量分数达到2.5%时,包埋率最高(62.3%);随着CaCl2浓度的继续升高,包埋率下降。这可能是由于,当Ca2+浓度较低时,由于没有足够Ca2+与海藻酸钠结合,导致微胶囊机械强度较低,不利于菌体的包埋[15];而Ca2+浓度过高时,由于海藻酸的结合位点达到饱和,没有多余空间与Ca2+结合。因此,CaCl2浓度过高不仅不会增加包埋率,反而会增加溶液表面张力和密度,使得挤压出的液滴浮于表面,不易成珠[16]。周莉等[17]在制备保加利亚乳杆菌海藻酸钠微胶囊时发现,当CaCl2质量分数为2%,海藻酸钠质量分数为3%的时候,其包埋率最高,达78.96%;随着Ca2+浓度的增加,微胶囊包埋率逐渐增加,但当Ca2+浓度过高,包埋率则会有所下降,推测过高的Ca2+浓度会导致体系内与壁材反应的Ca2+相对较少,由于交联有限导致包埋率下降。由图2可知,对于植物乳杆菌IMAU10120-1,CaCl2质量分数为2.5%时包埋率最高,这可能是由于本研究使用的海藻酸钠浓度较低,需要更多的Ca2+与海藻酸相结合。综上所述,CaCl2的最适添加量选择2.5%(质量分数)。

图2 不同CaCl2浓度对植物乳杆菌微胶囊包埋率的影响
Fig.2 The influence of different calcium chloride concentration on the embedding rate of Lactobacillus plantarum microencapsules
2.3 固化时间的确定
如图3所示,随着固化时间的增加,微胶囊包埋率呈先升高后降低的趋势(P<0.05)。当固化时间<40 min时微胶囊的包埋率逐渐升高,原因是海藻酸钠与Ca2+结合不完全,微胶囊易破碎漏出菌体。当固化时间达到40 min时,其包埋率最高,达到了74.47%。而当固化时间>40 min时,包埋率下降,原因是固化时间较长可能会导致微生物死亡,从而导致包埋率下降[18]。郭宇星等[19]发现,海藻酸钠的Na+会与CaCl2中的Ca2+发生置换形成海藻酸钙凝胶,因此需要一定的置换反应时间,但如果置换时间过长,交联程度过高,小球内部结构紧密,影响基质的传递,导致细胞存活率降低。与本实验结果一致,因此,固化时间选择40 min。
2.4 植物乳杆菌微胶囊的正交试验
根据单因素试验,选择不同海藻酸钠添加量(1.5%、1.8%、2%,质量分数),不同CaCl2添加量(2%、2.5%、3%,质量分数),不同固化时间(20、30、40 min),以植物乳杆菌微胶囊的包埋率为评价指标,进行正交试验,以此筛选出植物乳杆菌微胶囊的最佳制备工艺,正交试验因素水平如表1 所示。

图3 不同固化时间对植物乳杆菌微胶囊包埋率的影响
Fig.3 The influence of different curing times on the embedding rate of Lactobacillus plantarum microencapsules
表1 正交试验因素水平表
Table 1 Factor of orthogonal experiment

水平因素A(海藻酸钠添加量)/%B(CaCl2添加量)/%C(固化时间)/min11.522021.82.53032340
在单因素直观分析中,极差R越大,该因素对指标的影响就越强。由表2可知,以植物乳杆菌微胶囊的包埋率为评价指标,R值大小顺序为:海藻酸钠添加量(A)>CaCl2添加量(B)>固化时间(C)。因此,确定海藻酸钠添加量为主要影响因素,其次是CaCl2添加量,最后是固化时间。最优制备工艺为A2B3C3,即海藻酸钠质量分数1.8%,CaCl2质量分数3.0%,固化时间40 min。此时的微胶囊包埋率最高,可达到85.1%,制得的微胶囊颗粒较为均匀且无明显黏结现象,因此选用上述条件为植物乳杆菌IMAU10120-1微胶囊的最佳制备工艺。
2.5 植物乳杆菌微胶囊的形态
采用B-390微胶囊造粒仪,通过调节振动频率和气压等参数,可高效制备出颗粒大小适中且均匀的植物乳杆菌微胶囊。由图4可知,植物乳杆菌微胶囊的形态大致呈球形,为白色颗粒,粒径边界清晰,平均粒径在300 μm左右;冻干后的微胶囊表面不规则,但依旧维持完整外观,无破碎裂纹等现象。王庆卫[20]使用扫描电子显微镜(scanning electron microscope,SEM)观察双歧杆菌微胶囊时发现,冷冻干燥后,海藻酸钠形成的壁壳外观较粗糙,推测微胶囊表面具有较多孔隙,与本实验结果相似。
表2 植物乳杆菌微胶囊在不同制备条件下的包埋率
Table 2 The embedding rates of Lactobacillus plantarum microencapsules under various conditions
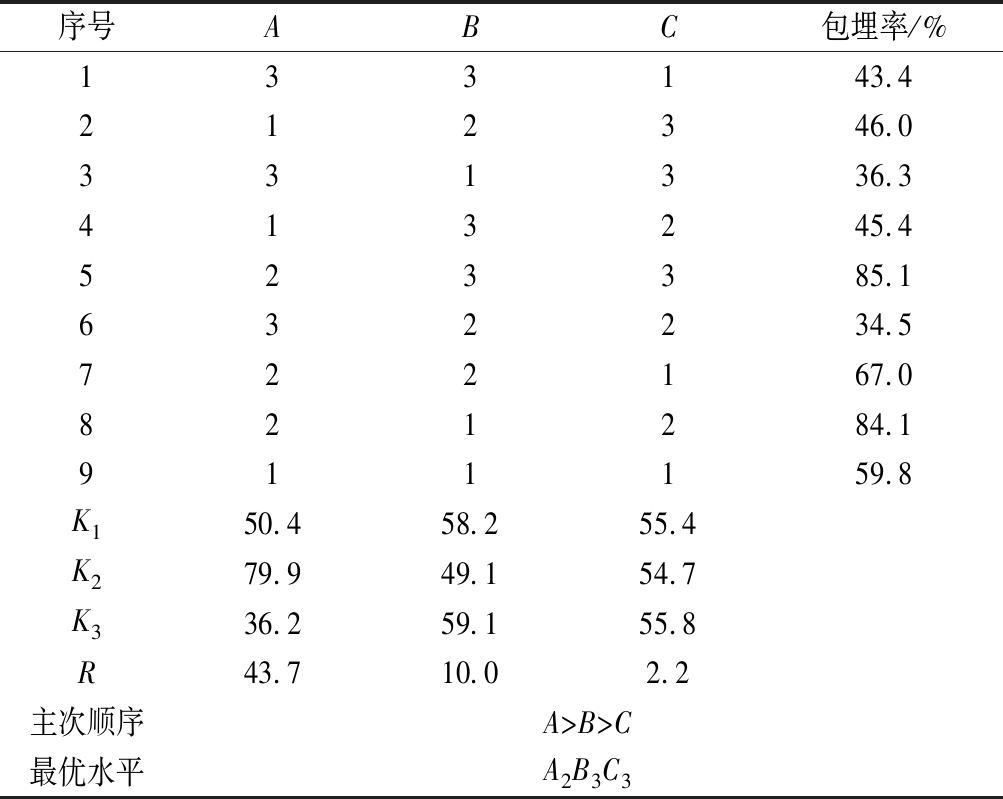
序号ABC包埋率/%133143.4212346.0331336.3413245.4523385.1632234.5722167.0821284.1911159.8K150.458.255.4K279.949.154.7K336.259.155.8R43.710.02.2主次顺序A>B>C最优水平A2B3C3

a-冻干前的植物乳杆菌微胶囊;b-冻干后的植物乳杆菌微胶囊
图4 植物乳杆菌微胶囊的扫描电子显微镜图
Fig.4 Scanning electron microscopy of Lactobacillus plantarum microencapsules
2.6 植物乳杆菌微胶囊肠溶性
微胶囊能够在肠道中完全释放,才能够发挥它的生理功能,结果如图5所示。植物乳杆菌IMAU10120-1微胶囊在不加牛胆盐的人工模拟肠液中处理60 min后,其活菌数维持在1.55×1010 CFU/mL,释放率达到95.00%,基本全部释放,说明本实验制备的微胶囊具有较好的肠溶性,60 min后能够完全释放。形成的原因可能是因为海藻酸钠是依赖Ca2+形成的可逆性凝胶,当外界环境存在更强的阴离子![]() 时,Ca2+便会与这种阴离子结合,导致海藻酸钙凝胶破裂[21]。刘月静等[22]制备鼠李糖乳杆菌微胶囊,在肠液内放置1.5 h后,活菌数量基本维持在4.3×107 CFU/g,本实验60 min可完全释放,表明不同的包埋材料的肠溶性不同,本实验微胶囊肠溶性相比较好。王庆卫[20]制备双歧杆菌微胶囊发现,经过人工肠液处理60 min后,微胶囊释放活菌数趋于平缓,维持在1×108 CFU/ml,证明菌体完全释放。与本实验结果相符,说明本实验制备的微胶囊具有较好的肠溶性。
时,Ca2+便会与这种阴离子结合,导致海藻酸钙凝胶破裂[21]。刘月静等[22]制备鼠李糖乳杆菌微胶囊,在肠液内放置1.5 h后,活菌数量基本维持在4.3×107 CFU/g,本实验60 min可完全释放,表明不同的包埋材料的肠溶性不同,本实验微胶囊肠溶性相比较好。王庆卫[20]制备双歧杆菌微胶囊发现,经过人工肠液处理60 min后,微胶囊释放活菌数趋于平缓,维持在1×108 CFU/ml,证明菌体完全释放。与本实验结果相符,说明本实验制备的微胶囊具有较好的肠溶性。

图5 植物乳杆菌微胶囊在人工模拟肠液中的肠溶性
Fig.5 The enterosolubility of Lactobacillus plantarum microencapsules in artificial simulated intestinal juice
2.7 植物乳杆菌微胶囊对人工胃肠液的耐受性
如表3所示,随着微胶囊和游离菌在胃液内处理时间的增加,两组的活菌数均有所降低(P<0.05)。未经包埋菌株在人工胃液处理3 h后,存活率仅有27.16%,活菌数下降了1.7×1010 CFU/mL,而微胶囊组存活率为85.68%,活菌数仅下降了4.0×109 CFU/mL,说明微胶囊包埋可以大大提高植物乳杆菌IMAU10120-1对胃液的耐受性。
将人工胃液处理3 h后的菌液及微胶囊转至pH 8.0的人工肠液中继续消化8 h后,微胶囊组的存活率仍高达79.36%,存活率仅下降6.32%;未包埋组则由于胆盐作用,存活率从27.16%下降到16.40%,下降了10.76%。说明经微胶囊化后,植物乳杆菌IMAU10120-1的肠液耐受性有一定提高。
RATHER等[23]将植物乳杆菌NCDC201游离菌及其微胶囊在胃液中处理90 min,游离菌下降了5个对数级,而微胶囊组仅下降2个对数级。朱莹丹[24]制备植物乳杆菌LIP-1微胶囊时发现,胃液处理90 min后,微胶囊组存活率为47.33%,未包埋组仅为16.01%,微胶囊化可对植物乳杆菌LIP-1起到较好的保护作用。本实验经胃液处理3 h后,微胶囊组仍有80%以上的存活率。综上所述,菌株微胶囊化后对人工模拟胃液具有一定的耐受作用。
表3 植物乳杆菌微胶囊在人工胃肠液中的存活率
Table 3 The survival rate of Lactobacillus plantarum microcapsules in continuous gastrointestinal juice

处理组0 h活菌数/(CFU·mL-1)3 h存活率/%8 h存活率/%未包埋组(2.43±0.09)×101027.16±0.018b16.40±0.03b微胶囊组(2.75±0.05)×101085.68±0.029a79.36±0.001a
注:不同小写字母表示不同组间差异显著(P<0.05)
3 结论
本实验以海藻酸钠为壁材,通过B-390微胶囊造粒仪制备植物乳杆菌微胶囊,成功制备出植物乳杆菌IMAU10120-1微胶囊,其最佳制备工艺为海藻酸钠添加量1.8%(质量分数),CaCl2添加量3.0%(质量分数),固化时间40 min,此条件下微胶囊包埋率最高。在不加胆盐的人工模拟肠液处理60 min,活菌数释放量达1.55×1010 CFU/mL。在人工胃液处理3 h后,其存活率达85.68%;继续在人工肠液处理8 h后,其存活率仍可达79.36%。本研究可为植物乳杆菌微胶囊包埋技术的开发及其在食品工业中的应用提供一定的数据和理论支持。
[1] 曹承旭, 郭晶晶, 乌日娜, 等.植物乳杆菌的生理功能和组学研究进展[J].乳业科学与技术, 2018, 41(1):33-39.
CAO C X, GUO J J, WU R N, et al.Advances in understanding the physiological function and omics of Lactobacillus plantarum [J].Journal of Dairy Science and Technology, 2018, 41(1):33-39.
[2] 陈婷, 王玉华, 蔡丹, 等.益生菌微胶囊技术研究进展[J].中国乳品工业, 2016, 44(1):31-37.
CHEN T, WANG Y H, CAI D, et al.Advances in wall materials and methods of probiotic microencapsulation[J].China Dairy Industry, 2016, 44(1):31-37.
[3] 何云侠. 干酪乳杆菌微胶囊的制备及应用[D].西安:陕西科技大学, 2019.
HE Y X.Preparation and application of Lactobacillus casei microcapsules[D].Xi′an:Shaanxi University of Science and Technology, 2019.
[4] MU R J, YUAN Y, WANG L, et al.Microencapsulation of Lactobacillus acidophilus with konjac glucomannan hydrogel[J].Food Hydrocolloids, 2018, 76:42-48.
[5] 宋娇娇, 包秋华, 王亚利, 等.瑞士乳杆菌MG9-2微胶囊的制备工艺优化及其性能分析[J].食品科学, 2017, 38(14):49-57.
SONG J J, BAO Q H, WANG Y L, et al.Optimization of preparation process and properties of microcapsules containing Lactobacillus helveticus MG9-2[J].Food Science, 2017, 38(14):49-57.
[6] 聂福贵. 厚垣普可尼亚菌微胶囊的研制[D].呼和浩特:内蒙古农业大学, 2019.
NIE F G.Preparation and study of microcapsule of Pochonia chlamydosporia[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[7] 李洪波, 李春爽, 张天琪, 等.干酪乳杆菌/乳糖醇双层合生元微胶囊制备及其在橙汁中的应用[J].中国食品学报, 2020, 20(4):93-99.
LI H B, LI C S, ZHANG T Q, et al.Preparation of Lactobacillus casei/lactitol synbiotic microcapsule and its application in orange juice[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(4):93-99.
[8] FRAKOLAKI G, KEKES T, LYMPAKI F, et al.Use of encapsulated Bifidobacterium animalis subsp.lactis through extrusion or emulsification for the production of probiotic yogurt[J].Journal of Food Process Engineering, 2022, 45(7):1-8.
[9] 王欢, 肖军霞, 黄国清, 等.微胶囊造粒仪制备青春双歧杆菌微胶囊[J].食品研究与开发, 2016, 37(21):92-97.
WANG H, XIAO J X, HUANG G Q, et al.Studies on preparation of Bifidobacterium adolescentis microcapsules using encapsulator B-395 Pro[J].Food Research and Development, 2016, 37(21):92-97.
[10] 陈美瑄.母乳中益生乳杆菌和双歧杆菌的初步筛选及特性研究[D].呼和浩特:内蒙古农业大学, 2020.
CHEN M X. Preliminary screening and characterization of probiotic Lactobacillus and Bifidobacteriumisolated from human breast milk[D]. Hohhot:Inner Mongolia Agricultural University, 2020.
[11] TIAN W J, SONG J J, WANG Y L, et al. Effect of different calcium salts and methods for triggering gelation on the characteristics of microencapsulated Lactobacillus plantarum LIP-1[J]. RSC Advances, 2015, 5(90):73 352-73 362.
[12] 张生生, 闫静芳, 陆兆新, 等. 锐孔凝固浴法制备表面活性肽微胶囊[J]. 食品工业科技, 2015, 36(12):221-225;230.
ZHANG S S, YAN J F, LU Z X, et al. The preparation of surfactin microcapsules by the method of piercing-solidifying [J].Science and Technology of Food Industry, 2015, 36(12):221-225;230.
[13] 李作美, 许晓云, 刘琦. 双歧杆菌微胶囊的制备及其理化性能[J]. 食品与发酵工业, 2020, 46(6):155-162.
LI Z M, XU X Y, LIU Q. Preparation and physical and chemical properties of Bifidobacterium microcapsules[J]. Food and Fermentation Industries, 2020, 46(6):155-162.
[14] CH VARRI M, MARA
VARRI M, MARA
 N I, ARES R, et al. Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions[J]. International Journal of Food Microbiology, 2010, 142(1-2):185-189.
N I, ARES R, et al. Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions[J]. International Journal of Food Microbiology, 2010, 142(1-2):185-189.
[15] ZHAO Y P, LIU S, FENG Y Q, et al. Development and optimization of attapulgite clay based microencapsulation for lactic acid bacteria by response surface methodology[J]. International Journal of Food Engineering, 2019, 15(8):21-25.
[16] CHANDRAMOULI V, KAILASAPATHY K, PEIRIS P, et al. An improved method of microencapsulation and its evaluation to protect Lactobacillus spp. in simulated gastric conditions[J].Journal of Microbiological Methods, 2004, 56(1):27-35.
[17] 周莉, 王晓瑞, 平洋, 等. 保加利亚乳杆菌微胶囊的制备及特性研究[J]. 食品工业科技, 2020, 41(11):188-193.
ZHOU L, WANG X R, PING Y, et al. Preparation and characterization of microcapsule Lactobacillus bulgaricus[J]. Science and Technology of Food Industry, 2020, 41(11):188-193.
[18] 马岩, 王艳杰, 陈昱凤. 复合壁材乳酸杆菌微胶囊的制备及其耐贮性和耐受性[J]. 农业工程, 2016, 6(3):54-58.
MA Y, WANG Y J, CHEN Y F.Preparation of compound wall material Lactobacillus microcapsule and its storability and tolerance[J]. Agricultural Engineering, 2016, 6(3):54-58.
[19] 郭宇星, 潘道东, 刘洋, 等.海藻酸钠固定瑞士乳杆菌条件优化[J]. 食品科学, 2012, 33(5):188-192.
GUO Y X, PAN D D, LIU Y, et al. Optimization of conditions for immobilization of Lactobacillus helveticus using sodium alginate[J]. Food Science, 2012, 33(5):188-192.
[20] 王庆卫. 内源乳化法制备双歧杆菌微胶囊的研究[D].无锡:江南大学, 2014.
WANG Q W. Study on the Bifidobacterium-loaded microcapsule prepared by internal emulsification method[D].Wuxi:Jiangnan University, 2014.
[21] 卢晓霆, 许中畅, 王田田, 等. 玉米多孔淀粉-海藻酸钠-壳聚糖-葡萄多酚缓释微胶囊的制备及表征[J]. 中草药, 2016, 47(13):2 252-2 259.
LU X T, XU Z C, WANG T T, et al.Preparation and characterization of sustained release microcapsules of grape polyphenols with porous cornstarch, alginate sodium, and chitosan[J]. Chinese Traditional and Herbal Drugs, 2016, 47(13):2 252-2 259.
[22] 刘月静, 闫杨, 王帅珂, 等. 鼠李糖乳杆菌肠溶性微胶囊的制备研究[J]. 聊城大学学报(自然科学版), 2019, 32(4):34-40.
LIU Y J, YAN Y, WANG S K, et al. Preparation of enteric microcapsulated of Lactobacillus rhamnosus[J].Journal of Liaocheng University (Natural Science Edition), 2019, 32(4):34-40.
[23] RATHER S A, AKHTER R, MASOODI F A, et al.Effect of double alginate microencapsulation on in vitro digestibility and thermal tolerance of Lactobacillus plantarum NCDC201 and L. casei NCDC297 [J]. LWT-Food Science and Technology, 2017, 83:50-58.
[24] 朱莹丹. 植物乳杆菌LIP-1微胶囊制备工艺及其性能的研究[D]. 呼和浩特:内蒙古农业大学, 2015.
ZHU Y D.Study on microencapsulation technologies and their characteristics for Lactobacillus plantarum LIP-1[D]. Hohhot: Inner Mongolia Agricultural University, 2015.