发酵肉制品是指原料肉在特定温度和湿度条件下,经微生物发酵或酶的作用而制成,具有较长货架期和特殊风味、质地、色泽的肉制品。亚洲是发酵鱼的主要市场,尤其是中国,发酵鱼类型有贵州和湖南地区的酸鱼、安徽地区的臭鳜鱼、广东地区的糟鱼、潮汕地区的鱼露、海南地区的鱼茶等[1]。
传统发酵鱼的生产工艺主要是以复杂的微生物群落为特征的自然发酵。自然发酵体系需要很长时间才能形成优势微生物群落,这已成为大多数传统发酵食品工业化生产的瓶颈[2]。自然微生物群落容易受到环境条件的影响和污染,如温度变化、腐败菌、致病菌等。YANG等[3]研究了水分、温度等生产因素对臭鳜鱼品质的影响,但仍难以生产出品质稳定的发酵鱼。接种发酵剂是提高发酵食品质量的常用策略[4-5],具有提高产品质量、缩短发酵时间、延缓变质和改善风味等优点。乳酸菌(lactic acid bacteria,LAB)作为流行的发酵剂,广泛用于各种食品的发酵,如肉类、鱼类和奶酪的生产。据报道[6],内源性弯曲乳杆菌LAB26和戊糖片球菌SWU73571能显著增加酸肉中乳酸菌数和氨基酸含量,且能抑制亚硝酸盐、生物胺、丙二醛(malondial- dehyde,MDA)等物质的产生。BAO等[2]的研究表明,内源性乳酸链球菌M10和食窦魏斯氏菌M3能快速适应臭鳜鱼生态变成优势菌群,抑制腐败菌的滋生和硫代巴比妥酸反应物、挥发性盐基总氮的增加,促进香气活性成分与关键挥发性成分的形成,可节省29%的发酵时间。GAO等[7]发现,接种植物乳杆菌可加快风味的形成,尤其是发酵鱼中的酯化与醇解生物合成途径。
水产品具有低脂肪、高蛋白等特点,极易发生脂肪和蛋白氧化,造成色泽变暗、弹性变差以及安全性降低等不良变化[8]。当前,生产企业通常使用人工抗氧化剂,如丁基羟基茴香醚、二丁基羟基甲苯和特丁基对苯二酚等来延长发酵鱼的货架期。但人工抗氧化存在食品安全风险[9-10],备受弊病。乳酸菌可作为一种食源性抗氧化剂进行应用,其自身的抗氧化活性已得到广泛证实。LI等[11]从中国传统香肠中分离出的植物乳杆菌C88具有良好的羟自由基和DPPH自由基清除活性;李默等[12]报道了希腊魏斯氏菌L23有较强的羟自由基、超氧阴离子自由基、DPPH自由基清除活性及脂质抗氧化能力,可作为天然高抗氧化发酵剂用于肉制品生产;HAN等[13]从哈尔滨干香肠中分离的弯曲乳杆菌R5和发酵乳杆菌R6能有效地抑制脂肪过氧化。另外,乳酸菌降解蛋白质形成的肽也有抗氧化活性[14]。
目前,我国利用乳酸菌发酵肉制品的研究多集中于香肠和火腿,对发酵鱼的研究较少。发酵鱼所用的发酵剂受多重因素影响,具有专一性,所以外源性商业化发酵剂不适用[15]。糟醉鱼是中国传统的发酵鱼制品,风味独特,倍受消费者喜爱。本文旨在以青占鱼为研究对象,从其自然发酵成品中筛选耐盐、产酸、抗氧化皆佳的乳酸菌菌株,为糟醉青占鱼的接种发酵提供优质的菌种资源。
1 材料与方法
1.1 材料与试剂
青占鱼[(200±20) g]、糯米、食盐、白酒;MRS琼脂培养基、MRS肉汤培养基,杭州微生物试剂有限公司;亚油酸(60%~70%)、三氯乙酸(trichloroacetic acid,TCA)、硫代巴比妥酸(thiobarbituric acid, TBA)、维生素E等,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
UV-4802紫外可见分光光度计,尤尼柯仪器有限公司;Docu-PH pH计,赛多利斯科学仪器有限公司;XSP-2C双目型生物显微镜,上海豫光仪器有限公司;StepOnePlus实时荧光定量PCR仪,美国应用生物系统公司。
1.3 实验方法
1.3.1 糟醉鱼制作
制备酒糟:浸糯米(20 ℃、18 h)、蒸饭(15~20 min)、淋饭(冷却后置于铝箔,约2 cm厚,撒少许凉开水)、拌曲(将适量白酒均匀喷在糯米上并拌匀)、入缸发酵(30~32 ℃,40~48 h)。制备糟醉鱼:将青占鱼去头、去尾、去内脏,切成约2 cm×3 cm块状,在150 g/L 的盐水中浸渍48 h,风干(湿度57%以下,温度18~22 ℃);酒糟中添加质量分数为5%的食盐和3%的白酒,拌匀。酒糟与青占鱼质量比为1.5∶1,以一层糟一层鱼的方式,在30 ℃下密封糟醉成熟。
1.3.2 乳酸菌的分离培养
参照文献[16]进行乳酸菌的分离培养。
1.3.3 菌落形态观察
挑选菌落分布较好的培养皿,肉眼观察培养皿中菌落的形态及特征。
1.3.4 乳酸菌的分离和纯化
选取溶钙圈较大的菌落,挑取并划线接种于MRS琼脂平板,(36±1) ℃培养48 h。重复上述操作,直至出现单个菌落。
1.3.5 乳酸菌的初步筛选
参照文献[17]进行革兰氏染色、镜检、过氧化氢试验及葡萄糖产酸产气试验。
1.3.6 乳酸菌体外抗氧化液的制备
将乳酸菌活化后接种于MRS肉汤培养基,(36±1)℃培养16 h。细胞培养液在4 ℃、10 000 r/min下高速离心10 min,离心后,细胞培养上清液即为乳酸菌体外抗氧化液。
1.3.7 乳酸菌抗脂质过氧化率测定
参照文献[18-19]进行抗脂质过氧化率测定。向0.5 mL 磷酸盐缓冲溶液(0.02 mol/L、pH 7.4)中加入亚油酸1 mL、10 g/L FeSO4溶液l mL、待测液0.5 mL,37 ℃ 水浴中反应1.5 h,加入40 g/L TCA溶液 0.2 mL、8 g/L TBA溶液2 mL,沸水浴中反应30 min,迅速冷却,离心,过滤,上清液于波长532 nm处测定吸光度。空白对照组为0.5 mL MRS肉汤培养基;调零组为0.5 mL磷酸盐缓冲溶液加等体积的细胞培养上清液;阳性对照组为不同质量浓度(0~1.0 g/L)的维生素E溶液。抗脂质过氧化率计算如公式(1)所示:
抗脂质过氧化率![]()
(1)
式中:A样品,细胞培养上清液的吸光度;A空白,MRS肉汤培养基的吸光度。
1.3.8 乳酸菌耐盐性测定
取0.1 mL活化后的菌液置于9.9 mL、NaCl质量分数分别为0%、2%、4%、6%的MRS肉汤培养基中,(36±1) ℃培养16 h。在波长600 nm处测定吸光度,以0%的菌液为空白对照组。
1.3.9 乳酸菌产酸能力测定
取0.1 mL活化后的菌液置于9.9 mL MRS肉汤培养基中,(36±1) ℃培养,24 h内测定培养基的pH值,每2 h测定1次。
1.3.10 乳酸菌生理生化鉴定试验
过氧化氢酶试验、二乙酰试验(Voges-Proskauer,V-P)、产H2S试验、葡萄糖产酸产气试验、精氨酸产氨试验、明胶液化试验、淀粉水解试验、石蕊牛奶试验、脲酶试验、葡聚糖试验和精氨酸水解试验,测试方法参照文献[20]。
1.3.11 乳酸菌16S rDNA鉴定试验
以细菌16S rRNA的通用引物27F和1541R扩增16S rDNA序列。(1)引物序列:27F(5′-AGA PTT TGA TCC TGG CTC AG-3′)和1541R(5′-ACG GCT ACC TTG TTA CGA CT-3′)。(2)PCR反应体系:25 ng模板,4 μmol/L引物,200 μmol/L dNTP,2.5 μL 10倍缓冲液,1.5 mmol/L MgC12,0.75 U DNA聚合酶,加双蒸水至25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃保持1 min,重复循环28次;最后72 ℃延伸5 min。
1.3.12 糟醉鱼感官评价
从色泽、滋味、糟香味、异味和质地5个指标来评定糟醉鱼的感官品质,总分为100分,感官评定标准见表1。滋味权重占25%;色泽、糟香味、异味次之,占20%;质地占15%。10名受专业培训的品评人员,品评前24 h内禁烟、禁酒、禁食刺激性食物。
表1 糟醉鱼的感官评定标准
Table 1 The sensory evaluation criteria for fermented drunk fish
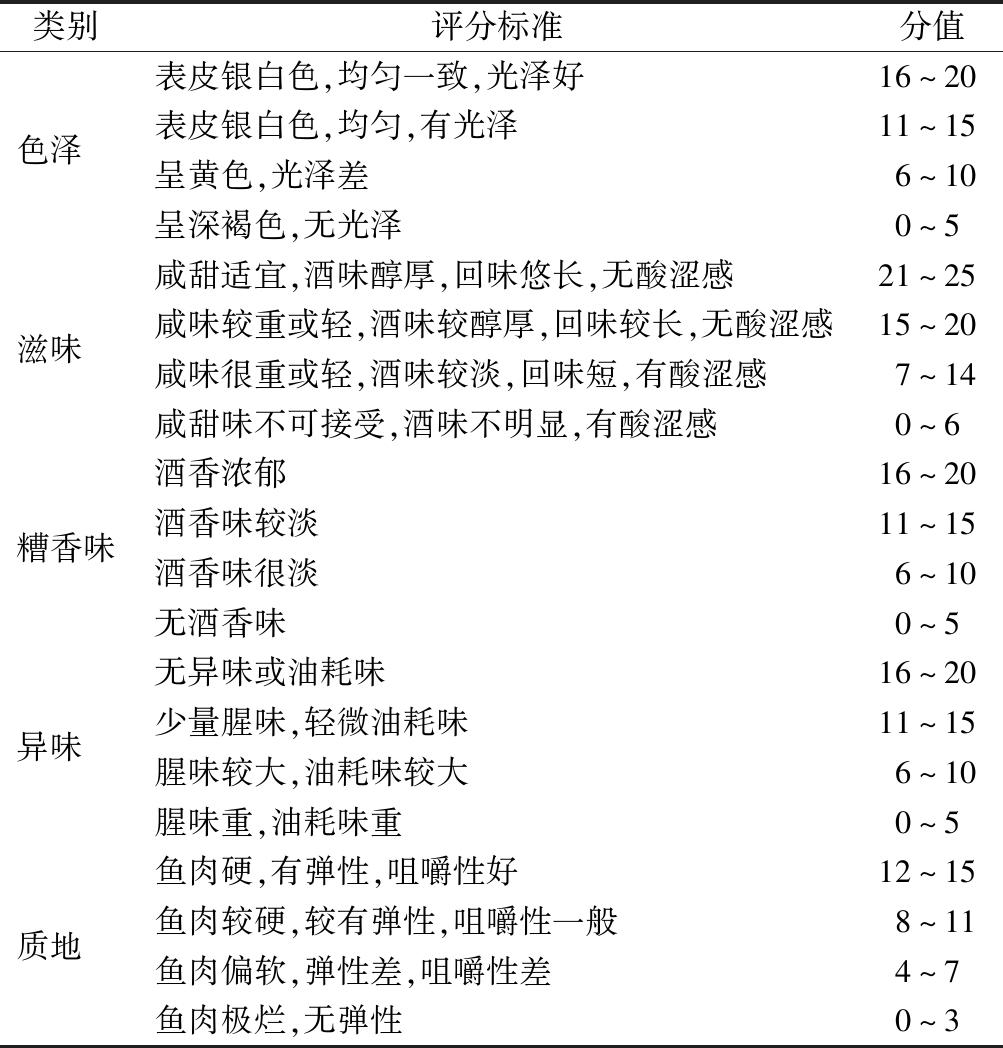
类别评分标准分值表皮银白色,均匀一致,光泽好16~20色泽 表皮银白色,均匀,有光泽11~15呈黄色,光泽差6~10呈深褐色,无光泽0~5咸甜适宜,酒味醇厚,回味悠长,无酸涩感21~25滋味 咸味较重或轻,酒味较醇厚,回味较长,无酸涩感15~20咸味很重或轻,酒味较淡,回味短,有酸涩感7~14咸甜味不可接受,酒味不明显,有酸涩感0~6酒香浓郁16~20糟香味酒香味较淡11~15酒香味很淡6~10无酒香味0~5无异味或油耗味16~20异味 少量腥味,轻微油耗味11~15腥味较大,油耗味较大6~10腥味重,油耗味重0~5鱼肉硬,有弹性,咀嚼性好12~15质地 鱼肉较硬,较有弹性,咀嚼性一般8~11鱼肉偏软,弹性差,咀嚼性差4~7鱼肉极烂,无弹性0~3
2 结果与分析
2.1 菌落形态观察
乳酸菌为厌氧或兼性厌氧菌,多分布于培养基中层或底层。乳酸菌菌落微小,直径约1.0~1.5 mm,呈乳白色或米黄色,不透明或半透明;菌落表面光滑、边缘整齐,多呈圆形或针尖形。基于上述特征,从自然糟醉鱼中分离出40株目标菌株。
2.2 乳酸菌的初步筛选
2.2.1 形态观察
将分离纯化后的40株目标菌株进行革兰氏染色,油镜下观察其形态特征。有33株为革兰氏阳性菌,5株为革兰氏阴性球菌,2株为革兰氏阴性杆菌。5株革兰氏阴性球菌呈成对状或短链状分布,无芽孢,无鞭毛。
2.2.2 过氧化氢酶试验
选择33株革兰氏阳性菌进行初步鉴定,经过过氧化氢酶试验判定,有20株呈阴性,13株呈阳性。
2.2.3 葡萄糖产酸产气试验
选择过氧化氢酶试验中呈阴性的20株革兰氏阳性菌进行葡萄糖产酸产气试验,结果显示,20株目标菌株初步判定为乳酸菌,且均可利用葡萄糖产酸,但不产气。
2.3 抗氧化乳酸菌株的筛选
抗脂质过氧化试验是检测抗氧性的常用方法。试验中亚油酸不饱和体系经Fe2+催化生成过氧化物,过氧化物继续分解生成次级氧化产物丙二醛,在酸性条件下与TBA反应生成红色缩合物,在波长532 nm处有强吸收峰,抗氧化性物质加入能够抑制红色产物的生成[18]。以不同浓度的维生素E 溶液为阳性对照,测定乳酸菌细胞培养上清液的抗脂质过氧化率,结果如图1所示。

图1 乳酸菌细胞培养上清液的抗脂质过氧化率和维生素E当量(n=3)
Fig.1 The anti-lipid peroxidation rate and vitamin E equivalent amount of LAB cell culture supernatant (n=3)
由图1可知,20株乳酸菌的抗脂质过氧化率均在29%以上,其中有13株(L1~L13)超过了50%,有7株(L1~L7)超过了60%;L1菌株最高,为77.05%,维生素E当量为0.69 g/L。
2.4 高耐盐乳酸菌株的筛选
发酵肉制品中的盐分较高。适量的盐分,不仅可以抑制致病菌和腐败菌的滋生,还能增强肉的保水力;但盐分也会直接影响肉制品中发酵菌株的生长[21],因此需要测试菌株的耐盐性。糟醉鱼中食盐的含量约为5%(质量分数),所筛选菌株应在5%及以上时生长良好。本试验模拟不同质量分数的NaCl条件,采用比浊法,在波长600 nm处测定菌液的吸光度,作为耐盐性评价指标。结果表明,有8株乳酸菌能在NaCl含量5%(质量分数)及以上发酵体系中存活,结果如图2所示。
从吸光度的变化趋势来看,盐分的增加对8株乳酸菌的生长均有不同程度的抑制作用。菌株L1、L5和L6的吸光度变化较为平稳,在NaCl含量为6%(质量分数)时,它们的吸光度仍在0.6以上,表明在高盐条件下L1、L5和L6仍具备良好的生长能力和耐受性。

图2 乳酸菌在不同NaCl含量下的生长情况
Fig.2 The growth situation of LAB in different mass fractions of NaCl
2.5 乳酸菌株产酸能力比较
产酸能力是衡量乳酸菌发酵剂性能的重要指标之一。乳酸菌产酸速度快可缩短发酵周期,迅速使其变成优势菌群,抑制腐败菌和致病菌的滋生,提高产品的生物安全性[22]。本试验将抗氧化与耐盐能力较好的菌株L1、L5和L6接种于MRS肉汤培养基,通过pH值的变化来比较三者的产酸能力,结果如图3所示。
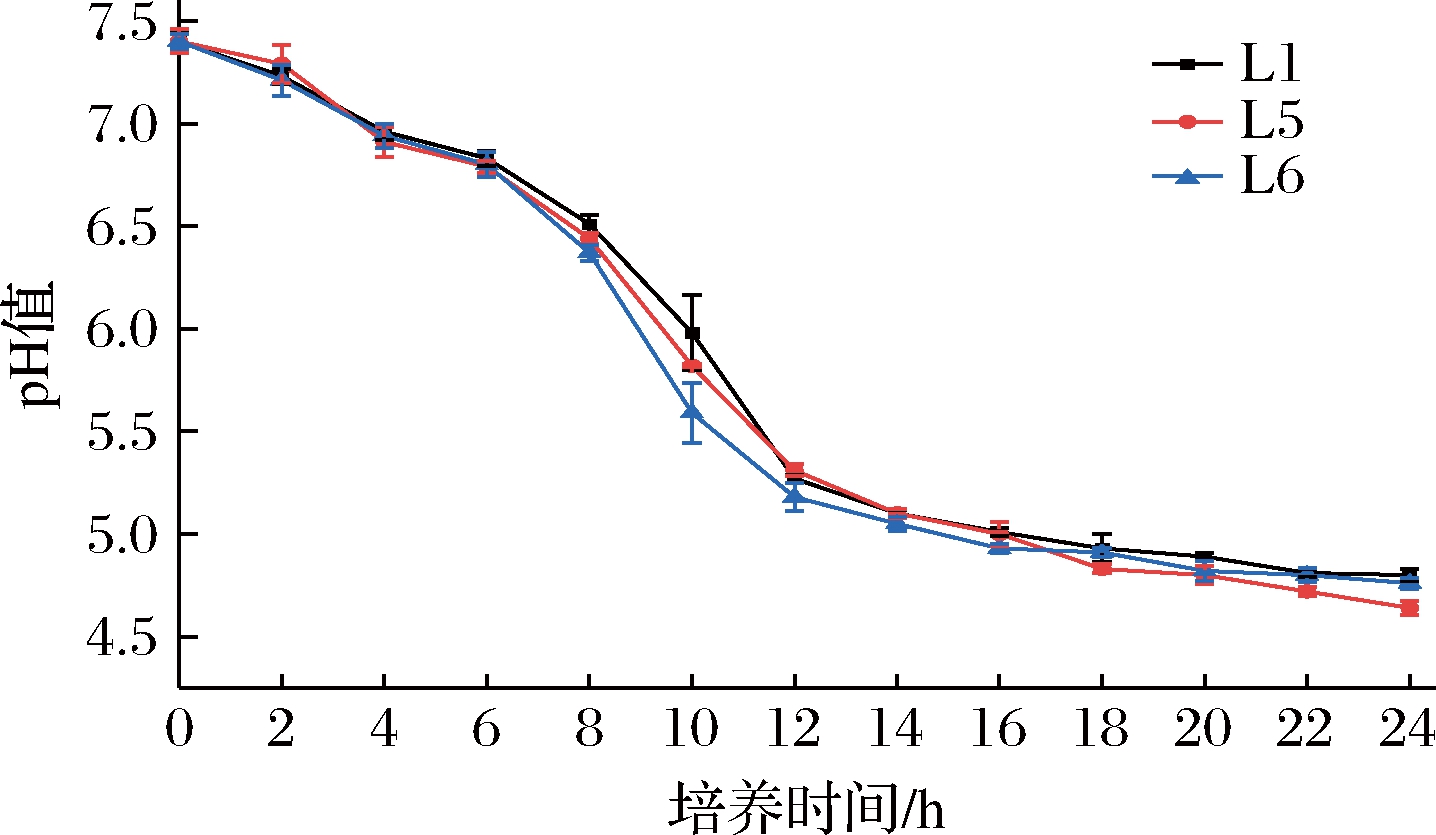
图3 乳酸菌在不同时间下的产酸能力曲线
Fig.3 The acid yield curve of LAB at different time
结果显示,L1、L5和L6均能在24 h内将pH值从7.4降至4.7左右,说明三者均具有较强的产酸能力;前6 h内,pH值下降缓慢,说明菌株可能正在适应此时的生长环境,故乳酸产量较低;从第6 h到第12 h,培养液的pH值下降迅速,表明菌株代谢旺盛产生了大量乳酸,致使培养液pH值迅速下降;12 h后,pH值再次下降缓慢,说明随着营养物质的大量消耗和毒性产物的大量积累,菌株生长代谢的速度放缓,已进入平稳期甚至是衰亡期。
为了评价L1、L5和L6产酸能力是否有显著差异,对MRS肉汤培养基pH值进行方差分析,结果如表2所示。
表2 MRS肉汤培养基pH值的方差分析
Table 2 Analysis of variance on the pH value of MRS broth

差异源平方和自由度均方F值P值临界值组间0.03720.0190.0170.9833.259组内38.439361.068总计38.47638
由表2可知,P值>0.05说明L1、L5和L6的MRS肉汤培养基pH值变化无显著差异,故三者产酸能力相当。
2.6 乳酸菌生理生化鉴定
经过氧化氢酶试验、V-P试验、产H2S试验等测试,菌株L1、L5和L6的生理生化特征如表3所示。
表3 菌株L1、L5和L6的生理生化特征
Table 3 Physiological and biochemical characteristics of strains L1, L5, and L6

菌株编号过氧化氢酶产酸产气产H2S精氨酸产氨明胶液化淀粉水解V-P石蕊牛奶脲酶葡聚糖精氨酸水解L1-+-----+++++L5-+-----+++++L6-+-----+++++
注:“+”表示试验结果显阳性,“-”表示试验结果显阴性
结果显示,菌株L1、L5和L6的生理生化特征完全一致,且该特征与肠球菌属最接近,具体参见《伯杰氏系统细菌学手册》[23]和《乳酸细菌分类鉴定及实验方法》[24]。
2.7 乳酸菌生理生化鉴定
16S rDNA是细菌染色体上编码16S rRNA相对应的序列,存在于所有细菌染色体基因中,其内部由保守区和可变区两部分组成;由于其分子内存在的可变区显示细菌不同分类等级水平的特异性,故可用利用保守区序列设计引物,将16S rDNA片段进行扩增,利用可变序列的差异对不同菌属、菌种的细菌进行分类鉴定[18]。经过DNA测序,L1、L5和L6的16S rDNA序列完全一致。NCBI在线BLAST进行同源性分析,该序列与耐久肠球菌(Enterococcus durans)相似度为100%。另外,用Mega11.0软件将三者与相关肠球菌属乳酸菌构建系统发育树,结果如图4所示。
L1、L5和L6与耐久肠球菌聚成一簇,同源性最为相近,置信度为92,表明L1、L5和L6均为耐久肠球菌。
2.8 发酵方式对感官品质的影响
菌株L1、L5和L6的耐盐性和产酸能力相当,但L1的抗氧化活性最强,更符合糟醉发酵的要求。为了比较自然发酵和接种发酵对糟醉鱼感官品质的影响,尝试将L1菌株与自然发酵后的酒糟混合(接种量为108 CFU/g),采用一层糟一层鱼的方式腌制,然后将自然发酵和接种发酵的试样置于30 ℃恒温培养箱中,发酵成熟。按照1.2.12评定标准对成品进行感官评定,并根据评定分数绘制雷达图,结果如图5所示。

图4 分离株与相关肠球菌属乳酸菌的系统发育树
Fig.4 The phylogenetic tree of three isolated strains and related Enterococcus LAB
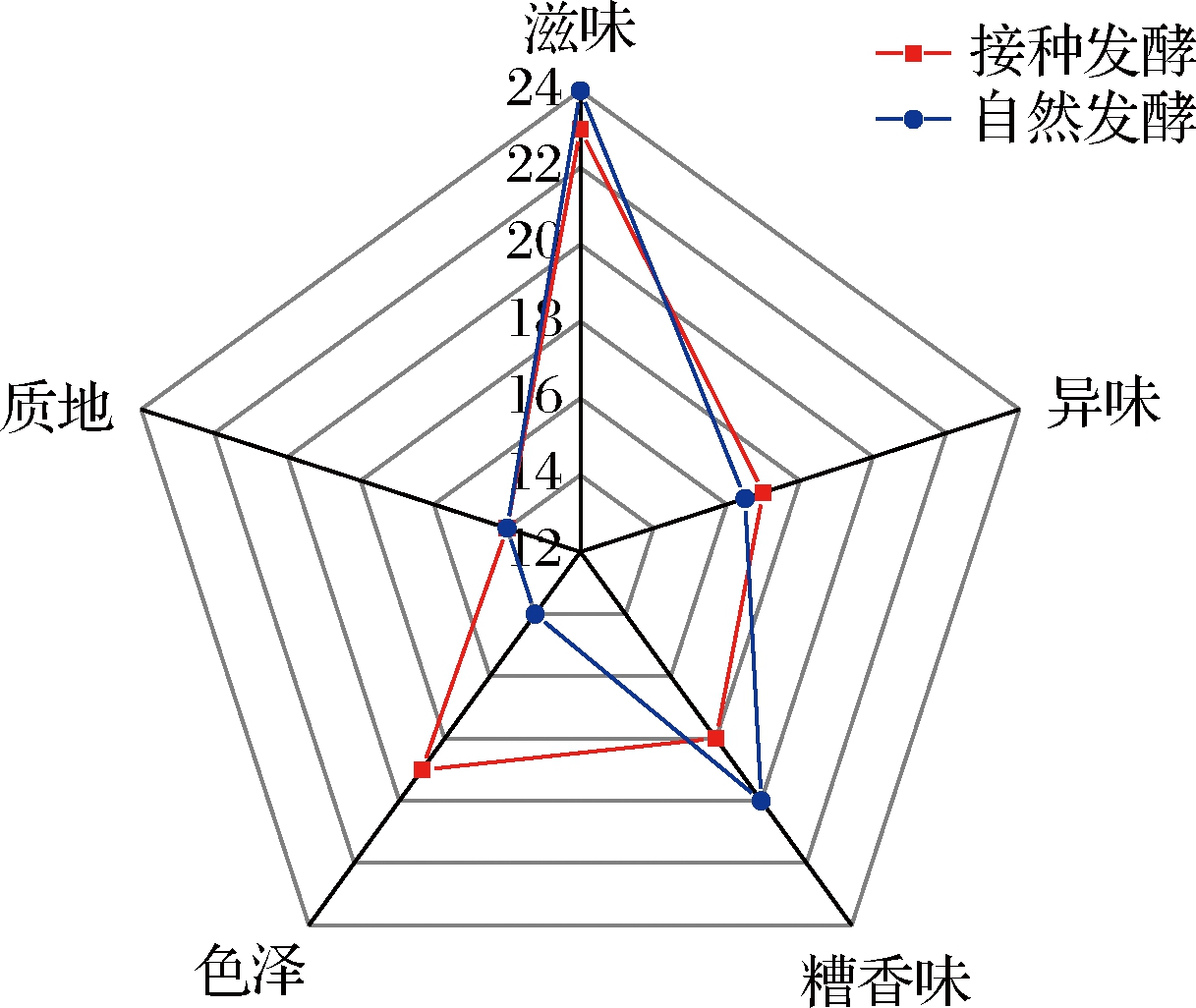
图5 两种不同发酵方式在糟醉鱼感官评价上的比较
Fig.5 The comparison of two different fermentation methods on sensory evaluation of fermented drunk fish
由图5可知,从色泽和异味看,尤其是色泽,自然发酵的氧化程度明显大于接种发酵,致使糟醉鱼表皮发黄并稍有异味(如油耗味),说明L1在一定程度上能够抑制脂肪的过度氧化;从滋味和质地看,两者相当,表明接种发酵能较好地保持糟醉鱼的原有特征;从糟香味看,接种发酵的稍淡,可能是接种发酵的肉质稍微松软,导致对易挥发醇类物质的吸附力下降。总体上,接种L1菌株对糟醉鱼的感官品质有明显的提升作用。
3 结论
从试验结果来看,有3株耐久肠球菌符合糟醉鱼的发酵要求;其中L1的抗氧化活性最高,其抗脂质氧化率达77.05%。经专业人员品评,L1接种发酵的成品较好地保持了糟醉鱼的原有特征,且色泽和异味优于自然发酵。L1能有效地抑制脂肪的过度氧化,对糟醉鱼的感官品质有显著提升作用,可作为糟醉鱼接种发酵的菌种资源。但接种L1也减弱了成品的糟香味,后续拟基于糟醉鱼的香气成分分析,尝试通过优化工艺参数来改善糟醉鱼的风味品质。
[1] 胡锦鹏, 吴曼铃, 时瑞, 等.乳酸菌在发酵鱼制品加工中的应用研究概述[J].食品与发酵工业, 2020, 46(9):285-289.
HU J P, WU M L, SHI R, et al.Research progress on lactic acid bacteria in production of fermented fish[J].Food and Fermentation Industries, 2020, 46(9):285-289.
[2] BAO R Q, LIU S S, JI C F, et al.Shortening fermentation period and quality improvement of fermented fish, Chouguiyu, by co-inoculation of Lactococcus lactis M10 and Weissella cibaria M3[J].Frontiers in Microbiology, 2018, 9:3003.
[3] YANG S, HE Y L, YAN Y, et al.Textural properties of stinky mandarin fish (Siniperca chuatsi) during fermentation:Effects of the state of moisture[J].International Journal of Food Properties, 2017, 20(sup2):1 530-1 538.
[4] DE ALMEIDA M A, SALDA A E, DA SILVA PINTO J S, et al.A peptidomic approach of meat protein degradation in a low-sodium fermented sausage model using autochthonous starter cultures[J].Food Research International(Ottawa, Ont.), 2018, 109:368-379.
A E, DA SILVA PINTO J S, et al.A peptidomic approach of meat protein degradation in a low-sodium fermented sausage model using autochthonous starter cultures[J].Food Research International(Ottawa, Ont.), 2018, 109:368-379.
[5] XU Y S, LI L, REGENSTEIN J M, et al.The contribution of autochthonous microflora on free fatty acids release and flavor development in low-salt fermented fish[J].Food Chemistry, 2018, 256:259-267.
[6] ZHANG Y L, HU P, XIE Y Y, et al.Co-fermentation with Lactoba- cillus curvatus LAB26 and Pediococcus pentosaceus SWU73571 for improving quality and safety of sour meat[J].Meat Science, 2020, 170:108240.
[7] GAO P, JIANG Q X, XU Y S, et al.Biosynthesis of acetate esters by dominate strains, isolated from Chinese traditional fermented fish(Suan yu)[J].Food Chemistry, 2018, 244:44-49.
[8] 丁丽丽, 吕欣然, 高永悦, 等.鱼肠道中抗氧化活性乳酸菌的筛选及鉴定[J].食品科学, 2021, 42(10):127-132.
DING L L, LYU X R, GAO Y Y, et al.Screening for and identification of lactic acid bacteria with antioxidant activity from the intestinal tract of fish[J].Food Science, 2021, 42(10):127-132.
[9] KARRE L, LOPEZ K, GETTY K J K.Natural antioxidants in meat and poultry products[J].Meat Science, 2013, 94(2):220-227.
[10] HALLIWELL B, AESCHBACH R, LÖLIGER J, et al. The characterization of antioxidants[J]. Food and Chemical Toxicology, 1995, 33(7):601-617.
[11] LI S Y, ZHAO Y J, ZHANG L, et al. Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J].Food Chemistry, 2012, 135(3):1 914-1 919.
[12] 李默, 朱畅, 赵冬兵, 等. 发酵肉制品中高抗氧化肉品发酵剂的筛选鉴定[J].食品科学, 2017, 38(12):83-88.
LI M, ZHU C, ZHAO D B, et al. Screening and identification of meat starters with high antioxidant activity from fermented meat products[J].Food Science, 2017, 38(12):83-88.
[13] HAN Q, KONG B H, CHEN Q, et al.In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics[J]. Journal of Functional Foods, 2017, 32:391-400.
[14] NAJAFAN L, BABJI A S. Fractionation and identification of novel antioxidant peptides from fermented fish (pekasam)[J]. Journal of Food Measurement and Characterization, 2018, 12 (3):2 174 -2 183.
[15] KOSE S, HALL G M. Fish Processing:Sustainability and New Opportunities[M].1th ed. Oxford:Blackwell Publishing Ltd, 2011:138-166.
[16] 刘慧. 现代食品微生物学实验技术[M].北京:中国轻工业出版社, 2006:248-252.
LIU H.Modern Experiment Technology of Food Microbiology[M].Beijing:China Light Industry Press, 2006:248-252.
[17] 刘晓蓉, 邓毛程, 连晓蔚. 腌肉中乳酸菌的分离选育[J].中国酿造, 2009, 28(1):46-48.
LIU X R, DENG M C, LIAN X W. Isolation and selection of lactic acid bacteria from cured meat[J].China Brewing, 2009, 28(1):46-48.
[18] 吴祖芳, 洪松虎, 沈锡权, 等.乳酸菌高抗氧化活性菌株的筛选及鉴定[J].中国食品学报, 2010, 10(1):73-78.
WU Z F, HONG S H, SHEN X Q, et al. Screening and identification of lactic acid bacteria stains with high antioxidative activity [J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(1):73-78.
[19] KULLISAAR T, SONGISEPP E, MIKELSAAR M, et al. Antioxidative probiotic fermented goats′ milk decreases oxidative stress-mediated atherogenicity in human subjects[J]. The British Journal of Nutrition, 2003, 90(2):449-456.
[20] 盛海圆. 传统泡菜中乳酸菌的分离鉴定及其多样性分析[D]. 合肥:安徽农业大学, 2010.
SHENG H Y. Identification and the biodiversity of lactic acid bacteria from the traditional fermented vegetable[D]. Hefei: Anhui Agricultural University, 2010.
[21] 褚福娟, 孔保华, 黄永. 发酵肉制品常见乳酸菌的发酵性能研究[J]. 肉类研究, 2009, 23(6):16-20.
CHU F J, KONG B H, HUANG Y. Fermentation property of common lactic acid bacteria isolated from fermented meat products[J]. Meat Research, 2009, 23(6):16-20.
[22] GESSESSEL A E.A survey on the function of lactic acid bacteria in milk fermentation and preservation[J]. Journal of Applied Bacteriology, 2015, 3(6):323-327.
[23] BUKANNKN R E, JIBENSI N E. 伯杰氏系统细菌学手册[M]. 第8 版.北京:科学出版社, 1984:660-727.
BUKANNKN R E, JIBENSI N E. Berger′s Manual of Systematic Bacteriology[M]. 8th ed. Beijing:Science Press, 1984:660-727.
[24] 凌代文, 东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社, 1999:33-45.
LING D W, DONG X Z. Classification, Identification and Experimental Method of Lactic Acid Bacteria[M]. Beijing:China Light Industry Press, 1999:33-45.