便秘是临床常见的消化道症状,主要表现为排便减少(3 次/周)、大便干硬、排便困难[1],《国际疾病分类(ICD-10)应用指导手册》将便秘列为独立病种[2]。根据便秘的形成原因,可分为先天性便秘、特发性便秘和继发性便秘。特发性便秘,又称功能性便秘(functional constipation,FC),是一种不属于器质性病变的便秘。功能性便秘的药物治疗常用膨松剂、渗透泻药、粪便软化剂等[3]。然而,不同患者对药物治疗的满意度不同,副作用也给药物治疗带来了新的麻烦[4-5]。因此,改善便秘的特殊饮食越来越受欢迎[6]。
发酵在很早以前就被用于人类消费和食品生产,发酵过程不仅有利于延长食品、饮料的保质期,而且可以安全有效地提高营养价值[7]。发酵食品食用相对方便,营养成分丰富,多数脂肪含量低,风味、香气和质地多样[8]。正是由于发酵技术及其相关的传统食品的产生,使得果蔬产品的高蛋白膳食成分被应用,这些食品提供了丰富的、高质量营养素,且易被接受。发酵蔬果产品富含人体所需的微生物代谢物(如乳酸和氨基酸),提高膳食营养价值。发酵还可以帮助去除或转化食物中的有毒成分,如植物中的植酸[9-10]。针对发酵食品的健康功效研究,包括抗便秘、抗肥胖、抗癌、促进结直肠健康、降低胆固醇、抗氧化、抗衰老、促进纤维分解以及促进免疫和皮肤健康[11-14]。近年来,食品和营养科学家开始提供更有力的证据,证明食用发酵产品对几种慢性疾病可能产生积极影响[15]。这些好处都归功于微生物本身和它们在食物中产生的代谢物。此外,人类微生物群对宿主健康的重要性以及它们之间主要通过肠道微生物相互作用的方式也得到了阐明[16],其化学成分和微生物代谢产物在调节肠道菌群和增强免疫力方面起着重要作用。发酵果蔬汁的通便作用已有报道[17-18],其作用机制归因于2个方面:一是发酵果蔬汁富含膳食纤维,水不溶性膳食纤维具有较强的持水力,使粪便柔软易于排出;二是水溶性膳食纤维易被肠道菌群酵解,产生短链脂肪酸,降低肠内pH值,同时与酵解产物甲烷、CO2等气体共同刺激肠黏膜、促进肠道蠕动[19]。但对于发酵果蔬汁干预对肠道菌群的影响研究较少,WANG等[20]研究指出正常小鼠干预发酵果蔬汁后的肠道菌群变化,厚壁菌门与拟杆菌门的相对丰度比例降低,Prevotellaceae、Bacteroidales_S24-7_group、Bacteroidaceae和 Bacteroides等菌的相对丰度出现上升趋势。针对发酵果蔬汁干预便秘小鼠后肠道菌群的变化情况尚无研究报道。
以无花果为主要原料,通过特定的发酵工艺生产出果蔬汁,对其提高免疫力和清除自由基的作用已有研究,但以便秘小鼠为模型,考察其对于小鼠肠道微生物群的影响未见报告。因此,本研究在建立功能性便秘的实验动物模型的基础上,探索发酵果蔬汁的通便作用,解读其对于肠道菌群的影响,为开发利用发酵果蔬汁产品提供科学依据。
1 材料与方法
1.1 材料与试剂
供试样品,以无花果为主要原料,通过特定的发酵工艺生产出果蔬汁,宁波晓宽生物科技有限公司;蒽酮、硫酸、MgCl2、无水乙醇、AlCl3·6H2O、乙酸钾、维生素C稳定液(10 mg/mL)、福林酚试剂、Na2CO3,均为分析纯,国药集团化学试剂有限公司;甲醇、乙腈,均为色谱纯,赛默飞世尔科技(中国)有限公司;DNA分离提取(MOBIO PowerSoil DNA Isolation)试剂盒,深圳市安必胜科技有限公司,微生物16S基因靶向测序由深圳谱元科技有限公司完成。
1.2 仪器与设备
Milli-Q Integral5水处理系统,默克密理博有限公司;Allegra25R离心机,贝克曼库尔特商贸(中国)有限公司;Thermo Scientific 2842水浴锅、超高效液相色谱-四级杆静电场轨道阱质谱仪(ultra-high performance liquid chromatography quadrupole Orbitrap mass spectrometry,UPLC-Q-Exactive)、Xcalibur工作站,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 高分辨质谱结合化学计量学方法分析发酵果蔬汁样品成分
精密量取发酵果蔬汁样品2 mL至250 mL容量瓶,加去离子水稀释100倍,混合均匀后静置10 min,取10 mL样品经3 000 r/min离心5 min,上清液过0.22 μm滤膜,待测。
色谱条件:固定相为Thermo Fisher Accucore Vanquish-C18(2.1 mm×50 mm,1.7 μm)色谱柱,流动相A为乙腈溶液,流动相B为0.3%(体积分数)乙酸水溶液,梯度洗脱,条件如下:0~45 min,4%~40%乙腈;45~55 min,40%~95%乙腈;55~60 min,95%~4%乙腈,流速0.3 mL/min,柱温35 ℃,进样量10 μL。
质谱条件:UPLC-Q-Exactive质谱仪,鞘气流速50 arb,辅助气流速15 arb,喷雾电压3 500 V,离子传输毛细管温度320 ℃,辅助气加热温度300 ℃,全扫描模式,质量扫描范围m/z 50~1 500 u。离子响应大于100 cps进行二级质谱信息采集:碰撞能量40 V,开启动态背景扣除。
1.3.2 动物通便实验
1.3.2.1 实验动物及分组
实验动物选择:BALB/c成年雄性小鼠,体重(20±2) g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0006,饲养于SPF级动物房。
SPF级动物房:室温(22±2) ℃,相对湿度40%~70%,12 h人工照明/黑暗循环,换气次数15 次/h。小鼠自由摄食并饮水,适应1周后进行试验。
实验分组:雄性BALB/c小鼠随机分为5组,每组10只,设置空白对照组(BC组)、模型对照组(MC组)、低剂量干预组(5 mL/kg BW,LI组)、中剂量干预组(10 mL/kg BW,MI组)、高剂量干预组(20 mL/kg BW,HI组)3个剂量组。
1.3.2.2 实验方法及指标测定
连续经口给予发酵果蔬汁样品及蒸馏水7 d,各组小鼠禁食16 h,MC组和各干预组小鼠灌胃给予复方地芬诺酯(5 mg/kg BW),灌胃量为0.4 mL/(20 g BW),BC组小鼠灌胃给予等量蒸馏水。灌胃复方地芬诺酯及给予蒸馏水0.5 h后,各干预组分别灌胃含相应样品的墨汁,灌胃量为0.4 mL/(20 g BW),BC组和MC组小鼠灌胃等量墨汁,正常饮水禁食,从灌墨汁开始,观察记录每只小鼠首粒排出黑便时间、6 h内小鼠排黑便粒数。
1.3.3 肠道菌群测定
实验过程中,各组小鼠单笼饲养,在给予受试样本前,无菌采取小鼠粪便0.1 g、最后一次给予受试样品后24 h,与实验前同样方式取直肠粪便,均存于取样管中(内含裂解液和稳定液),由深圳谱元科技有限公司完成肠道微生物16S基因靶向测序分析[21]。具体方法为:使用细菌DNA提取试剂盒(DP302)提取小鼠肠道内容物的细菌基因组,经NanoDrop2000测定选择DNA质量浓度为20 ng/μL的样本进行下一步PCR扩增。基因组通过PCR进行扩增,得到细菌16S rRNA基因的V4~V5区。扩增子经2%琼脂糖凝胶电泳后凝胶回收提取,使用AxyPrep DNA凝胶提取试剂盒,按照说明进行纯化,采用QuantiFluorTM-ST (Promega,U.S.)进行定量。纯化后的扩增子汇集在等分子质量的测序池中,使用Illumina MiSeq进行配对测序(2×PE300)。原始fastq文件使用QIIME(1.17版)进行质量过滤。具有97%相似性的序列通过UPARSE(版本7.1 http://drive5.com/uparse/)聚类为一个操作单元(operational taxonomic unit,OTU),并使用UCHIME识别和去除嵌合体序列。使用RDP分类器(http://rdp.cme.msu.edu/)对置信阈值为70%的silva (SSU115)16S rRNA数据库中每个16S rRNA基因序列的系统发育亲缘关系进行分析及注释。
1.4 数据处理
质谱数据:UPLC-Q-Exactive质谱仪采集数据后导入Compounds Discovery软件,噪音过滤、自动排除无用峰等,对数据降维。其中质谱数据稳定性和可靠性由质量控制样本控制。
谱库筛查:利用Compounds Discovery软件,同时参照化合物的同位素分布和精确质量数匹配信息,结合化合物的二级质谱信息,利用mzVault(含1 200多种植物化合物标准品一级、二级碎片质谱图信息、mzCloud(化合物高精确质量数碎片数据库)、ChemSpider等数据库进行化合物谱库匹配。
所有数据结果采用平均数±标准差表示,使用SPSS 20.0进行ANOVA分析,P<0.05为差异具有统计学意义,P<0.01、P<0.001为差异具有高度统计学意义。采用GraphPad Prism 9.0软件作图。
2 结果与分析
2.1 发酵果蔬汁成分分析结果
通过快速质谱分析和化学计量学方法,对发酵果蔬汁中可能含有的活性成分进行预测。化合物匹配结果(匹配分数均大于85分),见表1。发酵果蔬汁含有丰富的黄酮类化合物、酚类(酚酸类)、较高的超氧化物歧化酶活性,同时存在较多的有机酸、氨酸酯类物质、糖类物质。这与前人研究结果一致[22-23],归因于发酵果蔬汁的原料特性。酚类化合物大多数能够到达结肠,被微生物利用产生次级代谢产物,次级代谢产物被机体吸收,从而产生生理效应。发酵过程中,糖基化酚化合物在水解酶作用下,脱去糖基转化为酚类化合物、简单黄酮醇化合物等,游离酚类化合物更易发挥抗氧化作用。
表1 发酵果蔬汁成分匹配结果
Table 1 The component of fermented fermented
fruit and vegetable juice
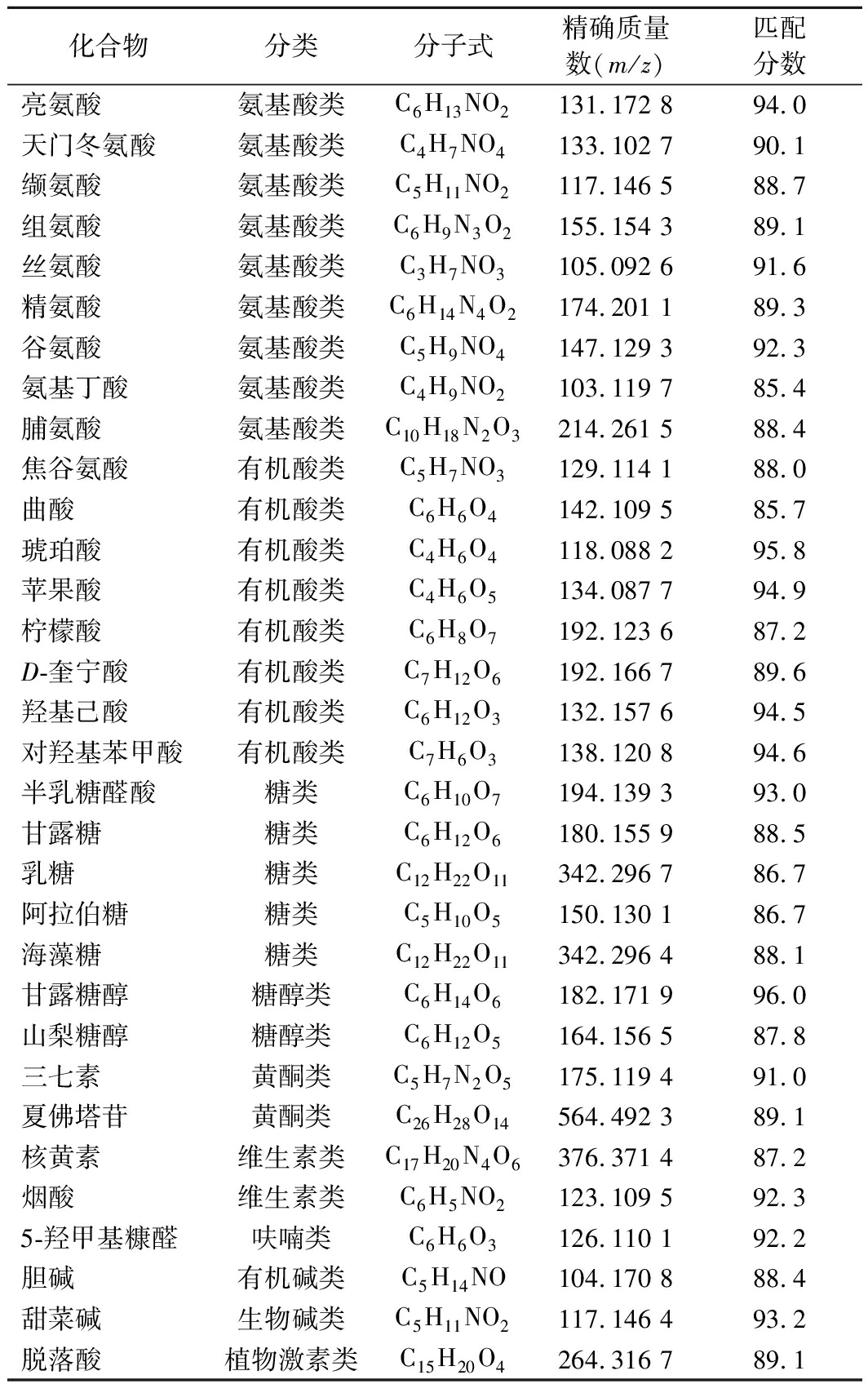
化合物分类分子式精确质量数(m/z)匹配分数亮氨酸 氨基酸类C6H13NO2131.172 894.0天门冬氨酸氨基酸类C4H7NO4133.102 790.1缬氨酸氨基酸类C5H11NO2117.146 588.7组氨酸氨基酸类C6H9N3O2155.154 389.1丝氨酸氨基酸类C3H7NO3105.092 691.6精氨酸氨基酸类C6H14N4O2174.201 189.3谷氨酸氨基酸类C5H9NO4147.129 392.3氨基丁酸氨基酸类C4H9NO2103.119 785.4脯氨酸氨基酸类C10H18N2O3214.261 588.4焦谷氨酸有机酸类C5H7NO3129.114 188.0曲酸有机酸类C6H6O4142.109 585.7琥珀酸 有机酸类C4H6O4118.088 295.8苹果酸有机酸类C4H6O5134.087 794.9柠檬酸 有机酸类C6H8O7192.123 687.2D-奎宁酸有机酸类C7H12O6192.166 789.6羟基己酸有机酸类C6H12O3132.157 694.5对羟基苯甲酸有机酸类C7H6O3138.120 894.6半乳糖醛酸糖类C6H10O7194.139 393.0甘露糖糖类C6H12O6180.155 988.5乳糖糖类C12H22O11342.296 786.7阿拉伯糖糖类C5H10O5150.130 186.7海藻糖 糖类C12H22O11342.296 488.1甘露糖醇糖醇类C6H14O6182.171 996.0山梨糖醇糖醇类C6H12O5164.156 587.8三七素 黄酮类C5H7N2O5175.119 491.0夏佛塔苷黄酮类C26H28O14564.492 389.1核黄素维生素类C17H20N4O6376.371 487.2烟酸维生素类C6H5NO2123.109 592.35-羟甲基糠醛呋喃类C6H6O3126.110 192.2胆碱有机碱类C5H14NO104.170 888.4甜菜碱生物碱类C5H11NO2117.146 493.2脱落酸植物激素类C15H20O4264.316 789.1
2.2 小鼠通便实验结果分析
实验小鼠给予不同浓度发酵果蔬汁14 d后,各组小鼠的状态均未有明显改变,精神状态良好,毛色及行动正常,体重没有显著差异。与BC组小鼠相比,各剂量组小鼠粪粒正常,为褐黄色麦粒状,各组小鼠没有腹泻现象。
由图1可以看出,与MC组相比,MI组可以显著缩短首粒黑便时间,由MC组的(111±19) min缩短为(92±15) min。6 h黑便粒数在LI、MI、HI组中分别为(20.83±5.98)、(21.82±5.89)和(27.70±5.11),呈明显剂量依赖性,且均高于MC组(19.17±2.52)。以上结果说明,发酵果蔬汁干预有助于促进小鼠肠道蠕动和提高排便量。一方面,发酵果蔬汁中的脂肪类有机酸(琥珀酸、柠檬酸、苹果酸等)对墨汁在小鼠小肠的运动有明显的促进作用[24];另一方面由水不溶性膳食纤维和水溶性膳食纤维共同作用,对粪便本身的含水量、体积等产生影响,同时对肠道微环境产生影响[18],从而发挥辅助通便的作用。
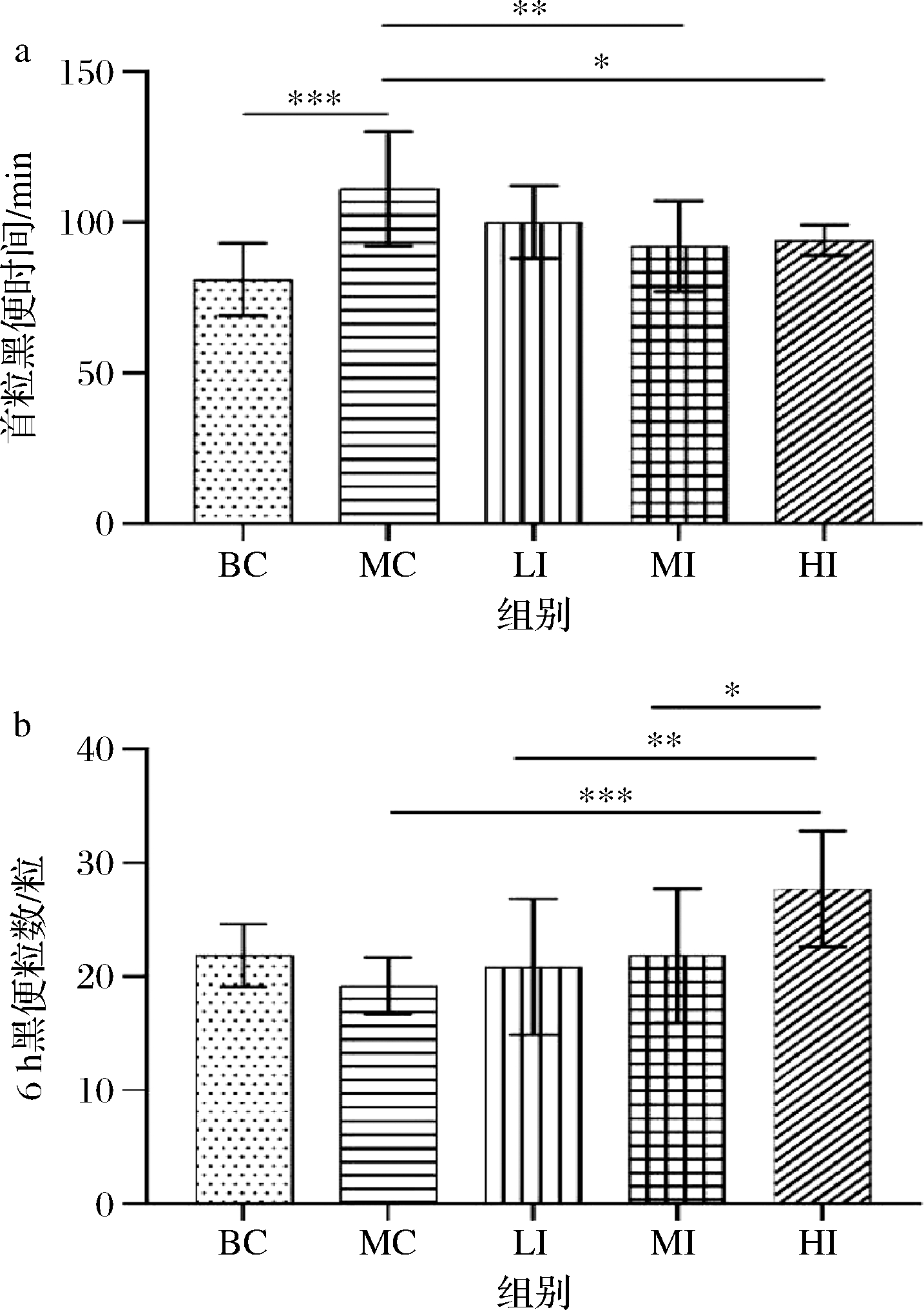
a-首粒黑便排出时间;b-6 h排出黑便粒数
图1 各组小鼠首粒黑便排出时间和6 h排出黑便粒数
Fig.1 The time of the first black feces excretion and
the number of black feces excretion in 6 h
注:*P<0.05,**P<0.01,***P<0.001(下同)
2.3 发酵果蔬汁干预对小鼠肠道菌群的影响
采用干预后的肠道菌群丰度数据分析肠道菌群α-多样性及门属水平变化情况,多样性分析包含丰富度(Obeserved_OTUs,反映样品中含有的物种数目,数值越高表明样品物种丰富度越高)和均匀度(Shannon 指数,评估样本中物种组成的丰富度和均匀度,值越大表示该环境的物种越丰富,各物种分配越均匀)。
由图2可知,干预后小鼠肠道菌群Obeserved_OTUs值与Shannon指数值均产生变化,说明干预后,小鼠肠道菌群的丰富度及均匀度产生了变化。与MC组相比,MI、HI组的Obeserved_OTUs值、Shannon 指数值出现下降趋势,差异显著(P<0.05),说明发酵果蔬汁干预对肠道菌群物种丰富度和均匀度有影响。发酵果蔬汁中的脂肪族有机酸能够降低肠道内pH值,具有重要的肠道调节功能[25],且高剂量干预下,肠道菌群多样性变化较大,提示发酵果蔬汁干预剂量不宜过高,易破坏肠道整体微生态平衡。因此推荐剂量为中剂量,即人每次饮用发酵果蔬汁原液30 mL,每日2次。

a-Obeserved_OTUs;b-Shannon指数
图2 发酵果蔬汁干预对小鼠肠道菌群α-多样性的影响
Fig.2 Effect of fermented fruit and vegetable
juice on α-diversity
对MI组属水平肠道微生物进行wilcox秩和检验及fold change分析,结果见图3。经发酵果蔬汁干预后,MI组小鼠体内厌氧棒状菌属(Anaerostipes)、对肠道具有保护作用的分节丝状菌属(Candidatus Arthromitus)、普雷沃氏菌属(Prevotella)等菌的相对丰度升高。与认知能力负相关的Mucispirillum属[26]、拟杆菌属(Bacteroides)、颤螺菌属(Oscillospira)、理研菌科(Rikenellaceae)、与肠炎相关的嗜胆菌属(Bilophila)等相对丰度降低。提示发酵果蔬汁干预后,肠道菌群从肉食型向植食型转变,对肠道具有保护作用的菌属相对丰度增加,而与肠道炎症等相关的菌属相对丰度减少。
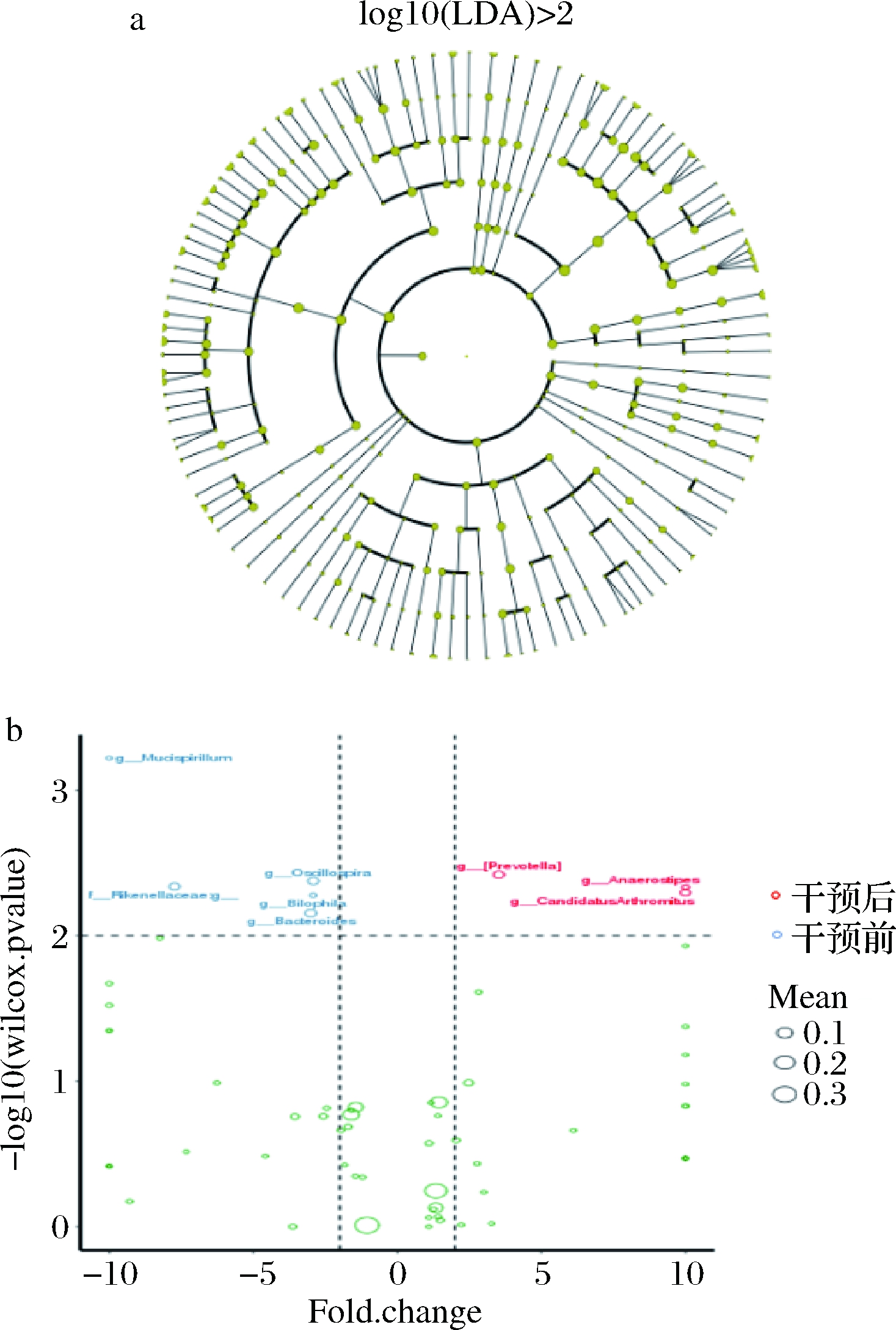
a-中剂量干预组wilcox秩和检验;b-fold change分析
图3 中剂量干预组wilcox秩和检验及fold change分析结果
Fig.3 Results of wilcox test and fold change analysis
in the medium dose intervention group
3 结论
基于超高效液相色谱-四级杆静电场轨道阱质谱系统,分析发酵型果蔬汁的物质组成规律。通过数据库比对,共鉴定出32种化合物,包括黄酮类、氨基酸类、有机酸类、糖类等物质。
动物实验结果表明,与模型组相比,中剂量干预组可以显著缩短首粒黑便时间,6 h黑便粒数低、中、高剂量干预组分别为(20.83±5.98)、(21.82±5.89)和(27.70±5.11),排便量呈明显剂量依赖性。肠道菌群结果显示,发酵果蔬汁干预后,小鼠肠道菌群的丰富度及均匀度产生了变化。高剂量发酵果蔬汁干预下,肠道菌群多样性变化较大,提示发酵果蔬汁干预剂量不宜过高,易破坏肠道整体微生态平衡。因此推荐剂量为中剂量,即人每次饮用发酵果蔬汁原液30 mL,每日2次。中剂量干预组小鼠经发酵果蔬汁干预后,厌氧棒状菌属(Anaerostipes)、对肠道具有保护作用的分节丝状菌属(Candidatus Arthromitus)、普雷沃氏菌属(Prevotella)等菌的相对丰度升高,与认知能力负相关的Mucispirillum菌属、拟杆菌属(Bacteroides)、颤螺菌属(Oscillospira)、理研菌科(Rikenellaceae)、与肠炎相关的嗜胆菌属(Bilophila)等菌的相对丰度降低,表明发酵果蔬汁干预后,肠道菌群从肉食型向植食型转变,对肠道有保护作用的菌属相对丰度增加,而与肠道炎症等相关的菌属相对丰度减少。
发酵果蔬汁具有促进小鼠肠道蠕动和提高排便量的作用,同时能够改善肠道微生态,为产品的功效作用提供数据支持。对于发挥通便作用的关键化合物及其作用机制,应通过系列研究进一步论证分析。
[1] 崔文文, 管忠安.中医诊治慢性便秘现状与进展[J].现代中西医结合杂志, 2021, 30(36):4 094-4 099.
CUI W W, GUAN Z A.Current state and advances of TCM diagnosis and treatment for chronic constipation[J].Modern Journal of Integrated Traditional Chinese and Western Medicine, 2021, 30(36):4 094-4 099.
[2] 袁萌, 孙增坤, 程羽, 等.便秘的词源学探讨[J].辽宁中医杂志, 2012, 39(2):277-279.
YUAN M, SUN Z K, CHENG Y, et al.Etymology exploration of constipation [J].Liaoning Journal of Traditional Chinese Medicine, 2012, 39(2):277-279.
[3] BASILISCO G, COLETTA M.Chronic constipation:A critical review[J].Digestive and Liver Disease, 2013, 45(11):886-893.
[4] 蒋欣容. 单一及混合乳酸菌发酵果蔬乳饮料对小鼠润肠通便作用的影响[D].扬州:扬州大学, 2017.
JIANG X R.Effect of single and mixed lactic acid bacteria fermentation of fruit and vegetable milk beverage on intestinal purgative effect in mice [D].Yangzhou:Yangzhou University, 2017.
[5] PRICHARD D O, BHARUCHA A E.Recent advances in understanding and managing chronic constipation[J].F 1000 Research, 2018, 7:1 640.
[6] 毛恺, 雷哲, 杨春.食物源抗便秘因子保健机理的研究进展[J].食品工业科技, 2022, 43(13):455-465.
MAO K, LEI Z, YANG C.Research progress on health mechanism of the food source anti-constipation factors[J].Science and Technology of Food Industry, 2022, 43(13):455-465.
[7] PANDA S K, SHETTY P H.Innovations in Technologies for Fermented Food and Beverage Industries[M].Cham:Springer International Publishing, 2018.
[8] SWAIN M R, ANANDHARAJ M, RAY R C, et al.Fermented fruits and vegetables of Asia:A potential source of probiotics[J].Biotechnology Research International, 2014, 2014:250424.
[9] GARC A-MANTRANA I, MONEDERO V, HAROS M.Reduction of phytate in soy drink by fermentation with Lactobacillus casei expressing phytases from bifidobacteria[J].Plant Foods for Human Nutrition (Dordrecht, Netherlands), 2015, 70(3):269-274.
A-MANTRANA I, MONEDERO V, HAROS M.Reduction of phytate in soy drink by fermentation with Lactobacillus casei expressing phytases from bifidobacteria[J].Plant Foods for Human Nutrition (Dordrecht, Netherlands), 2015, 70(3):269-274.
[10] GARC A-MANTRANA I, YEBRA M J, HAROS M, et al.Expression of bifidobacterial phytases in Lactobacillus casei and their application in a food model of whole-grain sourdough bread[J].International Journal of Food Microbiology, 2016, 216:18-24.
A-MANTRANA I, YEBRA M J, HAROS M, et al.Expression of bifidobacterial phytases in Lactobacillus casei and their application in a food model of whole-grain sourdough bread[J].International Journal of Food Microbiology, 2016, 216:18-24.
[11] SLAVIN J L, LLOYD B.Health benefits of fruits and vegetables[J].Advances in Nutrition, 2012, 3(4):506-516.
[12] GONZ LEZ-MONTOYA M, HERN
LEZ-MONTOYA M, HERN NDEZ-LEDESMA B, SILV
NDEZ-LEDESMA B, SILV N J M, et al.Peptides derived from in vitro gastrointestinal digestion of germinated soybean proteins inhibit human colon cancer cells proliferation and inflammation[J].Food Chemistry, 2018, 242:75-82.
N J M, et al.Peptides derived from in vitro gastrointestinal digestion of germinated soybean proteins inhibit human colon cancer cells proliferation and inflammation[J].Food Chemistry, 2018, 242:75-82.
[13] DING Q, NIE S P, HU J L, et al.In vitro and in vivo gastrointestinal digestion and fermentation of the polysaccharide from Ganoderma atrum[J].Food Hydrocolloids, 2017, 63:646-655.
[14] 张海燕, 康三江, 袁晶, 等.苹果酵素自然发酵过程中生物活性物质的变化[J].中国酿造, 2021, 40(3):111-114.
ZHANG H Y, KANG S J, YUAN J, et al.Changes of bioactive compounds of apple Jiaosu during natural fermentation[J].China Brewing, 2021, 40(3):111-114.
[15] GILLE D, SCHMID A, WALTHER B, et al.Fermented food and noncommunicable chronic diseases:A review[J].Nutrients, 2018, 10(4):448.
[16] MARCO M L, HEENEY D, BINDA S, et al.Health benefits of fermented foods:Microbiota and beyond[J].Current Opinion in Biotechnology, 2017, 44:94-102.
[17] 程阳, 吴思雅, 侯玲凤, 等.羊栖菜褐藻酸钠对便秘模型小鼠的润肠通便作用[J].食品研究与开发, 2019, 40(2):12-16.
CHENG Y, WU S Y, HOU L F, et al.Laxative effect of Sargassum fusiforme sodium alginate in constipation model mice[J].Food Research and Development, 2019, 40(2):12-16.
[18] 张敏佳, 欧阳道福, 王晓宁, 等.发酵果蔬汁的通便和减肥功能[J].食品与发酵工业, 2019, 45(1):77-82.
ZHANG M J, OUYANG D F, WANG X N, et al.Functions of fermented fruit and vegetable juices for defecation and weight loss[J].Food and Fermentation Industries, 2019, 45(1):77-82.
[19] 孟雪梅, 马文芳, 张玲玲, 等.复合苦荞粉通便作用的研究[J].现代食品科技, 2018, 34(1):19-23;30.
MENG X M, MA W F, ZHANG L L, et al.Effect of the compound tartary buckwheat flour on the defecation in mice[J].Modern Food Science and Technology, 2018, 34(1):19-23;30.
[20] WANG Y, YU M, SHI Y W, et al.Effects of a fermented beverage of Changbai Mountain fruit and vegetables on the composition of gut microbiota in mice[J].Plant Foods for Human Nutrition (Dordrecht, Netherlands), 2019, 74(4):468-473.
[21] EDGAR R C, HAAS B J, CLEMENTE J C, et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics, 2011, 27(16):2 194-2 200.
[22] OU J Y, SUN Z.Feruloylated oligosaccharides:Structure, metabolism and function[J].Journal of Functional Foods, 2014, 7:90-100.
[23] KWAW E, MA Y K, TCHABO W, et al.Effect of Lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chemistry, 2018, 250:148-154.
[24] 温靖, 徐玉娟, 肖更生, 等.青梅提取物的制备及体内促消化功能研究[J].食品科学, 2010, 31(5):266-269.
WEN J, XU Y J, XIAO G S, et al.In vivo digestion promoting function of extracts from plum fruits[J].Food Science, 2010, 31(5):266-269.
[25] SENEVIRATNE C J, WONG R W K, H GG U, et al.Prunus mume extract exhibits antimicrobial activity against pathogenic oral bacteria[J].International Journal of Paediatric Dentistry, 2011, 21(4):299-305.
GG U, et al.Prunus mume extract exhibits antimicrobial activity against pathogenic oral bacteria[J].International Journal of Paediatric Dentistry, 2011, 21(4):299-305.
[26] GAO L, LI J Q, ZHOU Y Z, et al.Effects of baicalein on cortical proinflammatory cytokines and the intestinal microbiome in senescence accelerated mouse prone 8[J].ACS Chemical Neuroscience, 2018, 9(7):1 714-1 724.