发酵乳作为益生菌的载体,在全世界被广泛消费。为了满足和丰富对发酵乳的偏好及提高产量,人们开始添加各种营养及功能成分[1]。植物精油(狭叶精油[2],留兰香、水薄荷精油[3],肉桂、丁香、迷迭香等精油[4],莳萝精油[5],紫苏叶精油[6]等)因为良好的功能性及益生性也被国内外学者添加于发酵乳中并进行研究。
精油是自植物中提取的天然产物,被美国食品药物管理局认定为一般认定为安全(Generally Recognized as Safe,GRAS)的物质,在食品行业具有广泛的应用前景。大多数精油对病原菌具有抑制作用,且抑菌途径涉及细胞的细胞壁、细胞膜、细胞质等方面,菌种对精油难以产生耐药性[7],精油能为发酵乳的食用创造一层安全保障。另一方面,精油抑制病原菌的同时,也可能对发酵菌种产生影响,而较致病菌而言,乳酸菌是对精油不敏感的微生物[3]。在发酵乳中致病菌引发的中毒事件时有报道[1],开发新型绿色的抑菌剂迫在眉睫。目前针对单种精油对乳源微生物作用及多种精油对致病菌的抑菌效果研究较多,而各种精油对致病菌及乳酸菌的选择抑制性报道较少。
本试验预选8种精油,以抑菌圈直径、最小抑菌浓度(minimum inhibitory concentration, MIC)为表征,分析精油对6株乳酸菌及2株致病菌的抑菌活性,从中筛选出具有强抑制作用及选择抑制性的精油,并系统研究pH对MIC的影响,旨在为发酵产品筛选合适的植物精油提供一定理论基础;以OD600值表征所筛选的精油各浓度对指示菌的生长过程的影响,并制作精油发酵乳,对发酵及储藏过程活菌数、pH、滴定酸度等指标进行监测,探究其在发酵乳中的实际作用,为精油应用于发酵乳提供依据。
1 材料与方法
1.1 材料
1.1.1 主要材料
肉桂、牛至、百里香、罗勒、没药、丁香,市售;留兰香,安徽桑标贸易有限公司;迷迭香,洛阳迷迭香农业开发有限公司;乳酸链球菌素(Nisin),索莱宝公司;其他试剂均为分析纯。
嗜酸乳杆菌G1、鼠李糖乳杆菌G5、罗伊氏乳杆菌G8、副干酪乳杆菌L9、嗜热链球菌Q1、嗜热链球菌Q2由甘肃农业大学食品科学与工程学院功能乳品工程实验室分离鉴定并保存;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)由甘肃农业大学食品科学与工程学院微生物实验室提供并保存。乳酸菌的培养采用MRS肉汤及MRS固体培养基,致病菌采用TSB和TSA培养基。
1.1.2 仪器与设备
Versa Max全波长酶标仪,美谷分子仪器(上海)有限公司;723型可见分光光度计,上海光谱仪器有限公司;pH S-3C精密pH计、HG 303-4电热恒温培养箱,上海一恒科学仪器有限公司;游标卡尺,上海九金工具有限公司;SW-CJ-2FD双人单面超净工作台,苏州净化设备有限公司。
1.2 实验方法
1.2.1 精油的提取
采用水蒸馏法提取精油。粉碎后的物料与蒸馏水以料液比1∶10(g∶mL)混合,采用Clevenger装置蒸馏4 h,收集后于4 ℃暗光保存。
1.2.2 菌种的活化
菌种在甘油管中于-80 ℃保存。使用前,将指示菌活化3代(37 ℃,12 h),调节菌液浓度,备用。
1.2.3 抑菌圈直径的测定
参照文献[7]的方法。将100 μL 108 CFU/mL的菌液涂布于培养基,将滤纸片贴于其上,移取5 μL精油或10 mg/mL的Nisin水溶液于滤纸片上,37 ℃培养24 h,十字交叉法测定抑菌圈大小并记录。
1.2.4 MIC的测定
根据欧洲抗菌药物敏感性试验委员会[8]的建议。用浓盐酸调整液体培养基的初始pH为6.4、5.8、5.2、4.6、4.0,灭菌,并加入0.5%(体积分数)的二甲基亚砜(过0.22 μm滤膜)。在96孔板前11列完成精油浓度为20 μL/mL到0.156 μL/mL的稀释,第12列为不加精油的生长对照,每孔100 μL。再接入100 μL 106 CFU/mL菌液,吹打混匀。37 ℃培养24 h,未观察到可见微生物生长的最低浓度为精油的MIC。
1.2.5 生长曲线
参照陈默等[9]的方法。将100 μL 108 CFU/mL的菌液加到100 mL含不同浓度牛至精油的培养基(含1.5%甘油作为乳化剂)中,混匀。吸取250 μL上述培养基于96孔板中,以不含精油的培养基为生长对照(CK),以不含菌的培养基为参比,37 ℃培养48 h,每隔一段时间用酶标仪在600 nm处测定吸光值。
1.2.6 发酵乳制备
配制脱脂乳粉质量分数为12%的复原乳,加入1.5%(体积分数)吐温-80为乳化剂,均质。95 ℃灭菌5 min,冷却至40 ℃,无菌条件下,加入0、0.156、0.313 μL/mL的牛至精油,以2%(体积分数)的接种量接种产酸能力最强的G5菌液,混匀,42 ℃培养,每隔0.5 h观察并记录凝乳时间,每隔4 h测定活菌数、pH及滴定酸度。将凝乳的发酵乳放入4 ℃后熟,在1、7、14、21、28 d时测定活菌数、pH、滴定酸度、DPPH自由基清除率。
1.2.7 活菌数测定
参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》测定活菌数。
1.2.8 pH和滴定酸度的测定
pH用精密pH计测定。参照GB 5009.239—2016《食品安全国家标准 食品酸度的测定》测定酸度。
1.2.9 DPPH自由基清除率
参照李思宁等[10]的方法并略作修改。将样品于4 ℃、8 000×g离心10 min,收集上清液,过0.45 μm滤膜,获得乳清样品。将2 mL DPPH溶液(0.2 mmol/L,95%甲醇作为溶剂)与1 mL的乳清样品或95%甲醇(对照)混匀,反应20 min。4 ℃、10 000×g离心10 min,取上清液,于517 nm测定吸光值为A2。用95%甲醇代替DPPH溶液测定吸光值为A1。用1 mL蒸馏水代替待测样品测定吸光值为A0。DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
1.2.10 感官评价
参考罗惠等[11]的方法并略作修改。由10名经过培训的人员按照表1对后熟1 d的发酵乳进行评价。
表1 感官评分标准
Table 1 Sensory evaluation standards
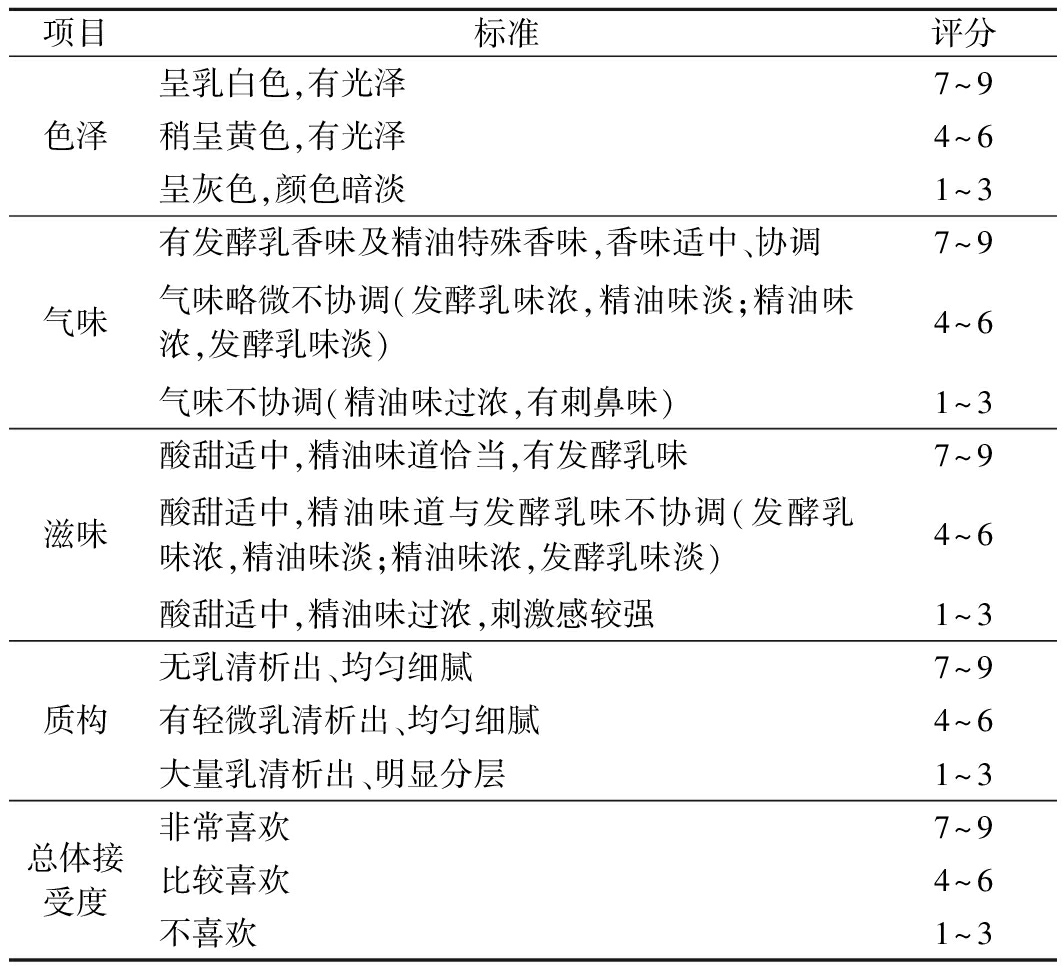
项目标准评分色泽呈乳白色,有光泽7~9稍呈黄色,有光泽4~6呈灰色,颜色暗淡1~3气味有发酵乳香味及精油特殊香味,香味适中、协调7~9气味略微不协调(发酵乳味浓,精油味淡;精油味浓,发酵乳味淡)4~6气味不协调(精油味过浓,有刺鼻味)1~3滋味酸甜适中,精油味道恰当,有发酵乳味7~9酸甜适中,精油味道与发酵乳味不协调(发酵乳味浓,精油味淡;精油味浓,发酵乳味淡)4~6酸甜适中,精油味过浓,刺激感较强1~3质构无乳清析出、均匀细腻7~9有轻微乳清析出、均匀细腻4~6大量乳清析出、明显分层1~3总体接受度非常喜欢7~9比较喜欢4~6不喜欢1~3
1.2.11 统计分析
所有试验均重复3次,采用Excel进行数据统计。使用SPSS 19.0的单因素方差分析中的邓肯氏多重比较进行显著性差异分析,以P<0.05为差异显著。利用Origin 2018进行绘图。
2 结果与分析
2.1 抑菌圈直径
菌种对精油敏感程度判定标准为:直径≤12 mm为低度敏感,12 mm<直径≤20 mm为中度敏感,直径>20 mm为高度敏感[7]。抑菌剂对指示菌的抑菌圈大小如表2及图1所示。精油对乳酸菌的抑菌圈直径均显著小于致病菌(P<0.05)。类似的结论也被AMBROSIO等[12]报道。乳酸菌对牛至、肉桂精油均中度敏感,而致病菌为高度敏感,2种精油展现了最好的抑菌效果。牛至精油的选择抑菌性更强,其对致病菌的抑菌圈直径均显著高于肉桂精油(P<0.05),而其抑制G8 (17.88±0.53) mm、L9 (18.44±0.98) mm的能力显著低于肉桂精油G8 (20.79±0.99)、L9 (20.41±0.06) mm(P<0.05)。FANCELLO等[13]研究也指出肉桂精油在各精油中抑制乳酸菌的能力最强。乳酸菌和E.coli对百里香中度敏感,S.aureus为高度敏感,乳酸菌和致病菌分别对丁香呈现低度敏感和中度敏感,两者抑菌性弱于牛至、肉桂。致病菌对迷迭香、罗勒、没药、留兰香精油均低度敏感,作为抑菌剂的能力较弱。按照精油抑制致病菌的程度从强到弱排序分别为牛至>肉桂>百里香>丁香,抑制乳酸菌程度从强到弱排序为肉桂=牛至>百里香>丁香。
表2 K-B法抑菌结果 单位:mm
Table 2 Antibacterial results of K-B method

种类菌株G1G5G8L9Q1Q2S.aureusE.coliNisin10.20±0.33Ad9.14±0.43Bc9.43±0.34Bd7.65±0.31Cd10.34±0.42Ac7.45±0.21Cd7.64±0.27Ce7.47±0.07Ce牛至18.37±0.99Ca18.02±0.36Ca17.88±0.53Cb18.44±0.98Cb19.86±0.71Ca18.45±0.84Ca35.03±1.85Ba43.89±1.83Aa肉桂17.44±0.51Db17.46±0.44Da20.79±0.99Ca20.41±0.06Ca19.45±0.87CDa18.77±0.67CDa30.40±1.84Ab27.19±1.89Bb百里香13.37±0.71CDEc12.49±0.65DEb14.13±0.66Cc12.88±0.54CDEc12.22±0.58Eb13.82±0.19CDb30.50±1.64Ab15.96±0.75Bc丁香8.55±0.22CDe7.93±0.42DEd6.89±0.11Fe7.76±0.28Ed8.21±0.35CDEc8.88±0.12Cc16.62±0.50Ac15.21±0.73Bc迷迭香8.96±0.39Be6.66±0.27Ee7.63±0.34De8.33±0.42Cd7.51±0.24Dc8.88±0.34BCc9.82±0.33Ad9.56±0.38Ad罗勒6.89±0.21CDf6.68±0.13De6.65±0.31De6.55±0.23De-7.21±0.03Cd9.51±0.30Ade8.08±0.29Bde没药6.82±0.30Cf8.49±0.43Acd-6.20±0.13De7.61±0.35Bc7.70±0.37Bd8.85±0.41Ade8.82±0.37Ade留兰香------7.81±0.23Be8.73±0.39Ade
注:直径包含原来的滤纸片(6 mm);大小写字母分别代表组内与组间差异显著(P<0.05);-代表无抑菌圈

图1 部分抑菌剂对指示菌的生长的影响
Fig.1 Effect of some bacteriostatic agents on the growth of bacterial
本文以Nisin为阳性对照。结果显示,Nisin水溶液抑制乳酸菌(Q2除外)效果均显著强于致病菌(P<0.05),贺松等[14]也有一致的研究结果。抗菌物质对致病菌及益生菌的选择抑制性是确定其抗菌谱的重要特征[15],牛至、肉桂、百里香、丁香精油在该方面展现出较Nisin更好的性能,故以这4种精油作为MIC试验展开的对象。
2.2 MIC
通常将pH 4.0作为发酵乳的货架期终点[6],故对精油进行pH 6.4~4.0下的MIC试验,结果如表3所示。精油对乳酸菌的MIC随着pH的降低均降低。这说明一定浓度的精油在乳酸菌发酵过程中具有前期影响小,后期抑制乳酸菌生长的潜力,这将有利于控制乳酸菌过度繁殖导致的后酸化。当pH为4.6和4.0时,E.coli和S.aureus依次不生长,根据ARYANA等[1]的报道,致病菌会在高pH下生长、低pH下进行变异,因而可能存在于低pH食品中。添加精油可以有效抑制高pH下致病菌生长,同时减小其在低pH下变异的风险。
表3 精油在不同初始pH环境下MIC的测定结果
Table 3 MIC of essential oils in different initial pH environments
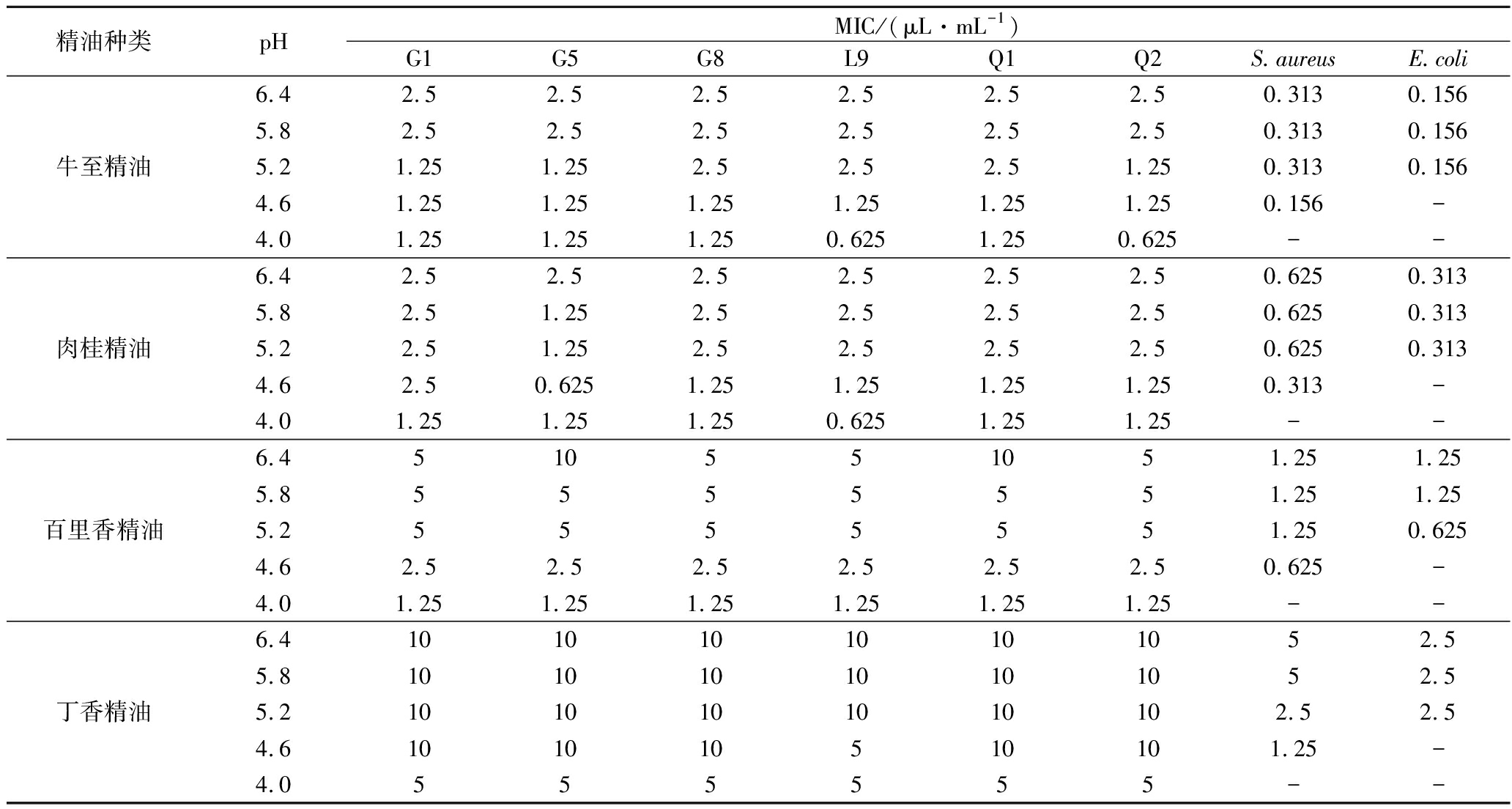
精油种类pHMIC/(μL·mL-1)G1G5G8L9Q1Q2S.aureusE.coli牛至精油6.42.52.52.52.52.52.50.3130.1565.82.52.52.52.52.52.50.3130.1565.21.251.252.52.52.51.250.3130.1564.61.251.251.251.251.251.250.156-4.01.251.251.250.6251.250.625--肉桂精油6.42.52.52.52.52.52.50.6250.3135.82.51.252.52.52.52.50.6250.3135.22.51.252.52.52.52.50.6250.3134.62.50.6251.251.251.251.250.313-4.01.251.251.250.6251.251.25--百里香精油6.4510551051.251.255.85555551.251.255.25555551.250.6254.62.52.52.52.52.52.50.625-4.01.251.251.251.251.251.25--丁香精油6.410101010101052.55.810101010101052.55.21010101010102.52.54.6101010510101.25-4.0555555--
注:-代表菌种未生长
相同pH下,牛至、肉桂、百里香、丁香精油对致病菌的MIC远小于对乳酸菌的MIC,这些精油均具有作为发酵制品抗菌剂的潜力。牛至精油具有最低的MIC,使用时可减少用量,从而减小对产品风味及品质的影响,其对乳酸菌的MIC(0.625~2.5 μL/mL)远大于对致病菌的(0.156~0.313 μL/mL),故进一步研究牛至精油浓度(0.156~2.5 μL/mL)对指示菌生长情况的影响,试验采用GC-MS对牛至精油进行成分表征,成分主要为香芹酚51.78%(数据未展示)。
2.3 生长曲线
图2监测了指示菌在不同浓度的牛至精油处理下的生长情况,精油通过抑制细菌对数期的正常分裂和繁殖,使其无法达到正常的生长高峰,这与萨仁高娃[7]的研究一致。精油含量0.156 μL/mL时便已完全抑制E.coli的生长(图2-h)和有效抑制S.aureus的生长(图2-g,生长量仅为CK的51.06%),而乳酸菌的生长量可达CK的95.26%~104.57%(图2-a~图2-f)。精油含量0.313 μL/mL时完全抑制S.aureus、E.coli的生长(图2-g~图2-h),乳酸菌的生长量达到CK的91.54%~102.12%(图2-a~图2-f)。精油含量0.625 μL/mL时,各乳酸菌的生长量为CK的62.76%~87.94%,更高浓度下乳酸菌不生长(图2-a~图2-f)。结果表明,0.156、0.313 μL/mL牛至精油可作为发酵制品抑菌剂来抑制致病菌的生长,且不会对乳酸菌造成明显的影响。
2.4 牛至精油对乳酸菌发酵过程的影响
2.4.1 凝乳时间及活菌数
各组均在16.5 h凝乳,精油未对凝乳时间造成影响。各组发酵乳发酵过程中活菌数如表4所示。在凝乳时间内,即16.5 h前,精油组与CK间无显著性差异(P>0.05)。20 h时,精油组活菌数均显著高于CK(P<0.05),且有剂量关系,这可能因为精油具有抗氧化性,可以清除O2为益生菌生长提供合适的条件[16]。24 h时,精油组活菌数均显著低于CK(P<0.05),这可能与过酸环境下精油的抑菌性加强有关[17]。

a-G1;b-G5;c-G8;d-L9;e-Q1;f-Q2;g-S.aureus;h-E.coli
图2 不同浓度的牛至精油对细菌生长的影响
Fig.2 Effects of different concentrations of oregano essential oil on bacterial growth
注:数字为48 h时该处理组生长量占CK生长量的百分比
表4 牛至精油对发酵乳活菌数的影响单位:lg CFU/mL
Table 4 Effect of oregano essential oils on the viable count of fermented milk
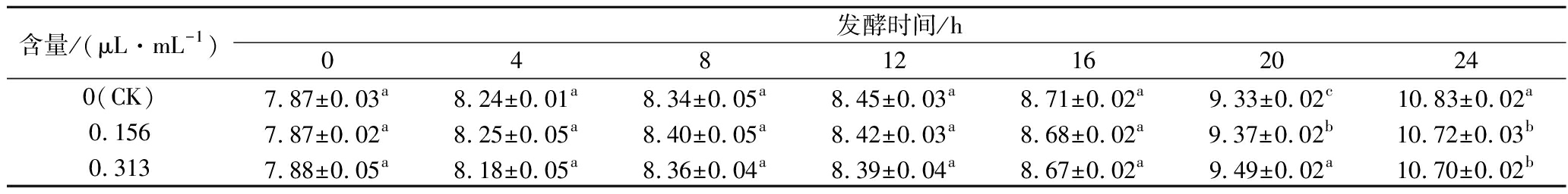
含量/(μL·mL-1)发酵时间/h048121620240(CK)7.87±0.03a8.24±0.01a8.34±0.05a8.45±0.03a8.71±0.02a9.33±0.02c10.83±0.02a0.1567.87±0.02a8.25±0.05a8.40±0.05a8.42±0.03a8.68±0.02a9.37±0.02b10.72±0.03b0.3137.88±0.05a8.18±0.05a8.36±0.04a8.39±0.04a8.67±0.02a9.49±0.02a10.70±0.02b
注:字母不同表示组间存在显著差异(P<0.05)(下同)
2.4.2 产酸特性
各组发酵乳发酵过程中pH和酸度如图3所示。凝乳前,第16 h时,牛至精油对发酵乳pH无显著影响,对滴定酸度具有显著促进作用,值得注意的是,在12 h内,精油组的滴定酸度显著低于CK(P<0.05),这可能因为精油中游离的羟基离子会中和乳酸菌产生的乳酸[18]。发酵20 h,0.313 μL/mL组pH显著低于其余组,精油组滴定酸度显著高于CK(P<0.05),精油对乳酸菌产酸呈现促进作用。发酵24 h,0.313 μL/mL组pH显著高于其余组,精油组滴定酸度显著低于CK(P<0.05),这说明精油在低pH高酸度条件下显著抑制了乳酸菌的产酸。郑佳[6]利用紫苏叶精油也成功延缓了发酵乳储藏中的后酸化现象。综上,牛至精油对乳酸菌产酸呈现促进-抑制的趋势,且浓度增加会增大该趋势。
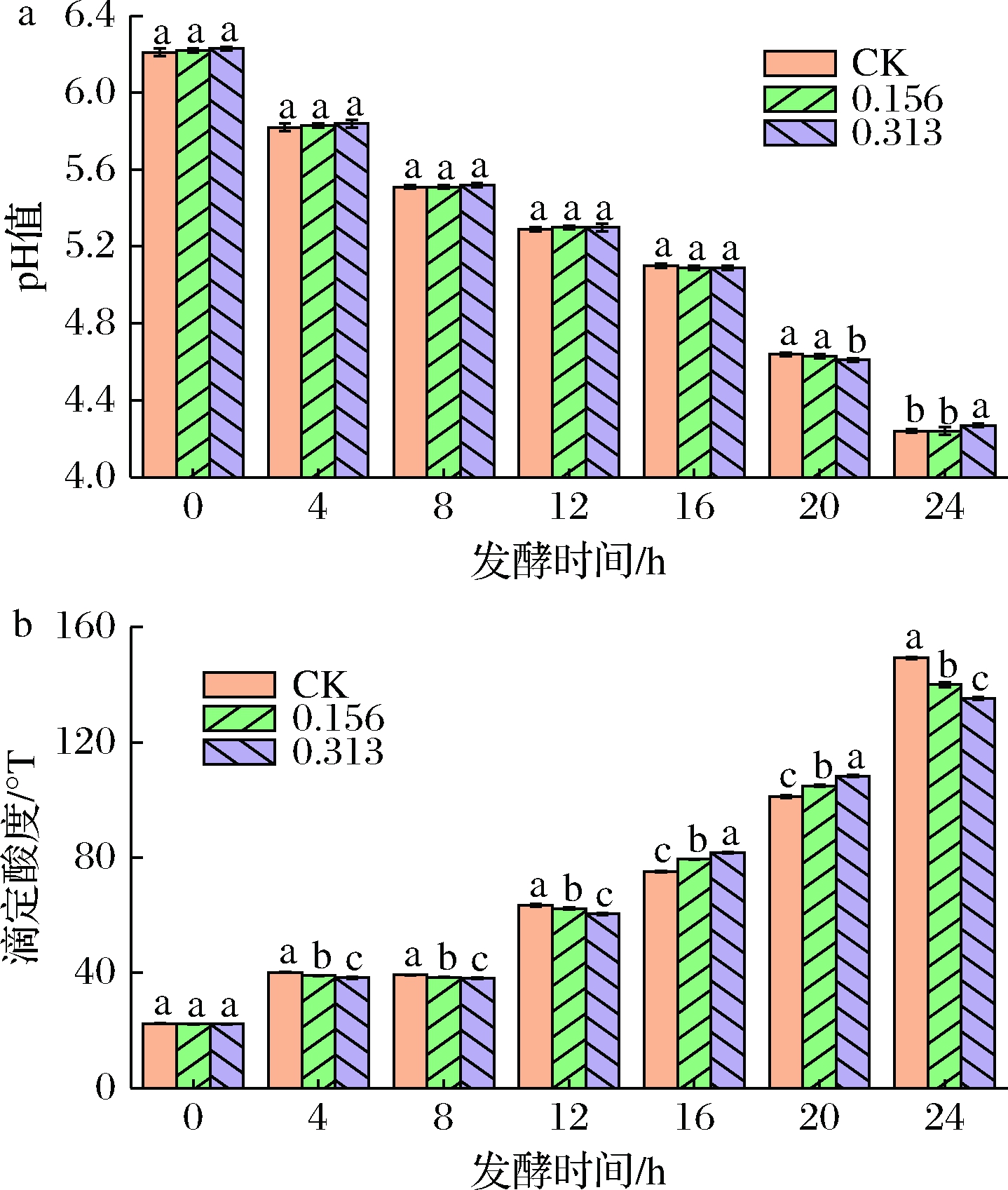
a-pH;b-滴定酸度
图3 牛至精油对乳酸菌产酸特性的影响
Fig.3 Effects of oregano essential oils on the acid-producing
properties of lactic acid bacteria
2.5 牛至精油对发酵乳储藏过程的影响
2.5.1 活菌数
牛至精油对发酵乳储藏过程中活菌数的影响结果如表5所示。活菌数在7 d时增长至最高,后呈现下降的趋势。精油组活菌数均高于CK,0.313 μL/mL组在储藏期均显著高于CK(P<0.05)。MEHDIZADEH等[5]报道,莳萝精油提高了储藏至14 d时发酵乳中益生菌的数量及活力。本研究表明,0.156~0.313 μL/mL的牛至精油在储藏期均有效提高了发酵乳活菌数,牛至精油0.313 μL/mL时活菌数最高。
表5 牛至精油对发酵乳储藏过程活菌数的影响 单位:lg CFU/mL
Table 5 Effects of oregano essential oils on viable counts of
fermented milk during storage
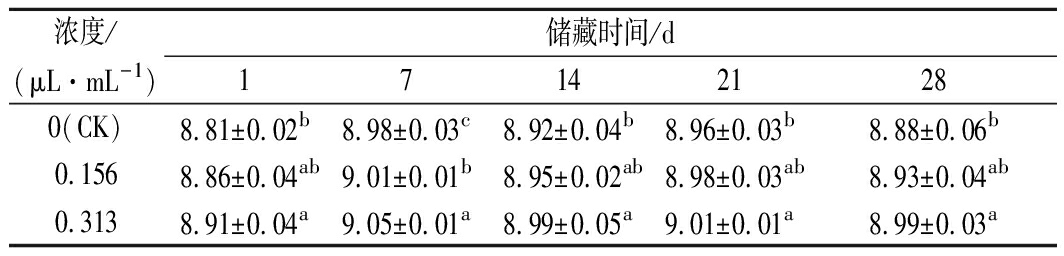
浓度/(μL·mL-1)储藏时间/d171421280(CK)8.81±0.02b8.98±0.03c8.92±0.04b8.96±0.03b8.88±0.06b0.1568.86±0.04ab9.01±0.01b8.95±0.02ab8.98±0.03ab8.93±0.04ab0.3138.91±0.04a9.05±0.01a8.99±0.05a9.01±0.01a8.99±0.03a
2.5.2 产酸特性
发酵乳储藏28 d的pH及滴定酸度结果如图4所示。在7 d内,0.313 μL/mL组的pH显著低于CK,精油组的酸度均显著高于CK(P<0.05),精油促进了乳酸菌的产酸,且有剂量依赖性。14~28 d时,精油组的pH与酸度均和CK无显著性差异(P>0.05)。MEHDIZADEH等[5]也有相似的报道。研究表明,牛至精油在储藏7 d内对pH及滴定酸度均有显著的促进作用。

a-pH;b-滴定酸度
图4 牛至精油对储藏过程中乳酸菌产酸特性的影响
Fig.4 Effects of oregano essential oils on acid production
characteristics of lactic acid bacteria during storage
2.5.3 抗氧化性
牛至精油添加对发酵乳DPPH自由基清除能力的影响如图5所示。在每个监测时间点,精油组DPPH自由基清除能力均显著高于空白组(P<0.05),且呈现剂量关系。JOUNG等[19]的研究中也有相似结果。这可能是由于牛至精油具有良好的抗氧化性,其中存在的酚类等成分发挥了作用,使得自由基清除率升高[20]。
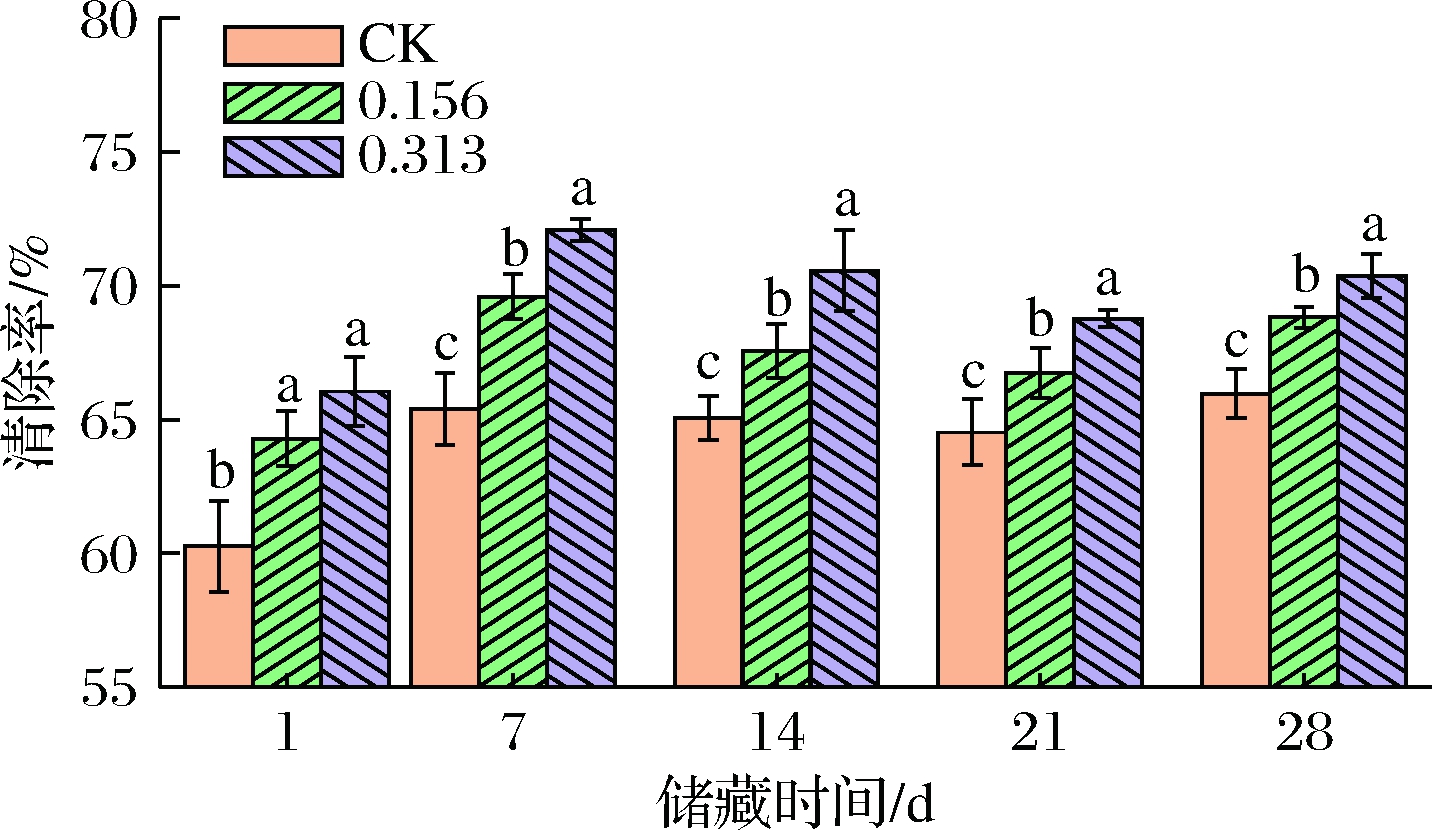
图5 牛至精油对发酵乳清除DPPH自由基能力的影响
Fig.5 Effects of oregano essential oils on DPPH free
radical scavenging rate of fermented milk
2.6 牛至精油对发酵乳感官评价的影响
发酵乳感官评分如图6所示。精油对发酵乳的色泽影响不大,样品均呈现乳白色。精油具有特有的风味,造成了气味、滋味评分的降低,且随浓度的增加而降低。精油对质构的影响并无剂量依赖性,0.156 μL/mL组乳清析出较多,评分较低,0.313 μL/mL组与CK评分相近。ELAMA等[4]报道,添加250 μL/kg的肉桂、丁香和迷迭香精油可赋予发酵乳制品良好的抑菌性,但同时精油带来了感官评价小组中一些成员不喜欢的强烈风味,这与本试验结果一致。而JOUNG等[19]报道,0.2%(质量分数)的柿子叶和莲叶提取物改善了发酵乳的口感和质地。MAHMOUDI等[2]报道,不同浓度的精油虽然都引起了发酵乳感官特性的降低,但低剂量仍可以得到较好的接受度。本试验表明,0.156、0.313 μL/mL的牛至精油引起了发酵乳气味、滋味、质构和总体接受度的下降。

图6 牛至精油对发酵乳感官评价的影响
Fig.6 Effects of oregano essential oils on sensory
evaluation of fermented milk
3 结论
结果表明,牛至、肉桂、百里香、丁香精油具有良好的选择抑制性,对致病菌S.aureus和E.coli的抑制能力显著强于乳酸菌,精油表现出较Nisin(对照)更具作为发酵产品抗菌剂的潜力。4种精油对指示菌的MIC随pH的降低而降低。0.156、0.313 μL/mL的牛至精油对培养基中乳酸菌的生长基本无影响,但具有完全抑制或部分抑制致病菌生长的能力。本文验证了0.156、0.313 μL/mL的牛至精油作为发酵乳添加剂的可行性。在发酵过程中,牛至精油对发酵乳凝乳时间、活菌数基本无影响,有助于乳酸菌在凝乳期的产酸,在过发酵情况下,精油有助于控制后酸化。在储藏过程中,精油处理使得7 d内活菌数显著增加,酸度提高,并增强了抗氧化能力,但造成气味、滋味、质构和总体接受度的下降。
[1] ARYANA K J, OLSON D W.A 100-Year Review:Yogurt and other cultured dairy products[J].Journal of Dairy Science, 2017, 100(12):9 987-10 013.
[2] MAHMOUDI R, ZARE P, HASSANZADEH P, et al.Effect of Teucrium polium essential oil on the physicochemical and sensory properties of probiotic yoghurt[J].Journal of Food Processing and Preservation, 2014, 38(3):880-888.
[3] GOLESTAN L, SEYEDYOUSEFI L, KABOOSI H, et al.Effect of Mentha spicata L.and Mentha aquatica L.essential oils on the microbiological properties of fermented dairy product, kashk[J].International Journal of Food Science & Technology, 2016, 51(3):581-587.
[4] ELAMA C, ALAYOUBI M, JAZZAR M, et al.Effect of different essential oils on the shelf life of concentrated yogurt[J].Annual Research & Review in Biology, 2019, 30(6):1-9.
[5] MEHDIZADEH T, MOJADDAR LANGROODI A, SHAKOURI R, et al.Physicochemical, microbiological, and sensory characteristics of probiotic yogurt enhanced with Anethum graveolens essential oil[J].Journal of Food Safety, 2019, 39(5):e12683.
[6] 郑佳. 降胆固醇益生菌发酵酸奶及其延长保质期的研究[D].贵阳:贵州大学, 2019.
ZHENG J.Study on cholesterol-lowering probiotic fermented yogurt and its extended shelf life[D].Guiyang:Guizhou University, 2019.
[7] 萨仁高娃. 百里香精油与海藻酸盐复合涂膜防控鲜切水果食源性病原微生物作用机制的研究[D].大连:大连理工大学, 2020.
SA R G W.Study on prevention and control mechanism of foodborne pathogens on fresh-cut fruits by thyme oil-alginate-based coating[D].Dalian:Dalian University of Technology, 2020.
[8] European Committee for Antimicrobial Susceptibility Testing (EUCAST) of the European Society of Clinical Microbiology and Infectious Diseases (ESCMID).Determination of minimum inhibitory concentrations (MICs) of antibacterial agents by broth dilution[J].Clinical Microbiology and Infection, 2003, 9(8):1-7.
[9] 陈默, 王志伟, 胡长鹰, 等.酶标仪法快速评价香兰素的抑菌活性[J].食品与发酵工业, 2009, 35(5):63-66.
CHEN M, WANG Z W, HU C Y, et al.Rapid evaluating of antimicrobial activity of vanillin with the microplate reader in 96-cell plate[J].Food and Fermentation Industries, 2009, 35(5):63-66.
[10] 李思宁, 唐善虎, 任然.动物双歧杆菌、植物乳杆菌与传统发酵剂共培养对发酵乳抗氧化特性的影响[J].食品科学, 2021, 42(18):127-134.
LI S N, TANG S H, REN R.Effect of co-fermentation with Bifidobacterium animalis, Lactobacillus plantarum and traditional starter cultures on antioxidant properties of fermented milk[J].Food Science, 2021, 42(18):127-134.
[11] 罗惠, 常旋, 程昊, 等.富含鱼油和白藜芦醇的凝固型酸奶制备和分析[J].食品与发酵工业, 2022, 48(14):202-208.
LUO H, CHANG X, CHENG H, et al.Preparation and analysis of set-style yogurt fortified with fish oil and resveratrol[J].Food and Fermentation Industries, 2022, 48(14):202-208.
[12] AMBROSIO C M S, CONTRERAS-CASTILLO C J, DA GLORIA E M.In vitro mechanism of antibacterial action of a citrus essential oil on an enterotoxigenic Escherichia coli and Lactobacillus rhamnosus[J].Journal of Applied Microbiology, 2020, 129(3):541-553.
[13] FANCELLO F, EL BEYROUTHY M, IRITI M, et al.Chemical composition and antimicrobial activity against food-related microorganisms of different essential oils from Lebanon[J].Journal of Food Safety, 2019, 39(6):e12688.
[14] 贺松, 龚芳红, 张德纯, 等.乳酸链球菌素对乳酸菌抑菌作用的研究[J].食品科学, 2009, 30(23):352-355.
HE S, GONG F H, ZHANG D C, et al.Antimicrobial activity of nisin against lactic acid bacteria[J].Food Science, 2009, 30(23):352-355.
[15] AMBROSIO C M S, IKEDA N Y, MIANO A C, et al.Unraveling the selective antibacterial activity and chemical composition of citrus essential oils[J].Scientific Reports, 2019, 9:17719.
[16] ASLI M Y, KHORSHIDIAN N, MORTAZAVIAN A M, et al.A review on the impact of herbal extracts and essential oils on viability of probiotics in fermented milks[J].Current Nutrition & Food Science, 2017, 13(1):6-15.
[17] OUSSALAH M, CAILLET S, LACROIX M.Mechanism of action of Spanish oregano, Chinese cinnamon, and savory essential oils against cell membranes and walls of Escherichia coli O157∶H7 and Listeria monocytogenes[J].Journal of Food Protection, 2006, 69(5):1 046-1 055.
[18] ALHEJAILI M, OLSON D W, VEL ZQUEZ C, et al.Short communication:Influence of an aqueous myrrh suspension on yogurt culture bacteria over yogurt shelf life[J].Journal of Dairy Science, 2019, 102(3):2 011-2 016.
ZQUEZ C, et al.Short communication:Influence of an aqueous myrrh suspension on yogurt culture bacteria over yogurt shelf life[J].Journal of Dairy Science, 2019, 102(3):2 011-2 016.
[19] JOUNG J Y, LEE J Y, HA Y S, et al.Enhanced microbial, functional and sensory properties of herbal yogurt fermented with Korean traditional plant extracts[J].Korean Journal for Food Science of Animal Resources, 2016, 36(1):90-99.
[20] SIMIRGIOTIS M J, BURTON D, PARRA F, et al.Antioxidant and antibacterial capacities of Origanum vulgare L.essential oil from the arid Andean region of Chile and its chemical characterization by GC-MS[J].Metabolites, 2020, 10(10):414.