植物乳杆菌(Lactobacillus plantarum)和短乳杆菌(Lactobacillus brevis)是黄酒自然浸米工艺中存在的乳酸菌[1],在长期的生产实践中发现,相同工艺、相同底物发酵浓度酿成的绍兴黄酒,因浸米时间不同(传统摊饭法酿酒,浸米时间长达16~26 d,机械化黄酒生产时浸米时间缩短至2~5 d),其贮藏期不一致,浸米时间长酿得的酒,入坛后能够久藏不坏,反之则不易久藏,有人认为与浸米过程中微生物及代谢产物息息相关[2]。黄酒浸米过程中乳酸菌属为优势细菌,其丰度含量占60.67%,其中乳杆菌属含量占乳酸菌的90%,而植物乳杆菌占57.4%,短乳杆菌占21.1%,浸米后期,植物乳杆菌占比达90%,而短乳杆菌几乎不存在[3-4]。短乳杆菌的消失是否与植物乳杆菌有关,目前研究报道较少。
另一方面,植物乳杆菌和短乳杆菌的代谢产物对黄酒的品质和风味有较大影响。一类代谢产物是有机酸类,这类物质与黄酒的回味、柔和性、浓厚感和愉悦感有关[4-5];另一类代谢产物是生物胺,有研究表明:生物胺含量过高会引起人体血管、动脉和微血管的扩大,导致高血压、头疼,腹部痉挛、腹泻和呕吐等不良反应[6-7],酒类饮品中生物胺含量过高是饮后“上头”的主要原因之一[8]。短乳杆菌所产生的酸有明显的恶臭味,使人产生不愉快的感觉,而植物乳杆菌所产的酸味比较清爽[5];同时植物乳杆菌代谢产生生物胺较低[5,9]。由此看来,黄酒发酵过程中应尽量控制短乳杆菌,而在不引入外源抑制剂,凭借共生系统中的一些微生物或者代谢产物来抑制其生长或破坏其完整的细胞,可提升黄酒品质。
为此,本研究以从黄酒浸米水中分离得到2株植物乳杆菌,即R1和R2,为实验菌株,探讨植物乳杆菌发酵粗提液对短乳杆菌生长情况、细胞内外无机磷和ATP的影响,为后续黄酒加工工艺优化和黄酒品质提升提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
短乳杆菌(Lactobacillus brevis) AS1.12,浙江省微生物研究所;植物乳杆菌(Lactobacillus plantarum)R1(CCTCC M 2019007)、植物乳杆菌(Lactobacillus plantarum)R2(CCTCC M 2019008),武汉大学工业微生物保藏中心。
1.1.2 试剂
MRS培养基、琼脂粉,杭州微生物试剂有限公司;CaCO3,成都市科龙化工试剂厂。
乙酸乙酯,上海凌峰化学试剂有限公司;无水乙醇,天津市永大化学试剂有限公司;三氯乙酸,上海阿拉丁生化科技股份有限公司;ATP含量测定盒、磷(Pi)测试盒(磷钼酸法),南京建成生物研究所。
1.1.3 仪器
分析天平,梅特勒-托利多仪器(上海)有限公司;旋转蒸发器,上海亚荣生化仪器厂;YM30Z灭菌锅,上海三申医疗器械有限公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;生化培养箱,上海博迅实业有限公司医疗设备厂;台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;酶标仪,美国热电Multiskanmk 3;恒温培养振荡器,济南欧莱博技术有限公司。
1.1.4 培养基
植物乳杆菌R1、植物乳杆菌R2、短乳杆菌斜面培养基[10]:含0.3%(质量分数)CaCO3的MRS(deMan,Rogosa and Sharpe)固体培养基。
植物乳杆菌R1、植物乳杆菌R2、短乳杆菌活化培养基:MRS液体培养基。
植物乳杆菌R1、植物乳杆菌R2、短乳杆菌保藏培养基:含2%琼脂粉的MRS固体培养基。
1.2 实验方法
1.2.1 植物乳杆菌发酵粗提液制备
参照崔天琦等[11]的方法略有改动。将植物乳杆菌单菌落接种于MRS液体培养基,在37 ℃培养24 h,发酵液以8 000 r/min、4 ℃离心15 min,收集上清液。将上清液与乙酸乙酯以1∶1体积比混合,置室温下以180 r/min在摇床上振荡2 h;后将混合溶液倒入干燥的分液漏斗中静置,待分层明显后取出上层有机相及乳化层于无菌锥形瓶中,将得到的有机相在45 ℃下旋转蒸发,除去乙酸乙酯,得植物乳杆菌发酵粗提液。
1.2.2 植物乳杆菌发酵粗提液对短乳杆菌抑菌活性的检测
1.2.2.1 牛津杯法
参考都立辉等[12]的方法。以短乳杆菌作为指示菌,取适量植物乳杆菌发酵粗提液进行2倍稀释,取样200 μL进行抑菌实验,抑菌活性按公式(1)计算:
抑菌活性![]()
(1)
式中:n,对短乳杆菌有抑菌效果的最大稀释倍数;V,牛津杯内的加样体积,μL。
1.2.2.2 平板计数法
用接种环挑取短乳杆菌单菌落于MRS液体培养基,在37 ℃恒温培养24 h。将50 mL短乳杆菌发酵液在4 ℃、3 000 r/min离心5 min,用无菌盐水洗涤2次并重悬于10 mL盐水中,采用10倍等比稀释法将短乳杆菌菌悬液梯度稀释至10-1、10-3、10-5。用0.9%生理盐水将R1、R2的发酵粗提液稀释至质量分数为25%。取10-1、10-3、10-5的短乳杆菌菌悬液200 μL,与等体积、质量分数为25%的R1、R2发酵粗提液混合,后均匀涂布于培养基表面,以生理盐水为对照组。将平板倒置于37 ℃恒温培养24 h。
1.2.3 短乳杆菌生长曲线的测定
将对数生长期的短乳杆菌和经0.20 μm滤膜除去杂菌、活性为160 AU/mL的植物乳杆菌发酵粗提液按1∶2的体积比加入96孔板中,37 ℃孵育12 h,每隔1 h记录600 nm处的吸光度,以吸光度为纵坐标,培养时间为横坐标,绘制生长曲线。对照组中加入与上述体积对应的短乳杆菌和生理盐水,每组设3个平行。
1.2.4 短乳杆菌细胞裂解率的测定
参照杨鹏斌等[13]的方法略作修改。取培养24 h短乳杆菌发酵液50 mL,4 ℃、3 000 r/min离心15 min,将沉淀用0.03 mol/L、pH 6.5的K3PO4缓冲液洗涤2次,沉淀重悬于10 mL K3PO4缓冲液。将50 μL短乳杆菌悬液和100 μL活性为160 AU/mL的植物乳杆菌发酵粗提液加入96孔板,37 ℃培养12 h,每隔1 h测定650 nm处的吸光度,以加入等比例蒸馏水为对照。设置3个平行,试验数据用平均值表示,细胞裂解率按公式(2)计算:
裂解率![]()
(2)
式中:A0,0 h的吸光度;At,1~12 h的吸光度。
1.2.5 短乳杆菌细胞内、外无机磷浓度的测定
参考周伟等[14]方法。将对数生长期的短乳杆菌以6 000 r/min离心10 min,取沉淀,用2.5 mmol/L HEPES并且含有10 mmol/L的葡萄糖的缓冲液(pH 7.0)反复洗涤2次,制成108CFU/L的菌悬液,备用。
吸取上述菌悬液每份2 mL,加入100 μL活性为160 AU/mL的植物乳杆菌发酵粗提液,每隔15 min终止反应。0 ℃、10 000 r/min离心7 min,取上清液,用磷测试盒在660 nm处测定短乳杆菌胞外无机磷的浓度。
短乳杆菌用1 mL的5%(体积分数)三氯乙酸充分悬浮菌体沉淀,-20 ℃下冷冻过夜。解冻后,95 ℃条件下温育10 min,10 000 r/min离心15 min,取上清液,用磷测试盒在660 nm处测定短乳杆菌胞内无机磷的浓度。
1.2.6 短乳杆菌细胞内、外ATP浓度的测定
取108CFU/L的短乳杆菌菌悬液每份2 mL,加入100 μL活性为160 AU/mL的植物乳杆菌发酵粗提液,每隔15 min终止反应,0 ℃、10 000 r/min离心7 min;取上清液,按ATP含量试剂盒说明书在636 nm处测定细胞外ATP的浓度[15];同时,用细胞破碎仪将沉淀破碎后离心,上清液用于测定细胞内ATP的含量。
1.2.7 数据处理
所有的实验数据均为3个重复的平均值,数据经Origin 2018分析和处理。
2 结果与分析
2.1 植物乳杆菌发酵粗提液对短乳杆菌的抑菌活性
含有短乳杆菌的培养基中,按牛津杯法加入植物乳杆菌R1和R2发酵粗提液的孔周围没有菌生长,形成明显的抑菌圈,说明短乳杆菌的生长完全被抑制(图1),而对照孔周围没有抑菌圈。将表1数据带入公式(1)计算得植物乳杆菌R1和R2发酵粗提液菌对短乳杆菌的抑菌活性分别为160和320 AU/mL。
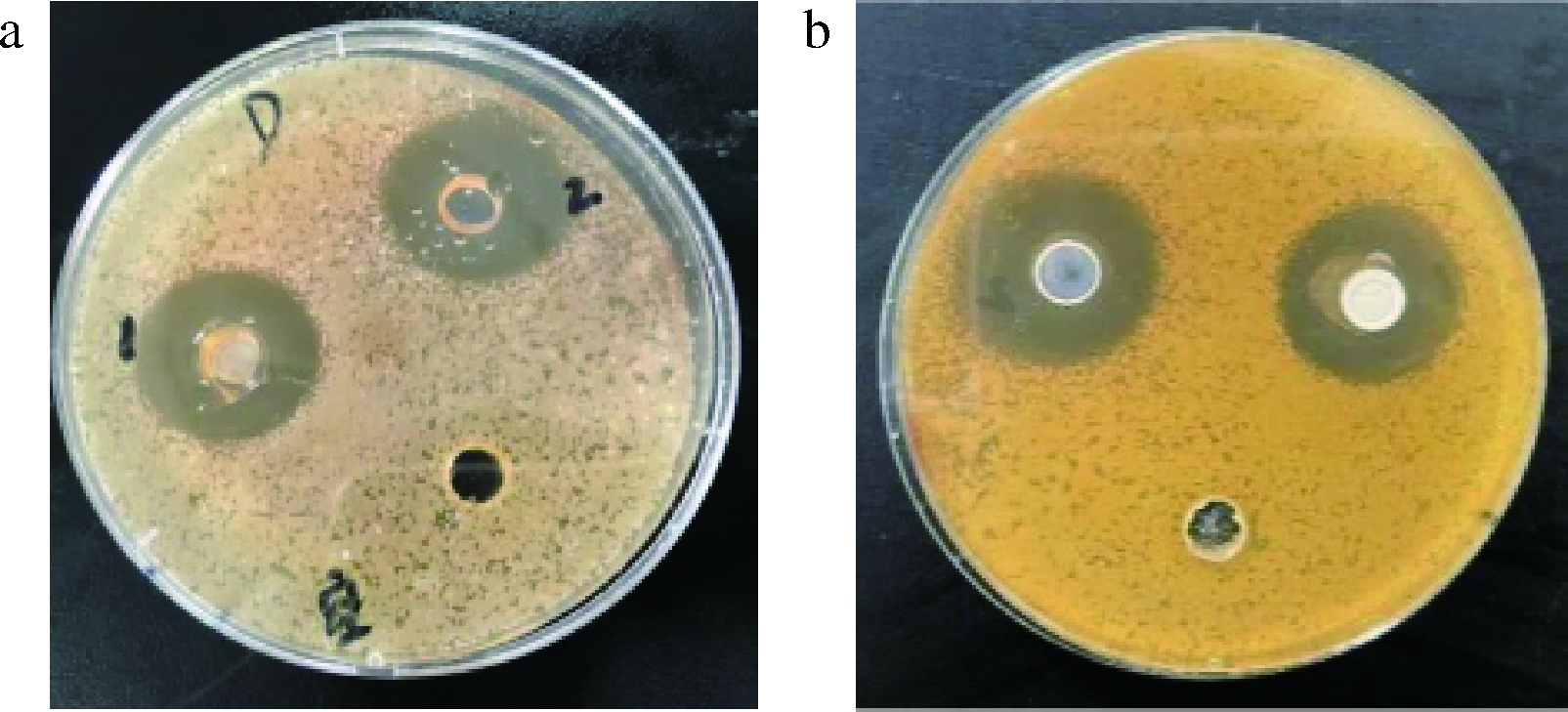
1-R1粗提液;2-R2粗提液
a-平板正面;b-平板反面
图1 植物乳杆菌粗提液对短乳杆菌的抑菌实验
Fig.1 Antibacterial activity of fermentation crude
extract of L.plantarum on L.brevis
表1 植物乳杆菌发酵粗提液对短乳杆菌的抑菌作用
Table 1 Effect of L.plantarum fermentation crude
extract on L.brevis
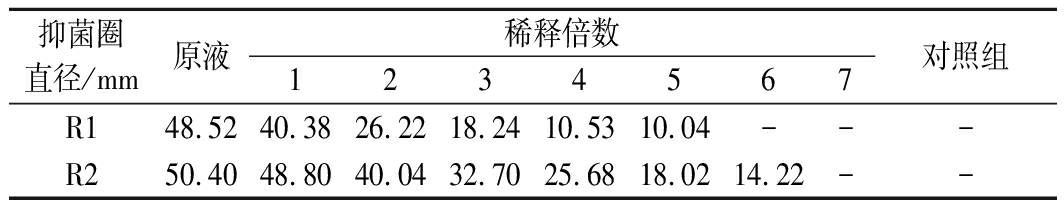
抑菌圈直径/mm原液稀释倍数1234567对照组R148.5240.3826.2218.2410.5310.04---R250.4048.8040.0432.7025.6818.0214.22--
注:“-”表示未观察到抑菌圈
平板计数法实验结果见图2。加入植物乳杆菌R1和R2发酵粗提液后,稀释度为10-3和10-5的短乳杆菌不生长,稀释度为10-1时,加入R1发酵粗提液的平板上有少量短乳杆菌生长,而R2发酵粗提液完全抑制了短乳杆菌的生长。
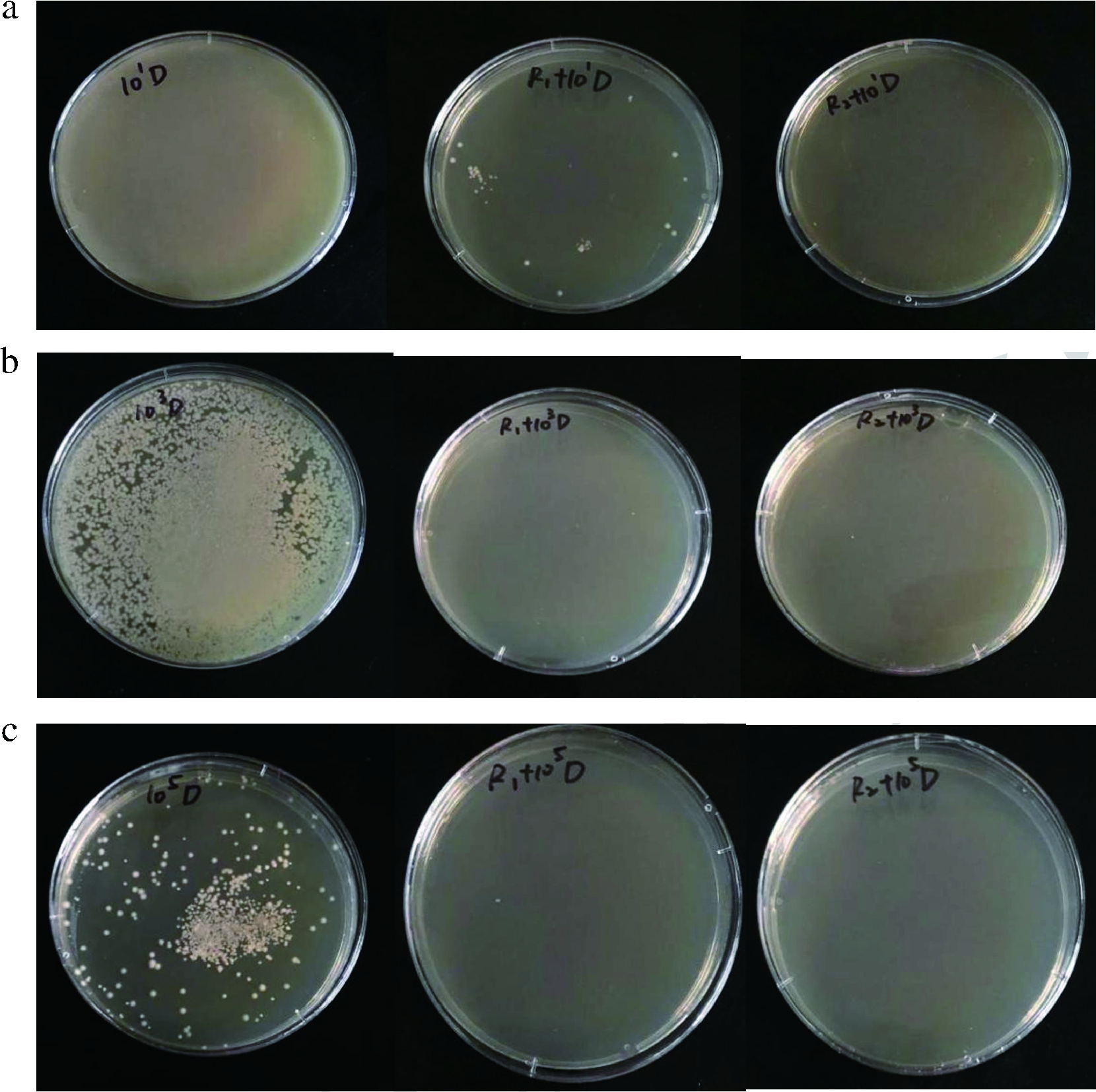
a-稀释度为10-1;b-稀释度为10-3;c-稀释度为10-5
图2 植物乳杆菌R1和R2发酵粗提液对短乳杆菌
生长的影响
Fig.2 Effect of L.plantarum R1 and R2 crude fermentation
extracts on the growth of L.brevis
注:从左到右依次为:短乳杆菌、短乳杆菌+R1发酵粗提液、
短乳杆菌+R2发酵粗提液
2.2 植物乳杆菌发酵粗提液对短乳杆菌生长曲线的影响
将对数期的短乳杆菌与植物乳杆菌发酵粗提液以1∶2的体积比混合,37 ℃培养12 h,短乳杆菌的生长曲线见图3。
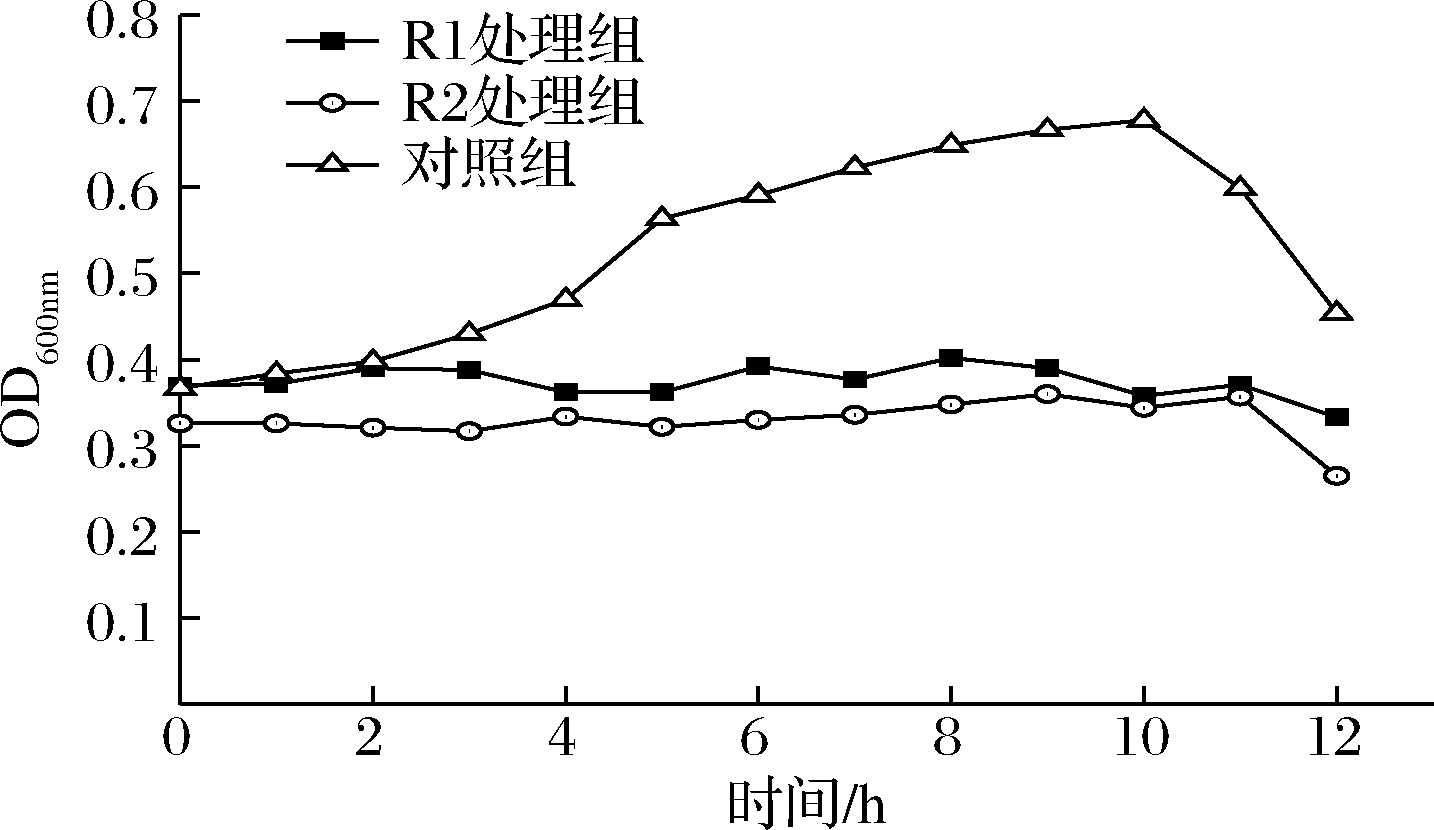
图3 植物乳杆菌发酵粗提液对短乳杆菌生长曲线的影响
Fig.3 Effect of L.plantarum fermentation crude
extract on growth curve of L.brevis
从图3可见,对照组在培养0~2 h时吸光度变化不大,培养2~10 h,吸光度增加,尤其在4~6 h时增幅最大,10~12 h吸光度下降;而短乳杆菌与植物乳杆菌发酵粗提液混合组在0~12 h吸光度变化幅度很小。说明植物乳杆菌发酵粗提液抑制了短乳杆菌的生长。
2.3 植物乳杆菌发酵粗提液对短乳杆菌裂解率的影响
从图4可见,在0~12 h,加入植物乳杆菌发酵粗提液组随时间延长,致短乳杆菌裂解率增加,至12 h时,植物乳杆菌R1和R2致短乳杆菌细胞裂解率分别达到18.9%和20.1%;而未添加植物乳杆菌发酵粗提液的短乳杆菌裂解率总体呈负值,说明在实验的0~12 h,短乳杆菌菌体一直处于增长态势。可见植物乳杆菌发酵粗提液对短乳杆菌有裂解作用。这可能是浸米后期植物乳杆菌成优势菌,而短乳杆菌几乎不存在的原因。
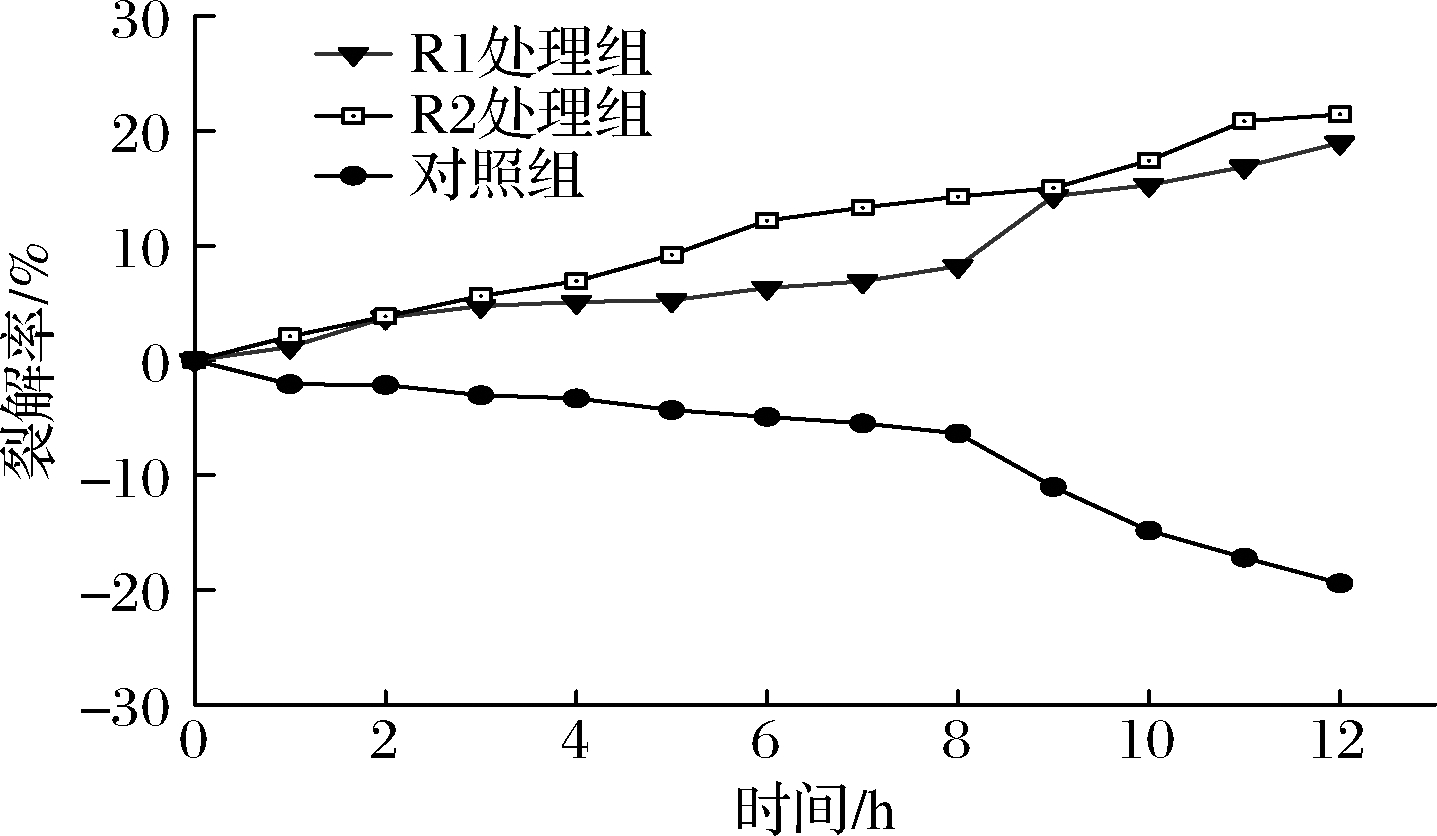
图4 植物乳杆菌发酵粗提液对短乳杆菌裂解率的影响
Fig.4 Effect of L.plantarum fermentation crude
extract on lysis rate of L.brevis
2.4 植物乳杆菌发酵粗提液对短乳杆菌细胞内、外无机磷浓度的影响
由图5可见,在植物乳杆菌发酵粗提液作用于短乳杆菌的90 min内,短乳杆菌胞内无机磷浓度随时间增加而下降,胞外无机磷浓度随时间增加而增高。植物乳杆菌R1发酵粗提液作用于短乳杆菌时,短乳杆菌胞内无机磷浓度从0时的1.359 mmol/L下降到90 min的0.224 mmol/L;相应的,胞外无机磷浓度为从0.213 mmol/L上升到1.107 mmol/L。植物乳杆菌R2发酵粗提液作用于短乳杆菌时,短乳杆菌胞内无机磷浓度从0时的2.056 mmol/L下降到90 min的0.455 mmol/L;相应的,胞外无机磷浓度从0.304 mmol/L上升到1.634 mmol/L。60 min后,短乳杆菌胞内ATP浓度几乎不再改变,胞外ATP浓度变化幅度不大。说明植物乳杆菌发酵粗提液破坏了短乳杆菌细胞膜的完整性。该实验结果与周伟等[14]报道的植物乳杆菌素L-1对单核细胞增生李斯特氏菌的研究结果相似,也与刘文婷等[16]报道的乳酸菌细菌素Lac-B23对荧光假单胞菌的研究结果相似。
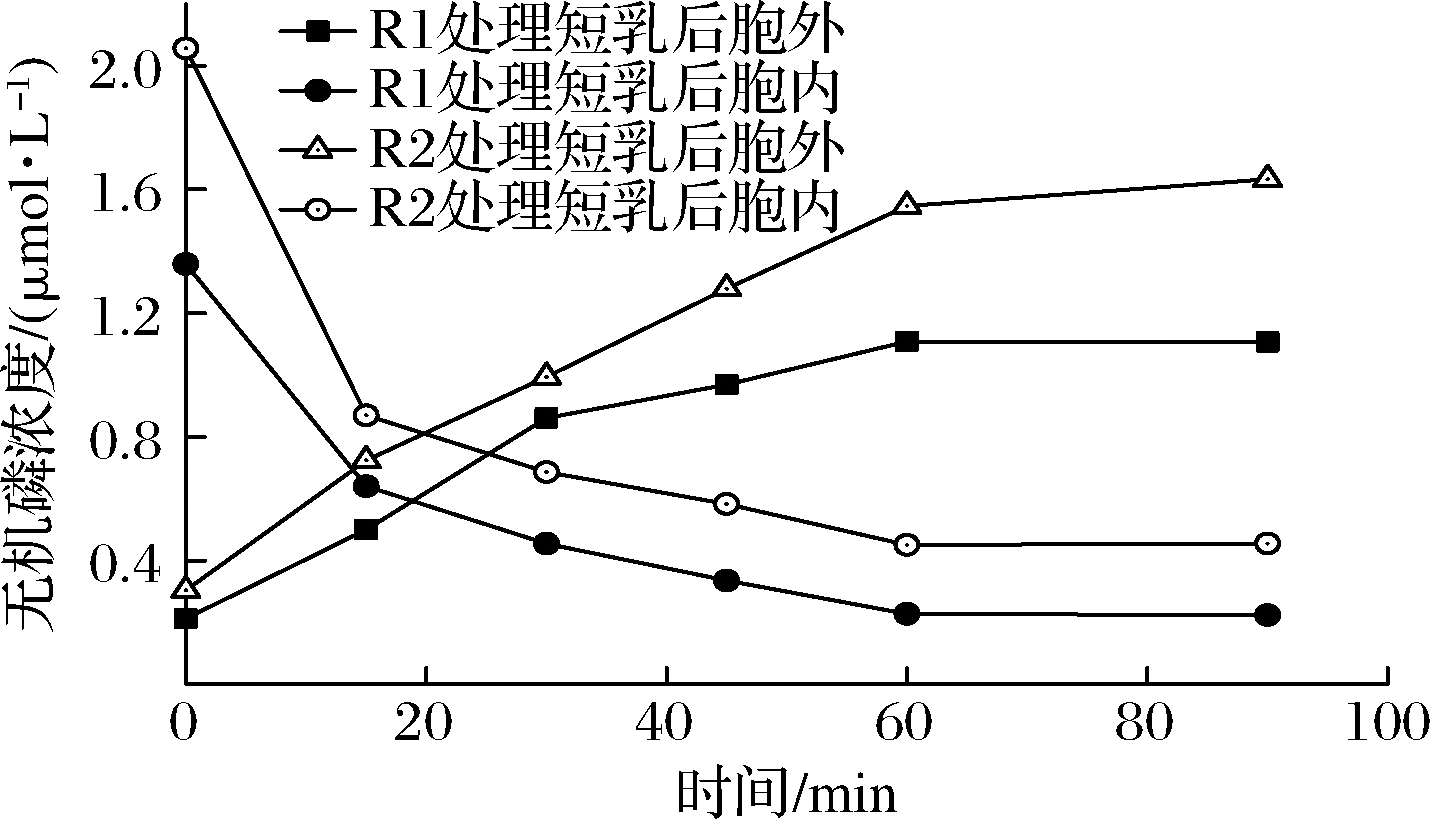
图5 植物乳杆菌发酵粗提液对短乳杆菌胞内外
无机磷浓度的影响
Fig.5 Effect of L.plantarum fermentation crude extract on
intracellular and extracellular inorganic phosphorus
concentration of L.brevis
2.5 植物乳杆菌R1发酵粗提液对短乳杆菌细胞内、外ATP浓度的影响
由图6可见,在植物乳杆菌发酵粗提液作用于短乳杆菌的90 min时间内,短乳杆菌胞内ATP浓度随时间增加而下降,胞外ATP浓度随时间增加而增高。
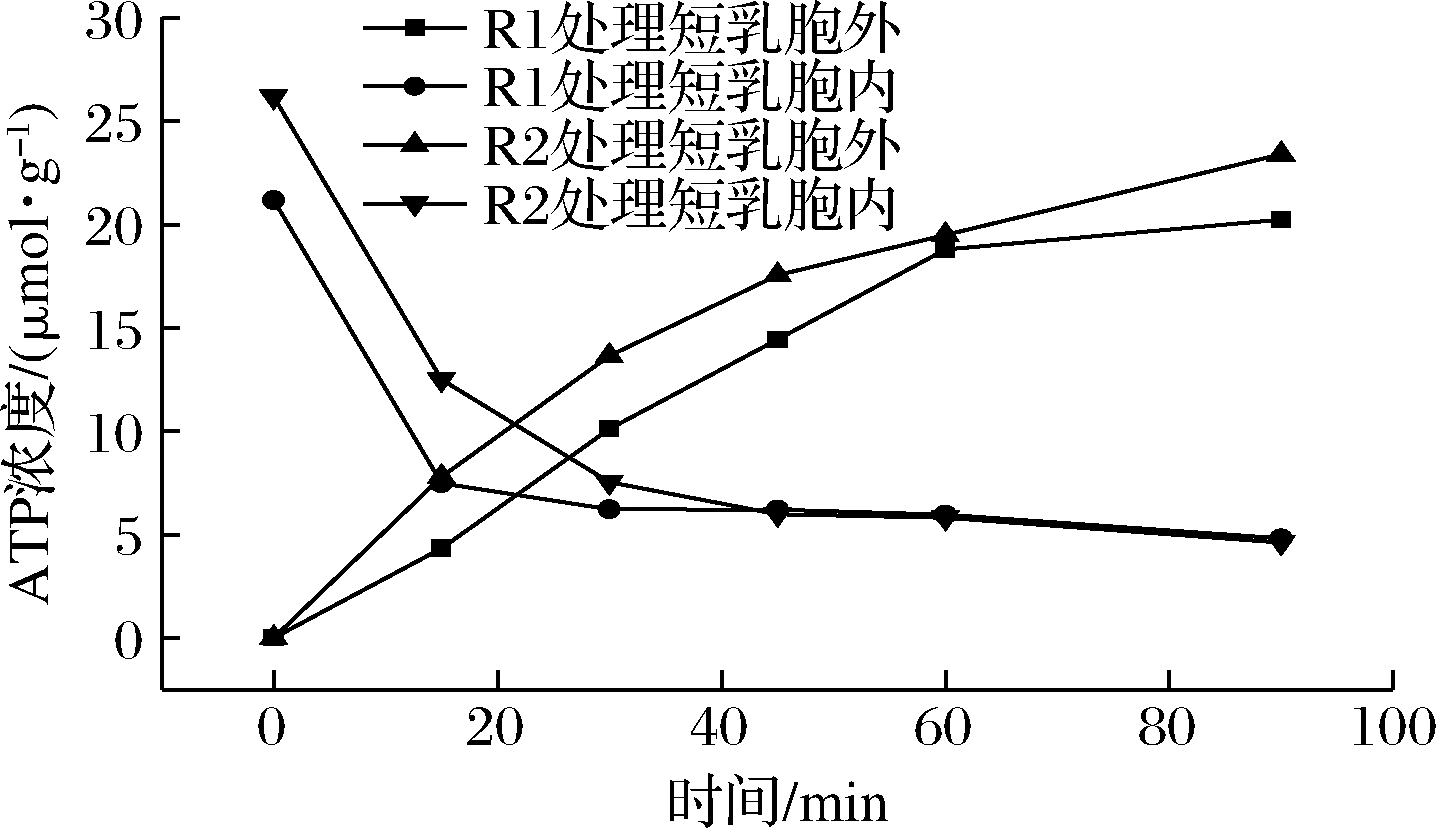
图6 植物乳杆菌发酵粗提液对短乳杆菌细胞
内外ATP浓度的影响
Fig.6 Effect of L.plantarum fermentation crude extract on
intracellular and extracellular ATP concentration of L.brevis
植物乳杆菌R1发酵粗提液作用于短乳杆菌时,短乳杆菌胞内ATP浓度从0时的21.18 μmol/g Hb下降到90 min的4.82 μmol/g Hb;相应的,胞外ATP浓度从0上升到20.23 μmol/g Hb。植物乳杆菌R2发酵粗提液作用于短乳杆菌时,短乳杆菌胞内ATP浓度从0时的26.18 μmol/g Hb下降到90 min的4.62 μmol/g Hb;相应的,胞外ATP浓度从0 μmol/g Hb上升到23.40 μmol/g Hb。说明植物乳杆菌发酵粗提液对短乳杆菌细胞膜有破坏作用。而细胞内ATP降低,对细胞内依赖于ATP的反应造成了影响,从而抑制微生物生长繁殖[15]。刘文婷等[16]、赵瑞香等[17]和ZHAO等[18]研究结果也显示细胞内ATP下降,胞外ATP浓度上升。
3 讨论
植物乳杆菌和短乳杆菌是黄酒发酵过程中常见的微生物,两者代谢产生的有机酸种类及含量差异较大,植物乳杆菌代谢产生乳酸、苹果酸和不挥发酸的能力均优于短乳杆菌,而短乳杆菌产的乙酸、庚酸、正丁酸和异戊酸分别是植物乳杆菌的4、5、6、3倍左右;现有研究表明,乳酸口感柔和有浓厚感,可以缓冲和平衡黄酒对口腔的刺激作用,乳酸和琥珀酸是导致黄酒回味的主要物质;乙酸刺激感强并有挥发性,适口性较差,而异丁酸、庚酸和异戊酸带有不愉悦的恶臭味[4-5]。从提高黄酒品质的角度来看,黄酒发酵过程中短乳杆菌含量越少越好,但是短乳杆菌是自然发酵情况下存在的微生物,不引入外源抑制剂,凭借共生系统中的一些微生物或者代谢产物能抑制其生长或破坏其完整的细胞,是比较恰当的处理方法。
本实验研究结果表明,植物乳杆菌代谢产物能抑制短乳杆菌的生长,会造成短乳杆菌的裂解,导致其细胞内无机磷和ATP的泄露。本实验结果为降低黄酒浸米过程中短乳杆菌提供了一条解决途径。
此前有报道,某些植物乳杆菌的代谢产物能抑制鼠伤寒沙门氏菌、大肠杆菌、荧光假单胞菌、金黄色葡萄球菌、枯草芽胞杆菌、单核细胞增生李斯特菌、白色念珠菌等[19-20],也有些植物乳杆菌代谢产物能抑制黑曲霉、棒状青霉、扩展青霉等真菌[21-22];发挥抑菌功能的主要物质有抑菌肽(常被称为细菌素)和有机酸(如乙酸、丙酸、丁酸、苯乳酸等)[23-25]。关于其抑菌机制,常见的有细胞膜损伤机制和细胞壁损伤机制之说;代谢产物通过改变细胞膜的结构或损伤细胞膜,可导致膜透性发生改变或形成孔洞,细胞发生裂解,胞内容物如ATP、无机磷、Na+、K+等小分子物质大量流出;而能作用于细胞壁的物质,是依靠肽内酶切,致目标细菌细胞壁裂解[26-28]。从本实验结果来看,植物乳杆菌R1和R2的发酵粗提液对短乳杆菌的细胞膜有影响,从而致其生长受阻。
[1] 毛青钟, 俞关松.黄酒浸米浆水中优势细菌的不同对发酵的影响[J].酿酒, 2010, 37(5):69-73.
MAO Q Z, YU G S.Advantage of racteria in the Baptist rice seriflux of Chinese rice wine Wate different studies on the effects of fermentation[J].Liquor Making, 2010, 37(5):69-73.
[2] 程斐, 周高峰, 谢广发, 等.适用于黄酒生物酸化浸米的乳酸菌筛选[J].食品与生物技术学报, 2013, 32(10):1 079-1 084.
CHENG F, ZHOU G F, XIE G F, et al.Screening of lactic acid bacteria suitable for biological acidification of rice soaking in Chinese rice wine[J].Journal of Food Science and Biotechnology, 2013, 32(10):1 079-1 084.
[3] 毛青钟. 冬酿春榨绍兴黄酒[J].酿酒, 2018, 45(1):106-108.
MAO Q Z.Winter wine spring squeeze Shaoxing rice wine[J].Liquor Making, 2018, 45(1):106-108.
[4] 贾瑞博, 潘雨阳, 胡荣康, 等.红曲黄酒传统酿造过程中的细菌菌群结构及其动态变化[J].福建农业学报, 2016, 31(11):1 238-1 243.
JIA R B, PAN Y Y, HU R K, et al.Composition and dynamic changes of bacterial community during traditional Hongqu glutinous rice winemaking[J].Fujian Journal of Agricultural Sciences, 2016, 31(11):1 238-1 243.
[5] 朱小芳, 张凤杰, 俞剑燊, 等.黄酒浸米水中细菌群落结构及优势菌代谢分析[J].食品科学, 2017, 38(10):82-86.
ZHU X F, ZHANG F J, YU J S, et al.Analysis of microbial community structure and metabolic characteristics of dominant microbes in rice milk for yellow wine[J].Food Science, 2017, 38(10):82-86.
[6] DOEUN D, DAVAATSEREN M, CHUNG M S.Biogenic amines in foods[J].Food Science and Biotechnology, 2017, 26(6):1 463-1 474.
[7] FALUS A, GILICZE A.Tumor formation and antitumor immunity;the overlooked significance of histamine[J].Journal of Leukocyte Biology, 2014, 96(2):225-231.
[8] PANCONESI A.Alcohol and migraine:Trigger factor, consumption, mechanisms.A review[J].The Journal of Headache and Pain, 2008, 9(1):19-27.
[9] 曹利瑞, 熊智强, 朱松, 等.黄酒酿造过程中产生物胺菌株的筛选及其特性研究[J].中国食品学报, 2018, 18(6):68-75.
CAO L R, XIONG Z Q, ZHU S, et al.Screening of strains producing biogenic amines and its characteristics during the Chinese rice wine formation[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(6):68-75.
[10] 刘彩琴, 陆胤, 王石磊, 等.黄酒米浆水中抗菌乳酸菌的筛选及特性分析[J].食品工业科技, 2020, 41(9):114-118.
LIU C Q, LU Y, WANG S L, et al.Screening and characteristic analysis of antibacterial lactic acid bacteria from rice pulp of Huangjiu[J].Science and Technology of Food Industry, 2020, 41(9):114-118.
[11] 崔天琦, 杜宏, 吕欣然, 等.植物乳杆菌JY-22细菌素粗提物在鲢鱼鱼丸保鲜中的应用[J].食品科学, 2019, 40(21):229-235.
CUI T Q, DU H, LYU X R, et al.Application of crude bacteriocin of Lactobacillus plantarum JY-22 in preservation of silver carp meatballs[J].Food Science, 2019, 40(21):229-235.
[12] 都立辉, 施荣华, 张虹, 等.肠球菌素的分离提取及其在牛乳杀菌中的应用[J].食品科学, 2014, 35(15):1-4.
DU L H, SHI R H, ZHANG H, et al.Purification of the bacteriocin produced by Enterococcus durans and its application in milk sterilization[J].Food Science, 2014, 35(15):1-4.
[13] 杨鹏斌, 于新, 杨静, 等.绿色木霉菌发酵液萃取物对金黄色葡萄球菌细胞膜的损伤作用[J].食品科学, 2013, 34(15):27-31.
YANG P B, YU X, YANG J, et al.Effect of extract from Trichoderma viride fermentation broth on cell membrane injury of Staphylococcus aureus[J].Food Science, 2013, 34(15):27-31.
[14] 周伟, 刘国荣, 李平兰, 等.植物乳杆菌素L-1对单核细胞增生李斯特氏菌作用机理的研究[J].微生物学报, 2007, 47(2):260-264.
ZHOU W, LIU G R, LI P L, et al.Mode of action of plantaricin L-1, an antilisteria bacteriocin produced by Lactobacillus plantarum[J].Acta Microbiologica Sinica, 2007, 47(2):260-264.
[15] KJOS M, OPPEGÅRD C, DIEP D B, et al.Sensitivity to the two-peptide bacteriocin lactococcin G is dependent on UppP, an enzyme involved in cell-wall synthesis[J].Molecular Microbiology, 2014, 92(6):1 177-1 187.
[16] 刘文婷, 王伟, 易华西, 等.乳酸菌细菌素Lac-B23对荧光假单胞菌及其生物膜的抑制作用[J].食品科学, 2017, 38(24):1-7.
LIU W T, WANG W, YI H X, et al.Anti-biofilm and antimicrobial activity of bacteriocin lac-B23 from lactic acid bacteria against Pseudomonas fluorescens[J].Food Science, 2017, 38(24):1-7.
[17] 赵瑞香, 段改丽, 杨天佑, 等.嗜酸乳杆菌细菌素Lactobacillin XH2抑制大肠杆菌作用机理的探讨[J].食品科学, 2015, 36(3):75-79.
ZHAO R X, DUAN G L, YANG T Y, et al.Antibacterial mechanism of lactobacillin XH2 from Lactobacillus acidophilus on Escherichia coli[J].Food Science, 2015, 36(3):75-79.
[18] ZHAO S M, HAN J Z, BIE X M, et al.Purification and characterization of plantaricin JLA-9:A novel bacteriocin against Bacillus spp.produced by Lactobacillus plantarum JLA-9 from Suan-tsai, a traditional Chinese fermented cabbage[J].Journal of Agricultural and Food Chemistry, 2016, 64(13):2 754-2 764.
[19] SARI N P, SARI R, UNTARI E K.Antibacterial activity test of bacteriocin from Lactobacillus brevis, Lactobacillus casei and Lactobacillus plantarum against gram positive pathogenic bacteria[J].Journal of Tropical Biodiversity and Biotechnology, 2018, 3(3):85.
[20] 乔荣更, 张红星, 谢远红, 等.植物乳杆菌SD26的筛选及对白色念珠菌的抑菌作用[J].北京农学院学报, 2021, 36(3):101-106.
QIAO R G, ZHANG H X, XIE Y H, et al.Screening of Lactobacillus plantarum SD26 and its antibacterial effect on Candida albicans[J].Journal of Beijing University of Agriculture, 2021, 36(3):101-106.
[21] LAVERMICOCCA P, VALERIO F, EVIDENTE A, et al.Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J].Applied and Environmental Microbiology, 2000, 66(9):4 084-4 090.
[22] DOPAZO V, LUZ C, QUILES J M, et al.Potential application of lactic acid bacteria in the biopreservation of red grape from mycotoxigenic fungi[J].Journal of the Science of Food and Agriculture, 2022, 102(3):898-907.
[23] 满丽莉, 向殿军.植物乳杆菌MXG-68所产细菌素的抑菌特性分析[J].食品与发酵工业, 2019, 45(12):35-40.
MAN L L, XIANG D J.Anti-bacterial characteristics of bacteriocin produced by Lactobacillus plantarum MXG-68[J].Food and Fermentation Industries, 2019, 45(12):35-40.
[24] 陆春波, 毛银, 李国辉, 等.植物乳杆菌DY6主要抑菌代谢物的分析和鉴定[J].微生物学通报, 2019, 46(9):2 258-2 271.
LU C B, MAO Y, LI G H, et al.Analysis and identification of main antibacterial metabolites secreted by Lactobacillus plantarum DY6[J].Microbiology China, 2019, 46(9):2 258-2 271.
[25] 孔祥丽, 吴昕雨, 许晓曦.植物乳杆菌代谢产物抑菌机制与应用研究进展[J].食品安全质量检测学报, 2021, 12(8):3 131-3 140.
KONG X L, WU X Y, XU X X.Research progress on metabolites and bacteriostasis mechanism of Lactobacillus plantarum[J].Journal of Food Safety & Quality, 2021, 12(8):3 131-3 140.
[26] 彭书东, 李键, 刘士健, 等.乳酸菌细菌素生物合成机制、抑菌机制及应用研究进展[J].食品与发酵工业, 2019, 45(6):236-242.
PENG S D, LI J, LIU S J, et al.Research progress on biosynthesis, antibacterial mechanism and application of lactic acid bacteria bacteriocin[J].Food and Fermentation Industries, 2019, 45(6):236-242.
[27] WANG Y, QIN Y X, ZHANG Y, et al.Antibacterial mechanism of plantaricin LPL-1, a novel class IIa bacteriocin against Listeria monocytogenes[J].Food Control, 2019, 97:87-93.
[28] BASTOS MDO C, COELHO M L, SANTOS O C.Resistance to bacteriocins produced by Gram-positive bacteria[J].Microbiology (Reading, England), 2015, 161(pt 4):683-700.