甘露醇(mannitol)是山梨醇的同分异构体,为白色透明状固体,有类似蔗糖的甜味[1]。在医药领域,甘露醇是良好的利尿剂,能降低颅内压和眼压,并作为治疗肾病的药剂[2];因其具有无吸湿性、干燥快、化学性质稳定等特点,可制成抗菌、抗癌药物以及维生素等的片剂[3];在食品领域,可用作低吸水性、低热值的甜味剂[4]。随着国家加大内循环经济的调控,甘露醇的价格与产量逐年呈上升趋势。
当前工业化生产结晶甘露醇主要有2种工艺[5]:一种是以果糖为原料,氢化以后转化为甘露醇,然后经过蒸发浓缩,2次降温重结晶而得;另一种是以葡萄糖为原料,通过化学合成异构、差向异构与酶催化异构等步骤,转变成甘露糖,然后加氢转化为甘露醇,再经过3次降温重结晶以及浓缩结晶生产结晶甘露醇。在目前的工业化生产中,结晶甘露醇主要以多次降温重结晶的方式制备。该工艺存在的问题是:结晶过程会产生大量母液,由于母液的重复回配,导致杂醇不断富集,继而造成产品纯度低、结晶收率低,导致获得较高纯度的甘露醇生产成本居高不下,企业难以获得更高的经济效益。
模拟移动床是近几年兴起的一项分离技术[6]。其原理是根据物料中组分的性质差异达到分离的效果,一般可分为2组分色谱分离技术、3组分色谱分离技术以及多组分色谱分离技术等,其中3组分色谱分离技术是在2组分色谱分离的基础上延伸与改进的新型技术[7],该技术通过对各种成分在固定相中运行时间与运行速度的控制,最终达到将3种组分分开的目的,不仅能够有效去除杂醇,提高产品的结晶收率,还可以使物料中各种组分得到合理的利用,从而开发出多元化的产品。目前,随着对模拟移动床分离技术的研究,这种3组分色谱分离模式越来越受到人们的关注。本研究通过对模拟移动床的3组分色谱分离系统中分离树脂、各分离参数进行研究和优化,对模拟移动床高效分离甘露醇的工艺进行实践和论证。
1 材料与方法
1.1 实验材料
1.1.1 主要实验材料
甘露醇(含山梨糖醇、甘露醇、麦芽糖醇、杂醇等),寿光天力药业有限公司;色谱分离专用树脂,Amberlite 99Ca310型、Amberlite 99K310型,杜邦生物化学公司。
1.1.2 主要仪器与设备
PHS-3C型pH计,上海仪电科学仪器股份有限公司;WAY-2S数显阿贝折射仪,上海申光仪器仪表有限公司;HWS-28超级恒温水浴锅,上海一恒仪器有限公司;XPR106DUHQ/AC电子天平,梅特勒-托利多国际有限公司;SHZ-D(Ⅲ)真空抽滤泵,英峪予华仪器厂;UPHW-IV-90T纯化水机,南京优浦仪器设备有限公司; 1515高效液相色谱仪,美国Waters仪器公司;中试级示范性色谱设备(树脂总装填量3.5 m3,美国罗克韦尔控制系统),山东兆光色谱分离技术有限公司。
1.2 实验方法
1.2.1 树脂单柱分离甘露醇
首先使用纯水洗涤实验用色谱树脂,直至树脂上部纯水的电导率、pH值与实验所用纯水的电导率、pH值相同;接着打开单柱上部的筛板,将树脂缓缓倒入单柱中(装填时速度不宜过快,避免在装填时树脂中产生气泡);树脂装填完毕后添加单柱上部筛板,然后用甘露醇主物料收缩树脂2次以上,尽量减少树脂装填的“死体积”;然后使用恒温水浴锅对单柱进行预热升温,待单柱温度升至60 ℃后,开启循环泵,在运行压力0.3 MPa,流速1.8 mL/min条件下进样,一般进样量为10 mL,记录流出液体积;待物料进样完毕,从柱下取样口取样测定甘露醇浓度,待甘露醇出样时开始收集样品,确保每份收集样的量约为4 mL,检测样品的折光率和组成成分。待其折光达到0%时,停止样品收集。以出样体积为横坐标,各种成分的相对浓度为纵坐标,绘制单柱评价曲线图,并计算树脂对甘露醇的分离度,并由此定性定量该树脂对甘露醇物料各组分的分离效果。
1.2.2 中试级色谱分离操作工艺流程
中试色谱示范型装置的操作包括系统试漏、树脂装填、系统预热、参数调节等部分,具体操作内容如下:首先对色谱柱进行保压试漏工作,排查系统阀门、管道存在的漏点;然后用隔膜泵装填实验所用的树脂。树脂装填完毕,启动“预热”程序,用热水对系统进行升温,在温度到达预设值以后,输入初步的运行参数;然后开启色谱系统的自动运行功能。当程序运行完一个周期,温度压力都达到稳定以后,再把色谱进料罐中的纯水换成原料,色谱正式进料;并从8 h后开始取样分析色谱出料的浓度及组成,此后间隔4 h取样,继续跟踪出料浓度以及纯度变化,并最终将运行参数调至最佳。
1.2.3 甘露醇中各个组分含量的测定
采用面积归一法测定各组样品含量。首先利用标准样品确定各糖醇的保留时间,然后用各糖醇的峰面积与所有色谱峰的总面积比值,计算各成分的相对含量。液相条件为:柱温85 ℃;示差检测器温度为40 ℃;进样量10 μL;流动相为超纯水,流速0.6 mL/min;色谱柱为Sugar Park-1(7.8 mm×300 mm)。
1.2.4 结晶甘露醇的传统生产方法
在传统的生产工艺中,主要采用多次降温结晶的方式来制备高纯度的结晶甘露醇。即通过结晶不断提高甘露醇的纯度,最终获得高纯度结晶甘露醇,其工艺流程如图1所示。
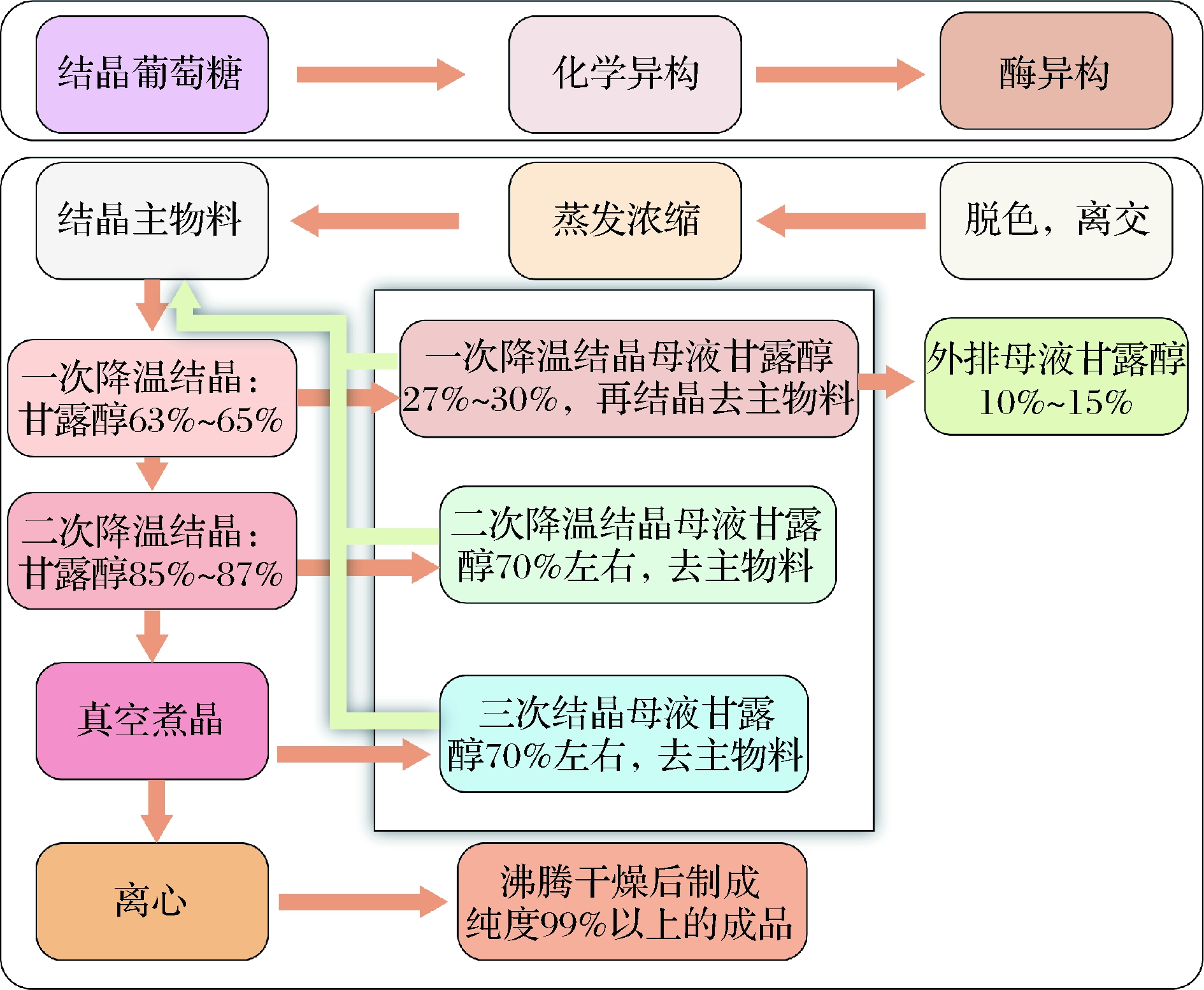
图1 结晶甘露醇的传统生产工艺流程图
Fig.1 Flow chart of traditional production process of
crystalline mannitol
传统工艺生产结晶甘露醇的具体操作如下:
首先配制质量分数50%葡萄糖溶液,然后加入催化剂七钼酸铵(按照葡萄糖干基0.02%~0.3%的比例),在温度100~110 ℃,pH 3.0~3.5的条件下,异构90 min,得到甘露糖含量30%左右,葡萄糖含量69%左右的混合液。其次将混合液打入脱色罐,加入0.5%(干基比)的活性炭进行脱色,经板框过滤后,进入离交系统进行精制处理。在离交液进入异构酶反应罐后,加入质量分数0.003 6% MgSO4和质量分数0.011%的NaNO2以及质量分数0.03%~0.06%的葡萄糖异构酶,在55~60 ℃条件下进行异构,得到葡萄糖40%,甘露糖30%,果糖30%的混合液;异构混合液先进行脱色、离交,然后再浓缩至浓度55%进入反应釜;以雷尼镍作为催化剂,在温度120~140 ℃,压力4.5~8 MPa的条件下,进行氢化反应,得到含量42%左右的甘露醇混合液;最后经过2次冷结晶与一次蒸发结晶得到纯度99%以上的结晶甘露醇,而纯度10%左右的甘露醇母液则从系统中外排。
1.2.5 模拟移动床色谱分离甘露醇的方法
模拟移动床色谱分离技术能把2种或者多种性质相似或相近的物质分开,因而受到企业的青睐,而3组分色谱分离技术就是在此基础上延伸开发出来的。该工艺不仅体现了当今清洁生产的新理念,还为客户开发多元化产品奠定了基础。3组分色谱分离制备结晶甘露醇的工艺流程如图2所示。
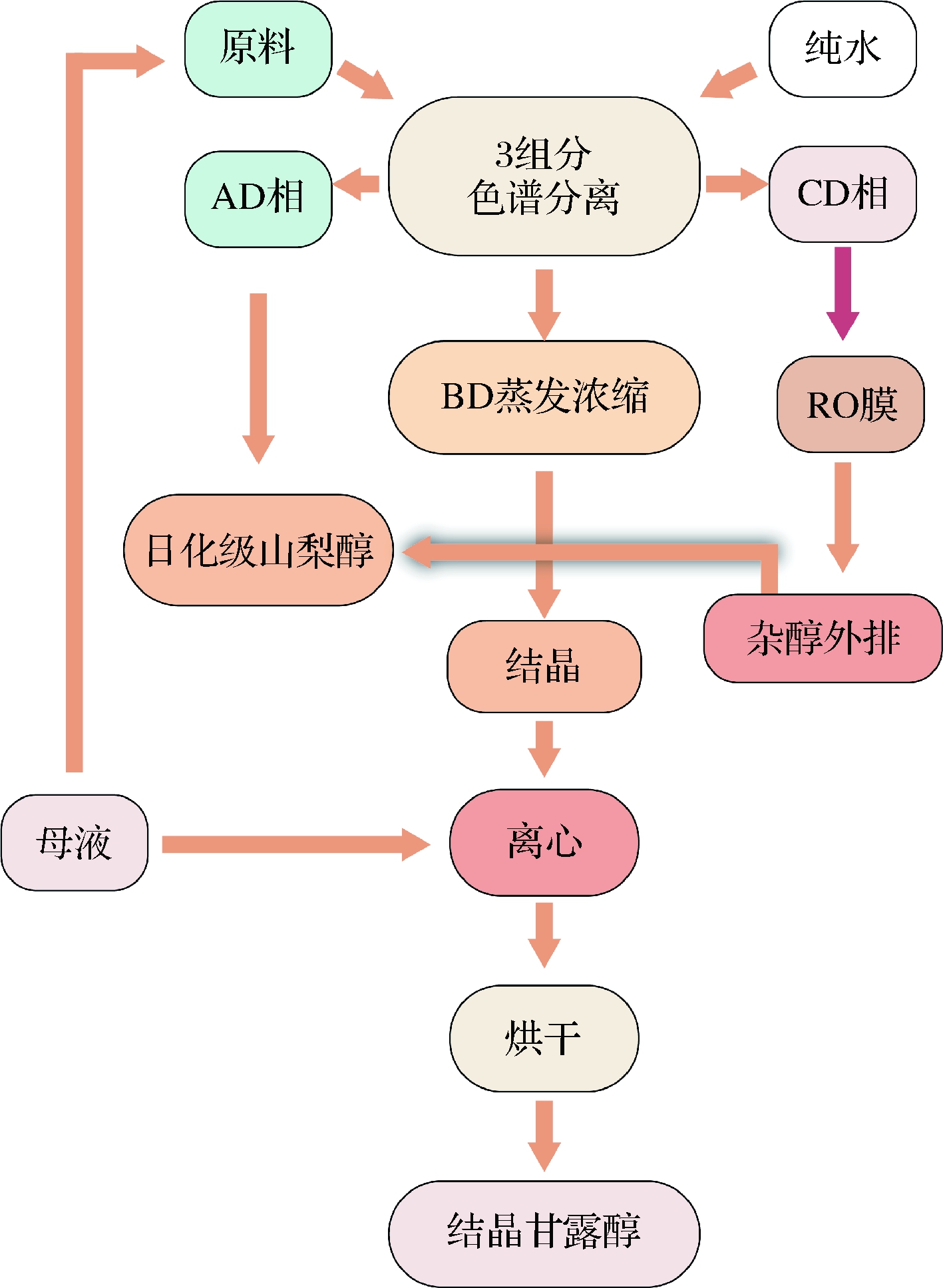
图2 三组分模拟移动床色谱分离制备结晶
甘露醇工艺流程图
Fig.2 Flow chart for preparation of crystalline mannitol by
three component simulated moving bed chromatography
注:AD为慢组分;BD为中间组分;CD为快组分
新型工艺生产结晶甘露醇的具体操作如下:首先将质量分数为50%、纯度为41%的甘露醇,通过模拟移动床色谱系统进行分离,可获得3种不同的组分。其中AD相为慢组分,主要为纯度90%的山梨醇;BD相为中间组分,主要为纯度85%以上的甘露醇;CD相为快组分,主要为纯度10%以下的杂醇。其中,AD相可以进入日化级山梨醇系统,生产日化级山梨醇产品;而CD相先通过RO膜处理,透析出的纯水可以回到色谱进水罐进行利用,而浓相则进入山梨醇系统,生产日化级山梨醇。其次,色谱分离所得BD相,先经过蒸发浓缩至浓度50%,然后注入结晶罐进行热结晶;结晶所得物料通过绞龙机输送至离心机进行离心;离心后的出料通过沸腾干燥剂制成结晶甘露醇成品;而离心以后的母液则可以回到色谱前罐进行二次利用。
2 结果与分析
2.1 两种不同树脂单柱评价甘露醇分离效果
2.1.1 钙型树脂Amberlite 99Ca310对甘露醇的分离
表1为钙型树脂Amberlite 99Ca310分离甘露醇的单柱评价实验数据。
该树脂的单柱评价曲线如图3所示。在图3中,横坐标表示2种组分流出液的体积,纵坐标表示2种组分流出液的质量百分比。此外,分离度代表树脂对物料中2种不同组分的分离效果,分离度越高,分离效果越好。通过对曲线图中甘露醇与山梨醇色谱峰的各项指标进行测量,将测定的数值代入分离度公式,钙型树脂对2组分的分离度按公式(1)计算:
表1 钙型树脂分离甘露醇的单柱评价实验
Table 1 Experimental data of single column evaluation of mannitol separation with calcium type resin
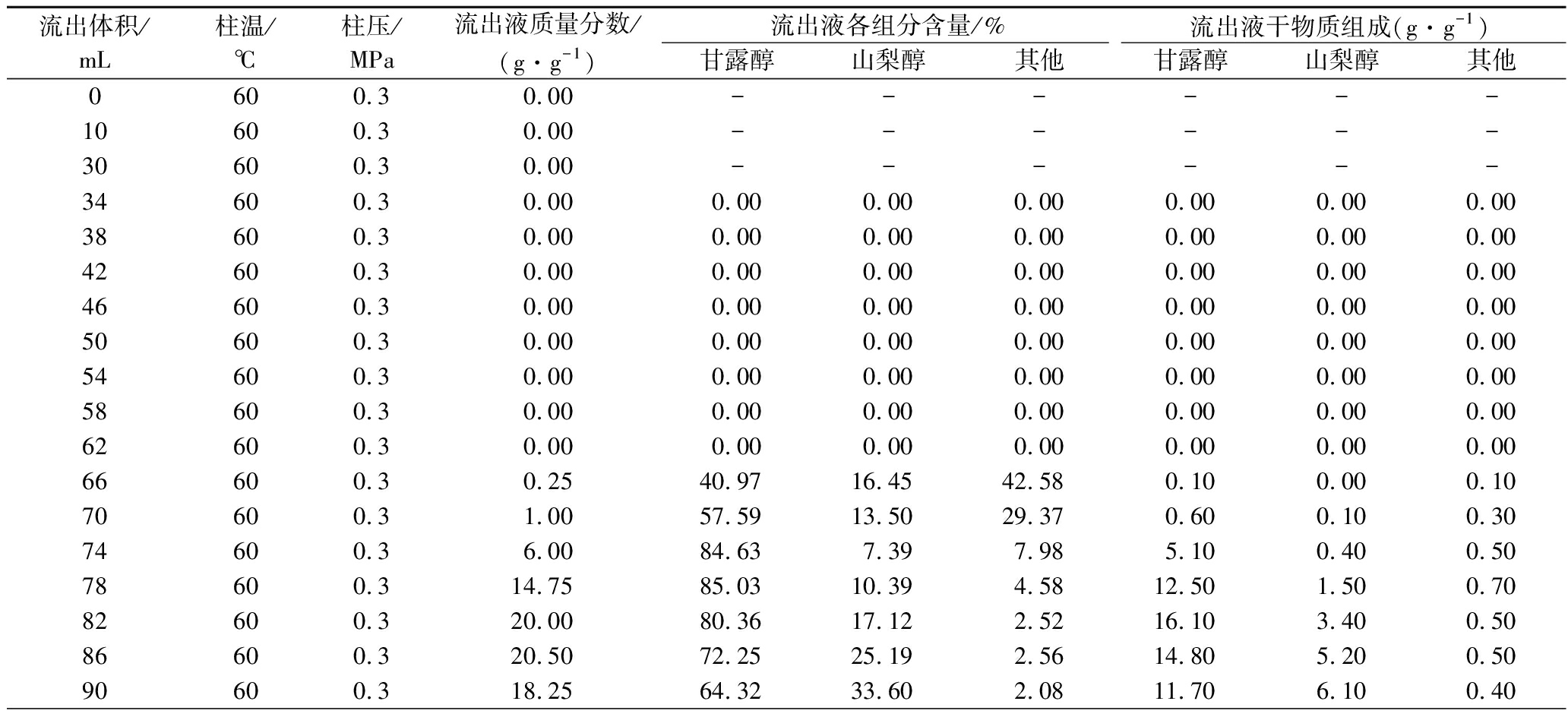
流出体积/mL柱温/℃柱压/MPa流出液质量分数/(g·g-1)流出液各组分含量/%流出液干物质组成(g·g-1)甘露醇山梨醇其他甘露醇山梨醇其他0600.30.00------10600.30.00------30600.30.00------34600.30.000.000.000.000.000.000.0038600.30.000.000.000.000.000.000.0042600.30.000.000.000.000.000.000.0046600.30.000.000.000.000.000.000.0050600.30.000.000.000.000.000.000.0054600.30.000.000.000.000.000.000.0058600.30.000.000.000.000.000.000.0062600.30.000.000.000.000.000.000.0066600.30.2540.9716.4542.580.100.000.1070600.31.0057.5913.5029.370.600.100.3074600.36.0084.637.397.985.100.400.5078600.314.7585.0310.394.5812.501.500.7082600.320.0080.3617.122.5216.103.400.5086600.320.5072.2525.192.5614.805.200.5090600.318.2564.3233.602.0811.706.100.40
续表1

流出体积/mL柱温/℃柱压/MPa流出液质量分数/(g·g-1)流出液各组分含量/%流出液干物质组成(g·g-1)甘露醇山梨醇其他甘露醇山梨醇其他94600.314.7555.2742.781.958.206.300.3098600.311.0045.5852.921.505.005.800.20102600.38.2535.7962.911.303.005.200.10106600.35.7526.6972.560.751.504.200.00110600.34.0019.0779.881.050.803.200.00114600.32.5013.5686.340.100.302.200.00118600.31.509.3390.380.290.101.400.00122600.30.506.4592.101.450.000.500.00126600.30.304.7894.340.880.000.300.00
注:“-”表示单柱进样区间,此时没有取样
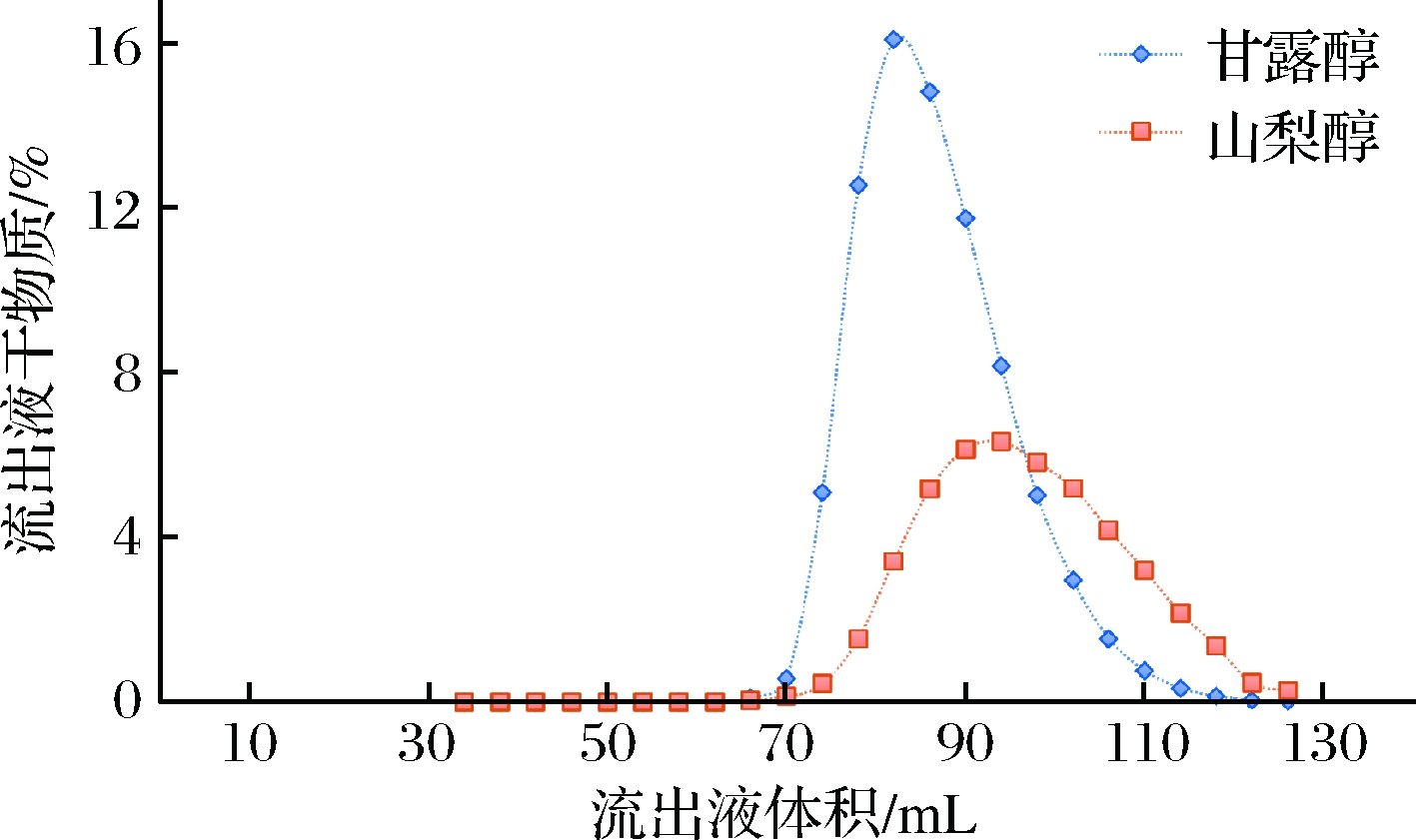
图3 钙型树脂单柱评价甘露醇流出液体积与浓度曲线图
Fig.3 Chart of volume and concentration of mannitol
effluent evaluated by single column calcium type resin
(1)
式中:R,分离度;V山,山梨醇从质量分数0%至最高质量分数的流出液体积;V甘,甘露醇从质量分数0%至最高质量分数的流出液体积;W1/2山,山梨醇色谱峰半峰宽的宽度;W1/2甘,甘露醇色谱峰半峰宽的宽度。
图3中各组分对应的半峰宽以及流出液体积关系如图4所示。根据图4中测量的数值,R=(93-83)/(18+30)=0.208,即山梨醇与甘露醇的分离度为0.208。
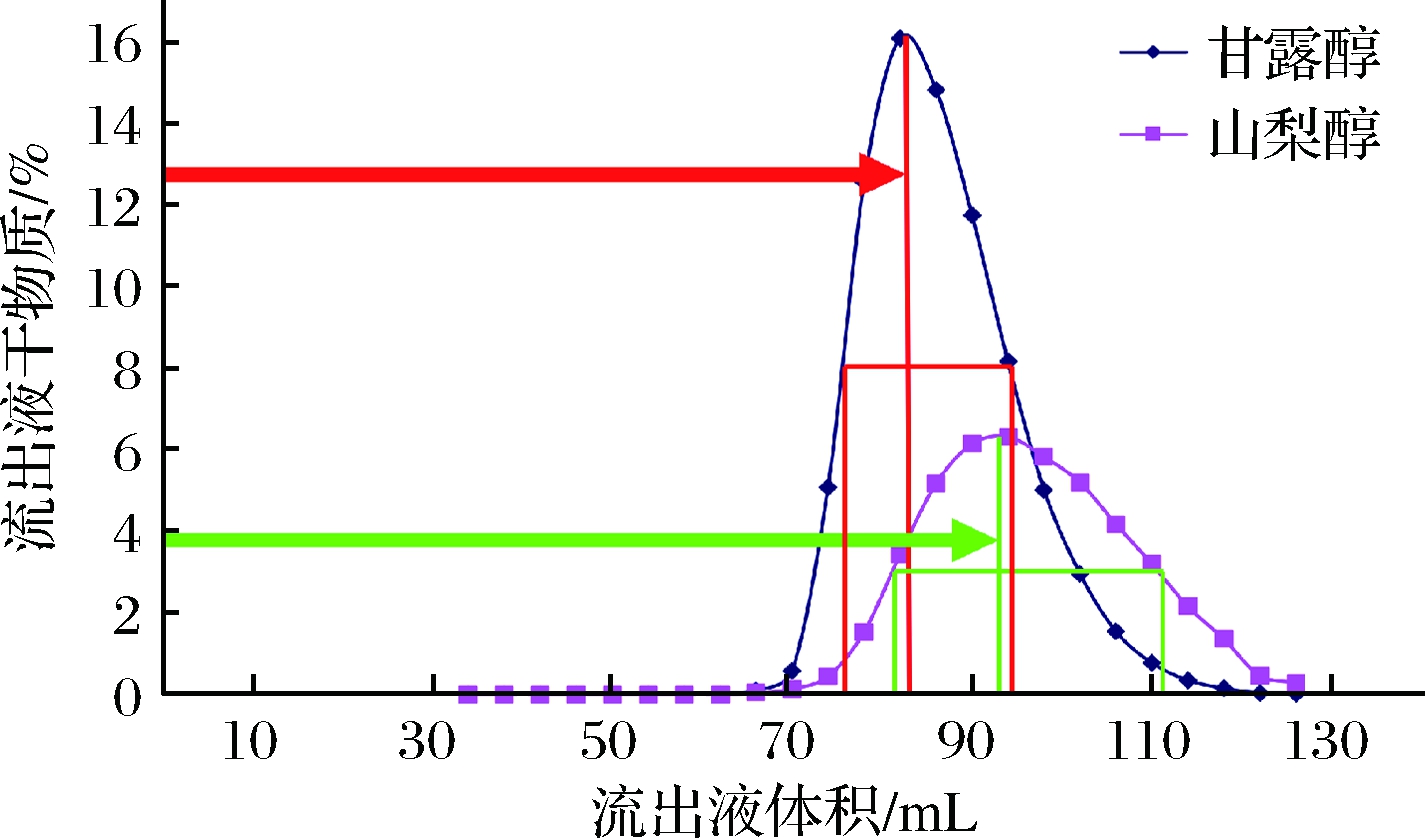
图4 钙型树脂分离度计算示意图
Fig.4 Schematic diagram for calculation of
separation of calcium type resin
2.1.2 钾型树脂Amberlite 99K310对甘露醇的分离实验
钾型树脂Amberlite 99K310分离甘露醇的单柱评价实验数据详见表2。
表2 钾型树脂分离甘露醇的单柱评价实验
Table 2 Experimental data of single column evaluation of mannitol separation with Potassium type resin
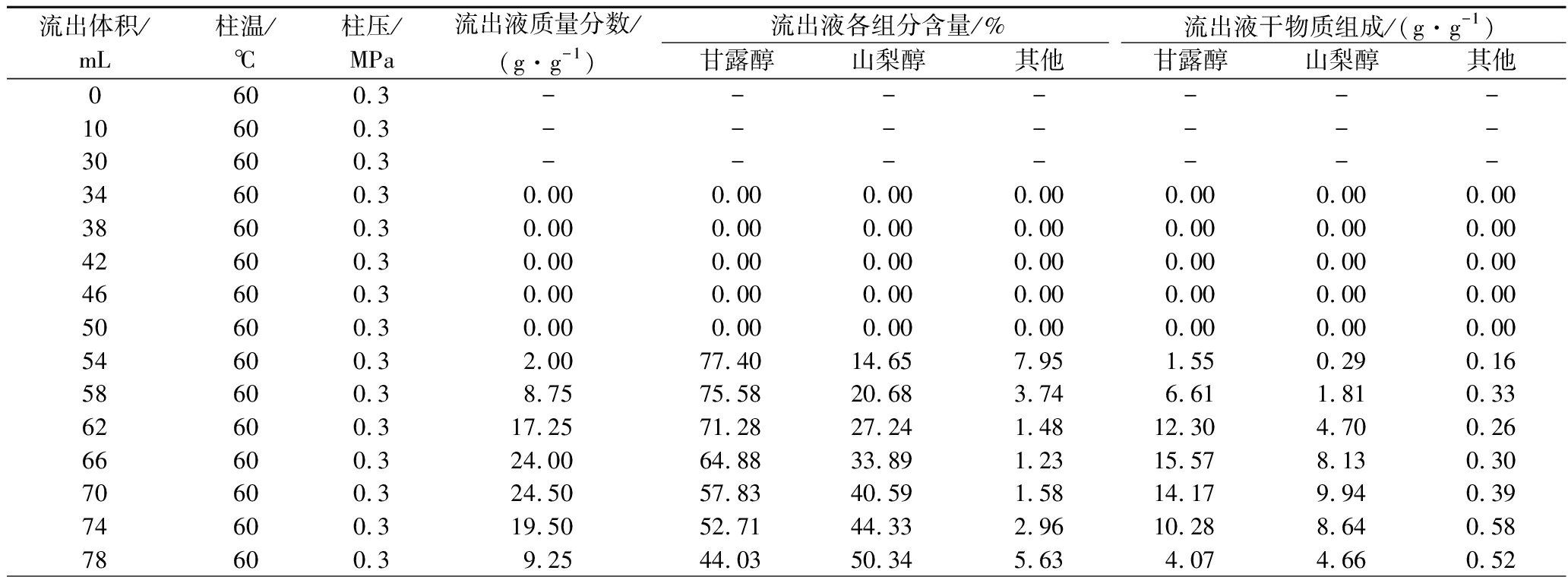
流出体积/mL柱温/℃柱压/MPa流出液质量分数/(g·g-1)流出液各组分含量/%流出液干物质组成/(g·g-1)甘露醇山梨醇其他甘露醇山梨醇其他0600.3-------10600.3-------30600.3-------34600.30.000.000.000.000.000.000.0038600.30.000.000.000.000.000.000.0042600.30.000.000.000.000.000.000.0046600.30.000.000.000.000.000.000.0050600.30.000.000.000.000.000.000.0054600.32.0077.4014.657.951.550.290.1658600.38.7575.5820.683.746.611.810.3362600.317.2571.2827.241.4812.304.700.2666600.324.0064.8833.891.2315.578.130.3070600.324.5057.8340.591.5814.179.940.3974600.319.5052.7144.332.9610.288.640.5878600.39.2544.0350.345.634.074.660.52
续表2
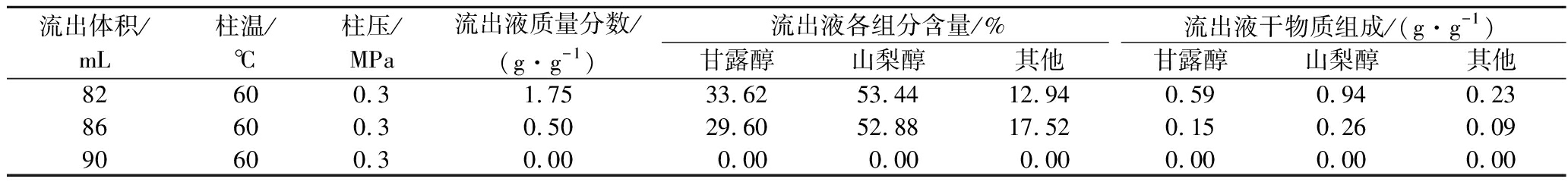
流出体积/mL柱温/℃柱压/MPa流出液质量分数/(g·g-1)流出液各组分含量/%流出液干物质组成/(g·g-1)甘露醇山梨醇其他甘露醇山梨醇其他82600.31.7533.6253.4412.940.590.940.2386600.30.5029.6052.8817.520.150.260.0990600.30.000.000.000.000.000.000.00
该树脂的单柱评价曲线如图5所示。
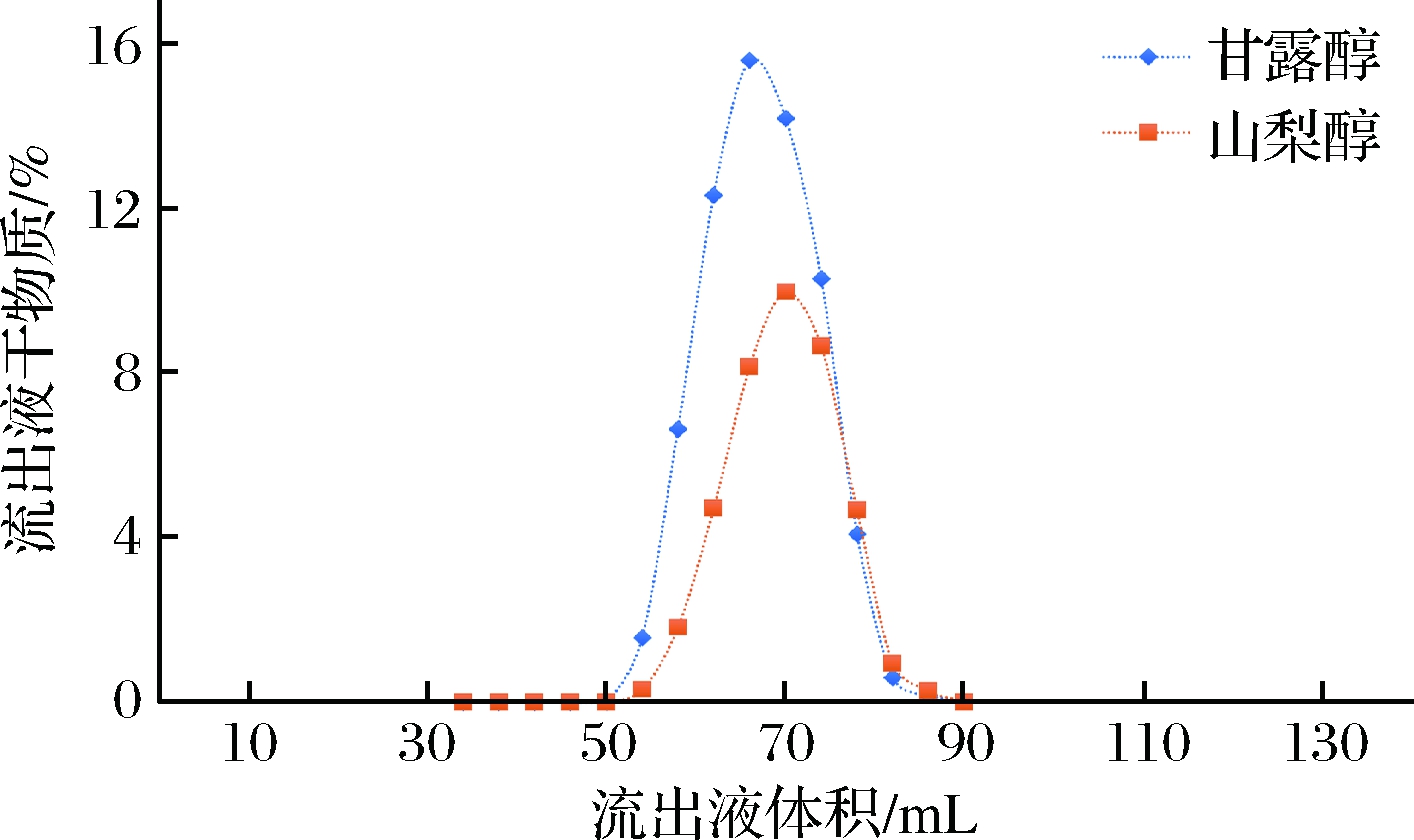
图5 钾型树脂单柱评价甘露醇流出液体积与浓度曲线图
Fig.5 Chart of volume and concentration of mannitol
effluent evaluated by single column potassium resin
采用与钙型树脂分离度相同的计算方式来计算钾型树脂对2种组分的分离度。通过对分离度曲线图中甘露醇与山梨醇色谱峰的各项指标进行测量,即可以计算出甘露醇对山梨醇的分离度。曲线图中各组份对应的半峰宽以及流出液体积值如图6所示。根据图6数据,R=(70-66)/(16+17)=0.121,即山梨醇与甘露醇的分离度为0.121。
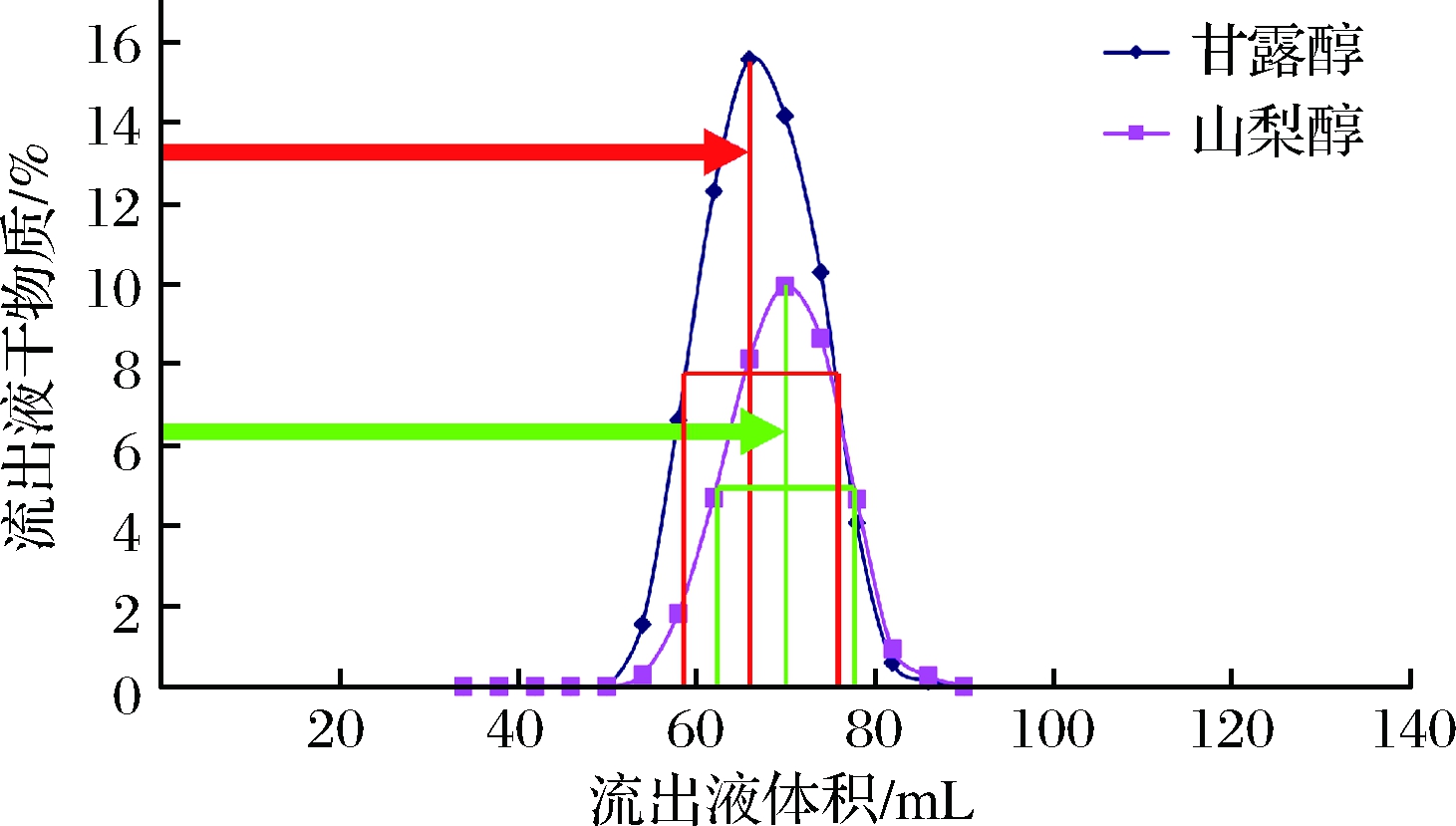
图6 钾型树脂分离度计算示意图
Fig.6 Schematic diagram for calculation of separation of
potassium type resin
通过对以上2种树脂的单柱评价数据进行分析,可以得出如下结论:
从出料浓度的角度分析:采用钙型树脂,甘露醇组分最高质量分数为16.1%;采用钾型树脂,甘露醇组份最高质量分数为15.57%。钙型树脂对甘露醇的吸附效果要优于钾型树脂。从洗脱液用水量的角度分析:采用钙型树脂,洗脱液用水量为60 mL;采用钾型树脂,洗脱液用水量为40 mL。钾型树脂用水量要少于钙型树脂。从分离度的角度分析:采用钙型树脂分离度为0.208;采用钾型树脂分离度为0.121。钙型树脂对山梨醇与甘露醇的分离度要大于钾型树脂。
综上所述,除洗脱液用水量以外,在出料浓度与分离度指标方面,钙型树脂都优于钾型树脂;而用水量指标可以通过运行参数进行调节,所以最终选择钙型树脂作为分离介质。
2.2 色谱分离纯化甘露醇优化的工艺参数
利用3组分模拟移动床色谱分离工艺,不但可以去除混合体系中杂醇(此处为山梨醇)、纯化甘露醇,而且能够获得日化级山梨醇产品。分离参数及优化指标见表3~表5。
表3 色谱出料慢组分(AD液)指标 单位:%
Table 3 Indexes of slow component (AD liquid)
separated from chromatography
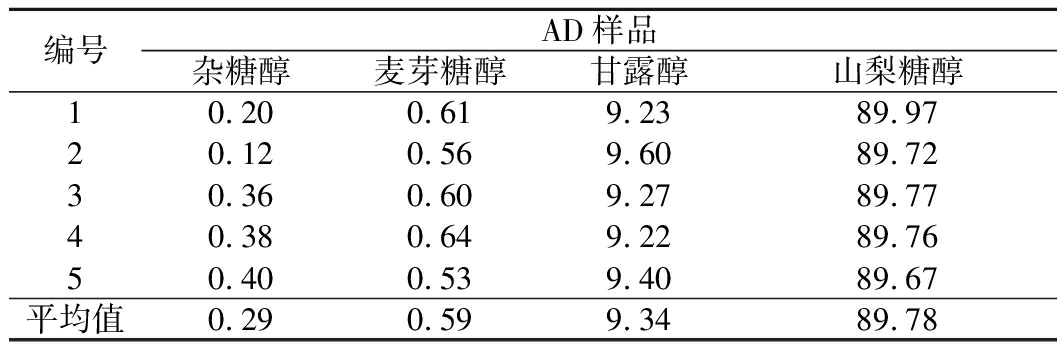
编号AD样品杂糖醇麦芽糖醇甘露醇山梨糖醇10.200.619.2389.9720.120.569.6089.7230.360.609.2789.7740.380.649.2289.7650.400.539.4089.67平均值0.290.599.3489.78
注:AD为慢组分的出料产品,BD为中间组分的出料产品,CD为快组分的出料产品(下同)
表4 色谱分离中间组分(BD液)指标 单位:%
Table 4 Indexes of intermediate component (BD liquid)
separated from chromatography
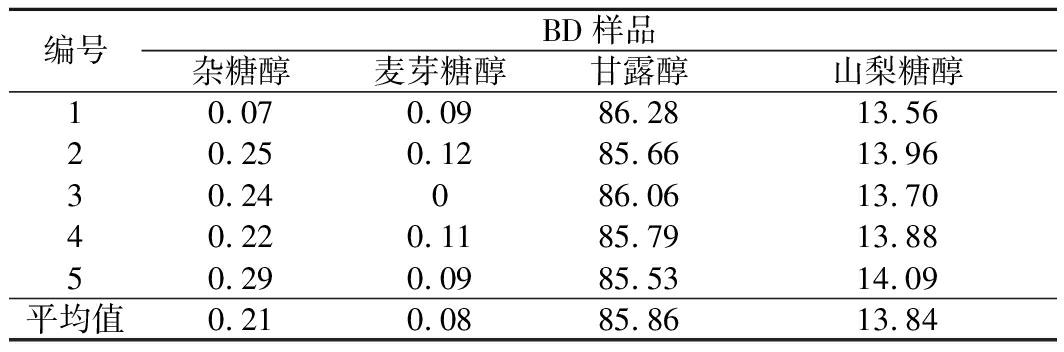
编号BD样品杂糖醇麦芽糖醇甘露醇山梨糖醇10.070.0986.2813.5620.250.1285.6613.9630.24086.0613.7040.220.1185.7913.8850.290.0985.5314.09平均值0.210.0885.8613.84
表5 色谱分离快组分(CD液)指标 单位:%
Table 5 Indexes of fast component (CD liquid)
separated from chromatography
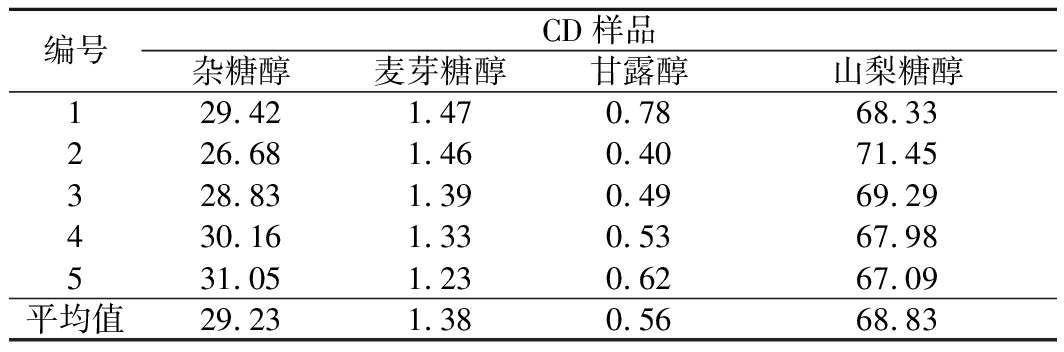
编号CD样品杂糖醇麦芽糖醇甘露醇山梨糖醇129.421.470.7868.33226.681.460.4071.45328.831.390.4969.29430.161.330.5367.98531.051.230.6267.09平均值29.231.380.5668.83
在色谱分离过程中,受色谱进料组成不稳定的影响,色谱出料的各个组分始终处于波动状态,由表3~表5可知,主产品甘露醇纯度为85.86%,收率为93%,杂糖醇收率85%以上。由此可见,色谱分离工艺具有很好地回收主产品以及去除杂糖醇的能力。
2.3 两种生产工艺指标及经济效益比对
对甘露醇的传统生产工艺和本文研发的3组分模拟移动床工艺的工艺指标和生产过程的成本(经济效益)进行对比,结果见表6。
表6 同种物料情况下2种生产工艺出料指标对比单位:%
Table 6 Output indexes of two different processes
using the same material
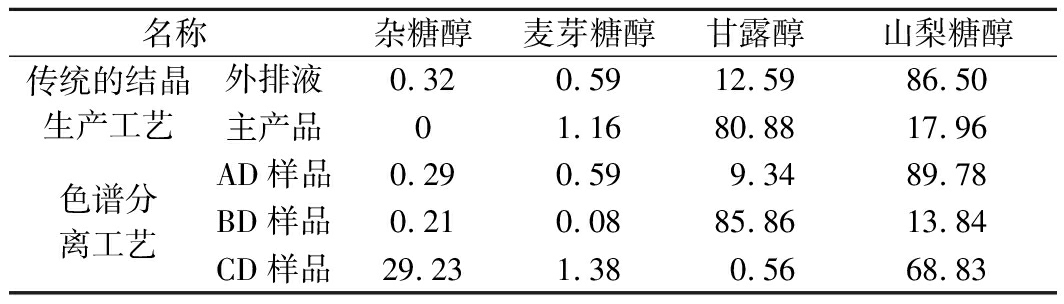
名称杂糖醇麦芽糖醇甘露醇山梨糖醇传统的结晶生产工艺外排液0.320.5912.5986.50主产品01.1680.8817.96色谱分离工艺AD样品0.290.599.3489.78BD样品0.210.0885.8613.84CD样品29.231.380.5668.83
表6反映了在同种物料的条件下,传统工艺与色谱分离工艺出料产品的各项指标的对比表。传统的结晶工艺主产品甘露醇的纯度为80.88%,山梨醇纯度为17.96%,麦糖醇纯度为1.16%,说明山梨醇始终是在主产品这边富集,采用传统的结晶工艺,山梨醇与杂糖醇很难去除。而采用色谱分离工艺,主产品的纯度能达到85%以上,山梨醇纯度降到13.84%,杂糖醇纯度能降到0.21%,说明采用色谱分离工艺,甘露醇的纯度提高,山梨醇与杂糖醇的含量降低,色谱收率以及后道工序的结晶收率大大提高。
年产1万t结晶甘露醇经济效益分析见表7。按照传统结晶生产1 t结晶甘露醇需要消耗2.3 t原料、15 t水、5.5 t蒸汽,用电约700 kWh。折合后可得,采用此工艺生产1 t结晶甘露醇成本约为8 730元;而采用模拟移动床分离工艺,折合价格后,生产1 t结晶甘露醇成本约为8 575元,生产成本明显下降。
表7 以年产1万t结晶甘露醇为例进行经济效益分析
Table 7 Analysis of economic benefits taking crystalline
mannose annual output of 10 000 t as an example
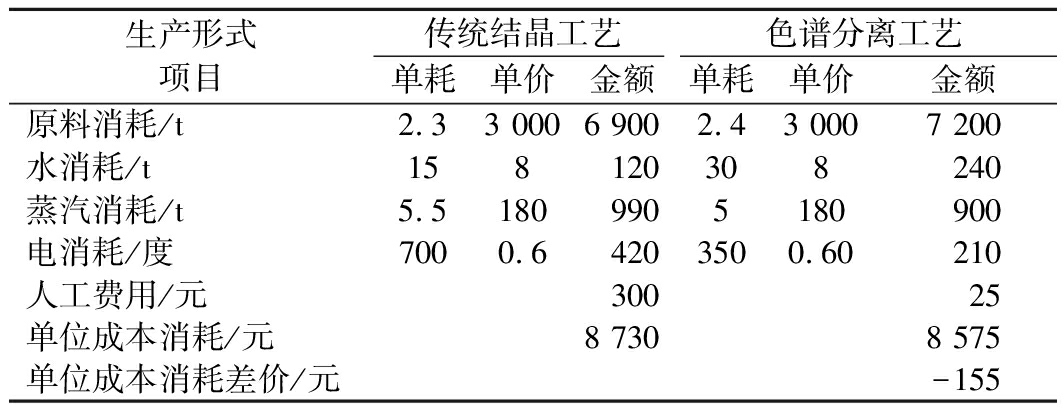
生产形式项目传统结晶工艺色谱分离工艺单耗单价金额单耗单价金额原料消耗/t2.33 0006 9002.43 0007 200水消耗/t158120308240蒸汽消耗/t5.51809905180900电消耗/度7000.64203500.60210人工费用/元30025单位成本消耗/元8 7308 575单位成本消耗差价/元-155
根据表7中数据进行计算和分析,从生产成本上来讲,色谱分离工艺比传统的结晶工艺节省成本155元;以年产1万t结晶甘露醇为例,利用色谱分离技术,每年可以降低的运行成本为155万元。从长远利益来讲,随着人工费用的增加,采用色谱工艺每年可节省275万元。由此可见,采用色谱工艺的成本较传统工艺明显降低。综上所述,无论从设备投资、占地面积、自动化程度以及工艺路线上来讲,采用色谱工艺代替结晶工艺都具备很大的优势。
3 结论与讨论
在甘露醇制备工艺中,杂醇的积累是影响结晶甘露醇收率高低的关键因素。本文采用色谱分离技术,不但解决了杂醇山梨醇的积累问题,而且可以使中间产品纯度提升5%,收率提升3%,在提高纯度和收率的同时降低了生产成本。该新型色谱工艺可以代替传统的3次降温结晶,可以一步将物料纯度从41%提升至85%以上;同时,通过色谱系统将物料中杂醇从AD与CD相进行外排从而避免杂醇对后续结晶的影响,使得结晶收率与产品质量大大提高。
本文通过模拟移动床色谱技术对甘露醇的分离进行了研究,结果表明该工业化色谱分离技术是可行的。本研究结果可为类似产品通过3组分模拟移动床色谱技术的分离提供参考方法和数据支持,有利于我国糖醇加工产业的深化发展和企业生产工艺的转型升级。
[1] GREMBECKA M. Sugar alcohols:Their role in the modern world of sweeteners: A review[J]. European Food Research and Technology, 2015, 241(1):1-14.
[2] 钟健. 浅析甘露醇在临床中的应用[J]. 中西医结合心血管病电子杂志, 2017, 5(17):2-3.
ZHONG J. Application of mannitol in clinic[J]. Cardiovascular Disease Journal of Integrated Traditional Chinese and Western Medicine, 2017, 5(17):2-3.
[3] 王芳, 张建虹. 甘露醇药理机制及在脑血管患者中的临床应用[J]. 临床合理用药杂志, 2022, 15(23):178-181.
WANG F, ZHANG J H. Pharmacological mechanism of mannitol and its clinical application in cerebrovascular patients[J]. Chinese Journal of Clinical Rational Drug, 2022, 15(23):178-181.
[4] 牛立沙. 糖醇在海绵蛋糕中的应用[D]. 无锡: 江南大学, 2017.
NIU L S. Study on the application of sugar alcohols in sponge cake[D]. Wuxi: Jiangnan University, 2017.
[5] 张伟, 章朝晖, 梁光兴, 等. 葡萄糖固定床柱异构工艺制备甘露醇[J]. 中国食品添加剂, 2017(6):144-150.
ZHANG W, ZHANG C H, LIANG G X, et al. Study on mannitol preparation from glucose by fixed bed column isomerization[J]. China Food Additives, 2017(6):144-150.
[6] 李云飞, 栾庆民, 刘峰, 等. 模拟移动床色谱在多组分糖液分离中的研究应用进展[J]. 食品与发酵工业, 2022, 48(11):338-344.
LI Y F, LUAN Q M, LIU F, et al. Development and research of simulated moving bed chromatography in separation of multi-fraction saccharides[J]. Food and Fermentation Industries, 2022, 48(11):338-344.
[7] 张前峰, 王兆光. 利用三组分色谱分离技术制备高纯度结晶麦芽糖醇[J]. 食品与发酵工业, 2019, 45(20):237-241.
ZHANG Q F, WANG Z G. Preparation of high purity crystalline maltol by three-component chromatography[J]. Food and Fermentation Industries, 2019, 45(20):237-241.