纳米银(silver nanoparticles,AgNPs)因其具有独特的表面增强特性、等离子体效应、催化活性及抗菌性,被广泛用在食品抗菌、医疗抗癌、纺织制造、废水处理和信息材料等领域[1]。近年来,AgNPs常被用作填料添加进包装薄膜或涂膜材料中,应用于奶制品、肉制品及果蔬的贮藏保鲜[2],其可显著抑制产品中微生物的生长,从而延长产品的保质期,在食品贮藏保鲜领域有巨大的应用潜力[3]。常见的AgNPs制备方法有物理法和化学法。物理法原理简单,制得的AgNPs纯度高,但设备成本高,且所得AgNPs粒径不均,易发生团聚;化学法虽能制备稳定的AgNPs粒子,但使用的化学试剂具有一定毒性,不环保,且所得AgNPs也不适合用于食品包装。绿色合成法则是采用天然无毒的植物材料或微生物系统作为还原剂和封端剂来合成AgNPs,可直接、快速地合成粒径小、纯度高、稳定性好的AgNPs,且在合成过程中不产生有毒副产物[4]。其中,利用富含抗氧化活性物质的植物提取液来进行AgNPs的绿色合成,在近年来引起了广泛关注[5]。
柚子[Citrus maxima (Burm) Merr.]为芸香料柑橘属植物,品种众多,是亚热带的主要果树之一。柚子皮作为柚子果实的副产物约占鲜果总重的20%~50%,其除了常见的水分、油脂、纤维素等成分外,还含有维生素、类胡萝卜素、抗坏血酸、类黄酮、烟酸、核黄素、类柠檬苦素等有机化合物[6]。这些富含羟基和醛基的化合物提取简单、无毒无污染、绿色环保,且抗氧化性强,可用作天然的还原剂[7]。但在目前的报道中,柚子皮主要用于加工饮品和蜜饯,以及制作肥料[8],缺少对其中活性物质的利用。因此,有效利用柚子皮中的抗氧化活性物质,提高其附加值的研究显得极为重要。机械球磨法是1970年BENJAMIN[9]在研究氧化物弥散强化镍基高温合金时提出的,其原理是在机械研磨的过程中使粉末发生变形、变性、破裂和分解等物理或化学反应,具有简单、绿色以及高效等优点[10]。研磨的过程中微观结构的细化,可使后续提取过程中柚子皮中有机化合物充分释放,有效提高其利用率[11]。有研究报道,将蛋壳膜与AgNO3的共混物放入球磨仪中进行反应,能合成粒径小、稳定性高、抗菌能力强的AgNPs粒子[12],这为机械球磨在纳米粒子合成中的应用奠定了基础。
本研究以机械球磨后的柚子皮提取液为还原剂,为提高绿色合成法的效率,以AgNPs产率和粒径为指标,优化制备条件,并对制备的AgNPs的性能进行表征,为其在食品包装中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜柚子[Citrus maxima (Burm) Merr.],市售;AgNO3、氨水、NaCl、NaOH、K2HPO4、DPPH(均为分析纯),成都市科龙化工试剂厂;牛肉膏、蛋白胨、琼脂粉、葡萄糖(均为分析纯),北京奥博星生物科技有限责任公司;大肠杆菌(Escherichia coli)BNCC336953、金黄色葡萄球菌(Staphylococcus aureus)BNCC354037、沙门氏菌(Salmonella)BNCC103283、枯草芽孢杆菌(Bacillus subtilis)BNCC184122,北纳创联生物技术有限公司。
1.2 仪器与设备
LGJ-10型真空冷冻干燥机,北京松源华兴科技发展有限公司;HH·B-S型电热恒温培养箱,上海跃进医疗器械厂;Nano-ZS90型马尔文激光粒度仪,英国马尔文公司;THZ-D型台式恒温摇床,江苏太仓市实验设备厂;SP-756P型紫外分光光度计,上海光谱仪器有限公司;BM6Pro型行星式球磨仪,北京格瑞德曼仪器设备有限公司;YK-24HDD型高温高压灭菌锅,江阴滨江医疗设备有限公司;JEM-1200EX型透射电子显微镜,日本电子公司;XRD-7000型X射线衍射仪,日本岛津公司;Nicolet 6700型傅里叶变换红外光谱仪,美国Nicolet公司。
1.3 实验方法
1.3.1 柚子皮粉末的制备
用蒸馏水将新鲜柚子表皮清洗干净,剥下柚皮并去除柚皮上的白瓤,保留约2 mm厚的外皮。然后将外皮切成碎片,真空冷冻干燥12 h后,用高速多功能粉碎机将干燥的柚皮粉碎,得到柚皮粉末,再将粉末过200目筛,能通过筛子的粉末即为实验所需的原料。将原料放入相对湿度60%、温度25 ℃的防潮柜中储存备用。
1.3.2 AgNO3及银氨溶液的制备
准确称取2 g AgNO3,将其溶于纯水中并定容至100 mL,配制成2%(质量分数,下同)的AgNO3溶液,避光低温保存备用。取2%的AgNO3溶液50 mL,向其中逐滴加入2%的氨水,边滴边振荡,直到最初生成的沉淀刚好溶完为止,得到银氨溶液(Tollens试剂),低温避光保存备用。
1.3.3 AgNPs的制备
称取一定量的柚子皮粉末(0.8、1.0、1.2 g)和25 g球磨珠(大珠∶中珠∶小珠=1∶2∶2,质量比)于球磨筒体中,以500 r/min的速度球磨一定的时间(20、40、60 min),将球磨后的粉末放入250 mL的烧杯中。然后向烧杯中加入80 mL的去离子水及20 mL 1%的AgNO3或银氨溶液,在90 ℃下水浴加热反应一定时间(0、0.5、1.0、1.5、2.0 h)合成AgNPs,最后将反应液4 000 r/min离心10 min,保留上清液,即得AgNPs溶液。
1.3.4 结构及性能表征
通过AgNPs的紫外可见吸收光谱(ultraviolet and visible spectroscopy,UV-Vis)、粒径分布及粒径大小分析银源、球磨时间、柚子皮添加量以及加热时间对制备AgNPs的影响,再表征AgNPs的结构和性能。
1.3.4.1 紫外吸光光谱的测定
将AgNPs溶液稀释50倍后,使用紫外分光光度计测定其在325~700 nm范围内的UV-Vis,分辨率为1 nm。
1.3.4.2 粒径的测定
将AgNPs溶液稀释100倍后,使用马尔文激光粒度仪测定AgNPs的粒径,样品池内温度25 ℃,平衡60 s。
1.3.4.3 微观形貌测定
将均匀分散的AgNPs溶液滴在覆炭铜网上,室温干燥后,使用透射电子显微镜(transmission electron microscope,TEM)对样品进行观察。观察条件为点分辨0.24 nm、线分辨率0.14 nm和加速电压200 kV。
1.3.4.4 结晶形貌测定
根据于嘉伦等[13]的方法,采用X射线衍射仪测定AgNPs的X射线衍射(X-ray diffraction,XRD)图谱。
1.3.4.5 红外光谱测定
将AgNPs溶液充分干燥后,采用KBr压片法测定AgNPs在波数500~4 000 cm-1的红外光谱(Fourier transform infrared spectrum,FTIR)。扫描次数32次,分辨率4 cm-1。
1.3.4.6 稳定性测定
将AgNPs溶液稀释50倍,置于4 ℃避光保存,每隔24 h吸取3.5 mL到石英比色皿中,使用紫外分光光度计测量溶液的最大吸光度值。
1.3.4.7 抗氧化性测定
准确称取0.019 7 g DPPH溶于无水乙醇中并定容至100 mL,得到浓度为0.05 mmol/L的DPPH溶液,装入棕色瓶中备用。分别称取0.03 g球磨后的柚子皮粉末和冻干后的AgNPs粉末分散于30 mL 0.05 mmol/L的DPPH溶液中,充分摇匀后置于25 ℃、150 r/min的恒温振荡器中避光反应30 min。反应结束后将溶液6 000 r/min离心6 min,使用紫外分光光度计测定上清液在517 nm下的吸光度值,以乙醇为参比调零。并用二丁基羟基甲苯(butylated hydroxytoluene,BHT)和维生素C作为阳性对照。样品的DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:Ai,样品加入DPPH溶液混匀后立即离心测得的吸光度值;Ac,DPPH溶液的吸光度值;Aj,样品与DPPH溶液反应30 min后的吸光度值。
1.3.4.8 抗菌性测定
将直径为6 mm的无菌滤纸片分别放在生理盐水、柚皮粉末提取液(8 g/L)、稀释1倍(50% AgNPs)及不稀释的AgNPs溶液中浸泡24 h后,根据于嘉伦等[13]的方法测量各组样品对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌以及沙门氏菌的抑菌圈直径。
准确称取10 mg冻干后的AgNPs粉末分散于10 mL的生理盐水中,并将其进行2倍浓度梯度稀释,得到质量浓度为1 000、500、250、125、62.5、31.3、15.6、7.8、3.9 mg/L的AgNPs分散液,灭菌后备用。然后,根据于嘉伦等[13]的方法测定AgNPs溶液对4种菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。按照AgNPs浓度从高到低将样品编号为1~9,阴性和阳性对照分别编号为10和11。
从MIC实验样品中各吸取0.2 mL混合液滴加到营养琼脂培养基上,涂布均匀后37 ℃恒温培养24 h,观察培养基上细菌的生长情况。若培养基上有菌落形成则用“+”表示;若没有菌落形成则用“-”表示。以培养基上没有细菌生长时向试管中加入的最低AgNPs的浓度作为最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.5 数据统计分析
使用Excel进行数据处理与分析,采用单因素方差(ANOVA)对数据进行显著性分析(P<0.05)。所有实验数据均测定3次及以上,结果以“平均值±标准差”表示。
2 结果与讨论
2.1 AgNPs合成工艺的优化
2.1.1 银源的影响
用AgNO3和银氨溶液分别作为银源制备AgNPs(柚子皮添加量0.8 g,球磨时间1 h, 加热反应时间1.5 h),所得AgNPs的UV-Vis谱图和粒径分布如图1所示。
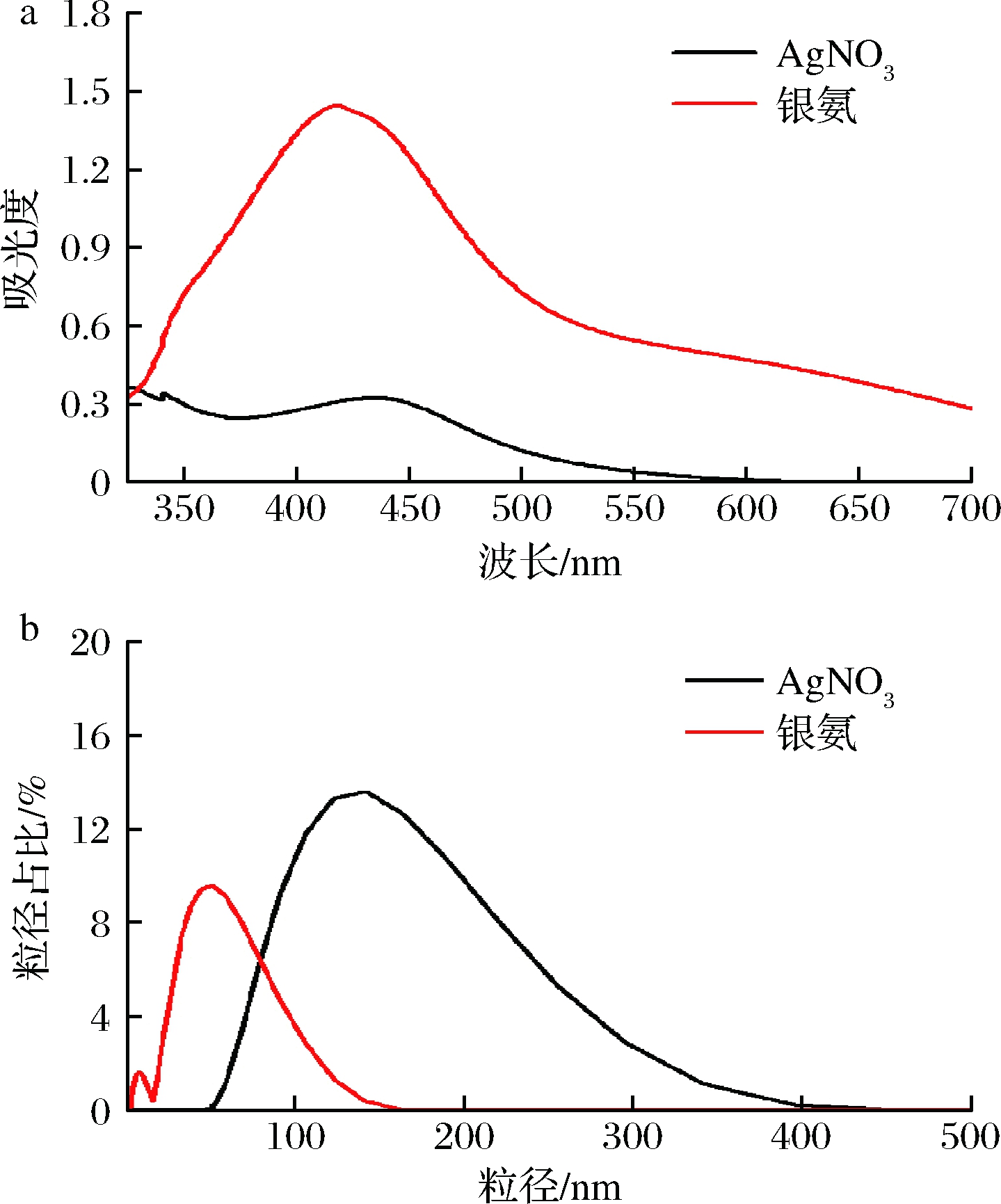
a-UV-Vis谱图;b-粒径分布图
图1 银源对AgNPs的UV-Vis谱图及粒径分布的影响
Fig.1 Effect of silver sources on the UV-Vis spectra
and particle size distribution of AgNPs
2种银源制备的AgNPs样品均在430 nm左右有1个明显的吸收峰(图1-a),为AgNPs表面等离子体共振所产生[14],由此表明采用2种银源均可制得AgNPs粒子。采用银氨溶液制备的AgNPs溶液在最大吸收波长处的吸光度值显著高于AgNO3制备的AgNPs溶液,表明采用银氨溶液为原料时转化率更高;采用AgNO3溶液为原料时,制备的AgNPs溶液的最大吸收波长发生了较大程度的红移,表明其粒径较大。图1-b所示的粒径分布进一步证实了该结果。其中,银氨溶液制备的AgNPs粒径分布较窄(图1-b),且平均粒径仅为(44.54±2.81) nm,显著低于AgNO3溶液制备的AgNPs粒径(148.97±4.84) nm(P<0.05)。相较于AgNO3,银氨溶液中的Ag+与氨基络合后,容易被醛、糖等化合物还原发生银镜反应,且银氨离子中的氨基容易与柚子皮中含羧基、酚羟基、氨基等基团的活性物质结合,使得银氨离子被这些活性物质吸附后,在溶液中形成多个独立的反应位点的同时生成AgNPs,因此所得AgNPs的粒径较小[15]。而AgNO3较难被醛、糖等弱还原剂还原,反应活化能高,反应速率慢,导致反应过程中生成的AgNPs容易发生互相碰撞而团聚[16]。因此,采用绿色还原法时,应采用银氨溶液为银源,制备得到的AgNPs具有产率高、粒径小、分布均匀等特点。具有较小粒径的AgNPs其比表面积更高,可释放出更多的Ag+,因此抗菌效果更好[17]。DONDI等[18]使用银氨溶液作为银源,采用糖三唑作为还原剂和钝化配体,制备得到高度稳定、尺寸和形状受控的AgNPs。
2.1.2 球磨时间的影响
图2所示为球磨时间分别为20、40、60 min(采用银氨溶液为银源,柚子皮添加量0.8 g,加热反应1.5 h)时所制备AgNPs的UV-Vis谱图和粒径分布。
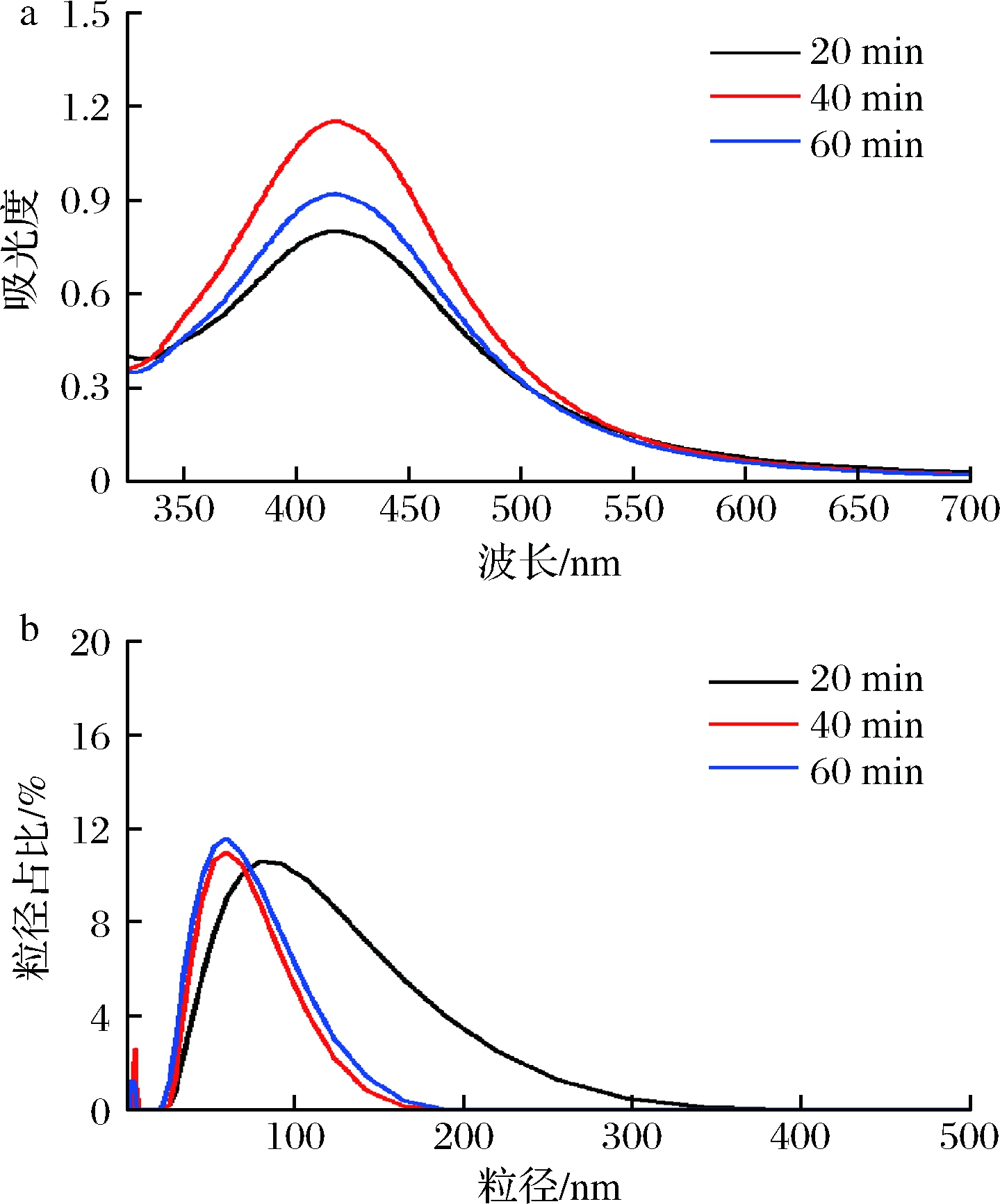
a-UV-Vis谱图;b-粒径分布图
图2 球磨时间对AgNPs的UV-Vis谱图及粒径分布的影响
Fig.2 Effect of ball milling time on the UV-Vis spectra
and particle size distribution of AgNPs
当球磨时间为40 min时,所得AgNPs的最大吸光度值最高,粒径分布最窄,平均粒径最小为(42.07±1.84) nm;当球磨时间为20或60 min时,所得AgNPs的吸光度较低,平均粒径分别为(63.12±1.53)和(49.21±1.47) nm,粒径分布范围均有所增加。球磨时间过短,柚子皮纤维破坏不充分,在后续加热反应过程中,柚子皮中还原性物质释放不完全,反应液中还原剂较少,导致AgNPs的产率低,且此时吸附在AgNPs表面的活性物质较少,AgNPs不稳定而易发生团聚,因此粒径分布不均;而球磨时间过长,柚子皮中部分还原性物质可能在球磨珠的持续碰撞过程中发生分解,同样造成后续反应中还原剂减少,并且研磨时间较长会导致研磨介质的污染[12]。BAL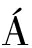 Ž等[12]将AgNO3溶液分别与球磨了30 min的蛋壳膜和45 min的牛至混合,均成功制备了粒径约为35 nm的AgNPs,与本文研究结果接近。因此,最佳球磨时间为40 min。
Ž等[12]将AgNO3溶液分别与球磨了30 min的蛋壳膜和45 min的牛至混合,均成功制备了粒径约为35 nm的AgNPs,与本文研究结果接近。因此,最佳球磨时间为40 min。
2.1.3 柚子皮添加量的影响
分别加入0.8、1.0、1.2 g柚子皮进行球磨,制备得到AgNPs(银氨溶液为银源,球磨时间40 min,加热反应1.5 h)的UV-Vis谱图和粒径分布如图3所示。
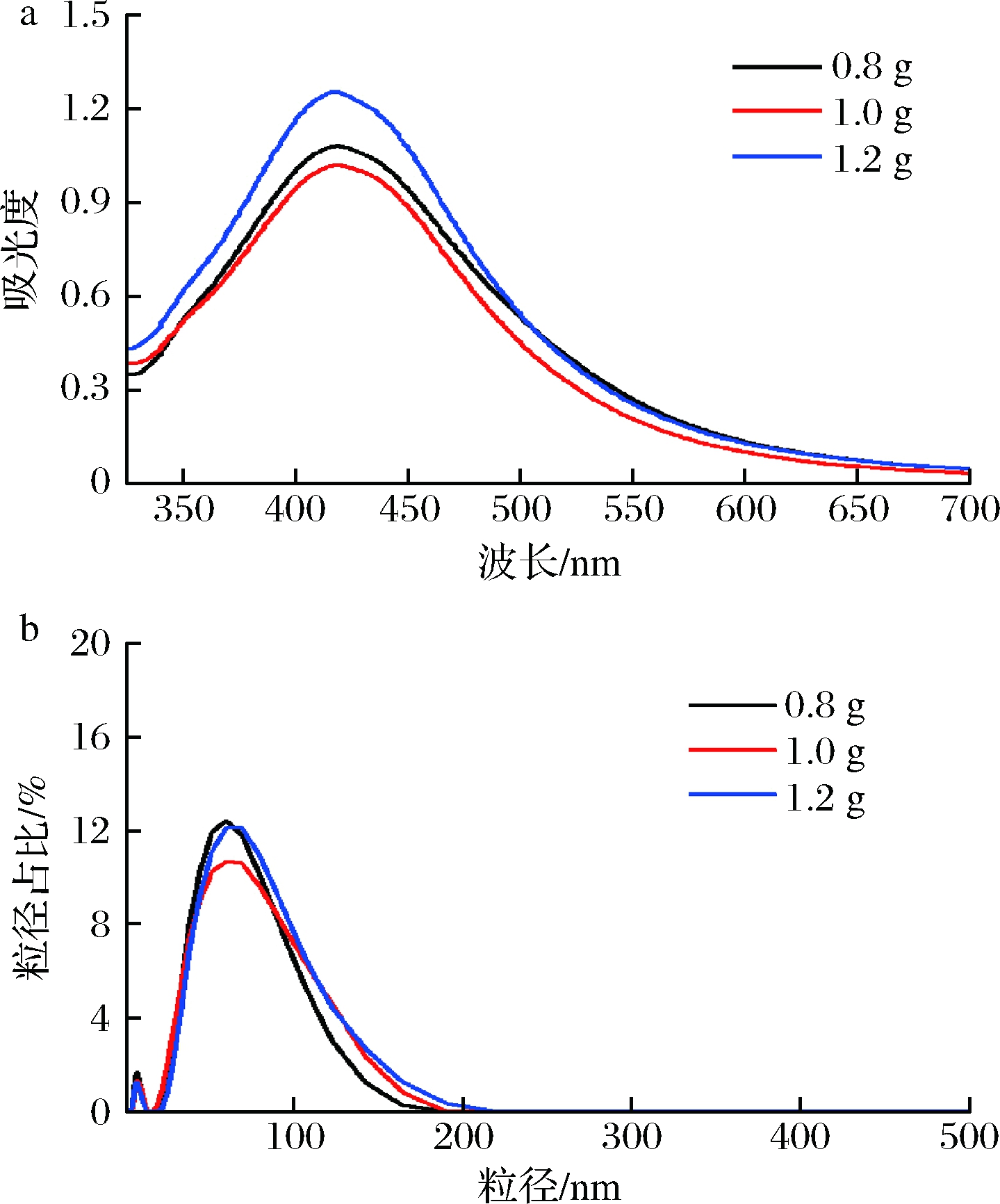
a-UV-Vis谱图;b-粒径分布图
图3 柚子皮添加量对AgNPs的UV-Vis谱图
及粒径分布的影响
Fig.3 Effect of pomelo peel adding amount on the UV-Vis
spectra and particle size distribution of AgNPs
随着柚子皮粉末添加量的增加,所得AgNPs的最大吸光度值先降低后增加,粒径分布范围逐渐增大,其平均粒径分别为(37.61±0.46)、(42.07±1.84)、(47.37±2.22) nm,呈显著增加(P<0.05)的趋势。柚子皮用量的增加使反应中的还原剂增加,有利于提高转化率,但是过多的柚子皮会导致球磨不充分,且AgNPs合成过程中,过多的还原剂吸附在AgNPs表面,导致其粒径增加。SONG等[19]发现随着木兰叶提取物添加量的提升,合成AgNPs的粒径逐渐增加,并推断纳米粒子的粒径与其表面结合的封端分子之间的相互作用有关。综上选择柚子皮的添加量为0.8 g。
2.1.4 加热时间的影响
以不同加热时间(0、0.5、1.0、1.5、2.0 h)制备AgNPs(采用银氨溶液为银源,柚子皮添加量为0.8 g,球磨时间为40 min),结果如图4所示。以上4种加热时间下制备的AgNPs平均粒径分别为(111.43±8.13)、(44.89±1.68)、(42.34±1.45)、(41.27±0.01)、(42.62±0.20) nm。当不加热时(0 h),溶液中只有非常少的AgNPs产生,且粒径分布范围很广,其平均粒径远高于加热反应所得的AgNPs粒径,可能是温度较低时,未达到反应的活化能,导致溶液中的活化分子较少,发生反应的活性位点少,导致更多的银氨离子吸附在少数反应成核的AgNPs表面,使其粒径增大。于嘉伦[20]采用天草柑提取液制备AgNPs最佳反应温度为90 ℃,本实验在此基础上进行了加热时间的优化。由图4-a可知,加热时间从0.5 h增加至1.5 h时,溶液的最大吸光度值逐渐增加,AgNPs粒径逐渐减小(图4-b)。当加热时间增至2.0 h时,溶液的最大吸光度值反而降低,且AgNPs粒径增大,表明大量的AgNPs合成后,再继续加热搅拌会导致AgNPs的聚集。由此说明,在加热活化后,AgNPs逐渐生成,但反应在1.5 h后已基本完成。因此,合成AgNPs的最优加热时间确定为1.5 h。
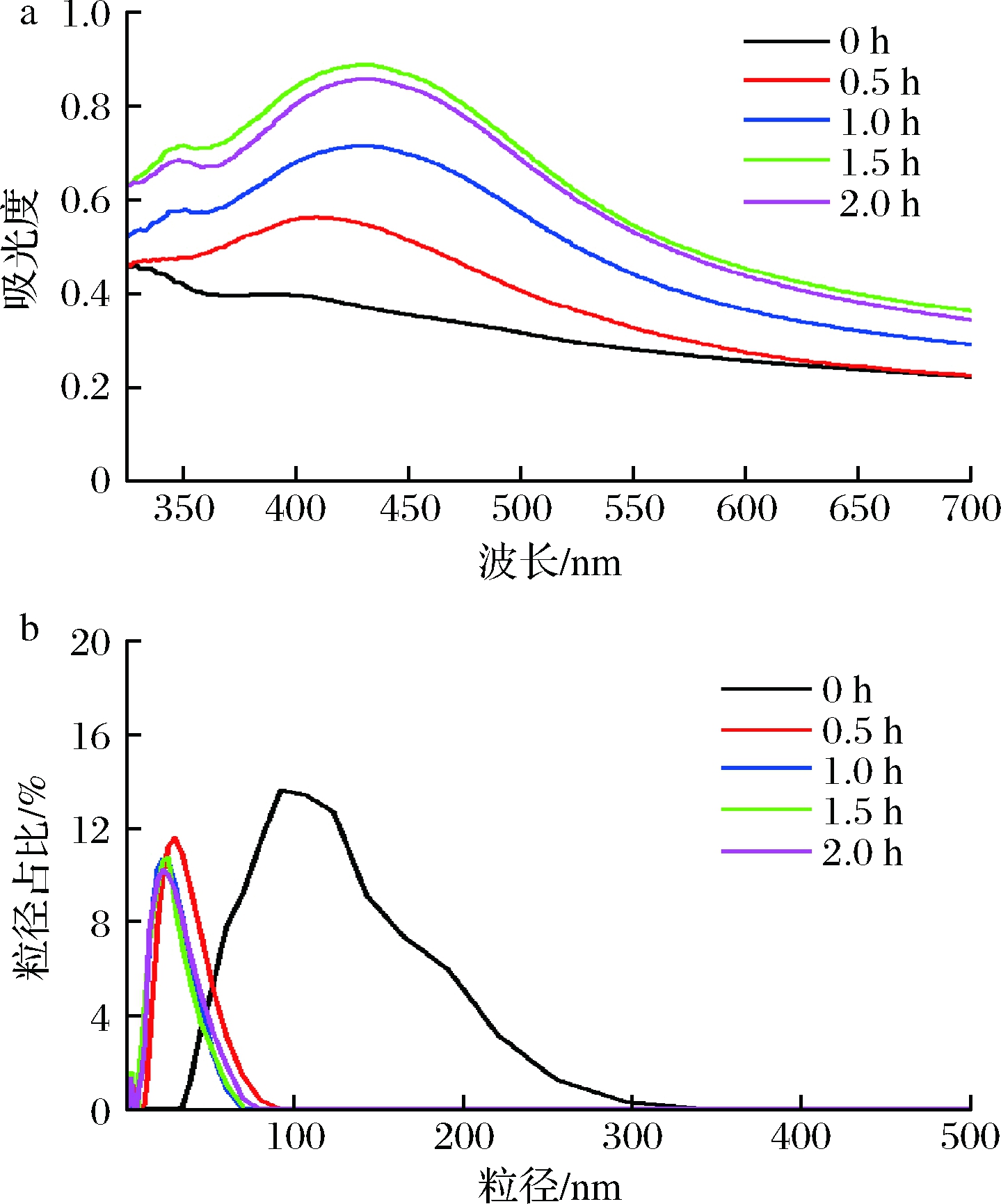
a-UV-Vis谱图;b-粒径分布图
图4 加热时间对AgNPs的UV-Vis谱图及粒径分布的影响
Fig.4 Effect of heating time on the UV-Vis spectra
and particle size distribution of AgNPs
2.2 AgNPs的结构和性能分析
2.2.1 形貌与结构分析
采用以上所得最佳工艺(将20 mL银氨溶液和0.8 g球磨40 min的柚子皮加入80 mL纯水中,在90 ℃下加热搅拌1.5 h)合成AgNPs,并对其进行表征。首先,利用TEM观察AgNPs的微观结构,结果如图5-a、图5-b所示。AgNPs粒子近于球形,且可均匀分散,说明本方法制备的AgNPs具有良好的分散性。同时观察到部分较小粒径的AgNPs,结合粒径分布图(图1-b和图4-b)可知AgNPs在溶液中呈双峰分布,主要分布在0~10 nm及20~40 nm,可能是由于在反应的过程中先合成了较小粒径的AgNPs,然后合并成较大的簇,并进一步重结晶成更大的Ag微晶[12]。

a-TEM(单个AgNP);b-TEM(多个AgNPs)
图5 AgNPs微观结构图
Fig.5 Microstructures of AgNPs
利用XRD测定AgNPs的结晶形貌,结果如图6-a所示。在2θ值为38.4°、44.1°、64.4°、77.1°处出现了尖锐的吸收峰,与JCPDS (No.04-0783)立方相Ag的标准峰相一致,分别对应于立方相Ag的(111),(200),(220)和(311)晶面[21]。由此说明,银氨溶液中的Ag+被还原为AgNPs颗粒,且其晶相为面心立方结构。2θ=22.6°处的宽吸收峰可能是AgNPs表面吸附的活性有机物质产生的,说明柚子皮中的还原性物质可能吸附于AgNPs表面。
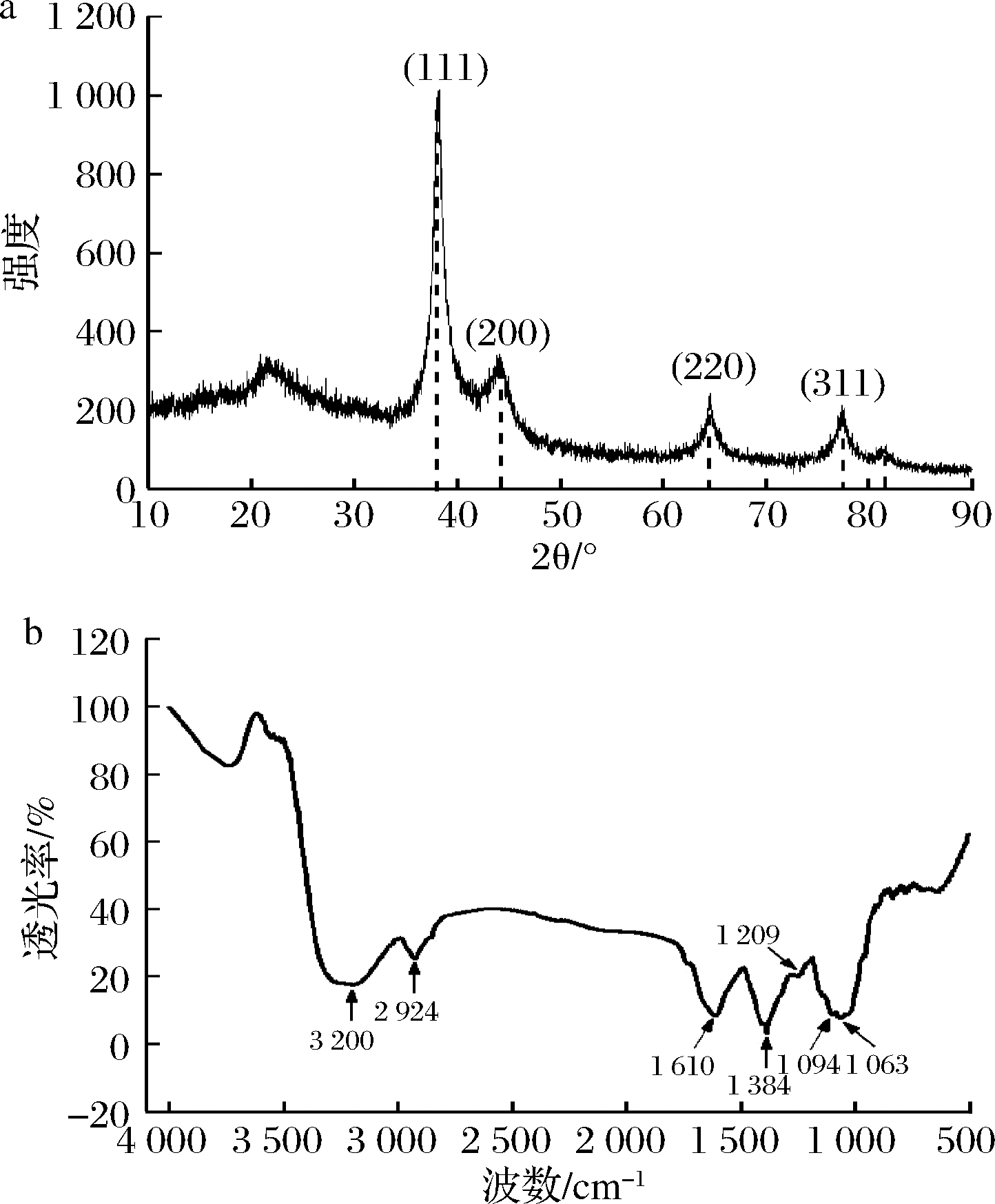
a-XRD图谱;b-FTIR图谱
图6 AgNPs的XRD与FTIR结果图
Fig.6 XRD and FTIR results of AgNPs
AgNPs的FTIR图可在3 200、2 924、1 610、1 384、1 209、1 094、1 063 cm-1处观察到吸收峰,分别对应于—OH,—C![]() C—,—C
C—,—C![]() O,—COOH以及芳香烃中—CH等键的伸缩和拉伸振动(图6-b)。这些有机基团可能源自于柚子皮中富含的多酚、类黄酮等活性物质,说明柚子皮提取液中的这些活性物质在还原Ag后,可附着于生成的AgNPs表面,形成稳定的—C—O…Ag、—CO—O…Ag等配位键。这些活性物质不仅在合成AgNPs的过程中,控制了晶核的生长方向,且在合成后吸附于AgNPs表面,增加了其表面极性,使其可稳定分散于水溶液中[22]。同时,由于AgNPs表面附着了一层有机物,从TEM中观察到的AgNPs粒径小于激光粒度仪所测得的粒径[23]。
O,—COOH以及芳香烃中—CH等键的伸缩和拉伸振动(图6-b)。这些有机基团可能源自于柚子皮中富含的多酚、类黄酮等活性物质,说明柚子皮提取液中的这些活性物质在还原Ag后,可附着于生成的AgNPs表面,形成稳定的—C—O…Ag、—CO—O…Ag等配位键。这些活性物质不仅在合成AgNPs的过程中,控制了晶核的生长方向,且在合成后吸附于AgNPs表面,增加了其表面极性,使其可稳定分散于水溶液中[22]。同时,由于AgNPs表面附着了一层有机物,从TEM中观察到的AgNPs粒径小于激光粒度仪所测得的粒径[23]。
2.2.2 稳定性、分散性与抗氧化性分析
AgNPs溶液的UV-Vis光谱中最大吸光度值随时间变化曲线如图7-a所示。AgNPs溶液初始的最大吸光度值为1.03,在整个贮藏期间数值虽有波动但波动幅度较小,12 d后溶液的最大吸光度值为1.02,仅比第1天下降了0.01,说明AgNPs在水中极稳定。可能是因为柚子皮中的小分子物质吸附在AgNPs的表面[15],降低了AgNPs的表面能,因此在水中不易团聚也不易沉降。
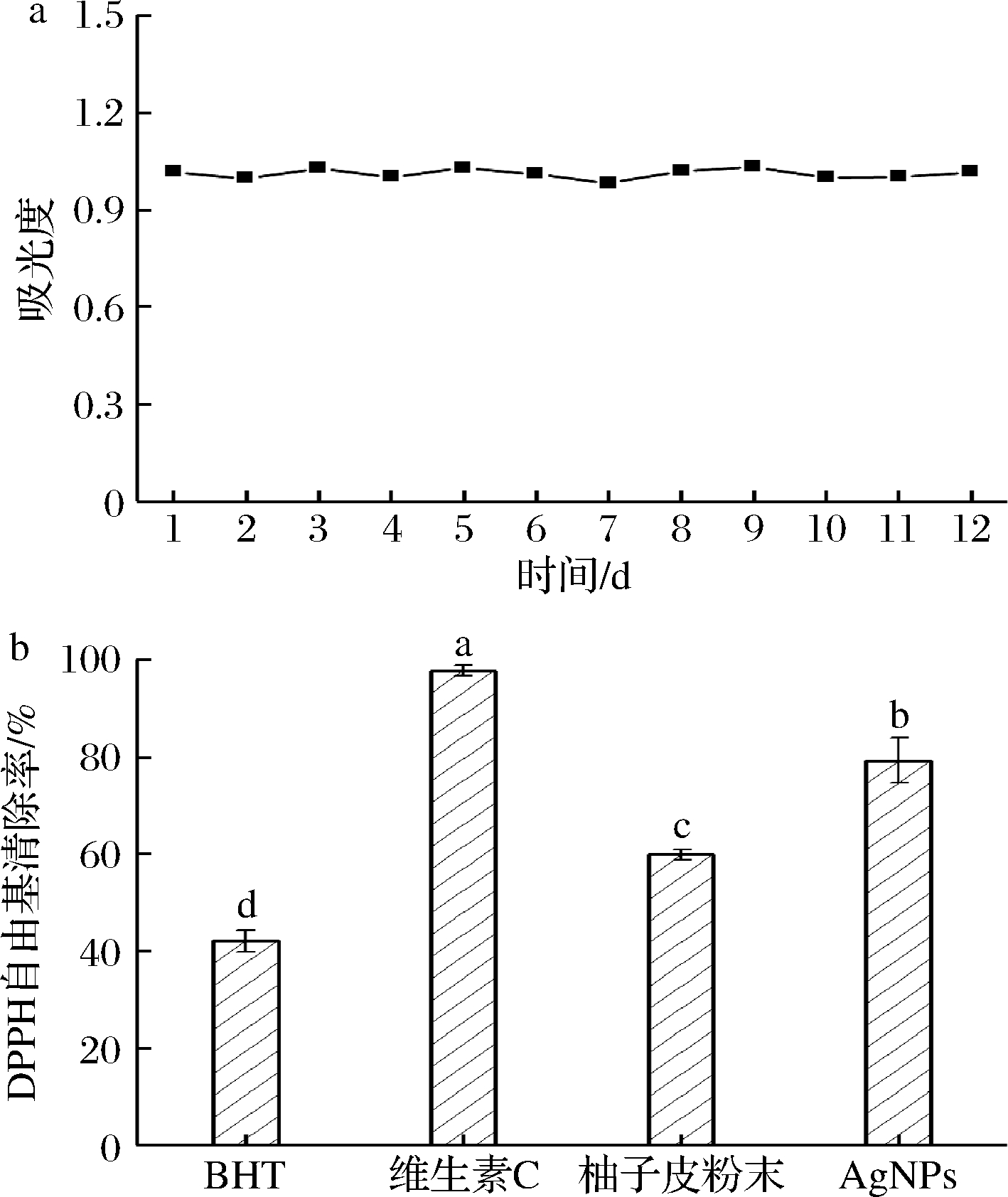
a-贮藏期间AgNPs溶液的最大吸光度值;
b-DPPH自由基清除率
图7 AgNPs溶液在贮藏期间最大吸光度值的变化
与AgNPs的DPPH自由基清除能力
Fig.7 Maximum absorbance of AgNPs solution during
storage and the DPPH free radical scavenging
capability of AgNPs
AgNPs与球磨后柚子皮粉末的DPPH自由基清除能力如图7-b所示,两者对DPPH自由基的清除率均介于BHT和维生素C之间,说明具有较强的抗氧化能力。其中,柚子皮粉末的清除率约为59.78%,而AgNPs约为79.20%,说明AgNPs的抗氧化能力显著高于柚子皮粉末(P<0.05),其原因可能在于AgNPs比表面积大,表面吸附了较多的多酚、类黄酮等,能较好地与DPPH自由基进行反应,而柚子皮粉末中还含有较多纤维等杂质,活性物质的浓度较低,因此抗氧化能力弱于等质量的AgNPs。
2.2.3 抗菌性分析
AgNPs通过释放Ag+不仅能使细胞膜的结构发生变化,细胞液渗漏[24],而且可以与细胞内酶中的硫氢基团发生反应,干扰细胞分裂[25],还可以与细胞中的DNA反应,通过光动力反应显著增强嘧啶二聚化并阻止DNA复制[26],从而使细胞凋亡。因此,AgNPs具有很强的光谱抗菌性,被广泛用于食品、医疗及生活用品中。如图8-a所示,生理盐水和柚子皮粉末提取液对4种菌的生长均无抑制作用,而AgNPs则对4种菌都表现出明显的生长抑制现象,但AgNPs与稀释1倍后的AgNPs溶液(50% AgNPs)的抑菌圈差异不显著,说明较低浓度的AgNPs就具有很强的抑菌性。4种菌中,AgNPs对枯草芽孢杆菌的抑菌效果最明显,其抑菌圈直径达到了28.0 mm,其次为沙门氏菌(11.2 mm)、金黄色葡萄球菌(10.0 mm)和大肠杆菌(9.8 mm)。
AgNPs对4种菌的MIC实验结果如图8-b所示。结果显示AgNPs对大肠杆菌、金黄色葡萄球菌、沙门氏菌和枯草芽孢杆菌的MIC分别为125、125、250、62.5 mg/L,说明AgNPs对4种菌的生长均有良好的抑制效果,但对枯草芽孢杆菌的抑制作用最强,与抑菌圈的结果一致;对大肠杆菌和金黄色葡萄球菌的抑菌能力较为接近;对沙门氏菌的抑制作用相对较弱。
在MIC实验中,虽然营养培养基澄清,但培养基中的细菌不一定被完全杀死。为了进一步探究AgNPs的杀菌性,在MIC实验结果的基础上,测定了AgNPs对4种菌的MBC,结果如表1所示。AgNPs对4种菌均有明显的杀灭效果,对大肠杆菌MBC值最低,为125 mg/L;其次是金黄色葡萄球菌,为250 mg/L;对沙门氏菌和枯草芽孢杆菌具有相同的MBC,为500 mg/L。综上所述,本研究中合成的AgNPs对革兰氏阴性和阳性细菌均有良好的抗菌效果,可用于抗菌食品包装。

a-抑菌圈;b-最小抑菌浓度
图8 AgNPs对4种菌的抑菌圈与最小抑菌浓度图示
Fig.8 The inhibition zone and the minimum inhibitory concentration of AgNPs towards four kinds of bacteria
表1 AgNPs对4种菌的MBC
Table 1 MBC of AgNPs towards four kinds of bacteria

实验菌种AgNPs质量浓度/(mg·L-1)1 00050025012562.531.315.67.83.9阳性对照阴性对照大肠杆菌---+++++++-金黄色葡萄球菌----++++++-沙门氏菌--++++++++-枯草芽孢杆菌--++++++++-
注:若培养基上有菌落形成则用“+”表示;若没有菌落形成则用“-”表示
3 结论
采用球磨后的柚子皮合成AgNPs时,银源、球磨时间、柚子皮添加量以及加热时间对AgNPs的粒径和得率均有较大的影响。将0.8 g球磨40 min的柚子皮加入20 mL银氨溶液中,在90 ℃下加热搅拌1.5 h制备AgNPs,得率高,粒径小且均匀。在此条件下合成的AgNPs平均粒径为(37.61±0.46)nm,呈球形面心立方结构,可均匀分散在水性介质中且稳定性好。其对DPPH自由基的清除率约为79.2%,对大肠杆菌、金黄色葡萄球菌、沙门氏菌及枯草芽孢杆菌的抑制生长和杀灭作用显著。本研究对柚子皮进行球磨处理以促进其活性还原性物质的溶出,并以银氨溶液为银源,大大提高了AgNPs合成反应的转化率,制备得到了粒径小、分布均匀、可稳定分散,并同时具有抗菌和抗氧化性能的AgNPs。本研究一方面使柚子皮废弃物得到了高值化利用,另一方面为AgNPs的绿色高效合成提供了新的思路,为其AgNPs在食品活性包装中的应用奠定了基础。后续仍需对柚子皮提取液合成AgNPs的机理以及AgNPs在食品包装中的应用效果进行进一步研究。
[1] 陈诗雨. 基于纳米银线透明导电薄膜的制备及其性能研究[D].济南:齐鲁工业大学, 2021.
CHEN S Y.Research on preparation and performance of transparent conductive film based on silver nanowires[D].Jinan:Qilu University of Technology, 2021.
[2] KRA NIEWSKA K, GALUS S, GNIEWOSZ M.Biopolymers-based materials containing silver nanoparticles as active packaging for food applications:A review[J].International Journal of Molecular Sciences, 2020, 21(3):698.
NIEWSKA K, GALUS S, GNIEWOSZ M.Biopolymers-based materials containing silver nanoparticles as active packaging for food applications:A review[J].International Journal of Molecular Sciences, 2020, 21(3):698.
[3] ADEYEYE S A O, ASHAOLU T J.Applications of nano-materials in food packaging:A review[J].Journal of Food Process Engineering, 2021, 44(7):e13708.
[4] 施佳男. 柿果皮萜类化合物提取及其纳米银制备和活性研究[D].扬州:扬州大学, 2021.
SHI J N.Extraction of terpenoids from persimmon pericarp and preparation and activity of silver nanoparticles[D].Yangzhou:Yangzhou University, 2021.
[5] PANDIAN A M K, GOPALAKRISHNAN B, RAJASIMMAN M, et al.Green synthesis of bio-functionalized nano-particles for the application of copper removal-characterization and modeling studies[J].Environmental Research, 2021, 197:111140.
[6] 杨静娴, 何娣, 丘苑新.柚子核中功能性成分的分离纯化研究进展[J].广州化工, 2019, 47(22):37-40.
YANG J X, HE D, QIU Y X.Research progress on separation and purification of functional components in grapefruit core[J].Guangzhou Chemical Industry, 2019, 47(22):37-40.
[7] GHAFFAR A, KIRAN S, RAFIQUE M A, et al.Citrus paradisi fruit peel extract mediated green synthesis of copper nanoparticles for remediation of Disperse Yellow 125 dye[J].Desalination and Water Treatment, 2021, 212:368-375.
[8] 张岩, 吴继军, 徐玉娟, 等.柑橘柚子皮渣综合利用研究进展[J].农产品加工, 2016(21):57-58;61.
ZHANG Y, WU J J, XU Y J, et al.Research progress of comprehensive utilization in citrus and pomelo peel residue[J].Farm Products Processing, 2016(21):57-58;61.
[9] BENJAMIN J S.Dispersion strengthened superalloys by mechanical alloying[J].Metallurgical Transactions, 1970, 1(10):2 943-2 951.
[10] ZENG J S, LIU L, LI J P, et al.Properties of cellulose nanofibril produced from wet ball milling after enzymatic treatment vs.mechanical grinding of bleached softwood kraft fibers[J].BioResources, 2020, 15(2):3 809-3 820.
[11] KHAYATI G R, JANGHORBAN K.The nanostructure evolution of Ag powder synthesized by high energy ball milling[J].Advanced Powder Technology, 2012, 23(3):393-397.
[12] BAL Ž M, DANEU N, BAL
Ž M, DANEU N, BAL ŽOV
ŽOV L, et al.Bio-mechanochemical synthesis of silver nanoparticles with antibacterial activity[J].Advanced Powder Technology, 2017, 28(12):3 307-3 312.
L, et al.Bio-mechanochemical synthesis of silver nanoparticles with antibacterial activity[J].Advanced Powder Technology, 2017, 28(12):3 307-3 312.
[13] 于嘉伦, 徐丹, 任丹, 等.橘皮还原法和硼氢化钠还原法制备的纳米银的结构和性能比较[J].材料导报, 2018, 32(20):3 489-3 495;3 503.
YU J L, XU D, REN D, et al.Comparisons in the structures and properties of silver nanoparticles synthesized by amakusa peels and sodium borohydride[J].Materials Review, 2018, 32(20):3 489-3 495;3 503.
[14] SHEN D Y, QIAN J, WANG C W, et al.Facile preparation of silver nanoparticles in bulk silicate glass by high-repetition-rate picosecond laser pulses[J].Chinese Optics Letters, 2021, 19(1):011901.
[15] SHARMA V K, YNGARD R A, LIN Y.Silver nanoparticles:Green synthesis and their antimicrobial activities[J].Advances in Colloid and Interface Science, 2009, 145(1-2):83-96.
[16] RAGHAVENDRA G M, JAYARAMUDU T, VARAPRASAD K, et al.Cellulose-polymer-Ag nanocomposite fibers for antibacterial fabrics/skin scaffolds[J].Carbohydrate Polymers, 2013, 93(2):553-560.
[17] DHANASEKARAN D, LATHA S, SAHA S, et al.Extracellular biosynthesis, characterisation and in-vitro antibacterial potential of silver nanoparticles using Agaricus bisporus[J].Journal of Experimental Nanoscience, 2013, 8(4):579-588.
[18] DONDI R, SU W, GRIFFITH G A, et al.Highly size- and shape-controlled synthesis of silver nanoparticles via a templated Tollens reaction[J].Small (Weinheim an Der Bergstrasse, Germany), 2012, 8(5):770-776.
[19] SONG J Y, KIM B S.Rapid biological synthesis of silver nanoparticles using plant leaf extracts[J].Bioprocess and Biosystems Engineering, 2009, 32(1):79-84.
[20] 于嘉伦. 采用柑橘皮提取液制备纳米银的工艺优化及其性能研究[D].重庆:西南大学, 2018.
YU J L.Process optimization of nano silver synthesis by Citrus peel extract and characterization of the nano silver[D].Chongqing:Southwest University, 2018.
[21] SHAH Z, HASSAN S, SHAHEEN K, et al.Synthesis of AgNPs coated with secondary metabolites of Acacia nilotica:An efficient antimicrobial and detoxification agent for environmental toxic organic pollutants[J].Materials Science and Engineering:C, 2020, 111:110829.
[22] 秦聪丽, 傅吉全.桑叶提取物还原制备钯纳米颗粒[J].贵金属, 2016, 37(3):29-32.
QIN C L, FU J Q.Preparation of palladium nanoparticles using mulberry leaf extract[J].Precious Metals, 2016, 37(3):29-32.
[23] 邢亚阁, 廖兴梅, 李文秀, 等.不同制备条件对纳米银绿色合成的影响[J].食品与发酵工业, 2022, 48(7):231-237.
XING Y G, LIAO X M, LI W X, et al.Effect of different preparation conditions on green synthesis of silver nanoparticles[J].Food and Fermentation Industries, 2022, 48(7):231-237.
[24] FERN NDEZ-ARIAS M, BOUTINGUIZA M, VAL J D, et al.Copper nanoparticles obtained by laser ablation in liquids as bactericidal agent for dental applications[J].Applied Surface Science, 2020, 507:145032.
NDEZ-ARIAS M, BOUTINGUIZA M, VAL J D, et al.Copper nanoparticles obtained by laser ablation in liquids as bactericidal agent for dental applications[J].Applied Surface Science, 2020, 507:145032.
[25] 翟纬坤, 王轩, 王源升, 等.聚乙烯醇/纳米银薄膜的制备及其对黄骨鱼保鲜效果的研究[J].包装工程, 2020, 41(9):44-50.
ZHAI W K, WANG X, WANG Y S, et al.Preparation of PVA/nano-silver film and its effect on preservation of yellow bone fish[J].Packaging Engineering, 2020, 41(9):44-50.
[26] RUSSELL A D, HUGO W B.7 antimicrobial activity and action of silver[J].Progress in Medicinal Chemistry, 1994, 31:351-370.