灰树花[Grifola frondosa (Dicks.) Gray]又名云蕈、莲花菌等,在日本被称为“舞茸”,是一种珍贵的药食两用真菌[1-2]。灰树花具有丰富的营养价值以及良好的风味,不仅可以直接烹饪食用,还可以加工成食品添加剂以及保健食品,因此数百年来在日本、中国以及其他一些亚洲地区都颇受欢迎[3-4]。
在灰树花的子实体和菌丝体中发现多种生物活性成分,包括多糖、蛋白质、多酚、有机酸、氨基酸类、甾醇等[5-6]。20世纪80年代,从灰树花子实体中提取出一种以β-1,6-连接的葡聚糖主链,并带有1,3-连接分支的多糖,发现该多糖具有高效的抗癌活性[7],此后对灰树花活性成分的研究主要集中于多糖上。灰树花多糖还具有显著的免疫调节、降低血糖血脂、抗氧化、抗病毒和保护肝脏等功效[8]。现阶段研究主要以免疫学和细胞学的角度探究灰树花多糖抗肿瘤等生物活性,而对酶机理的研究较少。
精氨酸酶是一种双核含锰金属酶,可催化L-精氨酸水解生成L-鸟氨酸和尿素[9]。在哺乳动物中,精氨酸酶活性的增加与心血管系统、肾脏、中枢神经系统以及免疫系统功能障碍和癌症有着密切联系[10]。精氨酸酶活性过高会减少NO合酶产生NO所需的 L-精氨酸供应[11],研究发现精氨酸酶抑制剂 nor-NOHA对肝癌细胞的增殖有抑制作用,并诱导肝癌细胞凋亡,这可能与高浓度NO的促凋亡作用有关[12]。抑制精氨酸酶还可改善肥胖诱导的脂肪组织炎症[13]。因此精氨酸酶可作为一种新型的治疗靶点。目前精氨酸酶抑制剂的开发主要集中于化学合成药物上,如2(S)-氨基-6-硼己酸、(S)-(2-硼乙基)-L-半胱氨酸和Nω-羟基-nor-L-精氨酸等,存在一定的副作用,而从植物中提取的天然类精氨酸酶抑制剂,因其安全性及有效性表现出潜在的价值。BUJOR等[14]首次证明了山茱萸、花楸和荚蒾多酚提取物的精氨酸酶抑制作用与NO依赖性血管舒张作用有关;另外,植物中的糖苷化合物也表现出精氨酸酶抑制活性[15]。灰树花多糖对精氨酸酶抑制作用尚无研究报道,故结合灰树花多糖药理功效良好、无毒副作用等特点,探究其对精氨酸酶的抑制活性,并进行初步的结构表征,为寻找天然精氨酸酶抑制剂和开发灰树花多糖新型药物提供方向和参考依据。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
灰树花(Grifola frondose)子实体,浙江省农业科学院;单糖标准品(D-葡萄糖、D-半乳糖、D-葡萄糖醛酸、D-半乳糖醛酸、L-鼠李糖、D-甘露糖、D-核糖、L-阿拉伯糖、D-岩藻糖、D-木糖、N-乙酰基-D-葡萄糖胺、N-乙酰基-D-半乳糖胺)、牛肝精氨酸酶,上海源叶生物科技有限公司;牛血清白蛋白(bovine serum albumin,BSA)、α-异亚硝基苯丙酮、三氟乙酸(trifluoroacetic acid,TFA),阿拉丁化学试剂(上海)有限公司;MnCl2,麦克林生物科技有限公司;生物防腐剂Proclin 300、刚果红,美国Sigma公司;其他试剂均为国产分析纯。
1.1.2 主要仪器与设备
DJ-04中药粉碎机,上海淀久仪器公司;R-1001VN旋转蒸发仪,郑州长城科工贸有限公司;QT-80FC-LCD智能自动部分收集器,上海琪特分析仪器有限公司;HL-2恒流泵,上海沪西分析仪器有限公司;DAWN HELEOS Ⅱ多角度激光散射仪、RID-10A示差折光检测器,美国怀亚特技术公司;Nicolet 6700傅里叶红外光谱仪、UltiMate 3000高效液相液质色谱仪,赛默飞世尔科技公司;TU-1900紫外分光光度计,北京普析通用仪器公司;SU8010场发射扫描电子显微镜,日本日立公司;XE-70原子力显微镜,韩国帕克股份有限公司。
1.2 实验方法
1.2.1 灰树花多糖的提取、分离纯化
称取200 g灰树花子实体,粉碎后过80目筛,加入4倍体积95%(体积分数)乙醇,浸泡12 h,除去脂肪和色素。过滤后收集残渣,自然晾干备用。
称取20 g灰树花子实体水浸提后残渣,加入5.2%(质量分数)NaOH溶液,料液比为1∶20(g∶mL),混合均匀后在57 ℃的水浴锅中浸提2.25 h,间断性搅拌,10 000 r/min离心10 min,过滤收集残渣和上清液,重复提取2次。收集所有上清液,3 mol/L乙酸中和,继续离心收集上清液。在45 ℃下减压浓缩,透析,除去中和碱液产生的盐,最后加入4倍体积95%乙醇,静置24 h,离心收集沉淀,得到灰树花碱提水溶性粗多糖。经DEAE-Sepharose Fast Flow 离子交换柱层析,分别用经0.45 μm 水系滤膜过滤后的0.1、0.2、0.4 mol/L NaCl 溶液洗脱,苯酚-硫酸法测定含糖量,绘制洗脱曲线。收集不同组分,浓缩、透析脱盐、冷冻干燥。根据前期实验结果筛选出0.2 mol/L NaCl 溶液的洗脱组分再进行Sephacryl S-500 High Resolution 凝胶柱层析,经0.45 μm水系滤膜过滤后的蒸馏水洗脱,收集单一组分,冻干得到水溶性多糖GFPN-2-A组分。
1.2.2 灰树花多糖的结构表征
1.2.2.1 分子质量及纯度鉴定
采用高效尺寸排阻色谱-多角度激光散射仪-示差折光检测(high-performance size exclusion chromatography-multi-angle laser light scattering-refractive index,HPSEC-MALLS-RI)测定多糖的重均分子质量。准确称取多糖样品5 mg,用1 mL的0.1 mol/L NaNO3溶液(含有体积分数0.02% Proclin 300试剂)充分溶解,过2次0.22 μm水系滤膜,注射器吸取并手动进样。仪器检测条件为:激光光散射仪DAWN HELEOS II,示差折光检测器RID-10A,系统DAWN HELEOS SYSTEM,进样器High-Pressure Injection System,色谱柱TSKgel G3000PWXL,流动相0.1 mol/L NaNO3溶液和0.02% Proclin 300试剂,流速0.5 mL/min,进样量100 μL,示差折光检测器温度为35 ℃。
1.2.2.2 紫外全扫描
配制1.0 mg/mL 的多糖溶液,在200~400 nm进行紫外光谱扫描,检测多糖中是否存在核酸和蛋白质。
1.2.2.3 单糖组成分析
精确称取多糖2 mg,加入5.0 mL 2 mol/L TFA,110 ℃下酸解8 h,水解后的多糖样品和单糖标准品混合物在碱性条件下,加入500 μL的0.4 mol/L 1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)-甲醇进行衍生化处理,再加入1.0 mL氯仿反复萃取至无色,3 000 r/min下离心10 min,吸取上清液,过0.22 μm滤膜,进行HPLC分析。检测条件:色谱柱Xtimate C18(4.6 mm × 200 mm × 5 μm),柱温30 ℃,流速1.0 mL/min,检测波长250 nm,进样量20 μL,流动相:0.05 mol/L KH2PO4溶液(pH 6.7)和乙腈,体积比为83∶17。
1.2.2.4 红外光谱(Fourier transform infrared spectroscopy,FT-IR)扫描
取适量的多糖样品与KBr粉末(100~200 mg)混合,研磨均匀,压片后在4 000~500 cm-1范围内测定红外光谱。
1.2.2.5 刚果红实验
配制2 mg/mL的多糖溶液和80 μmol/L的刚果红溶液,各取15 mL混合,取适量混合溶液加入1 mol/L的NaOH溶液,并使得混合液中NaOH的最终浓度达到 0、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mol/L,反应10 min后,在400~600 nm进行紫外扫描,记录每个混合液的最大吸收波长[16]。以各样品的最终NaOH浓度为横坐标,最大吸收波长为纵坐标,绘图。
1.2.2.6 扫描电子显微镜分析
取适量干燥的GFPN-2-A粉末,粘在样品板上,放入真空喷镀仪中喷金,加速电压为7 kV。在高真空条件下通过扫描电子显微镜系统进行扫描,记录不同放大倍数下样品的形态。
1.2.2.7 原子力显微镜分析
用超纯水配制0.1 mg/mL的GFPN-2-A多糖溶液,搅拌24 h以上,使多糖充分溶解,再稀释10倍,搅拌均匀后吸取50 μL,均匀地滴在干净的云母片上,水分自然挥干后用原子力显微镜在非接触模式下观察。
1.2.3 精氨酸酶抑制活性测定
1.2.3.1 多糖组分对精氨酸酶活性的抑制率
参考BORDAGE等[17]的方法并稍作改进,按照以下顺序添加溶液(共350 μL):(1)50 μL 0.1%(体积分数,下同)BSA缓冲液(含或不含200 U/mL的精氨酸酶);(2)150 μL含有10 mmol/L MnCl2的Tris/HCl缓冲液(50 mmol/L,pH 7.5);(3)50 μL含有灰树花多糖的溶液或其溶剂作为对照;(4)100 μL L-精氨酸(pH 9.7,0.1 mmol/L)。将上述混合溶液放入37 ℃水浴中反应40 min,后置于冰上,迅速加入600 μL V(H2SO4)∶V(H3PO4)∶V(H2O)=1∶3∶7终止反应。添加50 μL α-异亚硝基苯丙酮(5%乙醇配制)与生成的尿素反应,100 ℃下避光反应45 min(保持黑暗直到读数),冷却后离心,5 min后在550 nm下测定吸光值,重复独立实验3次,取平均值。多糖组分对精氨酸酶活性抑制率按公式(1)计算:
抑制率![]()
(1)
式中:Aa,不含多糖的精氨酸酶活性的吸光值;Ac1,0.1% BSA缓冲液代替精氨酸酶的对照1吸光值;Ab,含灰树花多糖和酶反应的吸光值;Ac2,含灰树花多糖和不含酶反应的对照2吸光值。
1.2.3.2 多糖浓度对精氨酸酶抑制率的影响
分别配制质量浓度为0.1、0.2、0.4、0.6、0.8、1.0、1.5、2.0 mg/mL的GFPN-2-A多糖溶液,按1.2.3.1中步骤进行实验,计算各个质量浓度下多糖对精氨酸酶活性的抑制率,每个浓度重复3次,取平均值,绘制多糖浓度-抑制率关系图,并进行回归分析,得到抑制率为50%时多糖的质量浓度,即IC50值。
1.2.3.3 多糖对精氨酸酶抑制类型判断
在不同的多糖质量浓度(0.4、0.6、0.8 mg/mL)下,改变精氨酸酶浓度(50、100、150、200 U/mL),按1.2.3.1中步骤进行实验,测定多糖对酶活力的影响,以酶浓度为横坐标,酶反应速率为纵坐标,绘制不同多糖浓度下的酶浓度-反应速率关系图,确定GFPN-2-A对精氨酸酶的抑制类型。
1.2.3.4 多糖对精氨酸酶抑制动力学研究
在不同的多糖质量浓度(0.4、0.6、0.8 mg/mL)下,改变底物精氨酸质量浓度(0.025、0.05、0.1、0.2 mg/mL),按1.2.3.1中步骤进行实验,计算出酶反应速率,以底物质量浓度的倒数为横坐标,以酶反应速率的倒数为纵坐标,绘制双倒数图,确定抑制类型,并求得抑制动力学常数Ki。
2 结果与分析
2.1 GFPN-2-A的提取、分离纯化
碱提法从灰树花子实体中获取水溶性粗多糖,通过DEAE-Sepharose Fast Flow离子交换柱,在不同盐浓度的洗脱下,测定每管洗脱液的多糖含量,得到洗脱曲线如图1-a,分别收集0.1、0.2、0.4 mol/L NaCl溶液洗脱出的多糖样品,命名为GFPN-1、GFPN-2、GFPN-4,收率分别为22.3%、5.4%和1.3%。根据前期活性实验筛选结果,发现GFPN-2具有较好的精氨酸酶抑制活性,综合考虑选取该组分进行后续分析。GFPN-2经Sephacryl S-500凝胶洗脱结果如图1-b,在第56~70管,有一个狭窄单一的峰,说明纯化效果好。将第60、61管合并收集,冷冻干燥后得到多糖组分,命名为GFPN-2-A。
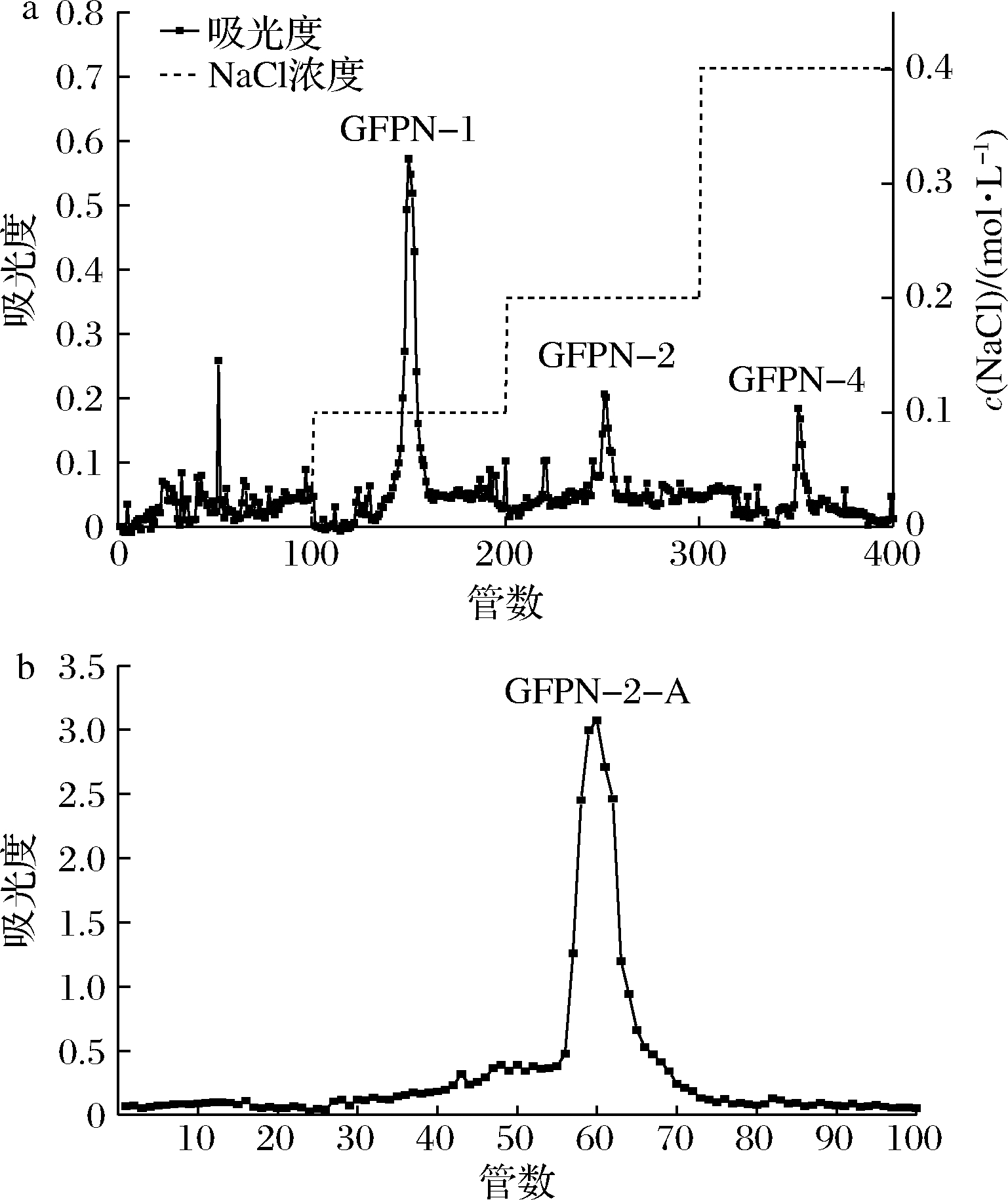
a-DEAE离子交换洗脱曲线;b-Sephacryl S-500凝胶洗脱曲线
图1 GFPN-2-A的DEAE离子交换洗脱曲线和Sephacryl
S-500凝胶洗脱曲线
Fig.1 DEAE ion exchange elution curve and Sephacryl
S-500 gel elution curve of GFPN-2-A
2.2 GFPN-2-A的结构表征
2.2.1 分子质量及纯度鉴定
多糖纯度指多糖分子质量在某一定范围内,相似链长的平均分布。由图2可知,经HPSEC-MALLS- RI检测, GFPN-2-A的出峰时间在19~25 min, 并为一个单一且狭窄的峰,由此判定GFPN-2-A的分子质量分布比较均一,纯度相对较高,根据线性回归方程计算得到其分子质量为4.56 × 106 Da。
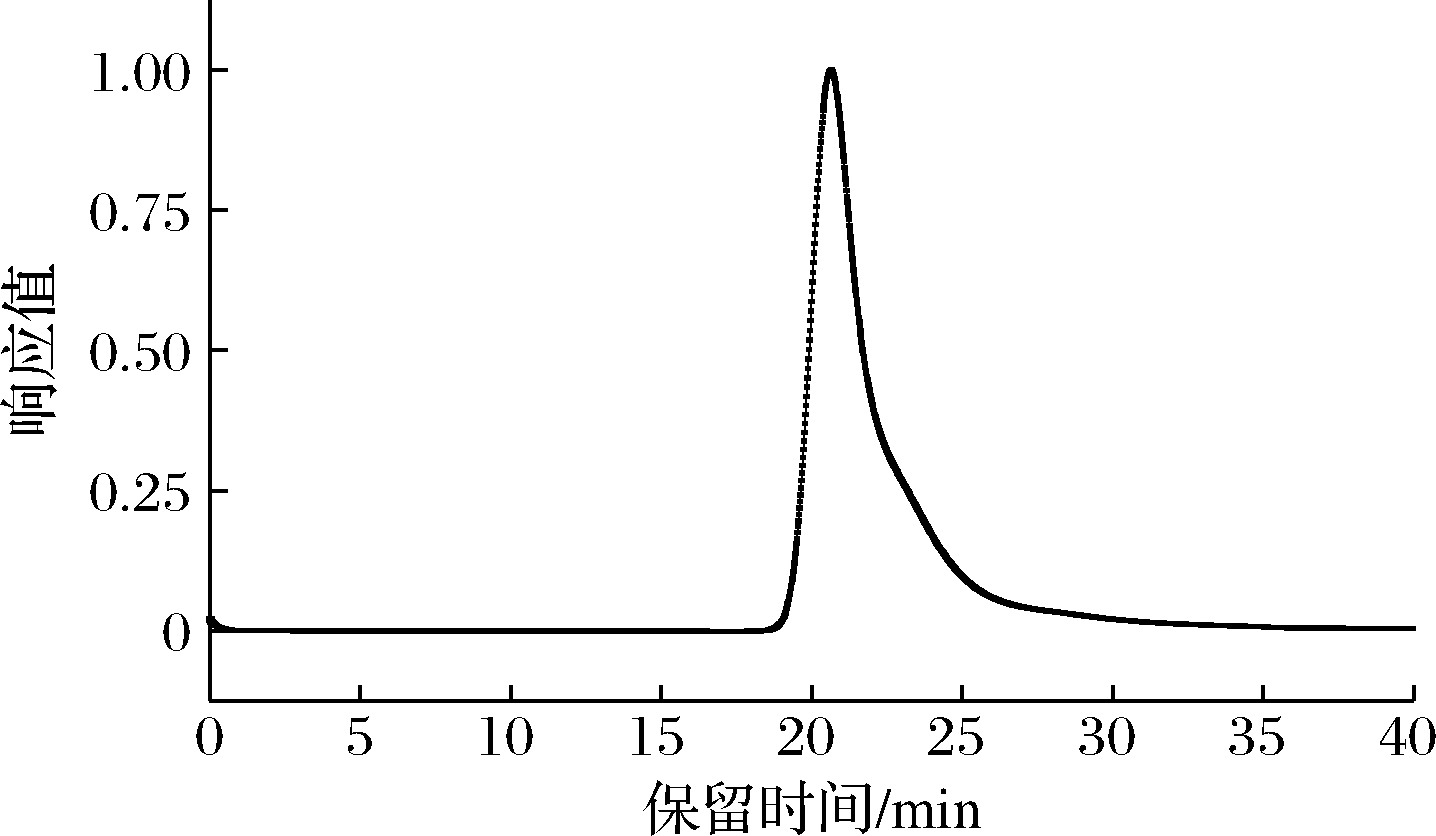
图2 GFPN-2-A的 HPSEC-MALLS-RI图谱
Fig.2 HPSEC-MALLS-RI profile of GFPN-2-A
2.2.2 紫外全扫描
GFPN-2-A的紫外全扫描光谱如图3所示,在206 nm处有一个明显的多糖吸收峰,而在260 nm和280 nm处无明显的吸收峰,说明GFPN-2-A中不含游离的核酸或蛋白质类物质[18]。
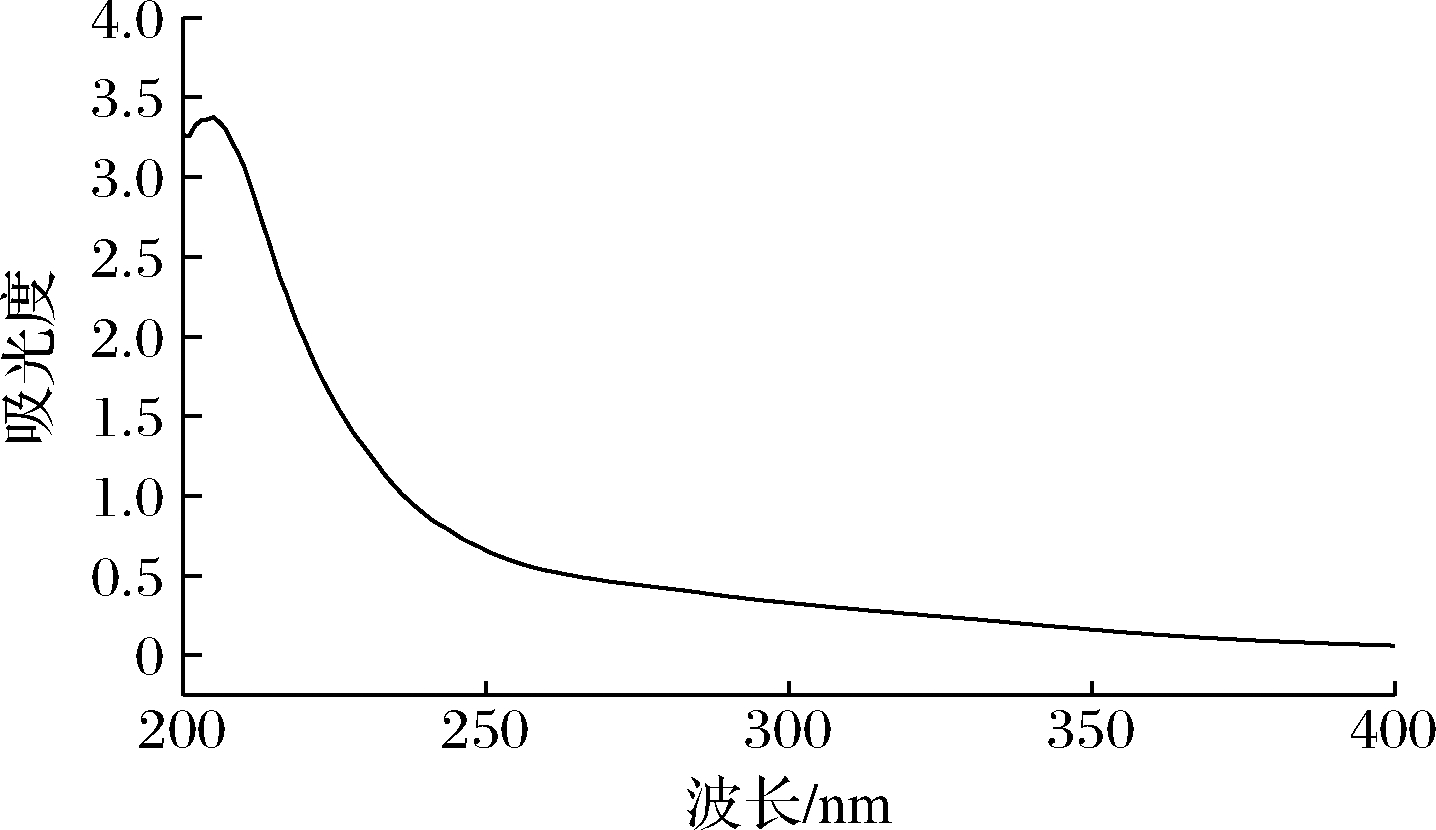
图3 GFPN-2-A的紫外全扫描光谱图
Fig.3 UV scanning spectra of GFPN-2-A
2.2.3 单糖组成
单糖混合标准品和经水解、衍生处理后的GFPN-2-A的HPLC谱图如图4所示,对比单糖混合标准品的乙酰化结果可知,GFPN-2-A主要由葡萄糖组成,还含有少量的葡萄糖醛酸、甘露糖、核糖和半乳糖,其物质的量比为54.00∶1.00∶0.51∶0.37∶0.68。
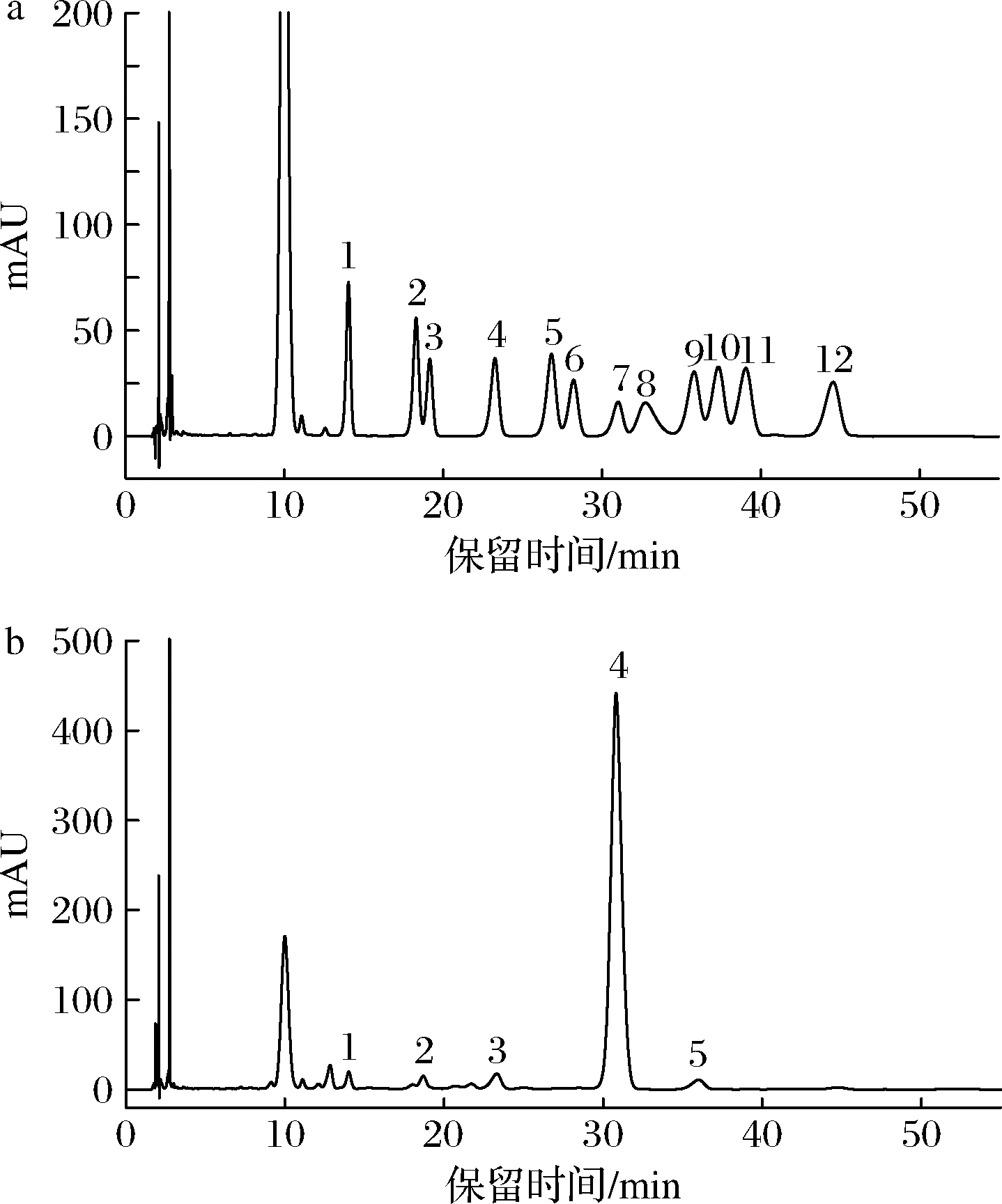
1-D-甘露糖;2-D-核糖;3-L-鼠李糖;4-D-葡萄糖醛酸;
5-D-半乳糖醛酸;6-N-乙酰-氨基葡萄糖;7-D-葡萄糖;
8-N-乙酰-氨基半乳糖;9-D-半乳糖;10-L-木糖;
11-L-阿拉伯糖;12-L-岩藻糖
a-单糖混合标准品;b-GFPN-2-A
图4 单糖混合标准品和GFPN-2-A的HPLC色谱图
Fig.4 HPLC chromatogram of monosaccharide mixed
standard and GFPN-2-A
2.2.4 FT-IR分析
GFPN-2-A的红外光谱如图5所示。
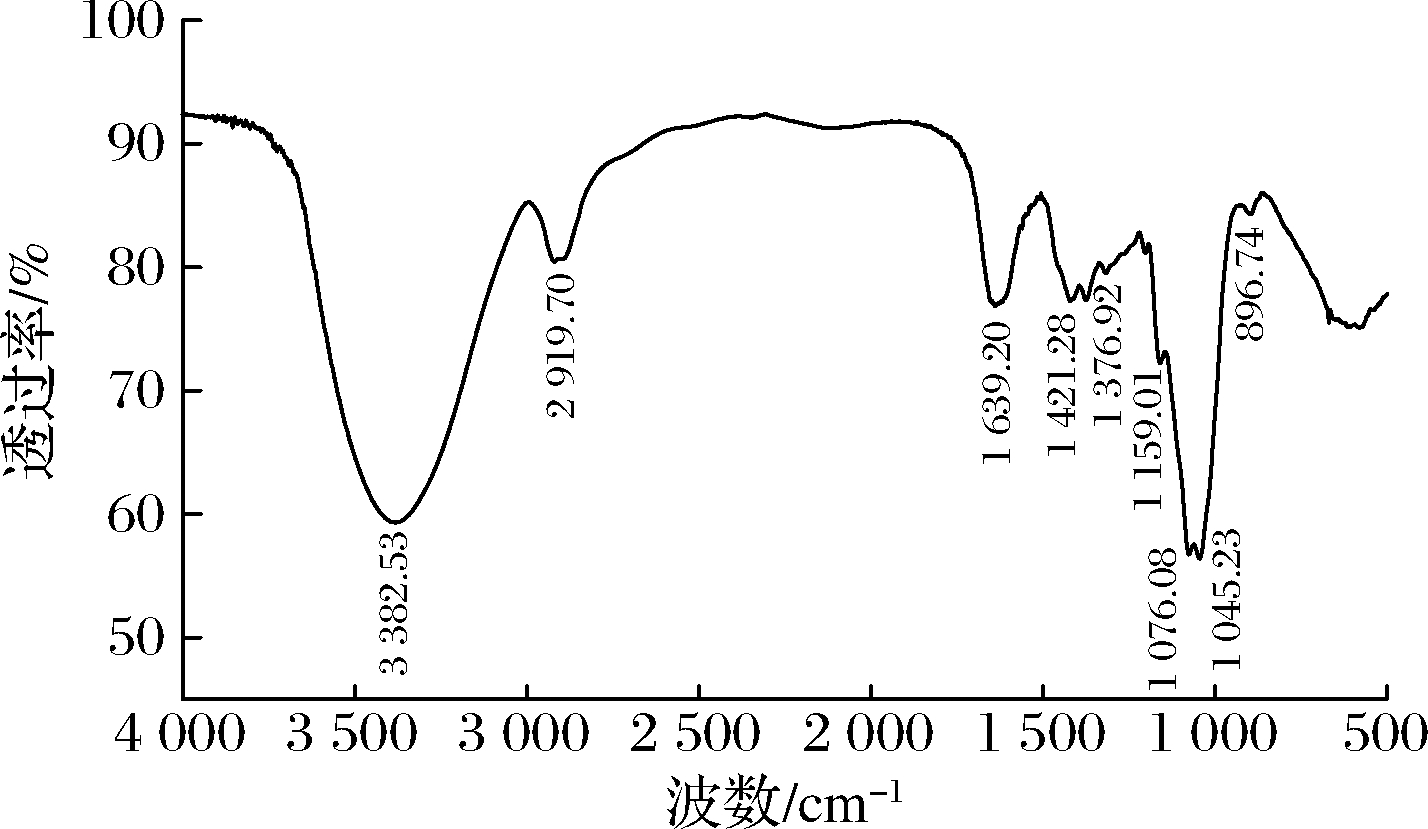
图5 GFPN-2-A的红外光谱图
Fig.5 FT-IR spectrum of GFPN-2-A
在3 382.53 cm-1处出现的强吸收峰代表—OH基团的伸缩振动,2 919.70 cm-1处的吸收峰是由于C—H的伸缩振动的结果,在1 639.20、1 421.28 cm-1处出现的吸收峰分别是羧酸根基团的对称和不对称的伸缩振动,表明GFPN-2-A中存在糖醛酸,与单糖组成的分析结果一致[19]。在1 730.00 cm-1附近没有明显的吸收峰出现,表明GFPN-2-A中的糖醛酸没有被酯化[20]。在1 000.00~1 200.00 cm-1的吸收峰是由于C—O—C和C—O—H的拉伸振动,在896.74 cm-1处的吸收峰表明GFPN-2-A是β构型多糖[21-22]。
2.2.5 刚果红实验
刚果红是一种酸性染料,分子式为C32H22N6Na2O6S2。当具有三股螺旋链构象的多糖分子与刚果红形成络合物时,在一定浓度范围内的NaOH溶液中,其紫外最大吸收波长与刚果红相比会向长波方向移动,尤其当NaOH浓度>0.3 mol/L后,该络合物的最大吸收波长会发生明显的下降[23]。由图6可知,GFPN-2-A和刚果红的络合物的最大吸收波长随着NaOH浓度的增加,逐渐向长波方向移动,说明已经形成了络合物,而当NaOH浓度>0.3 mol/L后,相比于刚果红溶液,最大吸收波长无明显下降,故GFPN-2-A不具有三螺旋构象。三螺旋结构与多糖生物活性密切相关,而单糖种类较多的多糖不容易形成三螺旋结构[24],结合单糖组成结果,GFPN-2-A是由5种单糖组成的均一多糖,因此对其三螺旋结构的形成有一定影响。
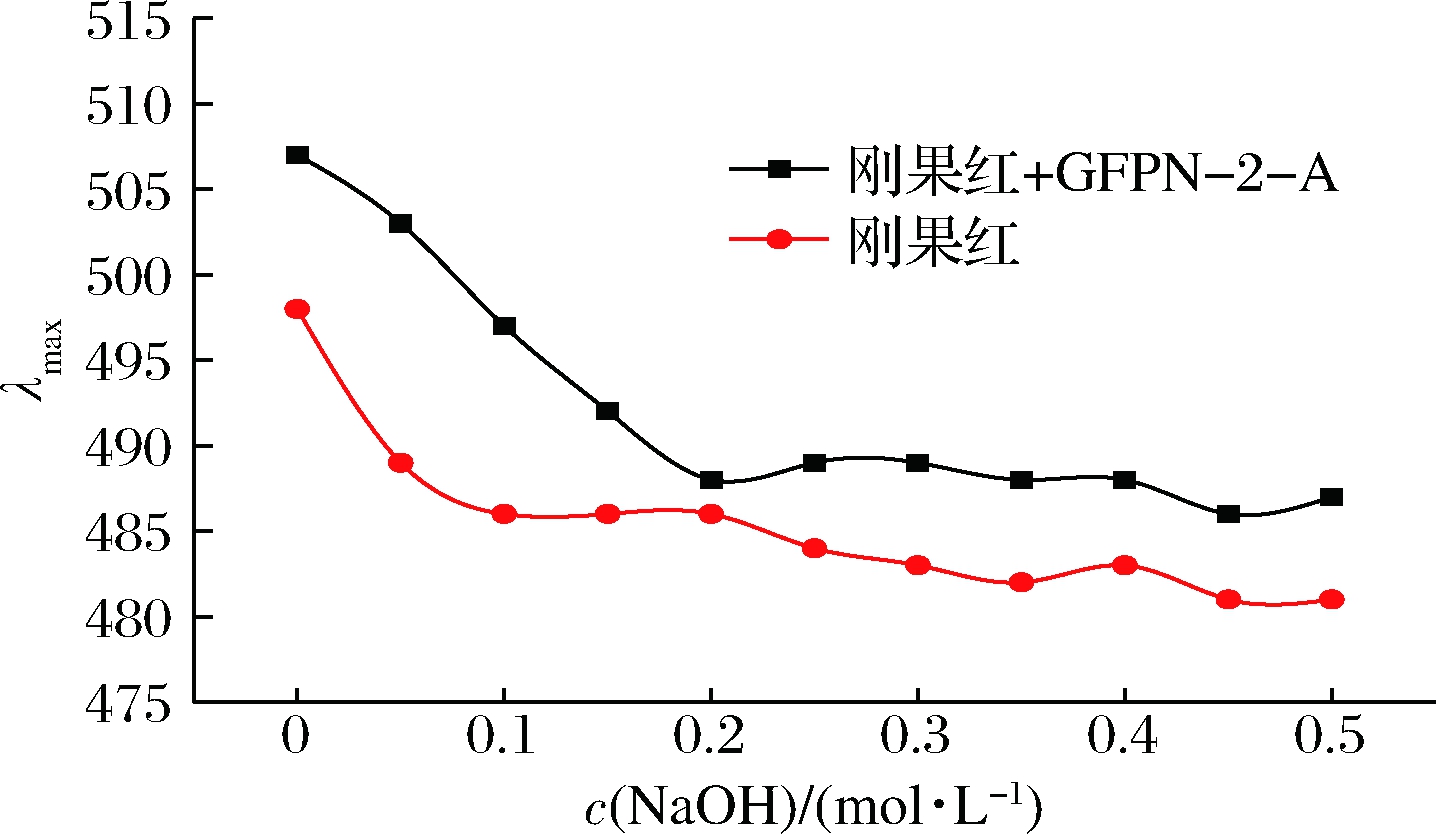
图6 GFPN-2-A和刚果红络合物在不同 NaOH
浓度下的最大吸收波长变化
Fig.6 Change curves of maximum absorption wavelength of
complexes formed by GFPN-2-A and Congo red
at different concentrations of NaOH
2.2.6 扫描电镜分析
如图7所示,在500、1 000、5 000、10 000的放大倍数下观察GFPN-2-A的形貌特征,发现GFPN-2-A主要以不规则的碎屑状和片状堆积的形式存在,在5 000和10 000的放大倍数下观察到GFPN-2-A的表面较为光滑平整,无孔状结构,说明分子间作用力较强,多糖分子间存在的相互排斥力较小。

a-×500;b-×1 000;c-×5 000;d-×10 000
图7 GFPN-2-A的扫描电镜图
Fig.7 SEM images of GFPN-2-A
2.2.7 原子力显微镜分析
原子力显微镜是观察多糖大分子形态的有效工具。由图8可知,GFPN-2-A在水溶液中的表面形貌呈现出圆柱和圆锥的块状特征,平均高度约为13.2 nm。WANG等[25]研究发现单个多糖链的高度约0.5 nm, 表明GFPN-2-A分子间的相互作用使得分子链发生了聚集。
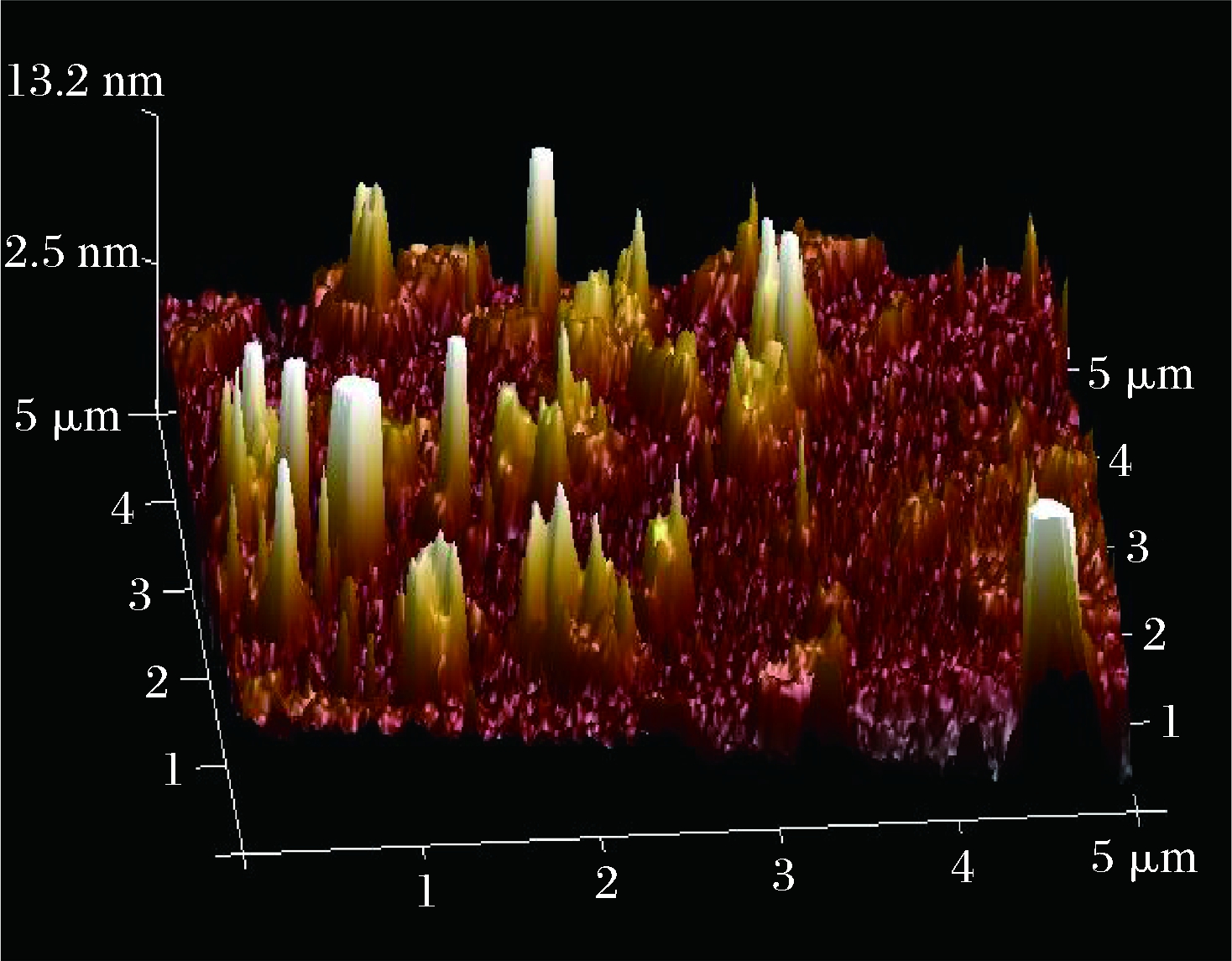
图8 GFPN-2-A的原子力显微镜图
Fig.8 AFM topographic image of GFPN-2-A
2.3 GFPN-2-A的精氨酸酶抑制活性测定
2.3.1 GFPN-2-A浓度与精氨酸酶抑制率
精氨酸酶催化精氨酸转化为鸟氨酸和尿素,根据尿素与α-异硝基丙苯酮反应生成粉红色亚胺,分光光度法测定在550 nm处产生的一个最大吸光度。如图9-a所示,GFPN-2-A的质量浓度在0~1 mg/mL时,其对精氨酸酶的抑制率逐渐增加,当质量浓度>1 mg/mL后,抑制率的增加幅度开始减小,说明GFPN-2-A并没有使精氨酸酶失去活性,而在一定质量浓度范围内,其对精氨酸酶的抑制率有剂量依赖性。进行回归分析,得到GFPN-2-A对精氨酸酶的IC50值为(0.855 ± 0.64)mg/mL。
2.3.2 GFPN-2-A对精氨酸酶的抑制作用分析
固定底物质量浓度不变,分别在不同的多糖质量浓度下,测定不同酶浓度的反应速率。如图9-b,随着多糖质量浓度的增加,酶反应速率与酶浓度的关系拟合直线的斜率逐渐降低,且每个多糖质量浓度下的拟合直线都经过原点,这说明GFPN-2-A对精氨酸酶的抑制作用是可逆的,属于可逆抑制[26]。
2.3.3 GFPN-2-A对精氨酸酶的抑制动力学分析
通过酶促动力学实验,在不同抑制剂质量浓度下,以底物质量浓度的倒数为横坐标,酶反应速率的倒数为纵坐标,绘制线性直线,由各直线的交点所在位置即可判断酶抑制剂的抑制类型,即双倒数作图法。由图9-c可知,4组直线相交于y轴,且随着多糖质量浓度的增加,直线与x轴的交点离原点越接近即斜率逐渐增大,说明酶促反应的Vm不随抑制剂浓度的改变而改变,符合竞争性抑制的动力学特征,GFPN-2-A对精氨酸酶的抑制作用属于竞争性可逆抑制。以双倒数线性直线的斜率为纵坐标,多糖质量浓度为横坐标作图,根据竞争性抑制的动力学方程(2),得到的线性直线与x轴的交点,即为Ki。
(2)
根据图9-d,求得GFPN-2-A对精氨酸酶的抑制常数为0.284 mg/mL。MOTOSHIMA等[27]报道了一种茶树菇中的岩藻半乳聚糖FG-Aa,对精氨酸酶的抑制作用也为竞争性抑制,其IC50值为(5.82 ± 0.57)μmol/L。
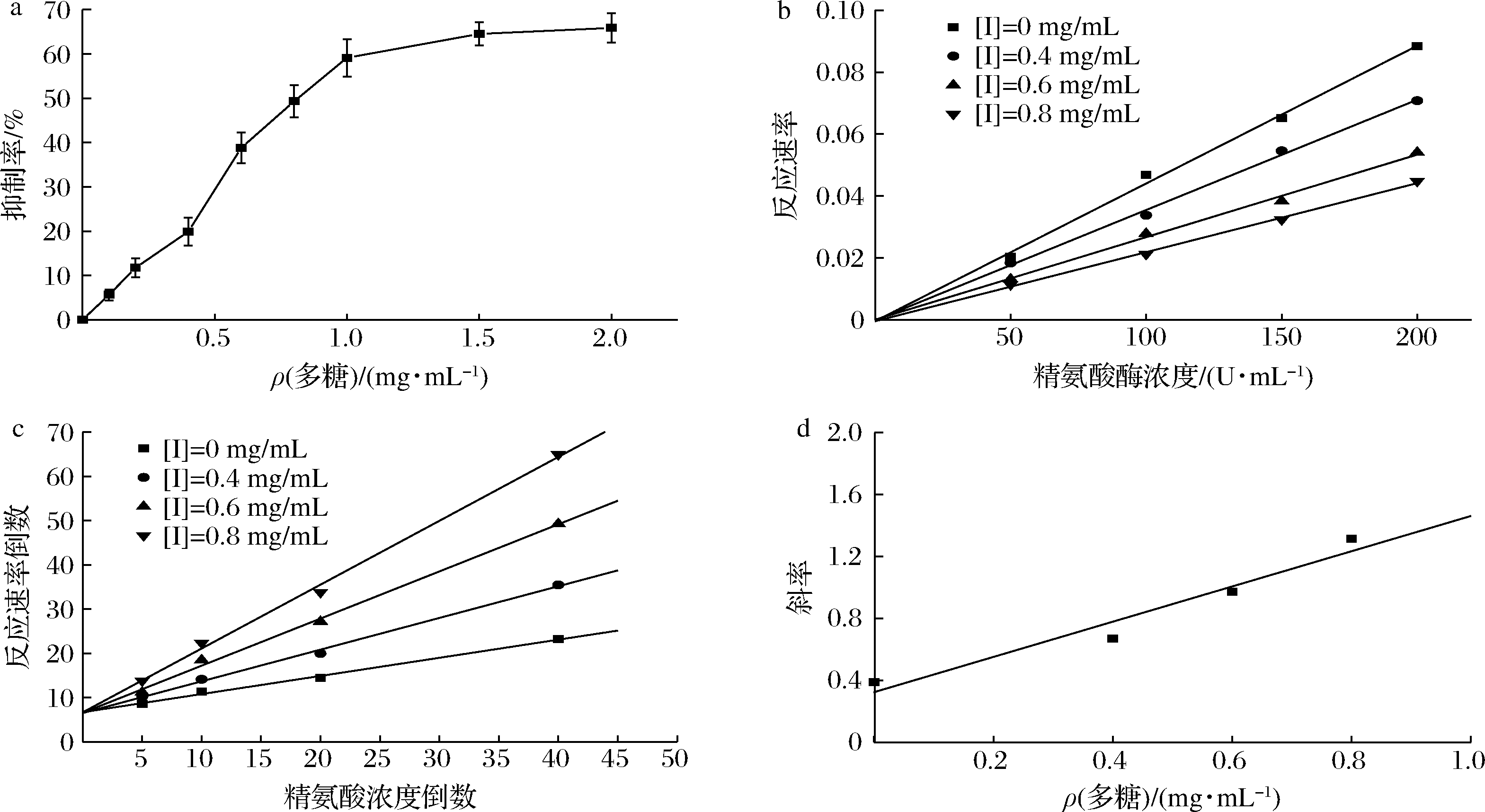
a-GFPN-2-A对精氨酸酶抑制率;b-GFPN-2-A对精氨酸酶的抑制作用;
c-GFPN-2-A抑制精氨酸酶的双倒数;d-GFPN-2-A对精氨酸酶抑制常数
图9 GFPN-2-A对精氨酸酶的抑制活性
Fig.9 Inhibitory of GFPN-2-A on arginase
3 结论
采用碱提法获取的灰树花粗多糖,经高效分离制备得到多糖纯化组分GFPN-2-A,初步结构鉴定表明GFPN-2-A是一种分子质量为4.56×106 Da的酸性均一多糖,不含核酸及蛋白质,红外分析表明其主要存在β构型糖苷键,单糖组成分析表明其主要由葡萄糖、葡萄糖醛酸、甘露糖、核糖和半乳糖组成,物质的量比为54∶1∶0.51∶0.37∶0.68。扫描电镜及原子力显微镜观察发现GFPN-2-A表面较为光滑,无孔状的结构,分子间作用力强,在水溶液中呈圆柱和圆锥状的形态。刚果红实验表明GFPN-2-A不具备三螺旋结构。在评价GFPN-2-A对精氨酸酶的抑制作用中,其对精氨酸酶的IC50为(0.855±0.64)mg/mL,通过酶促动力学实验,判断抑制类型属于竞争性可逆抑制,抑制常数为0.284 mg/mL,而GFPN-2-A与精氨酸酶活性位点的结合方式及构效关系仍有待进一步探索。
综上,本研究发现灰树花碱提水溶性多糖具有良好的精氨酸酶抑制活性,可作为天然的精氨酸酶抑制剂,为灰树花多糖的新型药物开发提供了理论基础。
[1] 戴玉成, 杨祝良.中国药用真菌名录及部分名称的修订[J].菌物学报, 2008, 27(6):801-824.
DAI Y C, YANG Z L.A revised checklist of medicinal fungi in China[J].Mycosystema, 2008, 27(6):801-824.
[2] 戴玉成, 周丽伟, 杨祝良, 等.中国食用菌名录[J].菌物学报, 2010, 29(1):1-21.
DAI Y C, ZHOU L W, YANG Z L, et al.A revised checklist of edible fungi in China[J].Mycosystema, 2010, 29(1):1-21.
[3] YUAN B, ZHAO C, CHENG C, et al.A peptide-Fe(II) complex from Grifola frondosa protein hydrolysates and its immunomodulatory activity[J].Food Bioscience, 2019, 32:100459.
[4] CHEN Y Q, LIU Y Y, SARKER M M R, et al.Structural characterization and antidiabetic potential of a novel heteropolysaccharide from Grifola frondosa via IRS1/PI3K-JNK signaling pathways[J].Carbohydrate Polymers, 2018, 198:452-461.
[5] 吴力亚, 吴天祥, 汪玲.茯苓提取物参与灰树花液态深层发酵及对其活性物质产量的影响[J].食品与发酵工业, 2021, 47(5):57-62.
WU L Y, WU T X, WANG L.Poria cocos extract affected yield of bioactive constituents in submerged culture of Grifola frondosa[J].Food and Fermentation Industries, 2021, 47(5):57-62.
[6] 雷露, 吴天祥, 王川南.基于UPLC-QTOF-MS代谢组学研究灰树花发酵的代谢差异[J].菌物学报, 2020, 39(10):1 920-1 932.
LEI L, WU T X, WANG C N.Analysis of metabolic differences in fermentation of Grifola frondosa based on UPLC-QTOF-MS metabolomics[J].Mycosystema, 2020, 39(10):1 920-1 932.
[7] NANBA H, HAMAGUCHI A, KURODA H.The chemical structure of an antitumor polysaccharide in fruit bodies of Grifola frondosa (Maitake)[J].Chemical & Pharmaceutical Bulletin, 1987, 35(3):1 162-1 168.
[8] 刘佳, 包海鹰, 图力古尔.灰树花化学成分及药理活性研究进展[J].菌物研究, 2018, 16(3):150-157.
LIU J, BAO H Y, BAU T.Chemical constituents and pharmacological activities of Grifola frondosa[J].Journal of Fungal Research, 2018, 16(3):150-157.
[9] DURANTE W, JOHNSON F K, JOHNSON R A.Arginase:A critical regulator of nitric oxide synthesis and vascular function[J].Clinical and Experimental Pharmacology and Physiology, 2007, 34(9):906-911.
[10] CALDWELL R W, RODRIGUEZ P C, TOQUE H A, et al. Arginase:A multifaceted enzyme important in health and disease[J].Physiological Reviews, 2018, 98(2):641-665.
[11] CALDWELL R B, TOQUE H A, NARAYANAN S P, et al.Arginase:An old enzyme with new tricks[J].Trends in Pharmacological Sciences, 2015, 36(6):395-405.
[12] 李向男, 朱方玉, 何永松, 等.精氨酸酶抑制剂nor-NOHA诱导HepG2肝癌细胞凋亡并抑制其侵袭和迁移[J].细胞与分子免疫学杂志, 2017, 33(4):477-482.
LI X N, ZHU F Y, HE Y S, et al.Arginase inhibitor nor-NOHA induces apoptosis and inhibits invasion and migration of HepG2 cells[J].Chinese Journal of Cellular and Molecular Immunology, 2017, 33(4):477-482.
[13] HU H, MOON J, CHUNG J H, et al.Arginase inhibition ameliorates adipose tissue inflammation in mice with diet-induced obesity[J].Biochemical and Biophysical Research Communications, 2015, 464(3):840-847.
[14] BUJOR A, MIRON A, LUCA S V, et al.Vasorelaxant effects of Crataegus pentagyna:Links with arginase inhibition and phenolic profile[J].Journal of Ethnopharmacology, 2020, 252:112559.
[15] MAQUIAVELI C C, LUCON-J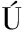 NIOR J F, BROGI S, et al.Verbascoside inhibits promastigote growth and arginase activity of Leishmania amazonensis[J].Journal of Natural Products, 2016, 79(5):1 459-1 463.
NIOR J F, BROGI S, et al.Verbascoside inhibits promastigote growth and arginase activity of Leishmania amazonensis[J].Journal of Natural Products, 2016, 79(5):1 459-1 463.
[16] YUAN Q X, ZHAO L Y, LI Z H, et al.Physicochemical analysis, structural elucidation and bioactivities of a high-molecular-weight polysaccharide from Phellinus igniarius mycelia[J].International Journal of Biological Macromolecules, 2018, 120:1 855-1 864.
[17] BORDAGE S, PHAM T N, ZEDET A, et al.Investigation of mammal arginase inhibitory properties of natural ubiquitous polyphenols by using an optimized colorimetric microplate assay[J].Planta Medica, 2017, 83(7):647-653.
[18] 张安强, 张劲松, 潘迎捷.食药用菌多糖的提取、分离纯化与结构分析[J].食用菌学报, 2005, 12(2):62-68.
ZHANG A Q, ZHANG J S, PAN Y J.Extraction, isolation, purification and structure analysis of polysaccharide from edible-medicinal fungi[J].Acta Edulis Fungi, 2005, 12(2):62-68.
[19] DENG Y J, HUANG L X, ZHANG C H, et al.Novel polysaccharide from Chaenomeles speciosa seeds:Structural characterization, α-amylase and α-glucosidase inhibitory activity evaluation[J].International Journal of Biological Macromolecules, 2020, 153:755-766.
[20] NEP E I, CARNACHAN S M, NGWULUKA N C, et al.Structural characterisation and rheological properties of a polysaccharide from sesame leaves (Sesamum radiatum Schumach.& Thonn.)[J].Carbohydrate Polymers, 2016, 152:541-547.
[21] SAHRAGARD N, JAHANBIN K.Structural elucidation of the main water-soluble polysaccharide from Rubus anatolicus roots[J].Carbohydrate Polymers, 2017, 175:610-617.
[22] FARHADI N.Structural elucidation of a water-soluble polysaccharide isolated from Balangu shirazi (Lallemantia royleana) seeds[J].Food Hydrocolloids, 2017, 72:263-270.
[23] WANG D Q, WANG D G, YAN T X, et al.Nanostructures assembly and the property of polysaccharide extracted from Tremella fuciformis fruiting body[J].International Journal of Biological Macromolecules, 2019, 137:751-760.
[24] 陆娟, 谢东雪, 贺柳洋, 等.洋甘菊多糖的分离纯化、性质结构及抗氧化活性分析[J].食品与发酵工业, 2021, 47(3):72-78.
LU J, XIE D X, HE L Y, et al.Purification, structure analysis and antioxidant activity of polysaccharides from Matricaria chamomilla L[J]. Food and Fermentation Industries, 2021, 47(3):72-78.
[25] WANG J L, BAO A J, MENG X H, et al.An efficient approach to prepare sulfated polysaccharide and evaluation of anti-tumor activities in vitro[J].Carbohydrate Polymers, 2018, 184:366-375.
[26] 李晶, 姜丽丽, 李沐轩, 等.黄芪多糖对黄嘌呤氧化酶活性的抑制作用[J].食品与生物技术学报, 2021, 40(10):16-20.
LI J, JIANG L L, LI M X, et al.Inhibitory effects of Astragalus polysaccharide on activity of xanthine oxidase[J].Journal of Food Science and Biotechnology, 2021, 40(10):16-20.
[27] MOTOSHIMA R A, DA F ROSA T, DA C MENDES L, et al.Inhibition of Leishmania amazonensis arginase by fucogalactan isolated from Agrocybe aegerita mushroom[J].Carbohydrate Polymers, 2018, 201:532-538.