中国竹资源丰富,约有39个属500多种竹子,竹林面积达土地总面积的5‰以上。竹笋是源于竹林的主要蔬菜食品,因其味美而长期受到国内外消费者的喜爱,竹笋产业已逐渐成为我国农民致富增收的支柱产业之一[1]。但竹笋产业的快速发展,随之也带来了数量巨大的加工副产物——笋壳。目前,在竹笋加工过程中,笋壳通常被作为废弃物而直接丢弃,这不仅增加了废弃物的处置难度,还造成了生物资源的极大浪费[2]。笋壳是木质纤维素类生物质,由纤维素、半纤维素和木质素构成,其中纤维素和半纤维素是由单糖组成的,通过预处理和酶解可以转化为可发酵糖。然而,木质素由3种苯基丙烷结构单元(愈创木酰、紫丁香基和对羟基苯基)聚合,通过共价键与纤维素和半纤维素交联,组成复杂的三维网络结构,形成了酶解的关键性屏障[3-4]。为了打破这种屏障,人们采用了许多基于不同机制的预处理方法,如:水热、稀酸、稀碱、蒸汽爆破、有机溶剂等,但由于制备成本高、二次污染环境、有一定毒性、生物降解性差以及难以回收等缺点,限制了其进一步的发展与应用[5-9]。
近年来,低共熔溶剂(deep eutectic solvent,DES)作为预处理方法被发掘出来,它是由一定摩尔比的氢键受体和氢键供体通过氢键相互作用结合,熔点低于其原组分的共晶混合物。据报道,DES可以溶解木质素,选择性地降解木质素-碳水化合物复合物(lignin-carbohydrate complex, LCC),是一种高效的破坏木质纤维素生物质屏障性的预处理方法[10-13]。更重要的是,DES对提取木质素有较高的选择性,这有利于再生木质素和保留纤维素的高价值利用。并且DES还具有绿色环保、成本低、毒性小、可回收和热稳定性良好等优点,从而引起了国内外学者的广泛关注[14]。氯化胆碱/乳酸溶剂已被证明是一种优良的酸性DES体系,该体系预处理样品后木质素的去除率较高[5,15-16]。但预处理条件对预处理后样品的酶解效果影响很大,ALVAREZ-VASCO等[17]使用乳酸/氯化胆碱为DES,预处理杨木与花旗松,结果表明,温度升高,酶解效果越好,但温度过高会抑制木质素的分离;ZHANG等[18]用乳酸/氯化胆碱为DES,对玉米芯材进行处理,结果表明,DES摩尔比由1∶1增至1∶15,木质素的去除效率由33%增至61%。说明DES的溶剂摩尔比和预处理温度会影响木质素的脱除效果和打破木质纤维素生物质屏障的程度。
本研究以氯化胆碱和乳酸(摩尔比为1∶3、1∶6和1∶9)合成DES,分别在90、110和130 ℃条件下预处理笋壳木质纤维素,脱除木质素,并通过成分分析、扫描电镜(scanning electron microscope, SEM)、X-射线衍射及结晶度指数(crystallinity index,CrI)、傅里叶变换红外光谱(Fourier transform infrared spectrum,FT-IR)表征DES预处理前、后笋壳木质纤维素的化学成分及物化特征的变化,以及对木质纤维素酶解效率的影响,以期实现笋壳高效酶解转化,为获得高值化利用提供有价值的参考。
1 材料与方法
1.1 材料与试剂
苦竹[Pleioblastus amarus (Keng) keng]笋壳采自四川省乐山市冠英镇。笋壳用蒸馏水清洗干净,晾干,使用高速粉碎机粉碎,并筛选40~60目颗粒,随后放入烘箱60 ℃干燥至恒重;用定性滤纸包好,置于索式抽提器内,以V(甲苯)∶V(乙醇)=2∶1溶液为抽提剂,抽提6 h,取出放入烘箱60 ℃烘干至恒重,置于干燥器中备用。
纤维素酶Novozyme Ctec2,诺维信(中国)生物技术有限公司;葡萄糖,德国Dr.Ehrenstorfer GmbH公司;乳酸、氯化胆碱、浓硫酸、无水乙醇、DNS、乙酸、乙酸钠等均为分析纯。
1.2 仪器与设备
KYKY-FM6900LV扫描电子显微镜,北京中科科仪股份有限公司;D8 ADVANCE X-射线衍射仪,德国布鲁克公司;Nicolet iS10傅里叶变换红外光谱仪,美国尼高力公司;iMark酶标仪,深圳市科力易翔仪器设备有限公司;DHG-2050恒温干燥箱,郑州生元仪器有限公司;HWS电热恒温水浴锅,上海惠泰仪器制造有限公司;ST16/ST16R高速冷冻离心机,美国热电实验设备有限公司;GR100DP高压灭菌锅,致微(厦门)仪器有限公司;FP-25马弗炉,北京市永光明医疗仪器有限公司;FDU-2110真空冷冻干燥机,日本东京理化。
1.3 笋壳DES预处理
1.3.1 DES准备
分别按摩尔比(1∶3、1∶6和1∶9)准确称取氯化胆碱与乳酸,将其混合后置于60 ℃、200 r/min的摇床上摇晃20 min进行合成,直至体系变为无色透明液体,将合成的DES室温储存待用。
1.3.2 DES预处理
准确称取5.00 g笋壳样品于250 mL的三角瓶中,加入50 g合成的DES(摩尔比分别为1∶3、1∶6和1∶9)混合,油浴加热处理(温度分别为90、110和130 ℃),处理时间为3 h,反应过程中每隔20 min摇晃三角瓶一次。反应结束后,立即将三角瓶置于冷水中终止反应,然后用真空过滤法分离所得的预处理液和固相残渣,并将固体残渣用150 mL丙酮洗涤,后用过量去离子水洗涤,直至滤液的pH值变为中性。最后将固体残渣置于冻干机中,-40 ℃真空干燥48 h,保存于干燥器中备用。并根据公式(1)计算样品的固体回收率。
固体回收率![]()
(1)
1.4 笋壳成分分析
笋壳中木质纤维素的组分含量根据NY/T 3494—2019《农业生物质原料 纤维素、半纤维素、木质素测定》方法测定。
1.5 表征方法
1.5.1 SEM分析
将未处理和DES处理的笋壳样品表面分别进行喷金处理,然后采用扫描电镜拍摄不同放大倍数(200和2 000倍)的照片。
1.5.2 CrI分析
采用X-射线衍射仪分别对未处理和DES处理笋壳样品进行测试,主要条件:管压40 kV,管流40 mA,扫描范围5°~40°,扫描速度5 °/min,步长1°。并根据公式(2)计算样品的结晶度指数。
(2)
式中:I002,002衍射晶面2θ=22.8°的强度;Iam,2θ=18°散射峰的强度[19]。
1.5.3 FT-IR分析
将未处理和DES处理笋壳样品分别均匀分散于KBr中,再用压片机压片,采用傅里叶变换红外光谱仪进行测定,主要条件:光谱分辨率为4 cm-1,波数范围400~4 000 cm-1,信躁比50 000∶1, 扫描64次。
1.6 笋壳酶水解
1.6.1 纤维素酶活性的测定
纤维素酶Novozyme Ctec2的酶活性采用滤纸酶活力法测试,主要步骤:将滤纸剪至1.0 cm×6.0 cm大小并卷起,放入10 mL离心管底中,加入1.0 mL的HAc-NaAc缓冲溶液(0.05 mol/L,pH 4.8)和0.5 mL经HAc-NaAc缓冲溶液稀释后的酶液,然后将离心管置于50 ℃恒温振荡器中,在120 r/min下振荡1 h,取出离心管后,置入沸水中5 min灭除酶活性。然后采用DNS法测得上清液产生的还原糖量,并按照公式(3)计算滤纸酶活力。
滤纸酶活力![]()
(3)
式中:m,葡萄糖含量,mg;180,分子质量,mg/mmol;60,时间,min;0.5,加入酶的体积,mL;N,稀释倍数。
1.6.2 酶水解测定
将未处理和DES处理笋壳样品分别进行酶水解,主要步骤:准确称取200 mg笋壳样品于50 mL离心管,加入5 mL HAc-NaAc缓冲溶液(0.05 mol/L,pH 4.8)和适量纤维素酶Novozyme Ctec2,置于恒温振荡器中(50 ℃,160 r/min)振荡72 h,取样,在沸水中煮沸10 min停止酶解,离心(6 000 r/min)5 min,然后采用DNS法对上清液中的还原糖进行测定,并计算酶水解率。
1.6.3 DNS法
采用DNS法测定还原糖含量[20],主要步骤:分别取上述上清液和葡萄糖标准溶液,加入DNS试剂和蒸馏水,沸水浴中煮沸5 min,然后立即冷水冷却。取冷却液200 μL于酶标板中,在540 nm酶标仪中测定光密度值(OD),以葡萄糖含量作为横坐标,光密度值为纵坐标,绘制葡萄糖溶液标准曲线,并通过样品光密度值与葡萄糖标准曲线,计算酶水解率。
1.7 数据处理
采用Excel 2016软件数据处理,SPSS 26软件差异性分析(P<0.05表示显著性差异),结果表示为平均值±标准差,试验为3次平行;使用PowerPoint 2016版、Origin 2021软件制图和绘图。
2 结果与分析
2.1 成分分析
苦竹笋壳DES预处理前后固体回收率和成分分析结果见表1。从固体回收率结果可见,DES预处理温度从90 ℃上升到130 ℃,固体回收率从82.79%下降到69.38%,说明苦笋笋壳木质纤维素在DES预处理过程中均有半纤维素和木质素因溶解而被去除。从成分分析结果可见,与未处理相比,预处理后固体残渣中纤维素的含量均有提高,从35.86%上升至48.63%;半纤维素的含量略有下降,从19.13%下降到15.59%;然而,木质素的含量下降明显,从28.67%下降到14.82%,这与固体回收率结果相一致。可见,DES预处理可高度保留苦竹笋壳木质纤维素中的纤维素,而选择性的溶解去除大部分的木质素和少量的半纤维素,这与SU等[21]采用DES预处理杨树原料的结果一致。
表1 DES预处理前后笋壳成分分析
Table 1 Composition analysis of bamboo shoot shell before and after DES pretreatment
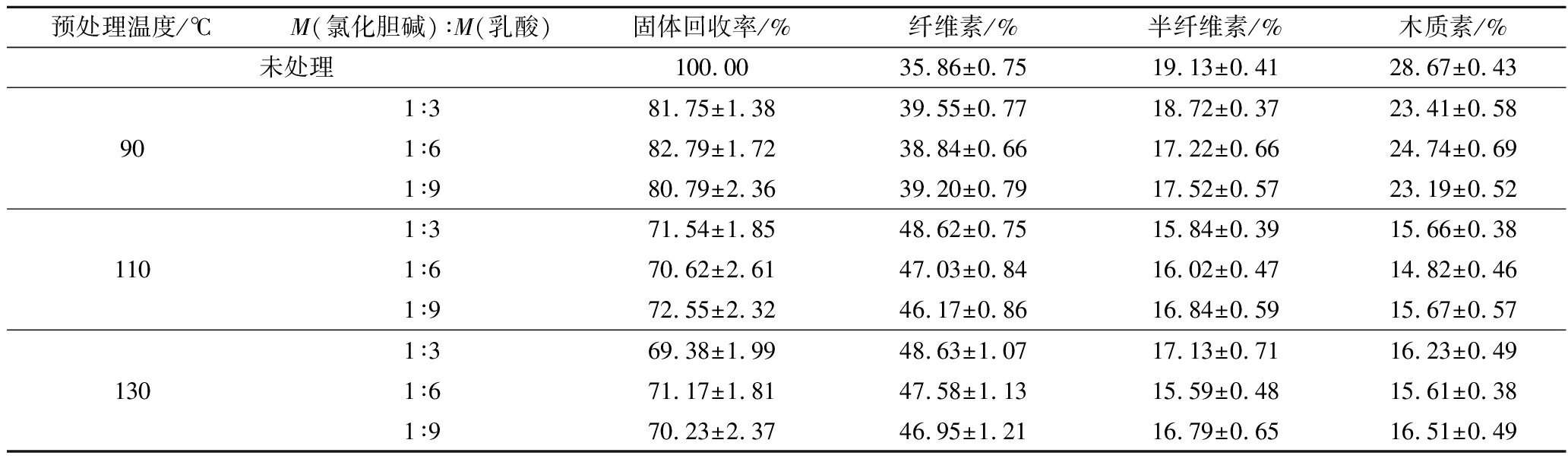
预处理温度/℃M(氯化胆碱)∶M(乳酸)固体回收率/%纤维素/%半纤维素/%木质素/%未处理100.0035.86±0.7519.13±0.4128.67±0.43901∶381.75±1.3839.55±0.7718.72±0.3723.41±0.581∶682.79±1.7238.84±0.6617.22±0.6624.74±0.691∶980.79±2.3639.20±0.7917.52±0.5723.19±0.521101∶371.54±1.8548.62±0.7515.84±0.3915.66±0.381∶670.62±2.6147.03±0.8416.02±0.4714.82±0.461∶972.55±2.3246.17±0.8616.84±0.5915.67±0.571301∶369.38±1.9948.63±1.0717.13±0.7116.23±0.491∶671.17±1.8147.58±1.1315.59±0.4815.61±0.381∶970.23±2.3746.95±1.2116.79±0.6516.51±0.49
2.2 SEM分析
采用扫描电镜对苦竹笋壳木质纤维素预处理前后的表面结构、形貌特征进行了观察,见图1。从图1-a可见,未处理的笋壳木质纤维素表面结构紧密、排列有序,其中纤维素相互粘结,这种天然的致密结构是抵抗酶水解的有力屏障,可以阻止纤维素酶进入笋壳内部,降低酶的可及性,因此未处理苦竹笋壳的酶解效率很低,与之后未处理苦竹笋壳酶水解效率低的结果一致。从图1-b~图1-j可见,经过DES预处理后,苦竹笋壳木质纤维素完整有序的外观结构被破坏,被分解成纤维束,以及单独的条状纤维,甚至是不规则的丝线状碎片和多孔隙的结构,说明DES预处理会破坏纤维素与木质素以及半纤维素的连接,不同程度地去除了木质素及半纤维素,暴露出了纤维素。这种破坏解除了酶水解的物理结构屏障,增加了纤维素酶的可及性,提高了酶水解效率。
比较不同预处理温度(90、110、130 ℃)的扫描电镜图时发现,DES预处理温度为90 ℃时,苦竹笋壳木质纤维素结构部分被分离,不再紧密结合,但表面仍然存在粘结,将纤维素包裹在内,整个笋壳木质纤维素结构仍然完整有序,使纤维素酶只能有限地接触到内部纤维素,这也是之后酶解效率仅小幅度增加的原因;随着预处理温度上升至110 和130 ℃时,半纤维素和木质素的去除程度增加,笋壳木质纤维素的结构变得更加疏松,纤维素大部分都被分离开,呈多间隙结构。由此可见,预处理的温度为110和130 ℃时比90 ℃对笋壳木质纤维素结构的破坏程度更为显著。

图1 DES预处理前后笋壳扫描电镜图
Fig.1 SEM images of bamboo shoot shell before and after DES pretreatment
2.3 CrI分析
采用X-射线衍射法研究苦竹笋壳木质纤维素DES预处理前后的晶体结构变化,见图2。
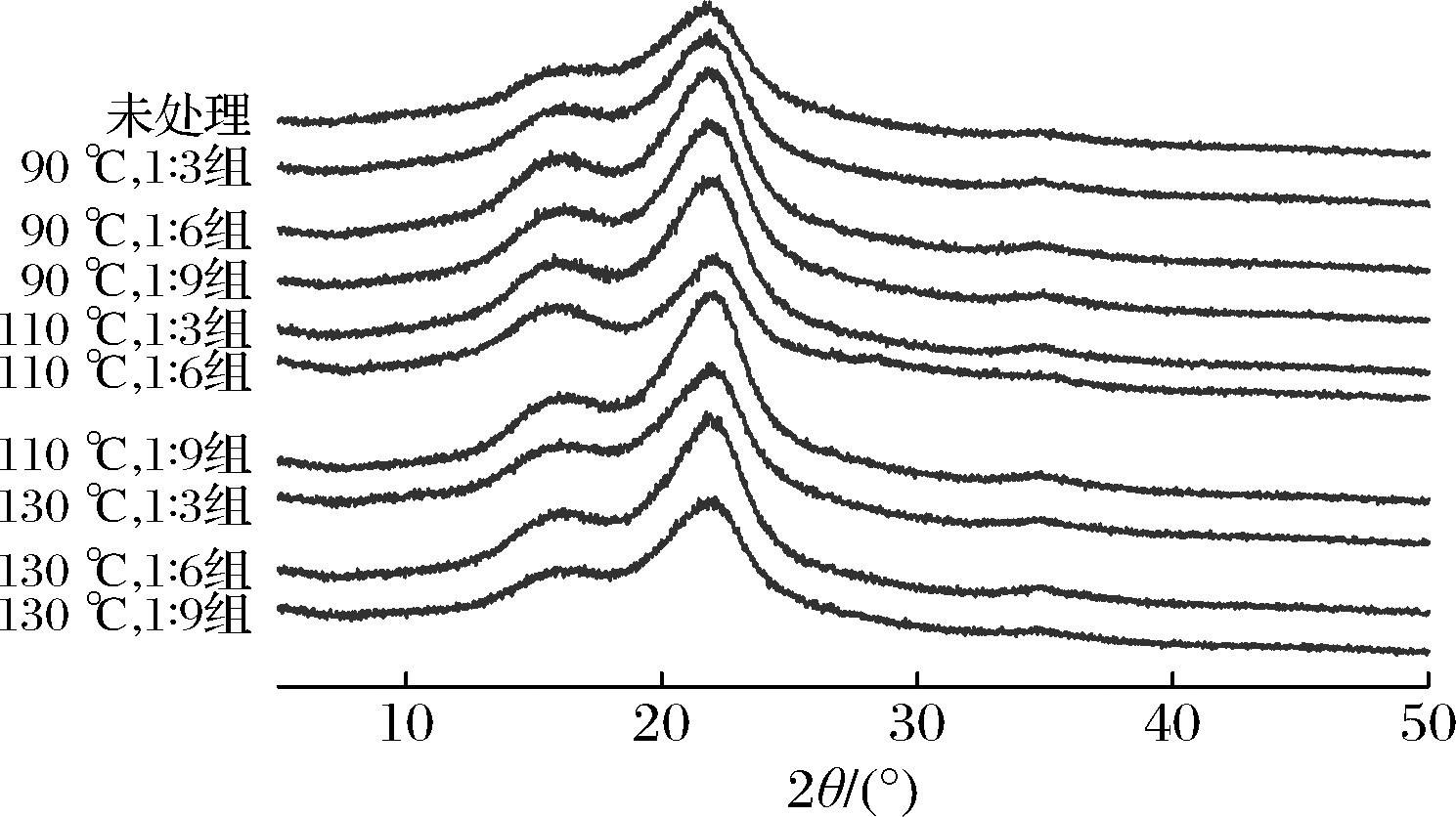
图2 DES预处理前后笋壳X-射线衍射图
Fig.2 X-ray diffraction pattern of bamboo shoot shell
before and after DES pretreatment
未处理和预处理笋壳样品的X-射线衍射图峰型没有明显的区别,在2θ=18.0°和2θ=22.8°左右均出现吸收峰,分别代表无定形区Iam和结晶区I002的衍射强度,说明苦竹笋壳木质纤维素在DES预处理前后均为天然Ⅰ型结晶结构,DES预处理未改变样品纤维素的晶型[22-23]。
研究了DES预处理反应温度和组分摩尔比对苦竹笋壳木质纤维素晶体结构的影响。由图3可见,未处理笋壳样品的结晶度为52.7%,经过DES预处理笋壳样品的结晶度为54.7%~61.5%,均有不同程度的增加。纤维素的结晶结构对酶水解有着重要作用,高结晶度的纤维素不易被酶解,结晶度降低可以有效促进初始酶水解[24],这一现象说明,DES预处理未有效破坏笋壳样品晶体结构,但结晶度与半纤维素和木质素的含量也紧密相关,脱去无定形区的半纤维素和木质素导致了笋壳样品结晶度的升高[5,25],这与前面DES预处理前后笋壳成分分析结果一致。从反应温度来看,预处理温度为90 ℃时,笋壳样品的结晶度为54.7%~56.8%,预处理温度升至110 和130 ℃时,结晶度略有升高,分别为57.4%~61.5%和57.2%~61.1%。从DES组分摩尔比来看,氯化胆碱与乳酸摩尔比为1∶6,预处理温度为110 和130 ℃时,笋壳样品的结晶度分别增至61.5%和61.1%。说明,DES预处理反应温度为110 和130 ℃和组分摩尔比为1∶6,苦竹笋壳样品中的半纤维素和木质素的去除效果最好。
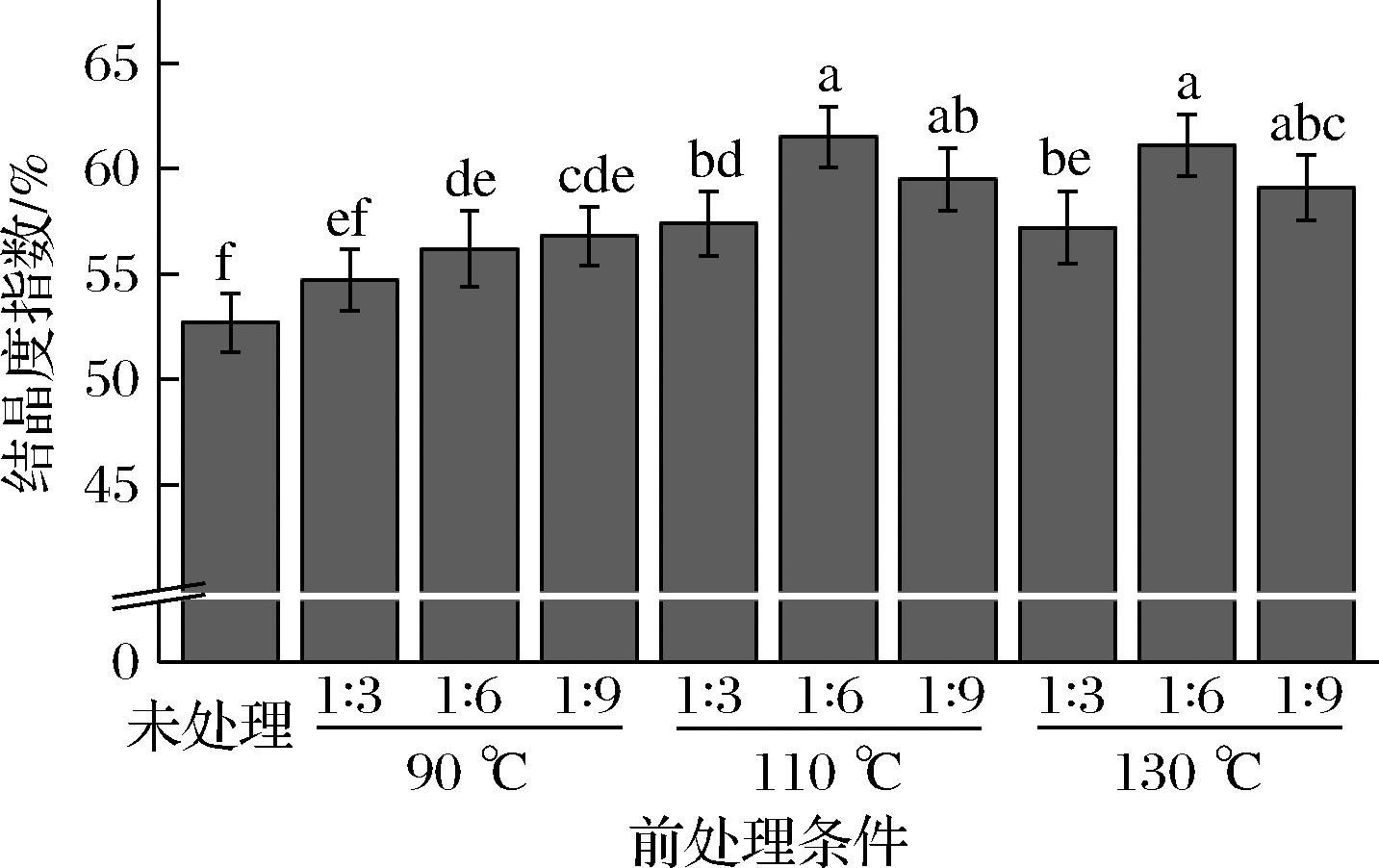
图3 DES预处理前后笋壳的结晶度指数
Fig.3 Crystallinity index of bamboo shoot shell before
and after DES pretreatment
2.4 FT-IR分析
通过傅里叶红外光谱分析了苦竹笋壳木质纤维素DES预处理前后各功能团及化学键的变化,见图4。与纤维素相关特征峰为898(β-1,4糖苷键的C—O—C拉伸)、1 373(C—H弯曲振动)与1 425 cm-1(C—H剪切振动)[18,26-27],这些吸收峰在苦竹笋壳木质纤维素DES预处理前后都存在,说明DES预处理未改变笋壳样品中纤维素的结构;在898 cm-1处吸收峰强度有所增加,说明笋壳样品在DES预处理后,纤维素含量略有增长,这与成分分析结果一致。

图4 DES预处理前后笋壳红外光谱图
Fig.4 Infrared spectra pattern of bamboo shoot shell
before and after DES pretreatment
1 737 cm-1处吸收峰对应的是半纤维素乙酰基的伸缩振动,DES预处理后笋壳样品此处吸收峰强度增加;与木质素相关的吸收峰在833、1 250、1 511、1 604 cm-1附近,833 cm-1处对应是丁香基木质素中的平面振动,1 250 cm-1处对应的是木质素的C—O拉伸,1 511 cm-1处对应的是芳香苯环骨架拉伸,1 604 cm-1处对应的是芳香族苯环骨架拉伸[18,26-27],DES预处理后,这些吸收峰强度均有所减弱,甚至消失。说明DES预处理后,笋壳样品中的木质素-半纤维素连接酯键结构被打破,木质素大部分被脱除,但结构未被完全破坏,半纤维素仍有部分保留,这与王延云等[20]在碱联合超高压预处理笋壳酶解效率的研究结果一致。
2.5 酶水解
苦竹笋壳木质纤维素DES预处理前后酶水解率是评价DES预处理效果的关键指标,采用滤纸酶活力法测得纤维素酶Novozyme Ctec2的酶活性为181.39 FPU/mL,然后按200 mg笋壳样品加入80 μL纤维素酶Novozyme Ctec2进行酶水解,结果见图5。未处理的苦竹笋壳中纤维素酶水解率为29.24%,DES预处理的苦竹笋壳中纤维素的酶水解率达到66.78%~90.43%,是未处理苦竹笋壳的2.3~3.1倍,说明DES预处理可以有效提高笋壳的酶水解率,这与DES预处理导致笋壳木质纤维素结构破坏(图1)、部分半纤维素和大量木质素的去除(表1)有关。
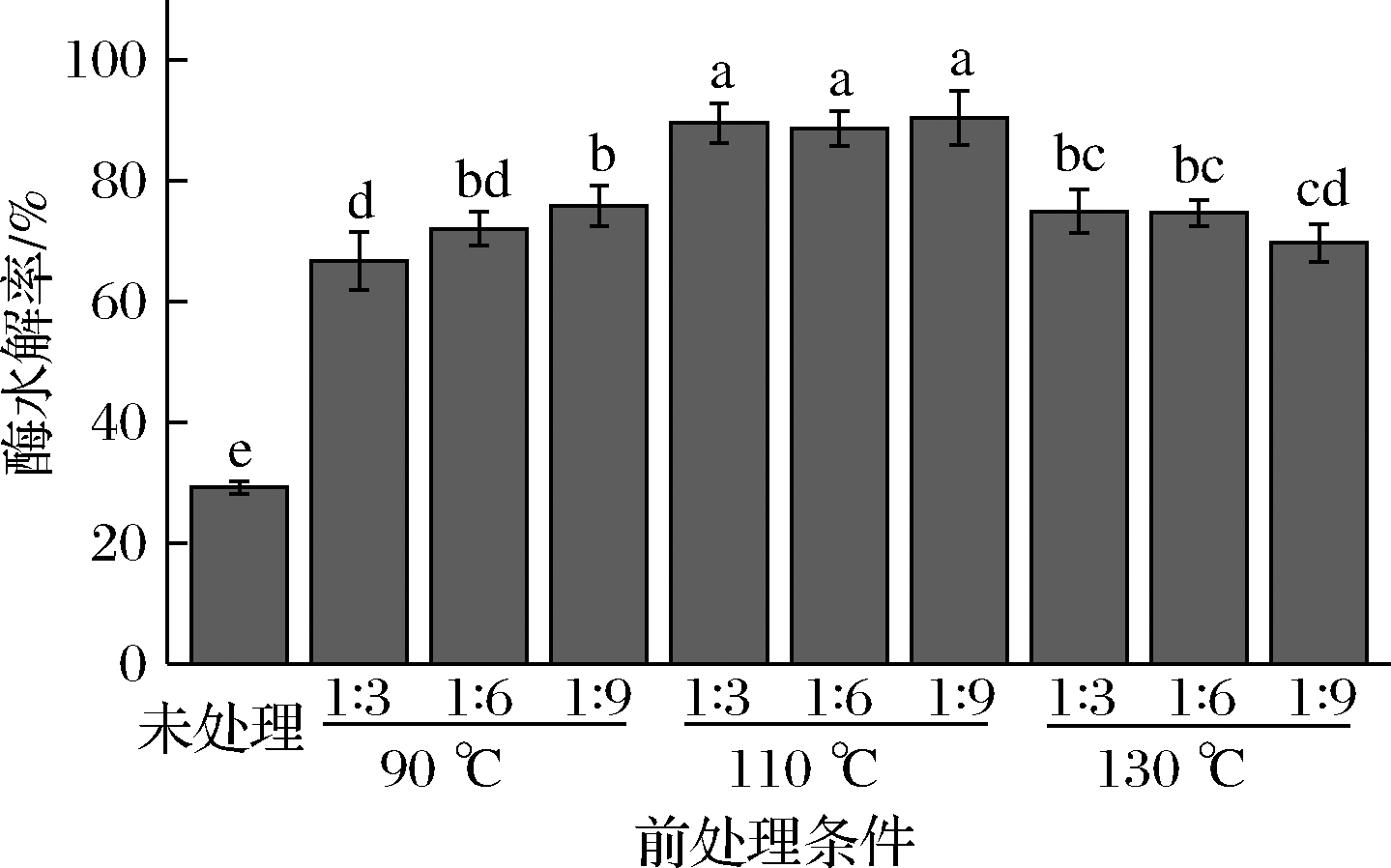
图5 DES预处理前后笋壳的酶水解率
Fig.5 Enzymatic hydrolysis rate of bamboo shoot shell
before and after DES pretreatment
研究了DES预处理反应温度和组分摩尔比对苦竹笋壳木质纤维素酶水解率的影响。通常木质素的存在对木质纤维素的酶水解效率有抑制作用,因为木质素粘结在纤维素表面,不仅阻碍了纤维素的酶水解,还与酶吸附形成木质素-酶复合物,降低酶解效率[27]。随着DES预处理温度从90 ℃提高到130 ℃,酶水解率分别为66.78%~75.91%(90 ℃)、88.65%~90.43%(110 ℃)和69.75%~74.98%(130 ℃),可见DES预处理在90 ℃时,笋壳样品的纤维素酶水解率最低,说明随着DES预处理温度升高,笋壳木质纤维素的物理结构破坏加剧(图1),去除了更多的半纤维素和木质素(表1),有利于提高笋壳样品中纤维素的酶水解率;但DES预处理在130 ℃时,笋壳样品中纤维素酶水解率却低于110 ℃时的酶水解率,这一现象说明,在DES预处理过程中过高的温度(130 ℃)可能会导致纤维素和残留木质素发生化学修饰(酰化反应),从而降低底物的酶水解率[28-30]。另外,预处理温度为110 ℃时,DES预处理组分(氯化胆碱和乳酸)摩尔比不同,竹笋笋壳酶水解率相当,均达到89%以上。
3 结论
采用DES预处理苦竹笋壳,探究DES预处理对笋壳木质纤维素组分、物化特征的变化及纤维素的酶水解效率的影响。研究表明,DES预处理破坏了苦竹笋壳木质纤维素完整有序的外观结构,将其分解成纤维束,并选择性地溶解、去除大部分的木质素和少量的半纤维素,使纤维素保留、暴露;DES预处理未改变笋壳纤维素的晶体结构,但笋壳木质纤维素会因脱去无定形区的部分半纤维素和大量木质素,从而导致笋壳样品结晶度的提高,这些DES预处理后笋壳木质纤维素的性质改变都大幅度促进了其酶水解率的提升,笋壳木质纤维素的酶水解率从29.24%(未处理)提升至66.78%~90.43%(DES处理),提升了2.3~3.1倍。另外发现,DES预处理温度升高,笋壳木质纤维素的酶水解率会相应增加,但DES预处理温度过高(130 ℃),反而会降低笋壳的酶水解率。本研究可为食品加工副产物的高值化利用(生产发酵糖、乙醇、乳酸等)提供指导。
[1] 徐森, 杨丽婷, 陈双林, 等.竹笋适口性形成及其主要影响因素研究综述[J].浙江农林大学学报, 2021, 38(2):403-411.
XU S, YANG L T, CHEN S L, et al.Review on the formation of bamboo shoot palatability and its main influencing factors[J].Journal of Zhejiang A & F University, 2021, 38(2):403-411.
[2] 李建科, 孟永宏, 刘柳, 等.我国食品工业副产物资源化利用现状[J].食品科学技术学报, 2021, 39(6):1-13.
LI J K, MENG Y H, LIU L, et al.Utilization of food industry by-products in China[J].Journal of Food Science and Technology, 2021, 39(6):1-13.
[3] V NSK
NSK E, VIHEL
E, VIHEL T, PERESIN M S, et al.Residual lignin inhibits thermal degradation of cellulosic fiber sheets[J].Cellulose, 2016, 23(1):199-212.
T, PERESIN M S, et al.Residual lignin inhibits thermal degradation of cellulosic fiber sheets[J].Cellulose, 2016, 23(1):199-212.
[4] DJAJADI D T, JENSEN M M, OLIVEIRA M, et al.Lignin from hydrothermally pretreated grass biomass retards enzymatic cellulose degradation by acting as a physical barrier rather than by inducing nonproductive adsorption of enzymes[J].Biotechnology for Biofuels, 2018, 11:85.
[5] SHEN X J, WEN J L, MEI Q Q, et al.Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization[J].Green Chemistry, 2019, 21(2):275-283.
[6] DU S K, ZHU X N, WANG H, et al.High pressure assist-alkali pretreatment of cotton stalk and physiochemical characterization of biomass[J].Bioresource Technology, 2013, 148:494-500.
[7] WU W J, WANG Z G, JIN Y C, et al.Effects of LiCl/DMSO dissolution and enzymatic hydrolysis on the chemical composition and lignin structure of rice straw[J].Biomass and Bioenergy, 2014, 71:357-362.
[8] LYNAM J G, KUMAR N, WONG M J.Deep eutectic solvents’ ability to solubilize lignin, cellulose, and hemicellulose;thermal stability;and density[J].Bioresource Technology, 2017, 238:684-689.
[9] CHUNDAWAT S P S, VENKATESH B, DALE B E.Effect of particle size based separation of milled corn stover on AFEX pretreatment and enzymatic digestibility[J].Biotechnology and Bioengineering, 2007, 96(2):219-231.
[10] HONG S, SHEN X J, XUE Z M, et al.Structure-function relationships of deep eutectic solvents for lignin extraction and chemical transformation[J].Green Chemistry, 2020, 22(21):7 219-7 232.
[11] ABBOTT A P, BOOTHBY D, CAPPER G, et al.Deep eutectic solvents formed between choline chloride and carboxylic acids:Versatile alternatives to ionic liquids[J].Journal of the American Chemical Society, 2004, 126(29):9 142-9 147.
[12] 董艳梅, 安艳霞, 马阳阳, 等.深度共熔溶剂预处理木质纤维素生物质研究进展[J].化工进展, 2021, 40(3):1 594-1 603.
DONG Y M, AN Y X, MA Y Y, et al.Research progress on deep eutectic solvent of lignocellulose pretreatment[J].Chemical Industry and Engineering Progress, 2021, 40(3):1 594-1 603.
[13] CHEN Y, MU T C.Application of deep eutectic solvents in biomass pretreatment and conversion[J].Green Energy & Environment, 2019, 4(2):95-115.
[14] FRANCISCO M, VAN DEN BRUINHORST A, KROON M C.New natural and renewable low transition temperature mixtures (LTTMs):Screening as solvents for lignocellulosic biomass processing[J].Green Chemistry, 2012, 14(8):2153.
[15] CHEN Z, WAN C X.Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment[J].Bioresource Technology, 2018, 250:532-537.
[16] TAN Y T, NGOH G C, CHUA A S M.Effect of functional groups in acid constituent of deep eutectic solvent for extraction of reactive lignin[J].Bioresource Technology, 2019, 281:359-366.
[17] ALVAREZ-VASCO C, MA R S, QUINTERO M, et al.Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES):A source of lignin for valorization[J].Green Chemistry, 2016, 18(19):5 133-5 141.
[18] ZHANG C W, XIA S Q, MA P S.Facile pretreatment of lignocellulosic biomass using deep eutectic solvents[J].Bioresource Technology, 2016, 219:1-5.
[19] 刘治刚, 高艳, 金华, 等.XRD分峰法测定天然纤维素结晶度的研究[J].中国测试, 2015, 41(2):38-41.
LIU Z G, GAO Y, JIN H, et al.Study on natural cellulose crystallinity determinated by the technology of XRD peak separation[J].China Measurement & Test, 2015, 41(2):38-41.
[20] 王延云, 胡强, 龚卫华, 等.碱联合超高压预处理对笋壳酶解效率的影响[J].化工进展, 2022, 41(3):1 357-1 363.
WANG Y Y, HU Q, GONG W H, et al.Effects of alkaline combined with ultra-high pressure pretreatment on enzymatic hydrolysis efficiency of bamboo shell[J].Chemical Industry and Engineering Progress, 2022, 41(3):1 357-1 363.
[21] SU Y, HUANG C X, LAI C H, et al.Green solvent pretreatment for enhanced production of sugars and antioxidative lignin from poplar[J].Bioresource Technology, 2021, 321:124471.
[22] 郭艳, 王悦, 张依, 等.不同方法提取的橄榄果渣纤维素的性质表征[J].中国食品学报, 2022, 22(1):306-313.
GUO Y, WANG Y, ZHANG Y, et al.Characterization of cellulose from olive pomace extracted by different methods[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(1):306-313.
[23] 余燕燕, 李以琳, 楼雨寒, 等.低共熔溶剂解离木纤维时木质素缩合对纤维素酶解的影响[J].林业工程学报, 2021, 6(6):101-108.
YU Y Y, LI Y L, LOU Y H, et al.Effect of lignin condensation on cellulose enzymatic hydrolysis during deep eutectic solvent fractionation of lignocellulose[J].Journal of Forestry Engineering, 2021, 6(6):101-108.
[24] ZHU L, O’DWYER J P, CHANG V S, et al.Structural features affecting biomass enzymatic digestibility[J].Bioresource Technology, 2008, 99(9):3 817-3 828.
[25] YU Z Y, JAMEEL H, CHANG H M, et al.The effect of delignification of forest biomass on enzymatic hydrolysis[J].Bioresource Technology, 2011, 102(19):9 083-9 089.
[26] EL HAGE R, BROSSE N, CHRUSCIEL L, et al.Characterization of milled wood lignin and ethanol organosolv lignin from Miscanthus[J].Polymer Degradation and Stability, 2009, 94(10):1 632-1 638.
[27] CAI Q, FAN Z S, CHEN J B, et al.Dissolving process of bamboo powder analyzed by FT-IR spectroscopy[J].Journal of Molecular Structure, 2018, 1 171:639-643.
[28] SUN S L, WEN J L, MA M G, et al.Enhanced enzymatic digestibility of bamboo by a combined system of multiple steam explosion and alkaline treatments[J].Applied Energy, 2014, 136:519-526.
[29] YOO C G, MENG X Z, PU Y Q, et al.The critical role of lignin in lignocellulosic biomass conversion and recent pretreatment strategies:A comprehensive review[J].Bioresource Technology, 2020, 301:122784.
[30] 沙如意, 张沙沙, 余瞻, 等.假木质素沉积及对纤维素酶解的影响研究进展[J].林业科学, 2020, 56(3):127-143.
SHA R Y, ZHANG S S, YU Z, et al.Advances in pseudo-lignin deposition and its effects on enzymatic hydrolysis of cellulose[J].Scientia Silvae Sinicae, 2020, 56(3):127-143.