鱼肉重组技术,一般是利用单一或复合黏合剂将低值碎鱼肉经重组黏接等工序制备鱼糜制品的一种方法,其本质是肌原纤维蛋白高级结构在热诱导及黏合作用下展开与再组装的一种过程。高温处理是制备即食重组鱼糜制品的关键工序之一,通过杀灭致病微生物从而延长产品保质期[1]。但是在高温灭菌过程中重组肌肉制品的肌球蛋白会发生重链降解,二级结构发生转变,凝胶特性、质构特性以及营养品质显著降低。目前鱼糜制品热稳定性的影响因素主要包括NaCl、水分含量以及黏合剂等。N
 EZ-FLORES等[2]研究发现,增大NaCl的添加浓度可使肌原纤维蛋白活性基团进一步暴露,增强蛋白质体系的疏水相互作用和二硫键作用,形成均一稳定的蛋白凝胶网络结构,从而增强鱼糜凝胶热稳定性。蛋白质分子表面的极性基团与水分子以氢键相结合,从而增强蛋白质网络结构的稳定性,提高其吸水能力,使其结构更加稳定。同时,TAKANO等[3]研究发现水分子可与蛋白质形成蛋白质-水分子簇,在分子层面增强蛋白质结构的稳定性。
EZ-FLORES等[2]研究发现,增大NaCl的添加浓度可使肌原纤维蛋白活性基团进一步暴露,增强蛋白质体系的疏水相互作用和二硫键作用,形成均一稳定的蛋白凝胶网络结构,从而增强鱼糜凝胶热稳定性。蛋白质分子表面的极性基团与水分子以氢键相结合,从而增强蛋白质网络结构的稳定性,提高其吸水能力,使其结构更加稳定。同时,TAKANO等[3]研究发现水分子可与蛋白质形成蛋白质-水分子簇,在分子层面增强蛋白质结构的稳定性。
此外,黏合剂对于重组鱼糜制品的热稳定特性具有重要作用。目前几种应用较为广泛的水产品黏合剂包括谷氨酰胺转胺酶(transglutaminase, TGase)、玉米淀粉、卡拉胶等。酶制剂主要是通过肌原纤维蛋白的化学交联作用增强蛋白质的凝胶作用,从而提高重组鱼肉的质构特性。TGase作为一种应用较为普遍的酶型黏合剂,可通过催化谷氨酰胺残基从肽链转移到γ-羧酰胺基团的转移反应,生成非二硫键共价键ɛ-(γ-Glu)-Lys,连接肌原纤维蛋白的头部以提高凝胶强度[4]。YANG等[5]研究发现,重组猪肉经TGase处理后,所形成的共价键比较稳定,不易断裂,经过反复冻融和蒸煮后不会松散。ARDIANSYAH等[6]研究低盐重组鱼排时发现添加TGase会使蛋白质之间形成的共价交联键增多,使其质地变硬,结构稳定,凝胶强度增加。
此外,重组鱼糜产品形式也较为匮乏,主要是鱼肠、鱼糕等传统产品。近年来有研究将鱼肉与猪肉重组,增强其风味[7],但猪肉油脂含量较高,易发生脂质氧化反应,导致货架期缩短。此外,增加的脂肪含量也与运动健身人群的健康低脂需求相悖,同时带来了高饱和脂肪酸和高胆固醇含量等缺点[8]。而鸡胸肉具有高蛋白、低脂肪、低胆固醇、低热量等特点,作为典型的白肉类型,鸡胸肉较鱼肉含有更为丰富的肌原纤维蛋白纤丝,其凝胶性和纤维感较强。且经过121 ℃高温灭菌后,蛋白质热降解产生的小分子肽和游离氨基酸发生脱氨、脱羧反应,生成醇、醛、硫化物等挥发性风味物质[9]。因此,将鱼糜与鸡胸肉结合,开发一种具有纤维感的重组鱼糜制品,对于丰富鱼糜制品种类,增强鱼糜的咀嚼性,以及创新鱼糜加工形式具有重要意义。
本研究通过结合鱼糜凝胶的黏弹特性及鸡胸肉鲜明的纤维特征,进一步以高温处理前后质构特性变化为指标,通过响应面分析法优化鱼糜制备过程中的关键工艺参数(食盐、水分和TGase的添加量),制备一种具有纤维感的即食重组鱼糜制品。进一步通过内源荧光光谱、微观结构观察、SDS-PAGE、化学作用力分析等表征手段,研究重组鱼糜制品的热稳定特性。本研究结果可为丰富鱼糜制品加工种类提供理论参考。
1 材料与方法
1.1 材料与试剂
阿拉斯加鳕鱼鱼糜由浙江渔福公司提供,真空包装,-20 ℃贮藏备用。泰森冷冻鸡胸肉购买于联华超市。TGase购买于上海青瑞食品科技有限公司,食品级,型号为TGY-2,酶活力为160 U/mL。NaH2PO4、三羟甲基氨基甲烷[tris-(hydroxymethyl)-aminomethane, Tris]、甘氨酸(glycine, Gly)、NaCl、盐酸、无水乙醇、戊二醛,分析纯,北京鼎国昌盛生物技术有限责任公司)。
1.2 仪器与设备
ZRD-A780全自动鼓风干燥箱,上海智诚分析仪器制造有限公司;TA-XT plus质构分析仪,英国Stable Micro Systems公司;Zetasizer Nano-ZS90激光纳米粒度分析仪,英国Malvern仪器有限公司;ARL Advant X荧光光谱仪,美国Thermo公司;ECLIPSE E100 SCIENTZ-950显微镜,尼康仪器有限公司;S312恒速数显电动搅拌器,郑州宇详仪器设备有限公司;ISO9001电子分析天平,北京赛多利斯仪器系统有限公司。
1.3 实验方法
1.3.1 纤维感重组鱼糜制品的制备
前期预实验结果表明,鸡胸肉的含水量与其质构特性密切相关,发现质量分数40%水分含量的肉粒纤维韧性与耐咀嚼性最好。因此,本研究将鸡胸肉风干至水分含量40%,切丁(0.2 cm×0.2 cm× 0.2 cm)待用。冷冻鱼糜解冻12 h,空擂2 min,加入鱼糜和风干鸡胸肉总质量0.5%~2%的食盐,盐擂2 min,随后加入7%的固形物(小麦蛋白∶马铃薯淀粉=2∶3,质量比,下同)擂溃2 min,分3次加入4%~16%的冰水,每次擂溃3 min,继续加入质量分数0.25%~1%的液态TGase,擂溃1 min,最后与鸡肉丁1∶1混匀。随后压模4 ℃放置18 h,40 ℃蒸煮20 min,90 ℃蒸煮15 min。脱模后真空包装,121 ℃高压蒸汽灭菌10 min。
1.3.2 单因素试验
按上述方法制备纤维感重组鱼糜制品,添加鱼糜和风干鸡胸肉总质量12%水分,0.5%TGase,选取食盐添加量(0.5%、1%、1.5%、2%);添加质量分数0.25%食盐,0.5%TGase,水分添加量(4%、8%、12%、16%);添加质量分数0.25%食盐,12%水分,TGase添加量(0.25%、0.5%、0.75%、1%)进行单因素试验,探究各因素对即食重组纤维感鱼糜制品高温灭菌前后质构特性的影响,每个因素平行试验12次,取平均值。
参考LIU等[10]的方法,将121 ℃高温灭菌前后的即食重组纤维感鱼糜制品切成1 cm×1 cm×1 cm的方块,选用质构仪的TPA模型,P 36R探头,测试前速度、测试速度和测试后速度设置为2、1、2 mm/s,压缩率为40%。每组样品至少测定12个平行样,取平均值。
1.3.3 响应面分析法优化纤维感重组鱼糜制品的最佳工艺
根据单因素试验结果,应用Design-Expert 8.06软件,采用Box-Behnken设计方案,选取食盐添加量、水分添加量、TGase添加量为考察因素,以咀嚼度和121 ℃高温灭菌前后咀嚼度降低率为响应值,根据响应面分析设计原理,选用3因素3水平的响应面试验设计(表1),优化耐高温的纤维感重组鱼糜制品的加工工艺。
表1 响应面实验因素编码及水平表
Table 1 Response surface experimental factor
coding and level table

水平因素食盐添加量(A)/%水分添加量(B)/%TGase添加量(C)/%-10.540.50180.7511.5121
1.3.4 微观结构的测定
根据响应面优化结果制备纤维感重组鱼糜制品,40 ℃蒸煮20 min,90 ℃蒸煮15 min。脱模后真空包装,再分别经过100、105、110、115、120 ℃高温蒸煮10 min后,以未经高温处理的样品作为对照,观察高温处理过程中其微观结构的变化。制作样品切片于25 g/L戊二醛中固定,乙醇梯度洗脱后冷冻干燥24 h,喷金后用扫描电子显微镜(scanning electron microscope,SEM)观察拍照。
1.3.5 肌纤维形态的测定[11]
将经过不同高温处理的重组鱼糜制品切成1 cm×1 cm×1 cm正方体浸入体积分数10%甲醛溶液中固定24 h,然后乙醇梯度脱水,二甲苯透明处理,用石蜡包埋,制成1 cm×1 cm×1 cm的石蜡块,用切片机切片,最后苏木精-伊红法染色后,显微镜镜检,图像采集,选取鸡肉纤维横纵切面进行分析。
1.3.6 抗热力降解机理研究
1.3.6.1 内源荧光
肌原纤维蛋白(myofibrillar protein,MP)提取采用林忠武[12]的方法。称取不同热处理的肉样 5 g,添加 50 mL 0.03 mol/L 的磷酸缓冲液(pH 7.4),打浆 2 min 均质。10 000×g、4 ℃离心20 min,上清液为肌浆蛋白,沉淀物中添加 40 mL 含有8 mol/L 尿素的缓冲液,打浆 2 min,10 000×g、4 ℃离心20 min,上清液用滤纸在4 ℃下过滤,滤液为肌原纤维蛋白。将MP浓度调成0.5 mg/mL,测定参数如下:激发波长295 nm;狭缝10 nm;扫描范围300~450 nm;灵敏度3。
1.3.6.2 聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)图谱
取适量样品,加入9倍体积分数5%的SDS溶液,高速匀浆2 min。在85 ℃水浴中放置1 h,冷却至室温。8 000×g下离心20 min,用Lowry法测定上清液中蛋白浓度,并调至1 mg/mL。取调节浓度后的样品与5×Loading Buffer混合,沸水浴5 min。
分别取15 μL上述混合液和标品于聚丙烯酰胺凝胶(12%分离胶、5%浓缩胶),电压为80 V,当样品跑至浓缩胶与分离胶之间后,调至120 V。电泳结束后,取出凝胶,考马斯亮蓝染色30 min。脱色液脱色至条带清晰。
1.3.6.3 非共价键[13]
2 g样品分别与10 mL萃取剂S0(0.05 mol/L NaCl)、S1(0.6 mol/L NaCl)、S2(0.6 mol/L NaCl和1.5 mol/L尿素)和S3(0.6 mol/L NaCl和 8 mol/L尿素)混合均匀后均质1 min,4 ℃浸提1 h,10 000×g离心15 min,上清液中的蛋白质含量用双缩脲法测定。离子键为溶解于S1与S0溶液中的蛋白质含量之差表示,氢键以溶解于S2与S1溶液中的蛋白质含量之差表示,疏水相互作用以溶解于S3与S2溶液中的蛋白质含量之差表示。
1.3.6.4 二硫键
参照 BEVERIDGE 等[14]方法。将1 g样品加入5倍体积的Tris-甘氨酸Gly缓冲溶液(含0.086 mol/L Tris,0.09 mol/L Gly,0.004 mol/L EDTA,8 mol/L 尿素)匀浆,10 000×g离心15 min,4 mL上清液加入200 μL Ellman 试剂,置于室温1 h,测定412 nm处吸光值(A412)。按公式(1)计算巯基含量:
巯基含量![]()
(1)
式中:73.53=106/1.36×104,1.36×104为摩尔消光系数;ρ,样品的蛋白质浓度,mg/mL。
测总巯基含量时,取1 mL上清液,加入4 mL Tris-甘氨酸缓冲液(含15 mg/mL β-巯基乙醇,8 mol/L 尿素,5 mol/L 盐酸胍),室温下反应1 h,之后加入50%三氯乙酸(trichloroacetic acid, TCA) 至最终浓度为10%,3 000×g离心,沉淀用12% TCA洗涤2次,将沉淀溶于3 mL的Tris-Gly-8 mol/L 尿素缓冲液,二硫键含量为总巯基含量与游离巯基的差值。
1.3.7 数据分析
数据结果表示为平均值±标准差,采用SPSS 19.0 软件进行数据分析,用单因素ANOVA两两比较的Duncan模型进行多组数据差异性分析,显著性水平为P<0.05。数据作图均采用 Origin Pro 8.6。
2 结果与分析
2.1 单因素试验
质构特性是评价肉制品品质的重要指标之一,能间接反映出蛋白基质的结构完整性及与其他成分相结合的状态。其中咀嚼度是指将固体样品咀嚼并达到吞咽时的稳定状态所需要的能量,能够反映肉质纤维的咀嚼感[15]。图1显示了食盐、水分和TGase的添加量对重组鱼糜制品高温处理前后硬度、弹性和咀嚼度的影响。121 ℃高温灭菌前后鱼糜制品质构特性(硬度、弹性、咀嚼度)降低率越低,说明其热稳定性越好。
由图1(a1~a3)可以看出,与对照组相比,添加一定浓度的食盐可显著增强重组鱼糜的硬度、弹性及咀嚼度(P<0.05)。经高温灭菌后,鱼糜制品的质构特性显著降低,且随NaCl添加量的增加,硬度与咀嚼度的降低率逐渐增大,热稳定性下降。BLIKRA等[16]研究发现,加入高于蛋白质等电点的NaCl,改变了蛋白质更有效结合水的pH值,增强持水性。但当盐浓度较高时,蛋白质发生变性,蛋白质之间形成较强的化学键,使得肌肉收缩,MP因此迅速失去水分,导致凝胶网络孔径增大,重组鱼糜制品热稳定性下降[17]。
水分子既可以通过氢键与蛋白质表面相结合,也可以填充在蛋白质空穴中增强蛋白质结构稳定性。由图1(b1~b3)可知,增加水分添加量,灭菌前后的鱼糜制品硬度和咀嚼度均显著降低(P<0.05),弹性变化不显著,其中添加8%的水分硬度和咀嚼度的降低率最低。由此可见,添加适量的水分可以有效提高重组鱼糜制品的热稳定性。这可能是因为添加水分为肌纤维的吸水膨胀提供了充足的条件[18],且由于蛋白质和水分子的水合作用使得蛋白质分子的热稳定性增强[3]。
由图1(c1~c3)可知,添加一定浓度的TGase使重组鱼糜制品的硬度、弹性和咀嚼度显著增强(P<0.05)。当TGase的添加量为0.75%时,产品高温灭菌后质构特性的降低率最小,其热稳定性最强。可能是因为在鱼糜凝胶的热诱导凝胶化过程中,交联度的增加导致凝胶质地从黏弹性变为弹性,凝胶结构从无序和松散变为有序和致密[19-20]。然而,过多的TGase使蛋白质之间相互作用增强,可能会减少蛋白质与水之间的相互作用,导致水分流失,形成过于坚固且柔韧性差的网络,热稳定性降低[21]。

a1~a3-食盐添加量对鱼糜制品质构的影响;b1~b3-水分添加量对鱼糜制品质构的影响;c1~c3-TGase添加量对鱼糜制品质构的影响
图1 食盐、水分及TGase添加量对重组鱼糜制品质构的影响
Fig.1 Effects of salt, water and TGase addition on texture of recombinant surimi products
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 响应面优化纤维感重组鱼糜制品加工工艺
根据单因素试验结果,综合分析,食盐添加量选取0.5%、1%、1.5%,水分添加量选取4%、8%、12%,TGase添加量选取0.5%、0.75%、1%。咀嚼度为硬度、内聚性、弹性三者乘积,它综合反映了重组鱼糜制品对咀嚼的持续抵抗性。经121 ℃灭菌后,肌纤维断裂程度越小,其咀嚼至吞咽时的稳定状态所需要的能量越高,可以在一定程度上间接反映该产品整体具有肉质纤维咀嚼的真实感[22]。因此,以咀嚼度和咀嚼度灭菌前后的降低率为响应值,采用BoxBehnken法进行试验因素设计,试验方案及结果见表2。
表2 响应面设计方案和试验结果
Table 2 Design and result of response surface analysis
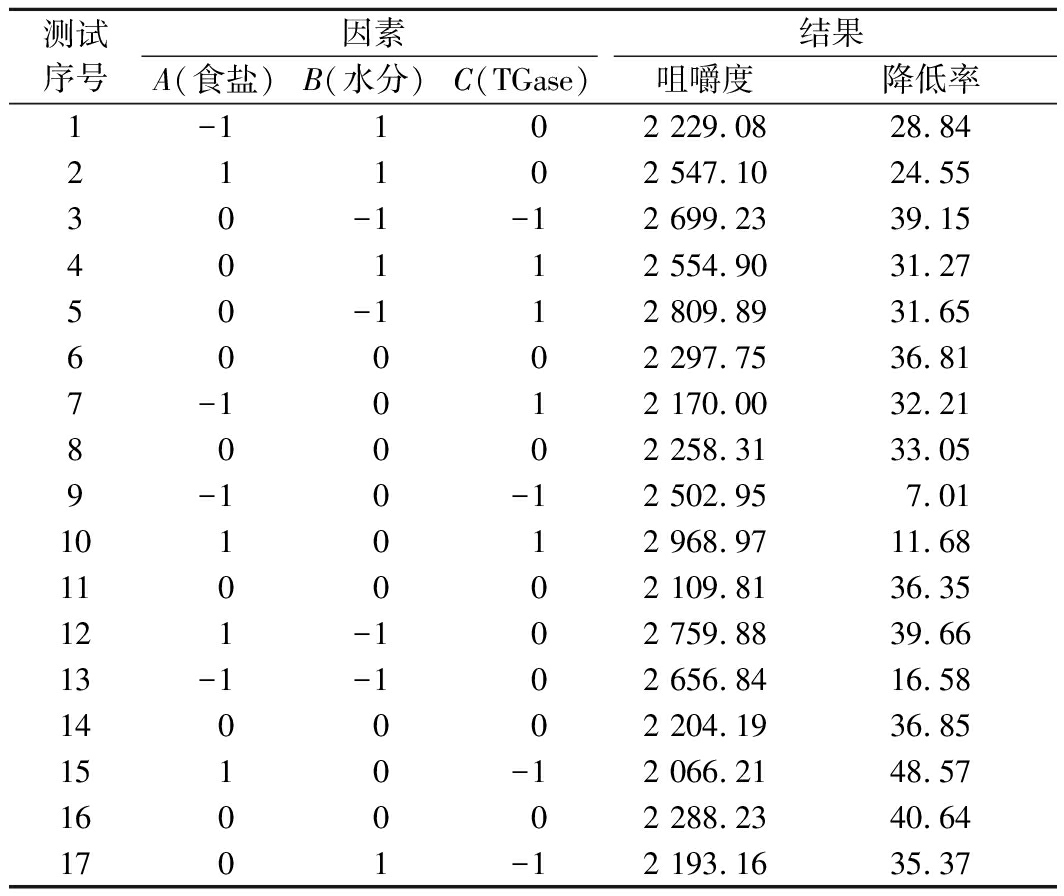
测试序号因素结果A(食盐)B(水分)C(TGase)咀嚼度降低率1-1 1 02 229.0828.8421102 547.1024.5530-1-12 699.2339.1540112 554.9031.2750-112 809.8931.6560002 297.7536.817-1012 170.0032.2180002 258.3133.059-10-12 502.957.01101012 968.9711.68110002 109.8136.35121-102 759.8839.6613-1-102 656.8416.58140002 204.1936.851510-12 066.2148.57160002 288.2340.641701-12 193.1635.37
利用 Design-Expert 10.0 统计软件将咀嚼度和咀嚼度降低率分别进行二次回归拟合,并对二次多项回归方程进行方差分析,所建立的模型能比较准确地分析和预测重组鱼糜制品中食盐、水分及TGase添加量与其咀嚼度及其降低率的关系,得出最佳工艺条件为,食盐添加量0.52%、水分添加量4.06%、TGase添加量0.51%,预测得到的纤维感重组鱼糜制品的咀嚼度为2 982.4,降低率为4.6%。为了检验模型准确性,在此条件下平行实验3次,得出咀嚼度为2 812.8,降低率为5.7%。由此可见咀嚼度和灭菌前后降低率的验证实验值与模型预测值比较接近,表明预测结果较优。
2.3 重组鱼糜制品微观结构及肌纤维形态
图2(a1~a6)为鱼糜凝胶部分在高温处理过程中的微观结构变化,经100~110 ℃高温处理后,鱼糜凝胶的网络结构变得更加平整有序。这是因为蛋白之间氢键、静电及疏水相互作用的改变,促使其发生聚集和交联,形成有序的网状结构。115 ℃高温处理组的凝胶网络结构松散,出现较多孔洞,无法形成有序的三维网络结构。说明115 ℃以上的高温对凝胶网状结构具有较大程度的破坏,网状结构的骨架变得更为脆弱,孔隙更大。120 ℃处理的鱼糜凝胶网络呈现出小而紧凑的聚集簇,表明随着加热温度的升高,使蛋白过度聚合变性,产生聚集现象。这与韩静文[13]研究耐热性鱼肠的结果一致。
通过HE染色法进一步对鱼糜制品中的鸡肉纤维形态进行观察(图2-b1~b6,c1~c6)。未进行高温处理的样品肌纤维结构完整,而经不同高温处理后肌纤维逐渐出现肿胀、边界不清晰、纤维断裂等现象,说明高温处理会破坏肌纤维的结构[23]。当高温处理温度升高至105 ℃时,可以明显看出肌纤维横截面积增大,可能是该温度范围内纤维纵向收缩的结果,导致肌肉纤维横截面积膨胀[24]。但当温度继续升高,肌纤维横截面积变小,且间隙变大,且纤维断裂现象更加明显,说明横向收缩和纵向收缩加剧。VASKOSKA等[25]也研究证实随着热加工过程中温度的升高,肌纤维会连续横向收缩,然后纵向收缩。因此,一定程度的高温处理(100~110 ℃)导致MP活性基团暴露,氢键、静电及疏水相互作用的改变,促使其发生聚集和交联,形成有序的网状结构。随着处理温度的升高,凝胶网络结构松散,孔洞较多,肌纤维发生明显断裂。

a-鱼糜凝胶部分SEM图,5 000×;b-肌纤维部分纤维横截面HE染色图;c-肌纤维纵截面HE染色图,20×;
对照-90 ℃蒸煮15 min后未经高温处理的样品(下同)
图2 高温处理过程中重组鱼糜制品微观结构及肌纤维形态变化
Fig.2 Changes in the microstructure and muscle fiber morphology of the recombinant surimi
products subjected to the high temperature treatments
注:1~6表示不同处理组
2.4 重组鱼糜制品肌原纤维蛋白内源荧光光谱分析
高温处理会引起蛋白构象改变,使芳香族氨基酸残基的位置及微环境发生变化,而芳香族氨基酸残基可吸收紫外入射光发射荧光,因此可利用内源荧光光谱来研究蛋白质三级结构的变化。如图3所示,高温处理使得MP的λmax发生红移,荧光强度随高温处理温度的升高先增大后减小,在105 ℃时达到最大。说明MP热变性过程中,结构会逐步展开,使埋藏在分子内部的色氨酸等芳香族氨基酸残基逐渐从内部疏水区向溶剂暴露,导致MP所处微环境极性增强,产生溶剂淬灭作用,因此蛋白质荧光强度的峰值λmax逐渐红移[26]。120 ℃荧光强度增加,可能是MP通过疏水相互作用聚集形成蛋白质聚集物,将暴露的少量疏水性残基重新包埋于蛋白质内部,使蛋白质所处的微环境极性降低,荧光强度增加,这与康怀彬等[27]研究高温处理对牛肉蛋白内源荧光光谱变化结果一致。
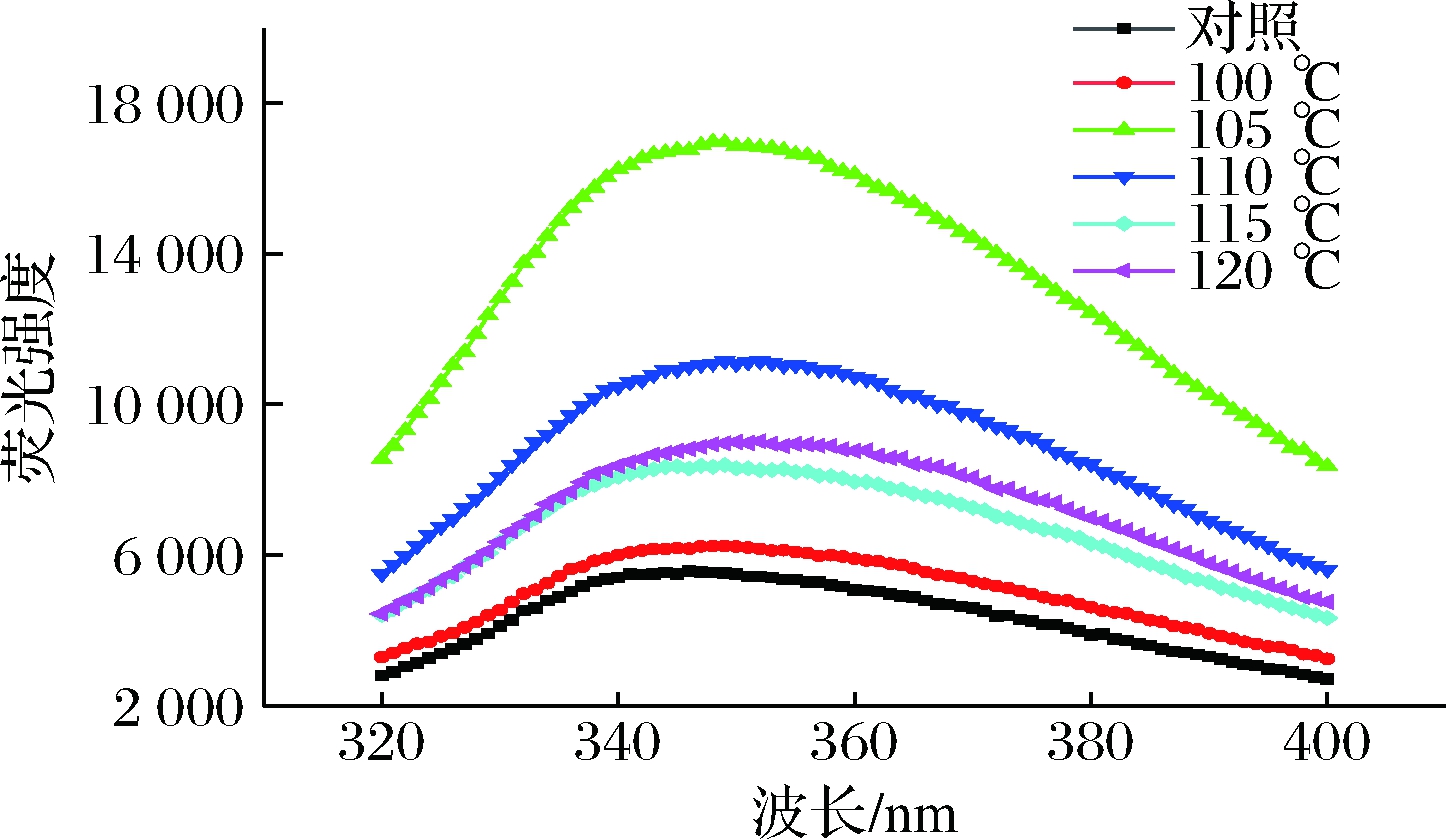
图3 高温处理过程中重组鱼糜制品肌原纤维
蛋白内源荧光光谱图
Fig.3 Intrinsic fluorescence spectra of myofibrillar protein
during high temperature treatment
2.5 重组鱼糜肌原纤维蛋白SDS-PAGE分析
SDS-PAGE图谱可以直观地看出蛋白质的热降解情况。重组肌肉蛋白的形成主要涉及肌球蛋白头部、尾部和肌动蛋白的展开、交联和聚集[28],因此,肌球蛋白重链(myosin heavy chain, MHC)(200 kDa)和肌动蛋白(Actin,43 kDa)在蛋白凝胶形成中起主要作用。从图4可以看出,随着热处理温度的升高,电泳条带在200~130 kDa和55~25 kDa均出现了明显变浅,说明高温促进蛋白发生热降解,形成了小分子肽段,导致MHC和Actin含量随热处理温度升高明显降低。经120 ℃高温处理后,200 kDa处的MHC条带已完全消失,而44.3 kDa处的肌动蛋白条带变化较小,120 ℃处理后仍存在,说明蛋白热稳定性较好[28]。
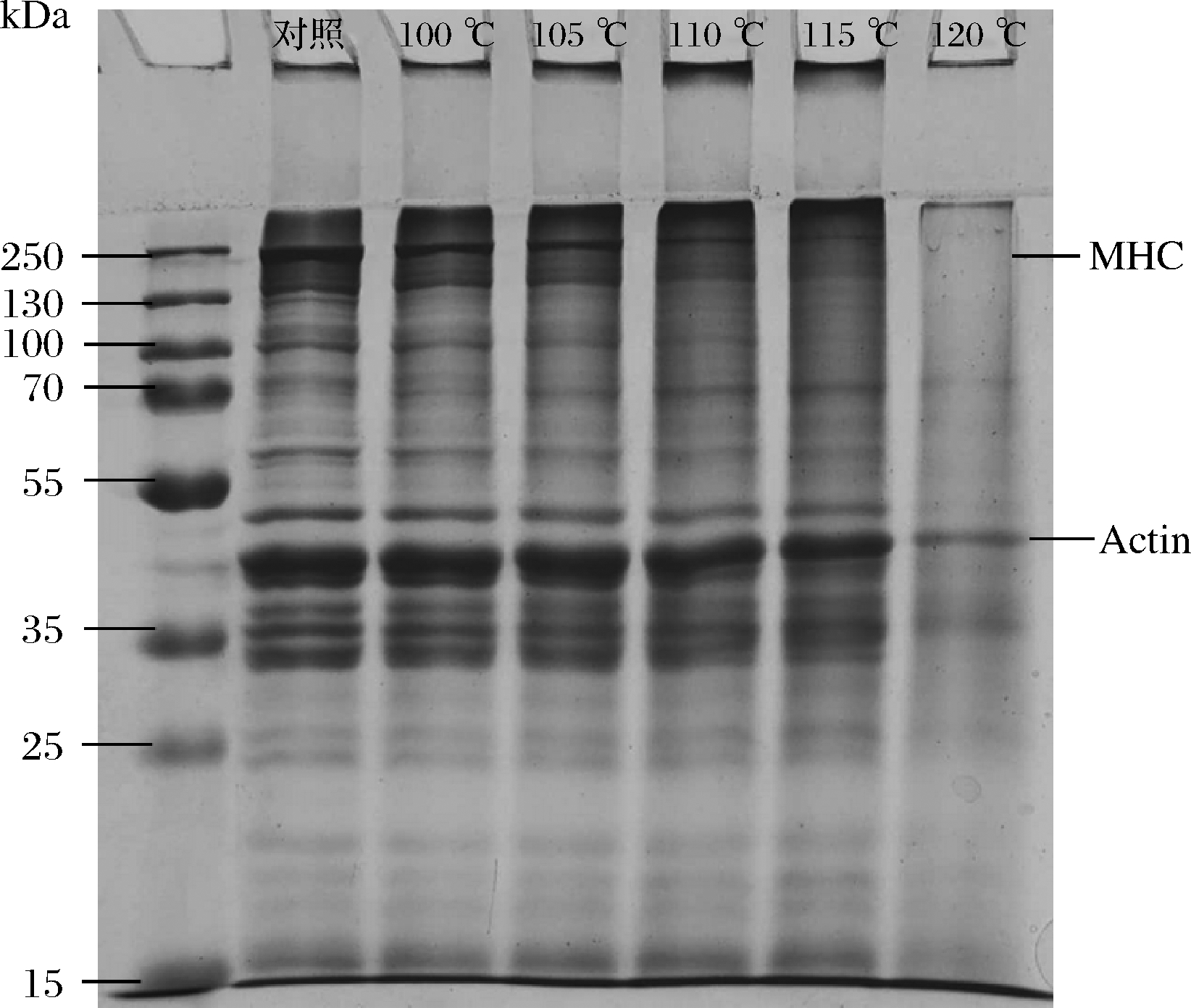
图4 高温处理过程中重组鱼糜制品肌原纤维
蛋白SDS-PAGE图
Fig.4 SDS-PAGE graph of myofibrillar protein of recombinant
surimi product during high temperature treatment
2.6 重组鱼糜制品蛋白质化学作用力的变化
化学作用力在鱼糜蛋白网状结构的形成中发挥了重要的作用。由图5-a可知,随着温度升高,离子键含量先上升,后下降,105~110 ℃无明显差异,当温度大于110 ℃时,迅速上升。氢键随处理温度的升高而迅速下降,至115 ℃后又呈上升趋势。可能是蛋白质结构在过高的处理温度下被破坏,因此维持蛋白质结构的氢键含量减少。120 ℃处理后的鱼糜制品的氢键含量增加,可能是因为解旋后的肌球蛋白相互间无序结合,此时氢键重新暴露出来,含量增加。疏水相互作用整体呈先上升后下降,最后趋于稳定。随着温度的升高,肌球蛋白展开导致疏水性残基的暴露,相邻暴露的疏水残基能够通过疏水相互作用交联,和其他分子间作用形成了蛋白凝胶网状结构[29]。温度继续升高时,蛋白变性和相互聚集的速率升高,不同蛋白质分子间相互作用的时间缩短,故其作用随着温度的升高而减少[13]。
二硫键是由巯基氧化生成的共价键,有着极强的键能,对蛋白质的结构有着一定的影响。由图5-b可知,随着处理温度的升高,二硫键含量呈先上升后下降的趋势,105 ℃最大。二硫键含量上升可能是因为蛋白分子之间静电斥力减弱,增加了蛋白分子表面游离巯基的互相接触,促进了二硫键的形成[30]。105~115 ℃二硫键含量趋于稳定,分子链内部的聚合联结作用得到加强。120 ℃二硫键含量大幅度降低,可能是因为蛋白质分子间的静电斥力增强,蛋白质分子去折叠的程度降低,巯基与二硫键之间的硫醇-二硫键交换反应减弱[30]。
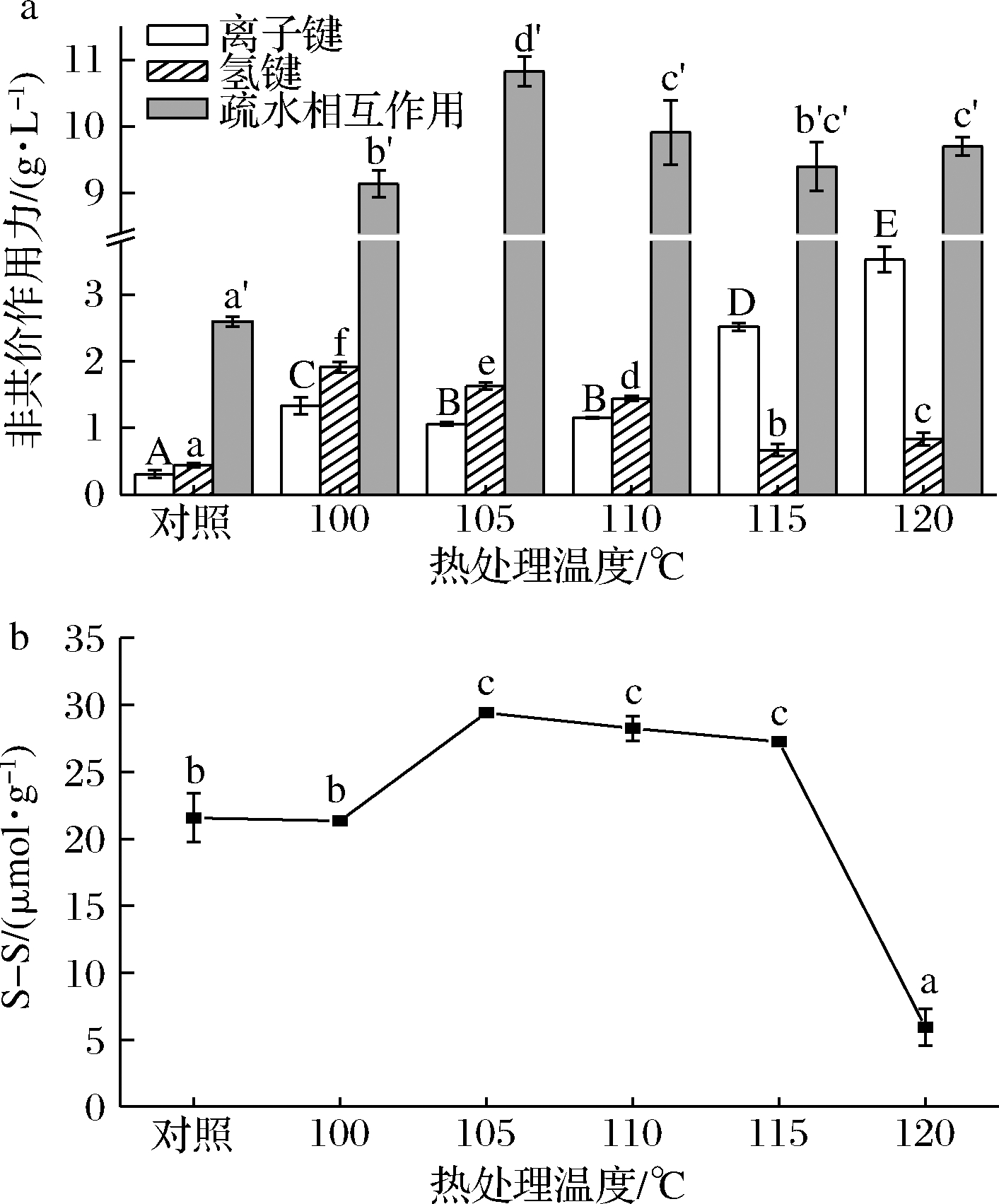
a-非共价作用;b-二硫键
图5 高温处理过程中重组鱼糜制品蛋白间
化学作用力的变化
Fig.5 Changes in the chemical force of recombinant surimi
product protein during high temperature treatment
3 结论
本实验以冷冻鱼糜和低温风干的鸡胸肉粒为原料,通过响应面优化制备了一种具有纤维感和高热稳定的重组鱼糜制品。确定食盐、水分、TGase的最佳添加量分别为质量分数0.5%、4.1%、0.5%,此条件下制备的纤维感重组鱼糜制品经121 ℃灭菌10 min后的咀嚼度仍具有较高的咀嚼度,灭菌前后降低率为5.7%。微观结构分析表明,在高温处理过程中,100~110 ℃条件下鱼糜凝胶部分的网络结构平整有序,肌纤维横截面积增大,温度继续升高,凝胶网络结构和肌纤维形态均被破坏。随着处理温度的升高,蛋白降解成小分子质量的蛋白片段,分子内部的色氨酸等芳香族氨基酸残基暴露,静电相互作用增加。高温处理过程中维持重组鱼糜制品蛋白结构稳定的主要化学作用力为疏水相互作用和二硫键。本研究可为即食重组鱼糜制品制备提供一定的理论依据。
[1] ZHANG T, LI Z J, WANG Y M, et al.Effects of konjac glucomannan on heat-induced changes of physicochemical and structural properties of surimi gels[J].Food Research International, 2016, 83:152-161.
[2] N
 EZ-FLORES R, CANDO D, BORDER
EZ-FLORES R, CANDO D, BORDER AS A J, et al.Importance of salt and temperature in myosin polymerization during surimi gelation[J].Food Chemistry, 2018, 239:1 226-1 234.
AS A J, et al.Importance of salt and temperature in myosin polymerization during surimi gelation[J].Food Chemistry, 2018, 239:1 226-1 234.
[3] TAKANO K, FUNAHASHI J, YAMAGATA Y, et al.Contribution of water molecules in the interior of a protein to the conformational stability[J].Journal of Molecular Biology, 1997, 274(1):132-142.
[4] ZHAO Z L, WANG Q, YAN B W, et al.Synergistic effect of microwave 3D print and transglutaminase on the self-gelation of surimi during printing[J].Innovative Food Science & Emerging Technologies, 2021, 67:102546.
[5] YANG X Q, ZHANG Y M.Expression of recombinant transglutaminase gene in Pichia pastoris and its uses in restructured meat products[J].Food Chemistry, 2019, 291:245-252.
[6] ARDIANSYAH A, SAHUBAWA L, USTADI.Restructuring steak from flakes of yellowfin tuna meat using low salt microbial transglutaminase (MTGase)[J].IOP Conference Series:Earth and Environmental Science, 2020, 404(1):012073.
[7] OLIVARES A, NAVARRO J L, SALVADOR A, et al.Sensory acceptability of slow fermented sausages based on fat content and ripening time[J].Meat Science, 2010, 86(2):251-257.
[8] 姚光明, 张猛, 刘佳彤, 等.脂代果蔬/鹿肉复合发酵香肠加工特性与工艺优化[J].肉类研究, 2014, 28(11):21-26.
YAO G M, ZHANG M, LIU J T, et al.Fermented venison sausages with added fruits and vegetables made by replacement of pork fat with vegetable oils:Processing properties and process optimization[J].Meat Research, 2014, 28(11):21-26.
[9] 蒋娅婷, 曹锦轩, 张玉林, 等.蛋白质与挥发性风味成分相互作用研究进展[J].核农学报, 2014, 28(2):285-291.
JIANG Y T, CAO J X, ZHANG Y L, et al.A proceeding of research in the interactions of protein with volatile flavor compounds[J].Acta Agriculturae Nucleatae Sinica, 2014, 28(2):285-291.
[10] LIU Y J, YU J M, ZHU J, et al.Effects of salt-induced changes in protein network structure on the properties of surimi gels:Computer simulation and digestion study[J].International Journal of Food Science & Technology, 2021, 56(8):3 914-3 923.
[11] 王雪松, 谢晶.不同冻结方式对竹荚鱼品质的影响[J].食品与发酵工业, 2020, 46(11):184-190.
WANG X S, XIE J.Effects of different freezing methods on the quality of horse mackerel[J].Food and Fermentation Industries, 2020, 46(11):184-190.
[12] 林忠武. 不同来源肌肉组织的耐煮性比较研究[D].杭州:浙江工业大学, 2016.
LIN Z W.Comparative study on the cooking tolerance of muscle tissues from different sources[D].Hangzhou:Zhejiang University of Technology, 2016.
[13] 韩静文. 鱼糜凝胶热加工特性及耐热型鱼糜肠配方研究[D].无锡:江南大学, 2018.
HAN J W.Study on thermal processing properties of surimi gels and formulation of the heat tolerant surimi sausage[D].Wuxi:Jiangnan University, 2018.
[14] BEVERIDGE T, TOMA S J, NAKAI S.Determination of sh- and ss-groups in some food proteins using ellman’s reagent[J].Journal of Food Science, 1974, 39(1):49-51.
[15] 杨珊珊. 鸡肉糜脯加工工艺以及品质改善的研究[D]. 广州:华南理工大学, 2010.
YANG S S. Study on processing technology and quality improvement of chicken minced meat[D]. Guangzhou: South China University of Technology, 2010.
[16] BLIKRA M J, JESSEN F, FEYISSA A H, et al.Low-concentration salting of cod loins:The effect on biochemical properties and predicted water retention during heating[J].LWT, 2020, 118:108702.
[17] THORARINSDOTTIR K A, ARASON S, GEIRSDOTTIR M, et al.Changes in myofibrillar proteins during processing of salted cod (Gadus morhua) as determined by electrophoresis and differential scanning calorimetry[J].Food Chemistry, 2002, 77(3):377-385.
[18] JIA R, KATANO T, YOSHIMOTO Y, et al.Effect of small granules in potato starch and wheat starch on quality changes of direct heated surimi gels after freezing[J].Food Hydrocolloids, 2020, 104:105732.
[19] FANG M X, LUO X Y, XIONG S B, et al.In vitro trypsin digestion and identification of possible cross-linking sites induced by transglutaminase (TGase) of silver carp (Hypophthalmichthys molitrix) surimi gels with different degrees of cross-linking[J].Food Chemistry, 2021, 364:130443.
[20] FANG M X, XIONG S B, YIN T, et al.In vivo digestion and absorption characteristics of surimi gels with different degrees of cross-linking induced by transglutaminase (TGase)[J].Food Hydrocolloids, 2021, 121:107007.
[21] DONG X P, PAN Y X, ZHAO W Y, et al.Impact of microbial transglutaminase on 3D printing quality of Scomberomorus niphonius surimi[J].LWT, 2020, 124:109123.
[22] 朱嵩. 基于高水分挤压技术的花生蛋白素肠制备及其贮藏特性研究[D].北京:中国农业科学院, 2019.
ZHU S.Study on preparation and storage characteristics of peanut protein sausage by high moisture extrusion[D].Beijing:Chinese Academy of Agricultural Sciences, 2019.
[23] RIBEIRO W O, OZAKI M M, DOS SANTOS M, et al.Interaction between papain and transglutaminase enzymes on the textural softening of Burgers[J].Meat Science, 2021, 174:108421.
[24] VASKOSKA R, HA M, ONG L, et al.Myosin sensitivity to thermal denaturation explains differences in water loss and shrinkage during cooking in muscles of distinct fibre types[J].Meat Science, 2021, 179:108521.
[25] VASKOSKA R, HA M, ONG L, et al.Ageing and cathepsin inhibition affect the shrinkage of fibre fragments of bovine semitendinosus, biceps femoris and psoas major during heating[J].Meat Science, 2021, 172:108339.
[26] LIU H T, WANG Z, BADAR I H, et al.Combination of high-intensity ultrasound and hydrogen peroxide treatment suppresses thermal aggregation behaviour of myofibrillar protein in water[J].Food Chemistry, 2022, 367:130756.
[27] 康怀彬, 邹良亮, 张慧芸, 等.高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J].食品科学, 2018, 39(23):80-86.
KANG H B, ZOU L L, ZHANG H Y, et al.Effect of high temperature treatment on chemical forces of beef proteins and structure of myofibrillar protein[J].Food Science, 2018, 39(23):80-86.
[28] QI J, ZHANG W W, FENG X C, et al.Thermal degradation of gelatin enhances its ability to bind aroma compounds:Investigation of underlying mechanisms[J].Food Hydrocolloids, 2018, 83:497-510.
[29] 周绪霞, 陈红, 陈小草, 等.谷氨酰胺转氨酶对白姑鱼鱼糜蛋白-油脂复合凝胶特性及微观结构的影响[J].中国食品学报, 2020, 20(6):106-113.
ZHOU X X, CHEN H, CHEN X C, et al.Effect of transglutaminase on properties and microstructure of surimi protein-lipids composite gels[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(6):106-113.
[30] DU X, ZHAO M N, PAN N, et al.Tracking aggregation behaviour and gel properties induced by structural alterations in myofibrillar protein in mirror carp (Cyprinus carpio) under the synergistic effects of pH and heating[J].Food Chemistry, 2021, 362:130222.