蜜柑以皮薄无核、肉汁丰富、内含物质高等特点而畅销国内外。温州蜜柑含有较高的总酚、类黄酮和维生素C等丰富的营养成分,具有很强的加工适用性[1-2]。除了日常食用外,大部分的蜜柑用来加工成罐头和果干,而加工过程中产生大量的蜜柑皮渣等副产物[3],带来严重的资源浪费和环境污染。据统计我国每年产生柑橘皮渣高达千万吨以上,可用于提取果胶、精油及黄酮类化合物等生物活性物质以及生产有机肥、饲料[4-5]。研究发现,柑橘皮渣中含有多种有效成分,包括膳食纤维、果胶、蛋白质、色素、类黄酮、精油等物质。其中柑橘皮渣膳食纤维相对于谷物膳食纤维具有更高营养质量和更低的热量等特点,因此对其提取利用有一定的意义和价值。
膳食纤维(dietary fiber,DF)是一类不能被人体小肠消化吸收,但可在大肠内全部或部分发酵的碳水化合物[6]。按其溶解性的差异,可分为可溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。SDF具有控制血糖血脂、降低胆固醇等功效[7];IDF通过增加粪便体积、刺激肠道蠕动等方式发挥生理活性。目前,对柑橘属膳食纤维的研究中发现,柑橘膳食纤维具有较高的水合性质[8];有研究表明, 柑橘皮渣膳食纤维具有良好的消炎杀菌、抗氧化等生理功效[9-10];L PEZ-MARCOS等[11]发现,柑橘纤维持水性和持油性有利于改善面包的色泽和口感,从而有利于食品加工生产。
PEZ-MARCOS等[11]发现,柑橘纤维持水性和持油性有利于改善面包的色泽和口感,从而有利于食品加工生产。
因此,本研究以蜜柑皮和蜜柑果肉为主要研究对象,分别提取SDF以及IDF,并对其结构特征、理化性质以及功能进行评价。为提高柑橘皮渣深加工产品附加值和开发高效、绿色的蜜柑膳食纤维加工工艺提供理论指导。
1 材料与方法
1.1 材料与试剂
温州蜜柑分离果肉和果皮,果皮切成均匀的(3±0.5)cm小块,果肉榨汁后留渣,将果皮和果肉渣经60 ℃完全干燥后,粉碎过80目筛,存于4 ℃冰箱备用。
Na2HPO4、NaH2PO4、NaOH(均为分析纯)、α-淀粉酶(4 000 U/g)、糖化酶(10万U/g)、中性蛋白酶(10万U/g),上海源叶生物科技有限公司;单糖标准品,美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HWS电热恒温水浴锅,上海一恒科学仪器有限公司;UV1800型紫外分光光度计,日本岛津公司;PB-10型pH计,Sartorius公司;LC-20A高效液相色谱仪,日本岛津公司;D8 Advance X射线多晶衍射仪,德国Bruker公司。
1.3 实验方法
1.3.1 膳食纤维的提取
1.3.1.1 IDF的制备
称取一定量的蜜柑果皮粉和蜜柑果肉渣粉放入离心管中,以1∶20的料液比加蒸馏水,混合均匀。用缓冲溶液调节pH至7.0,超声25 min(35 ℃、400 W),添加1.24%混合酶(α-淀粉酶与糖化酶质量比1∶1),80 ℃酶解60 min,100 ℃水浴5 min灭酶,冷却至室温后,添加1%中性蛋白酶,60 ℃酶解60 min,100 ℃水浴5 min灭酶。离心得沉淀,冷冻干燥即得IDF。
1.3.1.2 SDF的制备
保留1.3.1.1中离心所得上清液,用4倍体积的95%乙醇溶液进行醇沉过夜。离心得沉淀,冷冻干燥即为SDF。
1.3.2 理化性质测定
膳食纤维理化性质参考文献[12-13]的研究方法略作修改,具体方法如下。
1.3.2.1 持水性
将0.5 g样品与25 mL蒸馏水混合1 h,将混合物于5 000 r/ min下离心10 min,除去上清液,称重沉淀物。持水性通过公式(1)计算:
持水性![]()
(1)
式中:m1,样品持水后质量,g;m2,样品的质量,g
1.3.2.2 持油性
将0.5 g样品和8 mL葵花籽油置于10 mL离心管中,搅拌均匀后,于5 000 r/ min下离心10 min。弃去上清液,称重残余物。通过公式(2)计算持油性:
持油性![]()
(2)
式中:m1,样品湿重,g;m2,样品干重,g
1.3.2.3 膨胀性
将样品0.3 g置于量筒中,记下样品初始体积。再加入5 mL蒸馏水,混合均匀后在室温下放置24 h,读取样品最终的体积。通过公式(3)计算膨胀性:
膨胀性![]()
(3)
式中:V1,样品最终的体积,mL;V2,样品初始的体积,mL;m,样品的质量,g
1.3.3 阳离子交换能力
准确称取0.50 g样品,加入15 mL 0.1 mol/L HCl溶液,充分搅拌,室温静置24 h,然后用滤纸过滤,用蒸馏水洗涤。将残渣加入含有100 mL 150 g/L NaCl溶液的锥形瓶中,不断搅拌。以蒸馏水为空白样品,用0.1 mol/L NaOH溶液滴定,记录消耗的NaOH溶液体积。按公式(4)计算阳离子交换容量[14]。
阳离子交换能力![]()
(4)
式中:V1,测定样品NaOH溶液的滴定体积,mL;V0,测定空白样品中NaOH溶液的滴定体积,mL;m,样品的干重,g
1.3.4 扫描电镜(scanning electron microscope,SEM)分析
将微量样品固定于导电胶带观察台上, 用离子溅射方法进行喷金处理, 以20.00 kV的加速电压于扫描电镜观察台上收集图像并置于扫描电子显微镜下观察,放大倍数为800倍。
1.3.5 傅里叶红外光谱(Fourier transform infrared,FTIR)分析
将干燥的粉末样品与KBr粉末(1∶100,体积比)混合,并压成颗粒用于光谱测量。
1.3.6 X射线衍射
使用X射线衍射仪分析蜜柑皮和蜜柑果肉膳食纤维的晶体结构。
1.3.7 单糖组成分析
称取0.01 g样品,加入2 mL 2 mol/L三氟乙酸,100 ℃水解8 h,挥干三氟乙酸,加1 mL甲醇冲洗,旋干甲醇后加入1 mL蒸馏水溶解。
1.3.7.1 样品溶液衍生化
准确吸取200 μL样品液,加入250 μL 0.5 mol/L PMP-甲醇溶液,300 μL 0.3 mol/L NaOH溶液,70 ℃反应1 h。冷水中冷却10 min,加入300 μL 0.3 moL/L HCl溶液进行中和,再加入1 mL氯仿,离心,取上清液,再加1 mL氯仿,重复萃取3次,保留最后一次上清液。
1.3.7.2 液相色谱条件
色谱柱:WONDASIL C18(4.6 mm×200 mm,5 μm), 柱温30 ℃;流速1 mL/min。检测波长250 nm;进样量20 μL;流动相:V[0.05 mol/L KH2PO4(pH 6.85)]∶V(乙腈)=82∶18。
1.3.8 甲基化分析
多糖的糖苷键构成采用甲基化衍生结合GC-MS分析的方法[15],称取1 mg样品,依次加入500 μL 二甲基亚砜和1 mg NaOH,反应30 min。加入碘甲烷溶液反应1 h。用超纯水终止反应,然后用2 mL二氯甲烷萃取后旋干。经过水解、还原后,加入20 mL乙酸终止反应。用250 μL甲醇清洗2次,氮气吹干。加入250 μL乙酸酐,100 ℃反应2.5 h,生成部分甲基化乙酰化糖醇衍生物。加入1 mL纯水和500 μL二氯甲烷,离心,取下层二氯甲烷相,重复萃取3次,上机检测。GC-MS条件如下,柱温箱的初始温度为140 ℃保持2.0 min,载气为He。进样量1 μL,分流比10∶1。质谱条件用电子轰击离子源(electron impact ion source,EI)进行分析,电子能量70 eV,质量扫描范围(m/z):30~600。
1.3.9 吸附性分析
1.3.9.1 胆固醇吸附
参考罗欢[16]的方法并适当修改。取鸡蛋黄加9倍体积的去离子水,搅拌混匀打成乳液。取1 g样品与50 mL稀释蛋黄液混合,分别调pH至2和7,37 ℃振荡3 h,4 000 r/min离心10 min。采用邻苯二甲醛法测定吸光值,按公式(5)计算胆固醇吸附量。
胆固醇吸附量![]()
(5)
式中:m1,吸附前胆固醇含量,mg;m2,吸附后胆固醇含量,mg;m,IDF和SDF质量,g。
1.3.9.2 亚硝酸盐吸附
参考杨开等[17]的方法并适当修改。1 g样品与100 mL的250 μmol/L NaNO2溶液混合,分别调节pH至2和7,37 ℃下磁力搅拌10 min,4 000 r/min离心5 min。取5 mL样品,加入2 mL 4 g/L的对氨基苯磺酸溶液,静置5 min,再加入1 mL 2 g/L的盐酸萘乙二胺,加水定容至25 mL。538 nm处测定吸光度,按公式(6)计算亚硝酸盐吸附量。
亚硝酸盐吸附量![]()
(6)
式中:m1,吸附前亚硝酸盐含量,μg;m2,吸附后亚硝酸盐含量,μg;m,IDF和SDF质量,g。
1.4 数据分析
所有实验做3个平行,计算平均值和标准偏差,数据以平均值±SD表示;使用Origin 20.0,SPSS 16.0等软件对数据进行绘图以及ANOVA差异性分析。
2 结果与分析
2.1 理化性质分析
持水性、持油性和膨胀性是衡量膳食纤维品质和生理功能的重要指标[18],持水性指膳食纤维受到外界压力时保留水分的能力。由表1可知,样品的持水性值为10.37~14.60 g/g,以蜜柑皮IDF(14.60 g/g)最佳,蜜柑果肉SDF(12.15 g/g)和蜜柑皮SDF(11.29 g/g)次之,蜜柑果肉IDF(10.37 g/g)最差,可能由于蜜柑皮含有一定的海绵层结构,从而使IDF有较好的持水性。持油性有助于提高膳食纤维对胆固醇的结合能力,对心脑血管疾病起到防治作用[4],蜜柑皮IDF(3.64 g/g)最好,蜜柑果肉IDF最差(3.01 g/g),且蜜柑皮和蜜柑果肉膳食纤维的持油性明显高于雷笋膳食纤维[17],这可能与其原材料不同有关。膨胀性上,4个样品的膨胀性为15.78~18.33 mL/g,其中蜜柑皮SDF>蜜柑果肉SDF>蜜柑皮IDF>蜜柑果肉IDF。膨胀性的差异与膳食纤维表面积和多孔性质有关[18],而高膨胀性的膳食纤维更有利于增加人体的饱腹感,其中蜜柑果肉IDF(15.78 mL/g)高于锦橙皮渣膳食纤维(4.46 mL/g)[4],这可能是因为超声的前处理比后处理更能使纤维内部结构松散,氢键断裂,空隙密度增大。
膳食纤维通过在肠道内进行阳离子交换,减少人体对Na+的吸收,改变消化道内离子浓度,从而起到降血压的作用[16]。从表1可知,4个样品的阳离子交换能力由大到小依次为:蜜柑果肉IDF>蜜柑皮IDF>蜜柑皮SDF>蜜柑果肉SDF,蜜柑果肉IDF交换能力高可能与其表面积和基团暴露程度有关。暴露的基团越多,越能缩短阳离子吸附时间,从而提供较好的消化吸收环境。
表1 蜜柑皮和蜜柑果肉膳食纤维的理化性质
Table 1 Physicochemical indexes of dietary fiber from
mandarin orange peel and pulp
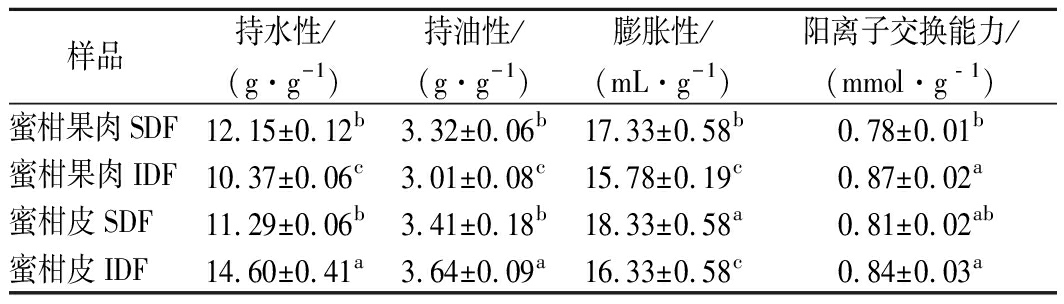
样品持水性/(g·g-1)持油性/(g·g-1)膨胀性/(mL·g-1)阳离子交换能力/(mmol·g﹣1)蜜柑果肉SDF12.15±0.12b3.32±0.06b17.33±0.58b0.78±0.01b蜜柑果肉IDF10.37±0.06c3.01±0.08c15.78±0.19c0.87±0.02a蜜柑皮SDF11.29±0.06b3.41±0.18b18.33±0.58a0.81±0.02ab蜜柑皮IDF14.60±0.41a3.64±0.09a16.33±0.58c0.84±0.03a
注:同列不同字母表示显著性差异(P<0.05)
2.2 扫描电镜分析
图1为蜜柑皮和蜜柑果肉膳食纤维在扫描电镜观测下的结构形态。蜜柑果肉SDF表面不光滑,条状和空隙相互交错,有凸起的颗粒;蜜柑果肉IDF表面光滑,呈现条状凸起和沟壑。蜜柑皮SDF表面空隙较大,但表面凹陷处夹杂着少量圆球形颗粒;蜜柑皮IDF表面疏松多孔,呈现珊瑚状态。综上所述,蜜柑果肉和蜜柑皮SDF的分子间有较强的相互作用,结构破坏程度小,呈现较为光滑的表面。而蜜柑果肉和蜜柑皮IDF的结构疏松,表面断裂,孔隙度高,这可能是因为超声处理对IDF的结构破坏力强[19],使膳食纤维表面积增大,从而表现出较好的持水力和持油力。

a-蜜柑果肉SDF;b-蜜柑果肉IDF;c-蜜柑皮SDF;d-蜜柑皮IDF
图1 蜜柑皮和蜜柑果肉膳食纤维扫描电镜图
Fig.1 The scanning electron microscopy of dietary fiber of mandarin orange peel and pulp
2.3 红外光谱分析
傅里叶变换红外光谱可以用来检测分子基团及化学键变化。由图2可知,3 300~3 600 cm-1处的吸收峰为纤维素和半纤维的O—H的伸缩振动带,由于分子间和分子内富含氢键,所以波段较宽。
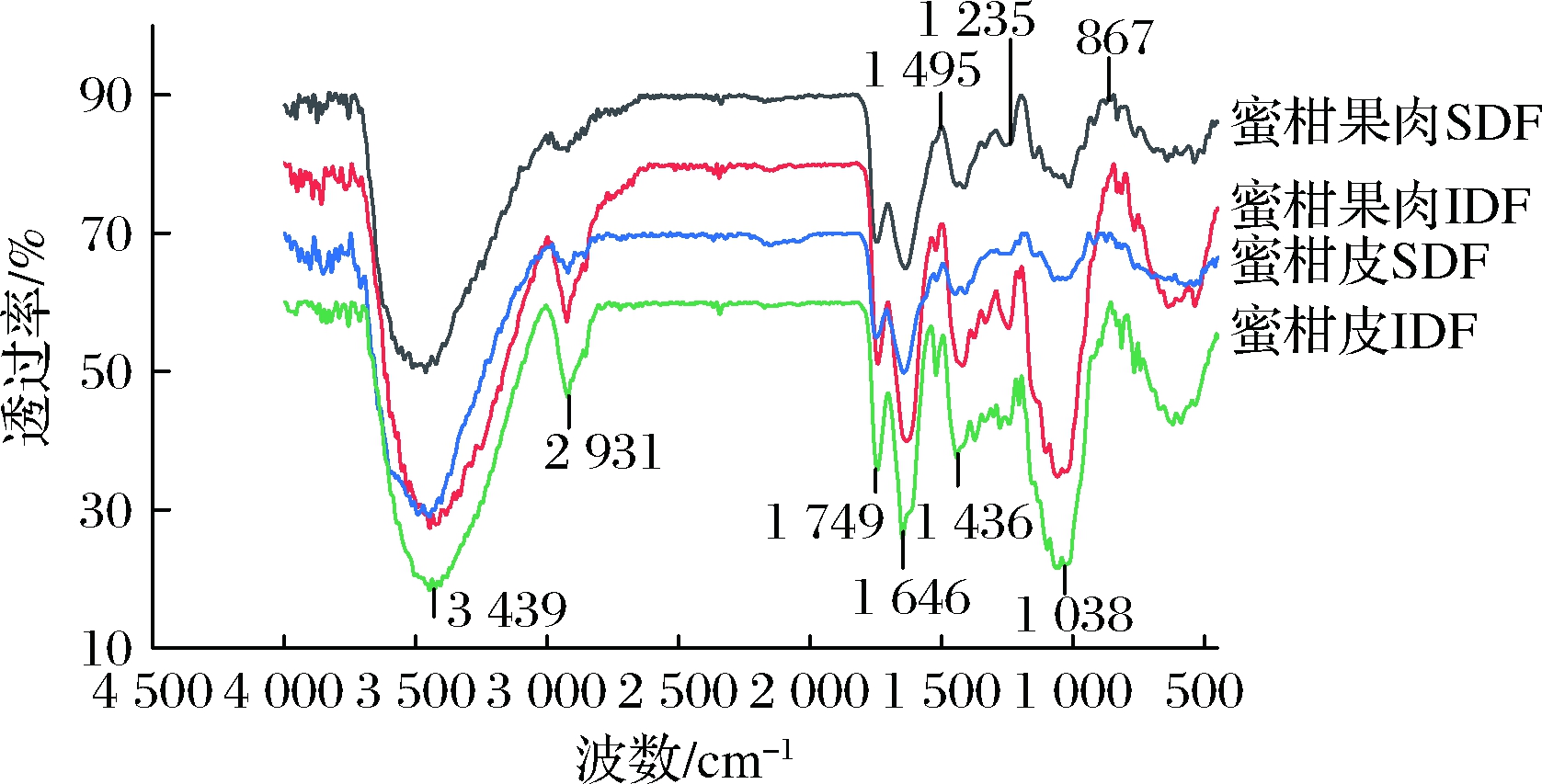
图2 蜜柑皮和蜜柑果肉膳食纤维红外光谱图
Fig.2 Fourier transform infrared spectroscopy analysis
of dietary fiber of mandarin orange peel and pulp
3 000~2 800 cm-1的小尖峰为多糖甲基和亚甲基C—H的伸缩振动峰,这是多糖类物质结构的典型特征[14],其中蜜柑皮和蜜柑果肉IDF的尖峰明显,可能含有较多的多糖类物质。在1 749 cm-1的吸收峰是半纤维素C![]() O的伸缩振动峰。1 646和1 436 cm-1附近的吸收峰包含羰基C
O的伸缩振动峰。1 646和1 436 cm-1附近的吸收峰包含羰基C![]() O和羧基COOH,其中COOH在IDF中含量高于SDF。可能在酶解提取SDF的过程中,纤维结构被一定程度的降解,致使特征吸收峰有所减弱[20]。1 235 cm-1处附近的吸收峰为木质素的特征性拉伸,其中蜜柑皮和蜜柑果肉IDF的峰值大于SDF,说明IDF含有较多的木质素。蜜柑皮和蜜柑果肉IDF在1 038 cm-1附近出现较强的吸收峰,主要是纤维素和半纤维素中C—O—C的C—O的伸缩振动,其中包含了阿拉伯糖的吸收区域。867 cm-1处是糖类的特征吸收峰,即β-糖苷键的伸缩振动峰,蜜柑皮和蜜柑果肉IDF的峰值较为明显。4个样品峰值强度的差异性可能与基团含量有关,且基团对膳食纤维的持水性、持油性、阳离子吸附等起着重要作用[21]。
O和羧基COOH,其中COOH在IDF中含量高于SDF。可能在酶解提取SDF的过程中,纤维结构被一定程度的降解,致使特征吸收峰有所减弱[20]。1 235 cm-1处附近的吸收峰为木质素的特征性拉伸,其中蜜柑皮和蜜柑果肉IDF的峰值大于SDF,说明IDF含有较多的木质素。蜜柑皮和蜜柑果肉IDF在1 038 cm-1附近出现较强的吸收峰,主要是纤维素和半纤维素中C—O—C的C—O的伸缩振动,其中包含了阿拉伯糖的吸收区域。867 cm-1处是糖类的特征吸收峰,即β-糖苷键的伸缩振动峰,蜜柑皮和蜜柑果肉IDF的峰值较为明显。4个样品峰值强度的差异性可能与基团含量有关,且基团对膳食纤维的持水性、持油性、阳离子吸附等起着重要作用[21]。
2.4 X射线衍射分析
膳食纤维分为有序结晶区和非晶区,特征尖锋衍射反映了结晶结构,弥散衍射反映着非晶体结构[17],晶体结构与纤维的持水性、持油性和膨胀性密切相关。由图3可知,除了蜜柑果肉SDF外,其他3个样品衍射峰的2θ角有3个,分别在12.38、15.35和21.52°左右,各样品之间的峰位置没有明显差异,只是衍射强度有所差异,表明4个样品均属于纤维素Ⅰ型的特征峰。2θ角在15.35°左右,蜜柑皮SDF和IDF的峰型较为尖锐,表明具有较高的结晶度,这是由于处于非结晶区的多糖类物质被水解去除,结晶区所占比例升高[6]。2θ角在21.52°附近为膳食纤维的主衍射峰,其中蜜柑果肉和蜜柑皮SDF主衍射峰峰形较宽,并无十分尖锐且明显的结晶峰。出现这种现象的原因可能与超声波对SDF结晶区纤维素的破坏性更强,使其峰值降低有关。经计算,蜜柑皮IDF、蜜柑皮SDF、蜜柑果肉IDF和蜜柑果肉SDF的结晶度分别为34%、21%、36%和18%。虽然超声辅助复酶法对蜜柑皮和蜜柑果肉SDF结晶区造成破坏,结晶度下降,但不会改变晶体结构。

图3 蜜柑皮和蜜柑果肉膳食纤维X射线衍射图
Fig.3 X-ray diffraction pattern of dietary fiber from
mandarin orange peel and pulp
2.5 单糖组成分析
蜜柑果肉和蜜柑皮中SDF、IDF单糖的组成和含量见表2。4个样品中共检测出8种单糖,其中葡萄糖含量最高。4个样品的单糖种类未发生变化,只是含量有明显的差异,这与之前的研究具有相似性[22]。蜜柑皮IDF中甘露糖(3.14 mg/g)、鼠李糖(10.15 mg/g)、半乳糖醛酸(1.63 mg/g)、半乳糖(14.99 mg/g)和木糖(1.42 mg/g)含量最高,显著高于其他3个样品。半乳糖醛酸、半乳糖和鼠李糖是果胶的典型成分,表明果胶是蜜柑皮中IDF的主要成分。蜜柑果肉和蜜柑皮的IDF的阿拉伯糖、鼠李糖、木糖、甘露糖等主要单糖含量明显高于SDF的糖含量,可能是由于IDF的成分化学键发生断裂,纤维素、半纤维素、天然蛋白等裂解成了小分子[23]。
表2 单糖标准品的标准曲线和蜜柑皮、蜜柑果肉膳食纤维中单糖含量 单位:mg/g
Table 2 Standard curve of monosaccharide standards and monosaccharide content in mandarin
orange peel and pulp dietary fiber
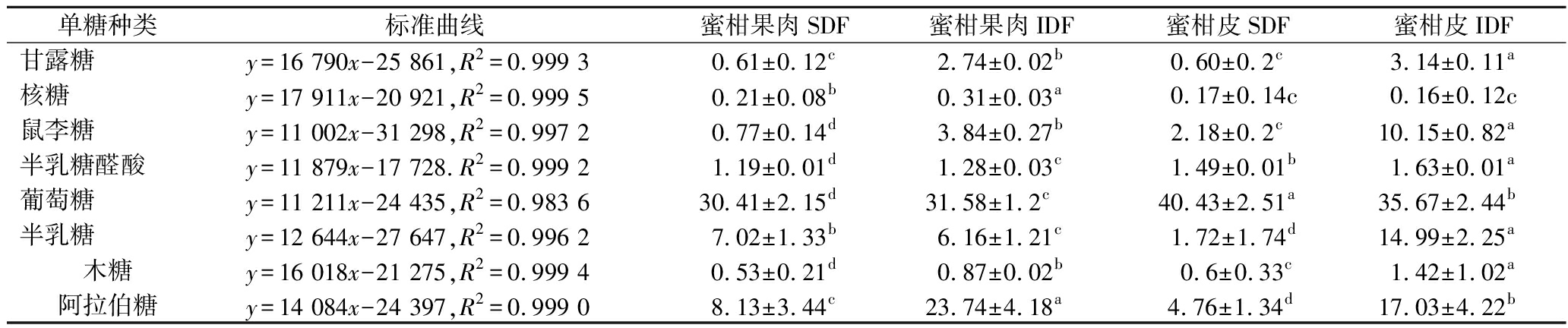
单糖种类标准曲线蜜柑果肉SDF蜜柑果肉IDF蜜柑皮SDF蜜柑皮IDF甘露糖y=16 790x-25 861,R2=0.999 30.61±0.12c2.74±0.02b0.60±0.2c3.14±0.11a核糖y=17 911x-20 921,R2=0.999 50.21±0.08b0.31±0.03a0.17±0.14c0.16±0.12c鼠李糖y=11 002x-31 298,R2=0.997 20.77±0.14d3.84±0.27b2.18±0.2c10.15±0.82a半乳糖醛酸y=11 879x-17 728.R2=0.999 21.19±0.01d1.28±0.03c1.49±0.01b1.63±0.01a葡萄糖y=11 211x-24 435,R2=0.983 630.41±2.15d31.58±1.2c40.43±2.51a35.67±2.44b半乳糖y=12 644x-27 647,R2=0.996 27.02±1.33b6.16±1.21c1.72±1.74d14.99±2.25a木糖y=16 018x-21 275,R2=0.999 40.53±0.21d0.87±0.02b0.6±0.33c1.42±1.02a阿拉伯糖y=14 084x-24 397,R2=0.999 08.13±3.44c23.74±4.18a4.76±1.34d17.03±4.22b
注:同行不同字母表示显著性差异(P<0.05)
2.6 甲基化分析
4个样品甲基化后经过酸水解、乙酰化处理得到部分甲基化糖醇乙酰化产物(partially methylated alditol acetates, PMAA),经过GC-MS分析获得蜜柑皮和果肉膳食纤维的链接构型和物质的量比如电子版增强附表1~4所示(https://doi.org/10.13995/j.cnki.11-1802/ts.028715)。蜜柑果肉SDF的PMAA产物中主要有1,5-二-O-乙酰基-2,3,4,6-四-O-甲基葡萄糖醇,1,4-二-O-乙酰基-2,3,5-三-O-甲基阿拉伯糖醇和1,3,5,6-双二O-乙酰基-2,4,6-二-O-甲基半乳糖醇。蜜柑果肉IDF的半乳糖和鼠李糖主要的中性糖组分,其中1,4,5-三-O-乙酰基-2,3,6-三-甲基半乳糖醇和1,5-二-O-乙酰基-2,3,4-三-甲基鼠李糖醇为主,物质的量分数分别是8.74%和7.13%。蜜柑皮SDF的PMAA产物中主要为1,5-二-O-乙酰基-2,3,4,6-四-O-甲基葡萄糖醇,相对物质的量分数达到80.13%。蜜柑皮IDF的PMAA产物中鼠李糖醇相对其他样品含量较高,主要是1,5-二-O-乙酰基-6-脱氧-2,3,4-三-O-甲基鼠李糖醇,物质的量分数达到8.70%。Xyl残基在所有样品糖链中的比例较低,主要以1,5方式连接。实验对蜜柑皮和果肉膳食纤维链状结构主要成分进行了初步确定,通过计算得到的4个样品不同糖残基比例与其的单糖组成分析结果(表2)相近。由此可知,蜜柑果肉和果皮膳食纤维主要由(→1)连接的鼠李糖、(→1)及(1→5)连接的阿拉伯糖、(→1)、(1→6)及(1→4)连接的葡萄糖、(1→3,6)及(1→4)连接的半乳糖、(1→4)及(1→2)连接的甘露糖构成。
2.7 吸附性分析
2.7.1 胆固醇吸附能力测定
胆固醇的代谢与心脑血管疾病的发病率有很大的关系[16],而膳食纤维通过与食物结合吸附,减少人体对胆固醇和甘油三酯的消化吸收,从而将吸附的胆固醇和油脂排出体外。图4可知,蜜柑果肉和蜜柑皮SDF在模拟胃肠环境中的吸附性很高,可能是因为可溶性多糖能降低胆固醇溶解度,从而抑制肠道对胆固醇的吸收[24]。蜜柑皮和蜜柑果肉膳食纤维对胆固醇的吸附能力受pH值环境影响较大,中性环境下4个样品对胆固醇的吸附能力均高于酸性条件,这也表明在肠道内环境(pH 7)比在胃内环境(pH 2)对胆固醇的吸收能力更强。
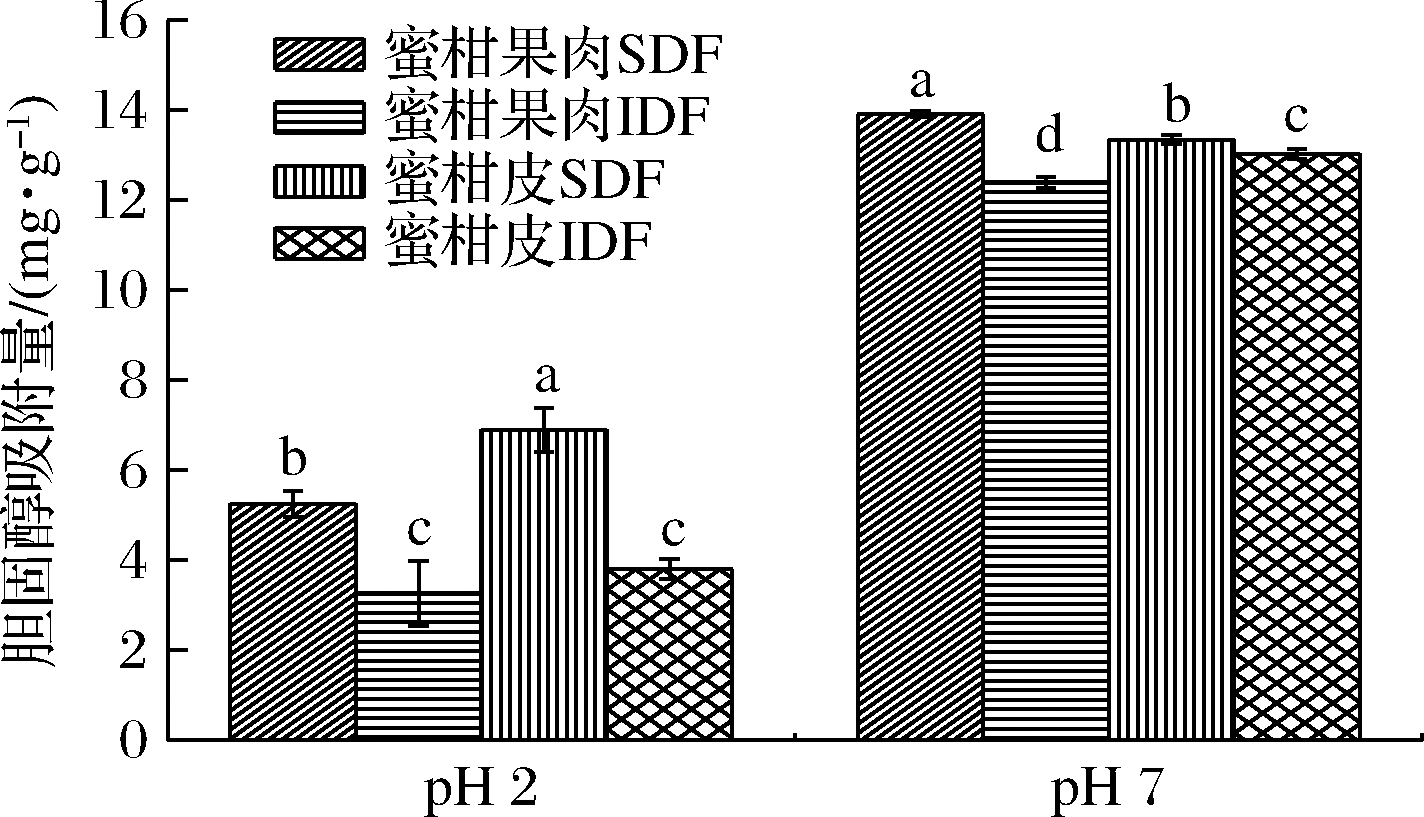
图4 蜜柑皮和果肉膳食纤维的胆固醇吸附能力
Fig.4 Cholesterol adsorption capacity of dietary fiber
from mandarin orange peel and pulp
2.7.2 亚硝酸盐吸附能力测定
亚硝酸盐作为一种肉制品保护色剂,会与仲胺、叔胺等物质发生反应,生成强致癌物——亚硝胺[25],膳食纤维能够有效减少亚硝酸盐在胃、肠中的分解,从而降低癌症的几率。由图5可知,在模拟胃环境(pH 2)下,4个样品对亚硝酸盐具有较强的吸附能力,随着pH值的升高,富含糖醛酸、阿魏酸等羧基化合物会发生解离,使膳食纤维表面的负电荷密度增大,排斥较多的NO2-,从而导致样品在模拟肠道环境(pH 7)下对亚硝酸盐吸附量减少[17]。其中蜜柑果肉和蜜柑皮IDF在模拟肠环境下的吸附性高于SDF,这可能与IDF表面的负电荷密度有关。蜜柑皮和蜜柑渣膳食纤维对NO2-的吸附能力均强于玉木耳根中的膳食纤维[26], 且酸性条件下对NO2-的吸附能力显著高于中性条件,这是因为NO2-与H+结合生成HNO2,形成了较多的氮氧化合物[27],这与之前研究具有一致性。

图5 蜜柑皮和果肉膳食纤维的亚硝酸盐吸附能力
Fig.5 Nitrate adsorption capacity of dietary fiber from
mandarin orange peel and pulp
3 结论
本研究采用超声辅助复酶法分别提取温州蜜柑皮和蜜柑果肉的膳食纤维,并对比分析膳食纤维理化性质、功能和结构的差异。4种膳食纤维单糖中以葡萄糖和阿拉伯糖含量最高,蜜柑皮中单糖含量明显高于蜜柑果肉,因此可以推断出果胶是蜜柑皮的主要成分;蜜柑皮IDF的持水性和持油性都显著高于其他3种样品,而蜜柑皮SDF的膨胀性最高为18.33 mL/g。4种膳食纤维都有较好的吸附能力,在酸性条件下,蜜柑皮和蜜柑果肉SDF对胆固醇和亚硝酸盐的吸附能力强;在中性条件下IDF对亚硝酸盐的吸附能力较强。此外,蜜柑果肉和蜜柑皮IDF的空隙更大,表面疏松,蜜柑果肉和蜜柑皮SDF表面较光滑。红外光谱和X射线衍射对膳食纤维结构分析显示,4种膳食纤维具有糖类物质典型的特征峰。综上所述,温州蜜柑皮和蜜柑果肉膳食纤维都具有较好的生理活性,其中蜜柑皮IDF具有较好的理化和功能性质,可作为一种吸附材料和食品添加剂,对温州蜜柑副产物的附加值利用提供新方向。
[1] 成传香, 王鹏旭, 贾蒙, 等.三个中国主栽宽皮柑橘品种制汁品质评价[J].食品与发酵工业, 2019, 45(24):173-178.
CHENG C X, WANG P X, JIA M, et al.Evaluation of juice-making quality of three main Chinese Mandarin (Citrus reticulate) varieties[J].Food and Fermentation Industries, 2019, 45(24):173-178.
[2] 沈勇根, 朱凤妮, 卢剑青, 等.宽皮柑橘品质特性及加工适性研究进展[J].江西农业大学学报, 2017, 39(4):669-677.
SHEN Y G, ZHU F N, LU J Q, et al.Advances in research on quality characters and processing eligibility of Citrus reticulata[J].Acta Agriculturae Universitatis Jiangxiensis, 2017, 39(4):669-677.
[3] 何李, 李绍振, 高彦祥, 等.柑橘属果皮渣制备膳食纤维的研究进展[J].食品科学, 2012, 33(7):310-314.
HE L, LI S Z, GAO Y X, et al.Dietary fiber from Citrus pomace:A review[J].Food Science, 2012, 33(7):310-314.
[4] 易甜, 崔文文, 王明锐, 等.锦橙皮渣膳食纤维微粉化及其功能特性分析[J].食品科学, 2019, 40(10):8-14.
YI T, CUI W W, WANG M R, et al.Functional and structural properties of micronized dietary fiber powder extracted from peel and pomace of Jincheng sweet oranges(Citrus sinensis(L.) osbeck cv.Jincheng)[J].Food Science, 2019, 40(10):8-14.
[5] LUNDBERG B, PAN X J, WHITE A, et al.Rheology and composition of citrus fiber[J].Journal of Food Engineering, 2014, 125:97-104.
[6] 孙海燕. 柑橘类膳食纤维的制备及其性能研究[J].食品工业科技,2016,37(4):318-321;329.
SUN H Y.Preparation and performance characterization of citrus dietary fiber [J].Science and Technology of Food Industry, 2016, 37(4):318-321;329.
[7] MAKKI K, DEEHAN E C, WALTER J, et al.The impact of dietary fiber on gut microbiota in host health and disease [J].Cell Host & Microbe, 2018, 23(6):705-715.
[8] FERN NDEZ-GINÉS J M, FERN
NDEZ-GINÉS J M, FERN NDEZ-L
NDEZ-L PEZ J, SAYAS-BARBER
PEZ J, SAYAS-BARBER E, et al.Lemon albedo as a new source of dietary fiber:Application to bologna sausages[J].Meat Science, 2004, 67(1):7-13.
E, et al.Lemon albedo as a new source of dietary fiber:Application to bologna sausages[J].Meat Science, 2004, 67(1):7-13.
[9] MUDGIL D, BARAK S.Composition, properties and health benefits of indigestible carbohydrate polymers as dietary fiber:A review[J].International Journal of Biological Macromolecules, 2013, 61:1-6.
[10] MAR N F R, SOLER-RIVAS C, BENAVENTE-GARC
N F R, SOLER-RIVAS C, BENAVENTE-GARC A O, et al.By-products from different citrus processes as a source of customized functional fibres[J].Food Chemistry, 2007, 100(2):736-741.
A O, et al.By-products from different citrus processes as a source of customized functional fibres[J].Food Chemistry, 2007, 100(2):736-741.
[11] L PEZ-MARCOS M C, BAILINA C, VIUDA-MARTOS M, et al.Properties of dietary fibers from agroindustrial coproducts as source for fiber-enriched foods[J].Food and Bioprocess Technology, 2015, 8(12):2 400-2 408.
PEZ-MARCOS M C, BAILINA C, VIUDA-MARTOS M, et al.Properties of dietary fibers from agroindustrial coproducts as source for fiber-enriched foods[J].Food and Bioprocess Technology, 2015, 8(12):2 400-2 408.
[12] LI B, YANG W, NIE Y Y, et al.Effect of steam explosion on dietary fiber, polysaccharide, protein and physicochemical properties of okara[J].Food Hydrocolloids, 2019, 94:48-56.
[13] ROBERTSON J A, DE MONREDON F D, DYSSELER P, et al.Hydration properties of dietary fibre and resistant starch:A European collaborative study[J].LWT - Food Science and Technology, 2000, 33(2):72-79.
[14] 万仁口, 李功景, 贺杨正, 等.竹笋膳食纤维的结构特性及其功能性质[J].中国食品学报, 2021, 21(5):75-82.
WAN R K, LI G J, HE Y Z, et al.Structural and functional properties of dietary fiber from bamboo shoots[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):75-82.
[15] 何坤明, 王国锭, 白新鹏, 等.山茱萸籽多糖分离纯化、结构表征及抗氧化活性[J].食品科学, 2021, 42(19):81-88.
HE K M, WANG G D, BAI X P, et al.Isolation, purification, structure characterization and antioxidant activity of Cornus officinalis seed polysaccharides[J].Food Science, 2021, 42(19):81-88.
[16] 罗欢. 木瓜渣膳食纤维的分离提取及理化性质研究[D].重庆:西南大学, 2010.
LUO H.Studies on extraction and physicochemical properties of dietary fiber from Chaenomeles sinensis (touin) koehn residue[D].Chongqing:Southwest University, 2010.
[17] 杨开,杨振寰, 吴伟杰, 等.雷笋膳食纤维酶法改性及其理化性能和结构变化[J].食品与发酵工业, 2019, 45(4):36-41.
YANG K, YANG Z H, WU W J, et al.Physicochemical properties and structural changes of bamboo shoots dietary fiber with enzymatic modification[J].Food and Fermentation Industries, 2019, 45(4):36-41.
[18] 梁文康,苏平, 魏丹.复合酶法提取黄秋葵可溶性膳食纤维的工艺优化及其理化特性、结构表征[J].食品工业科技, 2020, 41(17):199-205;218.
LIANG W K, SU P, WEI D.Optimization techniques for the extraction of soluble dietary fiber from okra with complex enzymes and its physicochemical properties and structure characterization [J].Science and Technology of Food Industry, 2020, 41(17):199-205;218.
[19] 潘利华,徐学玲, 罗建平.超声辅助提取水不溶性大豆膳食纤维及其物理特性[J].农业工程学报, 2011, 27(9):387-392.
PAN L H, XU X L, LUO J P.Ultrasound-assisted extraction of insoluble dietary fiber from soybean and its physical properties[J].Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(9):387-392.
[21] ZHAO X Y, CHEN J, CHEN F L, et al.Surface characterization of corn stalk superfine powder studied by FTIR and XRD[J].Colloids and Surfaces B:Biointerfaces, 2013, 104:207-212.
[20] SU Y, LI L.Structural characterization and antioxidant activity of polysaccharide from four auriculariales[J].Carbohydrate Polymers, 2020, 229:115407.
[22] 胡筱,潘浪, 朱平平, 等.超声波改性对葵花粕膳食纤维性质与结构的影响[J].中国食品学报, 2019, 19(11):88-99.
HU X, PAN L, ZHU P P, et al.Effects of ultrasonic modification on the properties and structure of dietary fiber in sunflower meal[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(11):88-99.
[23] WANG L, LIU H M, XIE A J, et al.Dietary fiber extraction from defatted corn hull by hot-compressed water[J].Polish Journal of Food and Nutrition Sciences, 2018, 68(2):133-140.
[24] GALLAHER C M, MUNION J, HESSLINK R, et al.Cholesterol reduction by glucomannan and chitosan is mediated by changes in cholesterol absorption and bile acid and fat excretion in rats[J].The Journal of Nutrition, 2000, 130(11):2 753-2 759.
[25] VELMURUGAN S, PALANISAMY S, YANG T C K.Single-crystalline SnS2 nano-hexagons based non-enzymatic electrochemical sensor for detection of carcinogenic nitrite in food samples[J].Sensors and Actuators B:Chemical, 2020, 316:128106.
[26] 司风玲,刘小裕, 邓俊林.玉木耳根膳食纤维提取工艺优化及理化性质测定[J].食品与发酵工业, 2019, 45(20):209-214.
SI F L, LIU X Y, DENG J L.Optimization of extraction process and physicochemical properties of dietary fiber from Auricularia cornea var.Li Root[J].Food and Fermentation Industries, 2019, 45(20):209-214.
[27] 丁莎莎.油橄榄果渣膳食纤维的制备、特性及改性研究[D].北京:中国林业科学研究院, 2017.
DING S S.Preparation, properties and modification of dietary fiber from olive pomace[D].Beijing:Chinese Academy of Forestry, 2017.