番茄红素,一种四萜类化合物,被广泛应用于保健品、医药等行业,因其卓越的抗氧化性被熟知。临床研究证明,番茄红素在预防心血管疾病、前列腺癌、乳腺癌等方面都有显著功效[1],可以降低心肌梗塞的风险,降低血压,并防止低密度脂蛋白胆固醇的氧化[2]。一般来说,番茄红素不能由人体自身合成,只能从外界获取,因此具有极高的商业价值。过去番茄红素的生产方式多为植物提取,近些年来环保高产的微生物发酵法逐渐成为主流。微生物发酵不仅可以解决植物种植占用大量土地的问题,还可以解决化学合成不环保的弊端,更重要的是,发酵产生的番茄红素是天然产物,其异构性和活性与从自然界中提取的活性成分一致[3],因此,番茄红素生产的前景广阔。
常用于番茄红素生产的细胞工厂有大肠杆菌、谷氨酸棒状杆菌、酿酒酵母、解脂亚洛酵母等。大肠杆菌由于其生长快、培养条件简单、基因操作工具成熟等优点,是最早开发的番茄红素生产底盘细胞。重组大肠杆菌通过引入番茄红素合成途径和发酵条件优化,生产出2.7 g/L番茄红素,是迄今为止使用基因工程大肠杆菌报告的番茄红素产量最高水平[4]。然而仍然存在一些争议,大肠杆菌在发酵过程中释放一些内毒素,从而引起食品安全问题,与其相对的,酵母因其较高的食品安全性脱颖而出,经过代谢改造,番茄红素在解脂亚洛酵母中可以积累到175 mg/g DCW[5]。LI等[6]研究表明,甲羟戊酸(mevalonate,MVA)途径的代谢产物,包括番茄红素在菌体中的积累会抑制菌体生长,脂质体(lipid droplets,LDs)的积累可以缓解产物毒性,同时由于番茄红素的结构易溶于脂,增大LDs含量有利于提高其在胞内的积累。三酰甘油(triacylglycerol,TAG)是在真核细胞中含量最高的储能物质,在脂肪酸消耗期间可保证膜脂的供给,且其毒性相对游离脂肪酸较低[7],这给胞内脂肪酸提供了储存方式。增加胞内脂质含量有多种方法,如过表达脂肪酸(fatty acid,FA)及TAG合成途径相关基因[8-9],酿酒酵母自身存在MVA途径、丙烷脱氢(propane dehydrogenation,PDH)途径与TAG途径(图1),分别是番茄红素合成的前体代谢途径、乙酰辅酶A(coenzyme A,CoA)胞内合成途经与三酰甘油TAG合成的途径。TAG途径以乙酰CoA为前体物质,经由限速酶Acc1羧化生成丙二酰辅酶A,进而转化生成脂肪酰辅酶A,进一步转化为磷脂酸(phosphatidic acid,PA),由关键酶Pap1催化生成甘油二酯(diacylglycerol,DAG),最后由Dga1进一步酰化生成TAG。三酰甘油是酿酒酵母中LDs的主要组成成分,Ldp1会附着于脂滴表面,显著增大脂滴的体积。乙酰辅酶A供应和产物形成途径中能量耦合和氧化还原辅因子平衡的整体分析对于高效细胞工厂的设计至关重要[10]。陈符江等[11]异源表达来自肠道沙门氏菌的胞质乙酰辅酶A合成酶acs1,并设计L641P氨基酸取代来防止乙酰化,从而解除了Acs1受到乙酰辅酶A乙酰化赖氨酸残基的抑制,这些修饰显着增加了线粒体外Acs1的活性,胞内乙酰辅酶A含量提高了2.19倍。此外,CHEN等[12]通过敲除ypl062w位点,使胞内的乙酰辅酶A增加了1倍。TRIKKA等[13]在酿酒酵母中敲除了exg1位点,将类胡萝卜素的产量提高了接近8倍。聚腺苷酸聚合酶(Pap1)催化向几乎所有mRNA添加poly(A)尾的反应[14],MEINKE等证明,poly(A)尾的添加促进了mRNA从核转运至胞质的过程,结合于poly(A)尾的蛋白质与mRNA 5′端之间的相互作用可提高翻译效率。

注:Acs1-醋酸盐-辅酶A连接酶1;Acc1-乙酰辅酶A羧化酶;
Pah1-磷脂酸磷酸酶;Dga1-二酰基甘油O-酰基转移酶;
Ldp1-脂质体定位蛋白; CrtE-香叶基香叶基二磷酸合酶;
CrtB-八氢番茄红素合酶; CrtI-八氢番茄红素去饱和酶
图1 酿酒酵母胞质中胞质乙酰辅酶A合成途径、
番茄红素合成途径及脂质代谢途径
Fig.1 Metabolic pathway of lycopene,acetyl coenzyme
A and lipids in S. cerevisiae
本文以酿酒酵母YPH499为底盘细胞,过量表达关键基因dga1、pah1[15],以及与脂滴形成关联紧密的ldp1基因[16]。TAG途径与MVA途径均主要发生在细胞质中,而该途径的前体乙酰辅酶A主要存在于线粒体中,这就导致前体供应成为一个亟待解决的问题。本文将来自三孢布拉霉的acs1基因敲入酿酒酵母内,这是一个定位于胞质内的丙酮酸脱氢酶,研究表明敲入该基因可使胞质乙酰CoA的含量增加50%以上[10];同时敲除ypl062w位点,该位点的缺失可提高所有萜类的产量[12]。本文中涉及到多个基因过表达,在较高的转录需求下,强化pap1基因(多核苷酸腺苷酸转移酶)表达是必要的,这一点在后续的实验结果中也得到了证实。选取本实验室的YthmgⅠ为出发菌株,该菌株在YPH499的基础上敲除了gal80,同时过表达了thmg1基因。经过代谢改造,番茄红素在重组菌内的单位产量显著提高。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
本文使用的所有菌株详见表2,质粒见表3,引物详见表4。
1.1.2 培养基
本实验培养大肠杆菌所用培养基为LB(Luria-Bertani)培养基(g/L):酵母粉5,蛋白胨10,NaCl 10;培养酿酒酵母所用培养基为DYPD(g/L):酵母粉20,蛋白胨40,葡萄糖20;诱导ura3抗性标记丢失所用培养基为5-FOA-YNB(yeast nitrogen base):体积分数1%的五氟乳清酸母液,体积分数1%的氨基酸补足母液,葡萄糖20 g/L,酵母氮源基础培养基7 g/L;固体培养基另添加18 g/L琼脂粉。
1.1.3 母液配制
五氟乳清酸溶液:取1 g五氟乳清酸固体粉末于50 mL EP管内,加入10 mL二甲基亚砜于55 ℃隔水融化,过膜分装,于-20 ℃避光保存;
氨基酸补足母液(μg/mL):亮氨酸100,赖氨酸100,色氨酸80,尿嘧啶30,组氨酸30;
抗生素母液:氨苄青霉素、卡那霉素、硫酸诺尔斯菌素、潮霉素母液浓度分别按照100、100、100、500 mg/mL配制,添加于培养基时均按照0.1%的体积比。
1.1.4 酶与试剂盒
本实验所用酶与试剂盒见表1。菌株、质粒和引物见表2~表4。
表1 工具酶与试剂盒
Table 1 Tool enzymes and kits

工具酶/试剂盒来源2×Taq PCR Master Mix杭州宝赛公司Phanta® Max Super-Fidelity DNA poly-merase南京诺唯赞生物科技有限公司Fast DigestedTMThermoFisher ScientificT4 DNA LigaseTaKaRaSolution 1ThermoFisher ScientificFastPure Plasmid Mini Kit南京诺唯赞生物科技有限公司FastPure® Gel DNA Extraction Mini Kit南京诺唯赞生物科`技有限公司
表2 菌株
Table 2 Strains

菌株基因型来源YPH499MATa, his3-Δ200, leu2-Δ1, trp1-Δ63, ura3-52, lys2-801, ade2-101本实验室YthmgⅠas YPH499; Δgal80∷loxp;Δadh5∷GAL1pr-thmg1-CYC1ter; Δyjl064w∷CYC1ter-crtI-GAL1,10pr-crtB-ADH1terΔrox1∷CYC1ter-crtI-GAL1,10pr-crtE-ADH1ter本实验室LFD5as YthmgⅠ;Δgal10∷ldp1本研究LFD6as YthmgⅠ;Δgal10∷non-marker本研究LFD7as YthmgⅠ;Δgal7∷pap1本研究LFD8as YthmgⅠ;Δgal7∷non-marker本研究LFD9as YthmgⅠ;Δexg1∷GAL1,10pr-pah1-ADH1ter本研究LFD10as YthmgⅠ;Δexg1∷GAL1,10pr-pah1,dga1-ADH1ter本研究LFD11as YthmgⅠ;Δexg1∷non-marker本研究LFD12as YthmgⅠ;Δgal10∷ldp1;Δexg1∷GAL1,10pr-pah1,dga1-ADH1ter本研究LFD13as YthmgⅠ;Δgal1∷acc1本研究LFD14as YthmgⅠ;Δgal1∷non-marker本研究LFD15as LFD12;Δypl062w∷GAL1, 10pr-acs1L641P-ADH1ter本研究LFD16as LFD12;Δypl062w∷non-marker本研究LFD17as LFD12;Δgal7∷pap1本研究LFD18as LFD15;Δgal7∷pap1本研究
表3 质粒
Table 3 Plasmids
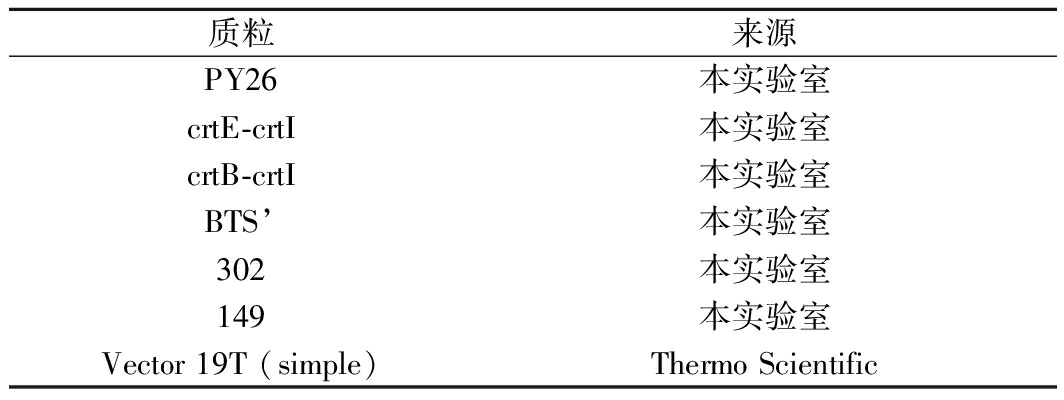
质粒来源PY26本实验室crtE-crtI本实验室crtB-crtI本实验室BTS’本实验室302本实验室149本实验室Vector 19T (simple)Thermo Scientific
1.2 实验方法
1.2.1 重组菌表达盒的构建
本实验选取来自三孢布拉霉(Blakeslea trispora)的acs1L641P,来自产脂酵母(Rhodosporidium toruloides)的ldp1以及来自酿酒酵母YPH499的pah1、dga1、pap1。前二者经密码子优化后送由上海生工公司合成,后者以YPH499基因组为模板进行PCR扩增。
以GAL1,10pr-acs1L641P-ADH1ter表达盒构建为例:(1)提取YPH499基因组,以其为模板PCR扩增得到GAL1、10pr、ADH1ter以及靶点ypl062w连带其左右同源臂;(2)通过融合延伸PCR将GAL1、10pr、acs1L641P、ADH1ter连接在一起,而后利用TA连接的方法将上述融合片段连接19T(simple)载体,菌落PCR验证;(3)利用TA连接将靶点ypl062w连带其左右同源臂连接载体Vector 19T(simple),反向PCR扩增连带左右同源臂的载体片段;(4)挑取步骤(2)验证正确的菌落接入液体培养基,于37 ℃,200 r/min过夜培养后提取质粒并酶切纯化得到目的片段,将该片段与步骤(3)扩增出的载体过夜连接后转化大肠杆菌JM109,菌落PCR验证。
以同样方法构建其他表达盒。
1.2.2 Sg质粒的构建
利用网站E-Crisp设计sgRNA并将其设计入引物中(表4),以实验室保藏质粒302、149为模板分别扩增出启动子与发卡结构的对应片段,然后重叠延伸PCR将两片段融合,酶切后连接BTS’质粒。
表4 引物
Table 4 Primers

引物名称序列(5’-3’)用作菌株验证YZ-G1-FATGAAGAGGAAAAATTGGCAGTAACCTGYZ-G1-RACGCAGCGGTTGAAAGCYZ-ACC-RAATAGTGGATTCTCGGAGGCGYZ-G7-FATACTTCGGAGCACTGTTGAGYZ-G7-RTGGAAAGGACCACTCTTACATAACTAGYZ-PAP-RACTTGAGGTTGGTCTAGACGTGYZ-G10-FAGAGTCTTCCGTCGGAGGYZ-G10-RATTCTTGTTGCTACCGTCCATATCYZ-LDP-RATCTTGCAAAGATGACAAATGAGCYZ-EXG-FTGCAGACGTTTTAAATACTCCCTCCYZ-EXG-RAGAGATAATGAACTAAAAGGGGTAGATA-AATTAACGYZ-DGA-RAGTCCTGGGTAAAATGCAACTATGGYZ-PAH-FAGACGATATGGATGATGAAGACTCC
续表4

引物名称序列(5’-3’)用作基因座敲除Q-Gal7GAGCATCAACATGATAAAAAAAAACAGTTGAATATTCCCTCAAAAAAAGAAAGTGGAATATTCATTCATATCATATTTTTTCTATTAACTQ-Gal10CGTCCATCCAAAAAAAAAGTAAGAATTTTTGAAAATTCAATATAATTTGCCAGCTTACTATCCTTCTTGAAAATATGCACTCTATATCTTQ-FLD1GTGAATCCAAGGTTTCAAGAAAATAAGATAAAGTGAATAGGAAGGTAGAATTGTACTTCTCGCTATATAATTTTAAAACCTAGCTGTTATQ-EXGACTAAAGTTTACGAGAGGACCCAAAAGTTTTGAATAACACGTGCCGTCGCCCTCAGTCCGCTCATTTTAGCTGAATTTTCTAATGTTATTQ-Gal1AAATTGTTAATATACCTCTATACTTTAACGTCAAGGAGAAAAAACCTACTCATAACTTTAGCATCACAAAATACGCAATAATAACGAGTA用作构建敲除质粒471-FAAGGAGGGTATTCTGGGCCTCCATGTC471-RTCTGCAGAATTCGTCGACGAGCTCGGTAC699-FATGTACGGGCGACAGTCAC699-RAGTGAGCTGATACCGCTCGG1-149FGATTCAATATCGCCGTTCCAGTTTTAGAGCTAGAAATAGCAAGG1-302RTGGAACGGCGATATTGAATCGATCATTTATCTTTCACTGCGGAGG7-149FGCCTCCTGTTGACCTAACCAGTTTTAGAGCTAGAAATAGCAAGG7-302RTGGTTAGGTCAACAGGAGGCGATCATTTATCTTTCACTGCGGAGG10-149FGTAGGCCTCTAGGTATTGCAGTTTTAGAGCTAGAAATAGCAAGG10-302RTGCAATACCTAGAGGCCTACGATCATTTATCTTTCACTGCGGAGEXG-149FGGTCTAGGTAAGATTCCTGTGTTTTAGAGCTAGAAATAGCAAGEXG-302RACAGGAATCTTACCTAGACCGATCATTTATCTTTCACTGCGGAG用作构建表达盒ACC-FATGAGCGAAGAAAGCTTATTCGAGACC-RTTATTTCAAAGTCTTCAACAATTTTTCTTTATCATCGGTAGG1-RTACTCGTTATTATTGCGTATTTTGTGATGCTAAAGTTATGAGTAGTTATTTCAAAGTCTTCAACAATTTTTCTTTATCATCGGPAP-FAACAGTTGAATATTCCCTCAAAAATGAGCTCTCAAAAGGTTTTTGGTATTACPAP-RTATGAATGAATATTCCACTTTCTTTTTAGTTTACGTCAACAGCTGCGGG7-FAGAGCATCAACATGATAAAAAAAAACAGTTGAATATTCCCTCAAAAATGAGG7-RAGGCAGTTAATAGAAAAAATATGATATGAATGAATATTCCACTTTCTTTTTAGTTTACGLDP-FCGTCCATCCAAAAAAAAAGTAAGAATTTTTGAAAATTCAATATAAATGGCTACTGTTAATGAAAAACAACCLDP-RAAGATATAGAGTGCATATTTTCAAGAAGGATAGTAAGCTGGCAAATCATTGTTTTTCACCTTCACCTTCEXG-FFTAAAACGACGGCCAGTGAATTCACCGCAGTGTGAAGCACEXG-FRGATCCCCGGGTACCGAGCTCATCCACGCCTTTTTATTTAAAGTGCEXG-RFCTAGAGTCGACCTGCAGGCATGCATTAGTTTCCTTTTTACCTCATTGCACEXG-RRTGACCATGATTACGCCAAGCTTACAACAGCGGTGAGAATTGADH-3-LFCTCGAGACTAAAGTTTACGAGAGGACCCAAAAGTTTTGAATAACACGTGCCGCTATTACGCCAGCTGAATTGGAL-LFCTCGAGACTAAAGTTTACGAGAGGACCCAAAAGTTTTGAATAACACGTGCCTTTCAAAAATTCTTACTTTTTTTTTGGATGADH-3-LFCTCGAGTTGATTTTTTGTTTACTTTCTTTTTCTAGTTAATTACCAACTAAAGCTATTACGCCAGCTGAATTGADH-5AATTCTTCGCCAGAGGTTTGGDGA-FAAACCTCTGGCGAAGAATTTTACCCAACTATCTTCAATTCTGCATCDGA-RAAGTAAGAATTTTTGAAAATGTCAGGAACATTCAATGATATAAGAAGAAGGAL-FTTTCAAAAATTCTTACTTTTTTTTTGGATGGAL-R-RCTCGAGAATAACATTAGAAAATTCAGCTAAAATGAGCGGACTGAGGGCGACGTTTTTTCTCCTTGACGTTAAAGGAL-L-FCTCGAGTTGATTTTTTGTTTACTTTCTTTTTCTAGTTAATTACCAACTAAATTTCAAAAATTCTTACTTTTTTTTTGGATGGAL-RGTTTTTTCTCCTTGACGTTAAAGPAH-FCTTTAACGTCAAGGAGAAAAAACATGCAGTACGTAGGCAGAGPAH-RGACCAAACCTCTGGCGAAGAATTTTAATCTTCGAATTCATCTTCGTCGADH-3-RRCTCGAGAATAACATTAGAAAATTCAGCTAAAATGAGCGGACTGAGGGCGACGCTATTACGCCAGCTGAATTGL-FCTCGAGTTGATTTTTTGTTTACTTTCR-RCTCGAGAATAACATTAGAAAATTCAGCDP-RATGTCAGGAACATTCAATGATATAAGAAG
注:引物中同源序列使用下划线标注
1.2.3 筛选及重复转化
本研究利用的CRISPR-Cas9基因编辑系统是一个双质粒系统,Cas9蛋白和sgRNA分别由2个游离质粒在酿酒酵母菌株中表达以进行相应基因座的敲除整合。以YthmgⅠ为底盘细胞,利用醋酸锂转化法将Cas质粒、sg质粒与线性化重组片段转入细胞,利用同源重组的机制完成整合,利用抗生素硫酸诺尔斯菌素与潮霉素进行重组菌株筛选,将完成转化的菌液涂布至诺尔斯-潮霉素双抗DYPD平板上,倒置于30 ℃培养箱至长出转化子,经菌落PCR初步筛选,再通过基因组测序验证后获得整合表达菌株。
由于转化完成后的质粒依然在底盘细胞内残留,这会影响再次转化,故在进行下一步操作前丢弃原有质粒是必要的。本研究根据ura3标记筛选原理,将无抗培养传代后的改造菌株涂布至5-FOA-YNB平板进行筛选,倒置于30 ℃培养箱至长出转化子,挑取单菌落接种于DYPD液体培养基摇培以待再次转化。
1.2.4 重组菌发酵实验
挑取转化完成的平板上的菌落接至DYPD培养基中,30 ℃,200 r/min培养至对数生长中期,即OD值0.6~0.8,以10%的接种量接至含15 mL培养基的25 mL小摇瓶中,30 ℃,200 r/min摇培至96 h。定时取样对重组菌生长趋势及合成番茄红素水平进行测定。
1.2.5 生长趋势测定及番茄红素提取
取1.5 mL菌液备用。其中1 mL菌液离心弃上清液,ddH2O洗涤2次后烘至恒重,称量计算干重。另0.5 mL菌液同样离心洗涤,添加菌体等体积的玻璃珠与1 mL三氯甲烷;振荡破碎3 min,冰浴1 min,重复2~3次,4 ℃低温离心后锡纸包裹,于4 ℃冰箱内静置过夜萃取。隔天吸取萃取液至新EP管中,氮气吹干,精确添加1 mL正己烷复溶,用酶标仪测定番茄红素产量。
1.2.6 番茄红素测定
本研究使用酶标仪进行番茄红素测定,测定波长为472 nm,每个样品取4个平行。番茄红素标品用于定量分析,精确称取1.5 mg番茄红素标品用正己烷定量于15 mL棕色容量瓶,充分溶解,加入体积分数1%的2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)作为抗氧化剂,4 ℃冰箱保存备用。预实验结果证明番茄红素样品在0~20 mg/L线性最好,故选取该范围制作标准曲线及样品测定。
1.2.7 胞外代谢物的检测
发酵液中葡萄糖、乙醇的浓度利用高效液相色谱进行测定。以Bio-RadHPX-87H为色谱柱,5%的稀硫酸作为流动相,流速为0.8 mL/min,柱温50 ℃,示差检测器。
1.2.8 荧光显微镜检
番茄红素主要积累于酿酒酵母胞内的脂阀上,会于荧光显微镜绿色激发光下发出荧光。将转化番茄红素表达盒的重组菌株涂布诺尔斯-潮霉素双抗平板,30 ℃培养箱倒置培养4 d后挑取红色单菌落制片,置荧光显微镜100×物镜下,分别于明场下与绿色激发光下观察其图像。
2 结果与分析
2.1 代谢改造表达盒的构建
构建脂质途径改造表达盒如图2-a所示,前体及转录途径相关表达盒如图2-b所示。本研究以YthmgⅠ[17]为出发菌株,对gal10位点敲入ldp1同时敲除gal10,得到重组菌株LFD5,单独敲除gal10得到LFD6;在gal7位点敲入pap1同时敲除gal7,得到LFD7,单敲除gal7得到LFD8;在exg1位点敲入GAL1,10pr-pah1-ADH1ter同时敲除exg1,得到LFD9;敲入ADH1ter-dga1-GAL1,10pr-pah1-ADH1ter同时敲除exg1,得到LFD10;单敲除exg1得到LFD11;在gal1位点敲入acc1同时敲除gal1,得到LFD13;单敲除gal1得到LFD14。
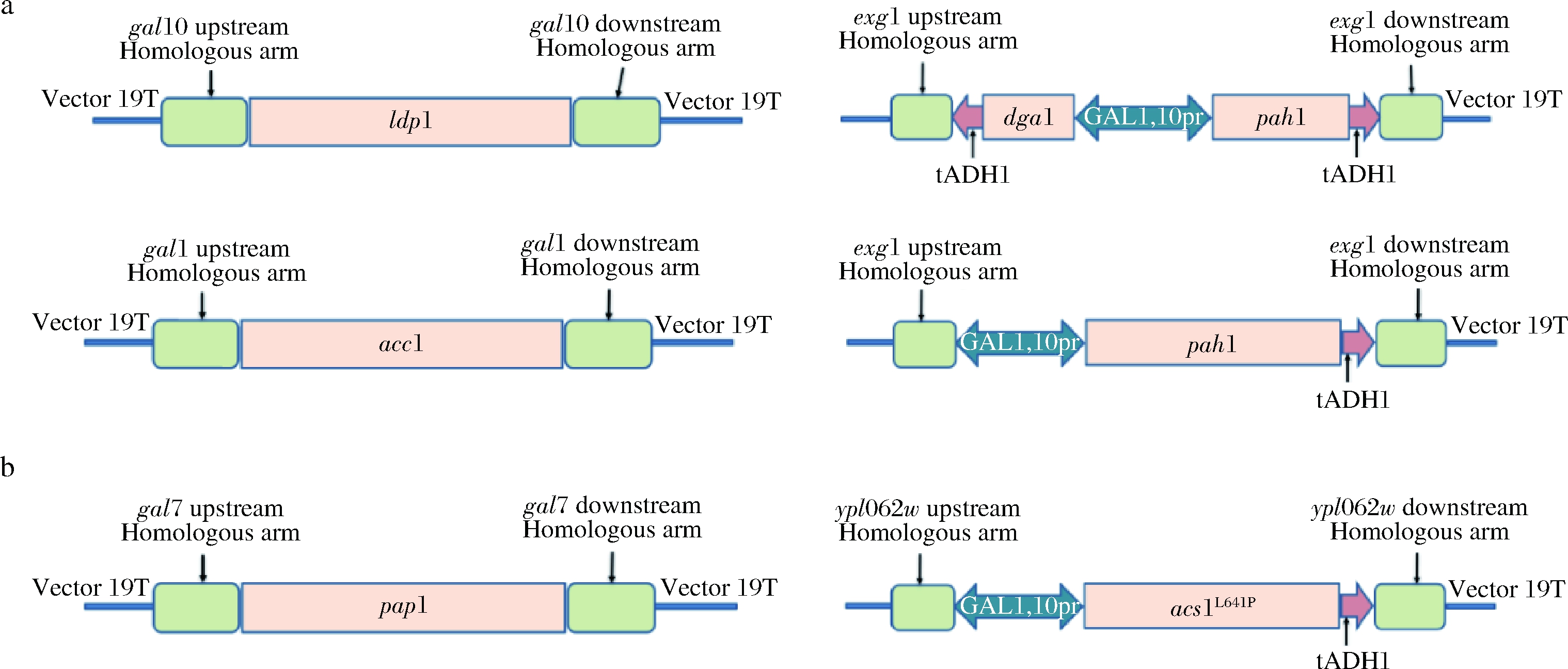
a-GAL启动子控制TAG途径关键基因的表达;b-GAL启动子控制关键基因pap1和acs1L641P的表达
图2 代谢改造途径表达盒
Fig.2 Metabolic engineering pathway expression box
以LFD10为出发菌株,对gal10位点敲入ldp1同时敲除gal10,得到重组菌株LFD12。以LFD12为出发菌株,在ypl062w位点敲入GAL1,10pr-acs1L641P-ADH1ter同时敲除ypl062w,得到重组菌LFD15,单敲除ypl062w得到LFD16;分别以LFD12、LFD15为出发菌株,于gal7位点敲入pap1同时敲除gal7,得到重组菌LFD17、LFD18。
2.2 酿酒酵母脂质体合成途径的改造
将脂质途径改造重组菌LFD5、LFD6、LFD9、LFD10、LFD11、LFD12、LFD13、LFD14,进行发酵培养,取发酵96 h时的样品进行分析测定,结果如图3所示。
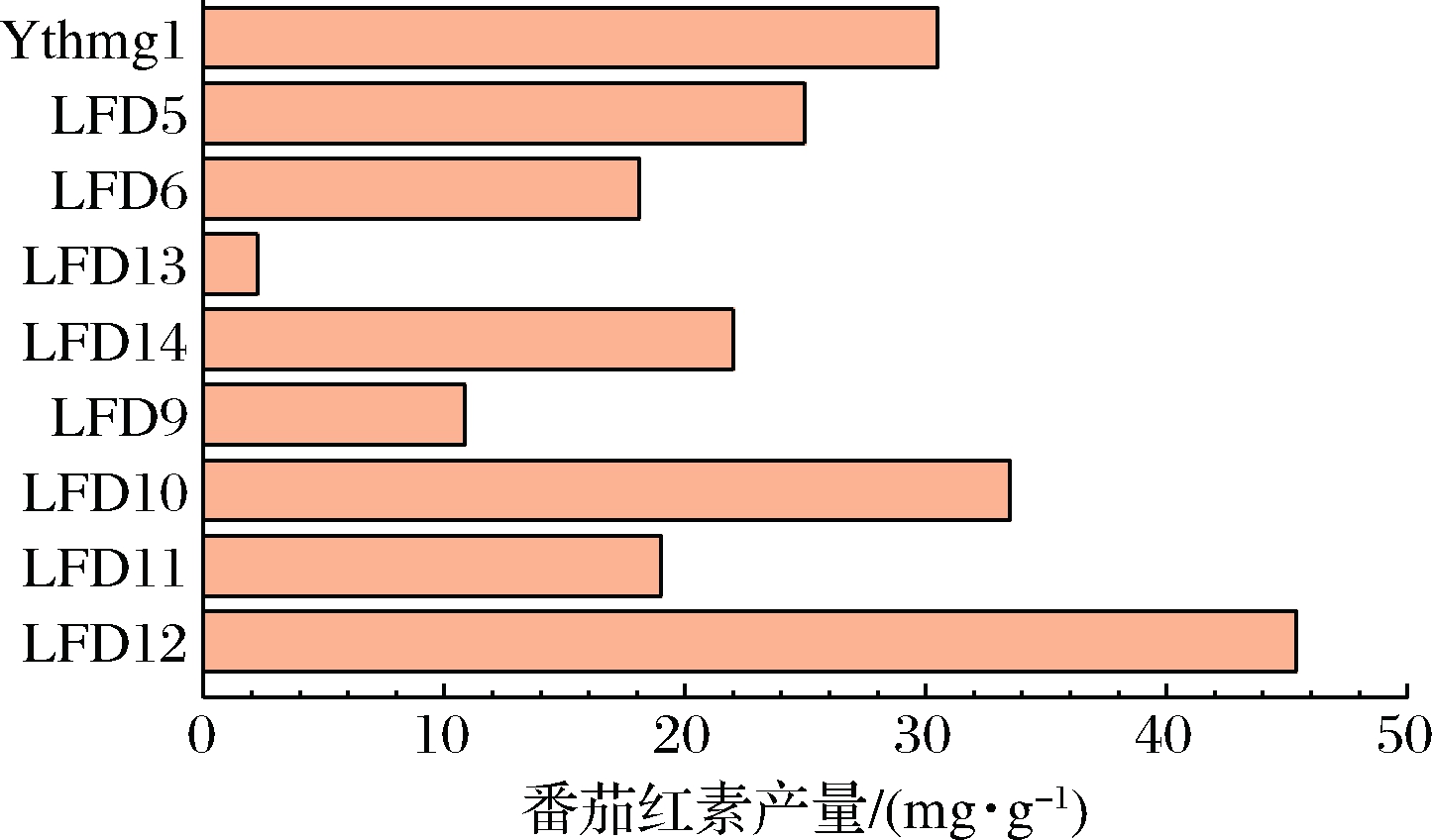
图3 重组菌摇瓶发酵的番茄红素产量
Fig.3 Lycopene production in shake flask fermentation of
recombinant strains
注:LFD5:as YthmgⅠ;Δgal10∷ldp1;LFD6:as YthmgⅠ;Δgal10∷non-marker;LFD9:as YthmgⅠ;Δexg1∷GAL1, 10pr-pah1-ADH1ter;LFD10:as YthmgⅠ;Δexg1∷GAL1,10pr-pah1,dga1-ADH1ter;LFD11:as YthmgⅠ;Δexg1∷non-marker;LFD12:as YthmgⅠ;Δgal10∷ldp1;Δexg1∷GAL1, 10pr-pah1, dga1-ADH1ter;LFD13:as YthmgⅠ;Δgal1∷acc1;LFD14:as YthmgⅠ;Δgal1∷non-marker
就过表达单个基因而言,LFD5的产量最高,但仍不及出发菌株。虽然各基因单一表达时对番茄红素产量提升的效果并不显著,但组合表达后,重组菌LFD12(过表达dga1、pah1、ldp1)的产量大大提高,为45.76 mg/g DCW,是YthmgⅠ的1.5倍。选取产量较高的重组菌,利用荧光显微镜对细胞形态进行观察,结果如图4所示。菌体荧光亮度与番茄红素单位细胞产量呈正相关,胞质内出现较为明亮的绿色小点。

图4 荧光显微镜观察重组菌于绿色激发光下(a)
与明场下(b)的图像
Fig.4 Fluorescence microscopy images of recombinant strains
under green excitation light (a) and bright field (b)
2.3 胞内乙酰辅酶A合成酶及转录翻译相关基因的过表达
对重组菌LFD12(基于YthmgⅠ组合过表达脂质相关基因)、LFD15(基于LFD12过表达乙酰CoA合成基因)、LFD18(基于LFD15加强转录翻译基因)敲入番茄红素表达盒后进行发酵,结果如图5所示。可以看出LFD18的产量最高,单位产量109.26 mg/g DCW,是出发菌株YthmgⅠ的3.36倍。
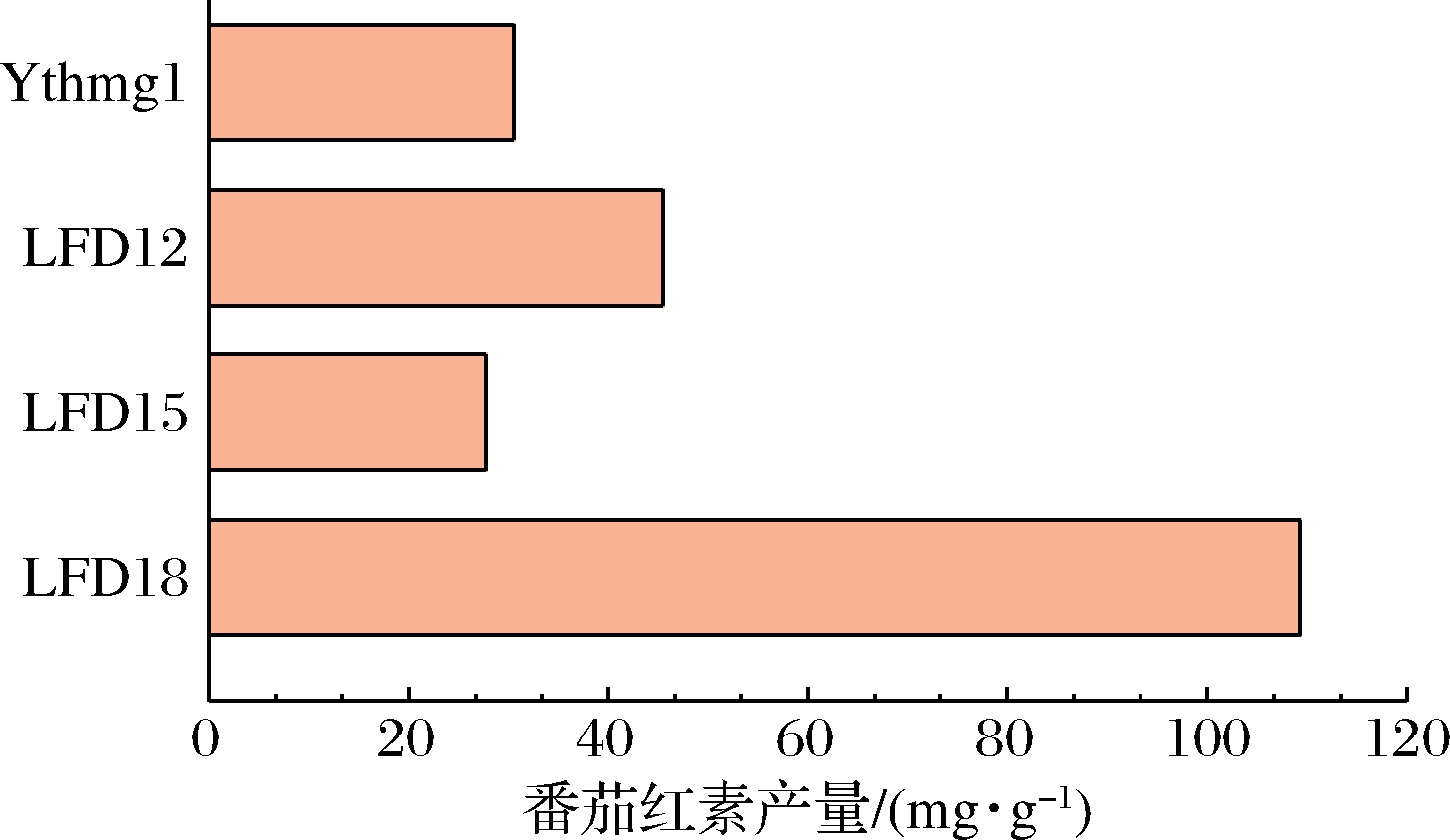
图5 重组菌摇瓶发酵的番茄红素产量
Fig.5 Lycopene production in shake flask fermentation of
recombinant strains
注:LFD12:as YthmgⅠ;Δgal10∷ldp1;Δexg1∷GAL1,
10pr-pah1, dga1-ADH1ter;LFD15:as LFD12;
Δypl062w∷GAL1, 10pr-acs1L641P-ADH1ter;
LFD18:as LFD15;Δgal7∷pap1
分别对LFD12、LFD15、LFD18进行荧光镜检,结果如图6所示,LFD18的荧光最为明亮,这与番茄红素产量相符。

图6 荧光显微镜观察重组菌于绿色激发光下(a)
与明场下(b)的图像
Fig.6 Fluorescence microscopy images of recombinant strains
under green excitation light (a) and bright field (b)
为了进一步探究过表达pap1的效果,分别对YthmgⅠ、LFD7(基于YthmgⅠ过表达pap1)、LFD18(基于LFD15过表达pap1)敲入番茄红素表达盒后进行摇瓶发酵实验,定期取样至96 h进行分析测定,绘制曲线图,结果如图7所示。可看出,通过代谢改造敲入的基因越多,过表达pap1对产量的提升越为显著。

a-番茄红素产量;b-菌株生长曲线
图7 使用不同出发菌株过表达pap1的效果
Fig.7 Typical profiles observed for lycopene
production and cell growth
注:LFD7: as YthmgⅠ; Δgal7∷pap1; LFD18: as YthmgⅠ;
Δexg1∷GAL1,10pr-dga1, pah1-ADH1ter; Δgal10∷ldp1;
Δypl062w∷GAL10pr-acs1L641P-ADH1ter; Δgal7∷pap1
2.4 发酵罐发酵培养
本研究使用上海迪必尔5 L发酵罐,发酵菌株为LFD18,发酵条件为:温度30 ℃,转速500 r/min;使用的培养基为DYPD,从发酵45 h开始以20 g/h的速度恒速流加补充葡萄糖;发酵时长为96 h。对番茄红素产量、菌体生长情况以及胞外代谢产物进行测定,结果如图8所示。
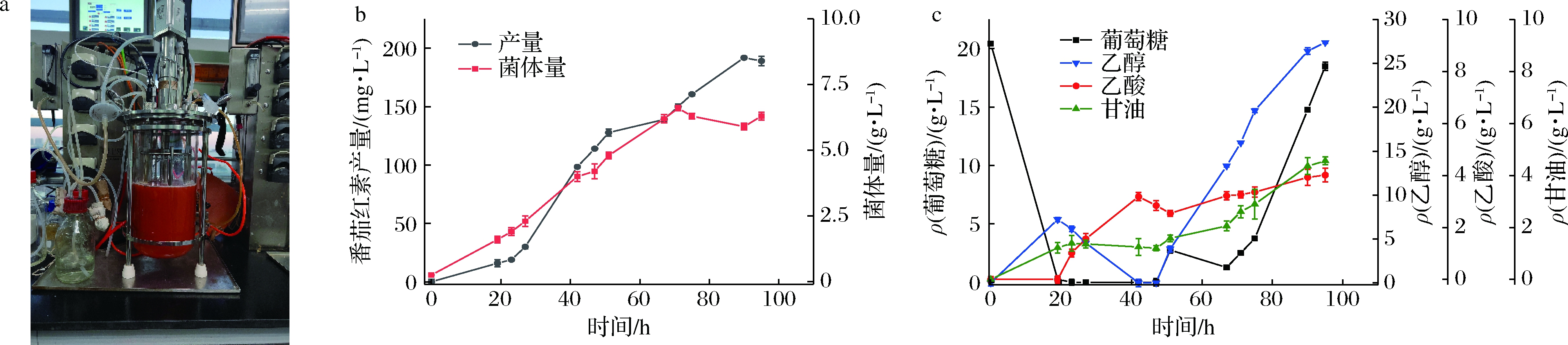
a-LFD18在发酵罐中补料发酵96h;b-LFD18的生长曲线和番茄红素产量;c-LFD18发酵液中葡萄糖、乙醇、乙酸酯和甘油的浓度
图8 葡萄糖补料发酵LFD18的番茄红素产量、菌体量及副产物测定
Fig.8 Determination of lycopene yield, biomass and by-products of LFD18 during glucose fed-batch fermentation
番茄红素产量最终达到191.77 mg/L,单位产量为30.44 mg/g DCW。葡萄糖在0~23 h被快速耗尽,同时产生一定量乙醇;葡萄糖耗尽后,乙醇作为碳源被消耗,菌体生长减缓,番茄红素快速积累,同时生成乙酸。自45 h恒速流加葡萄糖后,乙醇重新开始积累,菌体继续缓慢生长,至60 h后达到稳定。发酵总过程随着菌体生长出现一定的甘油积累,累积速度与菌体生长呈现不完全的正相关,且在发酵过程中几乎不被消耗。
3 结论与讨论
TAG途径与MVA途径共用乙酰CoA作为前体,而2个途径的产物积累时间不尽相同:本实验构建的番茄红素表达盒由GAL启动子启动,其产物积累会发生在葡萄糖浓度降低时;而菌体中脂质积累在氮源耗尽且碳源充足时较为显著[18],可以实现2条代谢途径的有序分流,亦可避免短时间内代谢通量过大耗尽乙酰CoA库,有利于维持菌体内部代谢的动态平衡。本实验利用GAL启动子组合过表达脂质途径相关基因后,番茄红素产量提升至45.76 mg/g DCW,是原菌株产量的1.7倍,说明提高菌体内脂质含量有利于番茄红素积累。观察显微镜像可见,菌体荧光强度与脂质改造过表达基因数目正相关。
MA等[15]在酿酒酵母中同时过表达TAG途径的关键基因pah1、dga1、acc1后胞内TAG含量增加了59%,番茄红素产量提升了110%;此外还敲除了fld1,该策略显著增加了番茄红素积累,但是缩短了酿酒酵母的寿命。ZHU等[16]研究表明,ldp1在酿酒酵母中过量表达时,Ldp1定位于脂滴表面促进了巨大脂滴形成,这表明Ldp1在酵母脂滴动力学方面有着重要作用。SHI等[19]通过在酿酒酵母中过表达来自肠道沙门氏菌的乙醛脱氢酶基因ald6、乙酰辅酶A合成酶基因acs以及乙醇脱氢酶基因adh211,显著增加了代谢通量,番茄红素产量相较改造前提高了12%。SHIBA等[20]组合表达来自三孢布拉霉的ald6和acs1L641P将乙酸合成乙酰辅酶A的转化率提高了3倍,使得紫穗槐二烯的产量提高了4倍。本实验在脂滴改造的基础上进一步加强乙酰CoA的表达,番茄红素产量相较过表达acs1L641P前并无提高,而在脂质改造及乙酰CoA改造的基础上进一步强化转录相关基因pap1后番茄红素产量提高了2.6倍,单位产量达到109.26 mg/g DCW,镜检可见菌体荧光明显增强,说明基因过表达应辅以转录强化,保证对应基因的高效表达。
SHI等[19]使用7 L发酵罐,分别使用葡萄糖与乙醇作为碳源,通过两阶段补料方法对代谢改造酿酒酵母进行发酵,番茄红素总产量达到3.28 g/L,相较摇瓶发酵产量310 mg/L提高了11倍。本实验结合脂质工程与代谢工程,构建了番茄红素高产酿酒酵母菌株,摇瓶发酵产量为360.66 mg/L;通过发酵罐恒速流加葡萄糖培养96 h,产量为191.77 mg/L,相较摇瓶反而有所降低。菌体在发酵后期退化较为严重,猜测一是由于发酵后期葡萄糖流加速度过大导致乙醇大量积累,抑制了菌体生长;二是YPH499菌株本身较容易退化,不适宜大体系发酵培养。后续可以再实行发酵培养基优化、分批补料优化等策略,进一步提高重组菌的番茄红素产量。
[1] MARIANI S, LIONETTO L, CAVALLARI M, et al.Low prostate concentration of lycopene is associated with development of prostate cancer in patients with high-grade prostatic intraepithelial neoplasia[J].International Journal of Molecular Sciences, 2014, 15(1):1 433-1 440.
[2] MCENENY J, WADE L, YOUNG I S, et al.Lycopene intervention reduces inflammation and improves HDL functionality in moderately overweight middle-aged individuals[J].Journal of Nutritional Biochemistry, 2013, 24(1):163-168.
[3] MARKHAM K A, ALPER H S.Synthetic biology expands the industrial potential of Yarrowia lipolytica[J].Trends in Biotechnology, 2018, 36(10):1 085-1 095.
[4] LIU N, LIU B, WANG G, et al.Lycopene production from glucose, fatty acid and waste cooking oil by metabolically engineered Escherichia coli[J].Biochemical Engineering Journal, 2020, 155:107488.
[5] ZLAB C,NL A,ZLA D, et al.Enhancing isoprenoid synthesis in Yarrowia lipolytica by expressing the isopentenol utilization pathway and modulating intracellular hydrophobicity[J].Metabolic Engineering, 2020, 61:344-351.
[6] LI L, LIU Z, JIANG H, et al.Biotechnological production of lycopene by microorganisms[J].Applied Microbiology and Biotechnology, 2020, 104(24):10 307-10 324.
[7] LEBER R, ZINSER E, ZELLNIG G, et al.Characterization of lipid particles of the yeast, Saccharomyces cerevisiae[J].Yeast, 1994, 10(11):1 421-1 428.
[8] WANG J, LEDESMA-AMARO R, WEI Y, et al.Metabolic engineering for increased lipid accumulation in Yarrowia lipolytica:A Review[J].Bioresource Technology, 2020, 313:123707.
[9] DOUROU M, AGGELI D, PAPANIKOLAOU S, et al.Critical steps in carbon metabolism affecting lipid accumulation and their regulation in oleaginous microorganisms[J].Applied Microbiology and Biotechnology, 2018, 102(6):2 509-2 523.
[10] VAN ROSSUM H M, KOZAK B U, PRONK J T, et al.Engineering cytosolic acetyl-coenzyme A supply in Saccharomyces cerevisiae:Pathway stoichiometry, free-energy conservation and redox-cofactor balancing[J].Metabolic Engineering, 2016, 36:99-115.
[11] 陈孚江, 周景文, 史仲平, 等.乙酰辅酶A合成代谢对酿酒酵母生理功能的影响[J].微生物学报, 2010, 50(9):1 172-1 179.
CHEN F J, ZHOU J W, SHI Z P, et al.Effect of acetyl-CoA synthase gene overexpression on physiological function of Saccharomyces cerevisiae[J].Acta Microbiologica Sinica, 2010, 50(9):1 172-1 179.
[12] CHEN Y, WANG Y, LIU M, et al.Primary and secondary metabolic effects of a key gene deletion (ΔYPL062W) in metabolically engineered terpenoid-producing Saccharomyces cerevisiae[J].Applied and Environmental Microbiology, 2019, 85(7):AEM.01990-18.
[13] TRIKKA F A, NIKOLAIDIS A, ATHANASAKOGLOU A, et al.Iterative carotenogenic screens identify combinations of yeast gene deletions that enhance sclareol production[J].Microbial Cell Factories, 2015, 14:60.
[14] MEINKE G, EZEOKONKWO C, BALBO P, et al.Structure of yeast poly(A) polymerase in complex with a peptide from Fip1, an intrinsically disordered protein[J].Biochemistry, 2008, 47(26):6 859-6 869.
[15] MA T, SHI B, YE Z, et al.Lipid engineering combined with systematic metabolic engineering of Saccharomyces cerevisiae for high-yield production of lycopene[J].Metabolic Engineering, 2019, 52:134-142.
[16] ZHU Z W, DING Y F, GONG Z W, et al.Dynamics of the lipid droplet proteome of the oleaginous yeast Rhodosporidium toruloides[J].Eukaryotic Cell, 2015, 14(3):252-264.
[17] 孙玲, 王均华, 蒋玮, 等.高效合成番茄红素酿酒酵母菌株的构建[J].生物工程学报, 2020, 36(7):1 334-1 345.
SUN L, WANG J H, JIANG W, et al.Construction of a highly efficient synthetic lycopene engineered Saccharomyces cerevisiae[J].Chinese Journal of Biotechnology, 2020, 36(7):1 334-1 345.
[18] PLOIER B, DAUM G, PETROVI U.Molecular mechanisms in yeast carbon metabolism:Lipid metabolism and lipidomics[M].Molecular Mechanisms in Yeast Carbon Metabolism.Berlin, Heidelberg:Springer Berlin Heidelberg, 2014:169-215.
U.Molecular mechanisms in yeast carbon metabolism:Lipid metabolism and lipidomics[M].Molecular Mechanisms in Yeast Carbon Metabolism.Berlin, Heidelberg:Springer Berlin Heidelberg, 2014:169-215.
[19] SHI B, MA T, YE Z, et al.Systematic metabolic engineering of Saccharomyces cerevisiae for lycopene overproduction[J].Journal of Agricultural and Food Chemistry, 2019, 67(40):11 148-11 157.
[20] SHIBA Y, PARADISE E M, KIRBY J, et al.Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae for high-level production of isoprenoids[J].Metabolic Engineering, 2007, 9(2):160-168.