马铃薯(Solanum tuberosum L.)是茄科属一年生草本植物,种植周期短,单产收获高,营养物质丰富,干物质含量约为20%,含量最多的是淀粉,除此之外还含有蛋白质、脂肪、粗纤维、矿物质及维生素等[1]。2015年农业部提出马铃薯主粮化战略,将马铃薯列为第四大主粮进行推广,扩大种植面积并提高亩产量[2]。采后的马铃薯块茎会进入休眠状态,此时营养物质消耗极少,当休眠状态被打破时,马铃薯块茎随即发芽[3]。发芽会引起马铃薯营养成分流失、腐烂变绿,并产生龙葵素等有毒物质,从而造成马铃薯商品品质下降,以及巨大的食用安全隐患。因此,有效抑制马铃薯块茎发芽成为亟待解决的问题。
目前抑制马铃薯发芽的方法有低温贮藏、辐射处理、化学抑制剂等。在低温贮藏过程中,淀粉转化分解为还原糖,导致还原糖迅速聚集累积[4]。在油炸加工时,易生成带有苦味的褐色物质,严重影响马铃薯的色泽和品质,并导致丙烯酰胺等致癌物质生成。辐射处理的作用是不可逆的,不适用于种薯,且运输成本大、设备要求高,消费者的安全顾虑多。常见的化学抑制剂有氯苯胺灵、青鲜素、α-萘乙酸甲酯等[5],抑芽效果好且成本低,在马铃薯贮藏产业广泛应用,但青鲜素和α-萘乙酸甲酯对人体有致癌作用,在食用后存在一定的安全隐患;氯苯胺灵的降解产物如3-氯苯胺和苯胺基衍生物会产生某些致癌物质[6],引发一系列健康风险和安全问题。随着人们对农药残留和食品安全的重视,氯苯胺灵的可接受度在下降,我国食品安全国家标准规定氯苯胺灵在马铃薯上的最大残留限量为30 mg/kg。因此寻找氯苯胺灵等化学抑芽剂的替代品,开发绿色安全高效的马铃薯新型抑芽剂,是马铃薯贮藏加工业亟待解决的问题。
植物精油主要含有萜类、醇类、醛类、酸类、酚类、芳香族化合物类等[7],具有抑菌、抗病毒、抗氧化等生理作用[8],因而被广泛应用于食品、香料、医药、化妆品领域。已有研究表明,薄荷、葛缕子、莳萝、留兰香、茉莉、百里香、肉桂等植物精油[9-12]对马铃薯的发芽具有明显的抑制作用。香茅是一种常见的香料,具有抗菌消炎、驱蚊避虫、和胃通气、提神醒脑等作用[13],被广泛应用于医药、日化等领域,其安全性得到证实,而香茅精油(citronella essential oil,CEO)对于马铃薯的抑芽作用还未见报道。
本文采用香茅精油处理马铃薯块茎,研究香茅精油对马铃薯贮藏期间的抑芽效果,从呼吸强度、糖代谢、蛋白质变化角度探究抑芽作用机理,以期为开发马铃薯的采后抑芽提供新的选择。
1 材料与方法
1.1 材料与试剂
马铃薯“V7”,2021年4月购自山东省济南市槐荫区山东匡山农产品综合交易市场(已过休眠期)。香茅精油购自重庆芳黛化妆品商行。
碘、葡萄糖、NaOH、3,5-二硝基水杨酸、K2SO4,国药集团化学试剂有限公司;KI、Na2SO3,天津博迪化工股份有限公司;可溶性淀粉、酒石酸钾钠、CuSO4、甲基红、溴甲酚绿、硼酸,天津大茂化学试剂厂;Na2SO4,天津广成化学试剂有限公司;苯酚,西陇科学股份有限公司;牛血清蛋白质,广州浩玛生物科技有限公司;石油醚、乙醇,天津富宇精细化工有限公司;考马斯亮蓝G-250、葡萄糖、果糖、蔗糖,上海源叶生物有限公司;浓硫酸(浓度98%),烟台远东精细化工有限公司;乙腈,上海星可高纯溶剂有限公司。
1.2 仪器与设备
YGA2100型气体测定仪,北京阳光亿事达科技有限公司;V-1100D 紫外可见分光光度计,上海美谱达仪器有限公司;ME104型电子分析天平,上海梅特勒-托利多仪器有限公司;XW-80A旋涡混合器,海门其林贝尔仪器制造有限公司;H1805R台式高速冷冻离心机,长沙湘仪离心机有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;LC-20AT HPLC仪器,日本岛津仪器有限公司;K9860全自动凯氏定氮仪、SH220F石墨消解仪,山东海能科学仪器有限公司。
1.3 样品处理方法
在正式实验之前,分别就香茅精油浓度和熏蒸方式进行预实验,选择香茅精油处理剂量0.5、1.0、2.0 mL/kg(以每筐马铃薯的质量计,每筐约1.5 kg),熏蒸方式选择直接熏蒸、滤纸熏蒸、混土熏蒸。马铃薯购买后运回实验室,对马铃薯块茎进行筛选,除去有机械损伤和病虫害的马铃薯,随后将马铃薯分装到10 L塑料筐中。(1)直接熏蒸法:把香茅精油添加到培养皿中,放置于塑料筐中心密闭熏蒸。(2)滤纸熏蒸法:用移液枪将香茅精油滴加在滤纸上,滤纸粘贴于塑料筐外侧密闭熏蒸。(3)混土熏蒸法:参考氯苯胺灵(马铃薯抑芽剂)的使用方法,以每筐马铃薯具体质量计,选择不同的香茅精油处理剂量(0.5、1.0、2.0 mL/kg)处理马铃薯,将一定量香茅精油与无菌土(300 g,于121 ℃灭菌30 min)混匀,均匀覆盖在马铃薯表面,用聚乙烯保鲜袋封口密闭熏蒸。定期测量芽长,统计发芽率。结果发现,混土熏蒸的抑芽效果最佳。对于香茅精油处理剂量(0.5、1.0、2.0 mL/kg)来说,随处理浓度上升马铃薯的发芽率逐渐下降,因此本试验采用混土熏蒸方式,选定1.0 mL/kg的质量浓度用于正式实验。
将筛选后无机械损伤、无病虫害的马铃薯分装到10 L塑料筐中,每组6筐,每筐马铃薯10个(约1.5 kg)。其中3筐马铃薯用来测定发芽率、发芽指数、呼吸强度,另外3筐取样后立即保存用于测定其他指标。采用混土熏蒸方式,香茅精油处理剂量为1.0 mL/kg(以每筐马铃薯具体质量计),将一定量香茅精油与无菌土(300 g,于121 ℃灭菌30 min)混匀,均匀覆盖于马铃薯表面,同时设置空白对照。然后将上述各处理组用厚度为0.03 mm的聚乙烯保鲜袋密封,于常温下(25 ℃)贮藏20 d,其中在贮藏24 h时将聚乙烯保鲜袋的4个角分别戳孔,便于马铃薯进行气体交换。
每4 d测定发芽率、发芽指数、呼吸强度。每4 d采用随机取样的方法进行取样,具体取样方法为:用打孔器沿马铃薯块茎顶部至基部方向打孔取样2次,然后垂直于上述方向再取样2次,取样后切成厚度3 mm左右的薄片混匀,液氮冷冻后放入-80 ℃冰箱储存待用。
1.4 指标的测定
1.4.1 发芽率及发芽指数的测定
每个处理随机选取5个马铃薯,记录每个块茎上的芽数并用游标卡尺测量最长芽的长度,均取平均值。发芽指数参照涂勇等[12]的方法,芽长共分8级(表1),芽长小于2 mm视为未萌动或处于萌动状态,判定为未发芽。
表1 发芽分级标准
Table 1 Germination classification standards

芽长/mm发芽等级芽长/mm发芽等级0~2015~2042~5120~2555~10225~30610~153>307
发芽率和发芽指数按照公式(1)(2)计算:
发芽率![]()
(1)
发芽指数![]()
(2)
1.4.2 呼吸强度测定
参考梁芸志等[14]方法,采用气体分析仪测定。随机选择5个马铃薯,放入体积为10 L的塑料筐中密闭1.5 h,记录CO2百分含量。呼吸强度以mg CO2/(kg·h)表示。
1.4.3 淀粉含量测定
参照曹建康等[15]的方法并做修改,采用碘-淀粉比色法。称取2.0 g马铃薯样品置于研钵中,加入30 mL石油醚和乙醇充分研磨、过滤,将滤渣转移至烧杯中,于沸水浴中加热、搅拌,直至淀粉完全糊化为澄清透明溶液。将上述溶液转移至100 mL容量瓶中,定容。淀粉含量按照公式(3)计算:
淀粉含量![]()
(3)
式中:m′,标准曲线中的淀粉质量,μg;V,提取液总体积,mL;N,样品稀释倍数;Vs,测定时吸取样品的体积,mL;m,样品质量,g。
1.4.4 还原糖含量测定
参照HU等[16]的方法,采用3,5-二硝基水杨酸法测定。称取1.0 g马铃薯样品,用50 L蒸馏水洗入三角瓶中,混匀后置于50 ℃水浴锅中保温30 min,待匀浆冷却后过滤,滤液转移至100 mL容量瓶并定容。在波长540 nm处测定溶液的吸光度。还原糖含量按照公式(4)计算:
还原糖含量![]()
(4)
式中:m′,标准曲线中的葡萄糖质量,μg;V,提取液总体积,mL;N,样品稀释倍数;Vs,测定时吸取样品的体积,mL;m,样品质量,g。
1.4.5 总糖含量测定
称取5.0 g马铃薯样品并加入10 mL 6 mol/L HCl溶液进行研磨,研磨后加入15 mL水置于沸水浴中煮沸30 min,取出冷却后加入1滴酚酞指示剂,以质量浓度100 g/L的NaOH溶液中和使溶液呈微红色,然后转移至100 mL容量瓶并定容。测定步骤及计算方法同1.4.4。
1.4.6 糖组分的测定
葡萄糖、果糖和蔗糖的提取和测定参照TERRY等[17]的方法并修改。称取1.5 g马铃薯样品于研钵中,加入20 mL 80%的乙醇充分研磨,然后转移至烧杯中超声波提取30 min,过滤后,将上清液在旋转蒸发仪中蒸干(温度设定为60 ℃)。残留物用10 mL的V(乙腈)∶V(水)=80∶20溶液溶解,置于4 ℃冰箱保存待用。提取液用0.45 μm滤膜过滤,然后用HPLC测定。其中色谱柱为NH2(5 μm,250 mm×4.6 mm),柱温30 ℃,进样量20 μL,检测器为RID-10A(温度40 ℃),流动相为乙腈和水(体积比80∶20),流速为1.0 mL/min。
1.4.7 总蛋白含量测定
马铃薯样品消解2 h后,采用凯氏定氮法测定[18],首先对仪器管路进行清洗,然后输入硫酸标准溶液的浓度以及蛋白质换算系数,待空白测试数值稳定后进行样品总蛋白含量测定,并记录全自动凯氏定氮仪的读数,总蛋白含量以%表示。
1.4.8 可溶性蛋白质含量测定
参照曹建康等[15]的方法,采用考马斯亮蓝染色法,测定在595 nm处溶液的吸光度。利用标准曲线计算马铃薯样品中的可溶性蛋白质含量,其中标准曲线为:y=0.002 9x+0.016 4(x表示蛋白质质量,y表示吸光值),R2=0.998 7。
1.5 数据分析
每种样品设置3个平行,使用Excel 2010软件绘制图表,用SPSS 23.0软件进行差异显著性分析,结果以平均值±标准差表示,采用方差分析进行邓肯氏检验,以P<0.05表示差异显著。
2 结果分析
2.1 香茅精油处理对马铃薯块茎发芽形态的影响
CEO处理对马铃薯贮藏期间块茎发芽形态的影响如图1所示。以第0天未处理的马铃薯块茎为对照,在贮藏20 d时,对照组的马铃薯块茎发芽数较多,主要聚集在顶芽周围呈现簇拥状态,在块茎侧身也有一定的萌芽现象,顶芽表现为紫色或绿色而侧芽为黄色。处理组的马铃薯块茎几乎未发芽,发芽的块茎主要集中在顶芽,芽眼部位呈现黑色。

图1 香茅精油处理对马铃薯块茎萌芽的影响
Fig.1 Effect of citronella essential oil treatment
on potato tuber sprout
2.2 香茅精油处理对马铃薯发芽率和发芽指数的影响
发芽率和发芽指数与马铃薯的品质息息相关,发芽后马铃薯营养成分流失,外观和食用品质大幅下降。由图2可知,在贮藏第4天时,对照组的发芽率为25.00%,发芽指数为2.86%,此时香茅精油处理组尚未发芽。对照组的发芽率和发芽指数从贮藏第4天开始,呈现迅速上升趋势,处理组的发芽率和发芽指数始终显著低于对照组(P<0.05)。贮藏结束时,处理组的发芽率和发芽指数分别为15.00%和4.29%,而对照分别是100.00%和30.00%。因此,香茅精油处理可以有效延缓马铃薯发芽,将发芽率和发芽指数维持在较低水平。
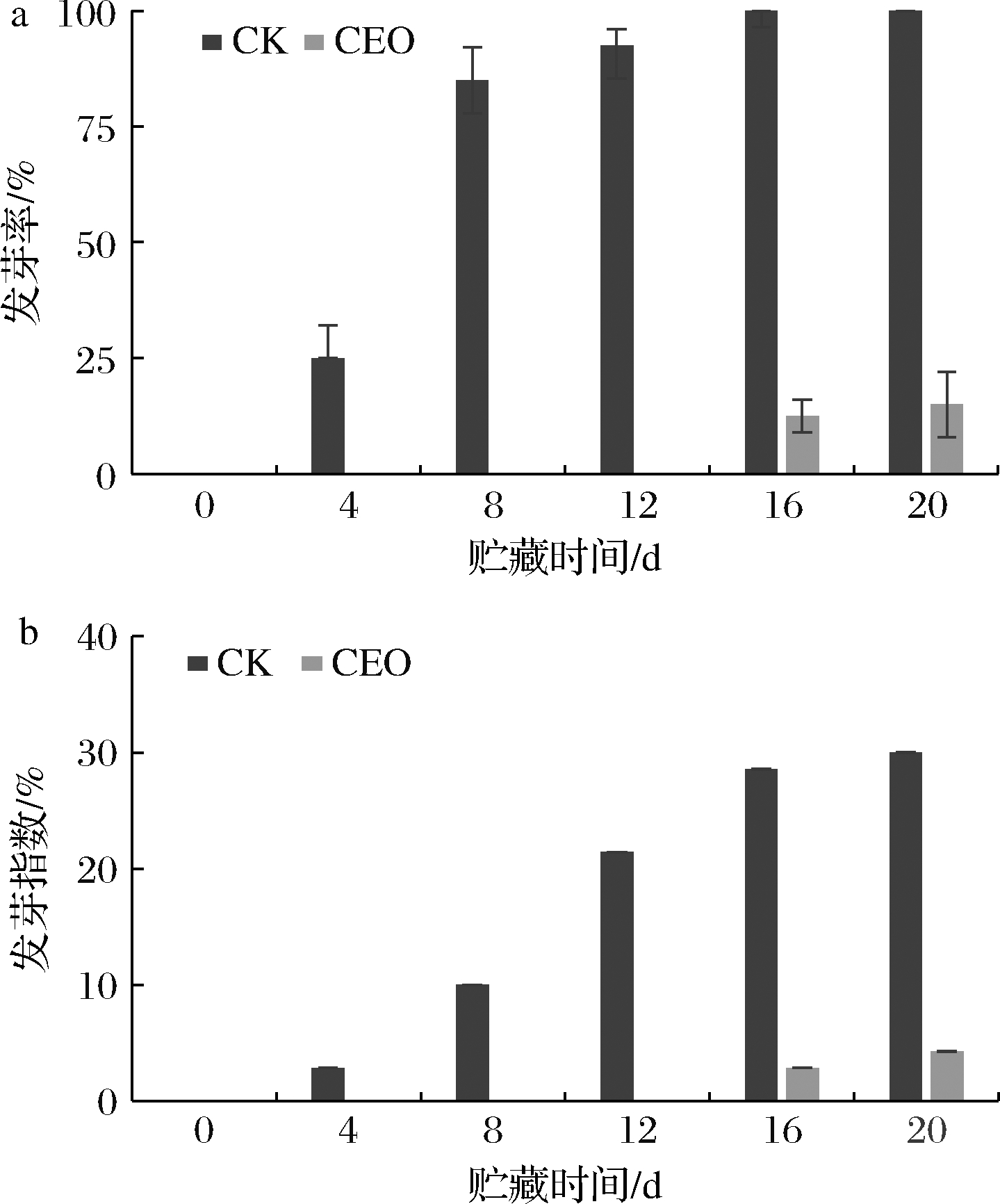
a-发芽率;b-发芽指数
图2 香茅精油处理对马铃薯发芽率、发芽指数的影响
Fig.2 Effect of citronella essential oil treatment on potato
germination rate and germination index
2.3 香茅精油处理对马铃薯呼吸强度的影响
呼吸强度是反映植物新陈代谢和生命活动强弱的重要指标。马铃薯在感染病害或受伤情况下呼吸强度明显增加[19],马铃薯从市场购买运回实验室途中受到机械损伤,所以贮藏初期2组马铃薯呼吸强度最高[48.81 mg/(kg·h)](图3)。贮藏第4天和第8天时,处理组的马铃薯呼吸强度均高于对照组,二者差异达到显著水平(P<0.05)。随后2组马铃薯块茎呼吸强度均呈现下降趋势,贮藏16 d至贮藏期结束,香茅精油处理组呼吸强度上升,因为此时是处理组块茎萌芽时期。因此,贮藏初期香茅精油处理会使马铃薯块茎呼吸强度保持较高水平,而伤口愈合后又迅速下降,香茅精油处理在贮藏后期可抑制马铃薯的呼吸强度。
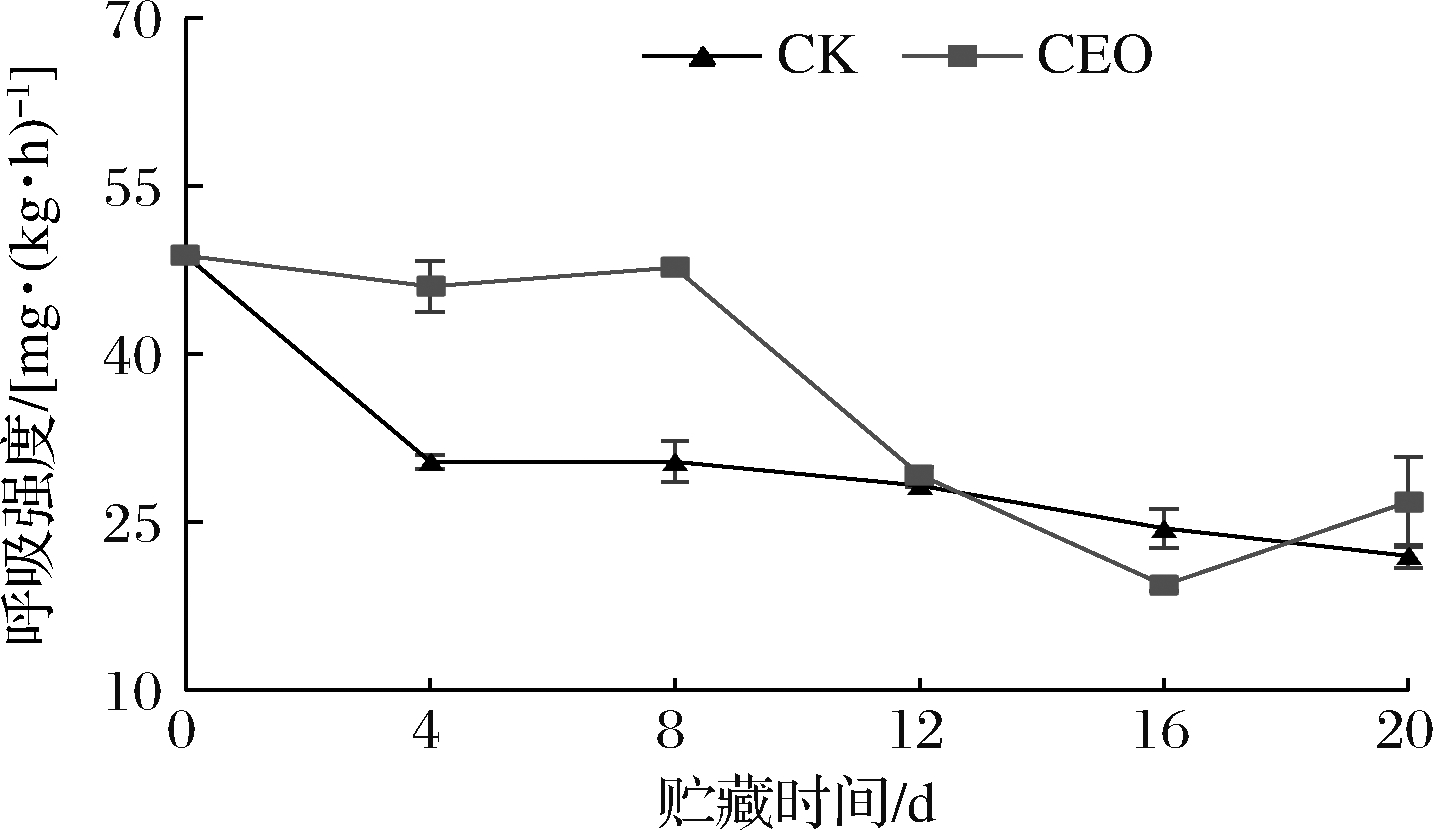
图3 香茅精油处理对马铃薯呼吸强度的影响
Fig.3 Effect of citronella essential oil treatment
on potato respiratory strength
2.4 香茅精油处理对马铃薯淀粉含量的影响
淀粉是马铃薯块茎的主要营养物质和能量来源[20],淀粉含量的高低可以反映马铃薯贮藏品质的变化。淀粉与糖的转换在贮藏期间一直存在,始终遵循淀粉和还原糖的可逆动态平衡[21]。如图4所示,对照组和处理组的马铃薯淀粉含量在贮藏期间处于波动状态。从贮藏第12天至贮藏结束,二者的淀粉含量变化趋势相同,且处理组的淀粉含量始终高于对照组,达到显著水平(P<0.05)。贮藏第20天时,对照组和处理组的淀粉含量分别为11.81%、14.65%,分别为初始值的73.9%、91.6%,这表明,香茅精油处理可有效延缓淀粉含量的下降,更有利于保持贮藏过程中马铃薯品质。
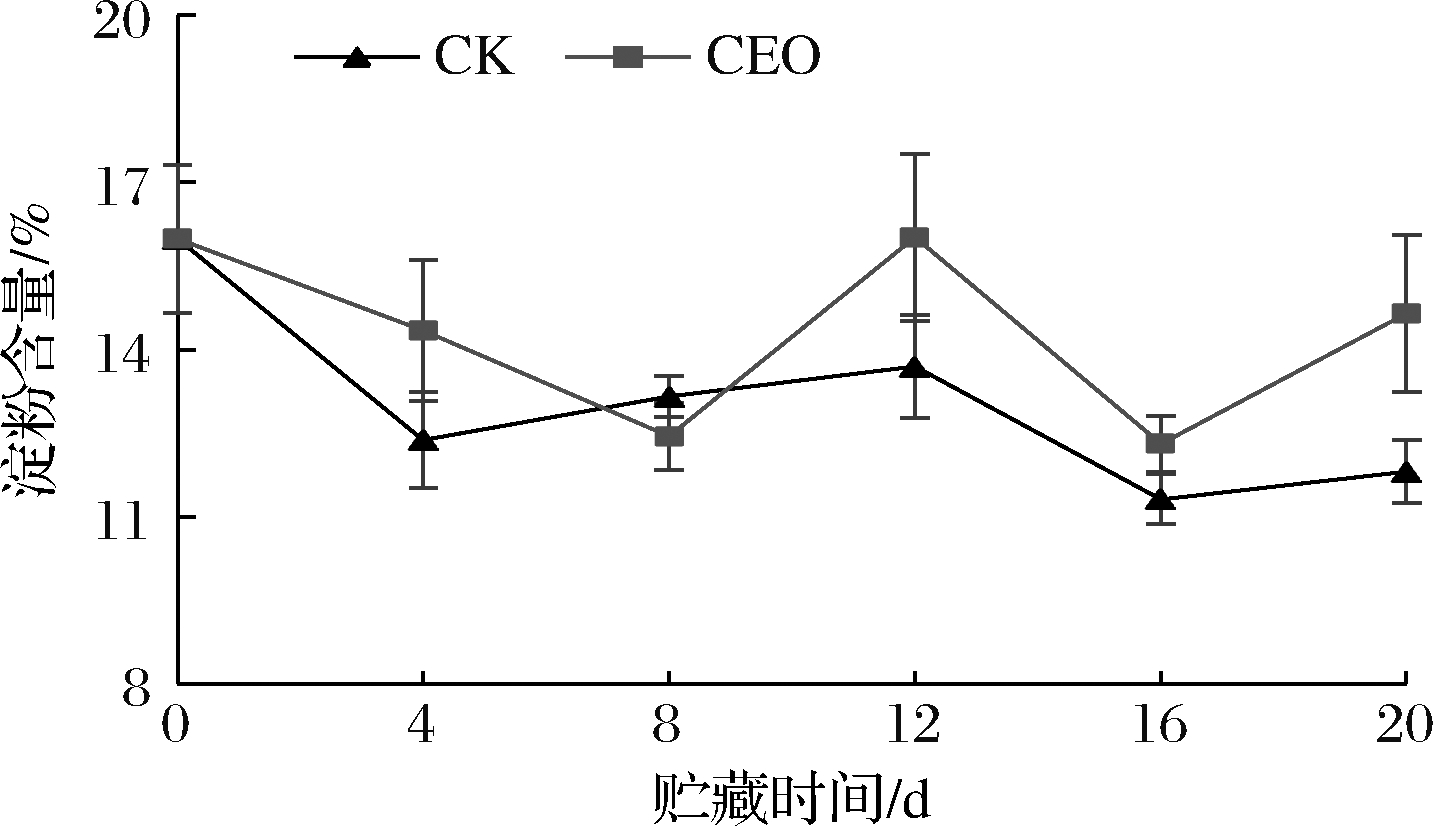
图4 香茅精油处理对马铃薯淀粉含量的影响
Fig.4 Effect of citronella essential oil treatment
on potato starch content
2.5 香茅精油处理对马铃薯总糖和还原糖含量的影响
糖是马铃薯呼吸作用的主要底物,也是重要的能量储存物质,马铃薯采后一切生命活动所需能量都由糖类提供。还原糖含量是衡量马铃薯贮藏品质的重要指标,还原糖包括葡萄糖、果糖、乳糖、麦芽糖等。还原糖会与氨基酸发生美拉德反应,产生棕色带苦味的物质[22],因此马铃薯中过高的还原糖会影响马铃薯油炸食品的色泽和品质。
整体来看,处理组的马铃薯总糖含量在贮藏期始终高于对照组,且在第4天和第12天达到显著水平(P<0.05)(图5-a)。贮藏20 d时,处理组和对照组的总糖含量分别为403.43、385.52 mg/g,与初始值相比分别下降了7.63%和9.18%。说明香茅精油处理可以减少总糖的消耗,使总糖含量保持在较高水平。如图5-b所示,在贮藏期开始,马铃薯的还原糖含量最高(139.65 mg/g),随着贮藏时间延长,2组还原糖含量均呈下降趋势,这是因为马铃薯脱离冷库后,由于温度升高,马铃薯呼吸作用加强以及糖逆转化为淀粉,导致累积的还原糖含量逐步下降,这与司怀军等[23]研究结果一致。贮藏结束时,对照组和处理组的还原糖含量分别为53.60、36.09 mg/g,差异达到显著水平(P<0.05)。说明香茅精油处理可以抑制还原糖的产生速率,使马铃薯块茎的还原糖含量保持在较低水平,从而减轻美拉德反应导致的品质和色泽变化。由于马铃薯总糖含量受还原糖含量影响,贮藏期间还原糖含量不断被消耗,导致总糖含量也有一定消耗。

a-总糖;b-还原糖
图5 香茅精油处理对马铃薯总糖和还原糖含量的影响
Fig.5 Effect of citronella essential oil treatment on potato
total sugar and reduced sugar content
2.6 香茅精油处理对马铃薯糖组分的影响
在贮藏期间,对照组和处理组果糖和葡萄糖含量略有下降,而蔗糖含量则明显下降。如图6所示。

a-果糖;b-葡萄糖;c-蔗糖
图6 香茅精油处理对马铃薯果糖、葡萄糖、蔗糖含量的影响
Fig.6 Effects of citronella essential oil treatment on potato fructose, glucose and sucrose content
在贮藏第8天至第16天,处理组和对照组间马铃薯果糖含量有显著差异(P<0.05),各组间葡萄糖含量仅在贮藏第8天时达到显著性差异(P<0.05)。贮藏第8天时,处理组的果糖、葡萄糖含量显著高于对照组,而处理组淀粉含量低于对照组,这说明在香茅精油作用下,马铃薯块茎内淀粉转化为蔗糖,进而在液泡转化酶作用下生成大量果糖和葡萄糖,导致果糖、葡萄糖含量高于对照组(图7)。对于蔗糖来说,在贮藏第12天,处理组蔗糖含量显著高于对照组(P<0.05)(图6-c),而此时处理组葡萄糖、果糖含量低于对照组,可能是蔗糖在液泡转化酶抑制剂作用下,合成果糖和葡萄糖路径受阻,导致蔗糖被积累(图7)。
2.7 香茅精油处理对马铃薯总蛋白和可溶性蛋白含量的影响
蛋白质代谢是马铃薯块茎生命活动的基础,马铃薯萌芽时,贮藏蛋白质在各种酶的作用下降解为小分子氨基酸,为新蛋白质和其他代谢物质合成提供基础[24]。可溶性蛋白质是果蔬细胞中酶体系的重要构成部分,参与多种生理代谢过程,可溶性蛋白质的含量与果蔬细胞的成熟衰老密不可分[25]。
总体来说,处理组以及对照组的总蛋白含量在贮藏期间变化较平稳,呈现缓慢下降趋势(图8-a)。仅在贮藏第8天时,2组间的马铃薯总蛋白含量有显著差异(P<0.05),贮藏结束时(20 d),对照组和处理组的总蛋白含量分别为1.81%和1.79%。如图8-b所示,在贮藏期间,对照组以及处理组的可溶性蛋白质的含量均呈现先上升后下降趋势。从贮藏12 d至贮藏结束,2组间可溶性蛋白质含量具有显著差异(P<0.05)。贮藏结束时(20 d),香茅精油处理组的马铃薯可溶性蛋白质含量比对照组高11.82%。结果表明,在贮藏过程中,2组马铃薯总蛋白含量都保持稳定,香茅精油处理对总蛋白的影响不大,而对马铃薯可溶性蛋白质含量的下降有抑制作用。

SP-淀粉磷酸化酶;AGPase-腺苷二磷酸葡萄糖焦磷酸化酶;SS-淀粉合成酶;UGPase-尿苷二磷酸葡萄糖焦磷酸化酶;
SuSy-蔗糖合成酶;VI-液泡转化酶;INH-液泡转化酶抑制剂;PPP-磷酸戊糖途径;EMP-糖酵解
图7 碳水化合物代谢路径[26]
Fig.7 Carbohydrate metabolic pathways
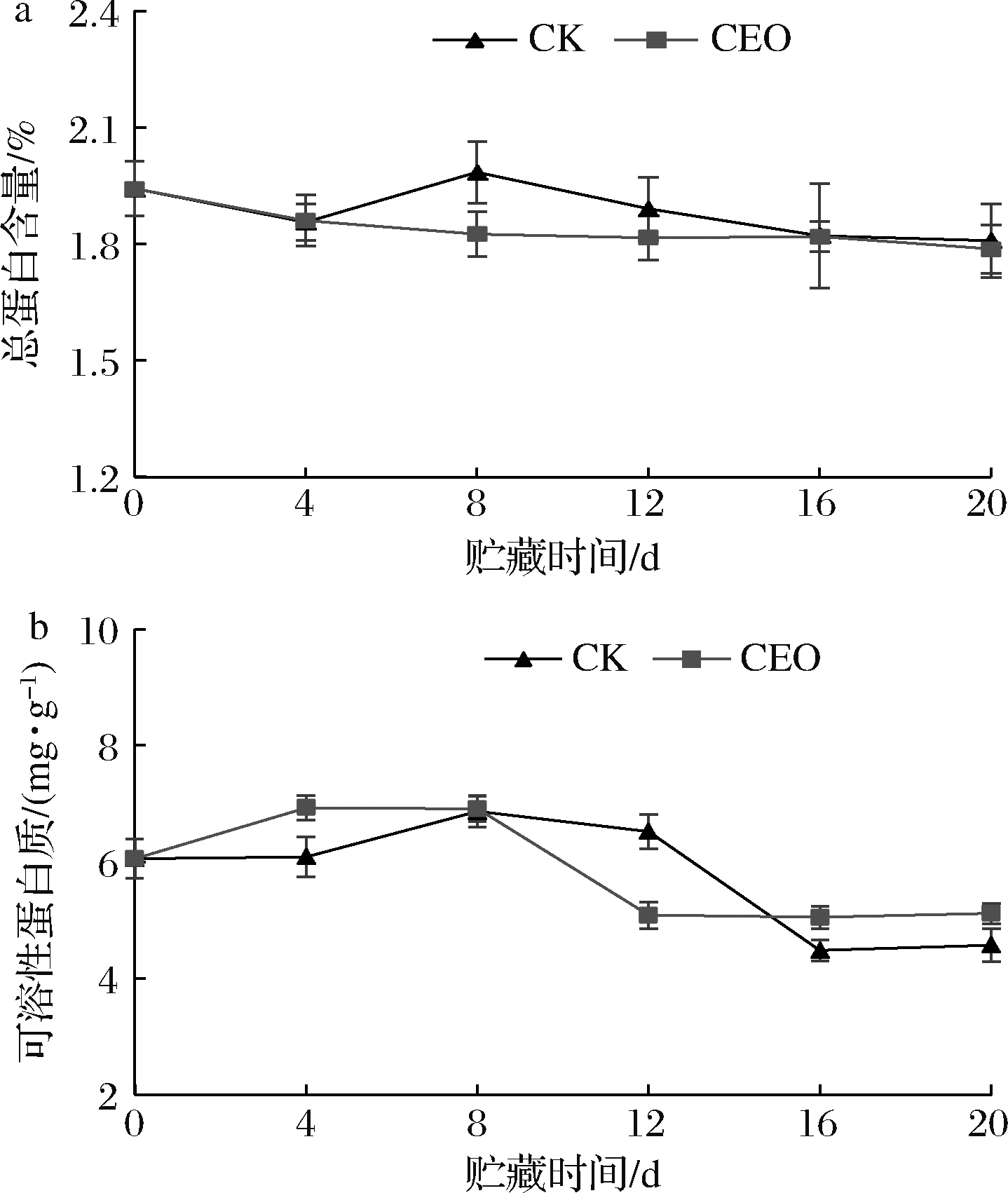
a-总蛋白质;b-可溶性蛋白质
图8 香茅精油处理对马铃薯总蛋白质和可溶性
蛋白质含量的影响
Fig.8 Effect of citronella essential oil treatment on potato
total protein and soluble protein content
3 讨论与结论
采后香茅精油处理能有效抑制马铃薯发芽,贮藏第20天时,马铃薯的发芽率和发芽指数分别为15.00%和4.29%,而对照组为100.00%和30.00%。香茅精油使马铃薯块茎芽眼部分呈现黑色,在萌芽阶段破坏芽组织,延缓发芽时间。品质方面,香茅精油处理延缓了淀粉、可溶性蛋白质含量的下降,贮藏结束时,有效保持了马铃薯块茎的营养成分。香茅精油处理降低了还原糖的产生速率,减少还原糖的积累,使马铃薯在后续加工期间保持良好的色泽和品质。
马铃薯块茎萌芽需要能量,而这些能量大部分是由淀粉降解产生的。在马铃薯贮藏过程中,淀粉与还原糖遵循着可逆动态平衡,淀粉在淀粉磷酸化酶(starch phosphorylase,SP)作用下生成葡萄糖,经一系列反应最终形成蔗糖。蔗糖在蔗糖合成酶(sucrose synthase,SuSy)、尿苷二磷酸葡萄糖焦磷酸化酶(UDP glucose pyrophosphorylase,UGPase)、腺苷二磷酸葡萄糖焦磷酸化酶(ADP glucose pyrophosphorylase,AGPase)、淀粉合成酶(starch synthase,SS)作用下重新形成淀粉。除此之外,蔗糖在液泡转化酶作用下重新生成果糖和葡萄糖。香茅精油处理可减少总糖的消耗,使总糖保持较高的水平,贮藏结束时下降了7.63%。香茅精油处理延缓了马铃薯淀粉含量的下降,抑制了还原糖的产生速率,使还原糖含量保持在较低水平。对于糖组分来说,果糖和葡萄糖含量处于动态变化,总体来说呈现缓慢下降趋势,而蔗糖含量的下降趋势较明显,说明香茅精油明显加快了蔗糖的降解速度。
马铃薯块茎的休眠状态被打破后,蛋白质开始分解为氨基酸,以支持芽的发育和生长。LIU等[27]研究发现,差异表达蛋白质随着分生组织的再次生长而发生转移,最终导致马铃薯块茎休眠被打破。对于总蛋白和可溶性蛋白质来说,香茅精油处理可以维持总蛋白含量稳定,减少马铃薯总蛋白消耗;处理组可溶性蛋白质含量在贮藏期结束时仍高于对照组,这表明香茅精油处理可以减缓可溶性蛋白质的消耗,延缓马铃薯衰老进程。本试验发现,香茅精油处理在贮藏前期使马铃薯块茎呼吸强度保持较高水平,伤口愈合后又迅速下降,并在贮藏后期抑制了马铃薯呼吸强度。
综上所述,香茅精油作为一种天然植物成分,除了具有良好的抑芽效果,还可使马铃薯保持良好的商品价值,这为开发新型安全马铃薯抑芽剂提供了新的选择。另外,马铃薯萌芽过程中,香茅精油对糖代谢的影响较大,而对蛋白质代谢的影响较小,但其具体的生理生化及分子机制还需进一步研究。
[1] 黄强, 舒婷, 刘小龙, 等.马铃薯的营养价值概述[J].现代食品, 2018(16):58-59.
HUANG Q, SHU T, LIU X L, et al.Overview of the nutritional value of potato[J].Modern Food, 2018(16):58-59.
[2] 张千友, 王万疆, 廖武霜.马铃薯主粮化与产业开发研究综述[J].西昌学院学报(自然科学版), 2016, 30(2):1-5;10.
ZHANG Q Y, WANG W J, LIAO W S.The review of the researches on the promotion and industrialization of potatoes as the staple food[J].Journal of Xichang College (Natural Science Edition), 2016, 30(2):1-5;10.
[3] CAMPBELL M, SEGEAR E, BEERS L, et al.Dormancy in potato tuber meristems:Chemically induced cessation in dormancy matches the natural process based on transcript profiles[J].Functional & Integrative Genomics, 2008, 8(4):317-328.
[4] CHENG S H, SU Z H, XIE C H, et al.Effects of variation in activities of starch-sugar metabolic enzymes on reducing sugar accumulation and processing quality of potato tubers[J].Journal of Integrative Agriculture, 2004, 3(7):519- 527.
[5] 吴明阳, 李万明, 丁大杰, 等.马铃薯抑芽药剂研究进展[J].中国马铃薯, 2019, 33(3):184-188.
WU M Y, LI W M, DING D J, et al.Research progress of potato sprout growth inhibitor[J].Chinese Potato Journal, 2019, 33(3):184-188.
[6] PAUL V, EZEKIEL R, PANDEY R.Sprout suppression on potato:Need to look beyond CIPC for more effective and safer alternatives[J].Journal of Food Science and Technology, 2016, 53(1):1-18.
[7] 卢锟, 龚吉军.植物精油对采后农产品抑菌作用的研究进展[J].保鲜与加工, 2021, 21(7):136-141.
LU K, GONG J J.Research progress of antimicrobial property of plant essential oils on postharvested agricultural products[J].Storage and Process, 2021, 21(7):136-141.
[8] ADORJAN B, BUCHBAUER G.Biological properties of essential oils:An updated review[J].Flavour and Fragrance Journal, 2010, 25(6):407-426.
[9] G MEZ-CASTILLO D, CRUZ E, IGUAZ A, et al.Effects of essential oils on sprout suppression and quality of potato cultivars[J].Postharvest Biology and Technology, 2013, 82:15-21.
MEZ-CASTILLO D, CRUZ E, IGUAZ A, et al.Effects of essential oils on sprout suppression and quality of potato cultivars[J].Postharvest Biology and Technology, 2013, 82:15-21.
[10]  ANL
ANL A, KARADO
A, KARADO AN T.Carvone containing essential oils as sprout suppressants in potato (Solanum tuberosum L.) tubers at different storage temperatures[J].Potato Research, 2019, 62(3):345-360.
AN T.Carvone containing essential oils as sprout suppressants in potato (Solanum tuberosum L.) tubers at different storage temperatures[J].Potato Research, 2019, 62(3):345-360.
[11] 叶旭. 三种植物精油对马铃薯贮藏保鲜效应的研究[D].雅安:四川农业大学, 2015.
YE X.Research on potatoes storage effect of three plant essential oils[D].Ya’ an:Sichuan Agricultural University, 2015.
[12] 涂勇, 刘川东, 姚昕.3种植物精油对马铃薯青薯9号贮藏效果的影响[J].现代农业科技, 2020(2):208-209;211.
TU Y, LIU C D, YAO X.Effects of three plant essential oils on storage effect of potato Qingshu 9[J].Modern Agricultural Science and Technology, 2020(2):208-209;211.
[13] 杨辉祥, 黄小芹, 潘磊, 等.香茅精油的抑菌和抗氧化活性研究[J].亚热带植物科学, 2021, 50(2):92-95.
YANG H X, HUANG X Q, PAN L, et al.Antibacterial and antioxidant activities of citronella essential oil[J].Subtropical Plant Science, 2021, 50(2):92-95.
[14] 梁芸志, 季丽丽, 陈存坤, 等.臭氧、1 MCP和乙烯吸收剂组合处理对番茄保鲜效果的影响[J].食品工业科技, 2018, 39(11):275-280;286.
LIANG Y Z, JI L L, CHEN C K, et al.Combined effects of ozone, 1-MCP and ethylene absorbent on the quality of tomato preservation[J].Science and Technology of Food Industry, 2018, 39(11):275-280;286.
[15] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Experimental Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:ChinaLight Industry Press, 2007.
[16] HU R F, LIN L, LIU T J, et al.Reducing sugar content in hemicellulose hydrolysate by DNS method:A revisit[J].Journal of Biobased Materials and Bioenergy, 2008, 2(2):156-161.
[17] TERRY L A, CHOPE G A, BORDONABA J G.Effect of water deficit irrigation and inoculation with Botrytis cinerea on strawberry (Fragaria x ananassa) fruit quality[J].Journal of Agricultural and Food Chemistry, 2007, 55(26):10 812-10 819.
[18] 谷瑶, 曾永明, 陈松武, 等.K12A全自动凯氏定氮仪测定核桃蛋白质含量[J].农产品加工, 2020(24):46-48.
GU Y, ZENG Y M, CHEN S W, et al.Study on determination of walnuts protein by K12A automatic Kjeldahl apparatus[J].Farm Products Processing, 2020(24):46-48.
[19] 田世平, 罗云波, 王贵禧.园艺产品采后生物学基础[M].北京:科学出版社, 2011.
TIAN S P, LUO Y B, WANG G X.Postharvest Biological Basis of Horticultural Products[M].Beijing:Science Press, 2011.
[20] 田甲春, 田世龙, 程建新, 等.贮藏温度对马铃薯品质和采后生理的影响[J].保鲜与加工, 2017, 17(3):16-20.
TIAN J C, TIAN S L, CHENG J X, et al.Impact of storage temperature on quality and postharvest physiology of potato tubers[J].Storage and Process, 2017, 17(3):16-20.
[21] 石瑛, 秦昕, 卢翠华, 等.不同马铃薯品种贮藏期间还原糖及干物质的变化[J].中国马铃薯, 2002, 16(1):16-18.
SHI Y, QIN X, LU C H, et al.Changes of reducing sugar and dry matter in different potato varieties during storage[J].Chinese Potato, 2002, 16(1):16-18.
[22] 杨明, 包媛媛, 张新永, 等.不同贮藏温度对云薯105马铃薯生理品质的影响[J].江苏农业科学, 2020, 48(5):189-193.
YANG M, BAO Y Y, ZHANG X Y, et al.Influences of different storage temperature on physiological quality of potato cultivar “Yunshu 105”[J].Jiangsu Agricultural Sciences, 2020, 48(5):189-193.
[23] 司怀军, 戴朝曦, 田振东, 等.贮藏温度对马铃薯块茎还原糖含量的影响[J].西北农业学报, 2001, 10(1):22-24.
SI H J, DAI Z X, TIAN Z D, et al.Effect of storage temperature on reducing sugar content in potato tubers[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2001, 10(1):22-24.
[24] 宋明, 杨博, 沈永宝, 等.香椿种子萌发初始阶段物质代谢的研究[J].江苏林业科技, 2021, 48(3):24-28.
SONG M, YANG B, SHEN Y B, et al.Matter metabolism of Toona sinensis seeds at initial germination stage[J].Journal of Jiangsu Forestry Science & Technology, 2021, 48(3):24-28.
[25] 刘容, 韦云伊, 孙卫东, 等.UV-C照射与壳聚糖涂膜保鲜处理对鲜切淮山营养品质的影响[J].食品研究与开发, 2021, 42(5):65-70.
LIU R, WEI Y Y, SUN W D, et al.Influence on the nutritional quality of fresh-cut Chinese yam with preservation process by UV-C irradiation and chitosan coating[J].Food Research and Development, 2021, 42(5):65-70.
[26] 杨建文. 马铃薯块茎抗低温糖化相关基因差减文库的构建[D].武汉:华中农业大学, 2006.
YANG J W.Constructing the subtractive cDNA library about the cold sweetening resistance related-genes of potato (S.berthaultii)[D].Wuhan:Huazhong Agricultural University, 2006.
[27] LIU B L, ZHANG N, ZHAO S, et al.Proteomic changes during tuber dormancy release process revealed by iTRAQ quantitative proteomics in potato[J].Plant Physiology and Biochemistry, 2015, 86:181-190.