我国西北地区的羊肉具有高蛋白、低脂肪、氨基酸和矿物质含量高等特点[1]。羊肉串因独特的色香味和高营养价值受到消费者的喜爱[2]。然而,羊肉串在烤制过程中容易产生多环芳烃(polycyclic aromatic hydrocarbons,PAHs)和杂环胺等有毒有害物质。PAHs是由两个或两个以上芳香环构成的烃类物质,作为重要的环境和食品污染物,其具有强致畸、致癌和致突变作用,能够引起生物体多个器官的癌变[3]。欧盟委员会国际癌症研究机构、欧洲食品安全局、美国有毒物质与疾病登记机构和我国国标将16种PAHs列为优先控制致癌物[4-6]。
目前,食品中检测PAHs的方法有HPLC和GC-MS法。GC-MS检测时,样品需要气化处理,气化时高温会引起目标物分解的可能,而HPLC可在室温下进行,避免了高温引起目标物分解的可能,且有较高的灵敏性、重现性以及准确度[6-8]。目前,白雪[6]建立一种HPLC法同时测定烤羊肉中5种硝基多环芳烃的方法,能够快速准确地测定5种强“三致”硝基多环芳烃的含量;姜三群[2]建立了HPLC-荧光检测器检测碳烤羊肉串中苯并芘的含量;王春蕾等[11]运用HPLC-紫外/荧光检测方法,能够准确检测熏肉制品中15种PAHs;而我国GB 5009.265—2016《食品中多环芳烃的测定》中规定了用液相色谱法测定食品中15种PAHs,并没有涉及对苊烯的检测[5]。
综上,关于烤羊肉串中16种PAHs的检测方法国内外研究报道较少,该试验用HPLC-荧光检测器串联二级阵列管检测器,通过系统优化前处理条件,建立16种PAHs的检测方法,以便为羊肉串中PAHs控制研究奠定理论基础。
1 材料与方法
1.1 材料与试剂
烤羊肉串,市售;PAHs标准品:苯并[a]芘[benzo(a)pyrene, BaP]、苯并[k]荧蒽[benzo(k)fluoranthene, BkF]、苯并[a]蒽[benzo(a)anthracene, BaA]、苯并[b]荧蒽[benzo(b)fluoranthene, BbF]、![]() (chrysene, Ch)、芘(pyrene, P)、荧蒽(fluoranthene, Fl)、萘(naphthalene, Na)、苊烯(acenaphthylene, Ace)、苊(acenaphthene, Ac)、芴(fluorene, F)、菲(phenanthrene, Phe)、蒽(anthracene, A)、苯并[g, h, i]苝[benzo(g, h, i)perylene, BgP]、茚并[1, 2, 3-c, d]芘[indeno(1, 2, 3-c, d)pyrene, IP]和二苯并[a, h]蒽[dibenzo(a, h)anthracene, DhA],纯度均>98%,常州市坛墨质检科技股份有限公司;二氯甲烷、乙腈、正己烷、环己烷、乙酸乙酯(均为色谱纯),DIKMA公司;Florisil弗罗里硅土固相萃取柱、C18反相固相萃取柱、多环芳烃分子印迹柱(polycyclic aromatic hydrocarbons molecularly imprinted column,PAH-MIP)、PCX混合型阳离子固相萃取柱,陕西艾杰尔有限公司。
(chrysene, Ch)、芘(pyrene, P)、荧蒽(fluoranthene, Fl)、萘(naphthalene, Na)、苊烯(acenaphthylene, Ace)、苊(acenaphthene, Ac)、芴(fluorene, F)、菲(phenanthrene, Phe)、蒽(anthracene, A)、苯并[g, h, i]苝[benzo(g, h, i)perylene, BgP]、茚并[1, 2, 3-c, d]芘[indeno(1, 2, 3-c, d)pyrene, IP]和二苯并[a, h]蒽[dibenzo(a, h)anthracene, DhA],纯度均>98%,常州市坛墨质检科技股份有限公司;二氯甲烷、乙腈、正己烷、环己烷、乙酸乙酯(均为色谱纯),DIKMA公司;Florisil弗罗里硅土固相萃取柱、C18反相固相萃取柱、多环芳烃分子印迹柱(polycyclic aromatic hydrocarbons molecularly imprinted column,PAH-MIP)、PCX混合型阳离子固相萃取柱,陕西艾杰尔有限公司。
1.2 仪器与设备
Agilent 1260 Infinity Ⅱ HPLC(配有二极管阵列检测器和荧光检测器),Agilent SB C18柱(4.6 mm×250 mm,5 μm)、EV C18(50 mm×2.1 mm,4 μm)、symmetry R C18(4.6 mm×250 mm,5 μm)和AQ C18(4.6 mm×250 mm,5 μm)色谱柱,美国Agilent公司;FSH-2A型可调高速匀浆机,宁波新芝生物科技股份有限公司;RE52CS旋转蒸发仪,上海亚荣生化仪器厂;N-20多功能氮吹仪,长春乐镤科技有限公司;KQ-500E型超声波清洗器(500 W,40 kHz),昆山市超声仪器有限公司;HX202T型电子天平,慈溪市天东衡器厂;TGL-16MC型台式高速冷冻离心机,湖南湘仪集团;FCR1000-UF-E超纯水机,上海和泰仪器有限公司。
1.3 试验方法
1.3.1 标准溶液的配制
PAHs储备液的配制:用乙腈分别将16种PAHs标准品溶解于50 mL棕色容量瓶,配成不同浓度的标准储备溶液。
单标溶液的配制:移取适量的PAHs储备液,配制成16种50 ng/mL的等质量浓度单标溶液;
PAHs混标溶液的配制:移取适量PAHs储备液,配制成4 000 ng/mL的等质量浓度PAHs中间液,准确移取16种PAHs储备液各0.1 mL,配制成100 ng/mL的混标溶液,用乙腈稀释成质量浓度分别为1、5、10、20、50 ng/mL的混标溶液。所有标准溶液置于-18 ℃环境中储藏。
1.3.2 样品前处理条件优化
1.3.2.1 超声波辅助萃取时间的选择
称取市售碳烤羊肉串3 g(精确到0.001 g),匀浆样品置于50 mL离心管中,再加入1 mL 30 μg/mL PAHs混标溶液,提取溶剂为20 mL 乙腈和 10 mL乙腈饱和正己烷,设置固相萃取柱为Florisil,洗脱剂为二氯甲烷,洗脱剂体积为11 mL,考察超声波辅助时间(10、20、30、40、50 min)对PAHs回收率的影响,筛选出最佳时间。
1.3.2.2 固相萃取柱的选择
样品预处理同上,设置超声萃取时间为30 min,洗脱剂为二氯甲烷,洗脱剂体积为11 mL,考察固相萃取柱(Florisil、PAH-MIP、C18、PCX)对PAHs回收率的影响,筛选出最佳固相萃取柱。
1.3.2.3 洗脱剂种类的选择
样品预处理同上,设置超声波萃取时间为30 min,固相萃取柱为PAH-MIP,洗脱剂为11 mL,考察洗脱剂[正己烷-二氯甲烷(30∶70,体积比,下同)、环己烷、二氯甲烷、正己烷-二氯甲烷(50∶50)、乙酸乙酯]对PAHs回收率的影响,筛选出最佳洗脱剂。
1.3.2.4 洗脱剂体积的选择
样品预处理同上,设置超声波萃取时间为30 min,固相萃取柱为PAH-MIP,洗脱剂为正己烷-二氯甲烷(30∶70),考察洗脱剂体积(5、7、9、11、13 mL)对PAHs回收率的影响,筛选出最佳洗脱剂体积。
1.3.3 样品前处理
根据王冲[8]的方法稍作修改。提取:称取羊肉串肉样3 g(精确至0.001 g),置于50 mL棕色离心管a中,加入10 mL乙腈饱和正己烷(乙腈饱和的正己烷溶液的配制:量取400 mL正己烷,加入100 mL乙腈,摇匀后静置,上层为乙腈饱和正己烷)和20 mL乙腈溶液匀浆,在40 ℃水浴下超声波辅助萃取30 min,在4 500 r/min冷冻(4 ℃)离心30 min,用移液枪将乙腈层移取到50 mL棕色离心管b中,将20 mL乙腈加入棕色离心管a中复提一次,吸取乙腈提取液合并到棕色离心管b中,用100 mL梨形烧瓶将棕色离心管b中的提取液在35 ℃下旋转蒸发至近干,加入6 mL正己烷复溶,涡旋振荡溶解。
净化:先用5 mL二氯甲烷活化PAH-MIP,再用10 mL正己烷平衡PAH-MIP,将6 mL正己烷提取样液转移到PAH-MIP中,用6 mL正己烷洗涤离心管b,并将洗涤液注入萃取柱中,用9 mL正己烷-二氯甲烷(30∶70)洗脱萃取柱,在10 mL试管c中收集所有洗脱液,氮吹(30 ℃)至有机溶剂全部挥发,加入1 mL乙腈涡旋振荡,用0.22 μm油系滤膜过滤,制得上机待测液。
1.3.4 仪器分析条件
色谱柱:Agilent SB C18(4.6 mm×250 mm,5 μm);流动相为乙腈和水;进样量5 μL,流速0.8 mL/min,柱温30 ℃,根据出峰种类和峰的分离度优化梯度洗脱程序。检测器:荧光检测器和二级阵列管检测器串联。
1.3.5 方法的线性范围、检出限和定量限测定
在最优的测定方法下,对1.3.1配制的5种混标溶液(1、5、10、20、50 ng/mL)进行测定,横坐标为各混标的质量浓度,纵坐标为PAHs的峰面积,绘制标准曲线;检出限用3倍信噪比(S/N=3)确定,定量限用10倍信噪比(S/N=10)确定。
1.3.6 回收率和精密度测定
称取3 g市售羊肉串肉样,分别添加2、5、20 ng/mL混标溶液,按照1.3.3进行样品前处理,再进行上机分析,每个添加水平重复测定6次,计算肉样中回收率及精密度,即相对标准偏差(relative standard deviation,RSD)。
1.3.7 实际肉样检测方法
3种不同来源的市售烤羊肉串(每种来源的羊肉串各做3个平行肉样),用1.3.3前处理方法进行提取和纯化,用HPLC检测。
1.3.8 数据处理
采用HPLC自带的软件对峰面积进行积分处理。用SPSS 20.0对数据进行显著性分析(P<0.05),用Origin 2017作图,每组试验重复3次。
2 结果与分析
2.1 色谱柱的选择
反相色谱柱是HPLC分析中最常用的柱子,该试验选取了Agilent SB C18柱(4.6 mm×250 mm,5 μm)、EV C18(50 mm×2.1 mm,4 μm)、symmetry R C18(4.6 mm×250 mm,5 μm)和AQ C18(4.6 mm×250 mm,5 μm)色谱柱,对比4种不同规格色谱柱对16种PAHs分离效果和出峰情况,结果显示,EV C18、symmetry R C18和AQ C18色谱柱响应值低、出峰种类少和峰形分离不彻底,Agilent SB C18柱具有良好的分离效果,可供检测16种PAHs。
2.2 梯度洗脱条件和检测波长的选择
水和乙腈的不同比例直接影响PAHs的分离度和出峰时间。该试验中,Ch和BaA、F和Ac、BbF和BkF分离度不高,经过优化,在5~25 min时,水相在27%~25%时,Ch和BaA及其他分离度不高的PAHs能够较好的分离,具体洗脱程序见表1。Ace无荧光性,用二极管阵列检测器在 230 nm 处测定Ace,其他15种PAHs荧光检测波长见表2。在该梯度洗脱程序下,16种PAHs能够较好分离。
表1 HPLC 流动相洗脱梯度
Table 1 HPLC mobile phase elution gradient
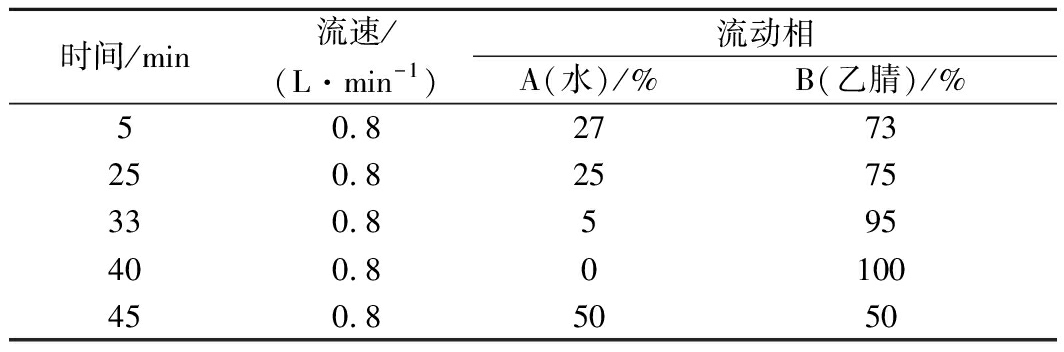
时间/min流速/(L·min-1)流动相A(水)/%B(乙腈)/%50.82773250.82575330.8595400.80100450.85050
表2 HPLC 荧光检测梯度
Table 2 HPLC fluorescence detection gradient
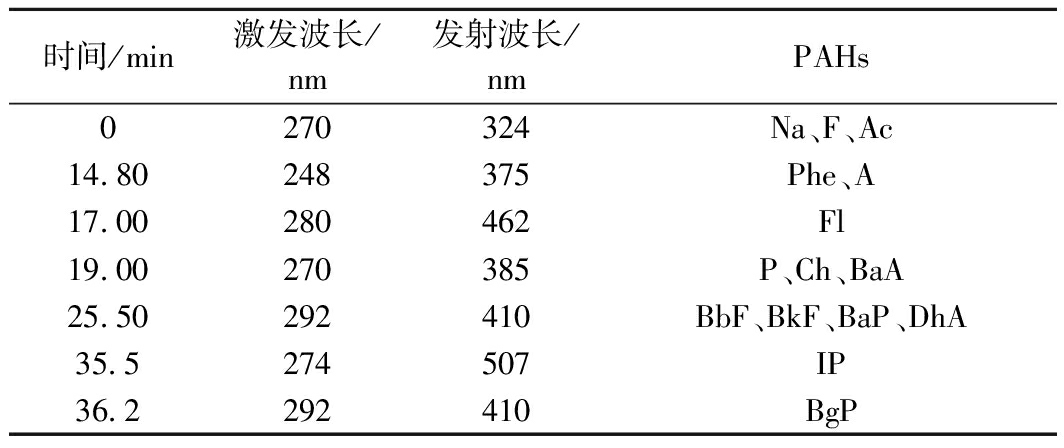
时间/min激发波长/nm发射波长/nmPAHs0270324Na、F、Ac14.80248375Phe、A17.00280462Fl19.00270385P、Ch、BaA25.50292410BbF、BkF、BaP、DhA35.5274507IP36.2292410BgP
2.3 超声波辅助萃取时间的选择
超声波时间对PAHs的提取也有着至关重要的影响,时间过短,导致萃取不完全,从而影响样品检测;时间过长,容易使低分子质量(2~3个苯环)的PAHs组分挥发而损失[12-13]。如图1所示,超声时间为10 min和20 min时,回收率略低于30 min,其原因可能是超声波时间较短,肉中PAHs未完全被提取出来;超声波时间为40 min和50 min时,回收率为56.96%~67.86%和52.26%~63.74%,显著低于30 min时的回收率,其原因可能是超声波时间过长,低分子质量的PAHs挥发损失,造成回收率低;超声波时间在30 min时,PAHs回收率最高,为63.65%~74.49%,因此选30 min作为前处理超声波萃取时间。

图1 不同超声波时间对PAHs回收率的影响
Fig.1 Effect of different ultrasonic time on
the recovery rate of PAHs
注:不同字母表示不同处理间差异显著(P<0.05)(下同)
2.4 固相萃取柱的选择
固相萃取柱可以达到净化和富集的双重功效,固相萃取柱填料种类不同,对PAHs有不同的吸附效果[14]。由图2可知,Florisil萃取柱回收率为62.5%~73.4%,显著低于PAH-MIP;PCX萃取柱和C18萃取柱对出峰前期低分子质量的PAHs有较高的回收率,但对Ch等高分子质量(4~6个苯环)PAHs回收率较低,其原因可能是萃取柱填充物质对高分子质量的PAHs吸附能力不强;PAH-MIP萃取柱回收率显著高于其他固相萃取柱,回收率为77.9%~91.9%,能够对PAHs特异性吸附,因此选择PAH-MIP萃取柱为前处理固相萃取柱。

图2 不同固相萃取柱对PAHs回收率的影响
Fig.2 Effects of different solid phase extraction
columns on the recovery of PAHs
2.5 洗脱剂种类的选择
PAHs属于非极性或极性较弱的碳氢化合物,洗脱剂的种类对PAHs的回收率有显著的影响[11],目前PAH-MIP萃取柱多用二氯甲烷作为洗脱剂,二氯甲烷单独洗脱时,能够显著阻止脂肪进入待测样品中,但二氯甲烷对PAHs的洗脱效率较低[5,14-15]。如图3所示,乙酸乙酯和环己烷洗脱效果显著低于正己烷-二氯甲烷(30∶70,体积比,下同);二氯甲烷单独洗脱时,回收率为77.94%~91.71%,但PAHs回收率显著低于正己烷-二氯甲烷(30∶70);正己烷-二氯甲烷(50∶50)对低分子质量的PAHs回收率较高,但对大部分高分子质量的PAHs回收率较低,且整体PAHs回收率显著低于正己烷-二氯甲烷(30∶70);洗脱剂为正己烷-二氯甲烷(30∶70)时,PAHs回收率最高,回收率为84.97%~103.82%,能够很好地从PAH-MIP萃取柱中将PAHs洗脱下来,因此选择正己烷-二氯甲烷(30∶70)为PAH-MIP的洗脱剂。
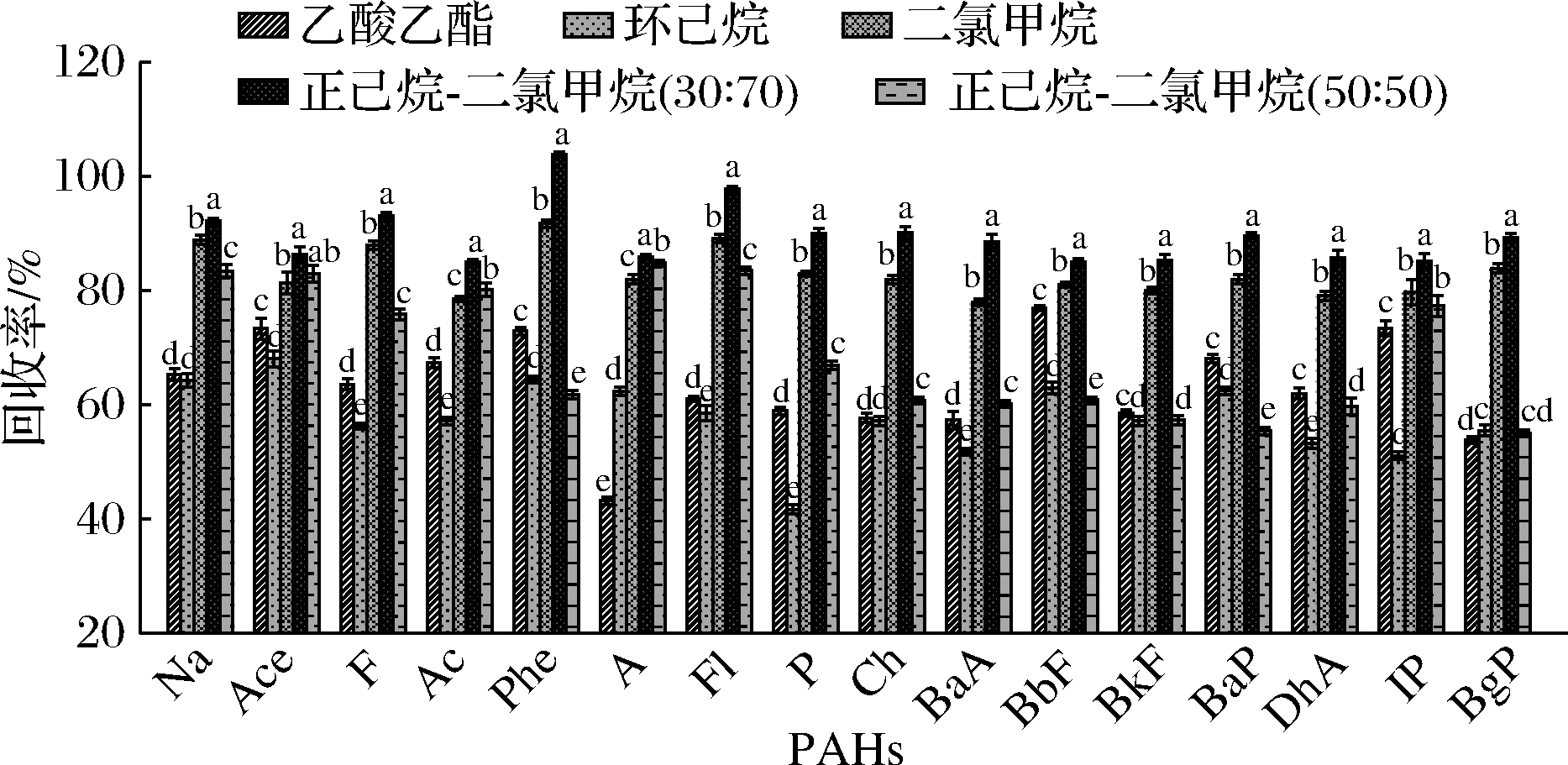
图3 不同洗脱剂种类对PAHs回收率的影响
Fig.3 Effects of different eluents on the recovery of PAHs
2.6 洗脱剂体积的选择
固相萃取过程中,洗脱剂的体积往往直接影响目标化合物的洗脱效果,洗脱剂体积少容易造成洗脱不彻底,降低PAHs的回收率,但体积过高也会导致稀释效应,浓缩时也容易贴壁浪费,导致回收率降低[17]。如图4所示,当洗脱剂正己烷-二氯甲烷(30∶70)体积为5 mL和7 mL时,PAHs回收率显著低于9 mL时,其原因可能是洗脱体积少而造成洗脱不彻底,从而使PAHs回收率低;洗脱剂体积为11 mL时,回收率略低于9 mL,其原因可能由于稀释效应不明显;当洗脱剂体积为13 mL时,回收率显著低于9 mL,稀释效应明显。洗脱剂体积为9 mL时,PAHs回收率高于其他各体积,回收率为85.21%~105.74%,因此选9 mL正己烷-二氯甲烷(30∶70)为最优洗脱体积。
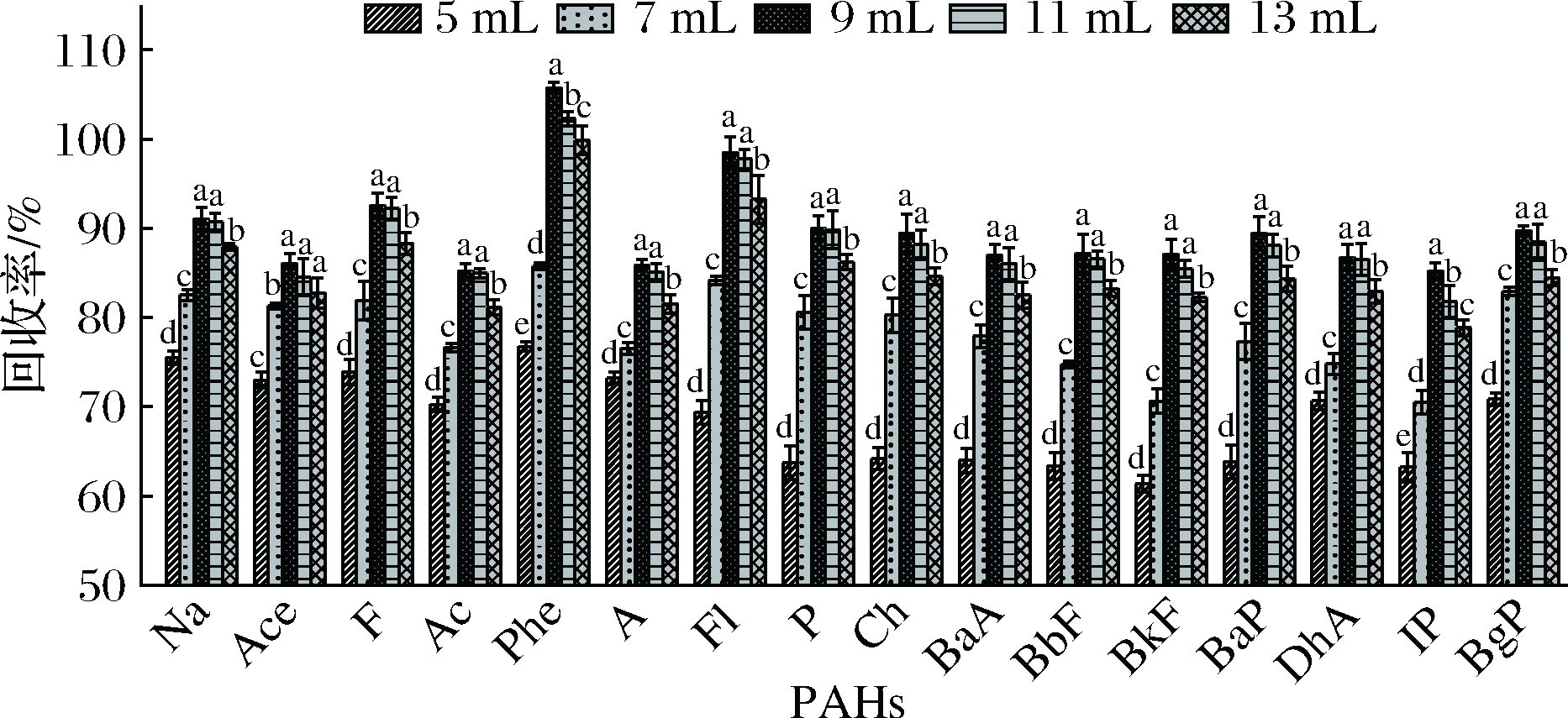
图4 不同洗脱剂体积对PAHs回收率的影响
Fig.4 Effects of different volumes of N-hexane∶dichloromethane
(30∶70) on the recovery of PAHs
2.7 线性范围、检出限和定量限
如表3所示,16种PAHs在1~50 ng/mL线性范围内均呈良好的线性关系,相关系数均大于0.99,方法检出限为0.33~3.30 μg/kg,定量限为1.0~10.0 μg/kg,能够满足16种PAHs的检测分析。
2.8 回收率和精密度
如表4所示,经过3个加标检测分析(2、5、20 ng/mL),目标物回收率在81.23%~101.1%,RSD为0.95%~5.84%,试验方法回收率高且精密度良好,能够满足烤羊肉串中16种PAHs的检测要求。
表3 16种PAHs方法学参数
Table 3 Methodological parameters of 16 PAHs
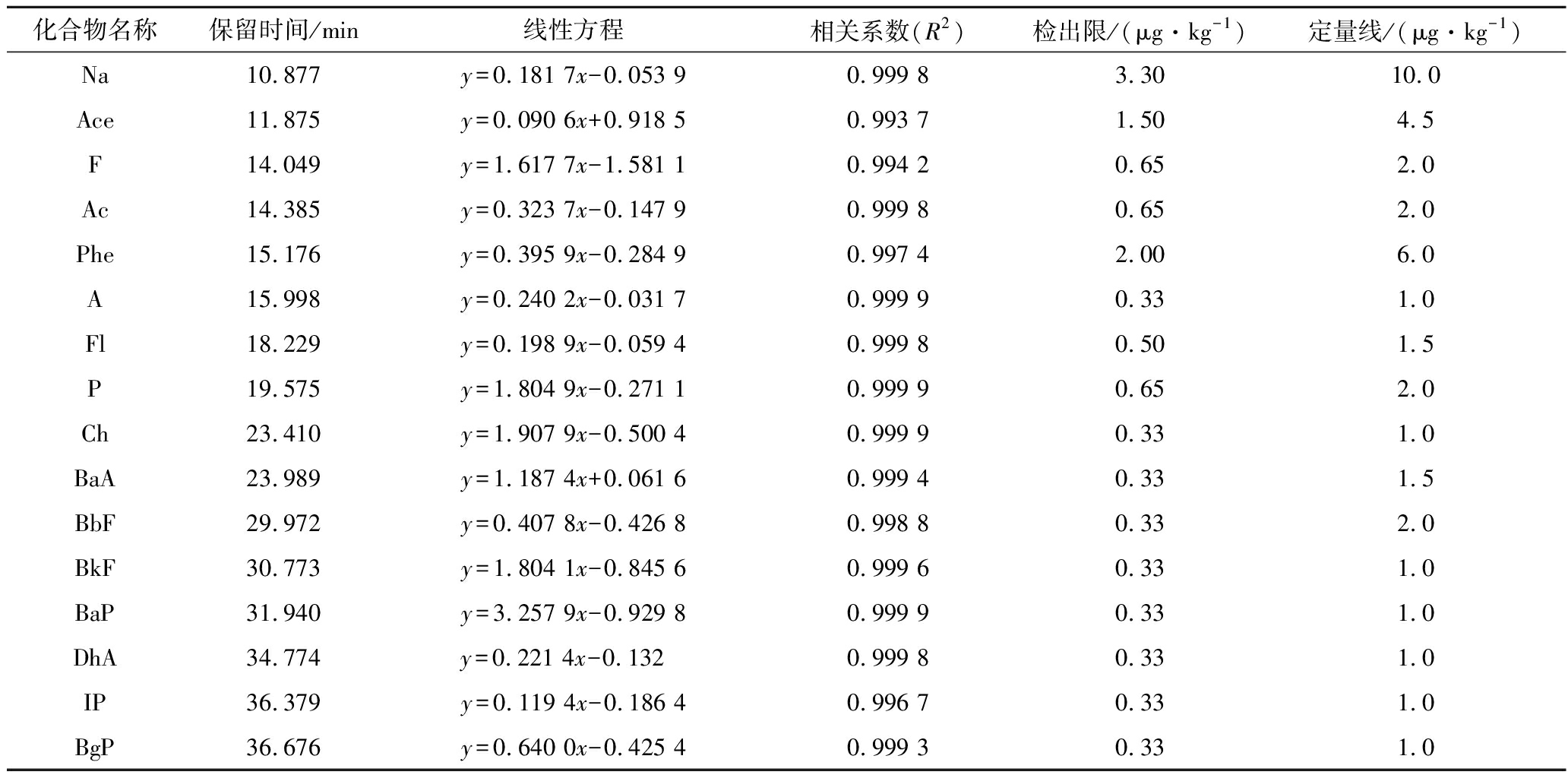
化合物名称保留时间/min线性方程相关系数(R2)检出限/(μg·kg-1)定量线/(μg·kg-1)Na10.877y=0.181 7x-0.053 90.999 83.3010.0Ace11.875y=0.090 6x+0.918 50.993 71.504.5F14.049y=1.617 7x-1.581 10.994 20.652.0Ac14.385y=0.323 7x-0.147 90.999 80.652.0Phe15.176y=0.395 9x-0.284 90.997 42.006.0A15.998y=0.240 2x-0.031 70.999 90.331.0Fl18.229y=0.198 9x-0.059 40.999 80.501.5P19.575y=1.804 9x-0.271 10.999 90.652.0Ch23.410y=1.907 9x-0.500 40.999 90.331.0BaA23.989y=1.187 4x+0.061 60.999 40.331.5BbF29.972y=0.407 8x-0.426 80.998 80.332.0BkF30.773y=1.804 1x-0.845 60.999 60.331.0BaP31.940y=3.257 9x-0.929 80.999 90.331.0DhA34.774y=0.221 4x-0.132 0.999 80.331.0IP36.379y=0.119 4x-0.186 40.996 70.331.0BgP36.676y=0.640 0x-0.425 40.999 30.331.0
表4 目标物的平均回收率和RSD(n=6)
Table 4 Average recovery and relative standard
deviation of target compounds (n=6)

化合物名称加标量2 ng/mL加标量5 ng/mL加标量20 ng/mL平均回收率RSD平均回收率RSD平均回收率RSDNa87.955.6790.534.4391.623.24Ace84.123.1285.452.7787.141.43F89.422.1494.011.6392.960.95Ac82.372.4381.751.6484.681.24Phe94.042.2295.701.65101.011.12A82.772.7584.382.1685.281.34Fl87.211.5693.161.2398.590.97P83.852.2788.841.7490.701.22Ch84.253.2387.092.6589.121.55BaA82.373.2482.122.6486.251.46BbF81.233.2581.722.4484.791.27BkF81.562.5682.222.0284.741.03BaP85.771.7387.191.4589.450.87DhA81.843.7484.422.4385.021.25IP84.783.6585.842.2284.641.56BgP84.265.8486.105.1588.382.40
2.9 实际样品检测
采用上述优化的方法,对市售3种来源的羊肉串检测PAHs含量,结果如表5所示,16种PAHs只有Ch、BaA、BkF、BaP和IP没有检出,其余PAHs均有检出。3份烤羊肉串样品中的16种PAHs总含量最低为127.59 μg/kg,最高为200.23 μg/kg。
表5 不同来源烤羊肉串中PAHs的含量 单位:μg/kg
Table 5 Content of PAHs in kebabs from different sources

化合物名称烤羊肉串1烤羊肉串2烤羊肉串3Na65.03±1.2355.10±1.1378.23±1.45AceND3.81±0.452.21±0.23FND23.52±0.87NDAc7.62±0.434.53±0.2412.05±0.32Phe30.65±0.7612.46±0.446.25±0.33A48.71±0.8669.67±1.242.26±0.32FlND19.64±0.676.84±0.23P5.31±0.375.62±0.384.18±0.34ChNDNDNDBaANDNDNDBbF2.11±0.171.77±0.141.88±0.15BkFNDNDNDBaPNDNDNDDhA2.97±0.131.87±0.322.26±0.16IPNDNDNDBgP11.35±0.262.24±0.3311.43±0.25总PAHs173.75200.23127.59
注:ND为未检出
3 结论
该试验通过高效液相色谱-荧光检测器-二级阵列管检测器建立了烤羊肉串中16种PAHs含量的检测方法,该方法净化效果好、灵敏度高、定量准确性高,能满足烤羊肉串中PAHs的检测要求,为今后烤羊肉串中PAHs的形成规律以及控制研究提供理论基础。
[1] 黄文颖. 青海牧区高寒草甸草地放牧藏羊肉品质分析[J].肉类研究, 2015, 29(5):10-12.
HUANG W Y.Meat quality of Tibetan sheep grazed in alpine meadows in Qinghai Province[J].Meat Research, 2015, 29(5):10-12.
[2] 姜三群. 羊肉串烤制中品质和有害物质变化规律及影响因素的研究[D].乌鲁木齐:新疆农业大学, 2014.
JIANG S Q.Studies on quality, harmful substances and influence factors of mutton shashlik in the baking[D].Urumqi:Xinjiang Agricultural University, 2014.
[3] 屠泽慧, 聂文, 王尚英, 等.烧烤及烟熏肉制品中多环芳烃的迁移、转化与控制研究进展[J].肉类研究, 2017, 31(8):49-54.
TU Z H, NIE W, WANG S Y, et al.Migration, transformation and control of polycyclic aromatic hydrocarbons in grilled and smoked meat products:A review[J].Meat Research, 2017, 31(8):49-54.
[4] 刘聪聪, 王冲, 叶可萍, 等.加工肉制品中多环芳烃的研究现状[J].中国食品学报, 2021, 21(2):367-377.
LIU C C, WANG C, YE K P, et al.Research status of polycyclic aromatic hydrocarbons (PAHs) in processed meat products[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(2):367-377.
[5] 阳文武, 谭顺中, 郭娅, 等.多环芳烃分子印迹柱-高效液相色谱荧光检测法快速测定烤肉中15种多环芳烃[J].肉类研究, 2018, 32(11):47-52.
YANG W W, TAN S Z, GUO Y, et al.Determination of 15 polycyclic aromatic hydrocarbons in barbecued meat by molecularly imprinted solid-phase extraction combined with high performance liquid chromatography-fluorescence detection[J].Meat Research, 2018, 32(11):47-52.
[6] 白雪. 烤羊肉中多环芳烃形成及抑制研究[D].西安:陕西科技大学, 2021.
BAI X.Study on the formation and inhibition of PAHs in roasted lamb[D].Xi’an:Shaanxi University of Science and Technology, 2021.
[7] 潘红. 烤肉中多环芳烃的检测[D].无锡:江南大学, 2009.
PAN H.Detection of polycyclic aromatic hydrocarbons in roast meat[D].Wuxi:Jiangnan University, 2009.
[8] 王冲. 酚类化合物对烤鸡中多环芳烃形成的影响及缓解细胞损伤机制研究[D].南京:南京农业大学, 2019.
WANG C.Effects of phenolic compounds on PAHs formation in grilled chicken and it’s mechanism of alleviating cell damage[D].Nanjing:Nanjing Agricultural University, 2019.
[9] 王惠源. 多酚腌制辅助烧烤对烤翅中多环芳烃生成的影响[D].南京:南京农业大学, 2019.
WANG H Y.Effect of polyphenol marinating on the formation of polycyclic aromatic hydrocarbons in grilled chicken wings[D].Nanjing:Nanjing Agricultural University, 2019.
[10] 邵琪. 烤肉中4种多环芳烃检测方法的筛选及其应用的研究[D].哈尔滨:黑龙江东方学院, 2019.
SHAO Q.Screening and application of 4 polycyclic aromatic hydrocarbons detection methods in grilled meat[D].Harbin:East University of Heilongjiang, 2019.
[11] 王春蕾, 刘华良, 马永建, 等.在线固相萃取-高效液相色谱法检测食用油中15+1种欧盟优控多环芳烃[J].分析化学, 2015, 43(11):1 743-1 748.
WANG C L, LIU H L, MA Y J, et al.Determination of 15+1 European priority polycyclic aromatic hydrocarbons in edible oil by online solid phase extraction and high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry, 2015, 43(11):1 743-1 748.
[12] 颜常盛, 许鹏, 齐玲, 等.超声协同GC/MS测定土壤中的多环芳烃[J].化学研究与应用, 2021, 33(6):1 051-1 057.
YAN C S, XU P, QI L, et al.Determination of polycyclic aromatic hydrocarbons in soil by GC/MS combined with ultrasonic extraction[J].Chemical Research and Application, 2021, 33(6):1 051-1 057.
[13] 安长伟, 贾思齐, 杨悦锁, 等.超声提取-气相色谱法测定土壤中多环芳烃(PAHs)的实验研究[J].应用化工, 2017, 46(3):597-600.
AN C W, JIA S Q, YANG Y S, et al.Study on PAHs in soils by ultrasonic extraction and gas chromatography[J].Applied Chemical Industry, 2017, 46(3):597-600.
[14] 钟冬莲, 喻宁华, 王玫鹃,等.分子印迹固相萃取-气相色谱-串联质谱法测定茶油中16种多环芳烃[J].中国油脂,2022,47(10):118-123;129.
ZHONG D L, YU N H, WANG M J, et al.Determination of 16 polycyclic aromatic hydrocarbons in camellia oil using molecularly imprinted solid-phase extraction coupled with GC-MS/MS[J].China Oil and Fats, 2022,47(10):118-123;129.
[15] 彭姚珊, 李永利, 陈鹰, 等.气相色谱-同位素稀释质谱法测定肉中多环芳烃含量[J].食品科学, 2019, 40(12):321-325.
PENG Y S, LI Y L, CHEN Y, et al.Determination of 16 polycyclic aromatic hydrocarbons in meat samples by gas chromatography-isotope dilution mass spectrometry approach[J].Food Science, 2019, 40(12):321-325.
[16] 葛文娜, 王玉芳.固相萃取-高效液相色谱法测定烤肉中的14种多环芳烃[J].预防医学论坛, 2021, 27(3):232-235.
GE W N, WANG Y F.Determination of 14 polycyclic aromatic hydrocarbons in roast meat by solid phase extraction and high performance liquid chromatography[J].Preventive Medicine Tribune, 2021, 27(3):232-235.
[17] 陈曼. 基于功能化锂皂石的磁固相萃取法在多环芳烃检测中的应用[D].保定:河北大学, 2021.
CHEN M.Application of magnetic solid phase extraction method based on functionalized laponite in the detection of polycyclic aromatic hydrocarbons[D].Baoding:Hebei University, 2021.
[18] 齐颖. 油炸肉制品加工过程中多环芳烃的形成及控制研究[D].天津:天津科技大学, 2015.
QI Y.Study of formation and inhibition of polycyclic aromatic hydrocarbons during the process of frying meat products[D].Tianjin:Tianjin University of Science and Technology, 2015.
[19] 朱易. 肉制品无甲醛无3,4-苯并芘液熏技术研究[D].南京:南京农业大学, 2013.
ZHU Y.Study on the liquid smoking technology of smoked meats without formaldehyde and benzo(a)pyrene[D].Nanjing:Nanjing Agricultural University, 2013.
[20] 屠泽慧. 香辛料与照射处理对熏肠多环芳烃含量及品质的影响[D].合肥:合肥工业大学, 2018.
TU Z H.Effect of spice and irradiation on the content of polycyclic aromatic hydrocarbons and the quality of the smoked sausages[D].Hefei:Hefei University of Technology, 2018.
[21] FANG Z X, ZHAO Y Y, WARNER R D, et al.Active and intelligent packaging in meat industry[J].Trends in Food Science & Technology, 2017, 61:60-71.
[22] JANOSZKA B.HPLC-fluorescence analysis of polycyclic aromatic hydrocarbons (PAHs) in pork meat and its gravy fried without additives and in the presence of onion and garlic[J].Food Chemistry, 2011, 126(3):1 344-1 353.