奶酪是鲜牛奶经过发酵之后得到的产物,含有丰富的蛋白质、维生素、钙、脂肪和磷等营养物质,因其口味醇厚而深受广大消费者青睐。但奶酪在其成熟和贮存期间,部分蛋白质在酶的作用下降解生成游离氨基酸,随后氨基酸在脱羧酶分解和催化作用下产生了生物胺[1-3]。组胺由组氨酸在微生物作用下生成[4],是奶酪等发酵食品中广泛存在的一种生物胺。组胺在奶酪中的含量最高可达2 500 mg/kg[5-6]。摄入高浓度的组胺,会使人产生头晕呕吐、呼吸紊乱等不良反应,甚至会因大脑出血导致死亡[7-8]。因此,奶酪发酵过程中产生的组胺与人体的健康息息相关,检测奶酪中的组胺含量具有重要意义。
食品中生物胺的检测较为困难,主要原因在于基质复杂、存在干扰物及多种生物胺的共存性较差。人们日常食用的发酵乳制品、肉类、水产类食品给生物胺形成提供了理想环境[9],同时这类食品富含蛋白质和脂肪为生物胺检测增加了难度。对于基质较为复杂的样品,其前处理在生物胺检测前起着至关重要的作用,关系到生物胺检测结果的准确性。目前食品样品中生物胺的前处理方法主要有液液萃取法[10]和固相萃取法[11],但二者均耗时冗长、操作繁琐、消耗大量有机试剂,在样品分析领域具有一定的局限性。近年来电膜萃取(electromembrane extraction,EME)技术作为一种新颖前处理方法,广泛运用于药物、环境分析方面,并逐渐向食品和饮料检测领域扩展[12-14]。电膜萃取是GJELSTAD等[15]提出的以电势差为驱动力,促使离子化待测物通过支撑液膜发生快速的定向移动,实现选择性萃取的前处理方法。支撑液膜是电膜萃取能否实现的关键因素,目前最常用的支撑液膜是将具有微孔结构的中空纤维浸润在有机溶剂中制成的液态膜。但纤维膜浸润及有机溶剂去除过程繁琐复杂。同时高电压萃取以及萃取过程中水解导致的温度升高等情况都易导致液态膜的脱落[16],影响待测物的传质效果。ASADI等[17]以固态的聚丙烯酰胺凝胶薄膜提取母乳和废水中的碱性药物,在萃取过程中膜的稳定性较液膜有显著提高,有效降低了膜脱落现象的发生,固态凝胶膜制备简单,无需有机试剂,且可通过调整浓度进而控制膜孔径尺寸,根据待测物质的结构大小灵活调整膜孔径,能有效提高待测物质的萃取效率。但目前尚未见到以聚丙烯酰胺凝胶薄膜为支撑液膜萃取生物胺的报道。
组胺在酸性条件下以阳离子形式存在,可以在电场驱动下定向移动。本文针对现有生物胺前处理技术不足的发展现状,利用上述原理,以聚丙烯酰胺凝胶薄膜为支撑膜,优化萃取条件,建立了电膜萃取-高效液相色谱检测组胺的方法,以期为食品中生物胺的快速检测提供技术支撑。
1 材料与方法
1.1 材料与试剂
卡萨奶酪粉(配料:牛奶、食盐、凝乳酶)购于上海嘉定区食品批发市场。组胺(≥99%)、丹磺酰氯(≥99%),美国Sigma-Aldrich公司;三氯乙酸(trichloroacetic acid,TCA,99.0%)、浓盐酸(36%~38%)、氨水、NaHCO3、NaOH、过硫酸铵(ammonium persulfate,APS)、丙酮(99%)、乙酸乙酯(色谱纯),上海国药化学试剂公司;丙烯酰胺、N,N′-甲叉双丙烯酰胺、四甲基乙二胺(tetramethylethylenediamine,TEMED),上海麦克林生化科技公司;甲醇(色谱纯)、乙腈(色谱纯),德国默克公司;所有化学试剂均为分析纯及以上级别,实验用水为双蒸水。
1.2 仪器与设备
Waters e2695高效液相色谱仪,美国沃特世公司;IKA color squid磁力搅拌器,德国IKA公司;QL-866旋涡混合器,海门其林贝尔仪器制造有限公司;KQ-400KDE型高功率数控超声波清洗器,昆山市超声仪器有限公司;台式离心机,赛默飞世尔科技公司;GM-0.33A隔膜真空泵,天津市津腾实验设备有限公司;伯乐电泳仪,美国伯乐公司;铂丝电极(0.5 mm×37 mm),武汉高仕睿联科技有限公司;0.45 μm微孔过滤膜,上海国药化学试剂公司;0.22 μm一次性针头过滤器,上海阿拉丁生化科技股份有限公司。
1.3 聚丙烯酰胺凝胶支撑膜的制备
在文献[17]的基础上稍作改进合成聚丙烯酰胺凝胶膜,称取适量丙烯酰胺和N,N′-甲叉双丙烯酰胺溶于100 mL超纯水中,在4 ℃下避光保存。于5 mL离心管中加入2 mL上述溶液,再依次加入1.6 mL超纯水、50 μL APS、6 μL TEMED,涡旋混匀后迅速取200 μL混合液于底部封闭的载体室中,静置20 min,待胶完全凝固后,避光保存。
1.4 电膜萃取装置的搭建
电膜萃取装置由伯乐电泳仪、L型铂丝电极、样品室、接受相载体室、磁力搅拌器构成。在整个萃取过程中,电泳仪作为电源提供电驱动力,正负铂丝电极的一端分别置于样品室和载体室中,另一端则与电泳仪相连,从而构成完整回路。装置示意图如图1所示。
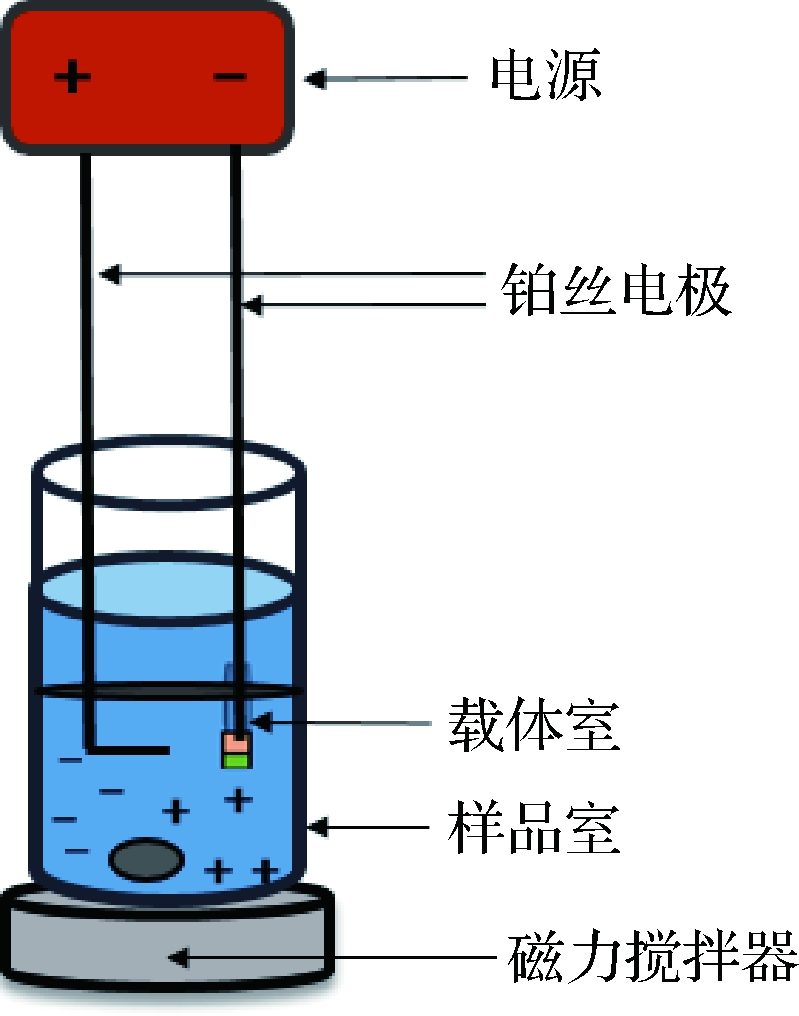
图1 电膜萃取装置图
Fig.1 Schematic illustration of EME device
1.5 电膜萃取
称取磨碎后的奶酪样品5 g(精确到0.000 1 g)于50 mL离心管中,加入35 mL 50 g/L TCA+0.1 mol/L HCl溶液(V/V=1∶2.5),涡旋振荡30 s,超声提取5 min,于 9 000 r/min下离心5 min,取离心后的上清液,经0.45 μm微孔滤膜抽滤,得到澄清透明的样液,作为供体相溶液。取5 mL供体相溶液于25 mL玻璃烧杯中,将600 μL HCl溶液作为接受相溶液加入固定有聚丙烯酰胺凝胶薄膜的载体室中,随后将载体室固定在烧杯中部的环形玻璃板上。L型铂丝电极则分别插入样品室和载体室中,样品室连接正极,载体室连接负极,调节电极距离为3 cm。整个萃取装置置于磁力搅拌器上,电压设置为45 V,时间为5 min,在电场力的驱动下,供体相溶液中的组胺以阳离子形式通过聚丙烯酰胺凝胶支撑膜进入接受相溶液。萃取完成后,立刻收集接受相溶液,以高效液相色谱法进行检测。
1.6 电膜萃取条件优化
供体相种类优化:称取5 g奶酪,分别加入35 mL 50 g/L TCA+0.1 mol/L HCl、2 g/L乙酸铅+1 g/L TCA、2 g/L乙酸铅+0.1 mol/L HCl,其他条件保持不变,电膜萃取完成后,高效液相色谱法测定组胺含量。
供体相体积优化:称取5 g奶酪,以35 mL 50 g/L TCA+0.1 mol/L HCl初步提取后,得到约33 mL上清液,分别取30、20、10、5 mL加入样品室,其他条件保持不变,电膜萃取完成后测定组胺含量。
接受相种类优化:50 g/L TCA+0.1 mol/L HCl初步提取得到的溶液作为供体相溶液,分别以0.5 mol/L HCl、0.2 mol/L PB、100 g/L TCA为接受相溶液,体积为0.6 mL,其他条件保持不变,进行电膜萃取实验,测定萃取完成后接受相溶液中的组胺含量。
接受相浓度优化:以HCl溶液为接受相溶液,浓度分别设置为0.08、0.5、0.8 mol/L,其他条件保持不变,进行电膜萃取实验,测定萃取得到的组胺含量。
萃取电压优化:在电压分别为25、35、45、55 V条件下进行电膜萃取实验,时间为5 min,其他条件保持不变,萃取结束后测定接受相溶液中的组胺含量。
萃取时间优化:在45 V电压条件下进行电膜萃取实验,时间分别设置为1、3、5、7 min,其他条件保持不变,进行萃取实验,萃取完成后,以液相法测定接受相溶液中的组胺含量。
1.7 高效液相色谱分析
1.7.1 仪器分析条件
色谱柱:Hypeisil ODS柱(150 mm×4.6 mm,5 μm);紫外检测波长:254 nm;室温35 ℃,流速0.8 mL/min;进样量20 μL,每次进样前的平衡时间为30 min。流动相A为:90%乙腈/10%乙酸铵(含0.1%乙酸的0.01 mol/L乙酸铵溶液);B相为10%乙腈/90%乙酸铵(含0.1%乙酸的0.01 mol/L乙酸铵溶液)。梯度洗脱程序(A相):0~15 min,60%~85%;15~18 min,85%~100%;18~23 min,100%~60%;23~25 min,60%。
1.7.2 组胺标准溶液配制
准确称取组胺标准品10 mg,置于10 mL容量瓶中,用0.5 mol/L HCl溶液稀释至刻度,配制成1 000 mg/L的组胺标准储备液,置于-20 ℃冰箱中储存备用。实验使用的不同质量浓度组胺标准溶液均由标准储备液稀释得到。
1.7.3 衍生化条件
取250 μL样品或某一浓度的组胺标准溶液,用0.5 mol/L HCl溶液稀释4倍后,依次加入1 mL饱和NaHCO3溶液、100 μL NaOH溶液(0.1 mol/L)、1 mL丹磺酰氯(10 mg/mL,溶剂为丙酮),涡旋混匀后于60 ℃水浴锅中衍生15 min,取出加入100 μL氨水,振荡混匀后,再次于60 ℃下水浴15 min,取出后放置一段时间待冷却到室温加入1 mL超纯水,振荡1 min后N2除去丙酮(约1 mL),加入0.5 g NaCl,振荡5 min至NaCl完全溶解,再加入6 mL乙酸乙酯,涡旋均匀后静置10 min,将上层有机相转移至15 mL离心管中,下层水相再萃取1次,合并2次乙酸乙酯溶液,在40 ℃条件下N2吹干,加入1 mL乙腈复溶,0.22 μm滤膜针头过滤器过滤。
1.7.4 线性范围、检测限
用0.5 mol/L HCl溶液对组胺标准溶液进行稀释,配制成系列梯度浓度的标准液,衍生化后采用高效液相色谱法对其进行测定,以不同组胺的浓度为横坐标,以组胺峰面积值为纵坐标,绘制标准曲线,对其进行线性拟合,求得线性方程和相关线性系数。
1.8 富集倍数的计算
根据萃取前后溶液中含有的组胺浓度,计算组胺的富集倍数[18],计算如公式(1)所示:
富集倍数![]()
(1)
式中:cf,萃取后接受相所含的组胺质量浓度,mg/L;ci,萃取前供体相样品中所含的组胺质量浓度,mg/L。
1.9 数据处理
实验数据用平均值±标准偏差表示,采用Origin 8.5软件进行数据处理及绘图。
2 结果与讨论
2.1 电膜萃取前后接受相溶液的色谱分析
以高效液相色谱法对奶酪样品进行测定,所得色谱图如图2所示。
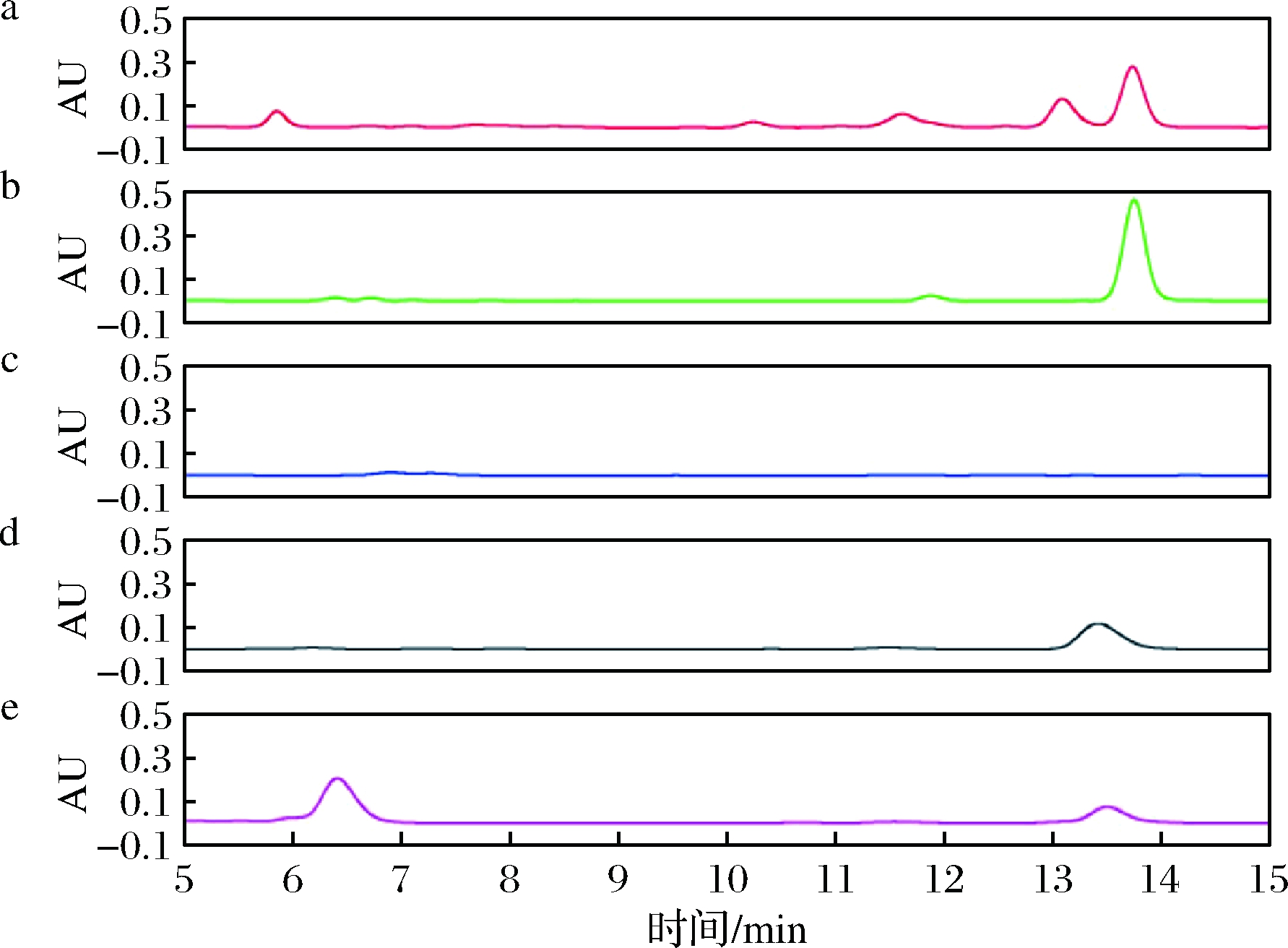
a-供体相溶液;b-组胺标准溶液(50 g/L TCA+0.1 mol/L HCl);
c-萃取前的接受相溶液;d-组胺标准溶液(0.5 mol/L HCl);
e-萃取后的接受相溶液
图2 组胺色谱图
Fig.2 The chromatograms of histamine
比较萃取前后的接受相溶液色谱图,结果表明,在电场力的驱动下,组胺成功地被萃取到了接受相溶液中。并且图2-a中供体相溶液中有较多的杂质峰和背景音,而经过电膜萃取得到的接受相溶液(图2-e),杂峰的数量明显减少,在一定程度上实现了对样品的净化。
2.2 萃取条件优化
对影响电膜萃取的因素进行优化,以接受相中的组胺含量(mg/L)为衡量指标,探究最适合组胺萃取的供体相种类和体积、接受相种类及浓度、萃取电压与时间,结果如图3所示。

a-供体相种类;b-供体相体积;c-接受相种类;d-接受相浓度;e-萃取电压;f-萃取时间
图3 电膜萃取条件的优化
Fig.3 Optimization of EME conditions
电膜萃取必需条件之一是目标物质以离子形式存在[19]。生物胺为有机碱小分子,在酸性溶液下以阳离子形式存在。因此选用酸试剂初步提取奶酪中的组胺,萃取结果如图3-a所示,0.1 mol/L HCl溶液对奶酪中生物胺的提取效果相对较好。这可能是由于乙酸铅和三氯乙酸更多作用于沉淀蛋白质,相较于盐酸,萃取能力较弱,因此,本方法采用50 g/L TCA+0.1 mol/L HCl作为提取剂。
比较不同供体相体积对电膜萃取组胺富集倍数的影响,在其他条件保持不变的情况下,将供体相的体积设置为5~30 mL,比较接受相溶液中的组胺含量,如图3-b所示,随着供体相体积的增加,接受相中组胺含量明显下降。奶酪制品不同于酸奶和牛奶,Na+浓度较高,在电场力驱动下,会对组胺的移动产生干扰。供体相体积越大,其中富含的盐离子量就越多,在一定程度上影响组胺从供体相向接受相移动,综合考虑,选择5 mL作为电膜萃取的供体相体积。
目标物质组胺在电场力的驱动下从供体相迁移到接受相溶液,从而达到富集和减少基质干扰的效果。接受相的种类影响组胺的迁移量。当目标物质为阳离子形式时,接受相的选择要满足以下条件[20]:(1)接受相为酸性溶液;(2)接受相的pH要小于供体相的pH,从而减弱H+向接受相溶液移动。如图3-c所示,以盐酸为接受相溶液得到的组胺含量明显高于PB溶液(0.2 mol/L,pH 2.5)和100 g/L TCA溶液。为了得到尽可能高的萃取效率,选择盐酸作为接受相溶液。
电膜萃取理论模型[21]中提出萃取效率与样品溶液及接受相的离子强度成反比。因此接受相中的离子强度高于供体相溶液往往能有效提高萃取效率。图3-d中探究了不同浓度的盐酸溶液作为接受相得到的组胺含量,当盐酸浓度从0.08 mol/L增加到0.5 mol/L时,组胺浓度增加,但进一步增加盐酸浓度,萃取效率有所降低。因此将盐酸浓度定为0.5 mol/L。
电膜萃取的过程中,电压是影响目标物质迁移的重要因素。图3-e研究了在25~55 V电压下萃取组胺的效果,结果表明在25~45 V,随着电压增加,接受相中的组胺浓度随之增加,但当电压超过45 V时,萃取得到的组胺含量反而下降。这可能是因为电压过高会加剧电解水反应,从而导致接受相溶液中的pH发生改变[22],影响传质过程,水电解反应式为式(2):
2H2O→4H++O2+4e- (正极)
2H2O+2e-→2OH-+H2 (负极)
(2)
研究表明萃取时间与电压是相互影响的,较高电压所需萃取时间较短,但高电压可能会导致液膜脱落,从而使萃取过程失败,若选用的电压较低,则需要增加萃取时间才能达到同样的萃取效果。为获得一个较为温和的实验条件,避免电解水过程中大量气泡的生成,影响目标物质的迁移,本试验探究了在不同时间条件下对萃取效果的影响,如图3-f所示,将萃取时间设置为7 min萃取组胺的效果较好,但电膜萃取过程中伴随电解水现象,时间越长,电解水产生大量气泡会导致实验结果的稳定性较差,综合组胺萃取效果、实验稳定性因素将电压萃取时间设定为5 min。
2.3 电膜萃取-高效液相色谱方法的检出限和定量限
分别用不同浓度的组胺标准工作液进样,以质量浓度为横坐标(X),以组胺峰面积为纵坐标(Y),绘制标准曲线,得到线性方程及相关系数。以3倍信噪比作为检出限(limit of detection,LOD),10倍信噪比作为方法定量限(limit of quantitation,LOQ),测定结果表明目标物质在1~200 mg/L线性关系良好,回归方程为y=89 190x-21 193,方法的检出限为0.02 mg/L,定量限为0.1 mg/L。
2.4 样品富集倍数
取5 g磨碎后的奶酪样品于50 mL离心管中,分别添加5、10、20 mg/L 3个水平的组胺标准溶液,按1.5步骤进行萃取处理,1.7步骤进行衍生液相测定。每个加标浓度设置6个平行样品,根据1.8计算富集因子,如表1所示,3个加标浓度得到的富集因子稳定在1.7倍左右,相对标准偏差(relative standard deviation,RSD)为1.41%~5.71%,符合样品检测要求。
表1 实际样品的富集倍数及RSD(n=6)
Table 1 The enrichment factor and RSD (n=6)
in actual samples analysis
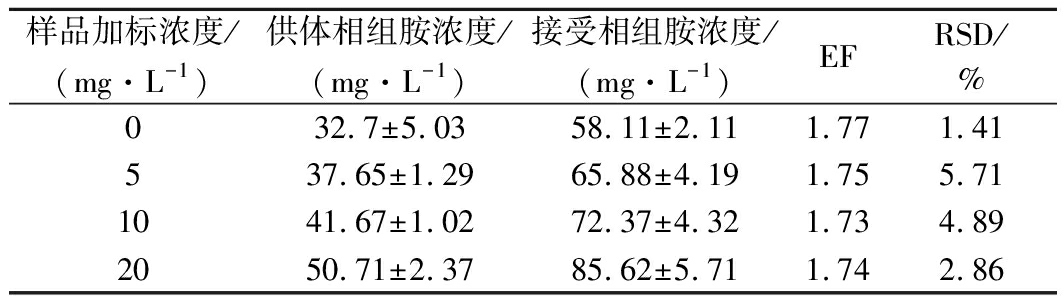
样品加标浓度/(mg·L-1)供体相组胺浓度/(mg·L-1)接受相组胺浓度/(mg·L-1)EFRSD/%032.7±5.0358.11±2.111.771.41537.65±1.2965.88±4.191.755.711041.67±1.0272.37±4.321.734.892050.71±2.3785.62±5.711.742.86
2.5 与国标方法的对比分析
根据GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》对奶酪样品进行前处理,与电膜萃取样品得到的结果进行比较,如表2所示,国标方法提取出的组胺含量与电膜萃取得到的组胺含量较为一致,RSD均小于6.55%。然而国标方法需经过酸提、除脂、液液萃取等步骤,耗时约4 h,以电膜萃取为前处理方法提取奶酪中的组胺仅需20 min,显著缩短了整个检测时间。
表2 国标法与电膜萃取法测定奶酪中组胺含量
Table 2 Comparison of national standard method
and EME-HPLC method in the determination of
histamine in cheese
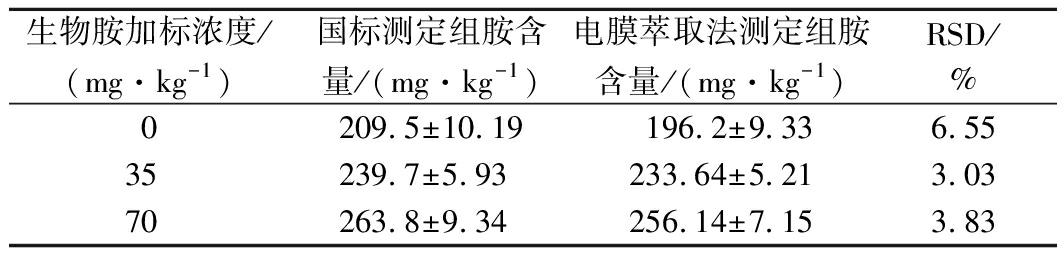
生物胺加标浓度/(mg·kg-1)国标测定组胺含量/(mg·kg-1)电膜萃取法测定组胺含量/(mg·kg-1)RSD/%0209.5±10.19196.2±9.336.5535239.7±5.93233.64±5.213.0370263.8±9.34256.14±7.153.83
3 结论
本文利用电膜萃取-高效液相色谱技术对奶酪中的组胺进行快速分析,在优化萃取条件的基础上,评估了对实际样品中组胺检测的可行性和准确性。整个前处理过程仅需20 min即可实现组胺的提取,富集倍数达到1.7倍。与国标方法相比,本方法显著缩短了前处理时间,操作简单,同时无需任何有机试剂,更适用于发酵乳制品中的组胺检测。适当延长萃取时间有利于提高目标物质的萃取效率,然而水电解现象的剧烈程度与萃取时间呈正相关,电解放热反应会使膜稳定性受到一定影响,如何在短时间内实现组胺的更高效提取,有待进一步研究。
[1] SUZZI G, TORRIANI S.Editorial:Biogenic amines in foods[J].Frontiers in Microbiology, 2015, 6:472.
[2] VALSAMAKI K, MICHAELIDOU A, POLYCHRONIADOU A.Biogenic amine production in Feta cheese[J].Food Chemistry, 2000, 71(2):259-266.
[3] NAM J H, CHO Y S, RACKERBY B, et al.Shifts of microbiota during cheese production:Impact on production and quality[J].Applied Microbiology and Biotechnology, 2021, 105(6):2 307-2 318.
[4] 金高娃, 蔡友琼, 于慧娟, 等.柱前衍生高效液相色谱法测定鱼罐头中的组胺[J].色谱, 2010, 28(11):1 099-1 102.
JIN G W, CAI Y Q, YU H J, et al.Determination of histamine in canned fish by high performance liquid chromatography with pre-column derivatization[J].Chinese Journal of Chromatography, 2010, 28(11):1 099-1 102.
[5] PAPAGEORGIOU M, LAMBROPOULOU D, MORRISON C, et al.Literature update of analytical methods for biogenic amines determination in food and beverages[J].TrAC Trends in Analytical Chemistry, 2018, 98:128-142.
[6] MADEJSKA A, MICHALSKI M, PAWUL-GRUBA M, et al.Histamine content in rennet ripening cheeses during storage at different temperatures and times[J].Journal of Veterinary Research, 2018, 62(1):65-69.
[7] 何璇, 马堃, 哈斯, 等.食品中生物胺形成与抑制的研究进展[J].食品与发酵工业, 2021, 47(18):294-300.
HE X, MA K, HA S, et al.Research progress on the formation and inhibition of biogenic amines in food[J].Food and Fermentation Industries, 2021, 47(18):294-300.
[8] 王光强, 俞剑燊, 胡健, 等.食品中生物胺的研究进展[J].食品科学, 2016, 37(1):269-278.
WANG G Q, YU J S, HU J, et al.Progress in research on biogenic amines in foods[J].Food Science, 2016, 37(1):269-278.
[9] SENTELLAS S, N
 EZ
EZ  , SAURINA J.Recent advances in the determination of biogenic amines in food samples by (U)HPLC[J].Journal of Agricultural and Food Chemistry, 2016, 64(11):7 667-7 678.
, SAURINA J.Recent advances in the determination of biogenic amines in food samples by (U)HPLC[J].Journal of Agricultural and Food Chemistry, 2016, 64(11):7 667-7 678.
[10] PAULO VIEIRA C, PEREIRA DA COSTA M, SILVA V L M, et al.Development and validation of RP-HPLC-DAD method for biogenic amines determination in probiotic yogurts[J].Arabian Journal of Chemistry, 2020, 13(1):1 582-1 597.
[11] GIL R L, AMORIM C G, MONTENEGRO M C B S M, et al.HPLC-potentiometric method for determination of biogenic amines in alcoholic beverages:A reliable approach for food quality control[J].Food Chemistry, 2022, 372:131288.
[12] SANTIGOSA-MURILLO E, MASPOCH S, MU OZ M, et al.An efficient microfluidic device based on electromembrane extraction for the simultaneous extraction of acidic and basic drugs[J].Analytica Chimica Acta, 2021, 1 160:338448.
OZ M, et al.An efficient microfluidic device based on electromembrane extraction for the simultaneous extraction of acidic and basic drugs[J].Analytica Chimica Acta, 2021, 1 160:338448.
[13] ABBASI S, HAERI S A.Enrichment of psychotropic drugs using rhamnolipid bioaggregates after electromembrane extraction based on an agarose gel using a rotating electrode as a green and organic solvent-free strategy[J].Journal of Chromatography A, 2021, 1 655:462500.
[14] KAMANKESH M, MOHAMMADI A, MOLLAHOSSEINI A, et al.Application of a novel electromembrane extraction and microextraction method followed by gas chromatography-mass spectrometry to determine biogenic amines in canned fish[J].Analytical Methods, 2019, 11(14):1 898-1 907.
[15] GJELSTAD A, RASMUSSEN K E, PEDERSEN-BJERGAARD S.Electrokinetic migration across artificial liquid membranes:Tuning the membrane chemistry to different types of drug substances[J].Journal of Chromatography A, 2006, 1 124(1-2):29-34.
[16] 魏欣,李青莲.电膜微萃取在样品前处理中的研究进展[J].药物分析杂志, 2017, 37(12):2 133-2 138.
WEI X, LI Q L.Research progress of electromembrane microextraction in the pretreatment of samples[J].Chinese Journal of Pharmaceutical Analysis, 2017, 37(12):2 133-2 138.
[17] ASADI S, TABANI H, NOJAVAN S.Application of polyacrylamide gel as a new membrane in electromembrane extraction for the quantification of basic drugs in breast milk and wastewater samples[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 151:178-185.
[18] ASADI S, NOJAVAN S, BEHPOUR M, et al.Electromembrane extraction based on agarose gel for the extraction of phenolic acids from fruit juices[J].Journal of Chromatography B, 2020, 1 159:122401.
[19] SAFARI M, NOJAVAN S, DAVARANI S S H, et al.Speciation of chromium in environmental samples by dual electromembrane extraction system followed by high performance liquid chromatography[J].Analytica Chimica Acta, 2013, 789:58-64.
[20] MIDDELTHON-BRUER T M, GJELSTAD A, RASMUSSEN K E, et al.Parameters affecting electro membrane extraction of basic drugs[J].Journal of Separation Science, 2008, 31(4):753-759.
[21] BALCHEN M, JENSEN H, REUBSAET L, et al.Potential-driven peptide extractions across supported liquid membranes:Investigation of principal operational parameters[J].Journal of Separation Science, 2010, 33(11):1 665-1 672.
[22] DROUIN N, KUB
 P, RUDAZ S, et al.Electromembrane extraction:Overview of the last decade[J].TrAC Trends in Analytical Chemistry, 2019, 113:357-363.
P, RUDAZ S, et al.Electromembrane extraction:Overview of the last decade[J].TrAC Trends in Analytical Chemistry, 2019, 113:357-363.