牛奶作为日常生活中最常见的乳品,以其较高的蛋白质含量在人们各个成长阶段中发挥着重要作用。牛奶蛋白中含量最高的是酪蛋白和乳清蛋白。牛酪蛋白包括β-酪蛋白(β-casein, β-CN)、αS1-酪蛋白(αS1-casein, αS1-CN)、αS2-酪蛋白(αS2-casein, αS2-CN)和κ-酪蛋白(κ-casein, κ-CN),其中β-CN含量接近40%,且具有遗传多样性[1],其会在被消化后形成较小的酪蛋白磷酸肽,酪蛋白磷酸肽可促进钙的吸收并与睡眠活动相关[2]。在已经发现的十几种β-CN的变异体中,最常见的是A1型和A2型。αS-酪蛋白(αS-casein, αS-CN)是牛乳中主要过敏原之一,主要组分为αS1-CN和αS2-CN,对αS-酪蛋白过敏的人群约占乳品过敏总数的65%左右[3]。κ-酪蛋白影响酪蛋白胶束的形成、大小和功能,同时具有抗菌活性、增加消化率等重要的生理学功能[4]。
牛乳清蛋白中主要含有α-乳白蛋白(α-lactalbumin, α-La)和β-乳球蛋白(β-lactoglobulin, β-Lg)[5]。α-La能够为发育中的新生儿提供蛋白质合成所必需的氨基酸,如色氨酸等,在促进婴儿生长发育的同时,具有免疫调节和促进大脑发育的作用[6]。成年人摄入α-La可以提高个体的认知能力、记忆力和睡眠质量,此外,α-La还是钙、镁、锰、钠、钾和锌的载体[7]。β-Lg是牛乳中具有天然防御功能的脂蛋白,经过胃酸和蛋白酶等消化后仍有部分保持完整的蛋白结构,因此也会造成一系列的过敏反应。同时,β-Lg是基本氨基酸和支链氨基酸的极好来源,并能够结合脂溶性维生素,增加其生物利用率[8]。
现在常用于检测酪蛋白和乳清蛋白主要组分的主要有电泳法[9-10]、酶联免疫吸附法[11-12]、高效液相色谱[13-15]和液相色谱-质谱联用法[16-18]等。通常前3种方法的单个样品检测需耗费大量时间,而液相色谱与质谱的联用大大缩短了检测时间,并一定程度提高了检测的精确度和灵敏性,使对牛奶中不同蛋白质的定量研究愈加方便准确。
本研究在BOBE等[19]建立的乳蛋白液相色谱测定方法的基础上优化了对牛奶样品的前处理方式,确定了有效色谱分离和质谱检测条件,在实现对牛奶中6种主要蛋白质定量检测的同时,通过解卷积分析对比观测质量数与理论质量数,可确认各个蛋白峰中包含的主要蛋白质亚型。
1 材料与方法
1.1 实验材料
标准品:κ-CN,αS-CN,β-CN,α-La,β-Lg,源叶生物公司;三羟甲基氨基甲烷(Tris Base)、盐酸胍(GdnHCl)、柠檬酸钠、dL-二硫苏糖醇(dithiothreitol,DTT)、三氟乙酸(trifluoroacetic acid,TFA),乙腈(acetonitrile,ACN),Sigma公司;超纯水(Milli-Q制备系统),美国Millipore公司。
1.2 实验仪器
1290-6546超高效液相色谱-四极杆飞行时间质谱仪,配备Dual AJS ESI源,美国Agilent公司;离心机,贝克曼库尔特美国股份有限公司;涡旋振荡器,其林贝尔仪器制造有限公司;一次性针管注射器,江苏治宇医疗器材有限公司;0.22 μm滤膜,北京汇科同创科学仪器有限公司。
1.3 样品收集
牛奶乳头奶样品分别采集于河北省、湖北省、黑龙江省和新疆维吾尔族自治区大型牧场,每个地区各选择6个样品,共24个样品。
1.4 试剂配制
流动相A:0.1%(体积分数,下同)TFA的水溶液;流动相B:0.1%TFA的乙腈溶液。
溶液A:根据定容体积,准确称(量)不同量的各试剂,使得最终混合溶液中含有17.5 mmol/L Tris Base缓冲液,6 mol/L GdnHCl的溶液,5.37 mmol/L柠檬酸钠,20 mmol/L DTT,溶液最终pH为7.92;溶液B:含有4.5 mol/L GdnHCl的流动相A,溶液pH为2.25。
1.5 样品前处理
样品前处理:1 mL溶液A在室温下加入到1 mL样品中,涡旋振荡10 s,室温下孵育1 h,之后在4 ℃下16 000×g离心5 min,去除脂肪层。残留液经溶液B以体积比1∶3稀释后,0.22 mm滤膜过滤,上样分析。
标准品前处理:标品蛋白质用超纯水溶解,分别配成质量浓度为40 mg/mL κ-CN,40 mg/mL αS-CN,40 mg/mL β-CN,20 mg/mL α-La,20 mg/mL β-Lg的标准储备溶液,储存在-20 ℃的冰箱中备用。将配好的标准品等体积混合,配制成混合标样溶液,之后操作步骤同牛乳样品预处理。在相同的前处理条件下,用超纯水代替样品制备溶剂作为对照。
1.6 色谱条件
使用安捷伦ZORBAX 300Extend-C18(2.1 mm×100 mm,300 A) 色谱柱,柱温40 ℃,流速0.3 mL/min;进样量1 mL。在6 min内使流动相B从30%升至40%,在6.1 min~16 min使流动相B从40%升至44%,后置平衡时间3 min。
1.7 质谱条件
干燥气温度200 ℃;干燥气流速8 L/min;雾化气压力30 psi;鞘气温度30 ℃;鞘气流速11 L/min;毛细管电压3 500 V;质量扫描范围m/z 50~3 200;采集速率2 spectra/s。
2 结果与分析
2.1 实验条件优化
以牛奶为研究对象,进行6种主要蛋白质的定量探究,使用GdnHCl作为变性剂,以打开蛋白质二级结构,使其中的氢键与流动相更好结合;使用DTT作为还原剂,用于还原蛋白质中的二硫键,并且阻止蛋白质分子内和分子间的二硫键生成。利用Tris base在pH 7.5~9.0较强的缓冲能力,以其作为缓冲剂来防止体系pH变化影响DTT的还原效果。
对乳蛋白的色谱分离通常采用水和乙腈作为流动相,在此基础上进行不同流动相组分、梯度、流速和进样量的对比,具体条件见表1。
表1 实验条件优化
Table 1 Optimization of experimental conditions

项目条件流动相0.1%(体积分数,下同) FA0.05% FA+0.05% TFA0.1% TFA流速/(mL·min-1)0.20.3梯度20%~30%~50% B30%~50% B30%~40%~44% B进样量/L0.51.01.5
为了减轻TFA对质谱的影响,使用甲酸(formic acid,FA)取代或部分取代TFA,但峰形较差,不能有效分离。TFA作为一种弱离子对试剂,能够起到改善峰宽和拖尾的问题,因此随着TFA的浓度逐渐上升,不同蛋白质峰的出峰情况和分离效果都得到改善。但由于TFA与质谱之间存在不兼容的情况,因此方法在得到较好的分离情况后,不再继续增加TFA的浓度,尽可能减轻对质谱造成的负担。
同时,实验对比了3种不同的流动相梯度洗脱程序,分析起始有机相(流动相B)比例与梯度变化速率对分离度的影响。先以20%有机相作为起始比例,发现蛋白质在洗脱程序的后半程(30%~50%,6.1~16 min)被集中洗脱,从而进一步选取蛋白质出峰的有机相比例范围(30%~50%,0~16 min)作为单线性梯度,此时部分蛋白峰不能实现有效的分离,出现拖尾、重叠、峰形较差的问题。在此基础上进行调整,采用了有机相比例从30%~40%(0~6 min)以及40%~44%(6.1~16 min)的两段线性梯度,以较高的有机相比例确保蛋白峰的分离度,同时又降低最终有机相的比例从而加快梯度变化,促进蛋白质的洗脱,使其具有良好的峰形。
方法使用的色谱柱内径为2.1 mm,在其适用流速的基础上,分析了0.2和0.3 mL/min的流速条件对峰型和分离度的影响,发现在0.3 mL/min的流速下,峰形相对较好、峰宽变小,但对于分离度不具有显著的影响。对进样量的优化结果显示,随着进样量的增加,峰高增加,但过大的进样量会使部分峰的分离效果变差、峰宽增加甚至可能出现色谱柱过载的问题,因此选择进样量1.0 mL,在保障良好的峰高和响应值的基础上确保良好的峰宽。基于以上研究,可在16 min内完成单个样品采集,如图1所示。

图1 牛奶中6种主要乳蛋白的总离子流图
Fig.1 Total ion chromatogram of six main proteins in milk
2.2 牛奶蛋白的定量
2.2.1 标准曲线建立
以超纯水为空白基质制作标准溶液,按照同样的样品前处理方法,在同一色谱及质谱条件下进行测定。以响应值与浓度建立6种蛋白质分别的标准曲线,结果见表2,各个蛋白质的线性相关系数r均在0.99以上,线性关系良好。
2.2.2 回收率、精密度、检出限和定量限
对牛奶样品进行6种蛋白质的3个水平加标回收率的检测验证,在各个水平重复3次,计算各个蛋白质分别在3个水平下的回收率以及平均回收率。如表3所示,牛奶蛋白质的平均加标回收率在92%~108%。
表2 六种蛋白质的标准曲线图
Table 2 Standard curve of six proteins in milk samples
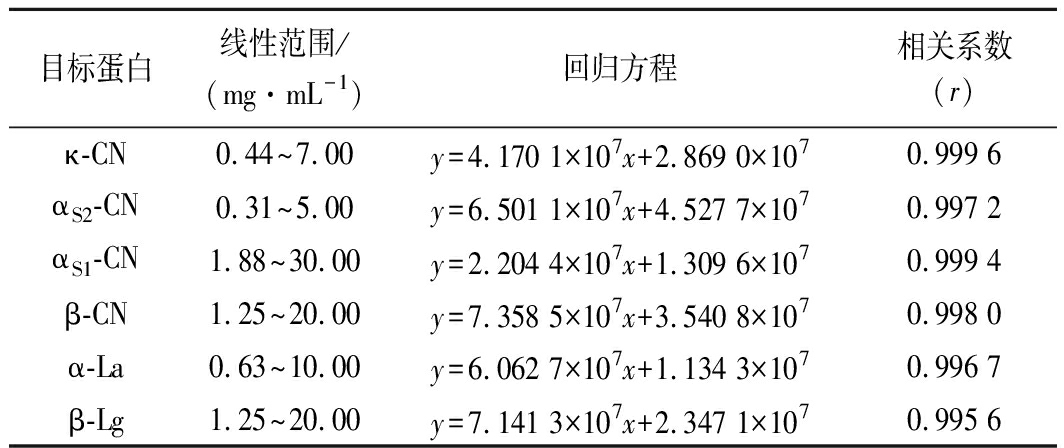
目标蛋白线性范围/(mg·mL-1)回归方程相关系数(r)κ-CN0.44~7.00y=4.170 1×107x+2.869 0×1070.999 6αS2-CN0.31~5.00y=6.501 1×107x+4.527 7×1070.997 2αS1-CN1.88~30.00y=2.204 4×107x+1.309 6×1070.999 4β-CN1.25~20.00y=7.358 5×107x+3.540 8×1070.998 0α-La0.63~10.00y=6.062 7×107x+1.134 3×1070.996 7β-Lg1.25~20.00y=7.141 3×107x+2.347 1×1070.995 6
表3 六种蛋白质在牛奶样品里的加标回收率
Table 3 Recoveries of six proteins in milk samples
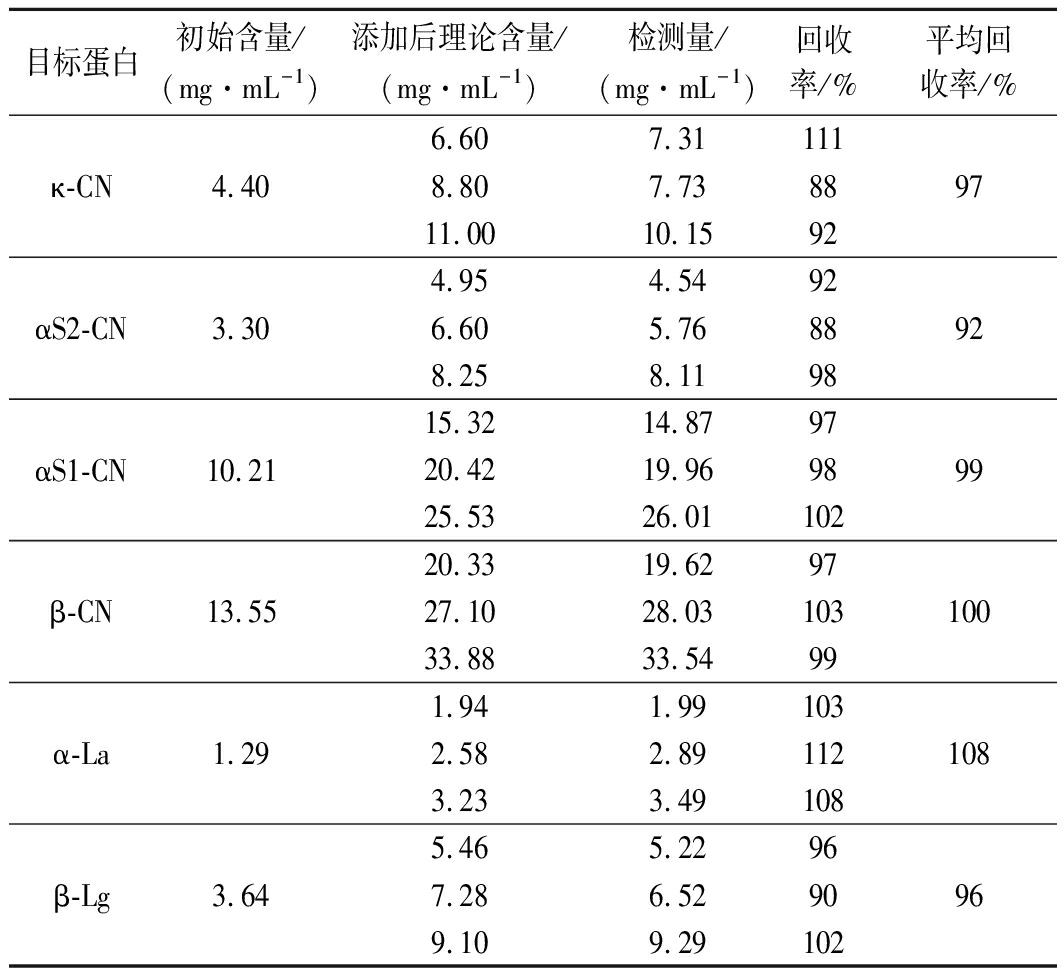
目标蛋白初始含量/(mg·mL-1)添加后理论含量/(mg·mL-1)检测量/(mg·mL-1)回收率/%平均回收率/%κ-CN4.406.607.311118.807.738811.0010.159297αS2-CN3.304.954.54926.605.76888.258.119892αS1-CN10.2115.3214.879720.4219.969825.5326.0110299β-CN13.5520.3319.629727.1028.0310333.8833.5499100α-La1.291.941.991032.582.891123.233.49108108β-Lg3.645.465.22967.286.52909.109.2910296
为了验证方法重现性和重复性,使用样品溶液按照研究方法进行6次重复检测,连续6 d,最终结果见表4。最终得到保留时间和峰面积的日内精密度和日间精密度均在10%以下。以标准曲线的最小浓度水平计算方法的检出限(S/N=3)和定量限(S/N=10),分别介于0.027 8~0.268 8 mg/mL和0.092 7~0.896 0 mg/mL。
表4 六种蛋白质在牛奶样品里的精密度、检出限和定量限
Table 4 RSD, LOD and LOQ of six proteins in milk samples
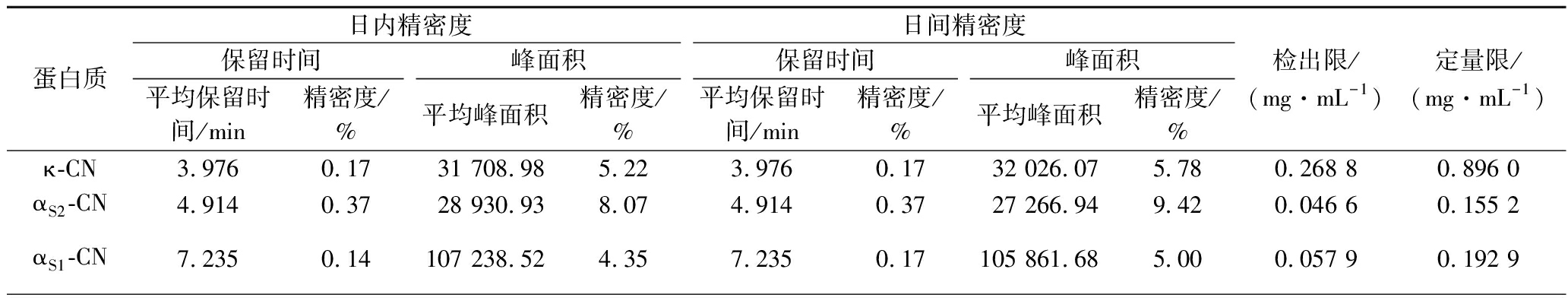
蛋白质日内精密度日间精密度保留时间峰面积保留时间峰面积平均保留时间/min精密度/%平均峰面积精密度/%平均保留时间/min精密度/%平均峰面积精密度/%检出限/(mg·mL-1)定量限/(mg·mL-1)κ-CN3.9760.1731 708.985.223.9760.1732 026.075.780.268 80.896 0αS2-CN4.9140.3728 930.938.074.9140.3727 266.949.420.046 60.155 2αS1-CN7.2350.14107 238.524.357.2350.17105 861.685.000.057 90.192 9
续表4
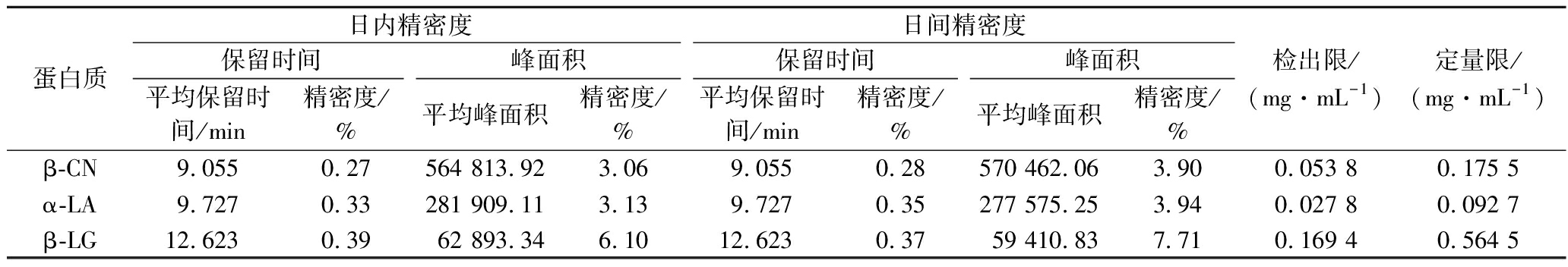
蛋白质日内精密度日间精密度保留时间峰面积保留时间峰面积平均保留时间/min精密度/%平均峰面积精密度/%平均保留时间/min精密度/%平均峰面积精密度/%检出限/(mg·mL-1)定量限/(mg·mL-1)β-CN9.0550.27564 813.923.069.0550.28570 462.063.900.053 80.175 5α-LA9.7270.33281 909.113.139.7270.35277 575.253.940.027 80.092 7β-LG12.6230.3962 893.346.1012.6230.3759 410.837.710.169 40.564 5
2.2.3 牛奶蛋白定量
在此基础上对来源于不同地区的牛奶样品进行定量,6种主要蛋白质的平均含量见表5。尽管所有牛奶均来源于荷斯坦奶牛,但κ-CN,αS1-CN和β-Lg的含量没有显著差异,但4个不同省份牛奶样品之间的α-La含量的差异显著, αS2-CN和β-CN在不同地理环境下呈现极显著差异。本次研究4个采样省份中,仅有湖北省来自中国南方地区,与其他3个省份的地理环境差异较大,蛋白含量整体较高。中国土地广阔,气候条件以及牧草差异会对奶牛所产牛奶中蛋白质组分含量造成不同程度影响,南北方气候差异较大,南方规模化养殖场较北方更多。同时,不同气候条件下,奶牛的进食量差异也会引起奶蛋白含量的差异[20]。因此即便相同奶牛品种,通过对比不同地区的牛奶中主要蛋白质的整体和细化分类含量差异,可以为牛奶产地鉴别提供基础。将本实验牛奶蛋白定量结果与文献[21]中的羊奶和牦牛奶中相应蛋白质含量进行了比较,发现牛奶中的αS-CN和β-Lg均高于羊奶中平均水平,但低于牦牛奶中平均水平。α-La在3种奶中含量相差不大,κ-CN和β-CN的含量均低于羊奶和牦牛奶。据此分析可知,不同气候条件对牛奶蛋白质含量有显著影响,物种对乳蛋白质含量影响更为显著。与此同时,可看出牛奶相较于羊奶和牦牛奶潜在的过敏风险较高,营养价值可能存在一定的差异性。
表5 六种蛋白质在牛奶样品里的定量结果
Table 5 Quantification results of six proteins in milk samples
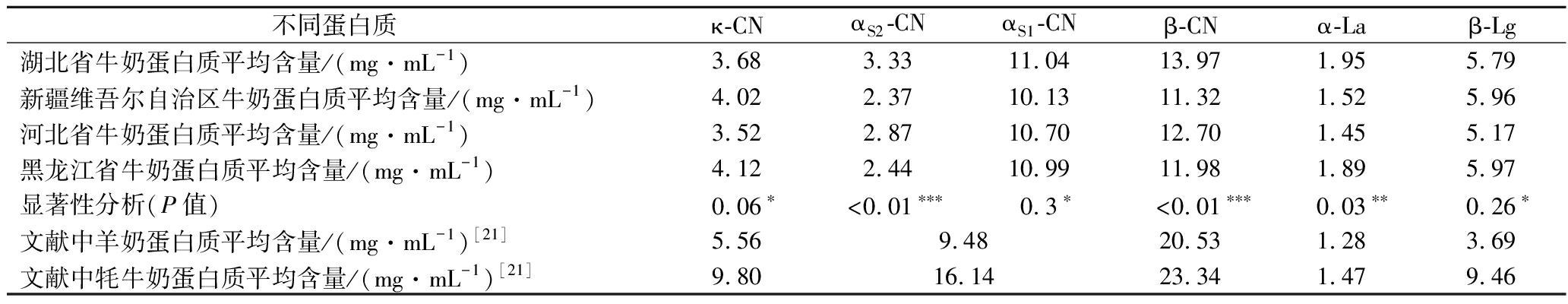
不同蛋白质κ-CNαS2-CNαS1-CNβ-CNα-Laβ-Lg湖北省牛奶蛋白质平均含量/(mg·mL-1)3.683.3311.0413.971.955.79新疆维吾尔自治区牛奶蛋白质平均含量/(mg·mL-1)4.022.3710.1311.321.525.96河北省牛奶蛋白质平均含量/(mg·mL-1)3.522.8710.7012.701.455.17黑龙江省牛奶蛋白质平均含量/(mg·mL-1)4.122.4410.9911.981.895.97显著性分析(P值)0.06∗<0.01∗∗∗0.3∗<0.01∗∗∗0.03∗∗0.26∗文献中羊奶蛋白质平均含量/(mg·mL-1)[21]5.569.4820.531.283.69文献中牦牛奶蛋白质平均含量/(mg·mL-1)[21]9.8016.1423.341.479.46
注:“*”表示没有显著差异(P>0.05),“**”表示差异显著(0.01<P<0.05),“***”表示差异极显著(P<0.01)
2.3 牛奶蛋白亚型
利用安捷伦Bioconfirm software对各个蛋白峰进行解卷积,得到观测质量数,并与文献[19, 22]中记载的理论质量数进行比对,确认6种蛋白质的主要亚型(图1)。色谱图中从左到右依次为κ-CN, αS2-CN, αS1-CN, β-CN, α-La和β-Lg。在此基础上对各个峰进行解析,各峰的质谱图和接卷积图详见电子增强出版附件(https://doi.org/10.13995/j.cnki.11-1802/ts.030460 ),分析结果见表6,κ-CN的亚型主要为A型和B型,质量数在19 000~22 000 Da,误差最大达到了1.95 Da;αS2-CN的主要亚型仅观测到A型,质量数在25 000 Da以上;αS1-CN的亚型仅观测到B型为23 614.54 Da;而β-CN的观测质量数集中在24 000 Da左右,亚型较多,分别为A1型、A2型和B型;B型是此次α-La观测到的唯一亚型,质量数最低,仅为14 185.72 Da;β-Lg得到2个亚型A型和B型,质量数则高于18 000 Da。事实上,对于蛋白质亚型的检测既需要有效的前处理过程和分离检测程序,专业的软件和数据库也不可或缺。本次研究简要对各个蛋白质的主要亚型进行了分析对比,发现同一蛋白质存在不同亚型,若进一步进行分离纯化可对不同亚型进行分离,以满足不同的实验需求。近些年来,研究者们的关注点从牛奶的蛋白总量转变成为关注更加细致的蛋白分类和蛋白质亚型含量,以此来进一步明确牛奶的营养价值和致敏性,如部分研究者在针对A1与A2型β-CN的差异时发现,A2型较A1型而言可以在一定程度上缓解乳糖不耐受反应[23]。因此,对于蛋白质不同亚型的检测分析能够有利于进一步明确牛奶中蛋白质的主要构成和生理功能。
表6 主要蛋白峰解卷积后的观测质量数和理论质量数对比
Table 6 Comparison of observed mass number and theoretical mass number after deconvolution of main protein peaks
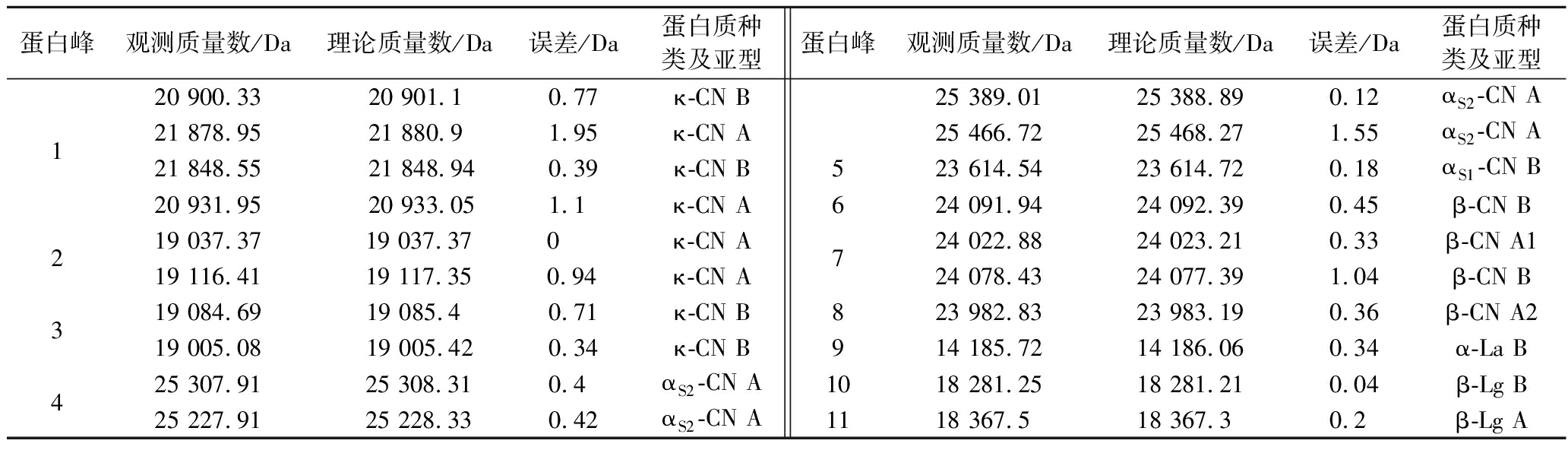
蛋白峰观测质量数/Da理论质量数/Da误差/Da蛋白质种类及亚型蛋白峰观测质量数/Da理论质量数/Da误差/Da蛋白质种类及亚型120 900.3320 901.10.77κ-CN B21 878.9521 880.91.95κ-CN A21 848.5521 848.940.39κ-CN B20 931.9520 933.051.1κ-CN A219 037.3719 037.370 κ-CN A19 116.4119 117.350.94κ-CN A319 084.6919 085.40.71κ-CN B19 005.0819 005.420.34κ-CN B425 307.9125 308.310.4 αS2-CN A25 227.9125 228.330.42αS2-CN A25 389.0125 388.890.12αS2-CN A25 466.7225 468.271.55αS2-CN A523 614.5423 614.720.18αS1-CN B624 091.9424 092.390.45β-CN B724 022.8824 023.210.33β-CN A124 078.4324 077.391.04β-CN B823 982.8323 983.190.36β-CN A2914 185.7214 186.060.34α-La B1018 281.2518 281.210.04β-Lg B1118 367.518 367.30.2β-Lg A
同时,同一蛋白质亚型存在不同观测质量数并能有相应的理论质量数与之匹配,这是由于蛋白质会与不同数量的磷酸基团结合导致磷酸化,而不同数量的磷酸基团使得质量数产生变化。此外,κ-CN除磷酸化之外还会出现糖基化现象,使得蛋白质质量数出现更多种可能性。
3 结论与讨论
本研究方法可在16 min内完成牛奶中6种主要蛋白质定量分析,并通过优化得到较好的峰分离效果。相较而言,电泳法在灵敏度和精确性上较差,易受到杂质干扰;酶联免疫法灵敏性与特异性高,但却存在制备新抗体较为繁琐的问题,通常应用于某一类蛋白质的检测分析,而不对亚型进行探究;液相色谱法重现性好,能在一定程度上对部分蛋白质亚型进行分离检测,但耗时较长。本方法的单样品检测时长与检测灵敏度均优于其他3种检测方法,实现了较短时间的牛奶蛋白质定量,适合进行大批量样品的采集,方法回收率以及精密度较高,能够进一步对蛋白质进行更加细致的分析,得到更加丰富的蛋白质亚型信息。本次研究的24个牛奶样品虽然来自于4个不同的省份,但在6种主要蛋白质的含量上并没有出现较大的差异,可能与奶牛品种均为荷斯坦奶牛有关,因此若加大采样数量并进行不同种类奶牛蛋白质比例对比分析,可一定程度上作为奶源分析的基础。根据采集到的谱图,针对不同蛋白质峰进行解卷积,探究其更加细化的分类,通过与理论数值进行对比,进一步明确了各个蛋白质在样品中的主要亚型,可以作为进一步细化牛奶蛋白甚至其他种类乳制品蛋白质种类的依据和对照,方法有望应用于乳制品品质评价与品种鉴别。
[1] 梁杰, 耿晓晖, 刘延平, 等.牛乳β-酪蛋白多态性及其对人体健康影响的研究进展[J].乳业科学与技术, 2019, 42(2):45-49.
LIANG J, GENG X H, LIU Y P, et al.Progress of polymorphism of β-casein in milk and its relationship with human health[J].Journal of Dairy Science and Technology, 2019, 42(2):45-49.
[2] LÖNNERDAL B.Bioactive proteins in breast milk[J].Journal of Paediatrics and Child Health, 2013, 49:1-7.
[3] 范安妮, 佘之蕴, 梁宇斌, 等.牛奶中主要过敏原αs1-酪蛋白的生物信息学分析[J].食品安全质量检测学报, 2016, 7(12):4 740-4 744.
FAN A N, SHE Z Y, LIANG Y B, et al.Bioinformatics analysis for αs1-casein of main allergens in milk[J].Journal of Food Safety & Quality, 2016, 7(12):4 740-4 744.
[4] MALKOSKI M, DASHPER S G, O’BRIEN-SIMPSON N M, et al.Kappacin, a novel antibacterial peptide from bovine milk[J].Antimicrobial Agents and Chemotherapy, 2001, 45(8):2 309-2 315.
[5] MARCINIAK A, SUWAL S, BRITTEN M, et al.The use of high hydrostatic pressure to modulate milk protein interactions for the production of an alpha-lactalbumin enriched-fraction[J].Green Chemistry, 2018, 20(2):515-524.
[6] NIELSEN C H, HUI Y, NGUYEN D N, et al.Alpha-lactalbumin enriched whey protein concentrate to improve gut, immunity and brain development in preterm pigs[J].Nutrients, 2020,12(1):245.
[7] CHEN Q, ZHANG J S, KE X, et al.Simultaneous quantification of α-lactalbumin and β-casein in human milk using ultra-performance liquid chromatography with tandem mass spectrometry based on their signature peptides and winged isotope internal standards[J].Biochimica et Biophysica Acta, 2016, 1 864(9):1 122-1 127.
[8] 李飞, 刘红娟, 王龙.乳清蛋白功能活性的研究[J].中国酿造, 2015, 34(7):20-23.
LI F, LIU H J, WANG L.Research of the functional activity of whey protein[J].China Brewing, 2015, 34(7):20-23.
[9] TRIMBOLI F, COSTANZO N, LOPREIATO V, et al.Detection of buffalo milk adulteration with cow milk by capillary electrophoresis analysis[J].Journal of Dairy Science, 2019, 102(7):5 962-5 970.
[10] SHARMA N, SHARMA R, RAJPUT Y S, et al.Separation methods for milk proteins on polyacrylamide gel electrophoresis:Critical analysis and options for better resolution[J].International Dairy Journal, 2021, 114:104920.
[11] ORCAJO J, LAVILLA M, MART NEZ-DE-MARA
NEZ-DE-MARA
 N I.Specific and sensitive ELISA for measurement of IgE-binding variations of milk allergen β-lactoglobulin in processed foods[J].Analytica Chimica Acta, 2019, 1 052:163-169.
N I.Specific and sensitive ELISA for measurement of IgE-binding variations of milk allergen β-lactoglobulin in processed foods[J].Analytica Chimica Acta, 2019, 1 052:163-169.
[12] DE LUIS R, LAVILLA M, S NCHEZ L, et al.Development and evaluation of two ELISA formats for the detection of β-lactoglobulin in model processed and commercial foods[J].Food Control, 2009, 20(7):643-647.
NCHEZ L, et al.Development and evaluation of two ELISA formats for the detection of β-lactoglobulin in model processed and commercial foods[J].Food Control, 2009, 20(7):643-647.
[13] OSTERTAG F, SCHMIDT C M, BERENSMEIER S, et al.Development and validation of an RP-HPLC DAD method for the simultaneous quantification of minor and major whey proteins[J].Food Chemistry, 2021, 342:128176.
[14] MA L, YANG Y X, CHEN J T, et al.A rapid analytical method of major milk proteins by reversed-phase high-performance liquid chromatography[J].Animal Science Journal = Nihon Chikusan Gakkaiho, 2017, 88(10):1 623-1 628.
[15] BOITZ L I, FIECHTER G, SEIFRIED R K, et al.A novel ultra-high performance liquid chromatography method for the rapid determination of β-lactoglobulin as heat load indicator in commercial milk samples[J].Journal of Chromatography.A, 2015, 1 386(11):98-102.
[16] MIRANDA G, BIANCHI L, KRUPOVA Z, et al.An improved LC-MS method to profile molecular diversity and quantify the six main bovine milk proteins, including genetic and splicing variants as well as post-translationally modified isoforms[J].Food Chemistry:X, 2020, 5:100080.
[17] NGUYEN D D, SOLAH V A, BUSETTI F, et al.Application of ultra-high performance liquid chromatography coupled to high-resolution mass spectrometry (OrbitrapTM) for the determination of beta-casein phenotypes in cow milk[J].Food Chemistry, 2020, 307:125532.
[18] KE X, ZHANG J S, LAI S Y, et al.Quantitative analysis of cow whole milk and whey powder adulteration percentage in goat and sheep milk products by isotopic dilution-ultra-high performance liquid chromatography-tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry, 2017, 409(1):213-224.
[19] BOBE G, BEITZ D C, FREEMAN A E, et al.Separation and quantification of bovine milk proteins by reversed-phase high-performance liquid chromatography[J].Journal of Agricultural and Food Chemistry, 1998, 46(2):458-463.
[20] 钟雨婷,王君.我国生牛乳蛋白质含量现状及影响因素调查[J].中国食品卫生杂志, 2016, 28(5):644-647.
ZHONG Y T, WANG J.Investigation on peresent situation and influential factors of protein content in raw milk in China[J].Chinese Journal of Food Hygiene, 2016, 28(5):644-647.
[21] 马露. 奶牛、水牛、牦牛、娟珊牛、山羊、骆驼和马乳特征性成分分析[D].呼和浩特:内蒙古农业大学, 2014.
MA L.Identification of the characteristic component in milk from Holstein cow, buffalo, yak, Jersey cattle, goat, camel and horse[D].Hohhot:Inner Mongolia Agricultural University, 2014.
[22] VINCENT D, ELKINS A, CONDINA M R, et al.Quantitation and identification of intact major milk proteins for high-throughput LC-ESI-Q-TOF MS analyses[J].PLoS One, 2016, 11(10):e0163471.
[23] SUN J Q, XU L M, XIA L, et al.Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology, symptoms of discomfort, and cognitive behavior of people with self-reported intolerance to traditional cows’ milk[J].Nutrition Journal, 2016, 15:35.