柠檬果实具有良好的营养、保健和药用价值,这主要由于其富含类黄酮、香豆素、类柠檬苦素和酚酸等生物活性成分[1-2]。研究发现,柠檬果实中生物活性成分的种类和含量受品种和生长环境等多种因素影响[3-4]。目前对柠檬中生物活性物质检测方法的研究已有报道。高炜等[5]采用分光光度计法评价了尤力克黄柠檬、小青柠、青柠檬和香水柠檬的果皮与果肉中总酚含量,并用超高效液相色谱对其中的酚酸和类黄酮进行定性和定量。KAWAII等[6]利用HPLC技术研究了在相同产地和年份生长的66种柑橘及近缘属样品中24种类黄酮,在甜柠檬和尤力克柠檬可食部位的类黄酮化合物含量比较分析中发现橙皮苷的含量最高,该实验使用了55 min的梯度洗脱程序。VAIO等[7]发现西西里和坎帕尼亚的18种柠檬果皮乙醇提取物的精油含量和抗氧化活性没有明显的相关性,可能是由于乙醇提取物中含有其他的植物化学物质如香豆素、呋喃香豆素和酚类物质。BARRECA等[8]使用反相液相色谱联用紫外和质谱技术研究了地中海甜柠檬的柠檬汁中类黄酮组成,共检测到8种类黄酮。PETERSON等[9]曾综述了葡萄柚、柠檬和酸橙中的黄烷酮,其中柠檬中占主导地位的黄烷酮是橙皮苷。GIRONÉS-VILAPLANA等[10]使用高效液相色谱联用紫外和质谱检测技术定量分析了“Fino”柠檬汁中17种类黄酮和4种羟基肉桂酸类化合物的含量。以上研究并未涉及柠檬果实中香豆素和呋喃香豆素类物质以及类柠檬苦素的分析检测。JUNGEN等[11]基于高效液相色谱质谱联用结合紫外检测对柠檬黄皮层、白皮层和内果皮中的11种香豆素类和补骨脂素类物质进行了鉴定与定量分析,黄皮层中的物质含量明显高于白皮层和内果皮。涂勋良等[12]建立了可在20 min内完成柠檬苦素和诺米林含量同时测定的HPLC方法,并据此对不同产地和不同品种柠檬果皮中柠檬苦素和诺米林含量进行了测定。本课题组基于超高效液相色谱-四极杆-飞行时间高分辨质谱(ultra performance liquid chromatography-quadrupole-time of flight high resolution mass spectrometry,UPLC-Q-TOF-HRMS)优化出一种定性定量分析柑橘种子中柠檬苦素、诺米林和奥巴叩酮3种类柠檬苦素物质的方法[13]。
目前,针对柠檬中生物活性成分的定量研究多见于高效液相色谱与超高效液相色谱,基于质谱的检测方法较少,且所测成分相对单一或者分析检测周期偏长。为了进一步有效研究柠檬中的生物活性成分,本研究基于UPLC-Q-TOF-HRMS技术,在正、负离子模式下结合所有理论碎片离子的连续窗口采集(sequential window acquisition of all theoretical fragment ions,SWATH),同时对柠檬中多类型生物活性成分进行筛查定量研究,仪器的高分辨率可提高筛查鉴定能力。SWATH是一种全景式、高通量和数据可追溯的质谱技术,可对样品中所有可检测到的化合物进行全面检测和定量分析,它在极低浓度下也能采集并提供类质谱多反应监测的定量信息,即二级定量信息,并具有强大的解卷积功能,可抗一级干扰,得到准确的二级质谱信息。王梦颖等[14]基于UPLC-Q-TOF-HRMS结合SWATH采集方法对乳液类化妆品中的9种抗过敏违禁药物进行了筛查与定量研究,实验分别利用了一级母离子和二级子离子的方式来进行定量,并考察了这2种定量方式对基质效应的影响,结果表明,采用SWATH二级特征子离子的方式进行定量可以使基质效应下降,同时定量的准确性也有所提高。本研究旨在建立一种快速、准确的筛查定量方法,对柠檬中的26种化合物包括13种类黄酮,8种香豆素和呋喃香豆素,2种类柠檬苦素和3种酚酸的含量进行检测分析。这对于进一步评估柠檬的营养、品质以及开发功能性柠檬产品具有一定的借鉴意义。
1 材料与方法
1.1 材料
实验所用柠檬材料于2019年11月采自中国农业科学院柑桔研究所国家果树种质资源(重庆)柑橘圃,品种名称(资源圃编号)依次为:扁红柠檬(LM0149)、里斯本柠檬(LM0004)、柯尔提粗柠檬(LM0094)、美国粗柠檬(LM0062)、尤力克柠檬(LM0084)、北京柠檬(LM0126)。在3棵长势一致果树上的不同方位(上、中、下、内、外部)均匀地采摘20~30个处于成熟期的柠檬果实。
1.2 试剂
甲酸为色谱纯,上海吉至生化科技有限公司;Milli-Q Advantage A10 超纯水器,美国Millpore公司;标准品:新西兰牡荆苷、5-降甲基蜜桔黄素、地奥司明、栀子黄素B、柠檬苦素、柠檬油素、诺米林(纯度均 98.0%)、8-牻牛儿醇基补骨脂素(纯度98.5%)、伞形花内酯(纯度99.0%),成都克洛玛生物科技有限公司;标准品:水合氧化前胡素、白当归素、蛇床子素、4′,5,7,8-四甲氧基黄酮、水仙苷、异橙皮内酯(纯度均98.0%)、4′,5,6,7-四甲氧基黄酮(纯度95.0%),上海源叶生物技术有限公司;甲醇、乙腈均为色谱纯,橙皮油内酯(纯度98.5%),美国Sigma-Aldrich公司;芦丁(纯度99.5%)、甜橙黄酮(纯度98.0%)、川陈皮素(纯度99.71%)、桔皮素(纯度98.49%)、芸香柚皮苷(纯度99.38%)、橙皮苷(纯度97.06%)、对羟基苯甲酸(纯度99.9%)、对香豆酸(纯度99.84%)、阿魏酸(纯度99.95%),上海安谱实验科技股份有限公司。
1.3 仪器
Nexera X2型UPLC,日本岛津公司;X500R型QTOF,美国AB SCIEX公司;KQ5200DE超声波清洗仪, 昆山市超声仪器有限公司;Milli-Q Advantage A10超纯水系统,美国密理博公司;3K15高速冷冻离心机,德国SIGMA公司;PB3002-S/FACT分析天平,瑞士梅特勒-托利多公司。
1.4 混合标准溶液配制
准确配制质量浓度2 μg/mL的混合标准品储备液A,取1 mL A溶液用甲醇稀释得质量浓度为0.2 μg/mL的混合标准品使用液B。分别准确移取A溶液0、25、50、250、500、1 000 μL,B混合标准品溶液5、10、25、50、100、1 000 μL,用甲醇分别稀释得质量浓度分别为0、1、2、5、10、20、50、100、200、500、1 000、2 000 μg/mL的混合标准品使用液。
1.5 UPLC-Q-TOF/HRMS条件
1.5.1 色谱条件
UPLC所用色谱柱为Waters Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm), 柱温40 ℃,进样量1.0 μL,流动相A为0.1%甲酸水溶液,流动相B乙腈,流速0.3 mL/min,正负离子模式下的梯度洗脱程序与庞雯辉等[15]的方法一致。
1.5.2 质谱条件
质谱数据是在AB SCIEX的X500R QTOF系统上采用SWATH模式在正、负2种离子模式下采集的。正负离子模式下的参数参照庞雯辉等[15]的研究。
1.6 方法学验证
1.6.1 标准曲线和定量限
在柠檬样品上机检测前,将预先配制的一系列混合标准品溶液上机检测,通过对每种化合物5种以上的适当浓度下的特征二级子离子碎片峰面积进行线性回归,拟合所有目标化合物的线性曲线。根据定量限来评估所提出方法的灵敏度,其由信噪比为10∶1时的浓度确定。
1.6.2 加标回收率试验
为了确定目标化合物的回收率,将适当浓度的26种混合标准品溶液加到柠檬样品的提取物中。首先确定混合标准品溶液添加到柠檬样品之前和之后的每种目标化合物的浓度,进行浓度差值的计算,再将浓度差值与已知的混合标准液添加量进行比较,从而可以确定目标化合物的回收率。每种目标化合物均进行3次重复试验,加标回收率以平均值±标准差的形式表示。
1.6.3 精密度试验
在1 d中3个不同的时间段对校准样品进行了3份重复检测,以考察日内精密度;连续3 d在同一时间段测定校准样品中的目标化合物,以考察日间精密度。日内和日间精密度均以相对标准偏差(relative standard deviation,RSD)表示。
1.7 数据分析
采用SCIEX OS软件控制UPLC-Q-TOF系统采集实验数据,并对目标化合物进行筛查匹配,对二级子离子定量数据进行统计分析,目标化合物二级定量子离子信息详见表1。采用Origin 2019b软件进行数据处理与绘图;所有样品均进行3次生物重复,以平均值±标准差表示测定结果。
表1 26种目标化合物的液相和质谱信息
Table 1 The LC-MS information of 26 target compounds
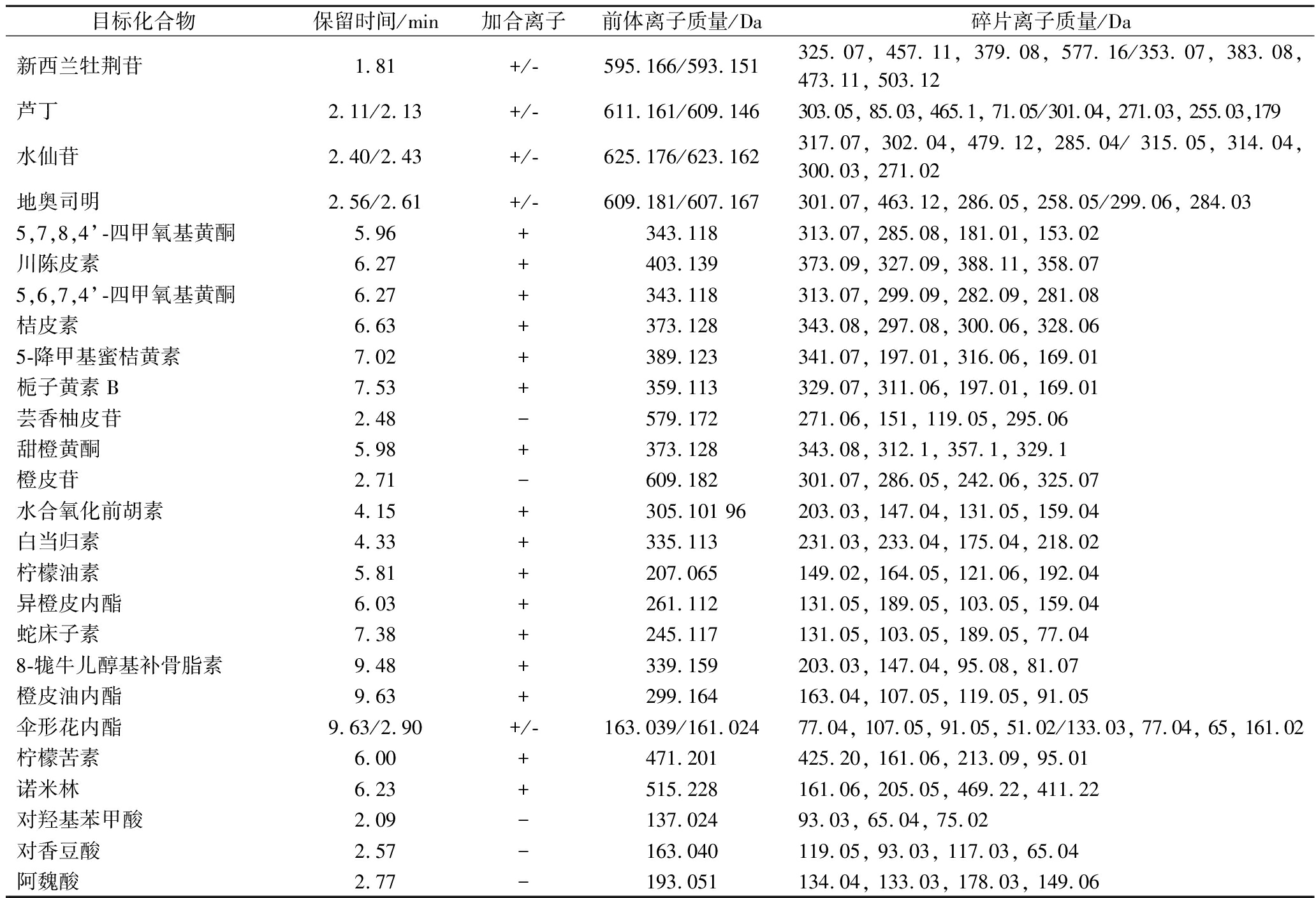
目标化合物保留时间/min加合离子前体离子质量/Da碎片离子质量/Da新西兰牡荆苷 1.81+/-595.166/593.151325.07, 457.11, 379.08, 577.16/353.07, 383.08, 473.11, 503.12芦丁 2.11/2.13+/-611.161/609.146303.05, 85.03, 465.1, 71.05/301.04, 271.03, 255.03,179水仙苷 2.40/2.43+/-625.176/623.162317.07, 302.04, 479.12, 285.04/ 315.05, 314.04, 300.03, 271.02地奥司明 2.56/2.61+/-609.181/607.167301.07, 463.12, 286.05, 258.05/299.06, 284.035,7,8,4’-四甲氧基黄酮 5.96+343.118313.07, 285.08, 181.01, 153.02川陈皮素 6.27+403.139373.09, 327.09, 388.11, 358.075,6,7,4’-四甲氧基黄酮 6.27+343.118313.07, 299.09, 282.09, 281.08桔皮素 6.63+373.128343.08, 297.08, 300.06, 328.065-降甲基蜜桔黄素 7.02+389.123341.07, 197.01, 316.06, 169.01栀子黄素B 7.53+359.113329.07, 311.06, 197.01, 169.01芸香柚皮苷 2.48-579.172271.06, 151, 119.05, 295.06甜橙黄酮 5.98+373.128343.08, 312.1, 357.1, 329.1橙皮苷 2.71-609.182301.07, 286.05, 242.06, 325.07水合氧化前胡素 4.15+ 305.101 96203.03, 147.04, 131.05, 159.04白当归素 4.33+335.113231.03, 233.04, 175.04, 218.02柠檬油素 5.81+207.065149.02, 164.05, 121.06, 192.04异橙皮内酯 6.03+261.112131.05, 189.05, 103.05, 159.04蛇床子素 7.38+245.117131.05, 103.05, 189.05, 77.048-牻牛儿醇基补骨脂素 9.48+339.159203.03, 147.04, 95.08, 81.07橙皮油内酯 9.63+299.164163.04, 107.05, 119.05, 91.05伞形花内酯9.63/2.90+/-163.039/161.02477.04, 107.05, 91.05, 51.02/133.03, 77.04, 65, 161.02柠檬苦素 6.00+471.201425.20, 161.06, 213.09, 95.01诺米林 6.23+515.228161.06, 205.05, 469.22, 411.22对羟基苯甲酸 2.09-137.02493.03, 65.04, 75.02对香豆酸 2.57-163.040119.05, 93.03, 117.03, 65.04阿魏酸 2.77-193.051134.04, 133.03, 178.03, 149.06
2 结果与分析
2.1 质谱方法优化
可变窗口是SWATH质谱方法所特有的一种采集技术,其可根据化合物母离子的质量范围来调整不同采集窗口的范围大小,以便在分析样品中母离子质荷比密度最高的区域(预期有最大数量的化合物和分析物的区域)采用更小的母离子质荷比范围的采集窗口,从而降低漏掉复杂样品中低丰度峰的风险,提高检测的专一性[16-17]。在本实验中,首先分别取经过前处理的6种柠檬果皮原液200 μL于2 mL进样小瓶中,混匀后上机进行检测,得到所检测样品的总离子流图信息,对在正(10 min内)、负离子(6 min内)模式下检测到的所有化合物分别按照质荷比的大小进行排序,最后通过软件去卷积技术依据化合物质荷比与峰面积分别对其进行连续平均分段,以该分段数据设置为SWATH扫描窗口。在本实验条件下,正离子模式下化合物的数量多于负离子模式,因此正离子模式设置15个扫描窗口,分别为:[99.5-141.5]、[140.5-149.5]、[148.5-191.5]、[190.5-207.5]、[206.5-255.5]、[254.5-274.5]、[273.5-287.5]、[286.5-329.5]、[328.5-371.5]、[370.5-374.5]、[373.5-403.5]、[402.5-404.5]、[403.5-434.5]、[433.5-566.5]、[565.5-800.5];负离子模式下设置10个扫描窗口,分别为:[99.5-191.5], [190.5-249.5], [248.5-325.5]、[324.5-373.5]、[372.5-457.5]、[456.5-531.5]、[530.5-580.5]、[579.5-609.5]、[608.5-611.5]、[610.5-800.5]。
2.2 方法学验证
表2显示了相关系数均高于0.99的26种目标化合物的线性方程、线性范围,且每种目标化合物的线性曲线范围均有5个及以上的浓度数量值,因此在本试验方法下,26种目标化合物均表现出良好的线性关系。所有目标化合物的定量限不完全相同,其中有5种目标化合物定量限低至0.001 μg/L,具有较高的灵敏度。从表2可知,所有目标化合物的回收率均在(84.27±3.02)%~(114.25±1.77)%,表明该方法具有良好的准确性。所有目标化合物的日内RSD不超过6.39%,日间RSD值不超过5.33%,均在可接受范围之内。以上结果表明,该方法具有良好的线性关系、灵敏度、精密度和准确度,可用于实际样品中类黄酮、香豆素和呋喃香豆素、类柠檬苦素和酚酸多类型生物活性成分的定量检测分析。
表2 方法的验证参数(n=3)
Table 2 Validation parameters of the method(n=3)
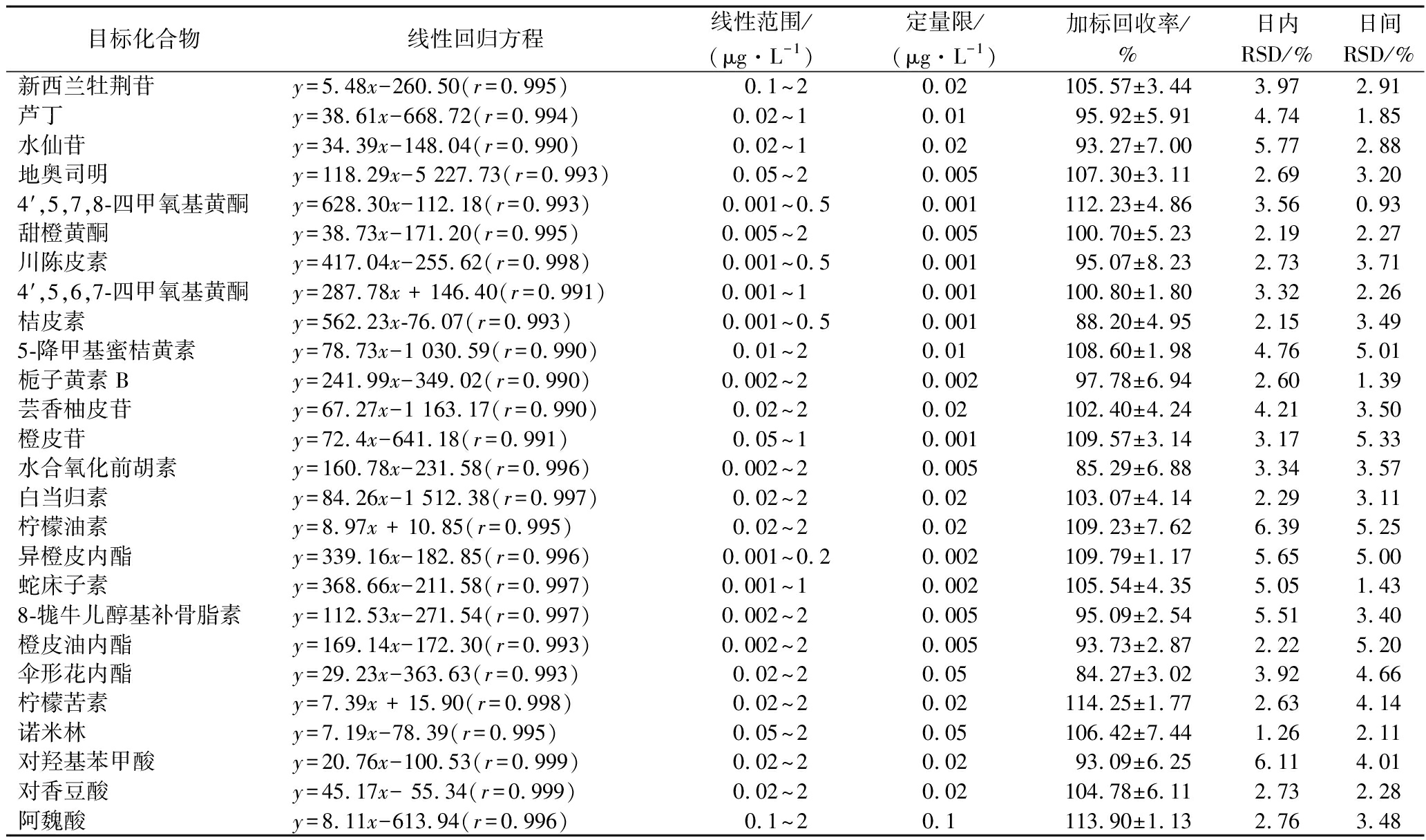
目标化合物线性回归方程线性范围/(μg·L-1)定量限/(μg·L-1)加标回收率/%日内RSD/%日间RSD/%新西兰牡荆苷y=5.48x-260.50(r=0.995)0.1~2 0.02105.57±3.443.972.91芦丁y=38.61x-668.72(r=0.994)0.02~1 0.0195.92±5.914.741.85水仙苷y=34.39x-148.04(r=0.990)0.02~1 0.0293.27±7.005.772.88地奥司明y=118.29x-5 227.73(r=0.993)0.05~2 0.005107.30±3.112.693.204′,5,7,8-四甲氧基黄酮y=628.30x-112.18(r=0.993)0.001~0.50.001112.23±4.863.560.93甜橙黄酮y=38.73x-171.20(r=0.995)0.005~2 0.005100.70±5.232.192.27川陈皮素y=417.04x-255.62(r=0.998)0.001~0.50.00195.07±8.232.733.714′,5,6,7-四甲氧基黄酮y=287.78x + 146.40(r=0.991)0.001~1 0.001100.80±1.803.322.26桔皮素y=562.23x-76.07(r=0.993)0.001~0.50.00188.20±4.952.153.495-降甲基蜜桔黄素y=78.73x-1 030.59(r=0.990)0.01~2 0.01108.60±1.984.765.01栀子黄素By=241.99x-349.02(r=0.990)0.002~2 0.00297.78±6.942.601.39芸香柚皮苷y=67.27x-1 163.17(r=0.990)0.02~2 0.02102.40±4.244.213.50橙皮苷y=72.4x-641.18(r=0.991)0.05~1 0.001109.57±3.143.175.33水合氧化前胡素y=160.78x-231.58(r=0.996)0.002~2 0.00585.29±6.883.343.57白当归素y=84.26x-1 512.38(r=0.997)0.02~2 0.02103.07±4.142.293.11柠檬油素y=8.97x + 10.85(r=0.995)0.02~2 0.02109.23±7.626.395.25异橙皮内酯y=339.16x-182.85(r=0.996)0.001~0.20.002109.79±1.175.655.00蛇床子素y=368.66x-211.58(r=0.997)0.001~1 0.002105.54±4.355.051.438-牻牛儿醇基补骨脂素y=112.53x-271.54(r=0.997)0.002~2 0.00595.09±2.545.513.40橙皮油内酯y=169.14x-172.30(r=0.993)0.002~2 0.00593.73±2.872.225.20伞形花内酯y=29.23x-363.63(r=0.993)0.02~2 0.0584.27±3.023.924.66柠檬苦素y=7.39x + 15.90(r=0.998)0.02~2 0.02114.25±1.772.634.14诺米林y=7.19x-78.39(r=0.995)0.05~2 0.05106.42±7.441.262.11对羟基苯甲酸y=20.76x-100.53(r=0.999)0.02~2 0.0293.09±6.256.114.01对香豆酸y=45.17x- 55.34(r=0.999)0.02~2 0.02104.78±6.112.732.28阿魏酸y=8.11x-613.94(r=0.996)0.1~2 0.1113.90±1.132.763.48
2.3 柠檬中生物活性成分的定量分析
经方法学验证,该方法可用于类黄酮、香豆素和呋喃香豆素、类柠檬苦素和酚酸等多类型生物活性成分的定量分析。因此,本实验基于该方法对6种柠檬(扁红柠檬、里斯本柠檬、柯尔提粗柠檬、美国粗柠檬、尤力克柠檬和北京柠檬)的果皮、果肉和果汁进行了定量检测分析,结果均以鲜重计。
2.3.1 柠檬中类黄酮的含量分析
6种柠檬样品不同部位中13种类黄酮的含量如图1所示,柠檬果实不同部位的类黄酮主要成分相差不大,但含量差异较大,柠檬果皮所含类黄酮含量显著高于果肉和果汁,果肉中类黄酮总量位居第2,果汁中的含量最低。从柠檬品种来看,除了扁红柠檬,其他5种柠檬的果皮、果肉和果汁中均是橙皮苷的含量最高。扁红柠檬果皮中,川陈皮素(323.65±4.60) μg/g、桔皮素(213.50±11.46) μg/g和芸香柚皮苷(206.55±8.84) μg/g的含量占主导地位,橙皮苷的含量排第4(104.22±8.04) μg/g。而扁红柠檬果肉和果汁中均为芸香柚皮苷含量最丰富,新西兰牡荆苷次之,橙皮苷位居第3。对于另一种外果皮呈红色的柯尔提粗柠檬来说,川陈皮素(429.05±3.46) μg/g、桔皮素(135.75±0.78) μg/g和5-降甲基蜜桔黄素(68.90±9.73) μg/g等多甲氧基黄酮的含量也很丰富。里斯本柠檬、尤力克柠檬和北京柠檬果皮中新西兰牡荆苷是仅次于橙皮苷,是含量位居第2的类黄酮。同时,在美国粗柠檬果皮中新西兰牡荆苷的含量(41.83±7.62) μg/g低于川陈皮素(70.14±10.49) μg/g的含量,位居第3。总体来看,扁红柠檬、柯尔提粗柠檬和美国粗柠檬的果皮相比其他3种柠檬来说,多甲氧基黄酮的含量较为丰富,其中川陈皮素是含量最高的多甲氧基黄酮。

a-果皮;b-果肉;c-果汁
图1 六种柠檬的果皮、果肉和果汁中类黄酮的含量
Fig.1 Contents of flavonoids in the peel, pulp and juice of six lemon fruits
2.3.2 柠檬中香豆素和呋喃香豆素类物质的含量分析
由图2可知,果皮中香豆素和呋喃香豆素类物质的含量普遍高于果肉,果汁中含量最少。不同品种柠檬各部位香豆素和呋喃香豆素类物质的含量也有差异。果皮中,除了扁红柠檬和美国粗柠檬,其他4种柠檬中含量最高的均为柠檬油素,其中柯尔提粗柠檬果皮中的柠檬油素含量高达(385.30±3.39) μg/g。扁红柠檬果皮中橙皮油内酯的含量最高为101.89 μg/g,伞形花内酯次之(89.62 μg/g);美国粗柠檬中白当归素的含量最高,为(1.28±0.22) μg/g,柠檬油素次之(0.74±0.13) μg/g。柠檬果肉中,扁红柠檬中橙皮油内酯含量最高,为(1.08±0.64) μg/g,伞形花内酯次之(0.96±0.69) μg/g;柯尔提粗柠檬(1.98±0.13) μg/g、美国粗柠檬(1.31±0.12) μg/g、尤力克柠檬(5.13±0.83) μg/g和北京柠檬(0.54±0.12) μg/g中柠檬油素的含量最高,蛇床子素的含量最低;而里斯本柠檬果肉中柠檬油素的含量位居第2,仅次于含量最高的水合氧化前胡内酯,二者没有显著差异。对果汁而言,除了扁红柠檬中伞形花内酯的含量最高,橙皮油内酯次之,其他5种柠檬中柠檬油素的浓度明显高于其他香豆素类物质。总体来看,柠檬果实中柠檬油素的含量在所测香豆素和呋喃香豆素类物质中含量占比较高,而蛇床子素的含量最低。
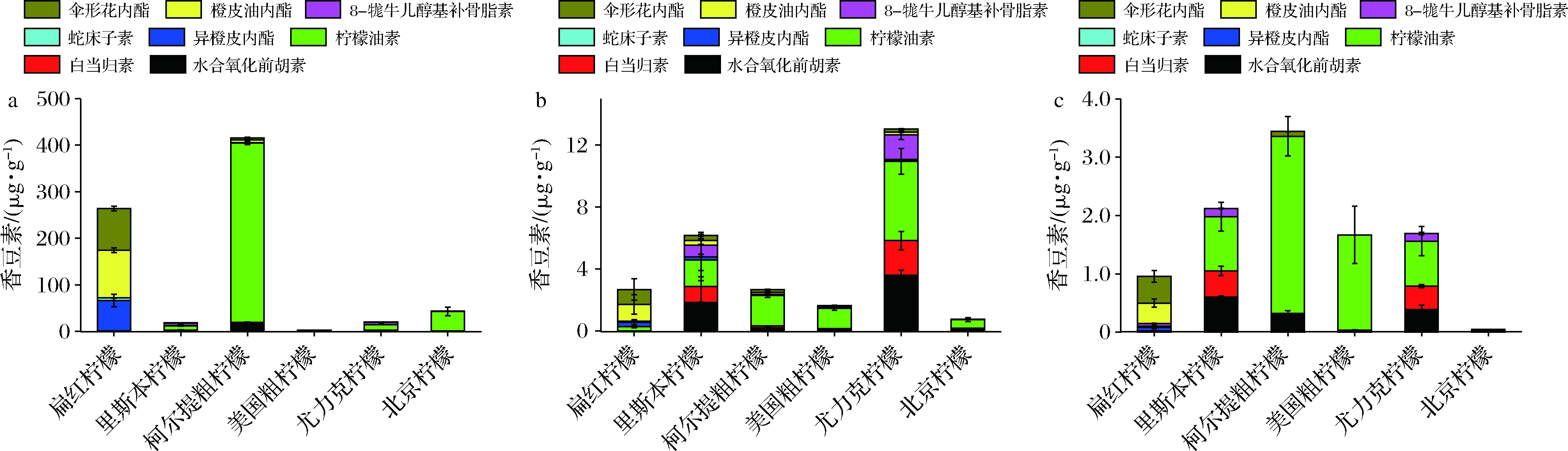
a-果皮;b-果肉;c-果汁
图2 六种柠檬果皮、果肉和果汁中香豆素和呋喃香豆素类物质的含量
Fig.2 Contents of coumarins and furocoumarins in the peel, pulp and juice of six lemon fruits
2.3.3 柠檬中类柠檬苦素和酚酸类物质的含量分析
类柠檬苦素是造成柑橘苦味的主要来源之一,且大多以柠檬苦素和诺米林存在于柑橘果实中,本实验分析了6种柠檬果皮、果肉与果汁中柠檬苦素和诺米林的含量(表3)。结果表明,6种柠檬果汁中柠檬苦素和诺米林的含量均显著低于果皮和果肉,其中诺米林在扁红柠檬果汁中可检出,但因浓度低于定量限而无法准确定量,且柠檬苦素在扁红柠檬果汁中的含量也是最低,为 0.43 μg/g。柠檬苦素和诺米林在里斯本柠檬果皮中的含量均为最高,分别为166.85、199.20 μg/g,尤力克柠檬果皮次之,分别为166.75、193.60 μg/g。扁红柠檬、里斯本柠檬、美国粗柠檬和尤力克柠檬果皮中柠檬苦素和诺米林的含量以及柯尔提粗柠檬果皮的诺米林均大于其对应果肉中的含量,而北京柠檬果皮中的柠檬苦素和诺米林的含量均低于果肉,柯尔提粗柠檬果皮(115.85 μg/g)中柠檬苦素的含量略低于果肉(129.80 μg/g)。整体来看,柠檬果皮中类柠檬苦素的总含量大于果肉。
表3 柠檬果实中类柠檬苦素和酚酸类物质的含量 单位:μg/g
Table 3 The contents of limonoids and phenolic acids in 6 kinds of lemon fruits
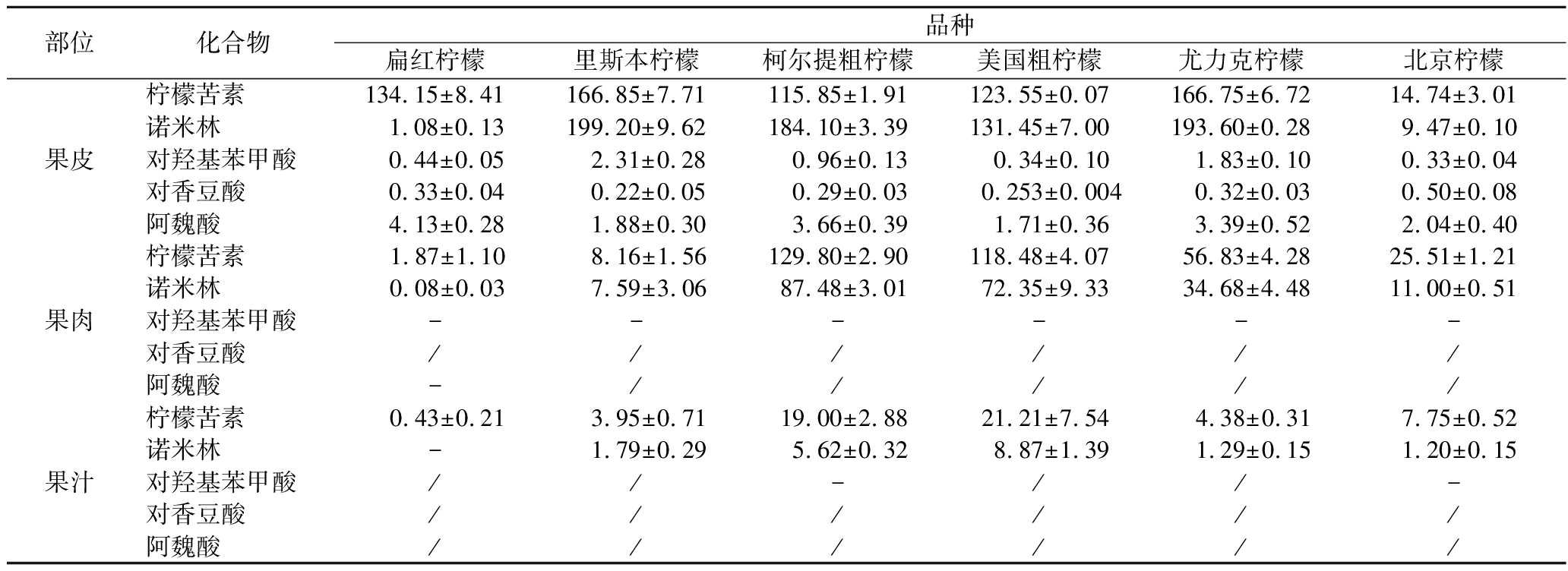
部位化合物品种扁红柠檬里斯本柠檬柯尔提粗柠檬美国粗柠檬尤力克柠檬北京柠檬果皮柠檬苦素诺米林对羟基苯甲酸对香豆酸阿魏酸134.15±8.41166.85±7.71115.85±1.91123.55±0.07166.75±6.7214.74±3.011.08±0.13199.20±9.62184.10±3.39131.45±7.00193.60±0.289.47±0.100.44±0.052.31±0.280.96±0.13 0.34±0.101.83±0.100.33±0.040.33±0.040.22±0.050.29±0.030.253±0.0040.32±0.030.50±0.084.13±0.281.88±0.303.66±0.39 1.71±0.363.39±0.522.04±0.40果肉柠檬苦素诺米林对羟基苯甲酸对香豆酸阿魏酸 1.87±1.10 8.16±1.56129.80±2.90118.48±4.0756.83±4.2825.51±1.210.08±0.037.59±3.0687.48±3.0172.35±9.3334.68±4.4811.00±0.51------//////-/////果汁柠檬苦素诺米林对羟基苯甲酸对香豆酸阿魏酸 0.43±0.21 3.95±0.7119.00±2.8821.21±7.54 4.38±0.317.75±0.52-1.79±0.295.62±0.32 8.87±1.391.29±0.151.20±0.15//-//-////////////
注:“/”,表示未检出;“-”,表示浓度低于定量限无法准确定量
从表3可知,对羟基苯甲酸、对香豆酸和阿魏酸在6种柠檬果皮均可检出并能准确定量,阿魏酸的含量显著高于对羟基苯甲酸和对香豆酸。其中,阿魏酸在扁红柠檬果皮中的含量最高为4.13 μg/g,柯尔提粗柠檬次之,美国粗柠檬含量最低。对羟基苯甲酸在扁红柠檬、里斯本柠檬、柯尔提粗柠檬、美国粗柠檬和尤力克柠檬果皮中的含量均高于对香豆酸,其在里斯本柠檬果皮中含量最高;而北京柠檬果皮中对羟基苯甲酸的含量略低于对香豆酸,但差异不显著。对羟基苯甲酸在6种柠檬果肉、柯尔提粗柠檬和北京柠檬的果汁中,阿魏酸在扁红柠檬的果肉中均有检出,但因其浓度低于定量限,故无法准确定量。
2.4 柠檬果实中4类生物活性成分的代谢轮廓及总体评价
由以上实验数据分析可知,柠檬果皮中所测生物活性物质的种类和含量均多于果肉和果汁。图3-a再次印证了该结果,柠檬果实中类黄酮、酚酸、类柠檬苦素和香豆素类物质的积累模式具有组织特异性,不同组织部位的种类和含量差异较大,以果皮中最丰富,果肉次之。由图3-b可知,6个柠檬品种中类黄酮、类柠檬苦素、酚酸和香豆素等26种物质的代谢具有多样性,其中里斯本柠檬和尤力克柠檬的代谢积累模式相近,而扁红柠檬与其他5种柠檬的生物活性成分代谢积累模式差异较大。同时,除扁红柠檬之外,其他5个品种都是橙皮苷的含量最高,扁红柠檬中则以川陈皮素和桔皮素等多甲氧基黄酮的含量居高,与图1结果一致。
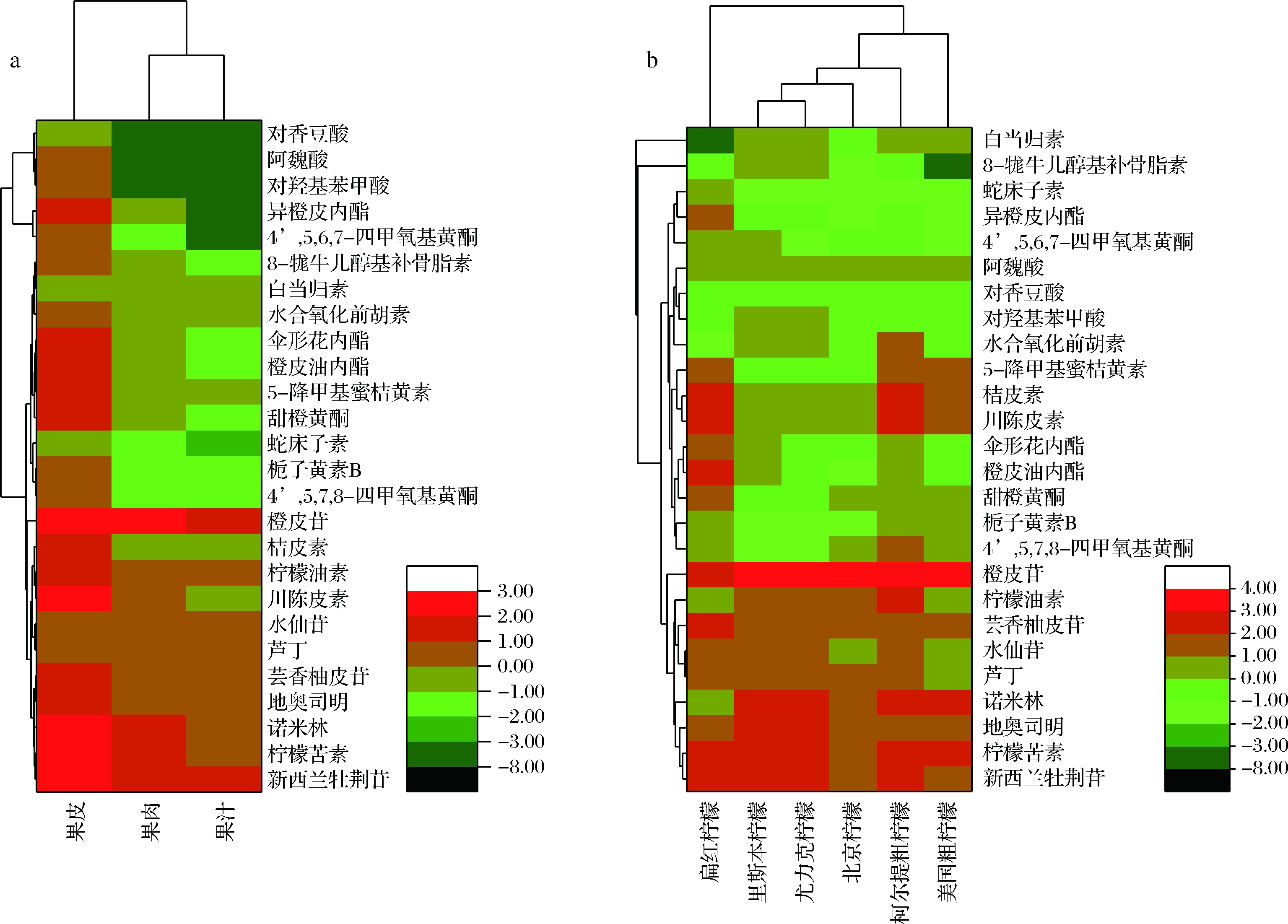
a-不同部位;b-不同品种
图3 各种化合物在柠檬的不同部位和不同品种中的积累规律
Fig.3 Accumulation patterns of the compounds in different tissues and varieties of lemon
本研究中尤力克柠檬果皮和果汁的主要类黄酮为橙皮苷、新西兰牡荆苷和地奥司明,与于玉涵等[18]研究结果中橙皮苷、圣草枸橼苷、地奥司明和芦丁为尤力克柠檬果皮和果汁中主要类黄酮略有不同。原因可能是提取与检测方法的差异以及尤力克柠檬产地不同。CARISTI等[19]测定了西西里的柠檬品种果汁中3种类黄酮的含量,其中“Femminello commune”和“Interdonato”2个品种的果汁中橙皮苷的含量最高,圣草枸橼苷次之,地奥司明第3。BARRECA等[8]研究发现地中海甜柠檬的柠檬汁所含的8种类黄酮中橙皮苷含量最高,为4.29 mg/L。GIRONÉS-VILAPLANA等[10]对“Fino”柠檬汁中类黄酮和羟基肉桂酸类化合物含量的分析中,橙皮苷的含量最高,与本研究结果一致。曾凡坤等[20]曾对邓肯葡萄柚、琯溪蜜柚和大红袍红桔等多种柑桔果皮、果汁和种子进行类柠檬苦素的定量检测分析,结果表明类柠檬苦素在种子中含量最高,果皮次之,果汁中的含量最低,这与本文研究结果基本一致,均为果皮中的类柠檬苦素含量大于果汁。ZHANG等[21]研究发现,中国野生柑橘果实中的酚酸主要以肉桂酸型为主,阿魏酸和对香豆酸均为肉桂酸型酚酸,其中阿魏酸是含量最丰富的酚酸。张静等[22]对9种晚熟柑橘的果皮、果肉和果汁中的7种酚酸进行定量分析时发现,阿魏酸含量显著高于其他6种酚酸,本研究发现柠檬果皮中阿魏酸的含量显著高于对香豆酸和对羟基苯甲酸,是所测3种酚酸中占主导地位的酚酸。
与其他柑橘类果实相比[23-25],目前柠檬果实香豆素和呋喃香豆素类物质的研究鲜有报道。本研究对6种柠檬果皮、果肉和果汁中8种香豆素和呋喃香豆素类物质含量进行了较系统的分析鉴定与比较。不同柠檬品种、不同部位香豆素和呋喃香豆素类物质的含量均有不同程度的差异。果皮中的含量普遍高于果肉,果汁中含量最低。总体来看,柠檬油素、橙皮油内酯、伞形花内酯是柠檬果实中含量较高的香豆素类物质。
3 结论
本试验利用UPLC-Q-TOF-HRMS技术对6种柠檬果实不同部位(果皮、果肉和果汁)中的13种类黄酮、8种香豆素、2种类柠檬苦素和3种酚酸进行定量,建立了一种快速、灵敏测定柠檬中多类型生物活性成分含量的方法,该方法采用SWATH质谱数据采集模式结合特征二级碎片子离子峰面积进行外标法定量,可降低基质效应,并保证了筛查定量结果的准确性。方法学考察结果显示该方法具有良好的线性关系、灵敏度、精密度和准确度:线性方程的相关系数均在0.99以上;定量限最低可达0.001 μg/L;日内RSD不超过6.39%,日间RSD值不超过5.33%;加标回收率为(84.27±3.02)%~(114.25±1.77)%。定量结果表明,不同部位与不同品种的柠檬样品中26种生物活性成分的含量存在较大差异,柠檬果皮中生物活性成分的含量显著高于果肉和果汁。26种生物活性成分在6种柠檬样品中的含量排序为:柯尔提粗柠檬>里斯本柠檬>尤力克柠檬>美国粗柠檬>扁红柠檬>北京柠檬,其中类黄酮和香豆素在柯尔提粗柠檬中的含量最高,类柠檬苦素含量在里斯本柠檬中最高,酚酸含量在尤力克柠檬最高。对多类型生物活性成分而言,类黄酮的含量在26种生物活性成分中占比最高,是柠檬生物活性成分的主要来源之一,类柠檬苦素次之。以上结果表明该方法操作简便、灵敏可靠,适用于柠檬中多类型生物活性成分的快速筛查定量分析,为我国柠檬资源的开发利用提供重要的参考价值。该方法有通用性,为柑橘生物活性成分的定性定量研究提供了简便、可靠的检测分析技术。
[1] GONZ LEZ-MOLINA E, MORENO D A, GARC
LEZ-MOLINA E, MORENO D A, GARC A-VIGUERA C.A new drink rich in healthy bioactives combining lemon and pomegranate juices[J].Food Chemistry, 2009, 115(4):1 364-1 372.
A-VIGUERA C.A new drink rich in healthy bioactives combining lemon and pomegranate juices[J].Food Chemistry, 2009, 115(4):1 364-1 372.
[2] DEL R O J A, FUSTER M D, G
O J A, FUSTER M D, G MEZ P, et al.Citrus limon:A source of flavonoids of pharmaceutical interest[J].Food Chemistry, 2004, 84(3):457-461.
MEZ P, et al.Citrus limon:A source of flavonoids of pharmaceutical interest[J].Food Chemistry, 2004, 84(3):457-461.
[3] GONZ LEZ-MOLINA E, MORENO D A, GARC
LEZ-MOLINA E, MORENO D A, GARC A-VIGUERA C.Genotype and harvest time influence the phytochemical quality of Fino lemon juice (Citrus limon (L.) Burm.F.) for industrial use[J].Journal of Agricultural and Food Chemistry, 2008, 56(5):1 669-1 675.
A-VIGUERA C.Genotype and harvest time influence the phytochemical quality of Fino lemon juice (Citrus limon (L.) Burm.F.) for industrial use[J].Journal of Agricultural and Food Chemistry, 2008, 56(5):1 669-1 675.
[4] LORENTE J, VEGARA S, MART N, et al.Chemical guide parameters for Spanish lemon (Citrus limon (L.) Burm.) juices[J].Food Chemistry, 2014, 162:186-191.
N, et al.Chemical guide parameters for Spanish lemon (Citrus limon (L.) Burm.) juices[J].Food Chemistry, 2014, 162:186-191.
[5] 高炜, 刘剑波, 朱明扬, 等.4种柠檬不同组织的酚类物质分布及其抗氧化特性[J].中国食品学报, 2019, 19(2):281-290.
GAO W, LIU J B, ZHU M Y, et al.Distribution of phenolics in different tissues of four kinds of lemon and their antioxidant activity[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(2):281-290.
[6] KAWAII S, TOMONO Y, KATASE E, et al.Quantitation of flavonoid constituents in citrus fruits[J].Journal of Agricultural and Food Chemistry, 1999, 47(9):3 565-3 571.
[7] VAIO C D, GRAZIANI G, GASPARI A, et al.Essential oils content and antioxidant properties of peel ethanol extract in 18 lemon cultivars[J].Scientia Horticulturae, 2010, 126(1):50-55.
[8] BARRECA D, BELLOCCO E, CARISTI C, et al.Flavonoid profile and radical-scavenging activity of Mediterranean sweet lemon (Citrus limetta Risso) juice[J].Food Chemistry, 2011, 129(2):417-422.
[9] PETERSON J J, BEECHER G R, BHAGWAT S A, et al.Flavanones in grapefruit, lemons, and limes:A compilation and review of the data from the analytical literature[J].Journal of Food Composition and Analysis, 2006, 19:S74-S80.
[10] GIRONÉS-VILAPLANA A, VALENT O P, ANDRADE P B, et al.Phytochemical profile of a blend of black chokeberry and lemon juice with cholinesterase inhibitory effect and antioxidant potential[J].Food Chemistry, 2012, 134(4):2 090-2 096.
O P, ANDRADE P B, et al.Phytochemical profile of a blend of black chokeberry and lemon juice with cholinesterase inhibitory effect and antioxidant potential[J].Food Chemistry, 2012, 134(4):2 090-2 096.
[11] JUNGEN M, LOTZ P, PATZ C D, et al.Coumarins, psoralens, and quantitative 1H-NMR spectroscopy for authentication of lemon (Citrus limon[L.]Burm.f.) and Persian lime (Citrus × latifolia[Yu.Tanaka]Tanaka) juices[J].Food Chemistry, 2021, 359:129804.
[12] 涂勋良, 张利, 秦帆, 等.HPLC法测定不同产地和品种柠檬果皮中柠檬苦素和诺米林含量[J].广西植物, 2020, 40(5):744-750.
TU X L, ZHANG L, QIN F, et al.Determination of limomin and nomilin of different varieties of lemon peel from different areas by HPLC[J].Guihaia, 2020, 40(5):744-750.
[13] 赵希娟, 刘青桥, 邢天天.柑橘种子类柠檬苦素的分析及质谱裂解途径:基于UPLC-Q-TOF-MS的新方法[J].西南大学学报(自然科学版), 2018, 40(11):20-29.
ZHAO X J, LIU Q Q, XING T T.Analysis of limonoids in citrus seeds and their fragmentation pathways:A new method based on UPLC-Q-TOF-MS[J].Journal of Southwest University (Natural Science Edition), 2018, 40(11):20-29.
[14] 王梦颖, 陈烨超, 涂凤琴, 等.超高效液相色谱-四极杆-飞行时间高分辨质谱用于乳液类化妆品中9种抗过敏违禁药物的筛查和定量分析[J].色谱, 2020, 38(12):1 423-1 430.
WANG M Y, CHEN Y C, TU F Q, et al.Screening and quantitative analysis of nine illicit antiallergics in emulsion cosmetics by ultra-high performance liquid chromatography-quadrupole-time-of-flight high-resolution mass spectrometry[J].Chinese Journal of Chromatography, 2020, 38(12):1 423-1 430.
[15] 庞雯辉, 赵希娟, 陈西, 等.超高效液相色谱-四极杆-飞行时间高分辨质谱法快速筛查柠檬果实中的生物活性成分[J].食品与发酵工业, 2021, 47(4):222-230;235.
PANG W H, ZHAO X J, CHEN X, et al.Ultra-performance liquid chromatography-quadrupole-time-of-flight high-resolution mass spectrometry method for rapid screening of bioactive compounds in lemon fruits[J].Food and Fermentation Industries, 2021, 47(4):222-230;235.
[16] SCHUBERT O T, RÖST H L, COLLINS B C, et al.Quantitative proteomics:Challenges and opportunities in basic and applied research[J].Nature Protocols, 2017, 12(7):1 289-1294
[17] MART NEZ-BUENO M J, G
NEZ-BUENO M J, G MEZ RAMOS M J, BAUER A, et al.An overview of non-targeted screening strategies based on high resolution accurate mass spectrometry for the identification of migrants coming from plastic food packaging materials[J].TrAC Trends in Analytical Chemistry, 2019, 110:191-203.
MEZ RAMOS M J, BAUER A, et al.An overview of non-targeted screening strategies based on high resolution accurate mass spectrometry for the identification of migrants coming from plastic food packaging materials[J].TrAC Trends in Analytical Chemistry, 2019, 110:191-203.
[18] 于玉涵. 柠檬中黄酮类化合物和辛弗林的检测和含量特征分析[D].重庆:西南大学, 2011.
YU Y H.Determination and quantitation of flavonoids and synephrine in lemon fruits[D].Chongqing:Southwest University, 2011.
[19] CARISTI C, BELLOCCO E, PANZERA V, et al.Flavonoids detection by HPLC-DAD-MS-MS in lemon juices from Sicilian cultivars[J].Journal of Agricultural and Food Chemistry, 2003, 51(12):3 528-3 534.
[20] 曾凡坤, 邹连生, 焦必林.柑桔中类柠檬苦素含量及分布研究[J].中国食品学报, 2003, 3(4):79-81.
ZENG F K, ZOU L S, JIAO B L.Study on the content and distribution of limonoides in citrus fruits[J].Journal of Chinese Institute of Food Science and Technology, 2003, 3(4):79-81.
[21] ZHANG Y M, SUN Y J, XI W P, et al.Phenolic compositions and antioxidant capacities of Chinese wild mandarin (Citrus reticulata Blanco) fruits[J].Food Chemistry, 2014, 145:674-680.
[22] 张静, 朱丽莎, 张耀海, 等.不同晚熟柑橘中酚类物质的含量检测及分析[J].食品与机械, 2018, 34(12):27-33;69.
ZHANG J, ZHU L S, ZHANG Y H, et al.Determination and content analysis of phenolic compounds in different late-maturing Citrus of China[J].Food & Machinery, 2018, 34(12):27-33;69.
[23] GUO P M, PANG W H, ZHAO X J, et al.A rapid UPLC-QqQ-MS/MS method for targeted screening and quantitative analysis of secondary metabolites in Satsuma mandarin[J].European Food Research and Technology, 2021, 247(7):1 725-1 736.
[24] ZHONG Y M, FENG Y F, WU X, et al.Rapid identification of coumarins from fructus citri sarcodactylis by UPLC/Q-TOF-MS[J].Natural Product Research, 2015, 29(1):53-58.
[25] DUGRAND A, OLRY A, DUVAL T, et al.Coumarin and furanocoumarin quantitation in citrus peel via ultraperformance liquid chromatography coupled with mass spectrometry (UPLC-MS)[J].Journal of Agricultural and Food Chemistry, 2013, 61(45):10 677-10 684.