辅酶Q10(coenzyme Q10,CoQ10)是一种脂溶性醌类化合物。作为天然存在的辅酶,CoQ10是人体必需的抗氧化剂和电子传递体,在呼吸作用中是非常关键的物质,能够增强胞内ATP的供给,降低体内自由基,抵抗氧化,帮助延缓衰老,提高机体免疫力[1]。CoQ10在食品、医药、化妆品和畜牧饲料领域有广泛应用,市场需求和技术应用日趋增加[2-3]。目前,CoQ10的生产方法主要是发酵法,该方法不仅仅可以扩大生产规模,在生产力层面占据优势,又因其是微生物自身合成的产物,CoQ10的下游产物均是具有良好生物活性的反式结构,相比于动植物组织提取法和化学合成法,发酵法生产成本更有竞争力[4]。类球红细菌(Rhodobacter sphaeroides)是一种古老的原核生物,广泛存在于农田、池塘、湖泊和海洋中。类球红细菌具有多种代谢途径,如光能自养、光能异养和化能异养。同时,类球红细菌可以利用多种小分子有机物为碳源合成增值产品,如微生物蛋白、类胡萝卜素、细菌叶绿素、CoQ10和长链游离脂肪酸等[5]。
CoQ10合成途径较为复杂,当前主要针对其合成关键机理及其限速酶进行解析,通过代谢途径和基因表达元件的调控等方式提高CoQ10效价[6-7]。目前,国内CoQ10的生产效率并不能满足当前我国日益增长的需求,国内外多采用诱变育种和发酵过程优化来强化CoQ10的生产[8]。选育高产量的CoQ10生产菌是当前亟待解决的问题。常用的菌株诱变育种方法包括物理诱变和化学诱变[9-10]。近年研究中,常压室温等离子体(atmospheric and room temperature plasma,ARTP)技术因具有高突变率、低危险性及操作便利性等优势,在国内诱变研究工作中获得了更多青睐,如维生素K、吡咯喹啉醌和辅酶等重要物质高产菌株的筛选研究进展迅速[11-12]。但是,诱变筛选的过程常常难以控制,菌株随机突变而导致筛选过程难以实现高效率和高正向突变率的问题仍然存在[13]。近年来,高通量筛选方法因其高自动化和高效率的特点迅速崛起,此类平台为CoQ10高产菌株的高效筛选提供了新思路[14-15]。能够简便而快速筛选到更多正向突变菌株的筛选方法亟待被开发,用以应对CoQ10高产菌株的研究工作。
本研究以类球红细菌作为出发菌株,应用Craven test法以碱性环境下CoQ10上甲氧基和氰基的配合物在荧光条件下能够快速检测的原理为基础,确定了多孔板初筛高产CoQ10菌株的方法,采用ARTP诱变技术结合筛选因子维生素K3、对羟基苯甲酸(p-hydroxybenzoic acid,PHBA)和罗红霉素(roxithromycin,ROX)进行多轮诱变和发酵培养复筛,获得1株高产CoQ10的突变菌株,考察其遗传稳定性,并在摇瓶水平进行培养基成分和浓度的优化,最后在5 L发酵罐中进一步优化发酵条件,以强化类球红细菌的生产性能。该研究亦可为其他维生素的高产菌株的筛选提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
出发菌株为类球红细菌(Rhodobacter sphaeroides),由本实验室保藏。
1.1.2 菌株培养基
平板培养基(g/L):酵母粉15.0,KH2PO4 1.0,NaCl 2.0,FeSO4·7H2O 0.1,MgSO4·7H2O 0.5,MnSO4 0.09,CoCl2 0.003,氯化胆碱0.012 12,琼脂粉18.0,pH 7.0~7.2。121 ℃灭菌20 min。
种子培养基(g/L):(NH4)2SO4 2.5,酵母粉1.0,谷氨酸钠0.5,玉米浆干粉0.5,葡萄糖4.0,KH2PO4 0.5,K2HPO4 0.5,NaCl 2.0,FeSO4·7H2O 0.1,MgSO4·7H2O 2.0,MnSO4 0.03,CoCl2 0.001,CaCO3 8.0,氯化胆碱0.004,pH 6.6~7。115 ℃灭菌20 min。
发酵培养基(g/L):(NH4)2SO4 2.5,谷氨酸钠2.5,玉米浆干粉3.5,KH2PO4 0.45,NaCl 2.0,FeSO4·7H2O 1.2,MgSO4·7H2O 11.0,MnSO4 0.05,CaCl2 0.07,CaCO3 8.0,氯化胆碱0.002 8。121 ℃灭菌20 min。
发酵培养基辅料(g/L):维生素B1 0.605,维生素B2 0.060 5,维生素B6 0.111 3,烟酸0.687 5,烟酰胺0.687 5,叶酸0.033,泛酸钙0.011,生物素0.021 7,0.22 μm水系膜过滤。
1.1.3 主要试剂和主要仪器
硫胺素、生物素、烟酸、PHBA、维生素K3、ROX、CoQ10标准品、DMF、甲醇、乙醇(色谱纯),阿拉丁试剂(上海)有限公司;谷氨酸钠、NaOH、(NH4)2SO4、CaCO3、FeSO4、MnSO4、CoCl2、无水乙醇,国药集团化学试剂有限公司;玉米浆干粉,上海源叶生物有限公司。
ZQZY-80AS摇床,上海知楚仪器有限公司;LC-6AD高效液相色谱仪,日本Shimadzu公司;Nanodrop ND-2000分光光度计,美国Thermo公司;Applied Biosystems台式离心机,美国Eppendorf公司;ARTP-IIS常压室温等离子体诱变仪,无锡源清天木生物科技有限公司;synergy H1酶标仪,南京拜尔沃克智能科技有限公司;T&J-TypeA 5L发酵罐,迪必尔生物工程(上海)有限公司。
1.2 实验方法
1.2.1 ARTP诱变处理
采用ARTP育种仪对出发菌株R.sphaeroides进行诱变。诱变条件:等离子体的输出功率为120 W;氦气流速为10 L/min;等离子体激发器与样品之间的距离为2 mm;突变细菌的悬浮液体积为10 μL;将10 μL细菌悬浮液铺在无菌不锈钢载片上(ARTP仪器配件)。诱变处理不同时间:从0 s开始,每一次增加30 s,最长的处理时间为150 s。诱变后,将包含细菌悬液的整个载片放入含有1 mL无菌生理盐水的2 mL无菌EP管中。用涡旋振荡器洗脱2 min后,梯度稀释后取100 μL菌溶液,涂在含有筛选因子的平板培养基上,在生化培养箱中于32 ℃孵育3 d,观察平板上菌落的生长情况并计算致死率。
1.2.2 致死率测定
取经过ARTP不同照射时间处理后的稀释10-4、10-5梯度的平板培养基(每个梯度进行3组重复),分别统计菌落个数,按照公式(1)计算致死率:
致死率![]()
(1)
式中:在同一稀释梯度下,N,未经诱变的空白对照平板上长出的单菌落个数;M,经过诱变处理后的平板上长出的单菌落个数。
1.2.3 高通量筛选方法
按照所选用90~120 s的时间进行ARTP诱变处理,处理完毕的菌悬液用无菌生理盐水稀释,然后吸取100 μL,涂布于含DMF、PHBA、ROX、维生素K3的筛选平板中,各3个平行,32 ℃静置避光倒立培养,3~8 d观察并统计单菌落数。通过比较突变菌株生长的菌落大小,挑选饱满的单菌落接种孔板筛选,平板划线保存。
将成熟后的单菌落挑选于含有1 200 μL种子培养基的48深孔板中,在32 ℃、220 r/min培养28 h,以10%的接种量转接于含有1 200 μL液体筛选培养基的24深孔板中,在32 ℃、220 r/min条件下培养48 h。从多孔板培养中取发酵48 h的发酵液至24深孔板中,提取CoQ10后吸取400 mL提取液与1 mL的体积分数0.5%的KOH以及1 mL氰基乙酸乙酯(ethyl cyanoacetate,ECA)充分混合,避光条件下25 ℃静置30 min后,吸取200 μL转移到96浅孔板中,使用酶标仪检测在λex/λem=430/530 nm处的荧光值,检测同样条件下的培养基,扣除培养基背景噪音,荧光值越高表明CoQ10量越高,挑取高于对照10%以上的优势菌株复筛。
摇瓶水平复筛后选取的优势菌株检测效价,挑取高于对照10%以上的优势菌株-80 ℃保存。进行传代培养,成熟后进行摇瓶筛选,将确定了遗传稳定性的高产菌株进行-80 ℃保存。
1.2.4 液相检测条件
CoQ10的提取:取1 mL发酵液于1.5 mL的EP管中,加入20 μL的HCl溶液,2 mL丙酮,100 μL的H2O2,补充无水乙醇定容至10 mL,超声波提取45 min后,用0.22 μm有机滤膜过滤,吸取1 mL置于液相进样瓶中进行液相检测,根据标准曲线计算发酵液效价。
采用HPLC检测发酵液中CoQ10的效价。色谱柱:Diamonsil 5 μm C18 150 mm×4.6 mm,检测条件:流动相为V(无水乙醇)∶V(无水甲醇)=35∶65等速洗脱,洗脱流速为1.1 mL/min,吸收波长为275 nm,柱温为35 ℃,进样量20 μL。
1.2.5 摇瓶培养方法
将安瓿管中菌粉用培养基混匀后于32 ℃,220 r/min振荡培养,待菌株长至对数期进一步平板划线进行活化,32 ℃培养6~7 d。划线接种摇瓶种子32 ℃、转速220 r/min培养30 h,按10%(体积分数)接种量接入摇瓶发酵,于32 ℃、转速220 r/min下培养48 h,采用单因素试验确定碳源、PHBA、金属离子的最佳组合。
1.2.6 5 L发酵罐培养条件
在摇瓶水平得到的最优培养基的基础上,在5 L发酵罐上进行验证培养。通气量1 vvm,转速400 r/min,5 L发酵罐初始装液量为2.5 L,控制发酵罐内的葡萄糖质量浓度在5~12 g/L,用氨水维持pH为6.8。观察发酵过程中菌株的生长情况及CoQ10的合成情况。
2 结果与分析
2.1 ARTP诱变致死曲线的绘制
ARTP诱变育种技术使用等离子体对菌体内P—O键、C—N键等关键位置进行破坏,因此,微生物经过诱变处理后会大量死亡,但少部分存活的菌株会通过自身修复系统实现一定的修复作用,从而导致基因突变[16]。通过平板计数法计算类球红细菌的ARTP致死率,计算不同诱变时间处理后涂板所获得的菌落数,计算ARTP诱变致死率,绘制致死率曲线,结果如图1所示。对R.sphaeroides菌悬液处理时间从0~150 s,处理90 s后致死率达到了90%以上,处理150 s致死率达到95%以上。通常情况下,致死率越高时,菌株发生突变的概率越高,致死率达到85%~90%时较为合理[17]。因此,为了高效获得突变菌库,本研究选择处理时间120 s(90%左右的致死率)作为诱变剂时间,进行诱变处理。
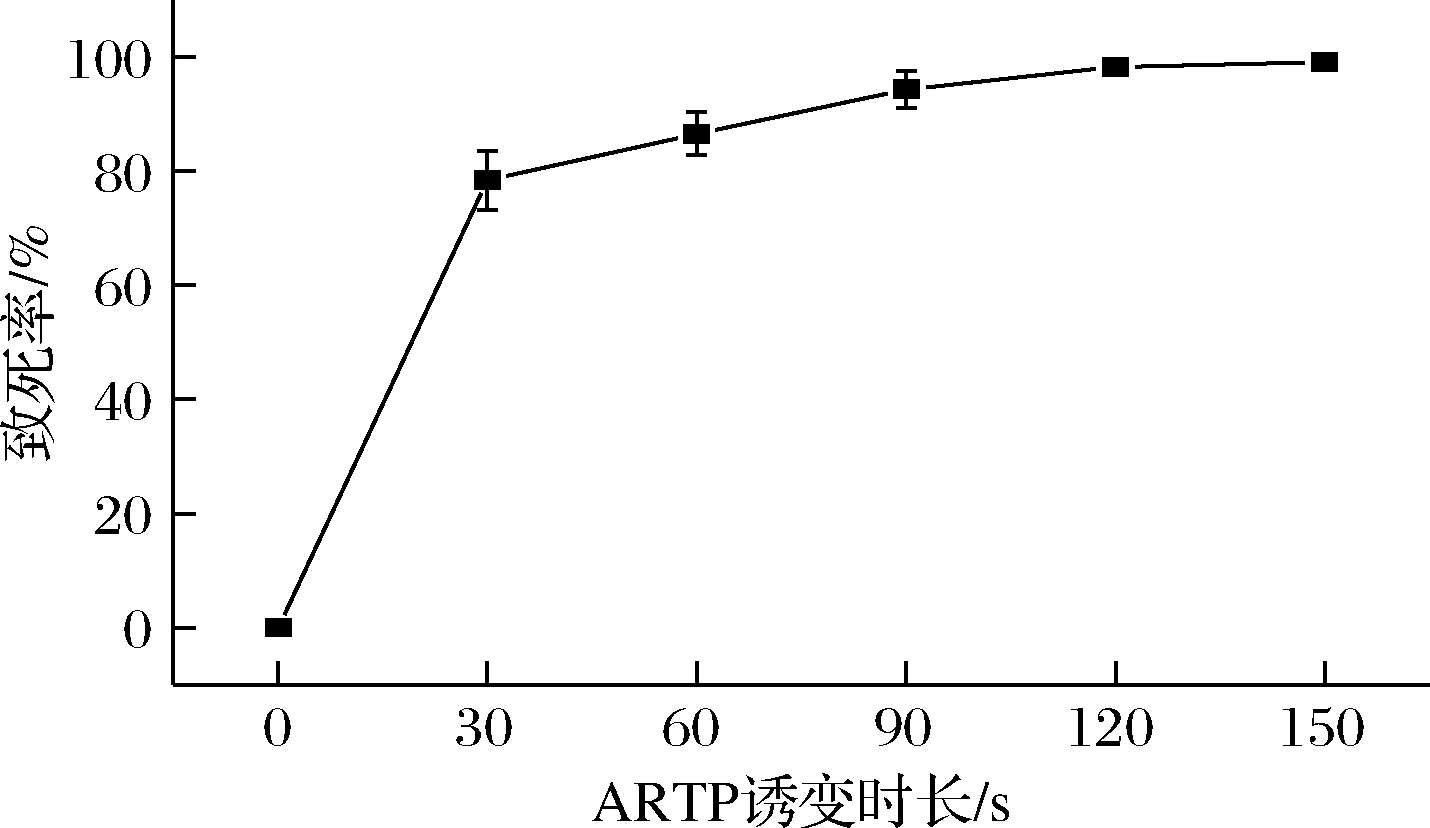
图1 致死曲线
Fig.1 The lethality curve
2.2 高产菌株诱变筛选方法与初筛
目前,CoQ10常用的检测方法包括高效液相色谱法、分光光度法、Craven test法。高效液相色谱法检测精准性高、范围广,但并不适用于高通量筛选检测。分光光度方法存在准确度不高和重复性较差等问题。本研究采用Craven test法,CoQ10的一个甲氧基被ECA的一部分取代,产生的化学衍生物可以在λex/λem=430/530 nm处通过荧光分光光度计检测[18]。如图2所示,使用Craven test法处理CoQ10的标品,避光条件中静置2 h后用酶标仪检测λex/λem=430/530 nm(检测CoQ10的终质量浓度分别为100、200、500、800、1 000 μg/mL)获得标准曲线y=3.299+364.57x(R2=0.998)。在100~1 000 μg/mL二者呈现良好的线性关系。因此使用本方法进行高通量筛选的初筛具有良好的可行性。
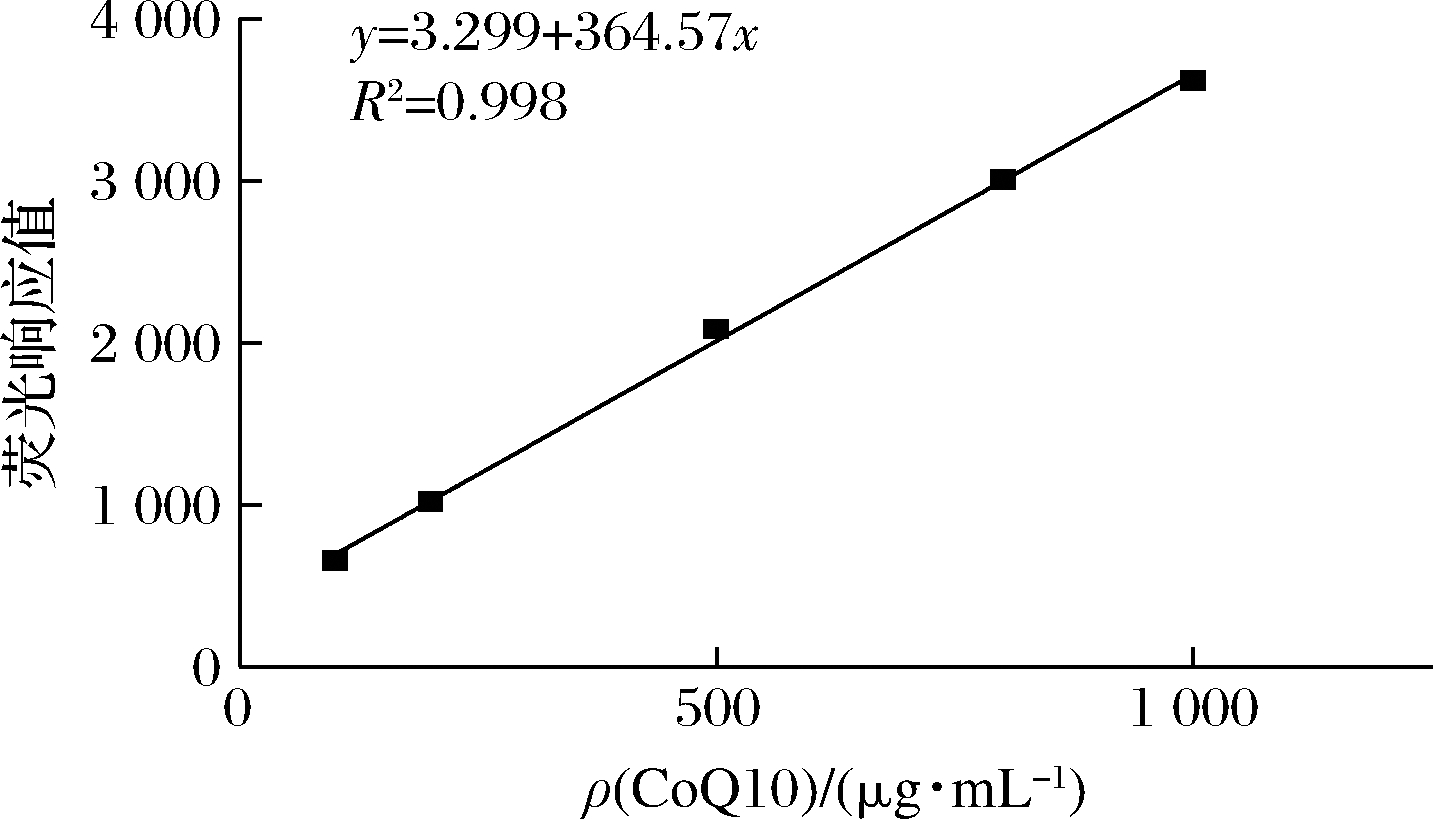
图2 Craven test法检测CoQ10的标准曲线
Fig.2 Standard curve of coenzyme Q10 detected
by Craven test method
通过培养平板中添加筛选因子,可以提高筛选正向突变的效率[19]。维生素K3是脂溶性物质,本实验使用DMF作为有机溶剂对其进行溶解。由表1可知DMF体积分数在0%~2.5%时对菌体的生长基本上没有影响,而体积分数超过7.5%时会对菌体生长产生明显抑制,因此,DMF的体积分数上限定为5.0%。
维生素K3是CoQ10的结构类似物,可用于筛选解除CoQ10产物抑制的菌株[19]。由表1可知,当维生素K3质量浓度在0.003~0.003 5 g/L时,平板上菌落正常,但随着维生素K3浓度的增加,菌落数减少;当质量浓度达到0.004 g/L时,由于受维生素K3的抑制作用比较明显,平板上无菌落生长。因此,确定筛选抗结构类似物突变株所用抗性平板中维生素K3质量浓度为0.003 5 g/L。
PHBA是CoQ10合成的重要前体物质,用于筛选解除前体抑制的菌株。由表1可知,随着PHBA浓度的增加,菌体的生长受到抑制逐渐加重,当质量浓度达到0.06 g/L时,没有菌落生长。因此,确定PHBA的最小抑制质量浓度为0.05 g/L。
ROX易与氧分子结合发生电荷转移形成超氧阴离子,用于筛选合成CoQ10能力强的菌株。由表1可知,随着ROX浓度的增加,菌体的生长抑制逐渐加重,当质量浓度达到0.007 5 g/L时,少有菌落生长。因此,确定ROX的最小抑制质量浓度为0.005 g/L。
表1 平板筛选因子浓度对菌体生长的影响
Table 1 Effect of plate screening factor concentration
on cell growth
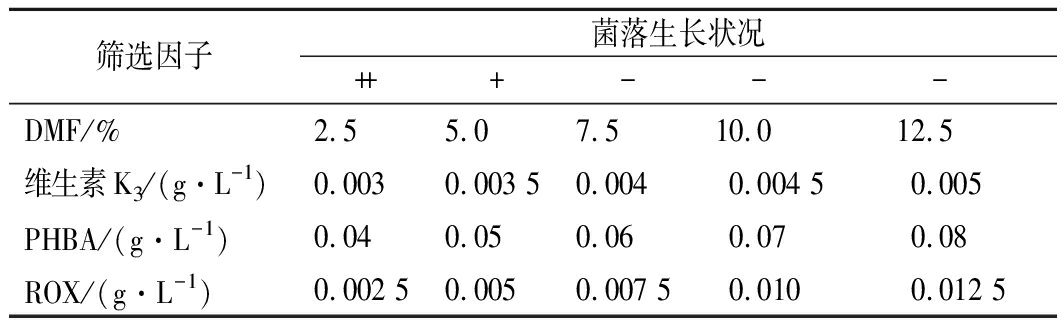
筛选因子菌落生长状况+++---DMF/%2.5 5.0 7.5 10.0 12.5 维生素K3/(g·L-1)0.0030.003 50.0040.004 50.005PHBA/(g·L-1)0.040.050.060.070.08ROX/(g·L-1)0.002 50.0050.007 50.0100.012 5
注:“+”代表有菌落生长,其数量代表菌落数量的多少;“-”代表无生长
本研究应用ARTP诱变处理CoQ10生产菌株R.sphaeroides,进行诱变处理,在孔板初筛阶段共进行6轮次的诱变处理,获得5 184株菌的突变菌库。使用本研究确立的高通量筛选方法获得126株正向突变的高产菌株(图3)从中选取孔板初筛效价提高12%以上的8株突变株进行下一步的摇瓶水平复筛,分别命名为64p12、622v22、61p20、7r16、64p5、7p22、61r21和521p10。
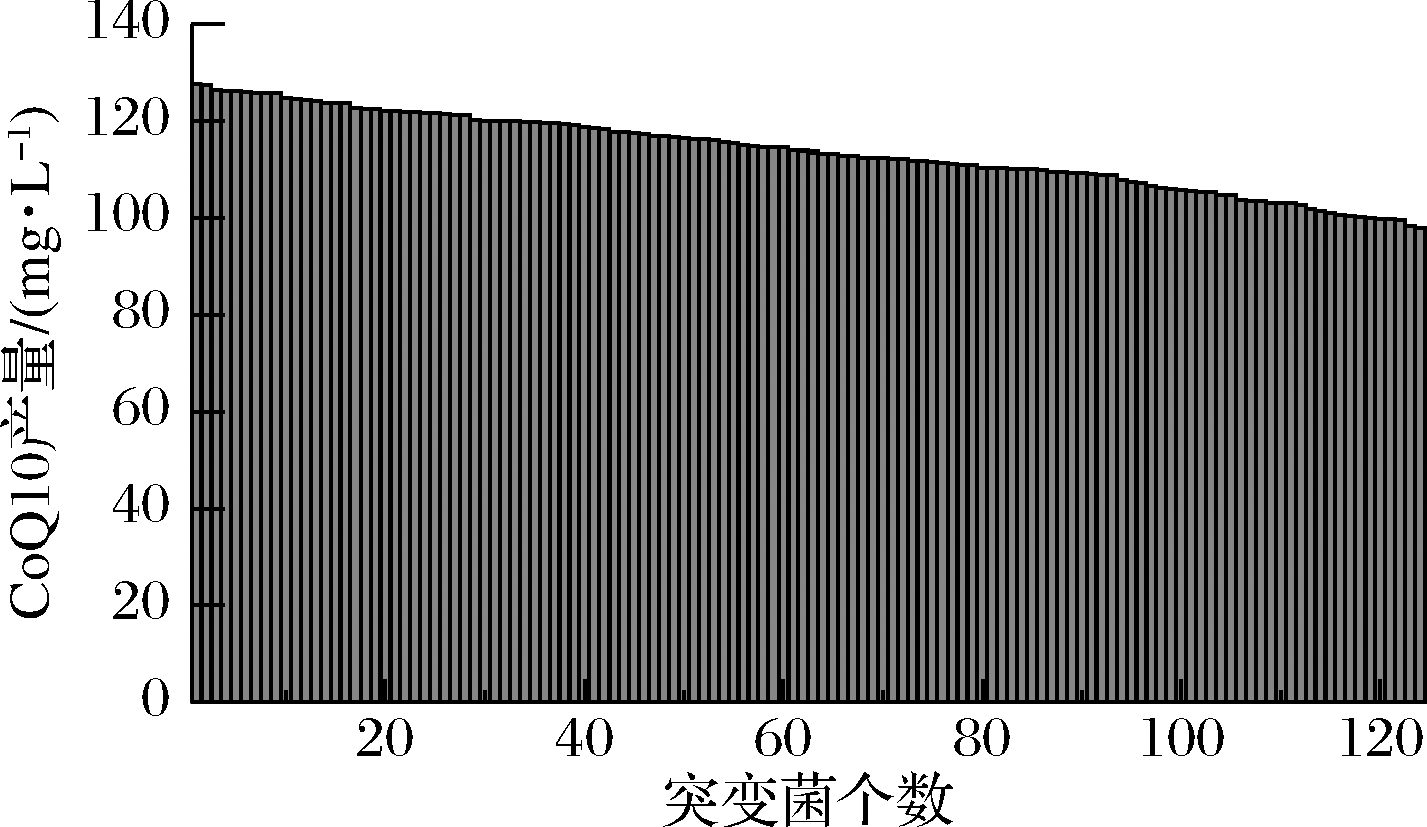
图3 ARTP诱变初筛
Fig.3 Primary screening with ARTP mutation
2.3 高产菌株的复筛与稳定性分析
将活化好的8株突变菌株进行摇瓶发酵复筛,以10%接种量转接至装有发酵培养基的250 mL摇瓶中,32 ℃、220 r/min条件下培养48 h,使用HPLC检测CoQ10。复筛结果如图4所示,获得高产菌株7p22,CoQ10的效价158.44 mg/L较出发菌株(136.47 mg/L)提高了16.1%。
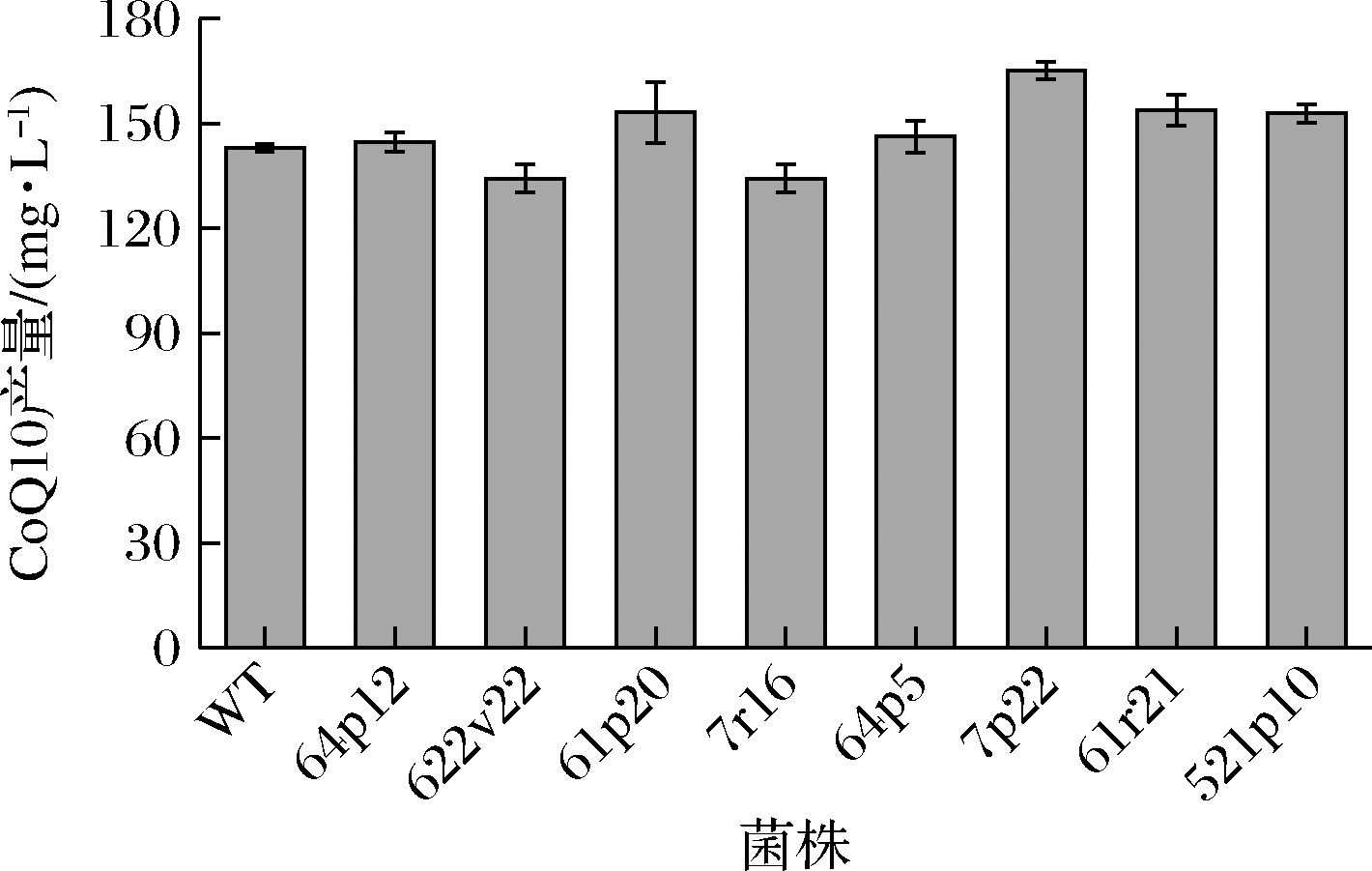
图4 摇瓶复筛
Fig.4 Second screening in the shake flasks
注:WT代表原始出发菌株(下同)
为了验证突变菌株的遗产稳定性,在摇瓶上高产菌株进行连续传代6次,以出发菌株为对照。对其中第1代、第3代和第6代进行摇瓶发酵,检测突变菌株的CoQ10发酵能力。结果如表2所示,传代至第4代时,突变体积累CoQ10的效价变化不明显。突变菌株积累的CoQ10的产量与第1代和第6代的产量基本相当。摇瓶验证结果表明3株高通量筛选获得的突变菌株具有稳定的遗传特性。
表2 突变菌株遗传稳定性
Table 2 The genetic stability of mutant strains
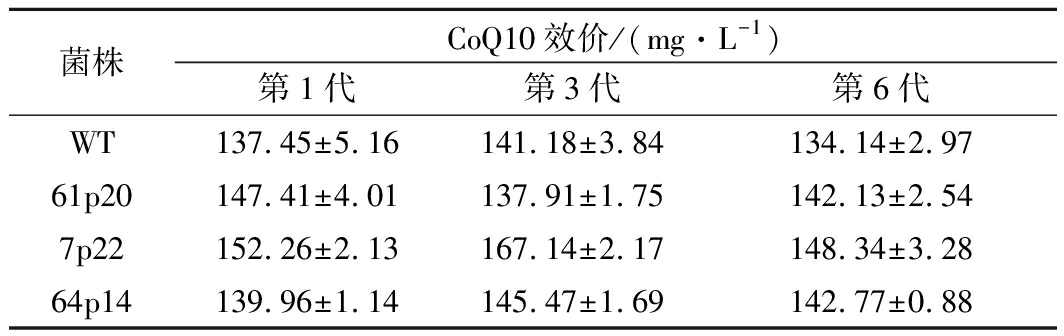
菌株CoQ10效价/(mg·L-1)第1代第3代第6代WT137.45±5.16141.18±3.84134.14±2.9761p20147.41±4.01137.91±1.75142.13±2.547p22152.26±2.13167.14±2.17148.34±3.2864p14139.96±1.14145.47±1.69142.77±0.88
2.4 摇瓶发酵培养基成分的优化结果
2.4.1 不同碳源条件对CoQ10的影响
在摇瓶水平上本研究选择了葡萄糖、麦芽糖、乙酸钠、果糖、甘油、蔗糖作为碳源,探究了几种不同的廉价碳源对CoQ10的影响,结果如图5所示,葡萄糖作为速效碳源时CoQ10产量最高可达143.4 mg/L (图5-a),有利于菌体的迅速生长(图5-c)。葡萄糖初始质量浓度添加量为30 g/L时更有利于CoQ10产物生产(图5-b、图5-d)。
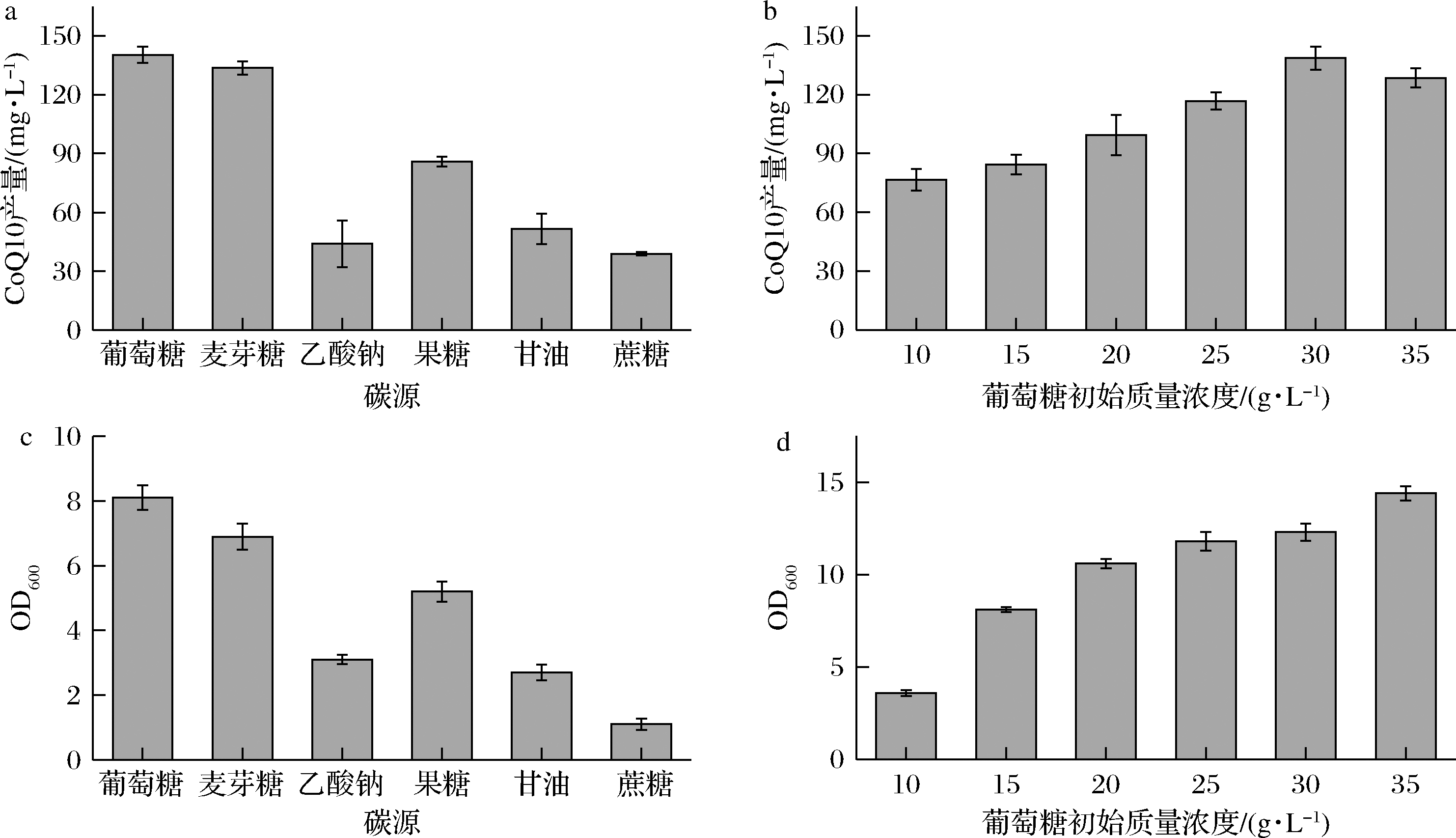
a-碳源种类对CoQ10产量的影响;b-葡萄糖初始质量浓度对CoQ10产量的影响;
c-碳源种类对生物量的影响;d-葡萄糖初始质量浓度对生物量的影响
图5 不同碳源下CoQ10的产量及OD600值
Fig.5 OD600value and CoQ10 titer of different carbon sources
2.4.2 不同浓度的PHBA对CoQ10的影响
本研究考察了不同浓度PHBA对和CoQ10合成的影响,结果如图6所示。初始添加质量浓度为37.5 mg/L时CoQ10产量达到93.8 mg/L,比对照组(73.8 mg/L)产量提升27.1%。当初始添加质量浓度超过50 mg/L时,前体物质抑制对菌体生长及CoQ10的产量有明显的影响,与前期筛选因子的选择实验结果吻合。因此选择初始添加PHBA质量浓度为37.5 mg/L更有利于CoQ10的合成。
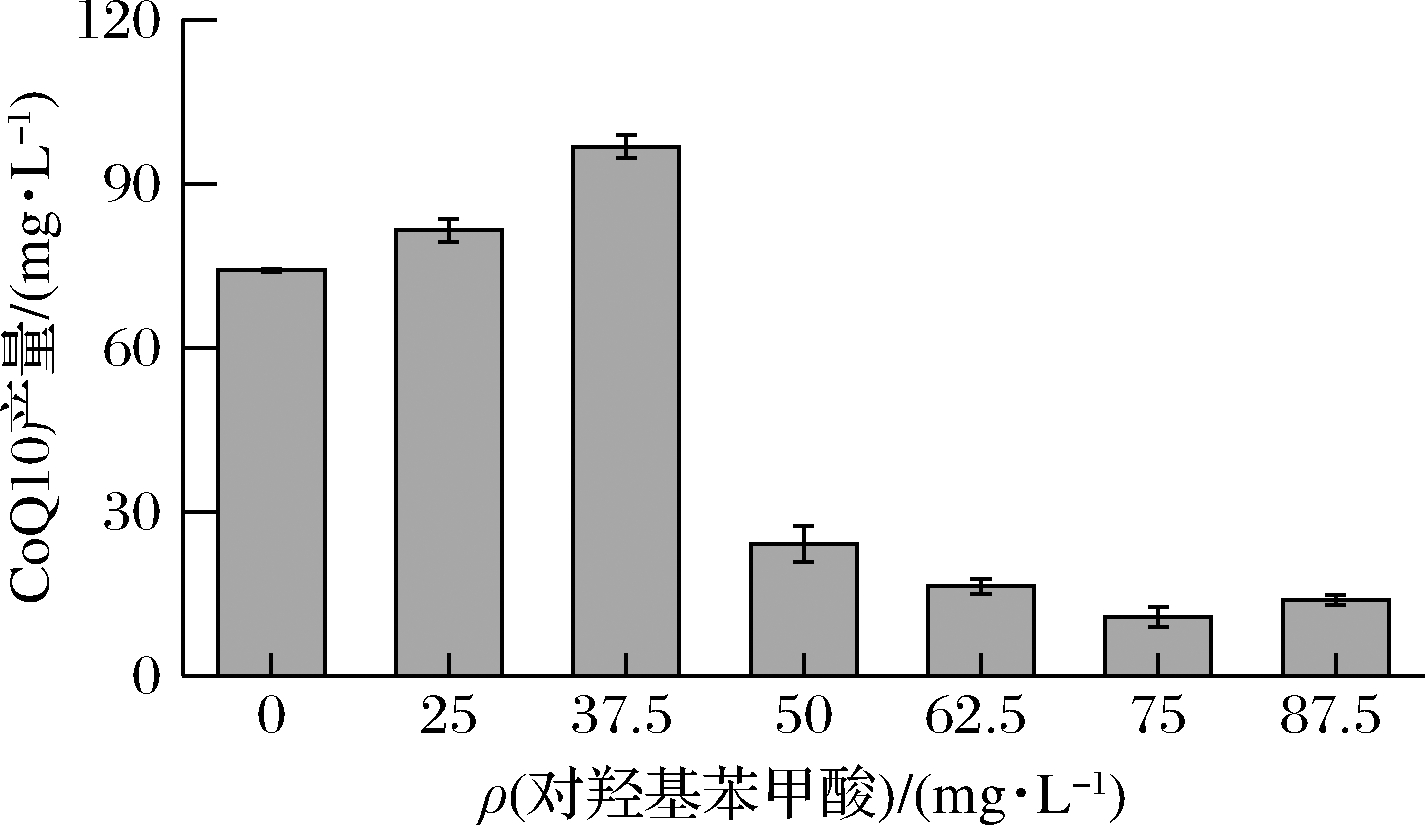
图6 不同浓度PHBA对CoQ10产量的影响
Fig.6 Effect of different concentrations of p-hydroxybenzoic
acid on titer of CoQ10
2.4.3 不同浓度的金属离子对CoQ10的影响
对发酵培养基无机盐进行单因素试验,确定发酵CoQ10各种无机盐的最适质量浓度范围,从图7中可以确定4种无机盐对CoQ10产量最适质量浓度分别为25、1.2、0.3和2.5 g/L。无机盐主要为微生物提供渗透压等环境,同时,许多盐离子作为重要的某些酶的酶活中心,能够明显地影响细胞的生长以及目标产物的合成,因此无机盐的浓度对微生物生长及合成CoQ10的影响同样很大。
2.5 5 L发酵罐优化
2.5.1 分批发酵
摇瓶阶段的发酵难以针对pH值、温度、溶氧等关键的发酵因素进行及时的检测与调节,5 L发酵罐更适合于满足菌体生长的需要。因此本研究探索在5 L发酵罐阶段中,分批发酵的策略培养类球红细菌,给后续实验提供经验。
发酵过程中菌体浓度、葡萄糖浓度以及CoQ10合成情况的变化,如图8所示。发酵60 h后停止发酵,OD600最高达到35.64,CoQ10产量达到256.6 mg/L。10 h后菌体生长进入对数期,葡萄糖被快速消耗,到40 h后葡萄糖被耗尽,菌体也随即停止生长,说明在分批发酵中葡萄糖是菌体生长和产物合成的限制性因素。
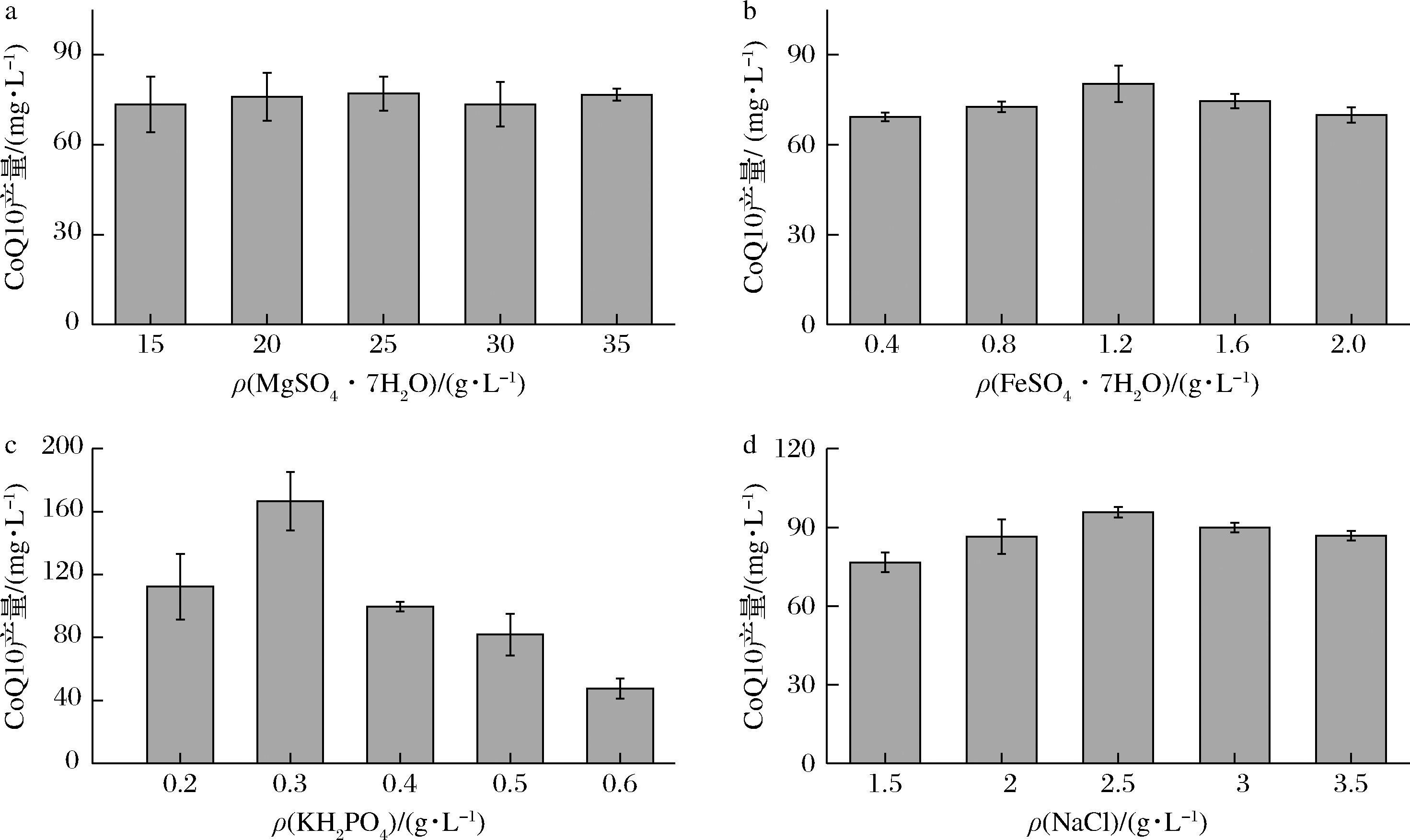
a-MgSO4·7H2O;b-FeSO4·7H2O;c-KH2PO4;d-NaCl
图7 金属离子浓度对CoQ10产量的影响
Fig.7 Effect of metal ions concentration on titer of CoQ10
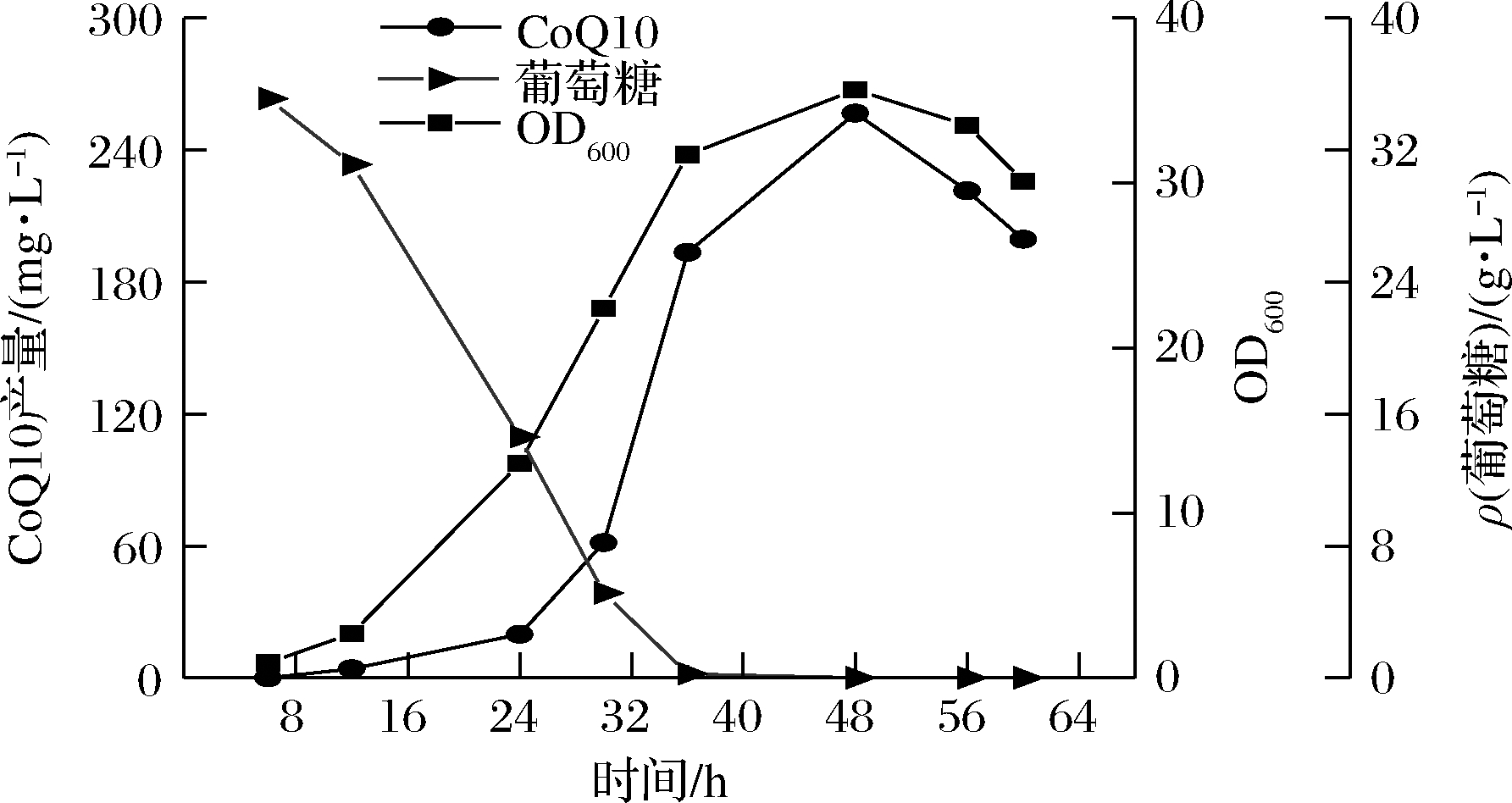
图8 5 L罐上分批发酵过程曲线
Fig.8 Batch fermentation process curve on 5 L bioreactor
2.5.2 连续流加补料发酵
分批补料发酵方式生产CoQ10可以减少发酵过程中底物过分消耗和代谢副产物积累对CoQ10的不利影响。应用恒定残糖浓度流加的方法,根据上一时间段的耗糖速率预测下一时刻的耗糖速率,从而将葡萄糖流速调至最适范围内,保持糖浓度的相对恒定。如图9所示,流加葡萄糖的补料分批发酵结果,碳源的流加补料延长了菌体的生长时间,60 h后OD600达116.8,此时CoQ10产量达973.61 mg/L。发酵50 h后,菌体生长逐渐缓慢,但单细胞耗糖速率保持较高水平,说明其他限制因子可能对菌体生长有影响。
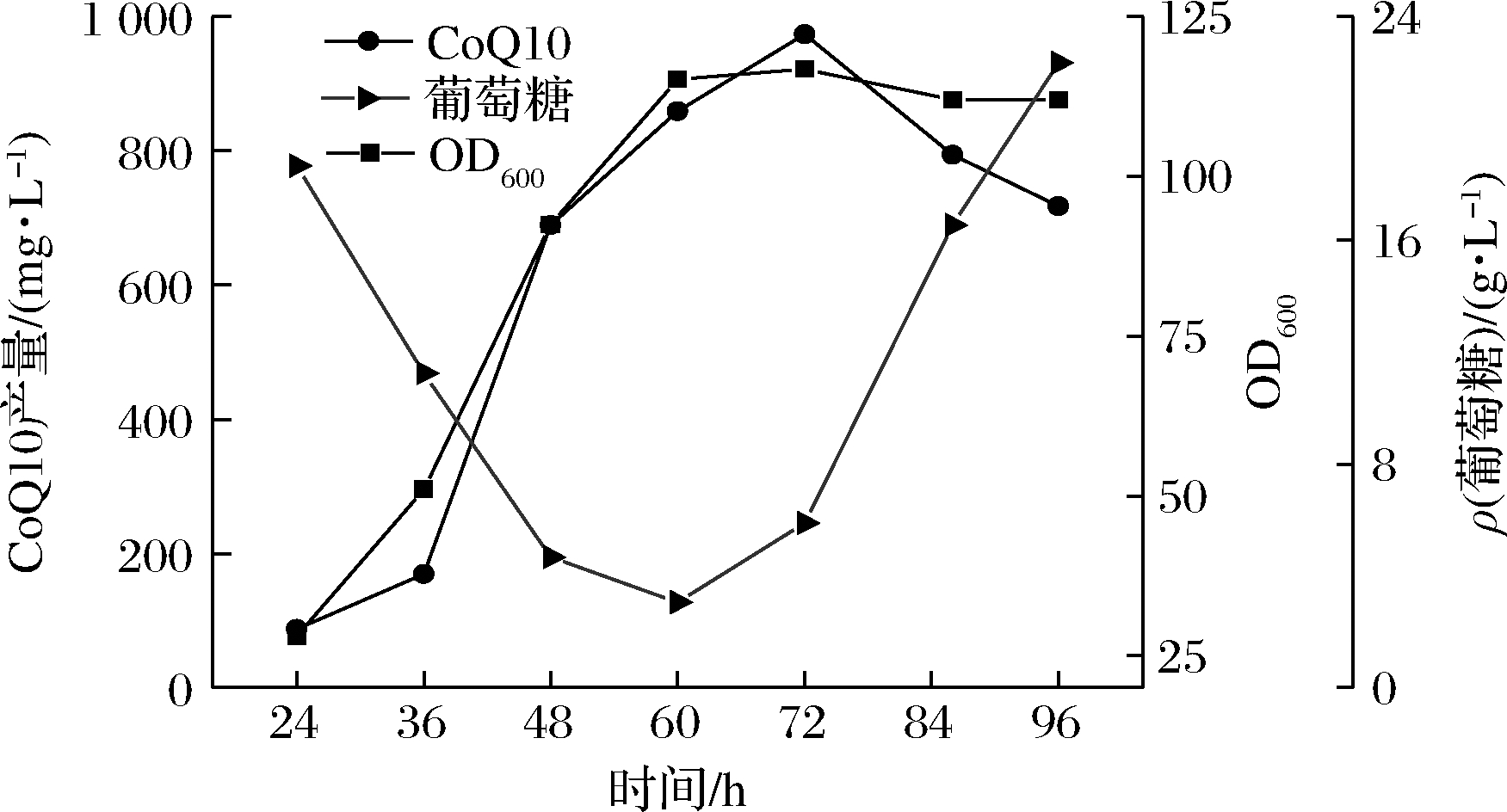
图9 5 L罐上流加葡萄糖的补料分批发酵过程曲线
Fig.9 Fed-batch fermentation with glucose feeding
fermentation process curve on 5 L bioreactor
2.5.3 溶氧(dissolved oxygen,DO)水平对CoQ10的影响
类球红细菌在发酵过程中对氧气的需求比较严格。过低的DO会导致菌体生长代谢受阻;而过量的氧会形成超氧化物O2-和过氧化物基O22-,破坏细胞组分,进而影响微生物生长[20]。为了确定发酵过程中最佳的DO条件,在其他条件不变的情况下,分别设置DO为5%和25%进行实验,通过溶氧偶联发酵罐的搅拌转速来研究DO对CoQ10发酵的影响。图10显示,DO为5%时,OD600和CoQ10最高达到134和1 411.05 mg/L,相较于DO为25%时,OD600和CoQ10分别为220和1 006.48 mg/L,低溶氧条件下,更利于发酵CoQ10的合成,高溶氧条件下,明显更利于菌体快速生长,但高溶氧对后期CoQ10的生产不利,具有抑制作用,与YOUSHIDA等[21]的报道基本符合。
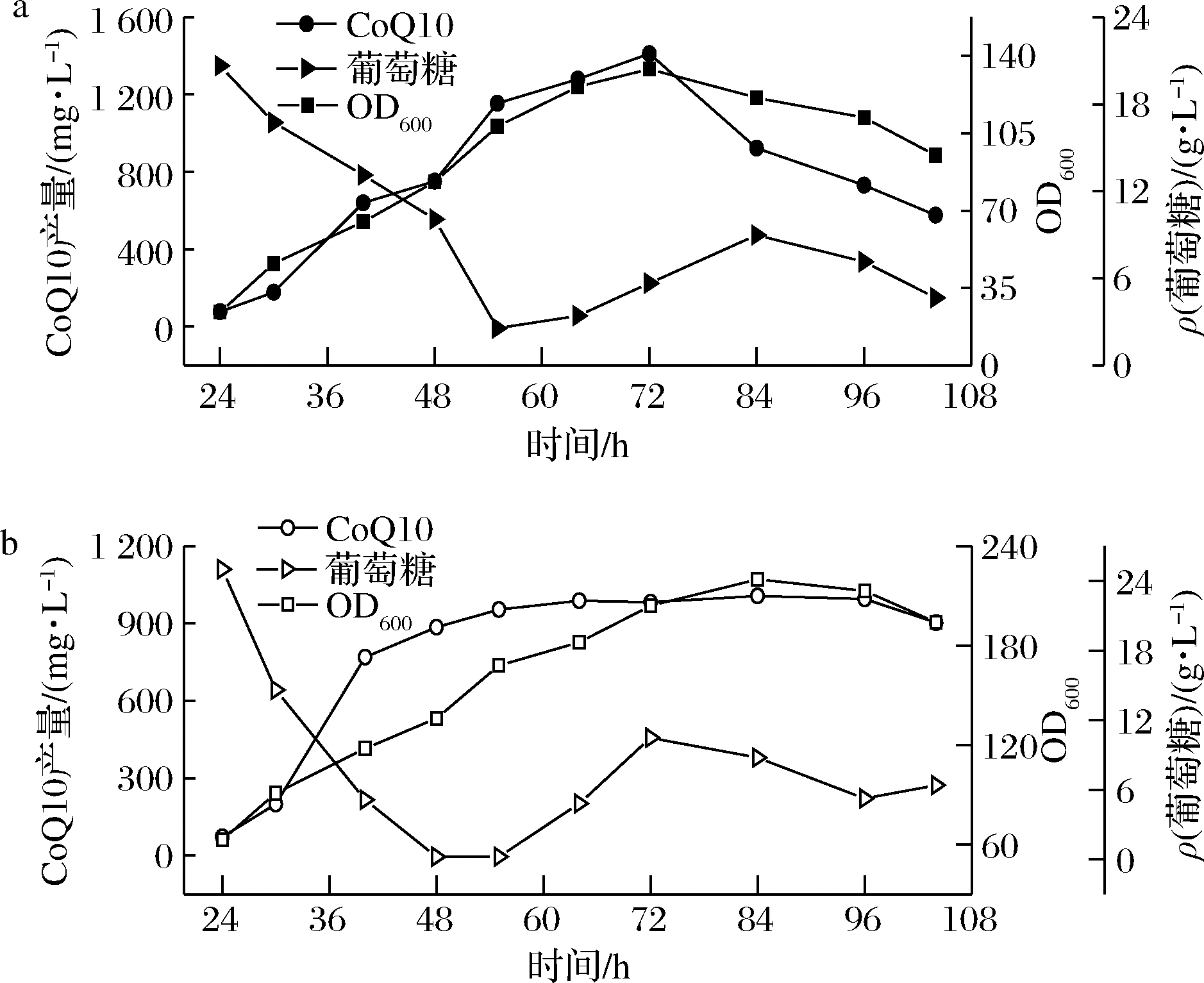
a-DO=5%;b-DO=25%
图10 不同DO条件对CoQ10产量的影响
Fig.10 Effect of different DO conditions on titer of CoQ10
2.5.4 补加无机磷对CoQ10的影响
磷元素在细胞代谢途径调节方面有着关键的作用,它不仅促进微生物生长,也能够为一些产物的提升做出贡献。CoQ10发酵过程中,通常选择流加高浓度的KH2PO4的方法来控制发酵液中磷元素的质量浓度为0.1~0.2 g/L。发酵过程中根据菌体的耗糖情况对流加速率做适当调整,控制葡萄糖质量浓度水平在5~10 g/L。由图11可知,菌体生长在72 h时达到对数生长后期,由于磷酸盐的加入使得菌体的生长周期延长,并且更有利于CoQ10的积累,于84 h时获得最高OD600达到172。发酵液CoQ10的产量为1 640.6 mg/L,比较不流加磷酸盐时CoQ10的产量显著提高。
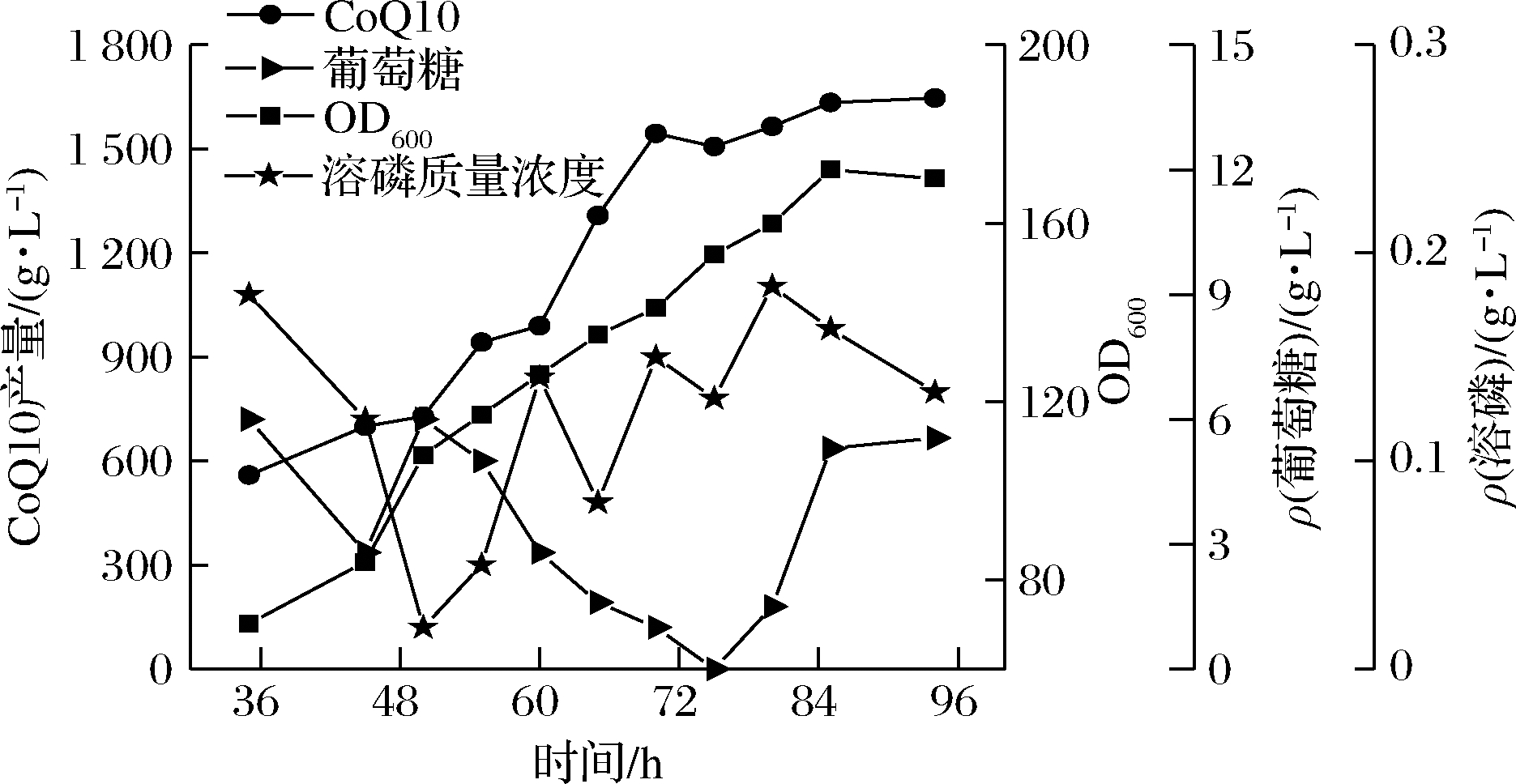
图11 连续流加分批发酵过程曲线
Fig.11 Continuous flow plus batch fermentation process curve
3 结论与讨论
CoQ10作为一种呼吸链传递系统的必需辅助因子,广泛应用于食品、医药、农业等行业。虽然在基因工程方面取得了一定的进展,如XU等[22]分析了类胡萝卜素途径和限速酶对CoQ10生产的影响;LU等[23]鉴定并消除泛醌修饰途径中的代谢瓶颈强化CoQ10的生产。但是CoQ10的合成途径复杂,通过基因工程获得CoQ10高产的菌株相对比较困难。目前主要是通过诱变育种和发酵工艺的优化强化生产,如梁琳琳[24]对Rhodopseudomonas palustris FM-01-12进行复合诱变和发酵优化后在50 L发酵罐上获得3 158 μg/mL的产量。ZHANG等[25]通过磷酸盐限制与葡萄糖补料分批发酵相结合的策略,R.sphaeroides ATCC BAA-808在100 L发酵罐上将CoQ10的产量提升至1.95 g/L。
本研究应用常温室压ARTP对CoQ10生产菌株R.sphaeroides进行诱变处理,针对CoQ10的特性确定了借助维生素K3、PHBA、ROX作为筛选因子的筛选手段,结合Craven test检测方法应用ECA碱性条件下在酶标仪中快速地对CoQ10的检测功能,对5 184株诱变菌株库进行分选、检测。从分选出的8个正向突变株中选取了1株CoQ10高产菌株7P22,相比于初始菌株提升了16.1%,遗传稳定性良好。针对筛选得到的高产菌株进行了摇瓶水平上的碳源、前体物质PHBA及金属离子的成分优化,将突变菌株和优化后的发酵培养基在5 L发酵罐上进行放大培养并对发酵罐水平的发酵条件进行优化,发酵84 h后CoQ10产量达到1 640.6 mg/L。本研究针对诱变育种的高通量筛选方式和发酵优化的方法对高产CoQ10的菌株进行研究,今后的研究可以寻找代谢途径关键的前体物质、氧化性强等产物针对性明显的细胞毒性物质作为正向突变菌株筛选因子,作为高产CoQ10的菌株选育的理性基础。结合流式细胞分选技术等更大规模高自动化的先进技术提高筛选通量,从而更高效的筛选高产突变株,进入工业菌株选育研究模式的更高层次,从而应对社会对CoQ10等高价值维生素的需求;另外,5 L发酵罐的溶氧、尾气、罐压等参数的检测条件有限,今后的研究可以在更大规模的发酵罐中进行优化,并结合氧传递系数(KLa)进行优化,从而进步强化CoQ10的积累。
[1] 陆文强. 类球红细菌中辅酶Q10的代谢工程研究及应用[D].杭州:浙江大学, 2014.
LU W Q.Metabolic engineering of the coenzyme Q10 pathway in Rhodobacter sphaeroides and its application[D].Hangzhou:Zhejiang University, 2014.
[2] RAIZNER A E, QUI ONES M A.Coenzyme Q10 for patients with cardiovascular disease:JACC focus seminar[J].Journal of the American College of Cardiology, 2021, 77(5):609-619.
ONES M A.Coenzyme Q10 for patients with cardiovascular disease:JACC focus seminar[J].Journal of the American College of Cardiology, 2021, 77(5):609-619.
[3] HERN NDEZ-CAMACHO J D, BERNIER M, L
NDEZ-CAMACHO J D, BERNIER M, L PEZ-LLUCH G, et al.Coenzyme Q10 supplementation in aging and disease[J].Frontiers in Physiology, 2018, 9:44.
PEZ-LLUCH G, et al.Coenzyme Q10 supplementation in aging and disease[J].Frontiers in Physiology, 2018, 9:44.
[4] 史立康, 徐尔尼, 汪金萍, 等.微生物发酵生产辅酶Q10的研究进展[J].中国酿造, 2006, 25(12):4-8.
SHI L K, XU E N, WANG J P, et al.Recent progress on the production of ubiquinone-10 by microbial fermentation[J].China Brewing, 2006, 25(12):4-8.
[5] YU S W, PENG L, XU Y F, et al.Optimizing light sources for selective growth of purple bacteria and efficient formation of value-added products[J].Journal of Cleaner Production, 2021, 280:124493.
[6] ZHANG J Q, GAO D, CAI J J, et al.Improving coenzyme Q10 yield of Rhodobacter sphaeroides via modifying redox respiration chain[J].Biochemical Engineering Journal, 2018, 135:98-104.
[7] LU W Q, YE L D, XU H M, et al.Enhanced production of coenzyme Q10 by self-regulating the engineered MEP pathway in Rhodobacter sphaeroides[J].Biotechnology and Bioengineering, 2014, 111(4):761-769.
[8] 李和平, 张晓菲, 郭恒, 等.大气压射频辉光放电等离子体射流诱变育种研究进展[C].第十八届全国等离子体科学技术会议摘要集, 西安:中国力学学会, 2017:50.
LI H P, ZHANG X F, GUO H, et al.Advances in atmospheric pressure radio frequency glow discharge plasma jet mutation breeding [C].Abstracts of the 18th National Conference on Plasma Science and Technology, Xi’an:Chinese Society Of Mechanics, 2017:50.
[9] 宋冰, 付永平, 李丹, 等.食药用菌诱变育种研究进展[J].微生物学通报, 2017, 44(9):2 201-2 212.
SONG B, FU Y P, LI D, et al.Advances in the mutation breeding of edible and medicinal fungi[J].Microbiology China, 2017, 44(9):2 201-2 212.
[10] 徐礼生, 于巧玲, 张兴桃, 等.常压室温等离子诱变选育微生物的研究进展[J].农产品加工, 2021(11):97-99.
XU L S, YU Q L, ZHANG X T, et al.Research progress of breeding microorganisms by plasma at atmospheric pressure and room temperature[J].Farm Products Processing, 2021(11):97-99.
[11] 杨自名, 薛正莲, 王洲, 等.基于ARTP技术选育维生素K2优势菌株及发酵培养基优化[J].食品与生物技术学报, 2020, 39(11):56-64.
YANG Z M, XUE Z L, WANG Z, et al.Screening of high-yield vitamin K2 strain based on ARTP technology and optimization of fermentation medium[J].Journal of Food Science and Biotechnology, 2020, 39(11):56-64.
[12] LI H, ZENG W, ZHOU J.High-throughput screening of Methylobacterium extorquens for high production of pyrroloquinoline quinone[J].Sheng Wu Gong Cheng Xue Bao, 2018, 34(5):794-802.
[13] ZENG W Z, DU G C, CHEN J, et al.A high-throughput screening procedure for enhancing α-ketoglutaric acid production in Yarrowia lipolytica by random mutagenesis[J].Process Biochemistry, 2015, 50(10):1 516-1 522.
[14] FEI X C, YU Y, DI Y L, et al.A rapid and non-invasive fluorescence method for quantifying coenzyme Q10 in blood and urine in clinical analysis[J].Journal of Clinical Laboratory Analysis, 2020, 34(4):e23130.
[15] RIENZO M, LIN K C, MOBILIA K C, et al.High-throughput optofluidic screening for improved microbial cell factories via real-time micron-scale productivity monitoring[J].Lab on a Chip, 2021, 21(15):2 901-2 912.
[16] 王立言, 张雪, 张翀, 等.常压室温等离子体(ARTP)诱变育种技术及其应用[C].2013年国际氨基酸产业发展高峰论坛论文集.上海:中国生物发酵产业协会,2013:72-77.
WANG L Y, ZHANG X, ZHANG C, et al.Atmospheric pressure and room temperature plasma (ARTP) mutation breeding technology and its application[C].Proceedings of the 2013 International Amino Acid Industry Development Summit Forum.Shanghai:China Biological Fermentation Industry Association,2013:72-77.
[17] ZHANG X, ZHANG X F, LI H P, et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology, 2014, 98(12):5 387-5 396.
[18] 熊璐璐. 辅酶Q10产生菌的发酵条件优化及诱变育种[D].南京:南京理工大学, 2005.
XIONG L L.Optimization of fermentation conditions and mutation breeding of coenzyme Q10 producing bacteria[D].Nanjing:Nanjing University of Science and Technology, 2005.
[19] ZOU R S, LI S Y, ZHANG L L, et al.Mutagenesis of Rhodobacter sphaeroides using atmospheric and room temperature plasma treatment for efficient production of coenzyme Q10[J].Journal of Bioscience and Bioengineering, 2019, 127(6):698-702.
[20] 董亮, 何永志, 王远亮, 等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报, 2013, 15(5):53-58.
DONG L, HE Y Z, WANG Y L, et al.Research progress on application of superoxide dismutase (SOD)[J].Journal of Agricultural Science and Technology, 2013, 15(5):53-58.
[21] YOSHIDA H, KOTANI Y, OCHIAI K, et al.Production of ubiquinone-10 using bacteria[J].The Journal of General and Applied Microbiology, 1998, 44(1):19-26.
[22] XU W, MA X, YAO J, et al.Increasing coenzyme Q10 yield from Rhodopseudomonas palustris by expressing rate-limiting enzymes and blocking carotenoid and hopanoid pathways[J].Letters in Applied Microbiology, 2021, 73(1):88-95.
[23] LU W Q, YE L D, LV X M, et al.Identification and elimination of metabolic bottlenecks in the quinone modification pathway for enhanced coenzyme Q10 production in Rhodobacter sphaeroides[J].Metabolic Engineering, 2015, 29:208-216.
[24] 梁玲玲. 辅酶Q10产生菌沼泽红假单胞菌的诱变筛选及发酵工艺优化[D].杭州:浙江工业大学, 2018.
LIANG L L.Study on the mutation screening and fermentation process optimizationof Rhodopseudomonas palustris[D].Hangzhou:Zhejiang University of Technology, 2018.
[25] ZHANG L, LIU L S, WANG K F, et al.Phosphate limitation increases coenzyme Q10 production in industrial Rhodobacter sphaeroides HY01[J].Synthetic and Systems Biotechnology, 2019, 4(4):212-219.