柠檬黄,又称酒石黄、酸性淡黄、肼黄,化学名称为1-(4′-磺酸基苯基)-3-羧基-4-(4′-磺酸苯基偶氮基)-5-吡唑啉酮三钠盐,是由对氨基苯磺酸经重氮化,与1-(4′-磺基苯基)-3-羧基-5-吡唑啉酮在碱性溶液中偶合、精制而成,属于水溶性偶氮类色素。由于柠檬黄成本低廉,具有鲜艳的嫩黄色,因此在冰淇淋、雪糕、罐头、蜜饯、果冻、糕点、饮料、风味发酵乳、糖果等热销食品中广泛应用,是最常用的食品合成色素之一。
然而,随着毒理学研究的深入,发现柠檬黄可以被肠道菌群代谢产生的偶氮还原酶还原产生芳香胺(磺胺酸),产生的芳香胺再被 P450 酶氧化为 N-羟基衍生物[1]。因此,过量摄入添加了柠檬黄的食品容易使儿童生长发育迟缓、睡眠障碍和神经系统受损,进而引起儿童多动症、智力下降。此外,研究发现过量摄入柠檬黄还会导致过敏、腹泻、湿疹、哮喘、头痛、肾脏功能异常、生殖毒性、先天免疫障碍、神经焦虑、肠道微生物群失衡等症状,甚至存在致畸、致癌的风险[2-4]。高剂量的柠檬黄还会与其他着色剂、防腐剂等食品添加剂发挥协同作用,从而表现联合毒性,如 DNA断裂损伤、抑制细胞增殖、神经系统发育迟缓等,严重危害人体健康[5-7]。2008年的“窝窝头”事件和2011年的“染色馒头”事件就是由于柠檬黄的非法添加而引发的食品安全事件。虽然我国在GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中对柠檬黄允许使用的食品类别和最大用量上做出了严格控制(表1),然而根据国家市场监督管理总局发布的2020年市场监管部门食品安全监督抽检情况通告,超范围超限量使用食品添加剂问题占不合格样品总量的16.17%。
表1 国家标准规定柠檬黄在部分食品中的最大使用量示例
Table 1 The maximum usage of tartrazine in partial
classifications of food according to GB 2760—2014
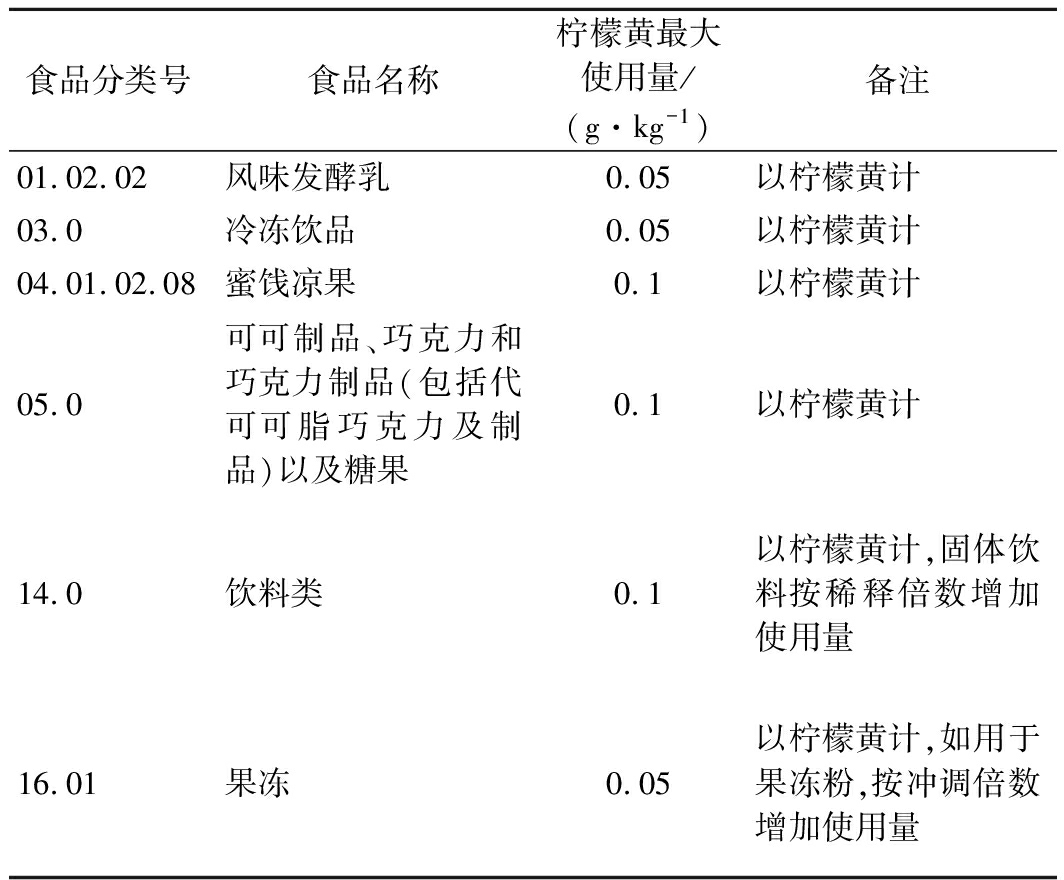
食品分类号食品名称柠檬黄最大使用量/(g·kg-1)备注01.02.02风味发酵乳0.05以柠檬黄计03.0冷冻饮品0.05以柠檬黄计04.01.02.08蜜饯凉果0.1以柠檬黄计05.0可可制品、巧克力和巧克力制品(包括代可可脂巧克力及制品)以及糖果0.1以柠檬黄计14.0饮料类0.1以柠檬黄计,固体饮料按稀释倍数增加使用量16.01果冻0.05以柠檬黄计,如用于果冻粉,按冲调倍数增加使用量
柠檬黄作为重要的食品添加剂之一,价格低廉、稳定性好、着色效果显著,因此不法商家违规使用柠檬黄的现象屡禁不止,山西左权县市场监督管理局发布的2020年第2期食品安全监督抽检信息、贵州省市场监管局网站发布的《关于2批次食品不合格情况的通告(2020年第8期)》、广东省市场监督管理局网站发布的关于22批次食品不合格情况的通告(2021年第21期)、深圳市市场监督管理局公布的2021年第14期食品安全抽样检验情况等均存在因违规使用柠檬黄而不合格的食品,具体表现为果脯中超量添加、面制品中超范围添加柠檬黄等[8]。表1列出了柠檬黄在部分食品中的最大使用量,并作为快速检测方法的依据。
1 概述
传统的柠檬黄检测方法包括紫外-可见光分光光度法、薄层色谱法、高效液相色谱法、高效液相色谱-质谱联用法等,这些方法大多存在设备昂贵、操作复杂、耗时长、对操作人员要求高等问题。而快速检测法成本低廉、响应迅速,分析操作过程简便、对操作人员要求低、方便携带,适合于大批量样品检测和实时检测[9-11]。因此,建立柠檬黄的快速检测方法对于保障相关食品的质量与安全具有重要意义。本文旨在对柠檬黄的快速检测方法进行综述,通过分析总结各种检测方法在食品和药品中的优缺点、灵敏度以及检测限等,以期为建立精准快速测定各种体系中柠檬黄含量的方法提供参考。
2 柠檬黄快速检测方法
2.1 电化学法
电化学法的核心是基于柠檬黄分子结构中含有的可被电化学还原的偶氮基团 (—N![]() N—),在电极产生特征电化学行为,通过线性扫描伏安法(linear sweep voltammetry, LSV)、循环伏安法(cyclic voltammetry, CV)、方波伏安法(square wave voltammetry, SWV)、差分脉冲伏安法(differential pulse voltammetry, DPV)等测得传感器的工作曲线,即峰电流强度与在一定范围内的待测物浓度呈线性关系,从而得出待测物浓度[12-13]。电化学法以其操作简便、检出限低、响应快、易于小型化、成本低等优点而广泛应用于各类物质的定性、定量分析[14]。然而,传统电极对有机分子的选择性较差,需要通过修饰电极以提高其检测性能,保证结果的准确性。
N—),在电极产生特征电化学行为,通过线性扫描伏安法(linear sweep voltammetry, LSV)、循环伏安法(cyclic voltammetry, CV)、方波伏安法(square wave voltammetry, SWV)、差分脉冲伏安法(differential pulse voltammetry, DPV)等测得传感器的工作曲线,即峰电流强度与在一定范围内的待测物浓度呈线性关系,从而得出待测物浓度[12-13]。电化学法以其操作简便、检出限低、响应快、易于小型化、成本低等优点而广泛应用于各类物质的定性、定量分析[14]。然而,传统电极对有机分子的选择性较差,需要通过修饰电极以提高其检测性能,保证结果的准确性。
程昊等[15]以阿拉伯糖为碳源、孔硅为模板剂制备介孔碳修饰电极,柠檬黄检测线性范围为5.34×10-4~5.34 mg/kg,检出限为0.142 μg。将该传感器用于检测螺蛳粉腐竹中的柠檬黄,样品加标回收率为97.38%~104.45%,电极活性位点更多,对柠檬黄的吸附富集作用更强,灵敏度高,稳定性强。林素英等[16]用L-Tyr、金、多壁碳纳米管对玻碳电极进行修饰,检测线性范围为0.48~26.72 mg/kg,检出限为0.11 mg/kg。该传感器的灵敏度高,选择性和稳定性良好。NAGLES等[17]利用La2O3和 TiO2对碳糊电极进行修饰,并对食品中含有的柠檬黄等色素进行检测,该法通过La2O3和TiO2组合对电极的积累效应从而达到与石墨烯和TiO2组合相同的效果,降低成本。结果表明,检测限低于48 μg/kg,该法操作简便、灵敏度高、经济环保,应用范围非常广泛。AKKAPINYO等[18]用还原氧化石墨烯(reduced graphene oxide, rGO)、蛋氨酸对丝网印刷碳电极(screen-printed carbon electrode, SPCE)进行修饰,如图1所示,其两段线性范围分别为0.53~5.34 mg/kg和 5.34~45.42 mg/kg,检测限为21.91 μg/kg。该传感器催化活性提高,抗干扰能力强、稳定性、重复性良好。
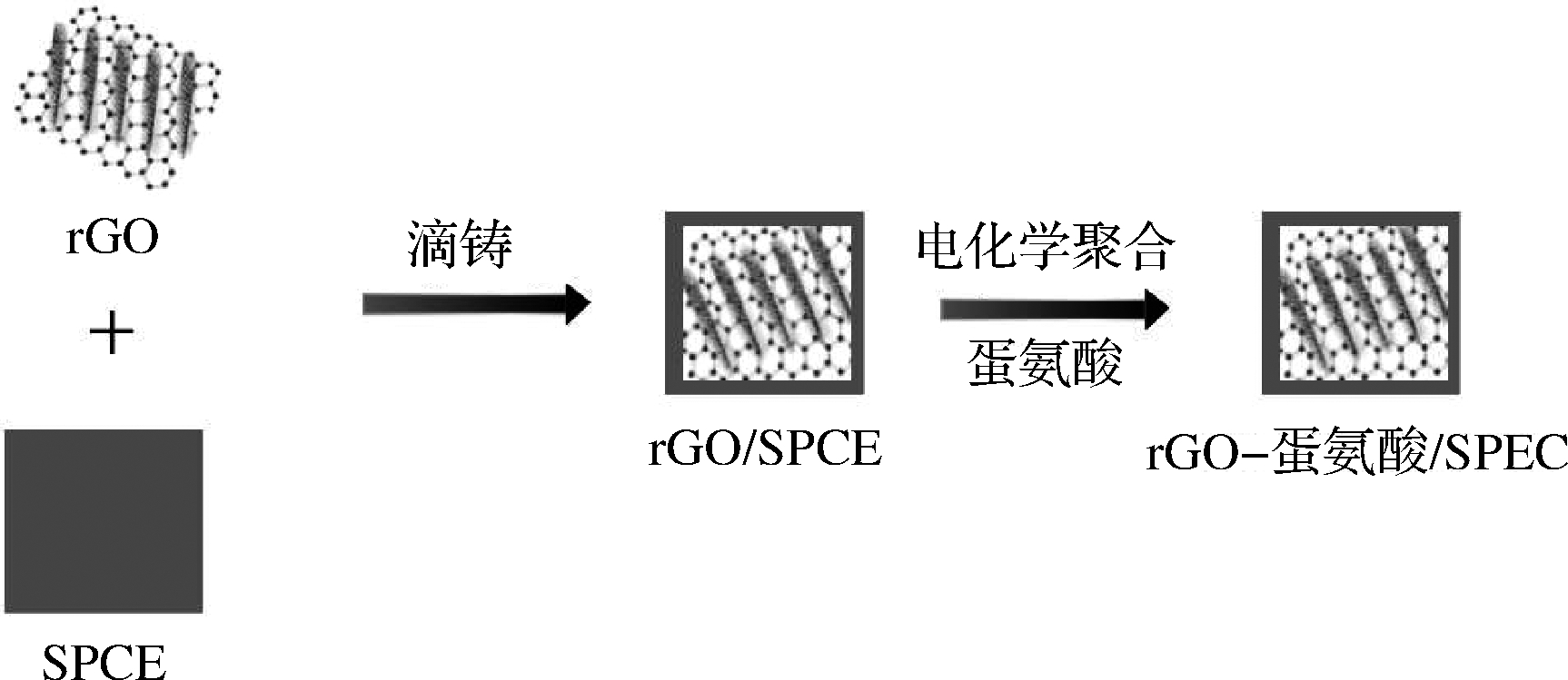
图1 rGO-蛋氨酸/SPCE电极改性过程示意图[18]
Fig.1 Schematic representation of modification
process of rGO-methionine/SPCE[18]
然而,此法用于检测柠檬黄大多是采用直接催化的形式,容易受到其他偶氮类色素如日落黄、苋菜红、胭脂红等的干扰,特异性差,因此通过寻找和合成原料成本低、电催化性能和导电性良好、比表面积大的电极改性材料和有机材料、无机材料及纳米材料这3类改性材料进行有机结合,提高电极的选择性、改善传感器的电催化活性、增强待测物的响应信号,使传感器拥有良好的抗干扰能力、重复性以及对柠檬黄分析检测的高性能,如基于碳量子点和铂纳米粒子装饰的三维多孔还原氧化石墨烯修饰的丝网印刷碳电极(Pt/CQDs@rGO/SPCE)用于检测柠檬黄,在存在几种具有相似结构的干扰剂和偶氮染料染色剂仍具有高选择性[19]。同时,已有研究表明,离子液体改性的电化学传感器检测柠檬黄,其稳定性、溶解性和导电性更好,比表面积大,生物相容性好,灵敏度高且低毒环保。随着研究的深入,曾经不被科研人员看好的离子液体同样能够用于电极修饰,提高电极对柠檬黄的选择性[20-21]。
2.2 荧光探针法
目前荧光探针法对柠檬黄的检测多是基于对特异性探针荧光的动态淬灭或静态淬灭(aggregation-caused quenching, ACQ)机制,从而建立特异性荧光传感器,荧光淬灭程度与一定范围内的待测物浓度成线性关系。此法分析速度快、灵敏度高、操作简便、可供选择参数多。所使用的探针主要由无机分子、有机分子、纳米材料等进行制备,但部分特异性探针的筛选、制备过程较为繁琐,对反应条件要求苛刻,影响其商品化生产[22]。
刘凌飞等[23]采用酸碱中和自放热法,以葡萄糖为碳源制备氮磷氯共掺杂碳量子点(N,P,Cl-CDs),可能是基于静态淬灭实现对柠檬黄的检测,其线性范围为5.34×10-3~8.02 mg/kg。将本法运用于果冻、糖果等实际食品体系中柠檬黄的检测,加标回收率为97.03%~105.41%,相对标准偏差不超过3.29%。该法灵敏度高、抗干扰性及结果可靠性强。YANG等[24]选用新型荧光探针吖啶黄素,基于静态淬灭机制实现柠檬黄的快速检测。如图2所示,其线性范围为2.99×10-4~2.67 mg/kg,检测限为9.08 μg/kg,将本法运用于检测软饮料中的柠檬黄,回收率在 96.0%~103.0%,该法响应快、选择性好、结果可靠。
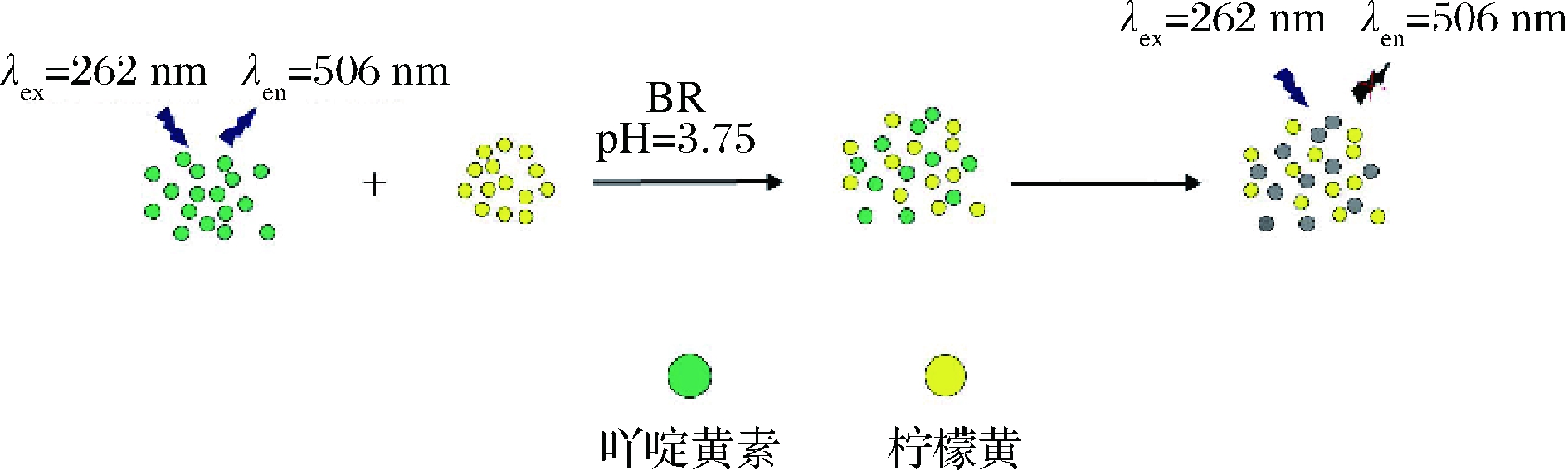
图2 吖啶黄素检测柠檬黄的示意图[29]
Fig.2 Schematic diagram for the detection of
tartrazine by acriflavine[29]
WANG等[25]制备了水溶性牛血清白蛋白荧光镍纳米簇(bovine serum albumin nickel nanoclusters,BSA-NiNCs),并将其作为荧光探针,如图3所示,并可能基于此探针与柠檬黄分子之间的分子间相互作用和二次内滤效应从而实现对柠檬黄的检测。结果表明,线性范围为5.34×10-3~1.87 mg/kg,检测限为2.14 μg/kg,该法成本较低、灵敏度高、选择性强、检测浓度范围大,检测结果较为可靠。

图3 荧光镍纳米团簇的制备过程[25]
Fig.3 Preparation process of NiNCs[25]
基于ACQ原理的荧光探针法对被检样品要求高、结果容易受到溶剂、缓冲液、温度、pH等环境因素影响,光稳定性差,斯托克斯位移窄。因此抗干扰性差,易出现假阳性结果。因此在检测时可以优先选择抗干扰性强的基于聚集诱导发射(aggregation-induced emission, AIE)的荧光法,此法信噪比更高、光稳定性更好且斯托克斯位移更大,结果更加准确,实现柠檬黄的快速准确检测[26]。此外,部分有机探针水溶性较差,金属纳米探针在制备过程中无法精确控制其结构和尺寸、生物毒性大、易污染环境、成本相对较高、规模化制备与量产不足使其应用受限[27]。而碳点(carbon dots,CDs)作为一种无机新型荧光纳米材料,具有成本低、水溶性好、灵敏度高、生物相容性好、对环境友好等优点而被广泛应用于制备荧光探针,但其荧光量子产率低,荧光现象不够明显,可以通过掺杂不同元素改变内部电子结构,从而改变 CD 的固有属性,提高荧光量子产率,同时通过采用新的制备工艺提高纳米探针结构和尺寸的精度,因此CDs成为一种有效的柠檬黄荧光探针,有望实现基于荧光探针法原理的试剂盒的大规模生产,实现柠檬黄的快速大批量定量检测[28]。
2.3 表面增强拉曼法
拉曼光谱属于分子振动光谱,能够反映分子的特征结构,分子振动较弱,特征峰较不明显。而表面增强拉曼法(surface-enhanced Raman spectroscopy, SERS)主要运用化学机制和电磁机制来增强拉曼光谱特征峰,并依赖由 SERS 活性贵金属(如金和银)和过渡金属纳米结构产生的等离子体耦合产生的SERS“热点”,使得分子振动增强,实现对柠檬黄检测。近年来SERS技术迅速发展,因其特征峰显著、灵敏度高、检测时间短、操作便捷、光谱带窄、无标记指纹光谱、仪器易于小型化、携带方便、成本低等优势,在食品安全、药物、生物医学等领域应用广泛,并成为检测柠檬黄高效准确的分析工具之一。
SONG等[29]采用多元醇法合成高度均匀且高质量的银纳米线,并将此银纳米线作为SERS衬底,建立了可实现标准柠檬黄溶液定量分析的偏最小二乘模型,结果表明,检测范围为0~10 mg/kg,最低检测浓度为10 μg/kg,该法灵敏度高,检测速度快,成本低,模型可预测性能良好。LI等[30]用功能化的抗坏血酸制作抗聚集金纳米粒子,并作为SERS增强底物检测柠檬黄,检测范围为5.34~5.34×104 ng/kg,检测限为0.43 ng/kg。该法灵敏高、选择性好、抗干扰能力强、检测范围广,可实现实时检测,但成本较高,因此科研人员应继续深入研究,寻找可供替代具有相同检测效果和性能的低成本原料。WANG等[31]将层状金属-有机框架材料(metal organic framework, MOF)纳米阵列与金纳米粒子通过电沉积进行结合,制成了能够用于痕量检出食品中柠檬黄的多功能MOF芯片(S-MOF@Au)。线性范围为5.34~5.34×105 μg/kg,检测限为0.53 μg/kg。将该芯片用于检测橙汁、牛奶、苹果和鱼类4种实际食品体系,加标回收率在96.2%~125.1%,相对标准偏差不超过 9.01%,该芯片电导率大大提高,金纳米粒子均一性、稳定性强,且制作简便、检测范围广、灵敏度高、结果准确可靠、重复性强。图4和图5展示了部分用于检测柠檬黄的SERS底物所用材料以及制备过程。
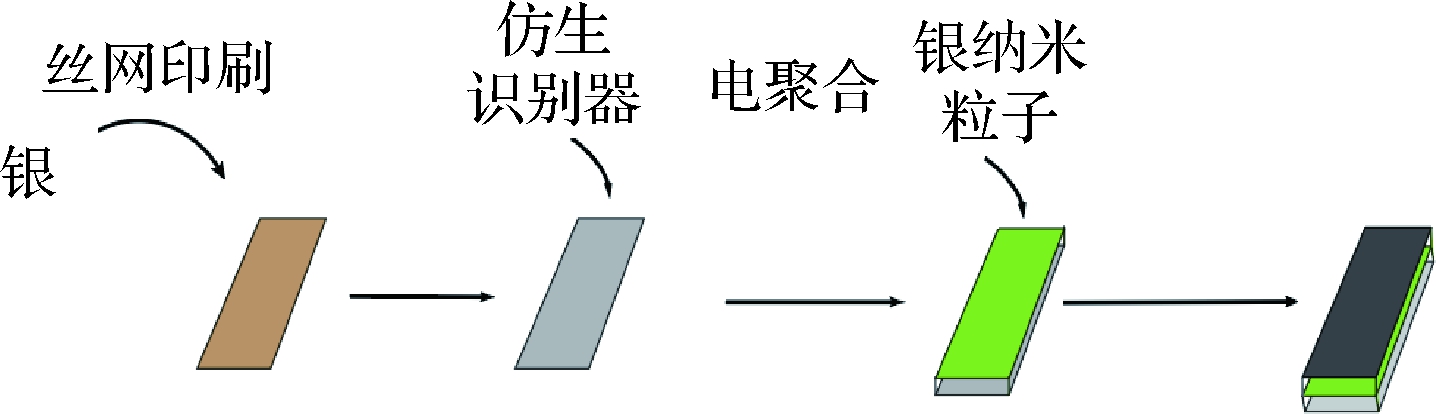
图4 柠檬黄传感器的制备过程[32]
Fig.4 Preparation process of tartrazine sensor[32]
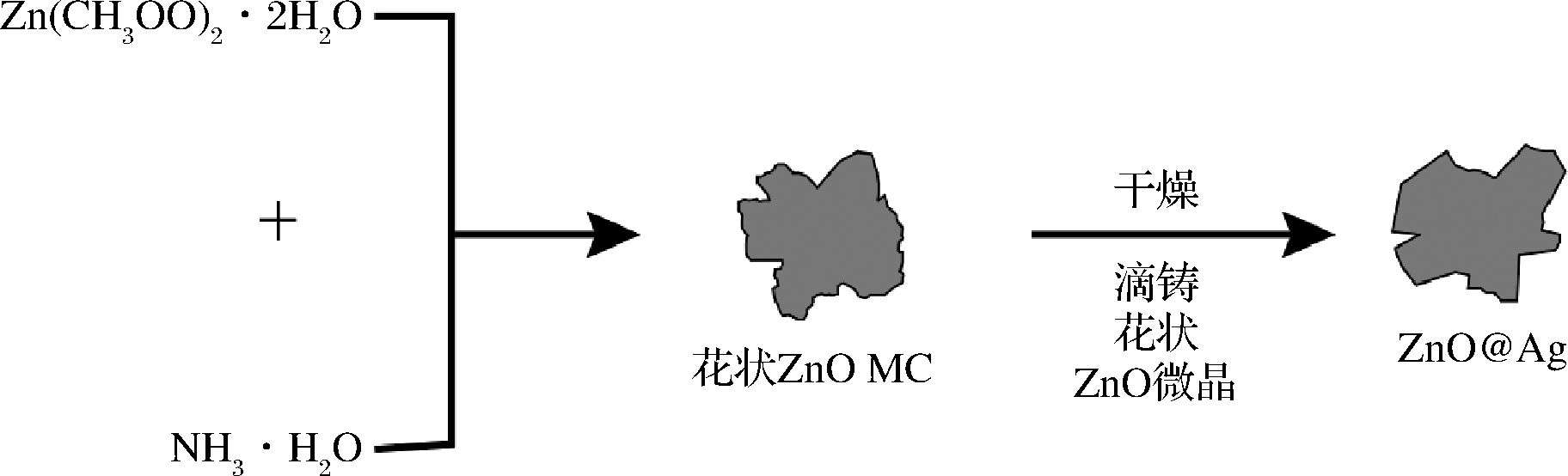
图5 花状 ZnO@Ag纳米结构的合成过程示意图[33]
Fig.5 Schematic representation of the synthesis process for
the flower-like ZnO@Ag nanostructures[33]
SERS法克服了拉曼光谱灵敏度低的缺陷,然而,目前SERS底物多使用贵金属纳米材料,如金和银等。而贵金属纳米材料生物相容性、稳定性和均匀性差,且用于制作底物的方法复杂、耗时长、成本高,该法重复性差,准确度不高。为解决上述问题,将半导体材料用于制备底物,半导体材料能一定程度弥补金属纳米材料作为底物的缺陷,底物均匀性好、物理稳定性高。或将还原氧化石墨烯纳米薄片制成纳米流体,纳米流体热导率得到显著提高,检测结果更加准确可靠,并且损耗的能源更少[34-35]。此外,除了改变SERS底物材料外,还可以通过改进底物的制备工艺降低基板制作成本,增强基板均一性、稳定性,如在Ar中采取一步飞秒激光直接烧蚀技术制造SERS银基板,过程操作简便、无接触、生产效率高[36]。因此,半导体/贵金属为基板且基板制作工艺简单的SERS法有望实现柠檬黄的大批量快速检测。
2.4 毛细管电泳法
毛细管电泳法通过在毛细管中接入高压直流电场,在电泳力和电渗力的作用下,样品中的带电分子与不带电分子根据不同的电泳迁移率以及分配系数而被分开,还能通过在毛细管柱末端使用缓冲背景电解质和一些添加物进一步提高分离效果,后在紫外分光光度计或荧光光谱仪检测分析,从而实现对柠檬黄的定量检测,可分为胶束电动毛细管电泳法、毛细管区带电泳法、毛细管等速电泳法等。该法高效便捷、消耗试剂少、经济环保、选择性较高、应用范围广泛,检测限低、无需借助昂贵设备、对所有离子化合物都能够进行检测,水溶性良好,对于摩尔级别的样品,能够在10 min内完成检测,是一种新型液相微分析检测方法,对于复杂食品基质中柠檬黄的检测更加适合。
郭芳芳等[37]采用高效毛细管电泳-紫外检测法对柠檬黄等5种雪糕中常见色素进行检测,其线性范围在10~1 000 mg/kg,检出限为1.2 mg/kg。将该法用于雪糕的柠檬黄检测中,平均回收率为93.8%~108.5%,相对标准偏差不超过4.19%。该法操作简便、检测速度快、结果准确性高。YI等[38]采用非接触式电导的毛细管电泳法同时测定包括柠檬黄在内的5种食品着色剂,同时并采用场放大样品进样(field-amplified sample injection, FASI)预富集技术,富集因子高而操作简单。其检测限在0.035~0.055 mg/kg,将该法用于检测果脯样品中的柠檬黄,回收率在94.3%~102%,相对标准偏差<5%。该法检测成本低、速度快、灵敏度高、重复性好、结果准确可靠。BORDAGARAY等[39]采用微乳液毛细管电泳法测定包括柠檬黄在内的4种食品着色剂,线性范围为2.29~22.89 mg/kg,检出限为0.68 mg/kg,定量限为2.26 mg/kg。将此法运用于液体果冻和冰棒等16个食品样品,回收率为90%~100%。该法灵敏度高、选择性强、检测耗时短、分析速度快,形成的胶束提供了更多的离子和疏水相互作用位点,促进带电和不带电溶质两者之间的分离,但用于实际食品体系中结果准确性较低,重现性较差。
然而,毛细管直径细小、光路短小,即使在离心之后过滤器也容易被粒子堵塞,造成分析物残留。此外,毛细管进样量小,导致制备标准溶液相对困难,并且电渗会因样品组成不同而发生变化,检测结果对温度、pH等实验参数较为敏感,使得此法虽然对柠檬黄具有高选择性,但检测结果准确性低,重现性差。针对上述问题,可采用预富集技术增大待测物的浓度,使得该法准确性、灵敏度在一定程度上得到改善。
2.5 免疫学法
免疫学法主要借助酶联免疫标记技术,通过修饰柠檬黄与酶偶合成抗原,再利用动物免疫实验获得特异性抗体,抗原与相应抗体结合后通过同位素标记法等标记技术加以放大和显示,从而实现对柠檬黄定性或定量检测。该法操作简便、易于控制、分析时间短、检测迅速、特异性强、灵敏度高[40]。
LI等[41]基于活性酯法、混合酸酐法制备半抗原,如图6所示,并采用超灵敏的间接竞争性酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定柠檬黄,线性范围为0.029~0.440 μg/kg,检测限为0.014 μg/kg,将该法用于检测橙汁中的柠檬黄,测定内和测定间的回收率分别为89.33%~109.70%和81.33%~93.43%,变异系数分别为7.54%~12.35%和5.90%~10.48%,该法灵敏度好、选择性高、抗干扰能力强,结果准确可靠。任立松等[42]通过将柠檬黄分子与卵清蛋白、牛血清白蛋白偶联制备抗原,并建立间接竞争ELISA检测方法,结果表明,最低检出浓度为0.36 μg/kg,检测限低、检测速度快,加之成本低,可以应用于大批量样品中柠檬黄的检测。LEI等[43]开发了一种竞争性ELISA用以检测尿液中的柠檬黄,其线性范围为0.04~1 000 μg/kg,检测限为0.04 μg/kg。该法操作简便、灵敏度高、特异性强、选择性高、抗干扰能力强。
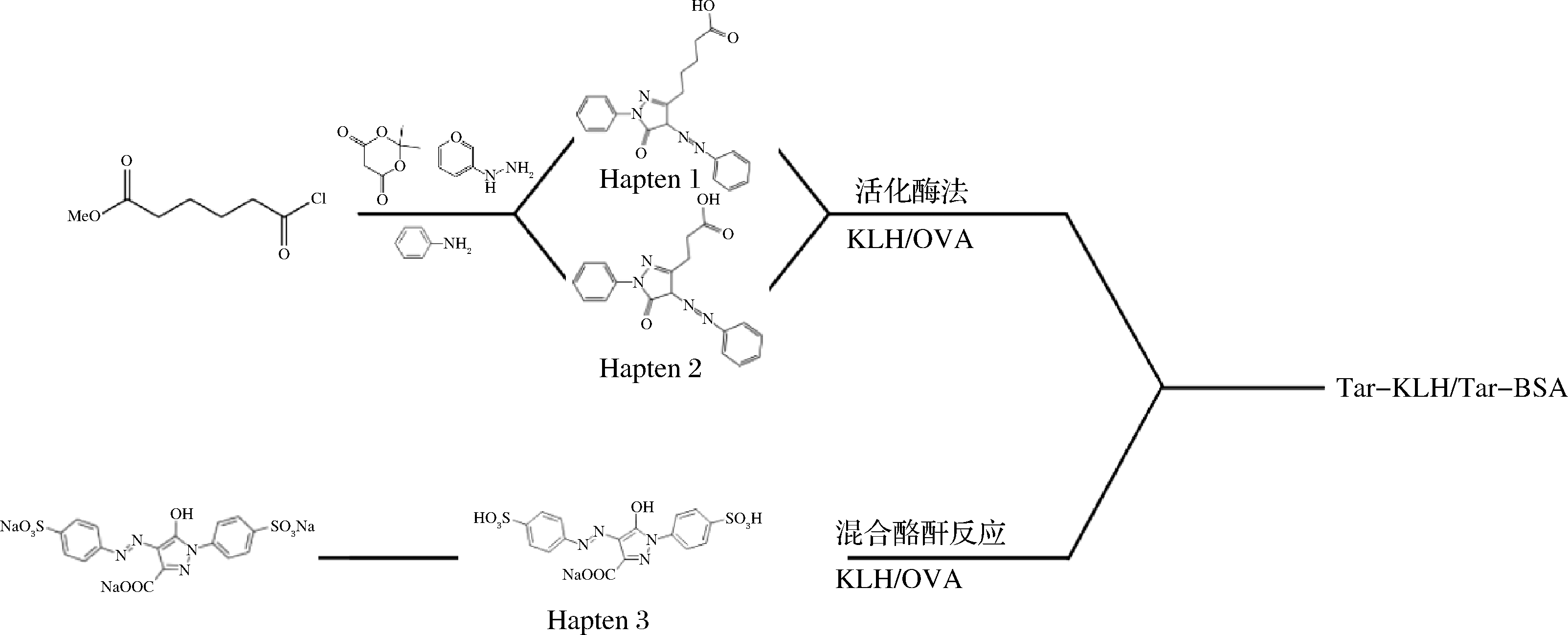
图6 柠檬黄半抗原、免疫原和包被抗原的合成[41]
Fig.6 Synthesis of the tartrazine hapten, immunogen and coating antigen[41]
注:KLH-钥匙孔帽同花色苷;OVA-卵清蛋白;BSA-牛血清白蛋白;Tar-柠檬黄
然而,该法检测结果与所用抗体的质量有较大关系,对抗体来源和亲和力的要求高而产量少,无法满足大批量检测的要求。同时,受检样品中要是存在细胞因子的可溶性受体,可能会对特异性抗体与细胞因子的结合有一定影响,导致检测结果准确性降低,同时因柠檬黄与其他人工色素的结构较为相似,抗体对于抗原的识别可能会出现假阳性结果,误判率较高,抗干扰性较弱。因此,为了提高检测准确度、灵敏度,关键在于特异性抗体的制备,而特异性抗体的产生和敏感性与半抗原分子的结合位置和间隔物的长度密切相关。因此目前多是基于活性酯法、混合酸酐法将柠檬黄分子的某些基团共价连接到卵清蛋白、牛血清白蛋白等载体蛋白制备抗原,再通过注射进入实验动物如BALB/c 小鼠、新西兰白兔以产生单克隆抗体,能够有效避免其他相似色素的干扰,选择性增强。相对于罗丹明等其他色素而言,柠檬黄的化学修饰比较困难,给相应的半抗原制备带来挑战,难以进行大批量制备,市面上销售的相关产品价格较高。因此,如何优化柠檬黄半抗原的制备过程、提高制备效率将是免疫法在柠檬黄快速检测上得到推广、实现大批量检测的关键之处。
2.6 各方法的比较
综上,快速检测柠檬黄的方法越来越多且日趋完善,检出限降低,检出浓度范围增大,灵敏度提高,已在食品、药品等多种实际样品中广泛应用。为了更好地比较几种方法,各项指标汇总如表2所示,电化学法灵敏度高、操作简便、选择性高,但易受干扰,结果重现性较差;荧光探针法对检测范围较窄、成本较高,无法进行大批量检测;SERS法检测成本较高、稳定性差;毛细管电泳法灵敏性不高,同时对各种实验参数敏感,应用性不高;免疫学法对检测样品的要求较高,易出现其他相似色素干扰的情况,结果准确度较低,因此在实际中应用较少。
表2 柠檬黄5种快速检测方法的比较
Table 2 Comparison of five rapid detection methods for tartrazine
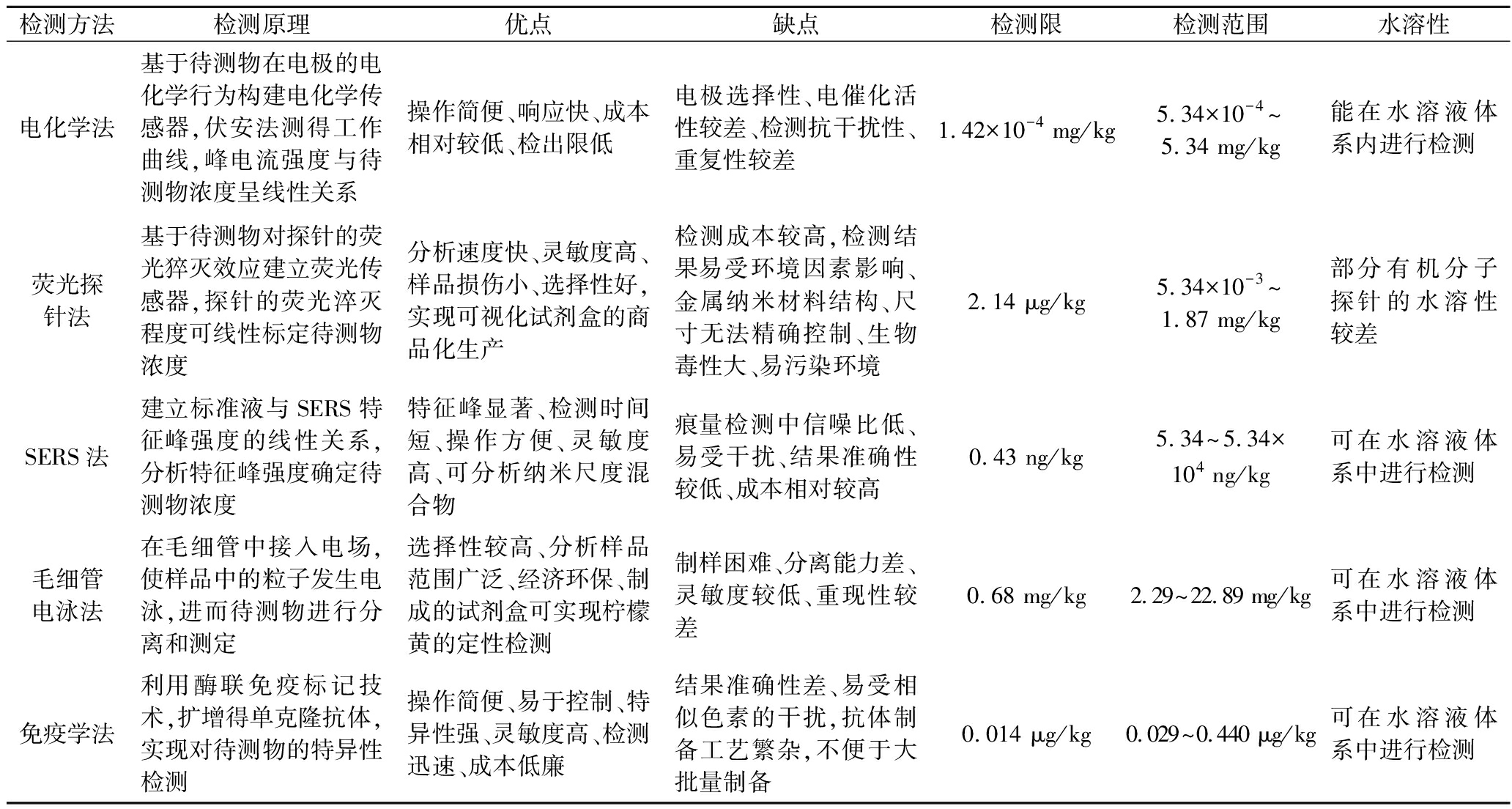
检测方法检测原理优点缺点检测限检测范围水溶性电化学法基于待测物在电极的电化学行为构建电化学传感器,伏安法测得工作曲线,峰电流强度与待测物浓度呈线性关系操作简便、响应快、成本相对较低、检出限低电极选择性、电催化活性较差、检测抗干扰性、重复性较差1.42×10-4 mg/kg5.34×10-4~5.34 mg/kg 能在水溶液体系内进行检测荧光探针法基于待测物对探针的荧光猝灭效应建立荧光传感器,探针的荧光淬灭程度可线性标定待测物浓度分析速度快、灵敏度高、样品损伤小、选择性好,实现可视化试剂盒的商品化生产检测成本较高,检测结果易受环境因素影响、金属纳米材料结构、尺寸无法精确控制、生物毒性大、易污染环境2.14 μg/kg5.34×10-3~1.87 mg/kg部分有机分子探针的水溶性较差SERS法建立标准液与SERS特征峰强度的线性关系,分析特征峰强度确定待测物浓度特征峰显著、检测时间短、操作方便、灵敏度高、可分析纳米尺度混合物痕量检测中信噪比低、易受干扰、结果准确性较低、成本相对较高0.43 ng/kg5.34~5.34×104 ng/kg可在水溶液体系中进行检测毛细管电泳法在毛细管中接入电场,使样品中的粒子发生电泳,进而待测物进行分离和测定选择性较高、分析样品范围广泛、经济环保、制成的试剂盒可实现柠檬黄的定性检测制样困难、分离能力差、灵敏度较低、重现性较差0.68 mg/kg2.29~22.89 mg/kg可在水溶液体系中进行检测免疫学法利用酶联免疫标记技术,扩增得单克隆抗体,实现对待测物的特异性检测操作简便、易于控制、特异性强、灵敏度高、检测迅速、成本低廉结果准确性差、易受相似色素的干扰,抗体制备工艺繁杂,不便于大批量制备0.014 μg/kg0.029~0.440 μg/kg可在水溶液体系中进行检测
3 结论与展望
随着检测需求日益增加且对检测的要求提高,高通量快速筛查将成为未来食品检测的发展方向。目前检测柠檬黄的试剂盒种类较少,仅能实现对柠檬黄的定性检测,严重限制了快速检测法在市场中的应用,价格还有进一步下降的空间。积极寻求成本低廉、性能稳定、重复性好的材料,同时结合化学生物传感技术以用于试剂盒的研发,无疑是解决上述问题的方案之一。综上所述,快速检测柠檬黄的方法具有极高的应用潜力和市场价值,随着科学研究的不断推进,新的快速检测方法有望在食品、药品等领域投入实际应用。
[1] AMSARAJ R, MUTTURI S.Real-coded GA coupled to PLS for rapid detection and quantification of tartrazine in tea using FT-IR spectroscopy[J].LWT, 2021, 139:110583.
[2] KARIM-NEZHAD G, KHORABLOU Z, ZAMANI M, et al.Voltammetric sensor for tartrazine determination in soft drinks using poly (p-aminobenzenesulfonic acid)/zinc oxide nanoparticles in carbon paste electrode[J].Journal of Food and Drug Analysis, 2017, 25(2):293-301.
[3] KHAYYAT L, ESSAWY A, SOROUR J, et al.Tartrazine induces structural and functional aberrations and genotoxic effects in vivo[J].PeerJ, 2017, 5:e3041.
[4] WU L M, LV X X, ZHANG Y F, et al.Tartrazine exposure results in histological damage, oxidative stress, immune disorders and gut microbiota dysbiosis in juvenile crucian carp (Carassius carassius)[J].Aquatic Toxicology, 2021, 241:105998.
[5] 何林. 几种食品添加剂的遗传毒性及其联合毒性研究[D].广州:暨南大学, 2008:47-52.
HE L.A research for the genotoxicity determination of several kinds of food additives and joint toxicity among them[D].Guangzhou:Jinan University, 2008:47-52.
[6] 付佳. 苯甲酸钠与糖精钠、柠檬黄体外联合毒性的研究[D].广州:中山大学, 2010:72-78.
FU J.An in vitro analysis of joint toxicity of sodium benzoate and saccharin sodium, lemon yellow[D].Guangzhou:Sun Yat-sen University, 2010:72-78.
[7] BALTA I, SEVASTRE B, MIRE\U015FAN V, et al.Protective effect of blackthorn fruits (Prunus spinosa) against tartrazine toxicity development in albino Wistar rats[J].BMC Chemistry, 2019, 13(1):104.
[8] 张家意, 罗珮妍.合成着色剂在食品中的应用及分析技术研究进展[J].食品安全导刊, 2021(22):74-75, 79.
ZHANG J Y, LUO P Y.Application of synthetic colorants in food and research progress of analytical technology [J].China Food Safety Magazine, 2021(22):74-75, 79.
[9] 陈圣权, 张卓旻.食品着色剂前处理及快速分析方法研究进展[J].食品科技, 2020, 45(11):255-262.
CHEN S Q, ZHANG Z M.Progress on sample pretreatment and fast analysis technologies for food colorants[J].Food Science and Technology, 2020, 45(11):255-262.
[10] 宣芳, 许子旋, 胡耀娟.表面增强拉曼光谱在食品添加剂检测方面的应用进展[J].南京晓庄学院学报, 2020, 36(6):6-12.
XUAN F, XU Z X, HU Y J.The application progress of surface enhanced Raman spectroscopy in the detection of food additives[J].Journal of Nanjing Xiaozhuang University, 2020, 36(6):6-12.
[11] 静平, 张晓梅, 许艳丽, 等.纳米材料电化学传感器在食品安全检测中的应用[J].食品安全质量检测学报, 2013, 4(2):379-382.
JING P, ZHANG X M, XU Y L, et al.Applications of electrochemical sensors based on nanomaterials for food safety detection[J].Journal of Food Safety & Quality, 2013, 4(2):379-382.
[12] ZHAO X Y, LIU Y Z, ZUO J J, et al.Rapid and sensitive determination of tartrazine using a molecularly imprinted copolymer modified carbon electrode (MIP-PmDB/PoPD-GCE)[J].Journal of Electroanalytical Chemistry, 2017, 785:90-95.
[13] 牛家华, 王勇, 卢明华.电分析化学法检测食品中有机合成色素的应用进展[J].理化检验-化学分册, 2020, 56(10):1 137-1 144.
NIU J H, WANG Y, LU M H.Advances of application of electroanalytical chemistry in detection of organic synthetic pigments in food[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2020, 56(10):1 137-1 144.
[14] ARVAND M, GASKARMAHALLEH A A, HEMMATI S.Enhanced-oxidation and highly sensitive detection of tartrazine in foodstuffs via new platform based on poly(5-sulfosalicylic acid)/Cu(OH)2 nanoparticles[J].Food Analytical Methods, 2017, 10(7):2 241-2 251.
[15] 程昊, 樊静静, 刘永逸.介孔碳修饰电极检测螺蛳粉中豆制品的柠檬黄[J].食品工业, 2021, 42(8):291-295.
CHENG H, FAN J J, LIU Y Y.Electrochemical determination of tartrazine in soybean products in snail noodle using a mesoporous carbon[J].The Food Industry, 2021, 42(8):291-295.
[16] 林素英, 陈宇, 谢丽燕, 等.MWCNTs/Au/L-Tyr复合修饰电极测定柠檬黄研究[J].广东化工, 2021, 48(21):151-154.
LIN S Y, CHEN Y, XIE L Y, et al.Detection of lemon yellow by MWCNTs/Au/L-Tyr composite modified GCE[J].Guangdong Chemical Industry, 2021, 48(21):151-154.
[17] NAGLES E, CERONI M, HURTADO J.Simultaneous detection of tartrazine-sunset yellow in food samples using bioxide/carbon paste microcomposite with lanthanum and titanium[J].Journal of Electrochemical Science and Technology, 2020:11(4):421-429.
[18] AKKAPINYO C, SUBANNAJUI K, POO-ARPORN Y, et al.Disposable electrochemical sensor for food colorants detection by reduced graphene oxide and methionine film modified screen printed carbon electrode[J].Molecules (Basel, Switzerland), 2021, 26(8):2312.
[19] MEHMANDOUST M, ERK N, KARAMAN O, et al.Three-dimensional porous reduced graphene oxide decorated with carbon quantum dots and platinum nanoparticles for highly selective determination of azo dye compound tartrazine[J].Food and Chemical Toxicology, 2021, 158:112698.
[20] TAJIK S, LOHRASBI-NEJAD A, MOHAMMADZADEH JAHANI P, et al.Co-detection of carmoisine and tartrazine by carbon paste electrode modified with ionic liquid and MoO3/WO3 nanocomposite[J].Journal of Food Measurement and Characterization, 2022, 16(1):722-730.
[21] QIN Z R, ZHANG J Y, LIU Y, et al.A simple but efficient voltammetric sensor for simultaneous detection of tartrazine and ponceau 4R based on TiO2/electro-reduced graphene oxide nanocomposite[J].Chemosensors, 2020, 8(3):70.
[22] GHEREGHLOU M, ESMAEILI A A, DARROUDI M.Green synthesis of fluorescent carbon dots from Elaeagnus angustifolia and its application as tartrazine sensor[J].Journal of Fluorescence, 2021, 31(1):185-193.
[23] 刘凌飞, 孙慧娟, 钱敏捷, 等.氮磷氯共掺杂碳量子点用于食品中柠檬黄的快速检测[J].中国果菜, 2021, 41(6):112-119.
LIU L F, SUN H J, QIAN M J, et al.Nitrogen, phosphorus and chlorine co-doped carbon dots for rapid detection of tartrazine in food samples[J].China Fruit & Vegetable, 2021, 41(6):112-119.
[24] YANG H, RAN G, YAN J, et al.A sensitive fluorescence quenching method for the detection of tartrazine with acriflavine in soft drinks[J].Luminescence, 2018, 33(2):349-355.
[25] WANG Y, MU Y X, HU J, et al.Rapid, one-pot, protein-mediated green synthesis of water-soluble fluorescent nickel nanoclusters for sensitive and selective detection of tartrazine[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 214:445-450.
[26] GAO X, SUN J Z, TANG B Z. Reaction-based AIE-active fluorescent probes for selective detection and imaging[J].Israel Journal of Chemistry, 2018, 58(8):845-859.
[27] ZOUGHI S, FARIDBOD F, AMIRI A, et al.Detection of tartrazine in fake saffron containing products by a sensitive optical nanosensor[J].Food Chemistry, 2021, 350:129197.
[28] YANG X P, XU J, LUO N, et al.N, Cl co-doped fluorescent carbon dots as nanoprobe for detection of tartrazine in beverages[J].Food Chemistry, 2020, 310:125832.
[29] SONG J, ZHANG Y Y, HUANG Y Q, et al.Rapid tartrazine determination in large yellow croaker with Ag nanowires using surface-enhanced Raman spectroscopy[J].Nanomaterials (Basel, Switzerland), 2018, 8(12):967.
[30] LI M R, LI R, HAN B, et al.Ascorbic acid functionalized anti-aggregated Au nanoparticles for ultrafast MEF and SERS detection of tartrazine:An ultra-wide piecewise linear range study[J].The Analyst, 2022, 147(3):436-442.
[31] WANG Q Z, ZHAO Y J, BU T, et al.Semi-sacrificial template growth-assisted self-supporting MOF chip:A versatile and high-performance SERS sensor for food contaminants monitoring[J].Sensors and Actuators B:Chemical, 2022, 352:131025.
[32] LIU H Y, ZHAO P N, WANG Y, et al.Paper-based sandwich type SERS sensor based on silver nanoparticles and biomimetic recognizer[J].Sensors and Actuators B:Chemical, 2020, 313:127989.
[33] BARVEEN N R, WANG T J, CHANG Y H, et al.Ultrasensitive and reusable SERS probe for the detection of synthetic dyes in food industry through hybrid flower-shaped ZnO@Ag nanostructures[J].Journal of Alloys and Compounds, 2021, 861:157952.
[34] WU Y, WANG X X, WEN X L, et al.Surface-enhanced Raman scattering based on hybrid surface plasmon excited by Au nanodisk and Au film coupling structure[J].Physics Letters A, 2020, 384(23):126544.
[35] PRAKASH SINGH J, NANDI T, KUMAR GHOSH S.Structure-property relationship of silver decorated functionalized reduced graphene oxide based nanofluids:Optical and thermophysical aspects and applications[J].Applied Surface Science, 2021, 542:148410.
[36] LUO X, LIU W J, CHEN C H, et al.Femtosecond laser micro-nano structured Ag SERS substrates with unique sensitivity, uniformity and stability for food safety evaluation[J].Optics & Laser Technology, 2021, 139:106969.
[37] 郭芳芳, 冯锋, 白云峰, 等.高效毛细管电泳-紫外检测法同时检测雪糕中多种添加剂[J].食品科学, 2015, 36(8):206-210.
GUO F F, FENG F, BAI Y F, et al.Determination of different synthetic dyes in ice-cream by high performance capillary electrophoresis with UV detection[J].Food Science, 2015, 36(8):206-210.
[38] YI J, ZENG L W, WU Q Y, et al.Sensitive simultaneous determination of synthetic food colorants in preserved fruit samples by capillary electrophoresis with contactless conductivity detection[J].Food Analytical Methods, 2018, 11(6):1 608-1 618.
[39] BORDAGARAY A, GARCIA-ARRONA R, VIDAL M, et al.Determination of food colorants in a wide variety of food matrices by microemulsion electrokinetic capillary chromatography.Considerations on the found concentrations and regulated consumption limits[J].Food Chemistry, 2018, 262:129-133.
[40] BERLINA A N, ZHERDEV A V, DZANTIEV B B.ELISA and lateral flow immunoassay for the detection of food colorants:State of the art[J].Critical Reviews in Analytical Chemistry, 2019, 49(3):209-223.
[41] LI Z, SONG S, XU L, et al.Development of an ultrasensitive immunoassay for detecting tartrazine[J].Sensors (Basel, Switzerland), 2013, 13(7):8 155-8 169.
[42] 任立松, 卢士英, 周玉, 等.柠檬黄色素免疫学检测方法的研究[J].食品科学, 2009, 30(12):258-261.
REN L S, LU S Y, ZHOU Y, et al.Immunoassay determination of tartrazine[J].Food Science, 2009, 30(12):258-261.
[43] LEI Y J, ZHANG S J, FANG L Z, et al.A sensitive and specific enzyme immunoassay for detecting tartrazine in human urinary samples[J].Analytical Methods, 2013, 5(4):925.