泛酸,也被称为维生素B5,D构型的右旋泛酸为其活性成分,是动物体内合成乙酰辅酶A的重要前体物质,也是大多数天然食物中存在的必需微量营养素[1],被广泛应用于食品、药品、饲料添加剂,其主要的产品形式为D-泛酸钙,以及D-泛醇、D-泛硫乙胺等衍生产品。合成D-泛酸的关键在于拆分DL-泛解酸内酯获得高光学纯度的D-泛解酸内酯。传统的方法是使用昂贵的手性试剂如奎宁、番木鳖碱、麻黄素等有机生物碱拆分[2],但是该工艺带来了严重的环境污染,并且拆分成本高。随着人们对绿色环保生产的追求及生物酶法的兴起,生物酶法拆分手性药物中间体越来越受到关注。
通过酶法拆分DL-泛解酸内酯包括氧化还原酶法[3-4]和选择性水解酶法[5-10],另外还有用羟腈裂解酶不对称加成法合成相对应的氰醇[11-13]等方法。而研究较多的是选择性水解酶法,选择性水解酶法是利用D-泛解酸内酯水解酶选择性地将DL-泛解酸内酯中的D-泛解酸内酯水解成D-泛解酸,D-泛解酸在酸性条件下加热得到D-泛解酸内酯,从而实现DL-泛解酸内酯的拆分。该方法不需要水解彻底,未水解部分经过消旋化处理可再次使用,只需所用的酶或微生物的立体专一性好,就能得到高光学纯度的D-泛解酸内酯,相较于其他酶法拆分DL-泛解酸内酯,该方法是最具有应用价值的路线。SAKAMOTO等于1994年首次报道了用D-泛解酸内酯水解酶拆分泛解酸内酯的方法,并报道了该酶一般来源Fusarium、Cylindrocarpon和Gibberella[14-15]。研究筛选到一株产D-泛解酸内酯水解酶的菌株,经鉴定为串珠镰孢霉菌(Fusarium moniliforme)SW-902,D-泛解酸内酯水解酶活力为0.92 U/g干菌体[5-7]。马佳鹏[8]通过筛选得到一株具有D-泛解酸内酯水解酶活性的菌株Fusarium avenaceum 3.4594,酶活力为0.489 U/mL。郑莉莉[9]筛选得到一株具有D-泛解酸内酯水解酶菌株,经鉴定为尖镰孢菌,并经过紫外诱变选育得到一株高活性菌株CZ-437,酶活力为5.7 U/L。王开放等[10]利用D380树脂固定化D-泛解酸内酯水解酶,固定化酶的比酶活力为(11.5±0.12) U/g。
目前利用产D-泛解酸内酯水解酶的菌株催化拆分DL-泛解酸内酯所面临的问题是原始来源菌酶活力较低,在工业上很难得到大规模应用。本实验室筛选得到一株具有D-泛解酸内酯水解酶活性的菌株,经鉴定属于镰孢霉菌(Fusarium),但是该菌株水解活力低,酶活力为1.42 U/mL,不利于大规模生产应用。为了提高其工业应用价值,本研究利用常温室压等离子(atmospheric room temperature plasma,ARTP)和UV-LiCl技术对产D-泛解酸内酯水解酶原始菌株进行多轮次递进诱变,并结合平板变色圈大小初筛,摇瓶测酶活力复筛,以期获得一株高产、稳定、适应性好的菌株,来提高生产效率以及降低生产成本,并对突变菌株进行发酵产酶条件优化。
1 材料与方法
1.1 材料试剂与仪器
1.1.1 菌株来源与培养基
种子培养基(g/L):酵母浸粉4,玉米浆干粉3.32,甘油13.32,棉籽蛋白胨13.32,豆粕粉6.68,消泡剂0.5,pH 7.0。
发酵培养基(g/L):玉米浆干粉1.32,甘油6.6,棉籽蛋白胨5.28,豆粕粉6.6,消泡剂0.12,pH 7.5。
初筛培养基(g/L):玉米浆干粉1.32,甘油6.6,棉籽蛋白胨5.28,琼脂20,DL-泛解酸内酯15,溴百里酚蓝0.1,pH 7.6。
菌种为本实验室筛选得到并保存,经菌种鉴定属于镰孢霉菌属。
1.1.2 试剂与设备
试剂:棉籽蛋白胨、豆粕粉、玉米浆干粉,南京茂捷微生物科技有限公司;酵母浸粉,OXOID公司;DL-泛解酸内酯,河南省新乡六通实业有限公司;Tris,上海毕得医药科技有限公司;消泡剂,济南翔邦化工有限公司;溴百里酚蓝,天津市致远化学试剂有限公司;LiCl、乙腈(分析纯),国药集团。
Lab Alliance高效液相色谱系统,美国科学仪器公司;Alphasil VC-C18色谱柱,华普科仪科技有限公司;ZWYR-2102C恒温培养振荡器,上海智诚分析仪器制造有限公司;PHSJ-4F雷磁pH计,上海仪电科学仪器有限公司;WZZ-2S 2SS旋光仪,上海申光仪器仪表有限公司;常温室压等离子发射装置,中国科学院合肥物质科学研究院提供。
1.2 实验方法
1.2.1 发酵产酶方法
将4 ℃保存的斜面菌种,转接至新鲜固体种子培养基上,27 ℃活化培养2 d,将活化后的菌落取一环转入50 mL种子培养基,27 ℃、300 r/min,培养24 h,再将种子液以7.5%(体积分数)的接种量转接至50 mL发酵培养基,27 ℃、300 r/min,培养36 h,发酵结束,抽滤并用去离子水洗涤,得到湿菌丝体。
1.2.2 孢子液的制备
取若干环生长3~4 d的固体培养基上的菌落,打入无菌生理盐水中,充分振荡,然后用一层无菌擦镜纸过滤掉菌丝体,制成孢子浓度在105 个/mL单孢子悬浮液。
1.2.3 诱变处理
ARTP诱变:取2 mL孢子悬液至无菌培养皿中,放置于常温室压等离子装置探头下,工作参数参考文献[16],工作气体He,电压12 kV,频率100 kHz,室温。处理时间分别为40、80、120、160、200、240、280 s。
UV-LiCl诱变:取2 mL孢子悬液至无菌培养皿中,在紫外灯下照射,照射距离为30 cm、功率为30 W,照射时间分别为20、40、60、80、100、120、140 s。
将诱变处理后的孢子液稀释100倍,取0.3 mL涂布与初筛培养基(UV-LiCl诱变涂布于含6 g/L LiCl的初筛培养基),27 ℃培养3~4 d,对照组的孢子悬浮液以同样方法操作,待长出菌落,致死率按公式(1)计算:
致死率![]()
(1)
1.2.4 初筛
在固体发酵培养基中加入DL-泛解酸内酯和pH指示剂,具有D-泛解酸内酯水解酶活力的菌株在培养基上生长,会水解培养基中的D-泛解酸内酯成D-泛解酸,导致菌落周围pH下降,产生变色圈,变色圈和菌落直径比值越大,酶活力可能越高[9]。将诱变处理后的孢子液涂布于初筛培养基,于27 ℃培养3~4 d,挑取变色圈/菌落直径较大的菌落复筛。
1.2.5 复筛
将初筛挑取的变色圈/菌落直径较大的菌株按照1.2.1步骤发酵培养,测其酶活力。
酶活力测定:取1 mL发酵液离心并用去离子水洗涤得到湿菌体,加入到2.5 mL 0.5 mol/L Tris-HCl缓冲液(pH 7.5),含6% DL-泛解酸内酯,30 ℃、150 r/min反应1 h,离心过滤除去菌体,采用液相色谱检测反应液。
酶活力定义:30 ℃、pH 7.5条件下,每分钟水解1 μmol D-(-)-泛解酸内酯成D-(+)-泛解酸所需要的酶量定义为1个酶活力单位(U)。
湿重定义:取1 mL发酵液离心并用去离子水洗涤,称质量。
高效液相检测条件为:色谱柱为Alphasil VC-C18(4.6 mm×250 mm×5 μm),流动相为V(乙腈)∶V(水)=25∶75,检测波长215 nm,流速1 mL/min,进样量20 μL。
突变菌株与对照菌株相比较,相对酶活力≤90%的为负突变株,相对酶活力≥110%的为正突变株,相对酶活力在90%~110%的视为中性突变株,并分别计算正突变率、负突变率和中性突变率。
1.2.6 高活性菌株遗传稳定性
将筛选到的高活性突变株4 ℃斜面保存,每隔1周转接活化1次,按照1.2.1步骤培养,测D-泛解酸内酯水解酶活力。
1.2.7 突变株与原始菌株催化高浓度DL-泛解酸内酯比较
欲提高突变菌株的工业应用价值,不仅要提高单位酶活力,也要提高其在高底物浓度下的水解能力以及对映体选择性。随着反应时间进行,该菌株催化的DL-泛解酸内酯水解反应的产物达到一定积累量,会抑制水解反应进行,使反应达到平衡。虽然提高底物浓度可以提高D-泛解酸的生成量,但是底物水解率会降低,导致大量底物未被利用,综合考虑底物利用率及产物生成量,底物浓度为200 g/L时最佳。因此以20%的DL-泛解酸内酯为催化底物,分别加入1 g筛选得到的高活性菌株和原始菌株的湿菌体,30 ℃反应9 h,反应结束后,将反应液离心过膜,用旋光仪检测其旋光度,液相检测其水解率,以及将D-泛解酸内酯分离纯化后测其光学纯度,水解率和光学纯度按公式(2)(3)计算:
水解率![]()
(2)
光学纯度![]()
(3)
式中:ρ0,反应前DL-泛解酸内酯浓度,g/L;ρ1,反应后DL-泛解酸内酯浓度,g/L。
1.2.8 突变株发酵产酶条件优化
相较于原始菌,突变株的基因组可能发生变化,原始菌株的发酵产酶条件不一定是突变株的最佳条件,因此对筛选到的高活性突变株,从发酵温度(15~35 ℃)、发酵初始pH(6.0~9.0)、接种量(1.5%~16.5%)、发酵时间(12~96 h)几个方面优化其发酵条件探究其对产D-泛解酸内酯水解酶的影响,每组做3个平行。
2 结果与分析
2.1 ARTP诱变最佳处理时间确定
如图1所示,随着处理时间增加,致死率逐渐增加,120 s时达到93.86%,280 s完全致死。当诱变时间短时,中性突变率较高;随着致死率增加,突变概率逐渐增加,但是负突变率也对应增加。在处理时间为80 s时正突变率最高为28%,致死率为82.89%,这与文献[17]中报道的致死率在80%左右更有利于筛选得到高产菌株相符合。
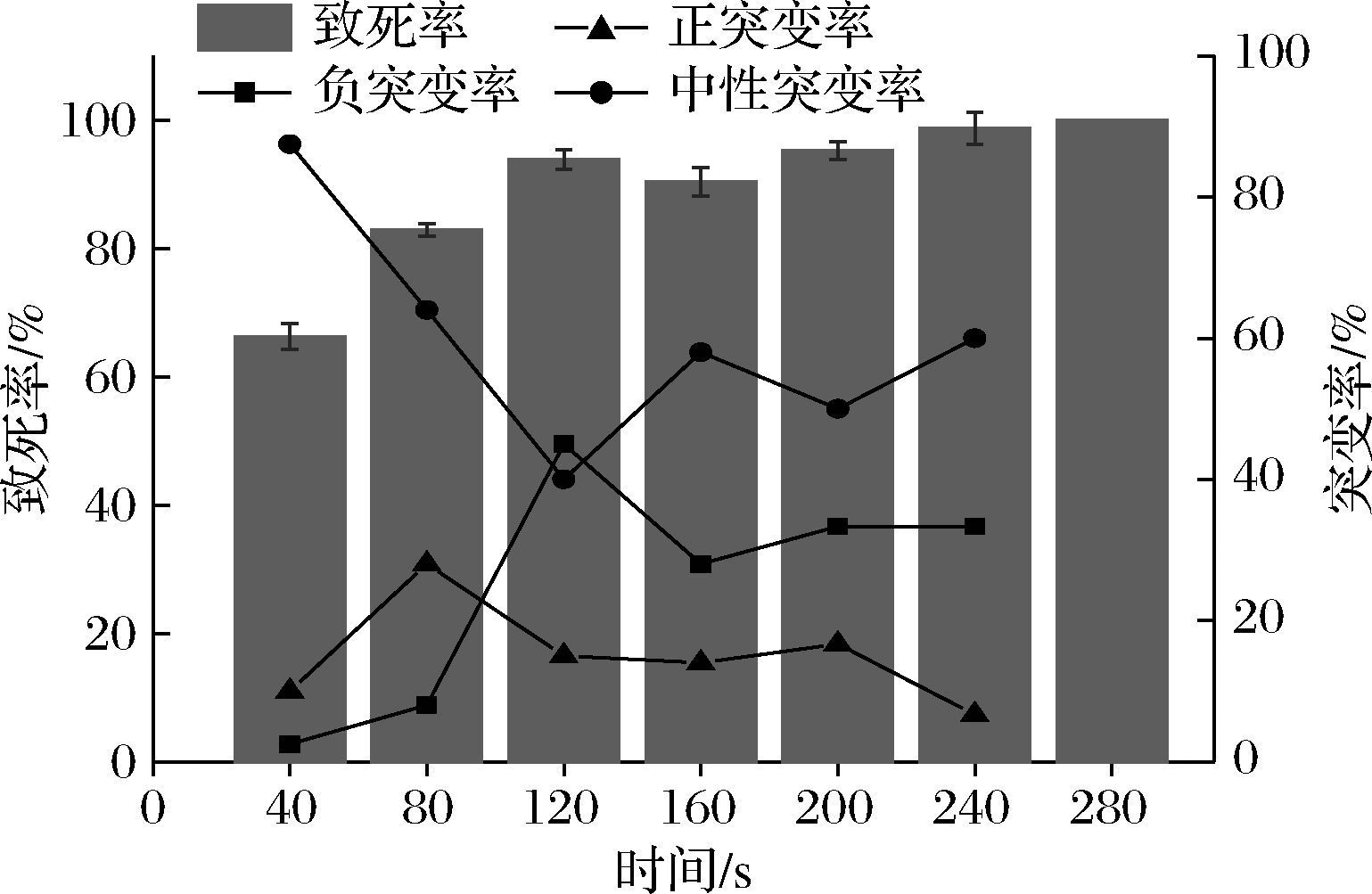
图1 ARTP诱变时间对镰孢霉菌致死率和突变率的影响
Fig.1 Effects of ARTP mutagenesis time on the sterilization
and mutation rate of Fusarium
2.2 UV-LiCl诱变最佳处理时间确定
将经紫外不同照射时间的孢子液涂布于含有6 g/L LiCl的初筛培养基上,诱变效果如图2所示。当照射时间为60 s时致死率达到83.17%,140 s时完全致死。随着照射时间的增加正突变率呈现先上升后下降的趋势,在80 s时最大为20%,此时的致死率为88.78%。
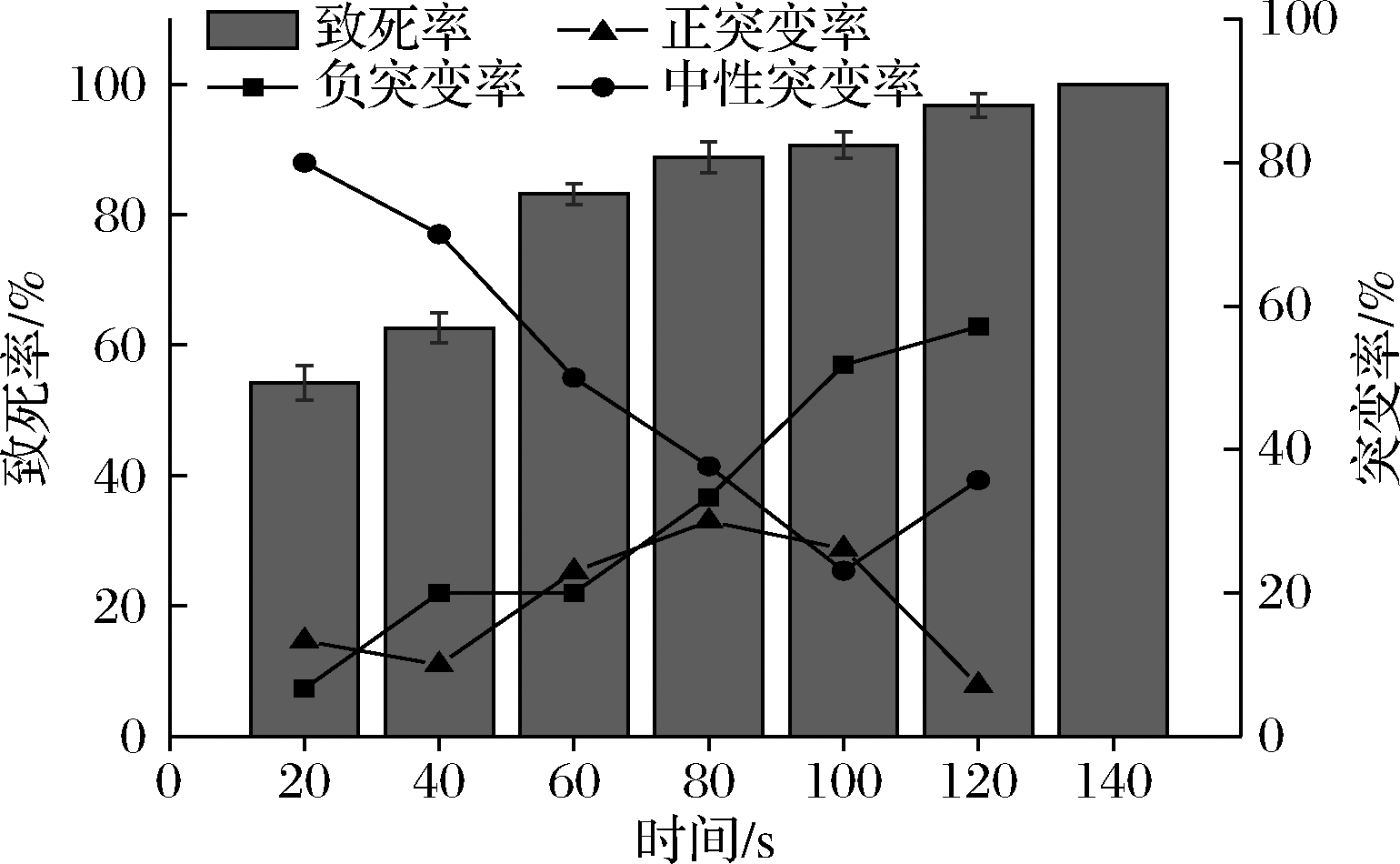
图2 UV-LiCl诱变时间对镰孢霉菌致死率
和突变率的影响
Fig.2 Effects of UV-LiCl mutagenesis time on sterilization
and mutation rate of Fusarium
2.3 初筛
在初筛培养基中加入底物DL-泛解酸内酯,相当于在筛选过程中给菌株一个胁迫作用,但是在培养基中加入DL-泛解酸内酯会抑制菌株生长。在初筛培养基中加入不同浓度DL-泛解酸内酯,27 ℃培养3 d,待菌落长出后计数,未添加DL-泛解酸内酯的作为对照,每组做3个平行,生长率按公式(4)计算:
生长率![]()
(4)
如表1所示,DL-泛解酸内酯含量太低时起不到胁迫作用,含量太高筛选范围小,因此选择1.5%的添加量较合适,初筛培养基变色圈效果如图3所示。
表1 DL-泛解酸内酯添加量对镰孢霉菌生长的影响
Table 1 Effect of DL-pantolactone addition
on the growth of Fusarium
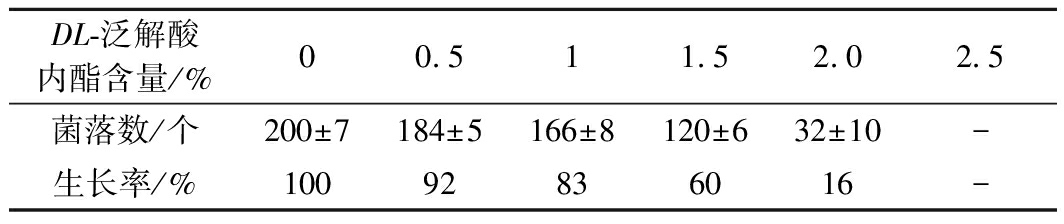
DL-泛解酸内酯含量/%00.511.52.02.5菌落数/个200±7184±5166±8120±632±10-生长率/%10092836016-
注:“-”表示未测到数值(下同)
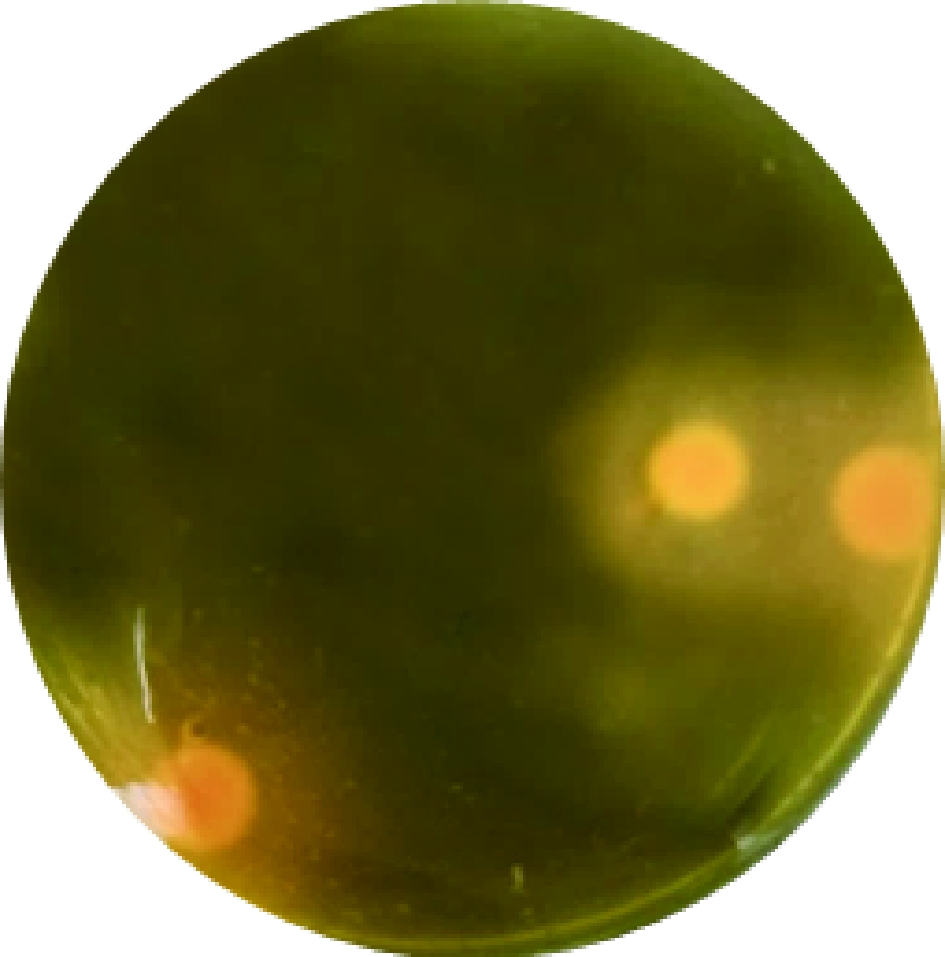
图3 初筛培养基筛选效果
Fig.3 Screening effect of primary screening medium
2.4 复筛
利用ARTP及UV-LiCl技术经过4轮诱变选育,以获得高活性D-泛解酸内酯水解酶突变株,其中在在进行第二轮ARTP诱变时,正突变率及负突变率较第一轮均有所下降,第三轮采用UV-LiCl诱变以提高镰孢霉菌对ARTP的敏感度,结果如表2所示,第四轮ARTP的突变率,较前三轮均有所增加。每一轮筛选出的高活性菌株如图4所示。以每轮诱变筛选到的遗传较稳定的高活性的菌株为出发菌株,再进行下一轮诱变(表2)。最终筛选得到一株高活性菌株4-80-6,其酶活力为3.51 U/mL。
表2 四轮诱变选育的过程
Table 2 Process of four rounds of mutagenesis breeding
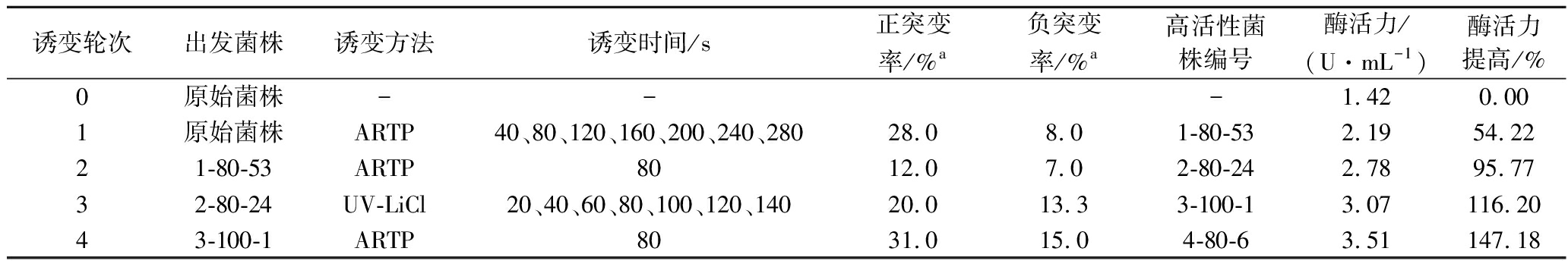
诱变轮次出发菌株诱变方法诱变时间/s正突变率/%a负突变率/%a高活性菌株编号酶活力/(U·mL-1)酶活力提高/%0原始菌株---1.420.001原始菌株ARTP40、80、120、160、200、240、28028.08.01-80-532.1954.2221-80-53ARTP8012.07.02-80-242.7895.7732-80-24UV-LiCl20、40、60、80、100、120、14020.013.33-100-13.07116.2043-100-1ARTP8031.015.04-80-63.51147.18
注:a-在最佳诱变条件(ARTP处理80 s,UV-LiCl处理80 s)下的突变率
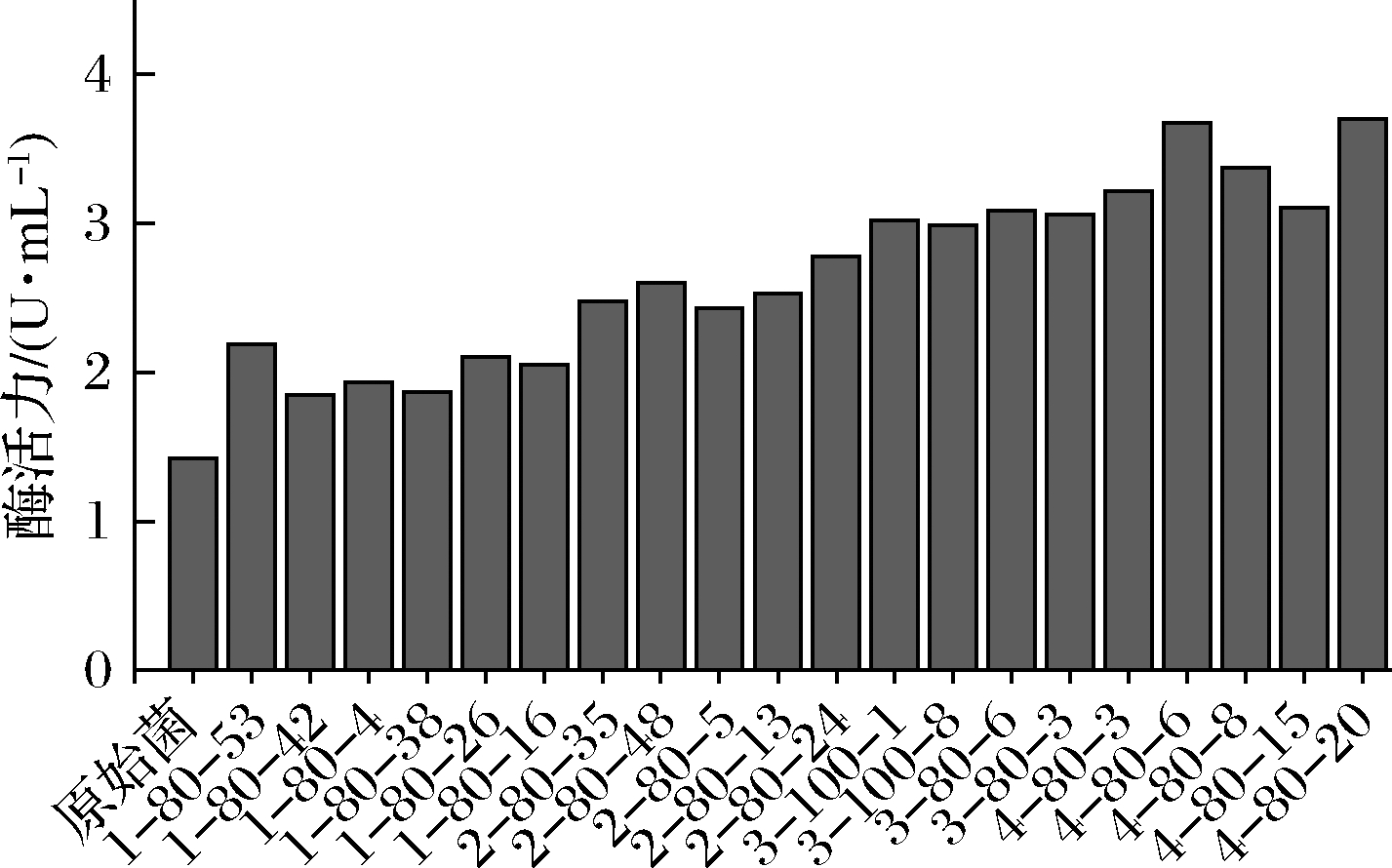
图4 四轮诱变选育复筛菌株的酶活力
Fig.4 Enzyme activity of re-screened strains selected
by four rounds of mutagenesis
2.5 突变株的遗传稳定性
经过诱变选育的突变株可能会出现自我修复,导致遗传不稳定,因此对突变株4-80-6传代培养8次,结果如表3所示。4-80-6菌株产酶活力比较稳定,其平均酶活力为3.46 U/mL,说明该突变株遗传稳定,具有进一步研究的价值。
2.6 原始菌株与突变株4-80-6催化高浓度DL-泛解酸内酯的比较
以20% DL-泛解酸内酯为底物,比较突变株4-80-6与原始菌株的水解能力,结果如表4所示。在20%底物浓度下,突变株4-80-6水解率由原始菌株的11.6%提高到了17.7%。因为D-(-)-泛解酸内酯水解成D-(+)-泛解酸,旋光性由左旋变成右旋,而L-(+)-泛解酸内酯也是右旋的,反应越彻底,右旋的旋光值就越大。测定反应液的旋光值大小,可以观察出菌体对底物的立体选择性。突变株4-80-6反应液旋光度由原始菌的1.216提高到了2.785,说明突变菌株没有改变其立体选择性。产物的光学纯度,由原始菌株的93.5%提高到了98.3%,表明该突变株对高浓度DL-泛解酸内酯的水解能力和对映体选择性较原始菌株均有所提高,该突变株为工业上催化拆分DL-泛解酸内酯提供了更好的酶源。
表3 突变株4-80-6的遗传稳定性
Table 3 Genetic stability of mutant strain 4-80-6
培养代数123456784-80-6酶活力/(U·mL-1)3.51±0.113.41±0.093.39±0.143.45±0.133.46±0.083.55±0.183.47±0.143.50±0.12
表4 原始菌与突变株4-80-6催化DL-泛解酸内酯
水解拆分的数据分析
Table 4 Comparison of DL-pantolactone hydrolysis and
resolution catalyzed by original strain and mutant
strain 4-80-6

酶活力/(U·mL-1)a水解率/%b旋光度/°b光学纯度/%原始菌1.4211.61.21693.54-80-63.4617.72.78598.3
注:a-以6%的底物反应1 h;b-以20%的底物酯反应9 h
2.7 突变株4-80-6的发酵条件优化
2.7.1 发酵温度对突变株4-80-6产D-泛解酸内酯水解酶的影响
如图5所示,随着发酵温度增加,酶活力与发酵湿重均先增加后下降,在25 ℃时达到最佳,此时酶活力达到3.57 U/mL。而原始菌株的最佳培养温度为27 ℃,说明突变株4-80-6较原始菌株更适合在低温度下产D-泛解酸内酯水解酶。
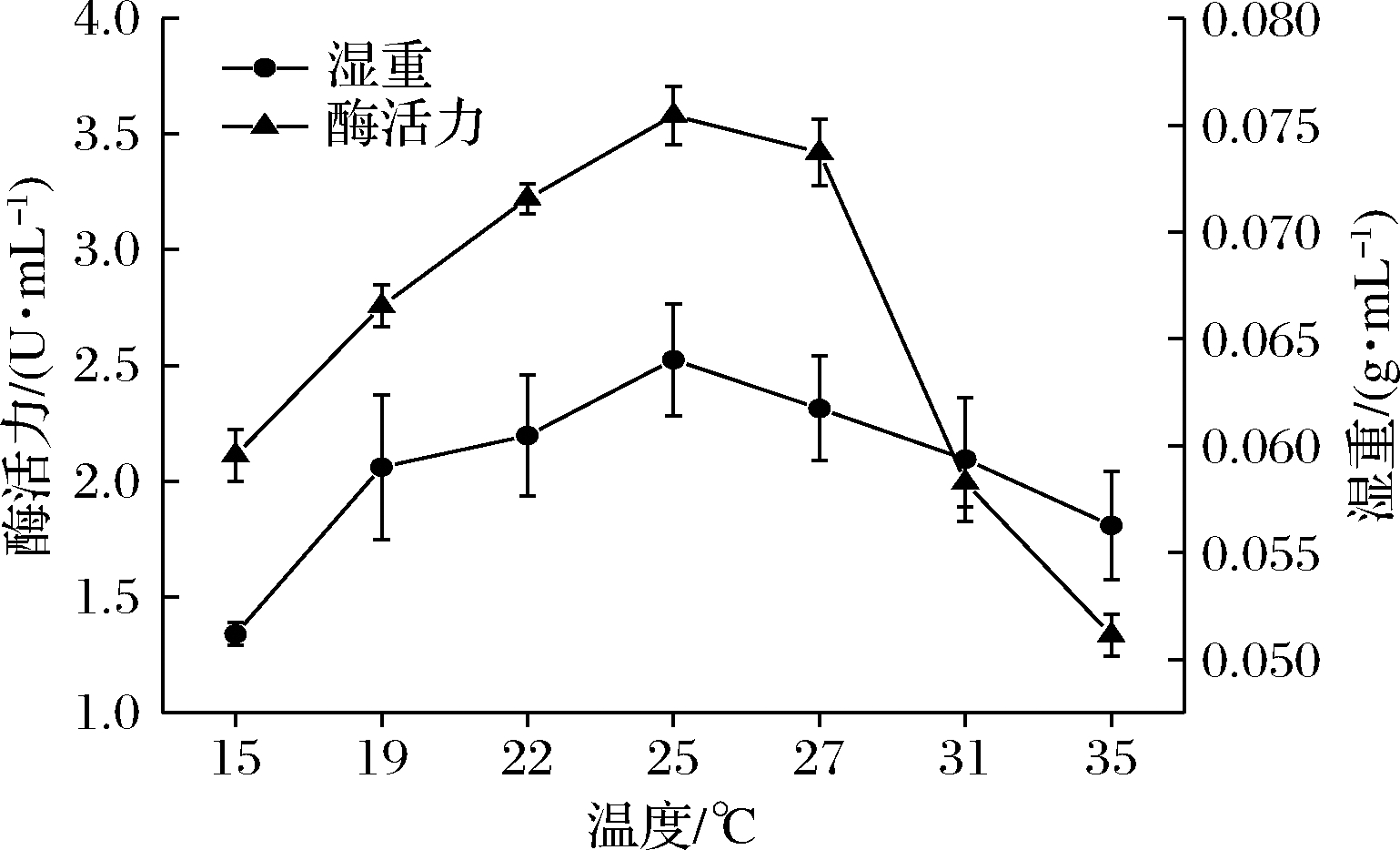
图5 发酵温度对突变株4-80-6产D-泛解酸内酯
水解酶的影响
Fig.5 Effects of fermentation temperature on the production of
D-lactonohydrolase by mutant strain 4-80-6
2.7.2 发酵初始pH对突变株4-80-6产D-泛解酸内酯水解酶的影响
如图6所示,随着发酵培养基初始pH的增加,菌体湿重和酶活力均在pH为8.5时达到最佳,此时酶活力为4.01 U/mL,当pH升高到9.0时开始下降。而原始菌株的最适发酵初始pH为7.5,说明突变株4-80-6较原始菌株,更适合在偏碱性下产D-泛解酸内酯水解酶。
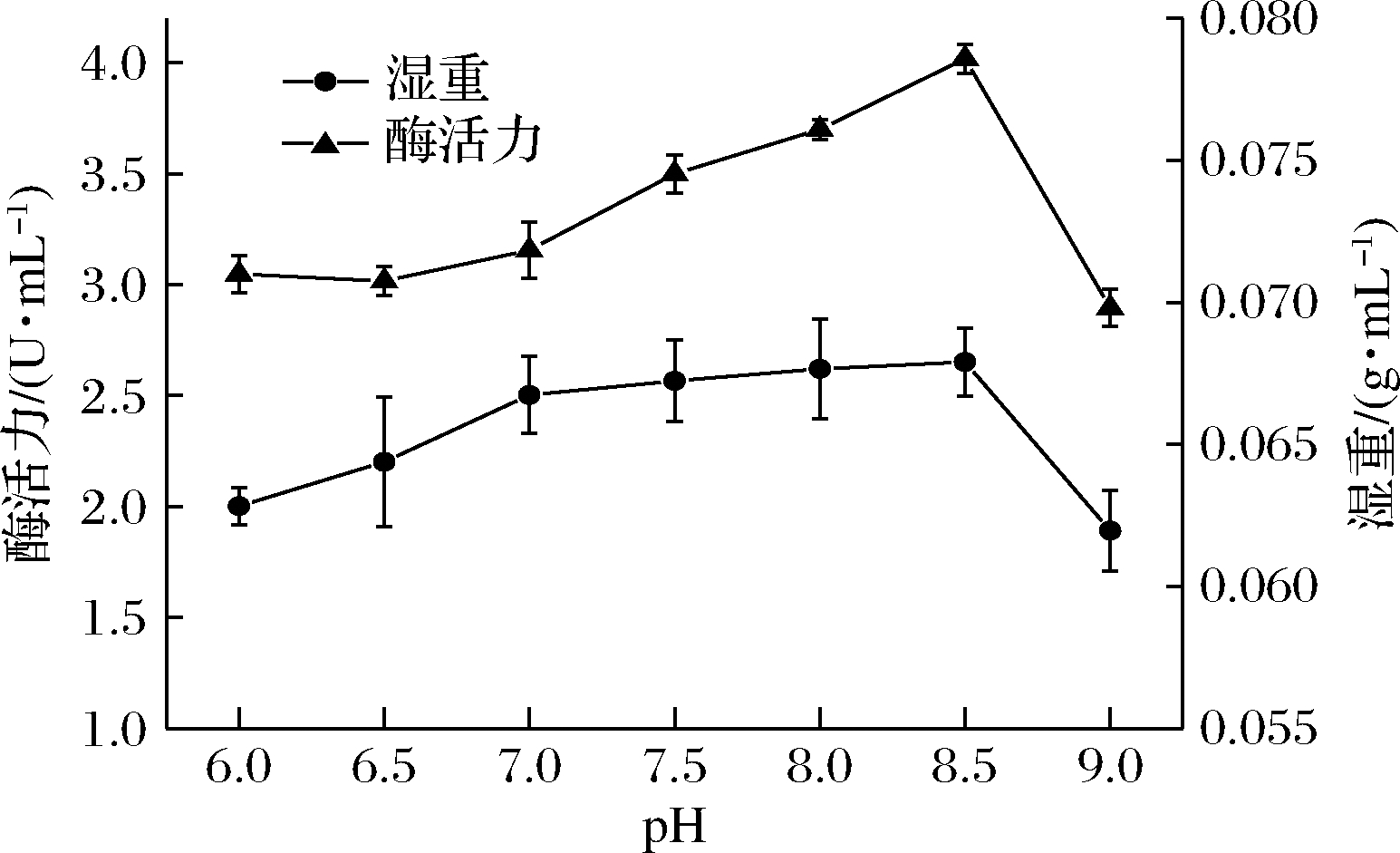
图6 发酵初始pH对突变株4-80-6产D-泛解酸
内酯水解酶的影响
Fig.6 Effects of initial pH on the production of
D-lactonohydrolase by mutant strain 4-80-6
2.7.3 接种量对突变株4-80-6产D-泛解酸内酯水解酶的影响
如图7所示,随着接种量的增加,酶活力和菌体湿重均在10.5%的接种量时达到最大,此时酶活力为4.12 U/mL,突变株4-80-6的最佳接种量由原始菌株的7.5%提高到了10.5%。
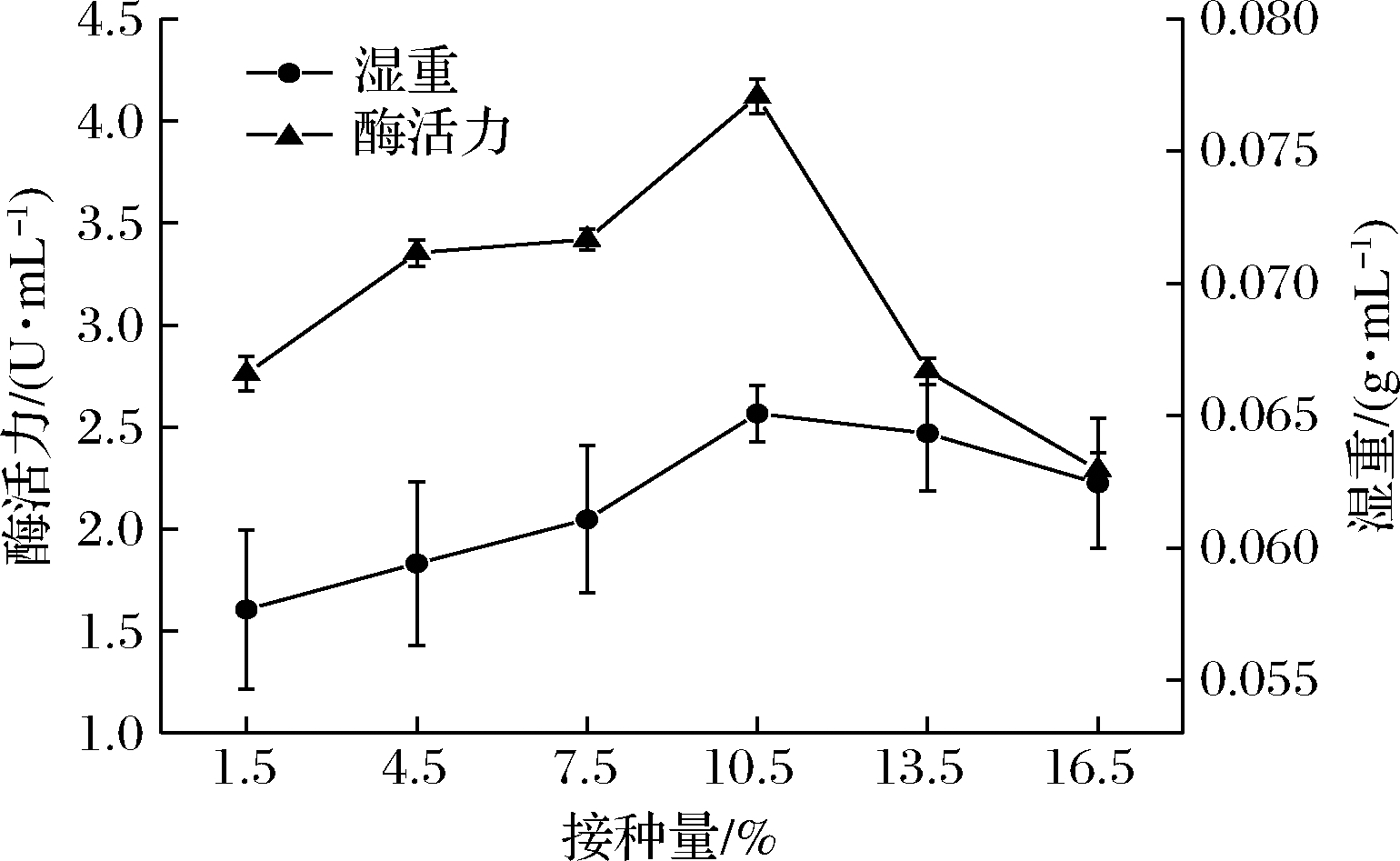
图7 接种量对突变株4-80-6产D-泛解酸内酯水解酶的影响
Fig.7 Effects of inoculation volume on the production of
D-lactonohydrolase by mutant strain 4-80-6
2.7.4 原始菌和突变株4-80-6的发酵时间曲线
按照上述优化的条件发酵培养,每隔6 h测酶活力和湿重,以及测发酵液pH。如图8所示,酶活力和发酵湿重随着发酵时间增加均出现先上升后下降的趋势,突变株4-80-6在48 h达到最佳,此时酶活力为4.33 U/mL,菌体湿重为0.075 g/mL。原始菌株在36 h达到最佳,此时酶活力为1.42 U/mL,菌体湿重为0.073 g/mL。突变株4-80-6达到最佳发酵时间由原始菌株的36 h延长到了48 h,说明该突变株较原始菌株生长缓慢些。
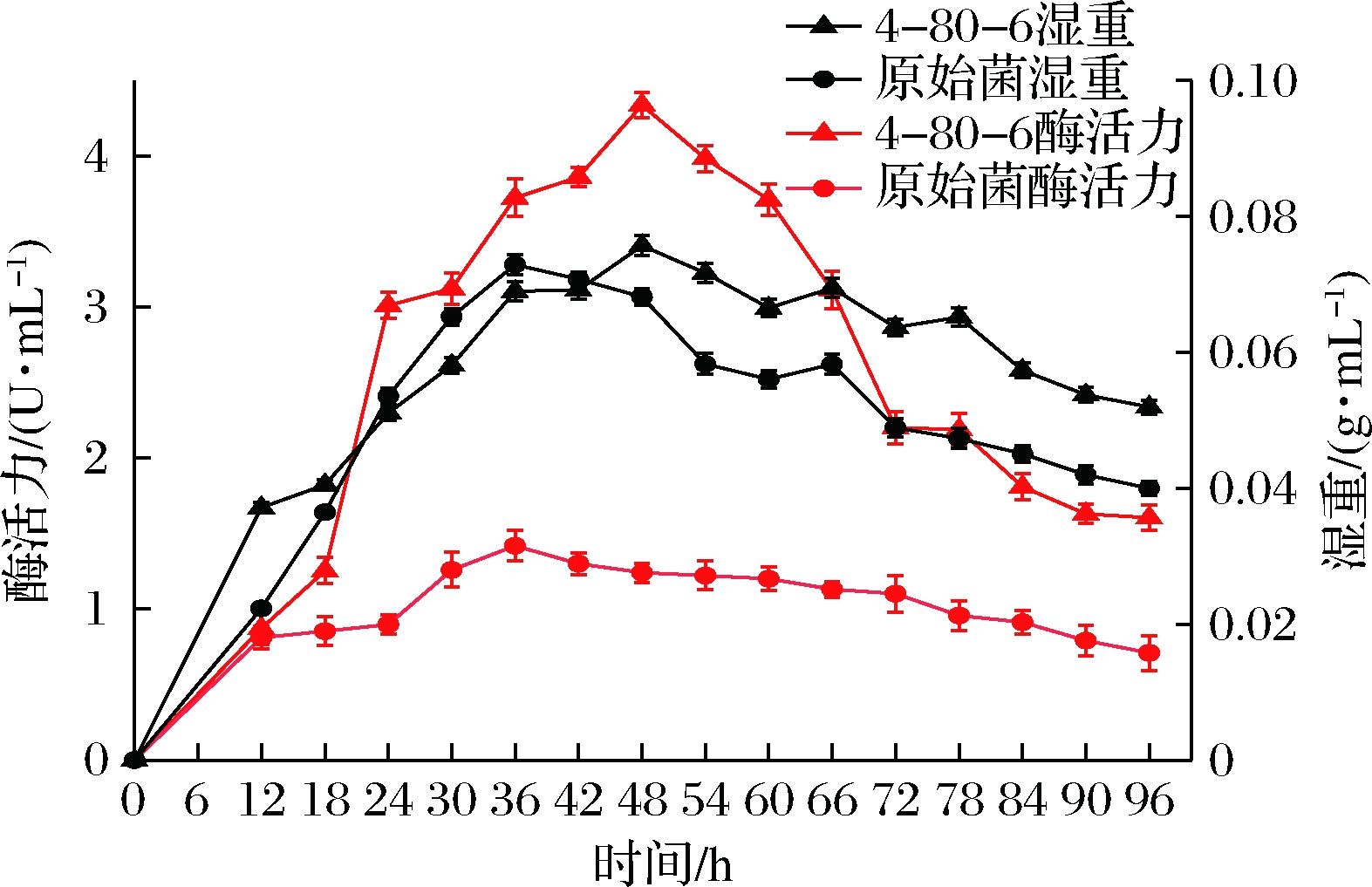
图8 原始菌株与突变株4-80-6发酵时间曲线
Fig.8 Fermentation time curve of original strain and
mutant strain 4-80-6
如图9所示,随着发酵时间的增加,发酵液pH先下降后上升,突变株4-80-6在48 h下降到最低4.94,原始菌株在36 h下降到最低5.1。pH变化趋势与菌株生长趋势相符合,前期菌体生长消耗培养基成分使培养基pH下降,当菌体生长到一定程度,菌体开始出现裂解,菌体自身代谢物质释放使pH上升。

图9 原始菌株与突变株4-80-6发酵液pH值变化曲线
Fig.9 pH value curve of fermentation of original strain
and mutant 4-80-6
3 结论
以产D-泛解酸内酯水解酶的镰孢霉菌为基础,利用ARTP和UV-LiCl技术经过4轮递进诱变,并结合平板变色圈大小初筛,摇瓶测酶活力复筛,筛选得到1株优势菌株4-80-6,酶活力为3.46 U/mL,是原始菌株的2.43倍,8次传代培养后,该菌株遗传稳定。以20%的DL-泛解酸内酯为底物催化时,突变株4-80-6较原始菌株,水解率提高了47.41%,光学纯度由93.5%提高到了98.3%。通过对突变株4-80-6发酵产酶条件的优化,酶活力达到4.33 U/mL,比优化前(3.46 U/mL)提高了25.14%。
本研究在多轮ARTP诱变中穿插一轮UV-LiCl诱变,其目的为了防止镰孢霉菌对ARTP产生耐受性,提高其对ARTP的敏感度,增加突变概率。从突变率和致死率的结果可知,当致死率较低时,突变概率小,产生的大多都是中性突变;致死率较高时,突变概率增加,负突变率会相应增加,并且致死率太高筛选范围较小。本研究中无论是ARTP诱变还是UV-LiCl诱变,均是在致死率为80%~90%时,正突变率最高,这与文献[17]报道的致死率在80%左右更有利于筛选到优势菌株一致。筛选到的突变株4-80-6,不仅酶活力较原始菌株有所提高,在20%底物浓度下水解率也高于原始菌株,同时所得到的产物D-泛解酸内酯的光学纯度也有所提高,以及通过发酵条件优化,进一步提高了其酶活力,为工业上拆分DL-泛解酸内酯提供了更好的酶源。
致谢
感谢中国科学院合肥物质科学研究院黄青研究员提供常温室压等离子设备与技术支持。
[1] 谢颂洋, 顾正华, 郭自涛, 等.重组表达D-泛解酸内酯水解酶乳酸克鲁维酵母的发酵工艺优化[J].食品与发酵工业, 2021, 47(23):38-45.
XIE S Y, GU Z H, GUO Z T, et al.Optimized fermentation condition for production of D-lactonohydrolase in a Kluyveromyces lactis recombinant[J].Food and Fermentation Industries, 2021, 47(23):38-45.
[2] 袁桂梅,于泉德,刘丽秀,等.泛解酸内酯拆分新工艺研究[J].山东化工,2002,31(4):3-4.
YUAN G M,YU Q D,LIU L X,et al.Research on a new process for the resolution of pantolactone [J].Shandong Chemical Industry, 2002,31(4):3-4.
[3] 王加跑.共轭聚酮还原酶基因挖掘和催化D-(-)-泛酰内酯的不对称合成[D].杭州:杭州师范大学,2019.
WANG J P.Discovery of conjugated polyketone reductases for asymmetrically catalyzing the synthesis of D-(-)-pantolactone[D].Hangzhou:Hangzhou Normal University,2019.
[4] ZHU F Y, ZHONG J, SHEN Q, et al.Development of an Escherichia coli whole cell catalyst harboring conjugated polyketone reductase from Candida glabrata for synthesis of D-(-)-pantolactone[J].Process Biochemistry, 2022, 112:223-233.
[5] 汤一新, 孙志浩, 华蕾, 等.D-泛解酸内酯水解酶产生菌的筛选及产酶条件研究[J].微生物学报, 2002, 42(1):81-87.
TANG Y X, SUN Z H, HUA L, et al.Production of D-pantolactone hydrolase by Fusarium moniliforme SW-902[J].Acta Microbiologica Sinica, 2002, 42(1):81-87.
[6] HUA L, SUN Z H, LENG Y, et al.Continuous biocatalytic resolution of DL-pantolactone by cross-linked cells in a membrane bioreactor[J].Process Biochemistry, 2005, 40(3-4):1 137-1 142.
[7] TANG Y X, SUN Z H, HUA L, et al.Kinetic resolution of DL-pantolactone by immobilized Fusarium moniliforme SW-902[J].Process Biochemistry, 2002, 38(4):545-549.
[8] 马佳鹏. 微生物酶法拆分DL-泛解酸内酯[D].沈阳:沈阳药科大学, 2009.
MA J P.Optical resolution of DL-pantolactone by microbial enzyme[D].Shenyang:Shenyang Pharmaceutical University, 2009.
[9] 郑莉莉. D-泛解酸内酯水解酶产生菌的筛选及条件优化的研究[D].济南:山东轻工业学院, 2009.
ZHENG L L.Screening of D-pantolactone hydrolase producing strains and optimizing of technology conditions[D].Jinan:Shandong Polytechnic University, 2009.
[10] 王开放, 张梁, 辛瑜, 等.D-泛解酸内酯水解酶的固定化及酶学性质[J].生物加工过程, 2019, 17(2):159-165.
WANG K F, ZHANG L, XIN Y, et al.Immobilization and characterization of D-lactonohydrolase[J].Chinese Journal of Bioprocess Engineering, 2019, 17(2):159-165.
[11] EFFENBERGER F, EICHHORN J, ROOS J.Enzyme catalyzed addition of hydrocyanic acid to substituted pivalaldehydes:A novel synthesis of (R)-pantolactone[J].Tetrahedron:Asymmetry, 1995, 6(1):271-282.
[12] PSCHEIDT B, LIU Z B, GAISBERGER R, et al.Efficient biocatalytic synthesis of (R)-pantolactone[J].Advanced Synthesis & Catalysis, 2008, 350(13):1 943-1 948.
[13] PSCHEIDT B, AVI M, GAISBERGER R, et al.Screening hydroxynitrile lyases for (R)-pantolactone synthesis[J].Journal of Molecular Catalysis B:Enzymatic, 2008, 52:183-188.
[14] SAKAMOTO K, YAMADA H, SHIMIZU S.D-pantolactone hydrolase and process for the preparation thereof:US5372940[P].1994-12-13.
[15] SAKAMOTO K, YAMADA H, SHIMIZU S.Process for the preparation of D-pantolactone:US5275949[P].1994-01-04.
[16] 马玉涵. 等离子体诱变灵芝及其药用成分的红外光谱分析[D].合肥:中国科学技术大学, 2018.
MA Y H.Plasma mutagenesis of Ganoderma Lingzhi and screening through infrared spectroscopy for medicinal components[D].Hefei:University of Science and Technology of China, 2018.
[17] 徐志南, 刘刚, 柯世省,等. 循环筛选法在除虫链霉菌诱变育种中的应用[J].中国抗生素杂志. 1999,24(3):1-19; 78.
XU Z N, LIU G, KE S S, et al. Application of cyclic screening in mutagenesis breeding of Streptomyces insecticides[J]. Chinese Journal of Antibiotics. 1999,24(3): 1-19; 78.