岩藻多糖是一种来源于褐藻的水溶性硫酸化杂多糖,主要由L-岩藻糖和硫酸基团组成,并含有其他的单糖和糖醛酸等[1-2]。研究表明,岩藻多糖的化学结构会因采收季节、褐藻种类、提取方法的不同而发生变化[1]。岩藻多糖化学结构的多样性赋予了其广泛的生理活性[3],使其越来越受到研究者的关注[4],如抗肿瘤[5-7]、抗氧化[8]、保护胃黏膜[9]、降血脂[10]、保湿等。但从褐藻中提取的天然岩藻多糖分子质量大、溶解性差、黏度高、难以吸收,限制了其在临床上的应用,因而研究者将目光转移到了低分子质量岩藻多糖(low molecular weight fucoidan,LMWF)。
LMWF是指经部分水解生成的分子质量1~100 kDa的岩藻多糖,具有溶解性好、黏度低、生物活性高等优点[5]。制备方法主要有化学法和酶法。化学法主要使用酸降解和H2O2降解,但此方法的反应条件剧烈、容易破坏多糖活性结构,且产物分子质量的分布范围大,给分离纯化带来困难[11-12];酶水解法因具有反应条件温和、对环境友好、产物分子质量易于控制等优点,显示出广阔的应用前景。当前,已知的岩藻多糖酶主要来源于海洋软体动物和微生物,从海洋软体动物Lambis sp.消化腺中分离得到的岩藻多糖酶活力为0.124 U/mL[13],海洋真菌Dendryphiella arenaria TM94酶活力为0.012 U/mL[14]、Cladosporium salinae为0.048 U/mL[15]、Mucor sp.3P为9.26 U/L[16],Aspergillus niger PSH为0.013 8 U/mL[17],这些岩藻多糖酶的活力较低,难以进行大规模的生产应用。因此,寻找酶活力更高的产岩藻多糖酶菌株成为亟待解决的重要问题。
本研究首次从酒曲中筛选得到了1株产岩藻多糖酶的菌株,通过单因素和正交实验对酶解条件进行优化,在最佳酶解条件下制备分子质量<10 kDa的LMWF,探究LMWF的DPPH、·OH和总氧自由基清除能力。以期丰富陆生真菌产岩藻多糖酶的来源,并发掘其酶解产物LMWF作为天然抗氧化剂在食品、保健和化妆品领域的应用潜力。
1 材料与方法
1.1 菌株来源
菌株来自于从不同酒厂采集的酒曲:汾酒酒曲、贵州酒曲、古井酒曲。
1.2 材料与设备
岩藻多糖(Mw:392 kDa),青岛明月海藻集团有限公司,其中岩藻糖19.3%(质量分数,下同)、糖醛酸51.5%、SO42- 30.1%;麸皮、黄豆皮、玉米皮、小麦粉、黄豆粉、大米粉、玉米粉等,市售;葡萄糖、蛋白胨、酵母粉等,国药集团。
高压灭菌锅,美国致微仪器有限公司;7GI-16M高速冷冻离心机,美国赛默飞世尔科技公司;Synergy H4 酶标仪,美国BioTek公司;SPX-250-Z恒温培养箱,上海跃进医疗器械厂;1260型高效液相色谱仪,美国安捷伦科技公司。
1.3 培养基
PDA培养基(g/L):马铃薯 200,葡萄糖 20,琼脂 20,pH自然。
筛选培养基(g/L):岩藻多糖10,NH4NO3 2,MgSO4 0.05,琼脂 20,50 μg/mL的青霉素及链霉素。
液态发酵培养基(g/L):麸皮50,岩藻多糖5,酵母粉10,蛋白胨5,pH 5.0。
固态发酵培养基(250 mL锥形瓶):麸皮10 g,岩藻多糖0.1 g,含水量60%,pH 5.0。
1.4 实验方法
1.4.1 菌株筛选
取5 g酒曲溶于45 mL的无菌水中,振荡培养2 h。分别取1 mL培养液进行10倍梯度稀释,吸取100 μL稀释液(10-1~10-5)涂布于筛选培养基上,30 ℃培养3~7 d,挑取生长良好的、不同形态的单菌落进行分离纯化。将所得菌株划线于PDA平板,30 ℃培养5 d。使用100 mL无菌水洗涤菌落并转移至含有玻璃珠的250 mL锥形瓶中,于25 ℃、180 r/min的摇床中振荡30 min,使用无菌水稀释至孢子含量为106个/mL。将制备的孢子悬液按照1.0%(体积分数)的接种量分别接种于液态发酵培养基(250 mL锥形瓶,装液量50 mL)和固态发酵培养基(250 mL锥形瓶中含有10 g发酵基质)中,其中液态发酵于30 ℃、180 r/min的恒温摇床中培养5 d,固态发酵于30 ℃的恒温培养箱中静置培养5 d,测定岩藻多糖酶活力。
1.4.2 菌株鉴定
形态特征:将菌株接种于PDA固体培养基上,30 ℃培养3~7 d,观察菌落的形态变化,并在扫描电子显微镜下观察菌丝和孢子形态。
分子生物学鉴定:使用真菌基因组提取试剂盒提取全基因组DNA,设计ITS序列引物进行PCR扩增,产物送至上海生工生物工程有限公司进行检测。测序结果于NCBI数据库进行BLAST比对,对比结果利用MEGA7构建系统发育树,确定菌株的种属。
1.4.3 岩藻多糖酶活力测定
粗酶液的制备:将50 mL预冷的0.1 mol/L Na2HPO4-柠檬酸缓冲液(pH 6.0)添加于终止发酵的固态培养基中,搅拌均匀,4 ℃过夜浸提,使用纱布进行过滤,滤出液离心(8 000 r/min,10 min)获得的上清液即为固态发酵下的粗酶液。
由于缺乏特定的岩藻多糖酶活力检测方法,研究者主要通过测定反应系统中还原糖的生成量来确定岩藻多糖酶的活力[14,18-19],常用的方法为3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[20]。使用0.1 mol/L Na2HPO4-柠檬酸缓冲液(pH 6.0)将粗酶液稀释至适当浓度,取0.2 mL稀释液与0.2 mL 5 g/L岩藻多糖溶液(0.1 mol/L Na2HPO4-柠檬酸缓冲液,pH 6.0)混合均匀,50 ℃反应1 h,添加0.6 mL DNS溶液,混匀,沸水浴10 min,冷却后测定540 nm下吸光度。岩藻多糖酶活力单位(U/mL)定义为:在50 ℃下,每分钟水解岩藻多糖产生1 μmol岩藻糖所需要的酶量。
1.4.4 LMWF得率的测定
取1 mL水解液并添加3 mL无水乙醇沉淀高分子质量岩藻多糖(high molecular weight fucoidan,HMWF),8 000 r/min离心15 min获得含有LMWF的上清液,蒸发上清液,所得产物用1 mL蒸馏水复溶[21]。总糖测定采用苯酚硫酸法[22],SO42-测定采用BaCl2-明胶比浊法。LMWF得率按公式(1)计算:
LMWF得率![]()
(1)
1.4.5 酶解条件对LMWF得率的影响
底物质量浓度:分别取5 mL不同质量浓度的岩藻多糖溶液(1、2.5、5、10、15、20、25 g/L)与4 mL粗酶液混合均匀,50 ℃反应4 h,测定LMWF得率和SO42-含量,确定最佳底物质量浓度。
酶解pH:将岩藻多糖溶于不同pH下的缓冲液中,Na2HPO4-柠檬酸缓冲液(pH 3~7),PBS(pH 7~8),Na2HPO4-K2HPO4缓冲液(pH 8~9)。分别取5 mL不同pH(4.0、5.0、6.0、7.0、8.0、9.0)的岩藻多糖溶液与4 mL粗酶液混合均匀,50 ℃反应4 h,测定LMWF得率和SO42-含量,确定最佳酶解pH。
酶解温度:取5 mL岩藻多糖溶液与4 mL粗酶液混合均匀,分别在不同温度(35、40、45、50、55、60 ℃)下反应4 h,测定LMWF得率和SO42-含量,确定最佳酶解温度。
酶解时间:取5 mL岩藻多糖溶液与4 mL粗酶液混合均匀,在50 ℃分别反应0、2、4、6、8、10、12、24、36、48、60 h,测定LMWF得率和SO42-含量,确定最佳酶解时间。
根据单因素实验结果,选取底物质量浓度、酶解pH、酶解温度设计三因素三水平的正交实验(表1),在各个条件下反应24 h,以LMWF得率为指标,确定最佳酶解条件。
表1 正交实验设计
Table 1 Design of orthogonal test
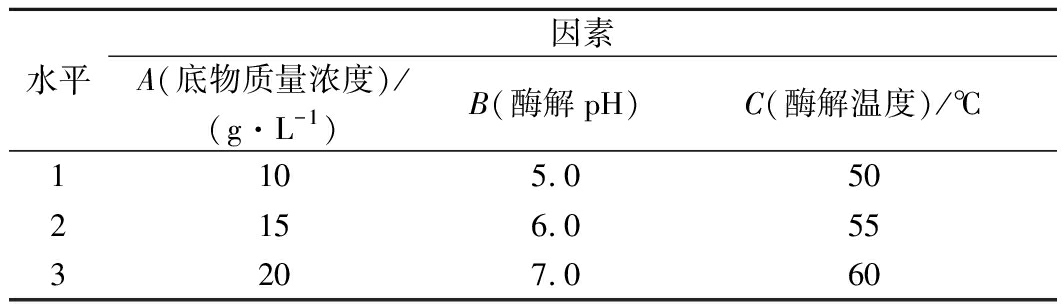
水平因素A(底物质量浓度)/(g·L-1)B(酶解pH)C(酶解温度)/℃1105.0502156.0553207.060
1.4.6 LMWF的制备
在最佳酶解条件下制备LMWF,酶解液沸水浴10 min后终止反应,8 000 r/min离心5 min,获得上清液。然后添加3倍体积的无水乙醇沉淀出HMWF,8 000 r/min离心10 min,弃去沉淀,向上清液中添加1/4体积的Sevage溶液[V(氯仿)∶V(正丁醇)=4∶1],振荡45 min,重复操作直至蛋白质完全去除。将含有LMWF的上清液减压浓缩,使用500 Da透析袋透析24 h以除去其中的盐。使用不同孔径的超滤管进行分级,冷冻干燥后获得不同分子质量的LMWF。
使用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测定各组分的分子质量。色谱柱:UltrahydrogelTM Linear(300 mm×7.8 mm id×2),流动相:0.1 mol/L NaNO3,流速0.9 mL/min,柱温45 ℃,检测器:示差检测器。将不同分子质量的葡聚糖标准品(DextrantT系列)配制为10 mg/mL的溶液,液相测定后以保留时间(Rt)为横坐标,重均分子质量的对数(lgMw)为纵坐标,绘制标准曲线。
1.4.7 LMWF抗氧化活性的研究
将1.4.6中制备得到的不同分子质量的LMWF配制为10 mg/mL的溶液,参考文献[8]和文献[23]的方法测定水解前后岩藻多糖的DPPH自由基、·OH、总氧自由基清除能力,其中F0代表水解前的岩藻多糖。
1.4.8 数据处理
使用Origin软件绘制图表,使用SPSS软件进行数据分析,各实验数据均重复3次,数据以方差进行(ANOVA)分析,不同小写字母表示差异显著(P<0.05)。
2 结果与分析
2.1 产岩藻多糖酶菌株的筛选与鉴定
2.1.1 菌株筛选
以岩藻多糖为唯一碳源,共从酒曲中获得35株真菌。将菌株分别接种于液态和固态发酵培养基中,30 ℃培养5 d,测定岩藻多糖酶活力,结果如表2所示,在固态发酵条件下,35株真菌中只有7株能检测到岩藻多糖酶活力,其中WA1207、GZ1701、FJ07酶活力相对较高,分别为(0.315±0.013)、(0.250±0.33)、(0.187±0.017)U/mL,其中WA1207的酶活力最高。在液态发酵条件下,仅有3株真菌能检测到岩藻多糖酶活力,且酶活力相对较低。综合2种发酵方式下菌株的岩藻多糖酶活力,确定菌株WA1207为目标菌株进行后续研究,发酵方式选用固态发酵。
表2 部分菌株在液态、固态发酵下的酶活力 单位:U/mL
Table 2 Enzyme activity of some strains under liquid and solid state fermentation

发酵方式菌株WA1207GZ1701FJ07FJ1101GZ0104FJ21GZ1502液态发酵0.131±0.0130.098±0.0090.207±0.012----固态发酵0.315±0.0130.250±0.0330.187±0.0170.049±0.0080.039±0.0030.028±0.0070.042±0.005
注:-表示未检出
将菌株WA1207于固态发酵培养基中30 ℃培养5 d,利用其粗酶液在50 ℃下对岩藻多糖酶水解0、12、24、36 h,使用HPGPC法对水解产物进行检测,结果如图1所示。随着水解时间的增加,高分子质量的岩藻多糖逐渐被水解,峰面积变小,并开始出现分子质量较小的岩藻多糖。水解12 h时,主要产物的重均分子质量(Mw)为4 074 Da,随着水解时间继续增加,分子质量较大的岩藻多糖继续被水解,水解24 h时,主要产物的重均分子质量(Mw)为2 529 Da。通常,分散系数(Mw/Mn)用来衡量多聚物分子质量分布的分散程度,当分散系数为1时,表明聚合物是由均一分子质量的聚合物组成的,分散系数越大,表明聚合物的分子质量分布范围越大。
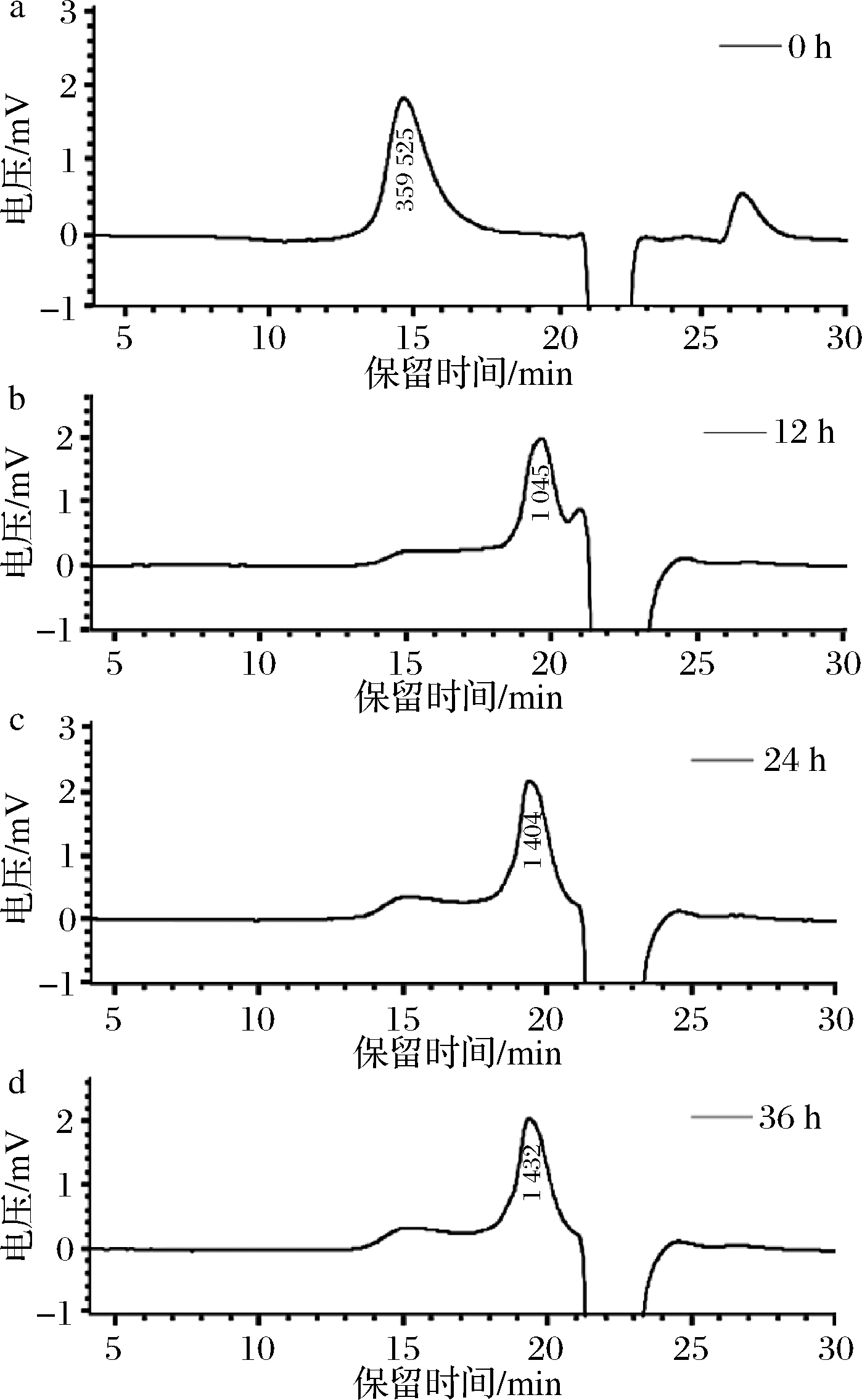
a-0 h;b-12 h;c-24 h;d-36 h
图1 不同水解时间下产物的HPGPC图谱
Fig.1 The HPGPC chromatographs of products in
different hydrolysis times
注:图中标记的分子质量为峰最高点的分子质量
由表3可知,随着水解时间的增加,产物分散系数的值降低,产物的离散程度变小,表明LMWF中分子质量较大的被继续水解。这表明菌株WA1207来源的岩藻多糖酶具有水解高分子质量岩藻多糖、降低岩藻多糖分子质量并产生LMWF的功能。
表3 不同水解时间下产物的分子质量
Table 3 Molecular weights of products in different
hydrolysis times

水解时间/h保留时间/min数均分子质量Mn/Da重均分子质量Mw/Da分散系数(Mw/Mn)面积/%014.674114 285392 005-1001219.6611 1304 0743.1074.912419.4101 0072 5292.578.23619.3939872 2922.377.595
2.1.2 菌株鉴定
如图2-a所示,菌株WA1207于PDA固体培养基上生长3~7 d后,观察到其菌落呈现为不规则圆形,结构疏松,中央为黄褐色凸起,边缘为新生菌落呈白色丝绒状。通过扫描电子显微镜(图2-b,图2-c)可以观察到,菌株WA1207的分生孢子顶部膨大形成顶囊,分生孢子呈辐射状孢子链,菌丝有隔。根据其形态特征,初步鉴定为曲霉属(Aspergillus sp.)。

a-菌落形态;b-孢子形态;c-菌丝形态
图2 WA1207的菌落及扫描电子显微镜下的
菌丝、孢子形态
Fig.2 The colony morphology of strain WA1207, and the
SEM photograph of its spores and mycelia
通过PCR扩增ITS序列,结果送至上海生工进行测序,测序结果在NCBI数据库中进行BLAST比对,将对比结果通过MEGA7软件构建系统发育树(图3)。综合形态学和分子生物学的鉴定结果,菌株WA1207被鉴定为谢瓦氏曲霉(Aspergillus chevalieri)。
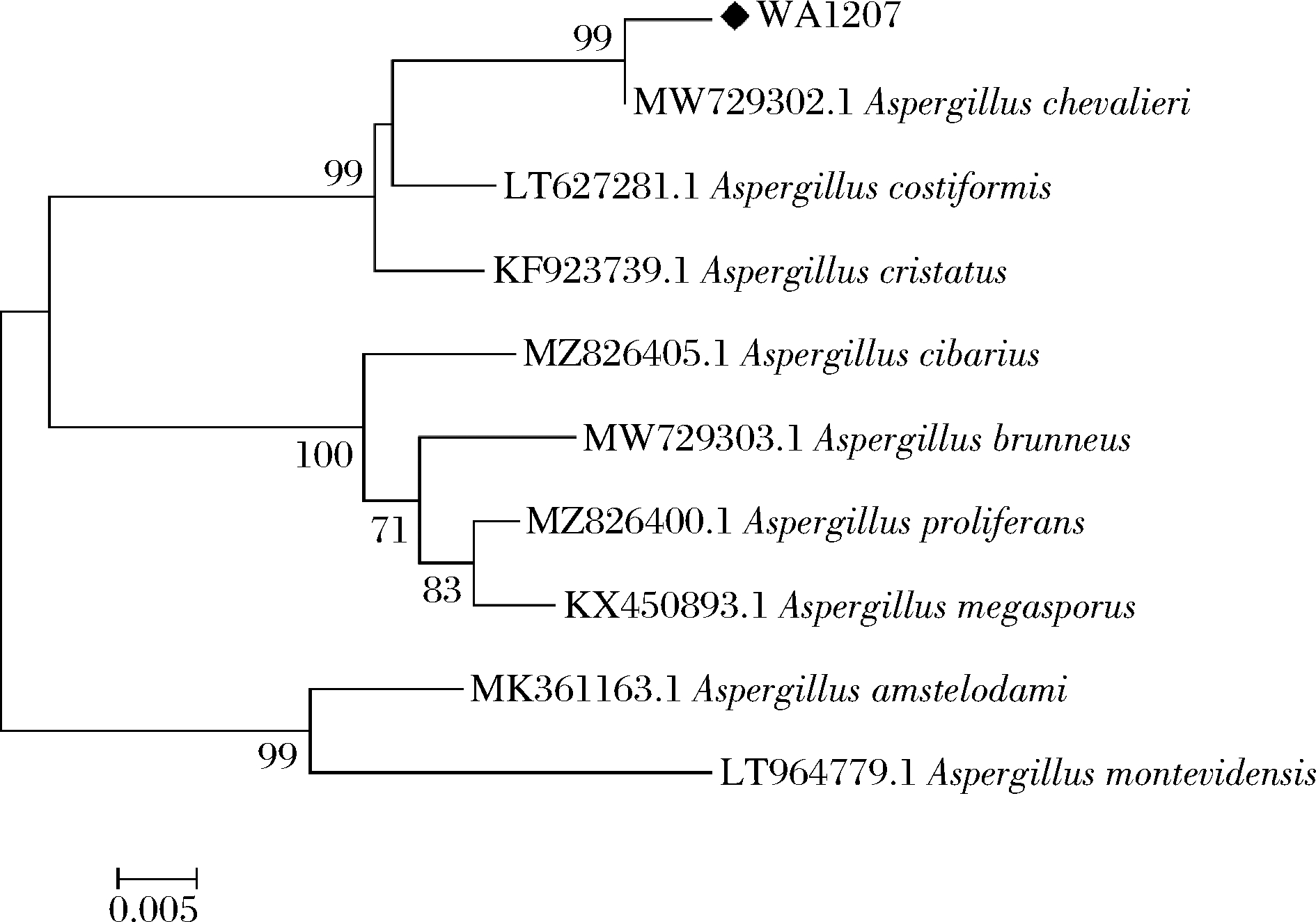
图3 菌株WA1207的系统发育进化树
Fig.3 Phylogenetic tree of strain WA1207
2.2 A.chevalier WA1207来源的岩藻多糖酶制备LMWF的探究
实验前期对菌株A.chevalier WA1207的固态发酵条件进行了优化,发现该菌株在以10 g麸皮为发酵基质、岩藻多糖0.1 g、含水量70%、初始pH 6.0,发酵温度30 ℃,发酵时间5 d的条件下酶活力最高,为0.414 U/mL,较优化前提高了31.43%。在此条件下大量制备粗酶液用于酶解制备LMWF。同时,为了进一步提高LMWF得率,通过单因素和正交实验对酶解条件进行探索,以LMWF得率为指标,探究最佳酶解条件,同时监控SO42-含量的变化,保证降解后组分不会因脱硫而失去活性。
2.2.1 酶解条件对LMWF得率的影响
2.2.1.1 最佳底物质量浓度的确定
如图4-a所示,随着底物质量浓度的升高,LMWF得率逐渐上升,底物质量浓度为15 g/L时,LMWF得率达到最高,为(30.51±2.49)%,而后随着底物质量浓度的继续升高,得率开始下降。因此最佳底物质量浓度为15 g/L。
2.2.1.2 最佳酶解pH的确定
如图4-b所示,随着pH的不断增加,LMWF得率迅速上升,在pH 6.0时的得率最高,为(36.53±0.65)%。表明K2HPO4-柠檬酸缓冲液为该酶的最佳缓冲液,且最佳酶解pH为6.0。
2.2.1.3 最佳酶解温度的确定
在酶水解多糖的实验中,酶解温度影响着酶的稳定性,温度过高会使酶结构发生变化,失去催化活性;温度过低则会影响酶的催化效率。此外,酶解温度对多糖也存在一定的影响,多糖具有高黏性,随着温度的升高,多糖黏度降低,有利于酶水解。如图4-c所示,随着温度的升高,LMWF得率逐渐上升,在55 ℃时达到最高,此时为最佳酶解温度。当温度继续升高至60 ℃时,得率明显降低,说明高温使酶发生变性,逐渐失去催化活性,催化效率降低。因此最佳酶解温度为55 ℃。
2.2.1.4 最佳酶解时间的确定
如图4-d所示,随着酶解时间的延长,LMWF得率逐渐增加。在0~4 h时,岩藻多糖酶活性高,水解速率快,在4 h时得率为(30.33±2.18)%;4~24 h时,水解速率降低,得率缓慢提升,在24 h时达到(52.82±1.97)%。在此基础上继续延长反应时间,LMWF得率没有明显提升,基本保持不变。因此最佳酶解时间为24 h。
SO42-是影响岩藻多糖活性的重要基团[23],由图4可知,未水解岩藻多糖中SO42-的含量为(30.06±0.75)%,在酶水解过程中,SO42-含量基本保持不变,表明来源于菌株A.chevalieri WA1207的岩藻多糖酶可以温和地水解岩藻多糖,保证了酶水解产物LMWF不会因脱硫而降低或失去活性。
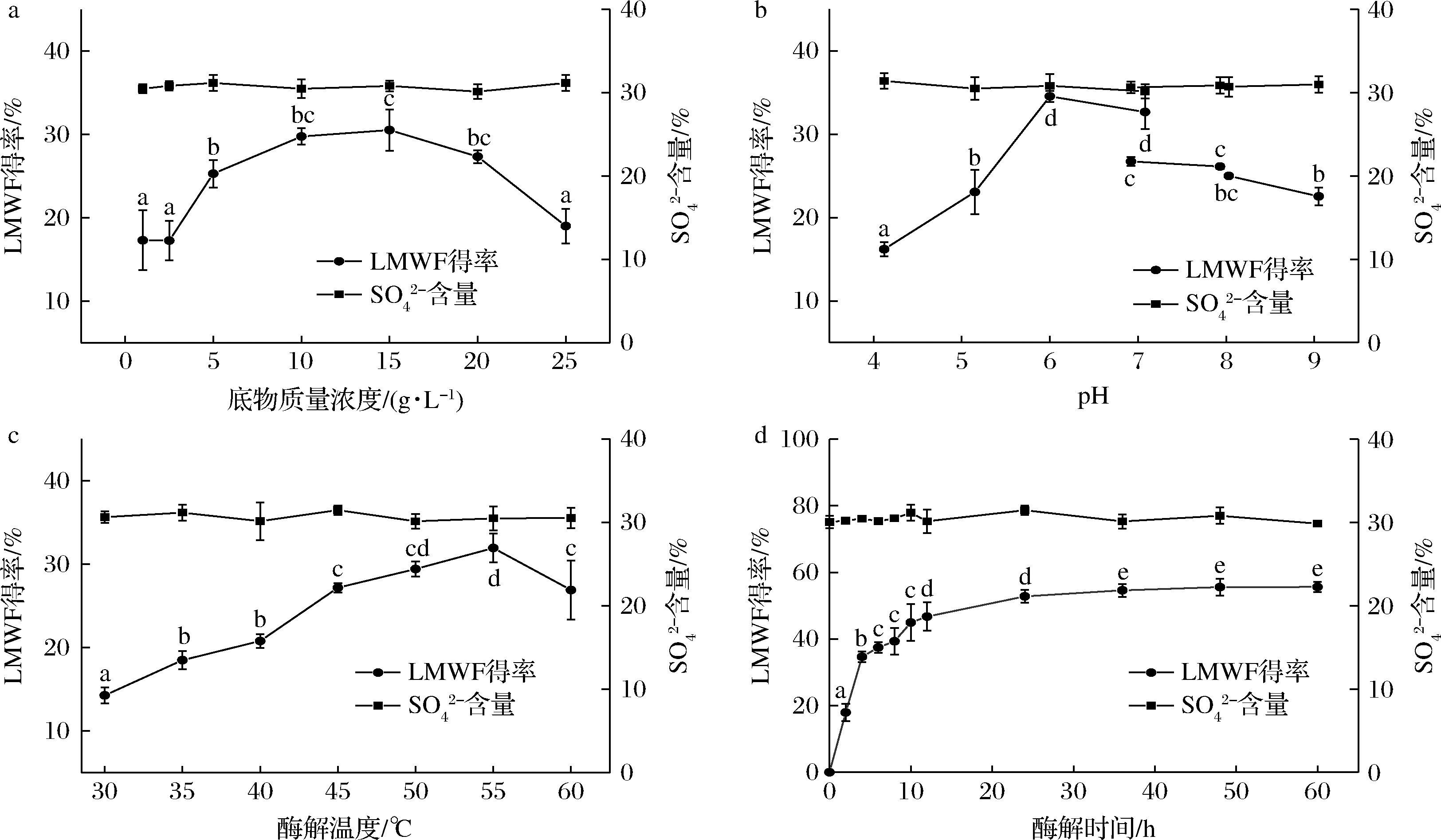
a-底物质量浓度;b-酶解pH;c-酶解温度;d-酶解时间
图4 不同酶解条件下的LMWF得率和SO42-含量变化
Fig.4 The yield of LMWF and sulfate content in different enzymatic hydrolysis conditions
2.2.1.5 正交实验结果
在单因素实验基础上,选取底物质量浓度、酶解pH、酶解温度进行三因素三水平实验,酶解时间为24 h。结果如表4所示,各因素对LMWF得率的影响为酶解温度>底物质量浓度>酶解pH,最佳组合为A2B2C2,即底物质量浓度为15 g/L,酶解pH 6.0,在55 ℃酶解24 h,此条件下LMWF得率为52.82%,高于正交实验中的最高值,为最佳酶解条件。与已知的岩藻多糖酶相比,菌株WA1207来源的岩藻多糖酶在降解岩藻多糖方面具有一定的优势。来自海洋细菌Formosa algae KMM 3553的岩藻多糖酶,于34 ℃下水解岩藻多糖72 h,其LMWF的得率为45%[24];从海洋软体动物的消化腺中分离得到的岩藻多糖酶,在37 ℃酶解岩藻多糖24 h后,再次添加酶液水解24 h,测得其得率为73%[13]。这表明来源于A.chevalieri WA1207的岩藻多糖酶能在相对短的时间下获得相对多的LMWF。
表4 正交实验结果
Table 4 The results of orthogonal test

序号A(底物质量浓度)B(酶解pH)C(酶解温度)LMWF得率/%111148.01212250.2313349.97421249.91522352.21623150.97731351.78832249.1933150.98k149.39350.01351.320k251.03050.40050.717k350.62050.71749.007R1.6370.7042.313
注:k值为各因素水平下LMWF的平均值,R为极差
2.2.2 LMWF的分级纯化
通过蛋白去除、透析除盐和超滤分级共获得了3种不同分子质量的LMWF,冷冻干燥后采用HPGPC法进行分子质量测定,结果如图5和表5所示。

图5 不同LMWF的HPGPC图谱
Fig.5 The HPGPC chromatographs of different LMWF
注:图中标记的分子质量为峰最高点的分子质量
组分F1的重均分子质量(Mw)为1 250 Da且分散系数为1.4,表明该聚合物中LMWF的分子质量分布范围窄,链长差距较小;F2的重均分子质量为2 505 Da,其分散系数为2.3,说明其分子质量分布范围较宽;F3的分散系数大,表明该聚合物中LMWF的链长差距大,分子质量分布范围大。
表5 HPGPC测定产物的相对分子质量
Table 5 Determination of relative molecular weight of
products by HPGPC
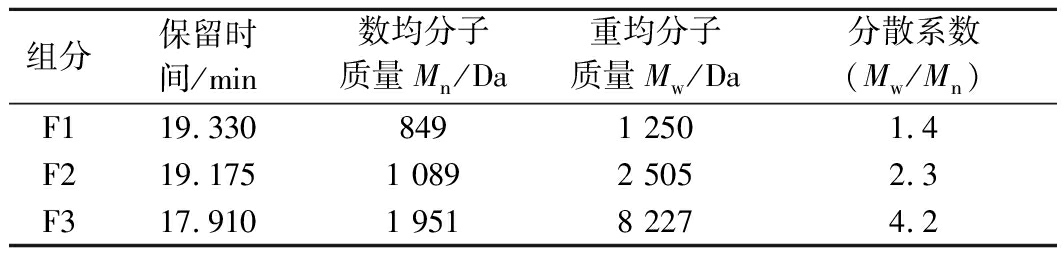
组分保留时间/min数均分子质量Mn/Da重均分子质量Mw/Da分散系数(Mw/Mn)F119.330849 1 2501.4F219.1751 0892 5052.3F317.9101 9518 2274.2
2.3 LMWF的抗氧化活性
如表6所示,岩藻多糖经水解后获得的LMWF的抗氧化活性均有提高。LMWF的·OH清除能力变化明显,且F1>F2>F3>F0,分子质量越小,清除活性越高,这是因为当HMWF被水解成LMWF时,LMWF会暴露出更多的还原和非还原端,且分子质量越小,数量越多,抗氧化活性越强。由此可知,分子质量是影响LMWF 的·OH清除活性的重要因素,清除活性与分子质量大小呈负相关。经酶解生成的LMWF的DPPH自由基清除能力变化小,F1、F2和F3的清除能力基本相同,表明分子质量<10 kDa的LMWF的DPPH自由基清除能力受分子质量的影响较小。在总氧自由基清除能力方面,LMWF的清除能力均远高于F0,抗氧化能力明显提高,其中F2(2 505 Da)的清除能力最高,其次为F3(8 227 Da),最后为F1(1 250 Da)。综上可知,分子质量降低后的LMWF的·OH清除能力和总氧自由基能力均明显提高,表明<10 kDa的LMWF具有良好的抗氧化活性。
表6 岩藻多糖的抗氧化活性
Table 6 Antioxidant activity of fucoidan
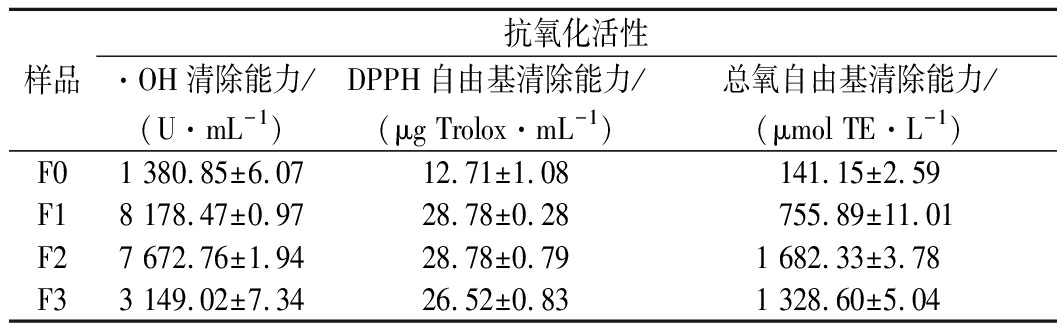
样品抗氧化活性·OH清除能力/(U·mL-1)DPPH自由基清除能力/(μg Trolox·mL-1)总氧自由基清除能力/(μmol TE·L-1)F01 380.85±6.0712.71±1.08141.15±2.59F18 178.47±0.9728.78±0.28755.89±11.01F27 672.76±1.9428.78±0.791 682.33±3.78F33 149.02±7.3426.52±0.831 328.60±5.04
3 结论
从酒曲中筛选得到1株产岩藻多糖酶的菌株,其酶活力为0.414 U/mL,与之前的研究相比,真菌A.chevalieri WA1207的岩藻多糖酶活力具有一定的优势。酶水解实验结果显示,该酶能在不损失硫酸基团的条件下水解岩藻多糖,稳定生成分子质量<10 kDa的LMWF。该菌株的发现表明以酒曲为来源筛选产岩藻多糖酶的菌株是一个可深入探索的新方向,丰富了产岩藻多糖酶菌株的来源,将岩藻多糖酶的来源从海洋微生物扩大到了陆生微生物。抗氧化实验的结果显示,酶水解后得到(<10 kDa)的LMWF抗氧化活性远优于未水解前岩藻多糖(F0),表明利用该酶水解岩藻多糖降低其分子质量是一种十分有效的方法,这为后续利用该酶降解岩藻多糖、解析岩藻多糖结构、探索岩藻多糖结构与功能之间的关系奠定了基础。
[1] SICHERT A, LE GALL S, KLAU L J, et al.Ion-exchange purification and structural characterization of five sulfated fucoidans from brown algae[J].Glycobiology, 2020, 31(4):352-357.
[2] 刘颖, 张敏, 吴茜茜,等.岩藻多糖的研究进展[J].食品与发酵工业, 2011, 37(6):146-151;155.
LIU Y, ZHANG M, WU Q Q, et al.Advances on fucoidan[J].Food and Fermentation Industries, 2011, 37(6):146-151;155.
[3] SAETAN U, NONTASAK P, PALASIN K, et al.Potential health benefits of fucoidan from the brown seaweeds Sargassum plagiophyllum and Sargassum polycystum[J].Journal of Applied Phycology, 2021, 33(5):3 357-3 364.
[4] SANJEEWA K K A, JEON Y J.Fucoidans as scientifically and commercially important algal polysaccharides[J].Marine Drugs, 2021, 19(6):284.
[5] 史大华, 刘玮炜, 刘永江, 等.低分子量海带岩藻多糖的制备及其抗肿瘤活性研究[J].时珍国医国药, 2012, 23(1):53-55.
SHI D H, LIU W W, LIU Y J, et al.The preparation and antitumor effets of low-molecular weight Laminaria fucoidan[J].Lishizhen Medicine and Materia Medica Research, 2012, 23(1):53-55.
[6] HSU W J, LIN M H, KUO T C, et al.Fucoidan from Laminaria japonica exerts antitumor effects on angiogenesis and micrometastasis in triple-negative breast cancer cells[J].International Journal of Biological Macromolecules, 2020, 149:600-608.
[7] BELLAN D L, BISCAIA S M P, ROSSI G R, et al.Green does not always mean go:A sulfated galactan from Codium isthmocladum green seaweed reduces melanoma metastasis through direct regulation of malignancy features[J].Carbohydrate Polymers, 2020, 250:116869.
[8] DE SOUZA M C R, MARQUES C T, DORE C M G, et al.Antioxidant activities of sulfated polysaccharides from brown and red seaweeds[J].Journal of Applied Phycology, 2007, 19(2):153-160.
[9] 孙占一, 申培丽, 王盼.岩藻多糖改善胃肠道功效研究进展[J].食品与发酵科技, 2019, 55(6):91-97.
SUN Z Y, SHEN P L, WANG P.Research progress on improving gastrointestinal effect of fucoidan[J].Food and Fermentation Sciences & Technology, 2019, 55(6):91-97.
[10] 王亚芳, 张海霞, 汪秋宽, 等.几种褐藻多糖硫酸酯粗提物的降血脂作用[J].食品科技, 2015, 40(2):247-253.
WANG Y F, ZHANG H X, WANG Q K, et al.Antihyperlipidemic activity of fucoidan extracted from several alginate[J].Food Science and Technology, 2015, 40(2):247-253.
[11] 耿丽华, 金维华, 王晶,等.海带褐藻多糖硫酸酯的降解与岩藻寡糖的制备[J].高等学校化学学报, 2017, 38(12):2 193-2 197.
GENG L H, JIN W H, WANG J, et al.Fucoidan degradation and preparation of fuco-oligosaccharides from Saccharina japonica[J].Chemical Journal of Chinese Universities, 2017, 38(12):2 193-2 197.
[12] 王琪琳, 曲爱琴, 王海仁.海带硫酸多糖的降解、分离纯化及理化性质分析[J].药物生物技术, 2004, 11(5):316-320.
WANG Q L, QU A Q, WANG H R.Degradation, purification and physicochemical property analysis of Laminaria polysaccharide sulfate[J].Pharmaceutical Biotechnology, 2004, 11(5):316-320.
[13] SILCHENKO A S, KUSAYKIN M I, ZAKHARENKO A M, et al.Endo-1, 4-fucoidanase from Vietnamese marine mollusk Lambis sp.which producing sulphated fucooligosaccharides[J].Journal of Molecular Catalysis B:Enzymatic, 2014, 102:154-160.
[14] WU Q Q, ZHANG M, WU K, et al.Purification and characteristics of fucoidanase obtained from Dendryphiella arenaria TM94[J].Journal of Applied Phycology, 2011, 23(2):197-203.
[15] GOMAA M, HIFNEY A F, FAWZY M A, et al.Biodegradation of Palisada perforata (Rhodophyceae) and Sargassum sp.(Phaeophyceae) biomass by crude enzyme preparations from algicolous fungi[J].Journal of Applied Phycology, 2014, 27(6):2 395-2 404.
[16] RODR GUEZ-JASSO R M, MUSSATTO S I, SEP
GUEZ-JASSO R M, MUSSATTO S I, SEP LVEDA L, et al.Fungal fucoidanase production by solid-state fermentation in a rotating drum bioreactor using algal biomass as substrate[J].Food and Bioproducts Processing, 2013, 91(4):587-594.
LVEDA L, et al.Fungal fucoidanase production by solid-state fermentation in a rotating drum bioreactor using algal biomass as substrate[J].Food and Bioproducts Processing, 2013, 91(4):587-594.
[17] JASSO R M R, GONZALEZ C N A, PASTRANA L, et al.Identification and evaluation of fungal strains with fucoidan degradation potential[C].Proceedings of the 10th International Chemical and Biological Engineering Conference.Braga:2008.
[18] LI Q, JIANG C F, TAN H D, et al.Characterization of recombinant E.coli expressing a novel fucosidase from Bacillus cereus 2-8 belonging to GH95 family[J].Protein Expression and Purification, 2021, 186:105897.
[19] SAKAI T, KAWAI T, KATO I.Isolation and characterization of a fucoidan-degrading marine bacterial strain and its fucoidanase[J].Marine Biotechnology (New York, N.Y.), 2004, 6(4):335-346.
[20] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3):426-428.
[21] SILCHENKO A S, KUSAYKIN M I, KURILENKO V V, et al.Hydrolysis of fucoidan by fucoidanase isolated from the marine bacterium, Formosa algae[J].Marine Drugs, 2013, 11(7):2 413-2 430.
[22] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[23] WANG J, ZHANG Q B, ZHANG Z S, et al.Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica[J].International Journal of Biological Macromolecules, 2008, 42(2):127-132.
[24] SILCHENKO A S, RASIN A B, KUSAYKIN M I, et al.Modification of native fucoidan from Fucus evanescens by recombinant fucoidanase from marine bacteria Formosa algae[J].Carbohydrate Polymers, 2018, 193:189-195.