二十二碳六烯酸(docosahexaenoic acid, DHA)是一种食用安全的ω-3型多不饱和脂肪酸[1],俗称脑黄金,在促进人体视觉器官、大脑发育以及治疗心脏疾病、炎症、癌症、焦虑症[2-3]等方面具有独特的生理功能,尤其对处于生长发育阶段的婴幼儿健康至关重要[4]。人体无法自行合成DHA,只能通过外部摄取。目前,DHA产品主要来源于深海鱼油,但产品质量会随鱼种类、捕捞季节、地点的差异而不同,且易受环境污染。研究表明鱼类体内的DHA是通过食物链蓄积获得,主要来源于海洋微生物[5]。能够合成DHA的海洋微生物主要是一些低等海洋真菌和微藻,如破囊壶菌(Thraustochytrium)、裂殖壶菌(Aurantiochytrium)和隐甲藻(Crypthecodinium)等[6]。微生物发酵法制备DHA,具有生长周期短、易于大规模培养[7]、不饱和脂肪酸成分单一、分离纯化简便等优点,有望替代鱼油成为DHA主要来源。
裂殖壶菌是一种异养型海洋真菌,其脂肪酸组成简单,DHA含量较高,是具有商业开发潜力的DHA主要生产菌株。裂殖壶菌可利用多种碳源生产DHA,葡萄糖因价格低廉,常被用作裂殖壶菌生产DHA的底物。在一些研究中裂殖壶菌利用甘油可以获得更高的DHA产量[8-10];也有研究表明,使用甘油和葡萄糖的混合碳源可以促进DHA的积累[11-12],但甘油和葡萄糖2种碳源的混合策略比较复杂。在前期工作中,作者研究了1株裂殖壶菌突变株SFD-1502利用甘油和葡萄糖生产DHA的发酵行为,发现葡萄糖作为碳源有利于底物消耗;甘油作为碳源有利于DHA的积累。为了将两种碳源优势相结合,缩短发酵时间,提高DHA产量,进一步提高SFD-1502发酵生产DHA的效率,本文详细探讨了葡萄糖和甘油2种碳源单独或混合培养对菌株SFD-1502的DHA油脂合成的影响,并构建一种新型的双碳源发酵控制策略,即前期使用葡萄糖培养以利于菌体生长,中后期发酵液中的葡萄糖浓度为10~5 g/L时补加甘油以利于提高油脂中的DHA比例并减少菌体生长延滞期,实现了DHA的高效生产且具有较高的工业推广价值。
1 材料与方法
1.1 实验材料
1.1.1 菌株
裂殖壶菌(Aurantiochytrium limacinum)SFD-1502,实验室保藏菌株。
1.1.2 培养基
人工海水(g/L):NaCl 11.2,KCl 0.8,MgSO4 1.9,CaSO4 0.9,MgCl2 2.6。
种子培养基(g/L):葡萄糖50,酵母粉20,谷氨酸钠5,用50%(体积分数)人工海水配制。
葡萄糖发酵培养基(g/L):葡萄糖132,酵母粉5.75,玉米浆14.6,谷氨酸钠6.66,(NH4)2SO4 1,用50%(体积分数)人工海水配制。
甘油发酵培养基(g/L):甘油120,酵母粉5.75,玉米浆14.6,谷氨酸钠6.66,(NH4)2SO4 1,用50%(体积分数)人工海水配制。
1.1.3 主要试剂
葡萄糖,山东西王糖业有限公司;酵母粉,安琪酵母股份有限公司;十九烷酸标准品,Sigma-Aldrich公司;消泡剂,山师化工厂;其他试剂来自国药集团。
1.1.4 仪器与设备
Alphaclean1300洁净工作台,力康精密仪器(上海)有限公司;恒温摇床,上海知楚仪器有限公司;SBA-40D生物传感分析仪,山东省科学院生物研究所;U3000液相色谱仪,戴安中国有限公司;7890B气相色谱仪,安捷伦科技有限公司;7200分光光度计,尤尼柯上海仪器有限公司;LGJ-10E冷冻干燥机,北京四环科学仪器厂有限公司;5 L标准全自动发酵罐,汇森生物设备镇江有限公司。
1.2 实验方法
1.2.1 培养条件
种子培养:将保存有菌株SFD-1502的甘油管接种于装有50 mL种子培养基的500 mL三角瓶中,28 ℃、180 r/min恒温振荡培养22 h,按5%(体积分数,下同)接种量再次转接到装有50 mL种子培养基的500 mL三角瓶中,28 ℃、180 r/min恒温振荡培养17 h,用于接种摇瓶发酵。
摇瓶发酵培养:将培养好的液体种子,按5%接种量接种到装有50 mL种子培养基的500 mL三角瓶中,28 ℃、180 r/min恒温振荡培养。
发酵罐培养:接种量7%,28 ℃,通气量0.5 m3/h,罐压0.1 MPa,通过调节转速控制0~12 h相对溶氧浓度为10%~20%,12 h以后相对溶氧浓度为0.5%~5%。
1.2.2 菌体浓度测定
发酵液经适当稀释后在600 nm处测定吸光值。
1.2.3 细胞干重的测定
量取45 mL的发酵液于50 mL离心管中,4 000 r/min离心10 min,用1%(质量分数,下同)NaCl溶液离心洗涤2次,冻干称重。
1.2.4 油脂含量的测定
称取1 g干菌粉置于10 mL离心管中,用5 mL正己烷浸泡,并间接超声波处理5 min,于3 000 r/min离心5 min,小心吸取上清液于干净试管备用,重复抽提3次,将3次所得上清液合并后置于60 ℃烘箱,蒸干溶剂,待恒重后测定油脂含量(质量百分比)。
1.2.5 葡萄糖、甘油含量的测定
将发酵液离心(8 000 r/min,5 min),后取上清液稀释至50~200倍使用配备葡萄糖氧化酶电极的生物传感分析仪测定残余葡萄糖。
发酵液离心后取上清液,稀释至合适浓度,用0.45 μm微孔滤膜过滤后,进行HPLC分析。HPLC条件:高效液相色谱仪,配备示差折光检测器;色谱柱HPX-87H(Bio Rad, USA);流动相0.005 mol/L H2SO4,三级水配制;流速0.6 mL/min;柱温65 ℃;进样量10 μL。
1.2.6 DHA含量的测定[13]
取发酵液5~10 mL,离心收集菌体,用1% NaCl溶液离心洗涤2次,弃去上清液,加入4 mL 4 mol/L盐酸溶液,混匀后沸水浴10 min,冷却至室温后冰浴10 min,加入正己烷10 mL,充分振荡1 min,静置分层后,取上层清液1 mL,加入1 mL十九烷酸内标液(称取十九烷酸标准品 0.04 g,于 10 mL容量瓶中,加入适量正己烷溶解,然后稀释至刻度,摇匀备用),和0.2 mL 4 mol/L KOH-甲醇溶液,剧烈振荡1 min,离心分层,取上层有机相用于气相色谱分析。
采用安捷伦7890B气相色谱仪,DB-23(60 mm×0.25 mm×0.25 mm)毛细管柱用于油脂的气相色谱分析。选用高纯N2作为载气,柱流量3.0 mL/min,尾吹流量30 mL/min,气化室温度250 ℃;检测器为火焰离子化检测器,温度280 ℃,H2流速40 mL/min,空气流速400 mL/min;柱箱初始温度100 ℃,之后以25 ℃/min升至200 ℃,再以4 ℃/min升至230 ℃,保持9 min;进样量为1 μL,分流比为30∶1。
采用内标法进行定量,脂肪酸含量按公式(1)计算:
脂肪酸含量![]()
(1)
式中:Ai,脂肪酸甲酯峰面积;As,内标峰面积;fis,脂肪酸甲酯i相对于内标的相对校正因子;Mi,脂肪酸i的相对分子质量;Mm,脂肪酸i甲酯的相对分子质量;m,待测试样质量;ms,内标的质量。
2 结果与分析
2.1 葡萄糖和甘油单一碳源培养菌株SFD-1502
分别以120 g/L葡萄糖和120 g/L甘油为碳源,采用摇瓶发酵进行菌株SFD-1502培养,不同培养时间取样测定碳源消耗、细胞干重、细胞油脂含量以及油脂中DHA所占比例,绘制菌株SFD-1502的发酵进程曲线,如图1所示。

a-底物质量浓度;b-细胞干重;c-油脂含量;d-油脂中DHA含量
图1 两种碳源单独发酵生产DHA进程
Fig.1 Fermentation process of SFD-1502 by glucose and glycerol
单一碳源发酵结果显示,以葡萄糖为碳源菌株SFD-1502底物消耗速度更快,培养84 h葡萄糖被全部消耗;以甘油为碳源培养菌株SFD-1502底物消耗速度慢,培养84 h甘油仍有约1/3残留,培养至120 h,仍残留4.76 g/L。以葡萄糖为碳源细胞生长速度也快,96 h达到最大值47 g/L,以甘油为碳源时108 h才达到最大值47.75 g/L,但2种碳源最终菌体干重差距并不显著。以葡萄糖、甘油单一碳源培养,培养过程中细胞中油脂含量都是持续增加的,以葡萄糖为碳源油脂含量增长较快,以甘油作为碳源油脂积累滞后于葡萄糖,但总产量与葡萄糖相当。最令人关注的是以甘油为碳源油脂中的DHA含量显著高于葡萄糖,油脂中DHA比例最高达47.49%,而以葡萄糖为碳源最高只有37.46%。
2.2 双碳源混合发酵
通过上述结果发现以葡萄糖为碳源有利于菌体生长,发酵周期短,但油脂中DHA含量低,而以甘油为碳源油脂中DHA的含量高,但发酵周期长。为充分发挥2种碳源各自优势,考察2种碳源预混合培养对菌株SFD-1502发酵产DHA的影响。将2种碳源按照不同的比例混合配制培养基,摇瓶发酵培养72 h取样分析,结果如图2所示。实验设计72 h取样是为了获得2种底物的消耗情况,避免因培养时间过长底物被完全消耗造成的误差。
采用葡萄糖、甘油双碳源混合发酵,总碳源消耗量比葡萄糖单一碳源发酵显著降低,甚至比甘油单一碳源还要低,同时菌体生长也受到一定程度的抑制。以葡萄糖单碳源发酵72 h葡萄糖消耗为93.7 g/L,菌体干重达到39.92 g/L,而双碳源混合发酵总碳源消耗大约只有单独使用葡萄糖的1/2。同时,采用双碳源混合发酵时甘油被优先利用,葡萄糖的利用速率明显降低。与甘油单一碳源发酵相比,葡萄糖同样也影响了甘油的消耗速率(P<0.05)。在油脂合成方面,双碳源发酵细胞中油脂含量明显低于葡萄糖单一碳源,但油脂中的DHA比例似乎未受到影响,并随着混合碳源中甘油比例的增加而增加。上述结果表明,使用葡萄糖和甘油的双碳源混合发酵,会严重影响裂殖壶菌细胞生长和油脂合成。

a-碳源消耗量;b-细胞干重;c-油脂含量;d-DHA含量
图2 菌株SFD-1502葡萄糖+甘油混合碳源发酵结果
Fig.2 Fermentation results of SFD-1502 using Glu and Gly mixed carbon source
注:Glu-葡萄糖;Gly-甘油;同一图中不同字母表示有显著性差异(P<0.05)
2.3 双碳源分段控制发酵
2.3.1 双碳源分段发酵甘油添加时机
葡萄糖有利于菌株生产,甘油有利于DHA的积累,但将葡萄糖和甘油简单混合培养则严重阻碍了菌体生长和油脂合成。为了更好地发挥2种碳源的优势,尝试采用双碳源分段发酵策略:前期以葡萄糖为碳源促进菌体生长,然后补加甘油促进DHA的合成。为了掌握甘油添加时机,首先考察了不同的初始葡萄糖浓度消耗进程(图3),20 g/L初始葡萄糖质量浓度大约需要24 h消耗完,40 g/L葡萄糖约需32 h,60 g/L葡萄糖约需44 h。
分别采用20、40、60 g/L质量浓度的葡萄糖进行前期菌体培养,当葡萄糖耗尽时分别补加甘油,使总碳源质量浓度均为120 g/L,发酵结果如表1所示。同样培养120 h,葡萄糖耗尽时补加甘油的发酵液中甘油残留量比甘油单一碳源时还要高,甘油添加量越多残留量越高,这说明葡萄糖促菌体生长非但没有加速甘油消耗,反而减缓了其消耗。
实验又采用40 g/L的初始葡萄糖浓度对甘油添加时机进行了进一步考察。当葡萄糖质量浓度分别降至20、10、5、0 g/L时,补加80 g/L的甘油,发酵结果如图4所示。当剩余葡萄糖质量浓度为20 g/L时补加甘油发酵结果和混合碳源相似,葡萄糖的存在抑制了甘油的消耗,延缓了整个发酵进程。当剩余葡萄糖质量浓度为10、5 g/L时补料,获得了比较理想的效果:甘油消耗速有所提升,发酵120 h所有碳源均消耗完全,油脂中的DHA比例与甘油单一碳源结果接近,最高值达47.19%,因此,采用双碳源发酵策略时,甘油的添加时机对发酵结果至关重要。
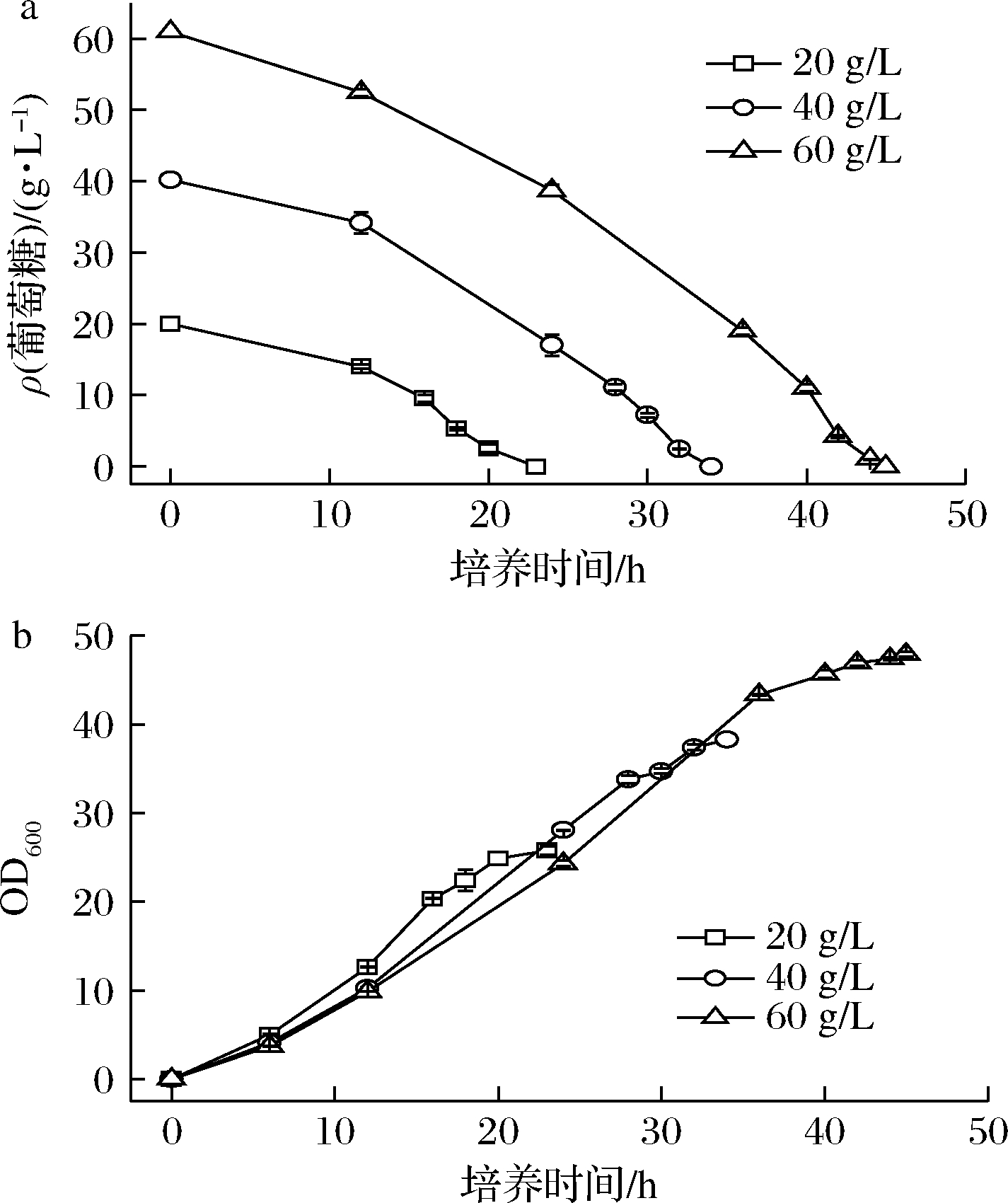
a-葡萄糖消耗;b-OD600
图3 SFD-1502利用不同浓度葡萄糖的发酵进程
Fig.3 Consumption process of SFD-1502 using
different concentrations of glucose
表1 菌株SFD-1502葡萄糖、甘油双碳源分段发酵结果
Table 1 Two carbon source staged fermentation
results of SFD-1502
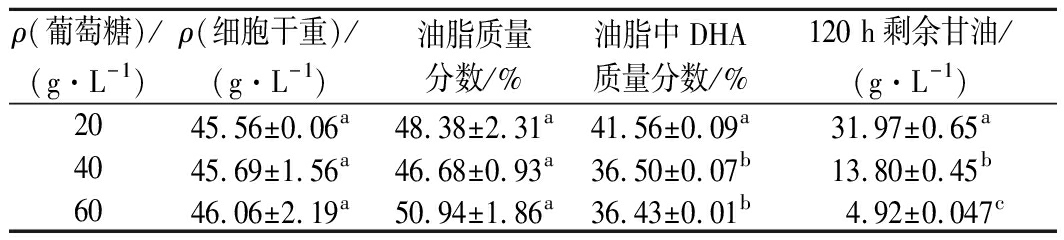
ρ(葡萄糖)/(g·L-1)ρ(细胞干重)/(g·L-1)油脂质量分数/%油脂中DHA质量分数/%120 h剩余甘油/(g·L-1)20 45.56±0.06a48.38±2.31a41.56±0.09a31.97±0.65a40 45.69±1.56a46.68±0.93a36.50±0.07b13.80±0.45b60 46.06±2.19a50.94±1.86a36.43±0.01b4.92±0.047c
注:同一列中不同字母表示有显著性差异(P<0.05)(下同)
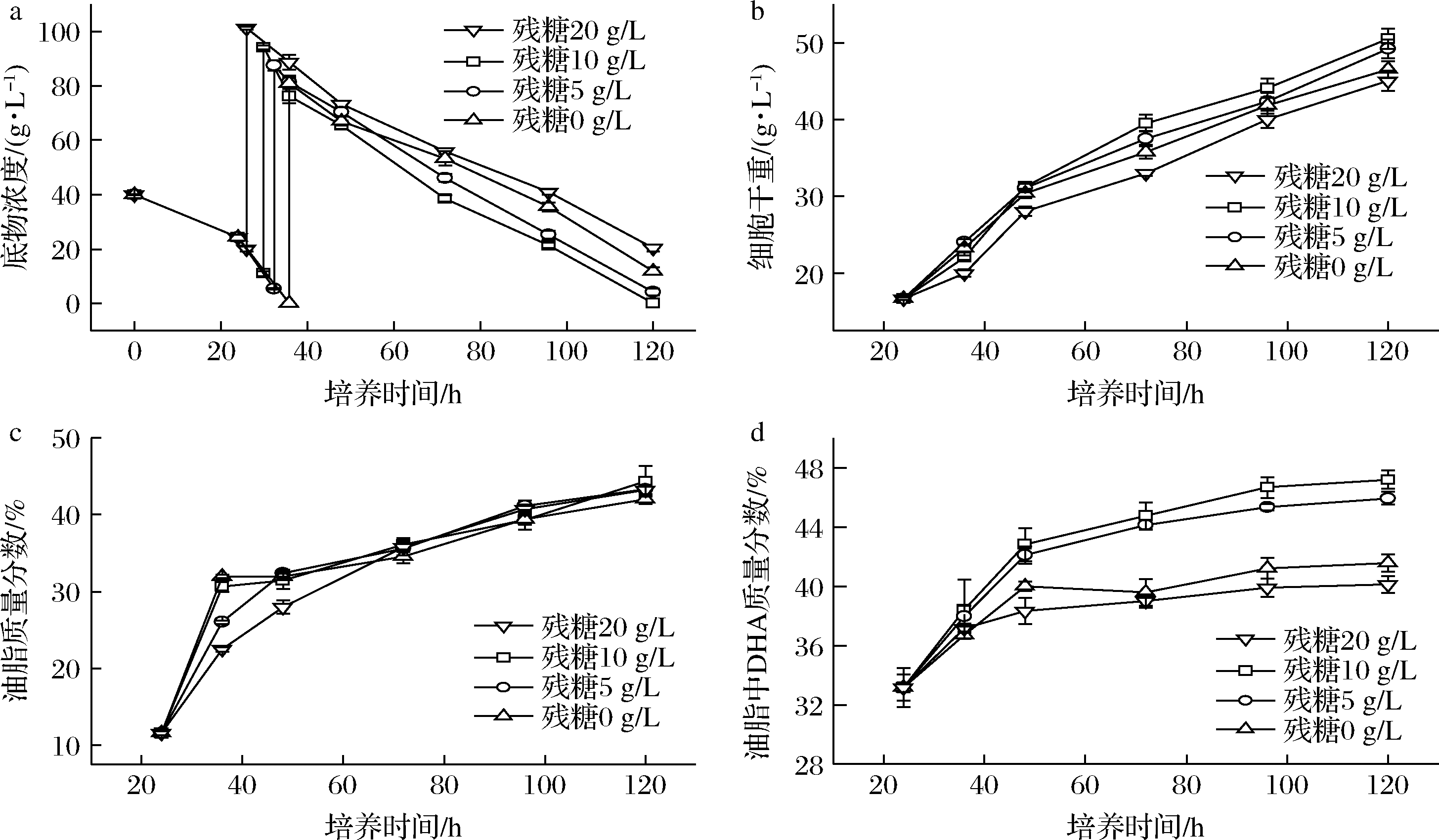
a-底物消耗;b-细胞干重;c-油脂含量;d-DHA含量
图4 甘油补加时机对菌株SFD-1502发酵DHA的影响
Fig.4 Effect of glycerol addition timing on DHA production by strain SFD-1502
2.3.2 双碳源分段发酵初始葡萄糖浓度
分别采用20、40、60 g/L初始葡萄糖质量浓度进行细胞前期培养,当发酵液中葡萄糖质量浓度降至10~5 g/L时分别补加100、80、60 g/L的甘油,发酵结果见表2。
表2 不同初始葡萄糖浓度对菌株SFD-1502双碳源
分段控制发酵的影响
Table 2 Effect of different initial glucose concentrations
on staged and controlled fermentation of strain SFD-1502
with two carbon sources.
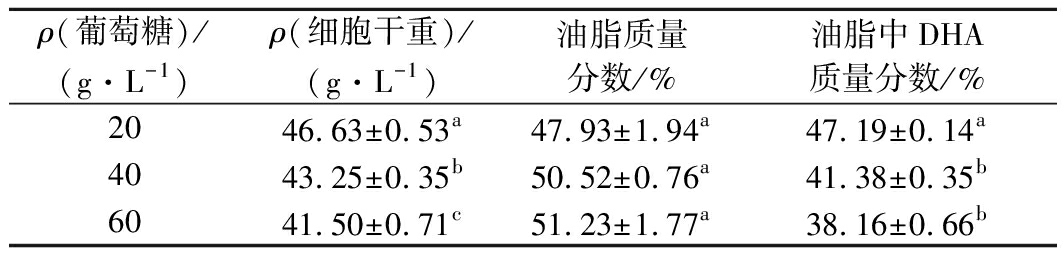
ρ(葡萄糖)/(g·L-1)ρ(细胞干重)/(g·L-1)油脂质量分数/%油脂中DHA质量分数/%2046.63±0.53a47.93±1.94a47.19±0.14a4043.25±0.35b50.52±0.76a41.38±0.35b6041.50±0.71c51.23±1.77a38.16±0.66b
初始葡萄糖质量浓度为20 g/L时,发酵液中的细胞干重以及DHA占总油脂的比例都显著高于40、60 g/L的初始葡萄糖质量浓度,只有细胞油脂含量略低于40、60 g/L的初始葡萄糖质量浓度。同时,初始葡萄糖质量浓度为20 g/L时,补加甘油为100 g/L,培养120 h发酵液中已经检测不到甘油,说明发酵周期也比单独使用甘油短,充分发挥了双碳源各自的优势。
2.3.3 5L发酵罐双碳源分段控制发酵
为了进一步充分显现双碳源分段控制发酵优势,采用5 L发酵罐(装液量3.5 L)对上述控制策略进行了放大实验。葡萄糖、甘油单一碳源发酵结果如图5所示。与摇瓶相比,5 L发酵罐发酵发酵周期明显缩短了,细胞干重也略微提高,但细胞油脂含量和油脂中DHA含量都有所下降。
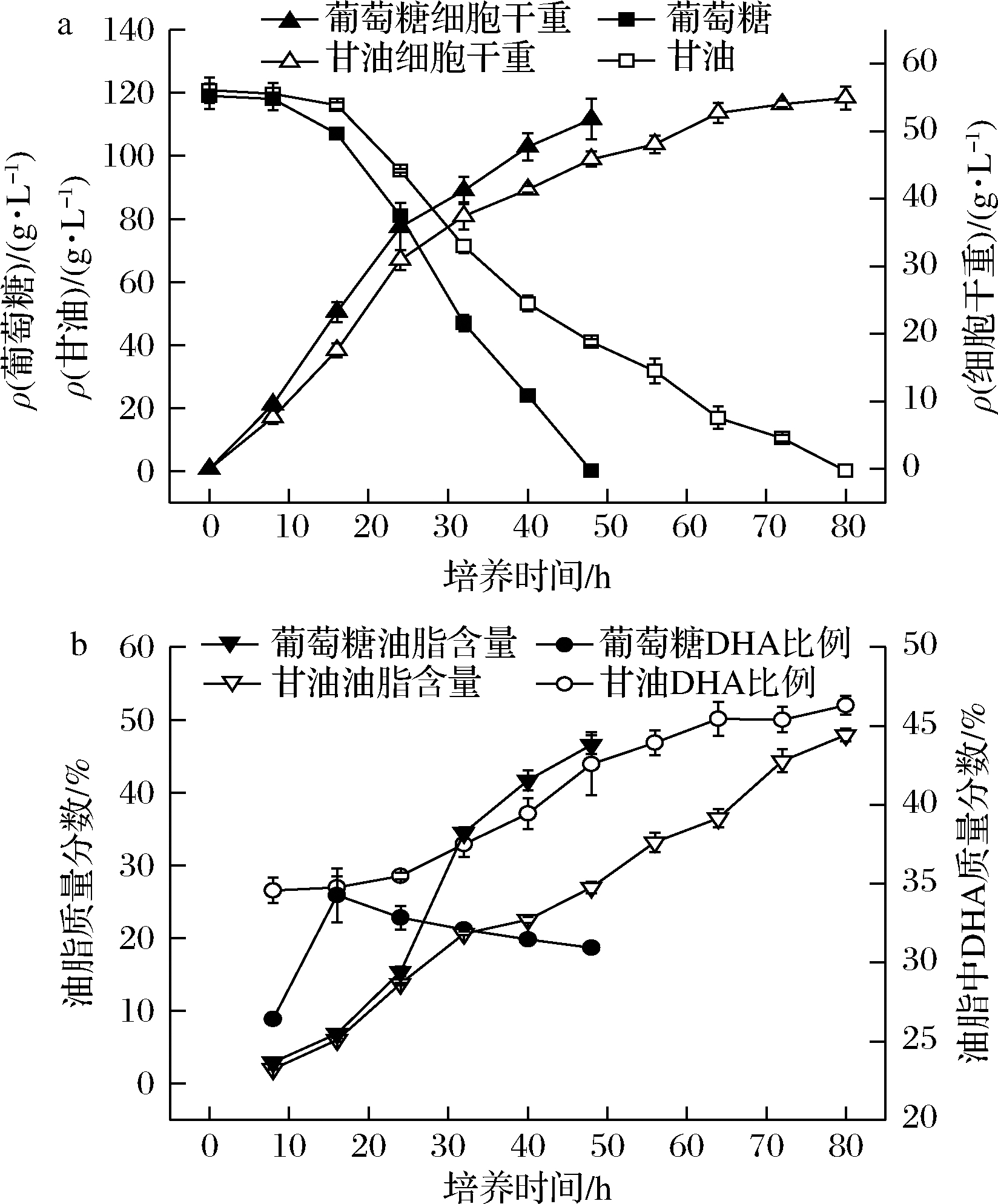
a-底物消耗和细胞干重;b-油脂含量和油脂中DHA含量
图5 菌株SFD-1502 葡萄糖、甘油5 L罐发酵进程
Fig.5 Fermentation process of SFD-1502 in 5 L
bioreactor with glucose and glycerol
葡萄糖、甘油双碳源分段控制发酵结果如图6所示,以20 g/L的葡萄糖为初始碳源,培养约8 h发酵液中葡萄糖质量浓度降至10~5 g/L,然后一次性补加100 g/L甘油,发酵进程几乎没有延滞期,甘油被快速消耗,55~60 h碳源被完全消耗,发酵周期仅为摇瓶培养的1/2,油脂中 DHA比例最高达45.50%,虽然比甘油单一碳源略低,但远远高于葡萄糖发酵。
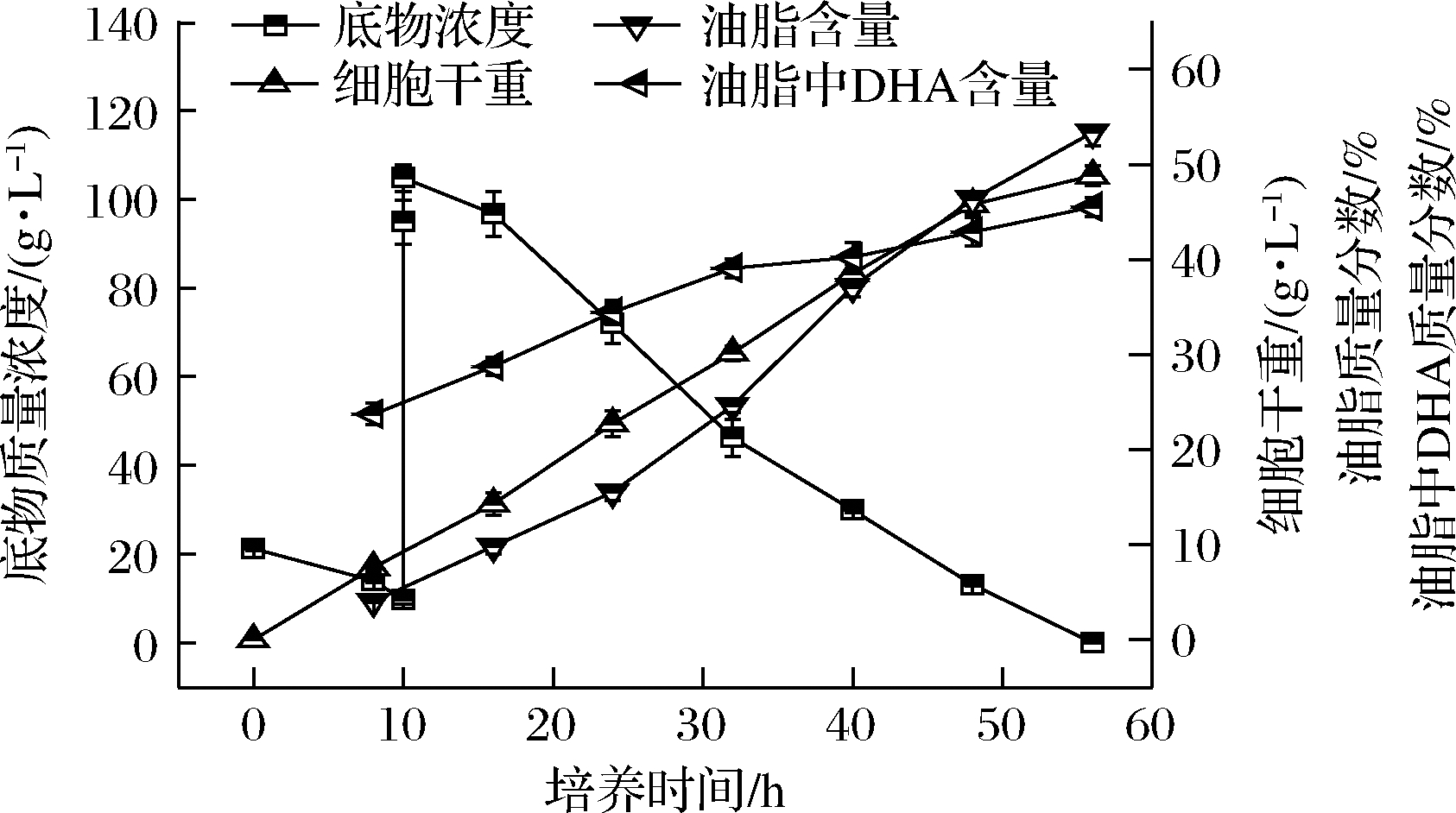
图6 菌株SFD-1502双碳源分段控制5 L罐发酵进程
Fig.6 Fermentation process of SFD-1502 in 5 L bioreactor
with two carbon source added in segments
3 讨论
工业发酵中最常用的碳源是葡萄糖,有时为了获得更好的发酵结果,双碳源、混合碳源也是不错的选择[14]。使用混合碳源发酵时如果工艺控制得当可显著提高发酵效率,超出单一碳源发酵水平[15]。工艺控制策略因菌种、发酵产品和混合碳源而异。如白色链霉菌分批培养生产ε-聚赖氨酸(ε-poly-L-lysine,ε-PL),采用葡萄糖-甘油混合碳源与葡萄糖单独发酵相比发酵周期显著缩短[16],相应生物量和ε-PL的产率也有所提高。在木糖醇发酵过程中添加葡萄糖作为辅助碳源可以提高木糖转化率[17]。通常,当2种碳源混合培养时微生物会表现出2种类型的生长行为:2种碳源依次被消耗(二次生长现象)或同时被消耗(共同利用)[18],但2种碳源互相抑制的报道较少。本文研究了裂殖壶菌SFD-1502利用葡萄糖和甘油发酵生产DHA的行为,发现单独使用葡萄糖作为碳源时,底物利用效率高,菌体生长快,但油脂中DHA含量低;单独使用甘油作为碳源时,底物利用效率相对较低,菌体生长慢,但油脂中DHA含量高。为了促进菌体生长和增加细胞油脂中DHA的含量,实验中采用葡萄糖和甘油混合发酵,结果发现葡萄糖和甘油同时存在时,2种碳源的利用速率都明显降低,总碳源消耗速率远低于单一碳源,说明2种碳源存在相互抑制。LI等[12]在研究A. limacinum SR21利用甘油和葡萄糖混合发酵生产DHA时发现当葡萄糖在25和50 g/L的时候补加甘油也会对底物消耗不利,这和我们的结果是一致的。转录组分析表明葡萄糖作为碳源可以激活糖酵解、磷酸戊糖2个代谢途径,而甘油仅能激活甘油激酶途径然后进入糖酵解途径[19],因此葡萄糖消耗速度更快些,更利于菌体的生长,甘油消耗速度慢,菌体生长滞后。但甘油为碳源时可能激活了聚酮合酶途径[8],该途径则有利于DHA的积累。当葡萄糖和甘油同时存在时,裂殖壶菌会优先利用甘油,甘油在甘油激酶的催化下磷酸化为3-磷酸甘油,3-磷酸甘油会竞争性地抑制葡萄糖-6-磷酸异构酶的活性,从而阻止了磷酸丙糖向磷酸己糖的快速循环,使磷酸戊糖途径和糖酵解途径均受到抑制[20-21],影响了葡萄糖的消耗;葡萄糖代谢中间产物1,6-二磷酸果糖也会抑制甘油激酶的活性,当葡萄糖代谢旺盛时胞内1,6-二磷酸果糖浓度增高,甘油激酶的活性受到抑制[22],甘油消耗也会受到影响。以上可能是本文发现的葡萄糖和甘油同时存在时互相抑制的主要原因。葡萄糖和甘油分段发酵结果显示当葡萄糖耗尽后再添加甘油,甘油的消耗速度也比单独使用甘油有所降低,进一步对补加甘油时的葡萄糖浓度进行了考查,发现当葡萄糖质量浓度为5~10 g/L时补加甘油,没有出现碳源消耗抑制现象,可以充分发挥了双碳源各自优势,获得了非常理想的效果。LI等[11]都曾研究过葡萄糖、甘油双碳源对异养微藻发酵生产DHA的影响,他们均设计了多种双碳源添加方案,最后通过发酵筛选出最佳方案都比较复杂。他们都没有对补加甘油时葡萄糖的浓度进行关注和深入探究。本文研究发现控制相对较低的葡萄糖质量浓度补加甘油可以获得比较理想的结果,说明甘油补加时机至关重要,这个现象是我们首先发现并明示的,关于这种现象的生物学机制还需要进一步研究。
4 结论
笔者在前期研究中发现,裂殖壶菌SFD-1502以葡萄糖为碳源发酵生产DHA,油脂中的DHA含量远低于以甘油为碳源发酵时,但甘油为碳源时底物发酵周期长。为了充分发挥2种碳源各自优势,本文详细研究了葡萄糖和甘油双碳源发酵对SFD-1502生产 DHA的影响。首先探讨了葡萄糖和甘油的双碳源按比例混合发酵,发现甘油和葡萄糖同时发酵,2种碳源会相互抑制,生产效率比单一甘油碳源还要低;然后又尝试先用葡萄糖促进菌体生长,当葡萄糖耗尽后再添加甘油,结果发现甘油消耗速度也低于单一甘油碳源。对甘油补加时机进行了研究,发现当发酵液中的葡萄糖质量浓度降为10~5 g/L时补加甘油可以获得最佳效果。在5 L发酵罐中,初始葡萄糖质量浓度设为20 g/L,葡萄糖质量浓度降至10~5 g/L时补加100 g/L的甘油,发酵周期为55~60 h,油脂中 DHA含量45.0%左右。本文的双碳源发酵控制策略简单,效果明显,适合工业化推广应用。
[1] DIAO J J, SONG X Y, GUO T H, et al.Cellular engineering strategies toward sustainable omega-3 long chain polyunsaturated fatty acids production:State of the art and perspectives[J].Biotechnology Advances, 2020, 40:107497.
[2] MARTINS B P, BANDARRA N M, FIGUEIREDO-BRAGA M.The role of marine omega-3 in human neurodevelopment, including Autism spectrum disorders and attention-deficit/hyperactivity disorder:A review [J].Critical Reviews in Food Science and Nutrition, 2020, 60(9):1 431-1 446.
[3] MALLICK R, BASAK S, DUTTAROY A K.Docosahexaenoic acid,22:6n-3:Its roles in the structure and function of the brain [J].International Journal of Developmental Neuroscience, 2019, 79:21-31.
[4] ROGERS L K, VALENTINE C J, KEIM S A.DHA supplementation:Current implications in pregnancy and childhood [J].Pharmacological Research, 2013, 70(1):13-19.
[5] TIBBETTS S M, SCAIFE M A, ARMENTA R E.Apparent digestibility of proximate nutrients, energy and fatty acids in nutritionally-balanced diets with partial or complete replacement of dietary fish oil with microbial oil from a novel Schizochytrium sp.(T18) by juvenile Atlantic salmon (Salmo salar L.)[J].Aquaculture, 2020, 520:735003.
[6] MORABITO C, BOURNAUD C, MAЁS C, et al.The lipid metabolism in thraustochytrids[J].Progress in Lipid Research, 2019, 76:101007.
[7] GUO D S, JI X J, REN L J, et al.Development of a scale-up strategy for fermentative production of docosahexaenoic acid by Schizochytrium sp.[J].Chemical Engineering Science, 2018, 176:600-608.
[8] CHEN X H, HE Y D, YE H K, et al.Different carbon and nitrogen sources regulated docosahexaenoic acid (DHA) production of Thraustochytriidae sp.PKU#SW8 through a fully functional polyunsaturated fatty acid (PUFA) synthase gene (pfaB)[J].Bioresource Technology, 2020, 318:124273.
[9] SAHIN D, TAS E, ALTINDAG U H.Enhancement of docosahexaenoic acid (DHA) production from Schizochytrium sp.S31 using different growth medium conditions[J].AMB Express, 2018, 8(1):7.
[10] LUNG Y T, TAN C H, SHOW P L, et al.Docosahexaenoic acid production from crude glycerol by Schizochytrium limacinum SR21 [J].Clean Technologies and Environmental Policy, 2016, 18(7):2 209-2 216.
[11] YE H K, HE Y D, XIE Y X, et al.Fed-batch fermentation of mixed carbon source significantly enhances the production of docosahexaenoic acid in Thraustochytriidae sp.PKU#Mn16 by differentially regulating fatty acids biosynthetic pathways[J].Bioresource Technology, 2020, 297:122402.
[12] LI J, LIU R J, CHANG G F, et al.A strategy for the highly efficient production of docosahexaenoic acid by Aurantiochytrium limacinum SR21 using glucose and glycerol as the mixed carbon sources[J].Bioresource Technology, 2015, 177:51-57.
[13] 赵祥颖, 赵晨, 张家祥, 等.发酵法生产DHA过程中油脂及DHA质量分数的快速定量测定[J].食品与生物技术学报, 2017, 36(4):405-409.
ZHAO X Y, ZHAO C, ZHANG J X, et al.Fast quantitative analysis of lipids and DHA contents during fermentation process for DHA production[J].Journal of Food Science and Biotechnology, 2017, 36(4):405-409.
[14] AN N, CHEN X, SHENG H K, et al.Rewiring the microbial metabolic network for efficient utilization of mixed carbon sources[J].Journal of Industrial Microbiology and Biotechnology, 2021, 48(9-10):kuab040.
[15] MA Q, SUN Q W, TAN M, et al.Highly efficient production of N-acetyl-glucosamine in Escherichia coli by appropriate catabolic division of labor in the utilization of mixed glycerol/glucose carbon sources[J].Journal of Agricultural and Food Chemistry, 2021, 69(21):5 966-5 975.
[16] ZHANG J H, ZENG X, CHEN X S, et al.Metabolic analyses of the improved ε-poly-L-lysine productivity using a glucose-glycerol mixed carbon source in chemostat cultures [J].Bioprocess and Biosystems Engineering, 2018, 41(8):1 143-1 151.
[17] 赵祥颖, 张立鹤, 韩延雷, 等.葡萄糖对热带假丝酵母菌株SFX-Y9木糖醇发酵的影响[J].食品与发酵工业, 2017, 43(11):107-111.
ZHAO X Y, ZHANG L H, HAN Y L, et al.Effect of glucose on xylitol fermentation by Candida tropicalis SFX-Y9[J].Food and Fermentation Industries, 2017, 43(11):107-111.
[18] WANG X, XIA K, YANG X J, et al.Growth strategy of microbes on mixed carbon sources[J].Nature Communications, 2019, 10:1279.
[19] 常桂芳. 氧对裂壶藻利用甘油产DHA影响机制及其高密度发酵控制策略的研究[D].无锡:江南大学, 2013.
CHANG G F.The influence mechanism of oxygen on DHA production by Schizochytrium sp.with high cell density cultivation on glycerol[D].Wuxi:Jiangnan University, 2013.
[20] PEREZ-GARCIA O, ESCALANTE F M E, DE-BASHAN L E, et al.Heterotrophic cultures of microalgae:Metabolism and potential products[J].Water Research, 2011, 45(1):11-36.
[21] AUBERT S, GOUT E, BLIGNY R, et al.Multiple effects of glycerol on plant cell metabolism.Phosphorus-31 nuclear magnetic resonance studies [J].Journal of Biological Chemistry, 1994, 269(34):21 420-21 427.
[22] 郭雪娜, 诸葛斌, 诸葛健.甘油代谢中甘油激酶的研究进展 [J].微生物学报, 2002, 04:510-513.
GUO X, ZHUGE B, ZHUGE J.Research progress on the glycerol kinase [J].Acta Microbiologica Sinica, 2002, 42(4):510-513.