α-酮戊二酸(α-ketoglutaric acid,α-KG)作为二元羧酸,在生物体碳氮代谢中扮演重要角色,对糖、氨基酸和蛋白质的合成也有重要作用[1-5]。α-KG同时还具有抗衰老的作用,被广泛应用于食品、医药、化妆品等工业[6-7]。传统工业采用化学合成法生产α-KG[8],使用大量化学试剂,严重污染环境。微生物发酵法存在副产物过多,发酵周期长等弊端。全细胞转化法具有催化反应条件温和、转化率高、反应副产物少,产物易分离等优点[9-10],适合α-KG的分离提纯。全细胞转化体系存在残留底物、杂蛋白、有机杂酸和色素等杂质,且α-KG的亲水性强、溶解度大,为后续的分离提纯带来困难。因此,高效率的转化技术和合理的分离提纯方法是生产α-KG的关键。
彭小雨等[11]发现钙盐沉淀法可以从含大量酮酸的发酵液中分离提纯α-KG,王东阳等[12]发现Ca(OH)2作为中和剂会使发酵液中的α-KG钙盐沉淀反应进行的更稳定。也有较多文献报道了离子交换法对有机酸的提取,如李寅等[13]采用离子交换法从发酵液中提取丙酮酸,占宏德等[14]采用离子交换法从发酵液中提取了α-KG。本文使用全细胞催化法生产α-KG[15],应用钙盐沉淀法作为分离提纯α-KG的预处理步骤。α-KG钙盐的酸解过程具有不可逆的特点,但是酸解后的液体依然会含有少量的CaSO4、Ca(OH)2、α-KG钙盐等残留。离子交换法具有提取效率高,设备结构简单等优点[16],并且可以去除酸解液中的钙盐杂质。本文使用离子交换法对钙盐沉淀法处理后的料液进行更进一步的分离提纯,采用动态吸附以及两阶段洗脱对α-KG钙HCl水解液进行纯化,对2种α-KG的分离方法进行结合,以期为α-KG转化液的分离纯化提供了新的思路。
1 材料与方法
1.1 仪器与试剂
仪器:DHG-9023A电热鼓风干燥箱,上海博讯实业有限公司医疗设备厂公司;SX-500灭菌锅,驭锘实业有限公司;有机玻璃型φ2.5 cm×45 cm离子交换层析柱,上海厦美生化科技发展有限公司;YRE-2010Z旋转蒸发仪,巩义市予华仪器有限责任公司;Avanti J-26S XP落地式高速冷冻离心机,上海纳锘实业公司;AL104-IC电子天平,梅特勒-托利多仪器(上海)有限公司生产;1260 InfinityⅡ高效液相色谱,Agilent公司;MOF205中空纤维膜,天津膜天膜科技股份有限公司;ZJSP-11-025型10 kDa纳滤膜,Merck Millipore公司。
试剂:离子交换树脂D380、D301、D113、D201、719、732、717、296R,宁波争光树脂有限公司;α-KG转化液,实验室制备(发酵菌株:CgL0);食品级活性炭,上海安谱实验科技股份有限公司;α-KG标品试剂,上海麦克林生化科技有限公司。
1.2 实验方法
1.2.1 α-KG全细胞转化液预处理
转化液预处理:大型冷冻离心机5 500 r/min离心后收取α-KG上清液,中空纤维膜过滤除固形物,10 kDa纳滤膜除去大部分杂蛋白,再通过活性炭进行脱色,最后用HCl溶液调节母液pH=2.0,作为后续实验的母液。
1.2.2 钙盐沉淀法粗分离α-KG
选取Ca(OH)2做沉淀剂,将母液pH调节至2.0后和过量的沉淀剂放入烧杯搅拌,用质量分数为50%的Ca(OH)2调节溶液pH=8.0,使Ca(OH)2过量,保证α-KG与Ca(OH)2中和反应完全。静置一段时间后抽滤收集α-KG钙盐沉淀,量取滤液体积,收集中和后的钙盐,检测滤液中α-KG的含量。将收集到的α-KG钙沉淀加5 mmol/L H2SO4重悬,再用浓H2SO4调节溶液pH至1.0,抽滤收集酸解液,HPLC仪检测酸解液中α-KG的含量和纯度。
1.2.3 离子交换树脂的预处理
阴离子树脂预处理步骤:第一步,配制饱和NaCl溶液,取其量约等于被处理树脂体积的3倍,将树脂置于其中浸泡24 h,用去离子水漂洗,使排出的水不带有黄色为止。第二步,配制5%(体积分数)HCl溶液,取其量约等于被处理树脂体积的3倍,将树脂置于其中浸泡8 h(或作小容量清洗),用纯水漂洗至中性。第三步,配制质量分数为5%的NaOH溶液,取其量约等于被处理树脂体积的3倍,将树脂置于其中浸泡8 h,用纯水漂洗至中性。
1.2.4 最佳树脂选型
对6种树脂做静态离子交换试验,选择吸附和洗脱效果较好的树脂进行后续实验。用去离子水水洗抽滤得到46 g抽干湿树脂,放入250 mL的三角瓶内并加入一定浓度的α-KG标准品溶液(每组2个平行),室温下静置吸附处理26 h。吸附液取样后用去离子水水洗抽滤,得到吸附后的树脂湿重,取其中的40 g抽干湿树脂加入2倍的洗脱剂洗脱26 h,取样使用比色法检测并根据公式(1)和(2)计算树脂平衡时α-KG的吸附率和洗脱率。
(1)
(2)
式中:A,树脂吸附率,%;E,树脂洗脱率,%;ρ0,原液中α-KG质量浓度,g/L;ρ1,吸附剩余液中α-KG质量浓度,g/L;ρ2,洗柱液中的α-KG质量浓度,g/L;ρ3,洗脱液中的α-KG质量浓度,g/L;V0,原液中α-KG体积,mL;V1,吸附剩余液中α-KG体积,mL;V2,洗柱液中α-KG体积,mL;V3,洗脱液中的α-KG体积,mL。
1.2.5 洗脱剂的选择
配制70 g/L的α-KG标准液记为溶液1,取110 g(D301)抽干湿树脂,加入适量溶液1静置过夜吸附,抽滤吸附液并用去离子水冲洗3个柱体积,取吸附后的抽干湿树脂50 g并分装于5个100 mL的三角瓶(每组2个平行),加入1%、2%、3%、4%、5%HCl或NaOH(质量分数)梯度的溶液各30 mL作为洗脱液静态洗脱24 h。通过不同质量分数洗脱剂的洗脱效率来决定最佳的洗脱剂和洗脱剂的质量分数。
1.2.6 固定床动态吸附与洗脱
离子交换柱采用玻璃层析柱(内径5.2 cm,外径7 cm,高44 cm),树脂装填量为100 mL。将预处理过的发酵液进行上样,待树脂吸附饱和后,用纯水洗去柱中残留的转化液,然后用洗脱液进行洗脱。经过3次独立试验后,采取等度洗脱策略,分别收集流出液、洗脱液,测定其中α-KG含量,分析α-KG的吸附效率和洗脱效率,对动态上样和动态洗脱进行优化,找到最优的离子交换工艺参数。
1.2.7 分析检测方法
对实际样品的分离纯化需要准确定量以及对纯度进行分析,本文选择HPLC法作为主要的检测方式[1],将待测样品稀释一定倍数,0.45 μm滤膜过滤后进行HPLC检测。流动相:5 mmol/L H2SO4溶液,用0.22 μm孔径的微滤膜抽滤并脱气。HPLC条件:Aminex HPX-87H色谱柱,柱温65 ℃,进样量10 μL,流量0.6 mL/min,检测器紫外检测器,检测波长210 nm。
2 结果与分析
2.1 钙盐沉淀法提纯α-KG
根据彭小雨[11]的研究结果可知CaCO3作为沉淀剂,α-KG的收率和纯度相对较高,但是选择CaCO3作为沉淀剂需要高温水浴除CO2,而CaCl2在中和时会使Cl-富集不利于后续的离子交换。Ca(OH)2作为沉淀剂缩短了中和时间,并且中和时无大量气体逸出、提高了设备利用率[17],本文在进一步试验后选择了Ca(OH)2作为钙盐沉淀法预处理α-KG的沉淀剂,进行工艺开发。由图1-a和图1-b可知,α-KG在中和滤液中的含量明显降低,同时不同杂质HPLC的相对峰面积占比增加,说明大部分杂质并没有参与中和阶段形成钙盐的反应。由此可知α-KG与钙离子的结合具有显著特异性,中和阶段α-KG母液与钙离子结合产生α-KG沉淀的过程有明显的分离提纯效果。
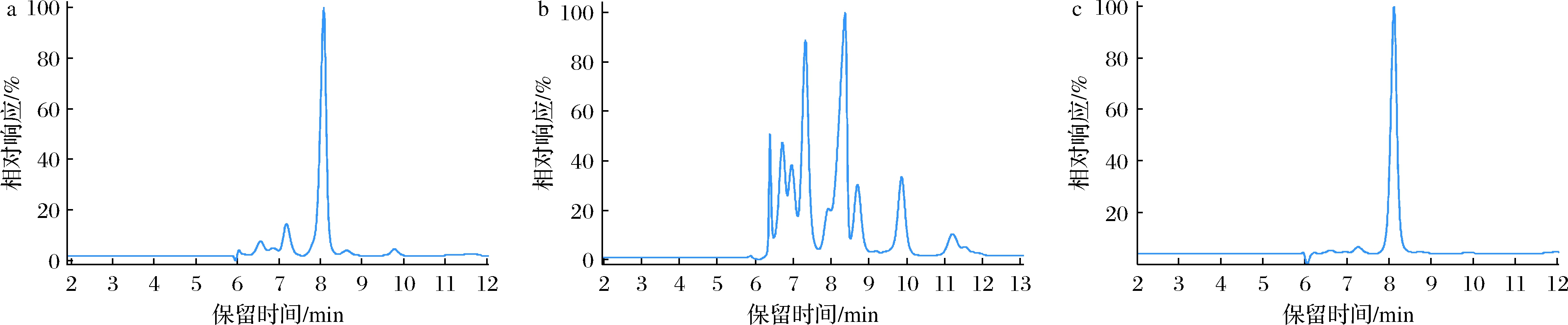
a-α-KG转化液稀释100倍;b-中和阶段滤液稀释10倍:c-酸解液稀释100倍
图1 钙盐沉淀法各阶段HPLC检测峰图
Fig.1 Peak diagram of HPLC detection in each stage of calcium salt method
酸解过程利用了α-KG钙在酸性条件下的解离常数随着H+浓度的增高而增大的特性,在H2SO4存在的溶液中发生反应,生成难溶于水的CaSO4沉淀,钙盐中的α-KG游离出来进入酸解液中。此反应属于不可逆反应,因此H2SO4和α-KG钙可以完全分解为α-KG和CaSO4。图1-a和图1-c表征了酸解后α-KG转化液纯度的提高,钙盐沉淀阶段的α-KG收率为85.87%,α-KG的纯度从78.79%提升至93.66%。但钙盐沉淀法在去除大量杂质的同时,酸解液中也引入了未反应完全的Ca(OH)2以及微溶于水中的CaSO4等钙盐杂质,本文选择通过离子交换法进一步除杂。
2.2 离子交换树脂筛选实验
采用静态吸附和洗脱实验对D380、D301、D201、719、296R、717等6种阴离子交换树脂内进行选型。6种树脂对α-KG的吸附率和洗脱率结果如表1所示。
表1 树脂的吸附和洗脱效果
Table 1 Effects of adsorption and elution of resin
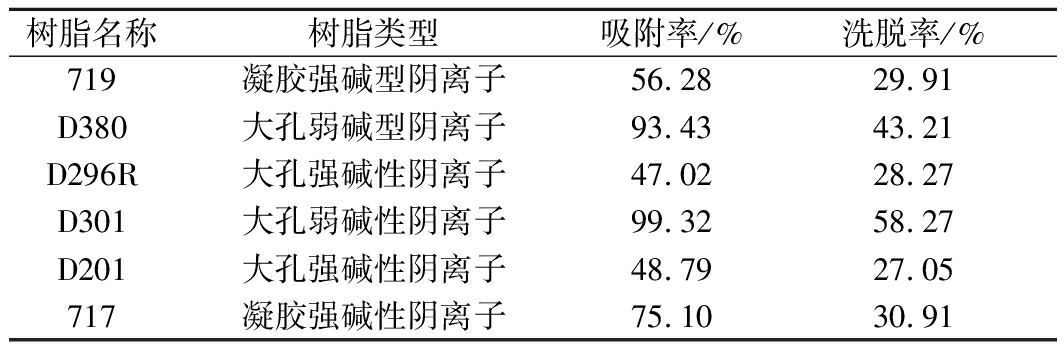
树脂名称树脂类型吸附率/%洗脱率/%719凝胶强碱型阴离子56.2829.91D380大孔弱碱型阴离子93.4343.21D296R大孔强碱性阴离子47.0228.27D301大孔弱碱性阴离子99.3258.27D201大孔强碱性阴离子48.7927.05717凝胶强碱性阴离子75.1030.91
弱碱大孔型树脂D301和D380对α-KG均有较强的吸附能力,但D301吸附α-KG的效果更好,也更容易洗脱,选择D301作为后续离子交换工艺开发的填料。
2.3 洗脱剂的筛选试验
通过静态离子交换洗脱试验,比较不同质量分数的NaOH和HCl的洗脱α-KG样品的效果,选取最合适的洗脱剂。洗脱效果如表2和图2所示,可以看到质量分数为5%的NaOH静态洗脱率接近90%,本文选择质量分数为5%的NaOH作为洗脱剂进行后续离子交换实验。当HCl质量分数为1%时洗脱率仅为9.47%,且将洗脱液收集后进行旋蒸,蒸干水分后得到黄色透明胶状的固体杂质,难溶于水和有机溶剂。后续选择质量分数为0.02%的HCl进行实验,收集的样品旋蒸后依然出现该物质。所以本文设计了一个离子交换前置洗脱实验,用质量分数为0.02%的HCl除去部分杂质同时尽量减少α-KG损失。
表2 不同质量分数洗脱剂的洗脱效率检测
Table 2 Elution efficiency tests with different mass
concentrations of eluent
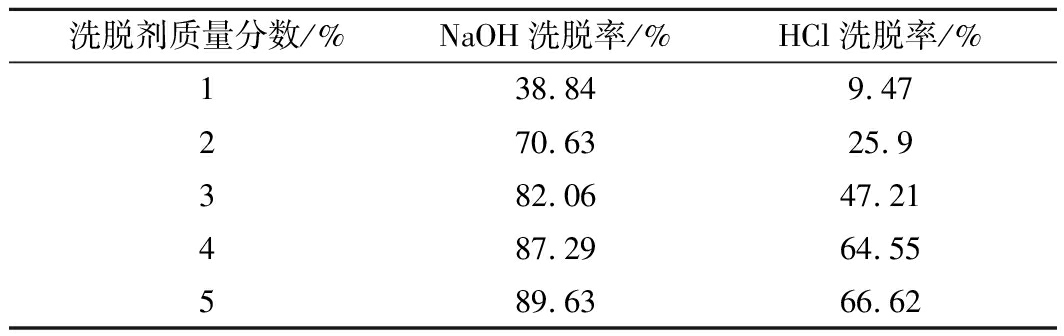
洗脱剂质量分数/%NaOH洗脱率/%HCl洗脱率/%138.849.47270.6325.9382.0647.21487.2964.55589.6366.62
α-HCl洗脱;b-NaOH溶液洗脱
图2 不同洗脱剂的洗脱效果
Fig.2 Elution effects of different eluents
后续再使用质量分数为5%的NaOH充分洗脱目标产物,与此同时树脂经过酸洗和碱洗在分离目标产物的同时也间接进行了再生,固定树脂床经去离子水冲洗3倍柱体积后能再次投入使用。该方法简化了树脂再生流程,提高了生产效率和洗脱液中α-KG的纯度。
2.4 动态上样条件优化实验
2.4.1 不同上样质量浓度对动态吸附的影响
如图3所示,虽然不同质量浓度的上样流出曲线的总体趋势相似,但是在上样质量浓度为10和21 g/L的时候流出曲线拉平明显,而上样质量浓度为43 g/L时穿透点提前,不利于树脂床均匀地吸附。造成这些现象的主要原因可能是因为柱子体积较小,吸附容量有限所致。在实验范围内,选择31 g/L作为α-KG的上样质量浓度进行后续上样优化实验。
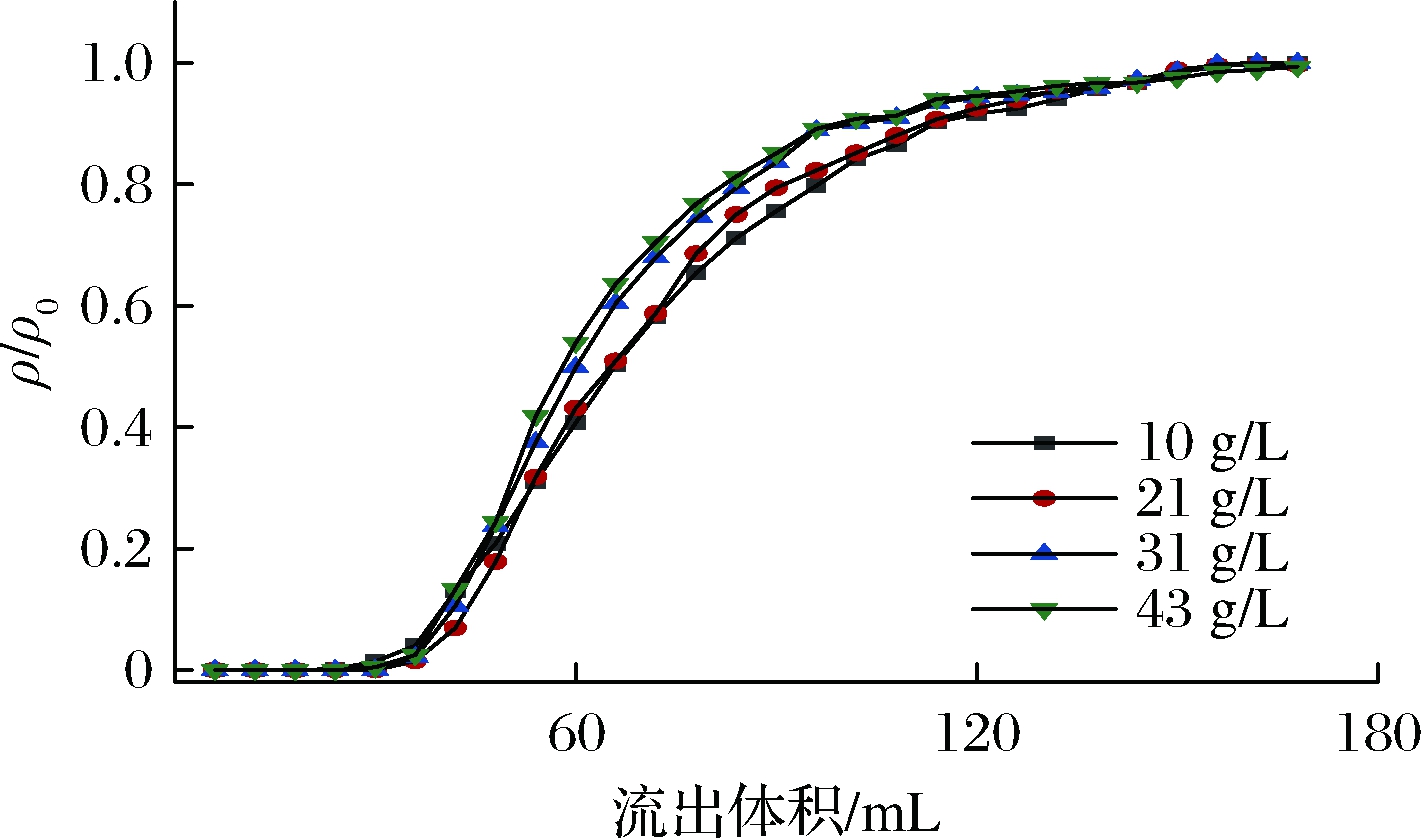
图3 不同上样质量浓度流出曲线
Fig.3 Outflow curves for different loading concentrations
2.4.2 动态吸附上样流速对流出曲线的影响
动态离子交换有一个重要的上样参数,料液流经已知体积的固定树脂床所用的时间,即每小时流经柱子的上样液为床体积(bed volume,BV)的倍数,常用BV/h表示[18]。
高效的离子交换必须使固液两相有充分的接触时间,如果液相流速增加,固液接触时间缩短,树脂与上样液来不及交换,就会导致交换区间拉长发生渗漏现象[19]。由图4可知,在以8 BV/h的流速上样时曲线拉平展开,而以4 BV/h和6 BV/h的流速上样使穿透点提前,这都不利于树脂的有效利用,造成上料的浪费,使生产成本进一步提高。在实验范围内,选择比较低的2.4 BV/h的流速作为上样流速比较合理。
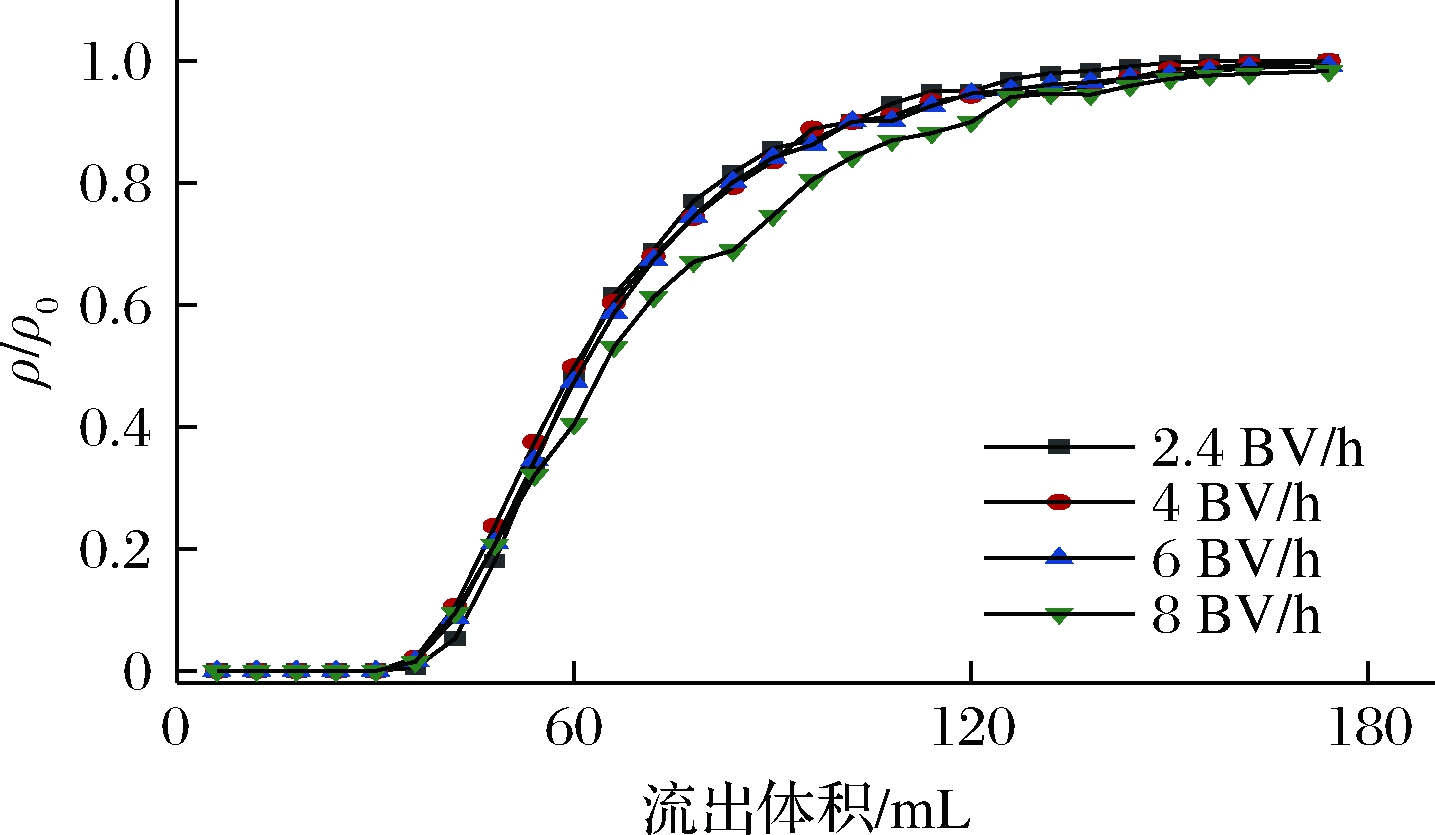
图4 不同上样流速的流出曲线
Fig.4 Outflow curves for different loading flow rates
2.4.3 树脂床装填量高径比对流出曲线的影响
在高径比不同的条件下进行上样,得到流出曲线(图5)。

图5 不同高径比的流出曲线
Fig.5 Outflow curves for different height to diameter ratios
分析流出曲线发现,不同的高径比对流出曲线变化趋势的影响较大。当高径比为10∶1时,流出曲线坡度相对较缓,交换区域相对拉长造成吸附效率降低。高径比为5∶1时,曲线出现拖尾现象,可能是由于随着上样进行树脂吸附容量降低,当交换区间拉的过长时,会导致吸附能力减弱使曲线出现拖尾,还可能是由于树脂装填不严实所致。故在实验范围内选择2.5∶1的高径比,吸附效率提高,有利于研究可以较好地进行。
2.5 动态洗脱实验优化
2.5.1 第一阶段质量分数为0.02%的HCl洗脱
上样后使用质量分数为0.02%等度洗脱2个柱体积,每10 mL取一次样进行HPLC检测,当取到350 mL样品时停止。经过检测,发现收集到的样品中α-KG含量很低不到母液的1%,α-KG的损失几乎可以忽略。此步骤除去了一部分母液中的杂质,使料液纯度进一步提升,有利于后续实验的进行。
2.5.2 第二阶段质量分数为5%的NaOH洗脱
通过第一阶段的洗脱分离提纯,第二阶段本文使用质量分数为5%的NaOH作为洗脱剂洗脱产物。观察不同流速的动态洗脱曲线,判断出最佳的洗脱流速,流出曲线如图6所示。洗脱流速在3.4 BV/h和5 BV/h时虽然出峰时间早,但是洗脱峰较小收率低。高流速的洗脱可能使固液两相接触时间不足导致洗脱效率低,当洗脱流速在2 BV/h的时候洗脱峰较大且集中,收率较高,洗脱曲线拖尾不明显,本文选择2 BV/h的流速为最佳动态洗脱流速条件。
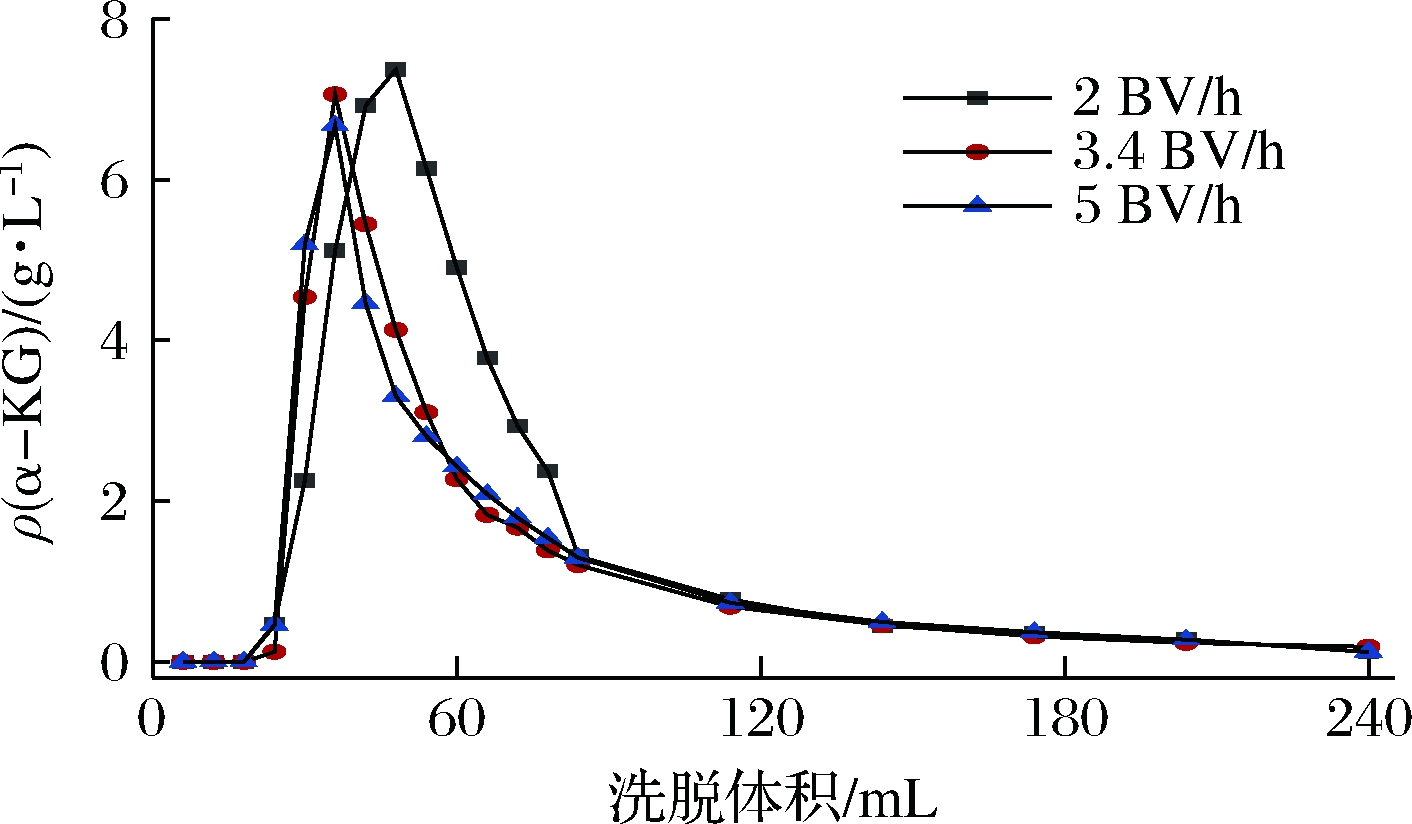
图6 不同流速动态洗脱流出曲线
Fig.6 Dynamic elution outflow curves for different flow rates
由图7可知,以5%(质量分数)的NaOH溶液做洗脱剂,用2 BV/h的流速进行等度洗脱,最终料液的纯度为97.32%。钙盐沉淀法和离子交换法结合的纯化工艺总收率可以达到80.32%。
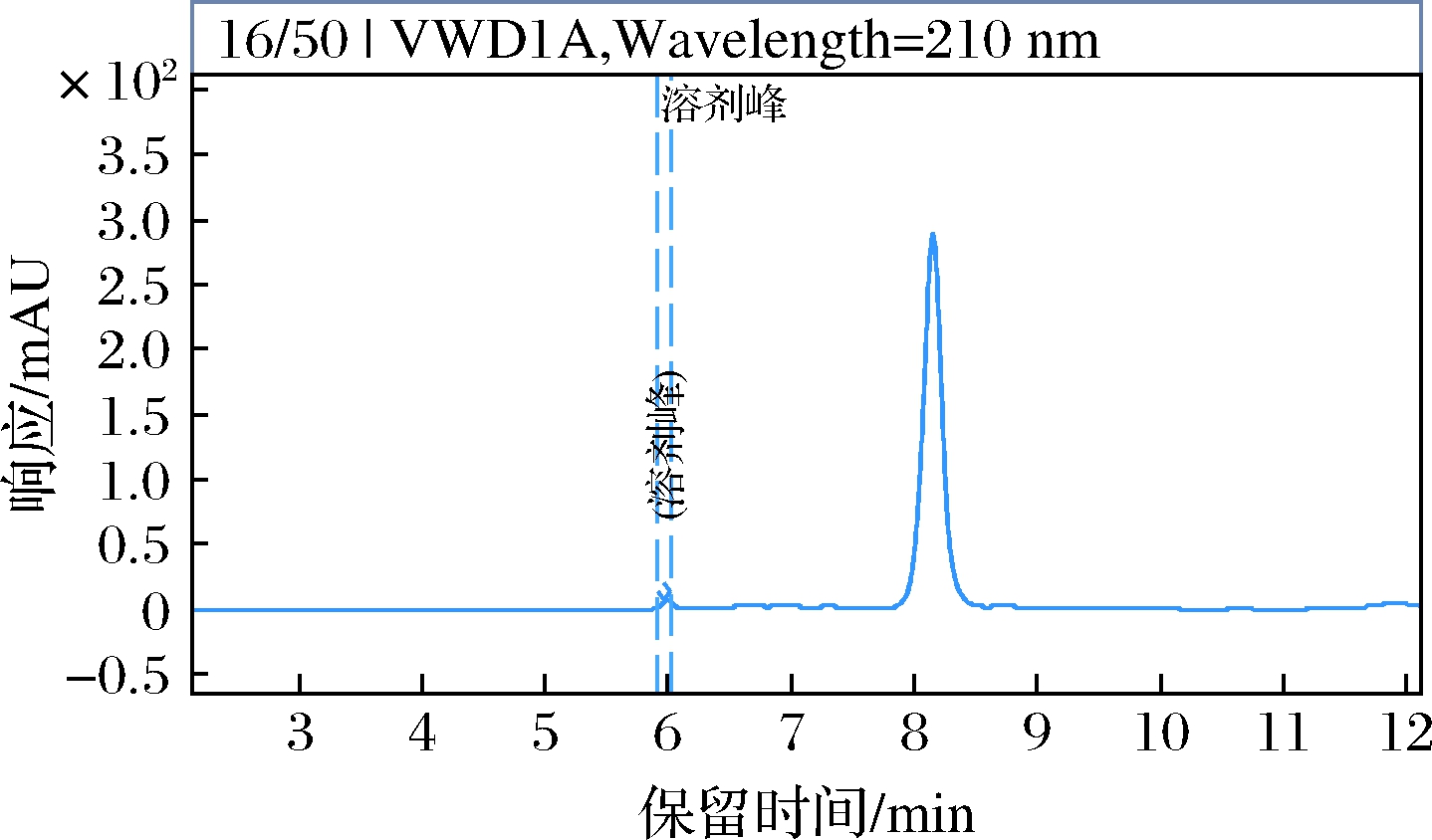
图7 洗脱液HPLC检测图
Fig.7 HPLC detection of the collected sample
3 结论与讨论
目前,单独使用离子交换法或钙盐沉淀法无法得到高纯度的α-KG,若想提升α-KG的品质,需采用一系列物理化学的组合方法进行分离提纯[20]。通过钙盐沉淀法,使转化液中的α-KG和Ca(OH)2进行中和反应,形成α-KG钙沉淀下来。在此过程中去除了中和滤液中的大量杂质,α-KG钙酸解后得到杂离子含量较少的α-KG酸解液。将钙盐沉淀法处理后的α-KG酸解液动态上样到D301树脂柱,去除钙盐沉淀法中引入的钙盐杂质,经过两阶段洗脱得到纯净的α-KG溶液。最终,α-KG的总收率可达80.32%,转化液中α-KG的纯度从78.79%提升至97.32%,为α-KG生物转化液的精细分离提供了可行方法。该工艺对比已报道过的钙盐沉淀法和离子交换法等分离提取方法,可以获得更高纯度的α-KG。使用经钙盐沉淀法去除大量杂质的酸解液进行离子交换,对比用转化液或者发酵液直接进行D301树脂的上样吸附,离子交换过程的洗脱效率得到明显提升,并进一步提高了分离后的α-KG纯度,适合工业化发展的需求。
虽然该工艺对α-KG的纯化效果明显、收率较高,但后续如果想进一步提高纯度以满足工业化的需求,需要设计α-KG阳离子树脂脱盐和重结晶工艺。目前尝试过的阳离子树脂分别为732、D001-X7、D113、D108,其中D113树脂的脱盐能力较好,后续会对该树脂的脱盐工艺进一步优化。经过阳离子树脂脱盐后,再添加有机溶剂进行重结晶,可进一步提升纯度。
[1] DE BANDT J P, COUDRAY-LUCAS C, LIORET N, et al.A randomized controlled trial of the influence of the mode of enteral ornithine α-ketoglutarate administration in burn patients[J].The Journal of Nutrition, 1998, 128(3):563-569.
[2] WU N, YANG M Y, GAUR U, et al.Alpha-ketoglutarate:Physiological functions and applications[J].Biomolecules & Therapeutics, 2016, 24(1):1-8.
[3] HE L, XU Z, YAO K, et al.The physiological basis and nutritional function of alpha-ketoglutarate[J].Current Protein & Peptide Science, 2015, 16(7):576-581.
[4] LIU S J, HE L Q, YAO K.The antioxidative function of alpha-ketoglutarate and its applications[J].BioMed Research International, 2018, 2018:3408467.
[5] PATEL R N.Biocatalytic synthesis of intermediates for the synthesis of chiral drug substances[J].Current Opinion in Biotechnology, 2001, 12(6):587-604.
[6] BAYLIAK M M, LUSHCHAK V I.Pleiotropic effects of alpha-ketoglutarate as a potential anti-ageing agent[J].Ageing Research Reviews, 2021, 66:101237.
[7] FINOGENOVA T V, MORGUNOV I G, KAMZOLOVA S V, et al.Organic acid production by the yeast Yarrowia lipolytica (a review)[J].Prikladnaia Biokhimiia i Mikrobiologiia, 2005, 41(5):478-486.
[8] SONG Y, LI J H, SHIN H D, et al.Biotechnological production of alpha-keto acids:Current status and perspectives[J].Bioresource Technology, 2016, 219:716-724.
[9] 王越, 李江华, 堵国成, 等.L-氨基酸脱氨酶的分子改造及其用于全细胞催化法生产α-酮戊二酸条件的优化[J].中国生物工程杂志, 2019, 39(3):56-64.
WANG Y, LI J H, DU G C, et al.Molecular modification of L-amino acid deaminase and optimization of α-ketoglutaric acid production by whole-cell biocatalysis[J].China Biotechnology, 2019, 39(3):56-64.
[10] LIU L M, XU Q L, LI Y, et al.Enhancement of pyruvate production by osmotic-tolerant mutant of Torulopsis glabrata[J].Biotechnology and Bioengineering, 2007, 97(4):825-832.
[11] 彭小雨, 曾伟主, 周景文, 等.钙盐沉淀法从酮酸发酵液中提取α-酮戊二酸[J].食品与生物技术学报, 2020, 39(3):65-70.
PENG X Y, ZENG W Z, ZHOU J W, et al.Extraction of α-ketoglutaric acid from fermentation broth by calcium precipitation method[J].Journal of Food Science and Biotechnology, 2020, 39(3):65-70.
[12] 王东阳, 蔡传康, 刘朋朋, 等.一种从发酵液中提取α-酮戊二酸的方法:中国, CN105198732A[P].2015-12-30.
WANG D Y, CAI C K, LIU P P, et al.A method for extraction of α-Ketoglutaric acid from fermentation broth:China, CN105198732A[P].2015-12-30.
[13] 李寅, 傅为民, 陈坚.离子交换法从发酵液中提取丙酮酸[J].无锡轻工大学学报, 2001, 20(4):335-339.
LI Y, FU W M, CHEN J.Recovery of pyruvate from fermentation broth by using ion exchange resin chromatography[J].Journal of Wuxi University of Light Industry, 2001, 20(4):335-339.
[14] 占宏德, 李江华, 刘龙, 等.离子交换法纯化α-酮戊二酸[J].食品与生物技术学报, 2013, 32(10):1 043-1 048.
ZHAN H D, LI J H, LIU L, et al.Ion-exchang purificatioon of alpha-ketoglutaric acid in fermentation broth[J].Journal of Food Science and Biotechnology, 2013, 32(10):1 043-1 048.
[15] ZHANG X, XU N, LI J L, et al.Engineering of L-glutamate oxidase as the whole-cell biocatalyst for the improvement of α-ketoglutarate production[J].Enzyme and Microbial Technology, 2020, 136:109530.
[16] 徐辉, 陈小娟, 龙长江, 等.离子交换法制备氨基磺酸镍[J].无机盐工业, 2017, 49(12):46-49.
XU H, CHEN X J, LONG C J, et al.Preparation of nickel aminosulfonate by ion exchange method[J].Inorganic Chemicals Industry, 2017, 49(12):46-49.
[17] 郑建光, 李忠杰, 项曙光.柠檬酸生产工艺技术及进展[J].河北化工, 2006, 29(8):20-24.
ZHENG J G, LI Z J, XIANG S G.Technique development on production process of citric acid[J].Hebei Chemical Engineering and Industry, 2006, 29(8):20-24.
[18] 姜志新. 离子交换动力学及其应用(上)[J].离子交换与吸附, 1989(1):54-73.
JIANG Z S, Ion exchange kinetics and its applications (above)[J].Ion Exchange and Adsorption, 1989(1):54-73.
[19] 刘清华, 张伟国, 钱和.离子交换法从发酵液中提取L-异亮氨酸[J].离子交换与吸附, 2003, 19(5):457-462.
LIU Q H, ZHANG W G, QIAN H.Recovery of l-isoleucine from fermentation broth via ion exchange[J].Ion Exchange and Adsorption, 2003, 19(5):457-462.
[20] 鄢凌, 傅宏鑫, 王旭东, 等.生物基有机酸提取分离技术研究进展[J].过程工程学报, 2018, 18(1):1-10.
YAN L, FU H X, WANG X D, et al.Recent advances on recovery and separation of biomass-based organic acids[J].The Chinese Journal of Process Engineering, 2018, 18(1):1-10.