传统固态白酒是我国古代劳动人民经验智慧的结晶。在独特的地理环境条件下,固态白酒独特的开放式生产,为酿造高品质白酒网罗富集了空气中微生物,多元的酿造工艺塑造了独特的酿造微生物菌群结构并赋予了白酒复杂的香型特征。五粮液作为我国传统固态白酒的典型代表,是国家地理标志产品,入选首批中欧地理标志产品互认清单产品[1],其原产地宜宾市位于岷江、金沙江、长江合流之处,被誉为万里长江第一城,海拔500~2 000 m,独特的中亚热带湿润季风气候(年均降雨量1 100 mm以上,年均气温18 ℃)以及当地独特的黄黏土为高品质五粮液酒的酿造奠定了物质基础[2]。正是因为当地独特的地理环境条件,因而十分有必要系统研究空气中微生物菌群的多样性。
目前空气微生物研究主要采用自然沉降法和机器采样法采集样品,并结合培养基法及非培养基法进行鉴定,解析白酒酿造环境微生物群落结构及其作用。朱治宇等[3]利用传统可培养及18S rRNA序列分析法对酱香型白酒酿造车间的墙面、窗台等环境灰尘样品中霉菌种群结构多样性进行分析,表明Lichtheimia、Mucor、Aspergillus等霉菌属是酱香白酒酿造环境优势菌属。张亚丽[4]采用安德森法结合传统微生物培养法及现代分子生物学方法系统性分析了茅台酒生产环境中空气细菌和真菌的组成结构。车路萍等[5]利用机器采样结合磷脂脂肪酸(phospholipid fatty acid,PLFA)图谱分析法分析了大曲及曲房空气微生物PLFA种类数,指出曲房空气中以革兰氏阴性细菌为优势菌群。陈泽军等[6]采用自然沉降法结合真菌分类学方法分析了浓香型酒厂空气中霉菌组成,指出生产车间内霉菌种类数量高于厂区和厂区外,Oedocephalum为优势属。迄今为止,还未见对五粮液酿造环境空气中可培养霉菌多样性及菌株进行系统的研究。
因此,本研究采用空气浮游菌采集器采集五粮液核心酿造区域内空气微生物,结合可培养法及内源转录间隔区(internally transcribed spacer,ITS)序列分析技术,系统分析了五粮液白酒酿造环境空气中可培养霉菌种群多样性,并初步探索分离菌株的产酶功能,为认识了解环境微生物对五粮液酿造的贡献提供理论支撑。
1 材料与方法
1.1 样品采集
样品地点位于宜宾五粮液股份有限公司主生产基地酿酒车间外围、摊晾场和窖池区域等酿酒环境(28°45′02″~28°52′00″N,104°34′01″~104°39′03″E),采样时间为2020年5~6月。
采用浮游菌采样器收集空气样本,采样器距离地面80 cm,将直径为9 cm的PDA平板置于采样器内,空气流量100 L/min,采样时间1 min;采集结束后,将平板置入无菌塑料封袋中,30 min内运回实验室进行霉菌分离。每个取样地点以半径为2 m的圆上进行3点取样,每个点平行取样3份,共计135份样品。
1.2 样品采集
葡萄糖(分析纯)、蛋白胨、牛肉膏,国药集团化学试剂有限公司;脱脂牛奶,蒙牛集团股份有限公司;脱氧胆酸钠,北京奥博星生物技术有限责任公司;氯霉素,广州赛国生物科技有限公司;Ezup柱式真菌基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;FKC-1型浮游菌采样器,江苏苏净净化设备有限公司;离心机,Eppendorf公司;光学显微镜,日本Olympus公司;生化培养箱,上海一恒科技仪器有限公司;UV-1800紫外可见分光光度计,日本岛津公司。
PDA 分离培养基(g/L):马铃薯浸粉6.0,葡萄糖20.0,琼脂20.0,氯霉素1.0,脱氧胆酸钠2.0,pH 5.6。
产酶活定性培养基[7]:(1)产淀粉酶培养基(g/L):蛋白胨10.0,NaCl 5.0,牛肉膏5.0,可溶性淀粉2.0,琼脂20.0,pH 4.0。(2)产蛋白酶培养基(g/L):脱脂牛奶20.0,琼脂20.0,pH 6.5。(3)产纤维素酶培养基(g/L):羧甲基纤维素钠(CMC-Na) 10.0,KH2PO4 2.0,MgSO4·7H2O 0.5,NaNO3 1.0,刚果红0.1,琼脂20.0。(4)产果胶酶培养基(g/L):K2HPO4 1.0,MgSO4 0.5,NaNO3 3.0,果胶2.0,FeSO4·7H2O 0.01,琼脂20.0,pH 5.5。
发酵培养基[8]:麸皮培养基:麸皮10.0 g,面粉3.0 g,水10.0 mL,混合均匀,121 ℃灭菌20 min。
1.3 菌株分离纯化、保藏及形态描述
将采集样品后的平板倒置于28 ℃恒温培养箱3~4 d,待菌落长出后,根据菌落颜色、形态、大小等表型差异,挑取所有形态、颜色不同的单菌落,在新平板上进行划线纯化、编号并记录菌落形态特征。将纯化后的菌株制作冻干备份,置于-80 ℃超低温冰箱保存。通过观察培养基上的纯培养菌落记录其菌落形态,通过光学显微镜观察显微形态。
1.4 ITS序列PCR扩增及序列测定
采用Ezup柱式真菌基因组DNA抽提试剂盒提取基因组DNA后,采用真菌通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)扩增霉菌的rRNA基因ITS。PCR反应体系参考文献[9],PCR反应条件为:95 ℃预变性3 min后,进入以下循环:94 ℃变性30 s,55 ℃退火25 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。经质量分数2%琼脂糖凝胶电泳检测,将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,序列提交至NCBI GenBank (https://www.ncbi.nlm.nih.gov/genbank/)进行比对分析。
1.5 序列比对及系统发育树的构建
参考文献[10]略有改动,将获得的霉菌rRNA基因ITS序列在GenBank 数据库中进行同源序列分析(BLAST, https://blast.ncbi.nlm.nih.gov/),下载最相似序列。利用MEGA 5.0软件进行多序列比对、p-distances模型计算进化距离、最后采用邻接法(neighbor-joining)构建系统发育树,并用Bootstrap检验进化树分支聚类的置信度,重复1 000次。
1.6 产酶霉菌的筛选
产淀粉酶、蛋白酶、纤维素酶、果胶酶菌株的筛选均参照文献[11-13],略有改动。产淀粉酶菌株的筛选:在含有可溶性淀粉的产淀粉酶培养基中,加入卢氏碘液,以菌落周围出现明显的水解圈,判断其水解淀粉的能力,28 ℃培养96 h;产蛋白酶菌株的筛选:在以脱脂牛奶为底物的产蛋白酶培养基中进行蛋白酶活性检测,以菌落周围是否产生透明圈来表示蛋白酶活性,28 ℃培养96 h;产纤维素酶的筛选:在含有CMC-Na的产纤维素酶培养基中加入刚果红染液,以菌落周围是否产生透明圈来表示纤维素酶活性,28 ℃培养96 h;产果胶酶的筛选:在含有果胶的产果胶酶培养基中加入卢氏碘液,以菌落周围是否产生透明圈来表示果胶酶活性,28 ℃培养96 h。
1.7 酶活力测定
酶液的制备:将筛选得到透明圈较大的霉菌接种于麸皮培养基中,28 ℃培养24 h后扣瓶,继续培养72 h。称取麸曲5.0 g,加入30 mL磷酸缓冲液,40 ℃下保温1 h,经5 000 r/min离心10 min去沉淀,所得粗酶液用于后续酶活力测定。
α-淀粉酶活力和蛋白酶活力[14]、纤维素酶活力[13]、果胶酶活力[11]的测定均参照文献所述方法进行。
2 结果与分析
2.1 可培养霉菌菌株菌落形态和结构
采用传统培养法,挑取平板上大小、颜色以及显微细胞形态等方面有差异的菌落。菌落形态如图1所示,部分菌株编号为1-17、1-57、1-48、1-62、1-47、1-104、1-83、1-79、1-107和1-45 d,颜色种类丰富,包括黄色、绿色、白色、紫黑色、锈橘色、黑色;菌落直径15~70 mm。
显微形态如图2所示,霉菌的分生孢子梗呈有隔或无隔,分生孢子形态有圆形、椭圆形、球形或辐射状等,分生孢子单生或链生;毛霉属无囊托,有球形孢子囊,内含大量的孢子囊孢子;青霉属有分生孢子梗和近圆形的分生孢子,整体呈典型的“帚状枝”形态;曲霉属分生孢子梗长而粗,顶端产生瓶状或近球形球囊,附着生长球形分生孢子;Quambalaria无分生孢子梗,菌丝顶端或其短分枝产椭圆形、卵形分生孢子;Cunninghamella无囊轴和囊托,孢子囊梗的分枝顶端形成球形孢子囊。

a:1-17;b:1-57;c:1-48;d:1-62;e:1-47;f:1-104;g:1-83;h:1-79;i:1-107;j:1-45 d(下同)
图1 部分霉菌单菌落形态
Fig.1 The single colony morphology of some molds

图2 部分霉菌的显微结构
Fig.2 Optical microscope observation of cells of some molds
2.2 基于ITS序列系统发育分析
扩增从3个不同酿酒场地空气中共得到可培养霉菌的ITS rDNA序列并测序,通过NCBI 中的 BLAST 比对工具在GenBank数据库中进行同源性对比,其ITS与GenBank中对应菌株的相似性均在99%以上,构建系统发育树如图3所示。66株可培养霉菌分属3门6纲9目15科18属41种,曲霉属(Aspergillus)13个种、青霉属(Penicillium) 8个种;毛霉属(Mucor)3个种;木霉属(Trichoderma)、交链孢属(Alternaria)、枝孢霉属(Cladosporium)各2个种;黄丝曲霉属(Talaromyces)、镰刀菌属(Fusarium)、Purpureocillium、Pestalotiopsis、帚霉属(Scopulariopsis)、附球霉属(Epicoccum)、Didymella、Peyronellaea、Stagonosporopsis、Botryotinia、Sclerotinia和Quambalaria各1个种。其中曲霉属(Aspergillus)19株和青霉属(Penicillium)15株占菌株总数的51.52%,表明Aspergillus和Penicillium等属霉菌是浓香型白酒酿造核心区域的优势菌属。
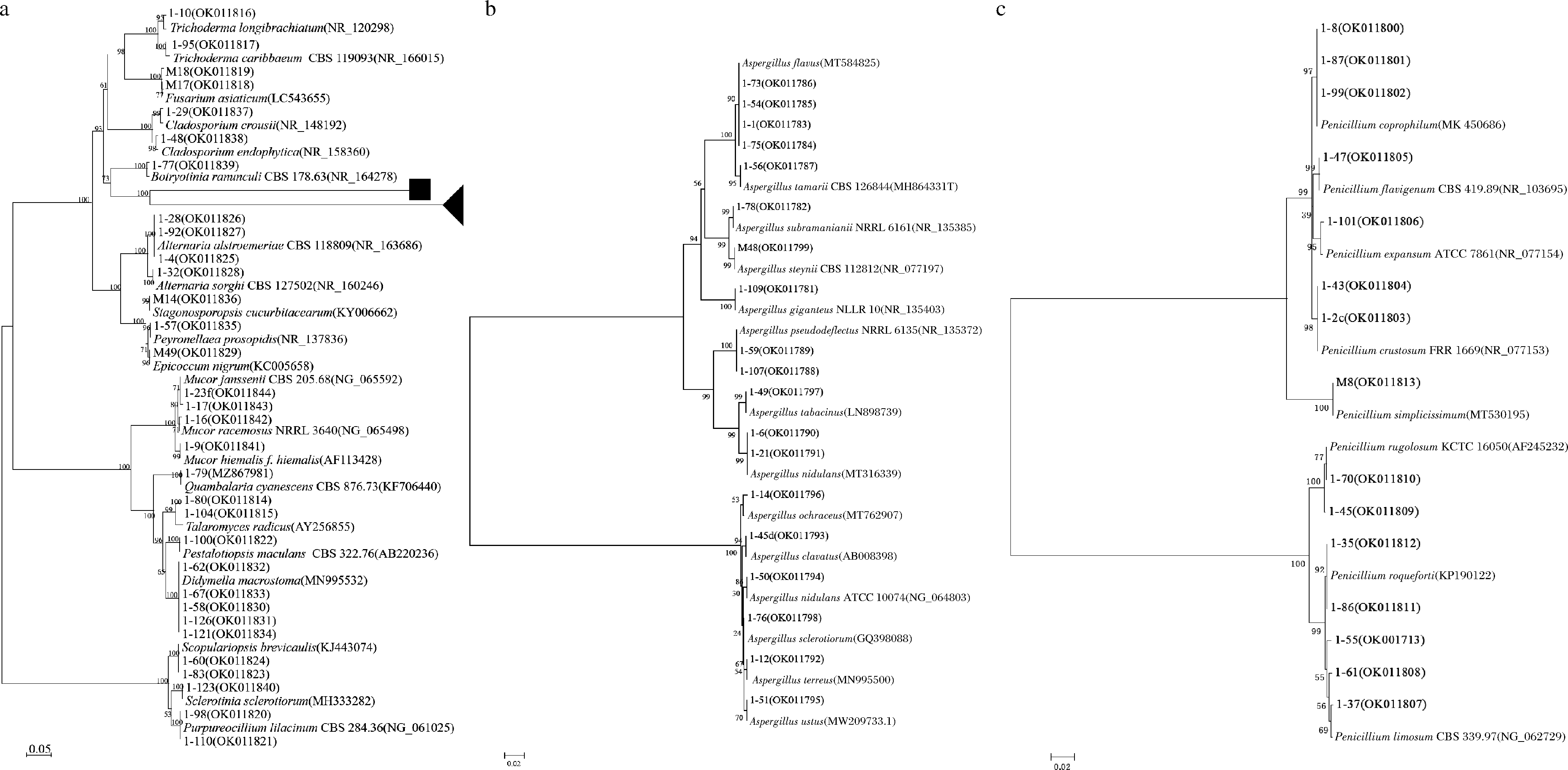
a-所有菌株发育树图;b-a中黑色正方形图标所代表的曲霉属菌株发育树图;c-a中黑色三角形图标所代表的青霉属菌株发育树图
图3 基于ITS rRNA基因序列构建的酿造环境空气中霉菌系统发育树
Fig.3 Phylogenetic tree based on ITS rRNA gene sequences of the molds isolated from the air of
Wuliangye Baijiu-making workshop
2.3 不同位置空气中可培养霉菌分布
根据酿酒车间的工艺操作流程,车间内大致分为带有摊晾床的前处理区域和窖池发酵区域。比较车间外环境,车间内摊晾区域和窖池区域的可培养霉菌多样性分布,各个酿酒场地得到的分布情况结果如图4所示。从3个酿酒场地空气中分离的菌株隶属于18个不同属。其中,车间外围空气中获得可培养霉菌最多,为28株,分属2门5纲7目13科16属;摊晾场共得到26株,分属2门4纲6目8科9属;窖池区域共得到12株,分属3门4纲5目5科6属。
在属水平,对比分析3个不同酿造场地的可培养霉菌相对丰度(图4-a),发现不同场地的菌群差异明显,其中曲霉属(Aspergillus)、青霉属(Penicillium)、交链孢属(Alternaria)在3个采样点中均有检出。在车间外环境、摊晾床区域和窖池发酵区域分离得到菌株总数中,曲霉属菌株数分别占25.00%、26.92%和41.67%,青霉属菌株数分别占21.43%、23.08%和25.00%,交链孢属菌株数分别占3.57%、7.69%和8.33%;毛霉属(Mucor)、帚霉属(Scopulariopsis)是摊晾场和窖池区域共有分布属;Botryotinia、Peyronellaea、Epicoccum、Fusarium等8个属仅在酿造车间外围分离得到;木霉属(Trichoderma)、枝孢霉属(Cladosporium)、黄丝曲霉属(Talaromyces)仅在摊晾场分离得到;Quambalaria属仅在窖池区域分离得到。在种水平(图4-b),A.flavus和A.nidulans在3个采样点中均被分离得到。

a-属水平;b-种水平的韦恩图分布
图4 酿酒场地空气中霉菌的多样性
Fig.4 Diversity of molds in the air of Wuliangye
baijiu-making workshop
2.4 霉菌产酶情况初探
本研究中,66株霉菌产酶特性表明(图5),产α-淀粉酶、中性蛋白酶、果胶酶、纤维素酶分别为21株、19株、18株、26株。Penicillium crustosum、Penicillium expansum、Aspergillus steynii、Aspergillus clavatus能同时产4种酶;Stagonosporopsis cucurbitacearum、Epicoccum nigrum、Aspergillus ochraceus、Aspergillus tabacinus能同时产3种酶。其余菌株产1种或2种酶或不产酶。
进一步对产透明圈强的菌株进行产酶能力的测试,各选取5株、7株、4株、8株进行α-淀粉酶、中性蛋白酶、果胶酶和纤维素酶活力检测。由图6可知,5株霉菌产α-淀粉酶活力为(7.69±0.89)~(13.34±0.89) U/g,以1-49(A. tabacinus)最高;7株霉菌产蛋白酶活力为(1 900.00±213.72)~(5 391.76±63.15) U/g,以1-37(Penicillium limosum)最高;4株霉菌产果胶酶活力为(4.82±0.08)~(10.19±0.30) U/g,以1-123(Sclerotinia sclerotiorum)最高;8株霉菌产纤维素酶活力为(1 928.15±105.01)~(3 194.33±152.91) U/g,以1-123(Sclerotinia sclerotiorum)最高。
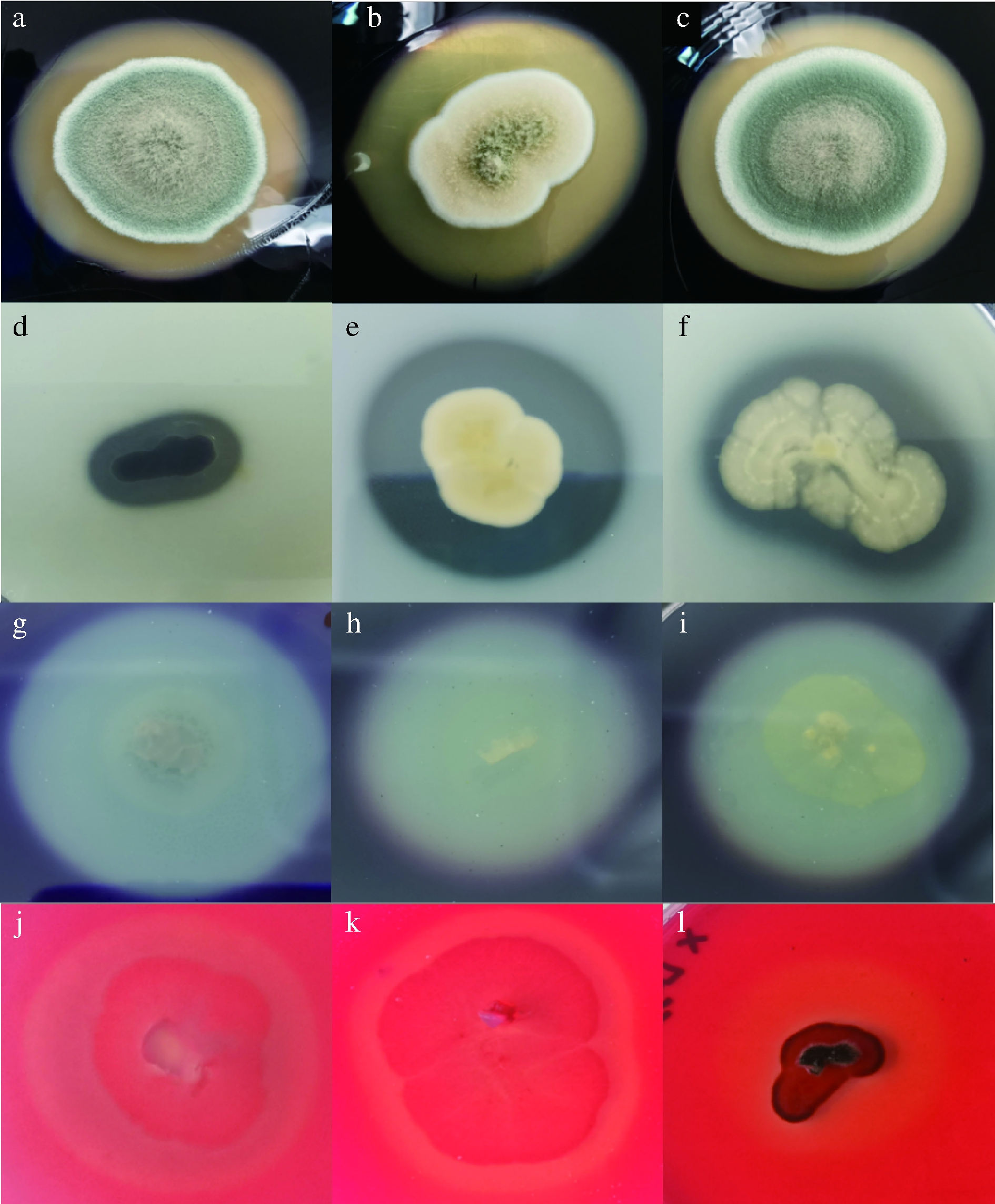
α-淀粉酶活力:a-Aspergillus flavus;b-Aspergillus tabacinus;
c-Penicillium coprophilum;中性蛋白酶活力:d-Botryotinia
ranunculi;e-Aspergillus tabacinus;f-Aspergillus ochraceus;
果胶酶活力:g-Stagonosporopsis cucurbitacearum;h-Aspergillus
sclerotiorum;i-Aspergillus clavatus;纤维素酶活力:j-Scopulariopsis
brevicaulis;k-Alternaria sorghi;l-Botryotinia ranunculi
图5 部分霉菌株产酶情况
Fig.5 Enzymes production of some molds
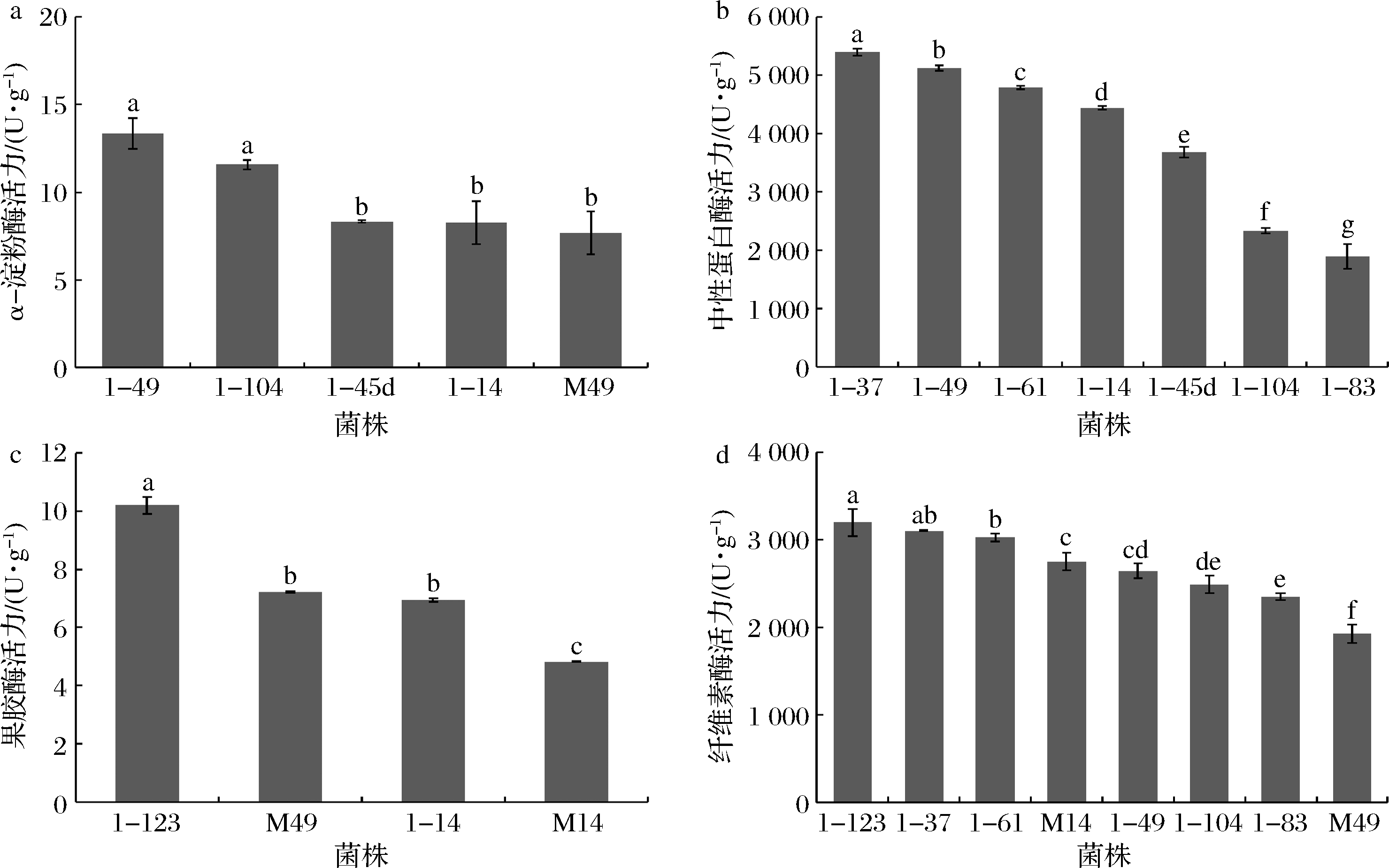
1-49: A. tabacinus;1-104:Talaromyces radicus;1-45d:A. clavatus;1-14:Aspergillus ostianus;M49:Epicoccum nigrum;
1-37:P. limosum;1-61:P. limosum;1-83:Scopulariopsis brevicaulis;1-123:S. sclerotiorum;M14:S. cucurbitacearum
图6 部分霉菌菌株的产4种酶能力
Fig.6 Four enzymes producing ability of some molds
3 结论与讨论
白酒酿造环境涵盖生产工艺操作中酿造原料直接或间接接触的一切环境,包括空气、操作工具、地面粉尘等环境因素。目前浓香型[15]、酱香型[16]、清香型[17]白酒酿造环境中可培养微生物的研究方法,是对每个酿酒场地的空气、工具、粉尘等环境采样进行平板培养筛选分离,然后对不同场地微生物组成进行比较。本研究对优质浓香型白酒酿造环境空气中可培养霉菌进行筛选分离,通过ITS rDNA基因序列分析得出曲霉属(Aspergillus)和青霉属(Penicillus)为优势菌属,也是大曲和糟醅中优势菌属[18-19],在一定程度上反映了不同酿造区域微生物区系的变化。
本研究在浓香型白酒核心酿造区域中检出交链孢属、帚霉属,这2个属主要在酱香型白酒的大曲和酒醅中检出[3]。此外,与过去研究相比[18, 20-21],本研究在五粮液核心酿造区域中筛选获得了Peyronellaea、Quambalaria、Sclerotinia和Stagonosporopsis等4个属,除Quambalaria来源于窖池区域,其余属均来自于酿酒车间外围环境中,极大地丰富了核心酿造区域霉菌的种属多样性。Peyronellaea prosopidi、S. sclerotiorum、S. cucurbitacearum、Quambalaria cyanescens主要分布于植物界中,在大曲、酒醅、窖泥等白酒酿造微生态中未见报道[22],这可能是由于某些霉菌虽然在白酒开放式生产环境中广泛存在,但是进入白酒酿造环节后,由于基质(大曲、糟醅等)的理化因素,如酸度、酒精度、水分等致使这些霉菌无法生存,进而未能检出。
过去研究认为,霉菌主要起糖化作用,为制曲和酒醅发酵提供丰富的酶类,它代谢产生的淀粉酶、蛋白酶、纤维素酶等水解酶系,能将原料中蛋白质、糖类等大分子物质降解为氨基酸、寡糖等小分子营养物质,为其他微生物生长代谢提供能源;另一方面推动着酒体中呈香呈味物质的形成[21]。本研究中P.limosum产中性蛋白酶活力(5 391.76±63.15) U/g,高于刘莹莹等[23]优化毛霉产中性蛋白酶发酵培养基,得到中性蛋白酶活力能达到1 310.56 U/g。与本实验其他菌株相比,S.sclerotiorum产果胶酶活力和纤维素酶活力的能力最高,分别为(10.19±0.30)、(3 194.33±152.91) U/g。KASHYAP等[24]指出Sclerotinia在酸性环境下能代谢产生多聚半乳糖醛酸酶等类型的果胶酶。A.tabacinus产α-淀粉酶活力(13.34±0.89) U/g最高,但相比邓加聪等[25]筛选的黑曲霉发酵产淀粉酶活力(452.23±33.05) U/g性能相对较弱。此外,产α-淀粉酶、蛋白酶、果胶酶、纤维素酶主要集中于青霉属和曲霉属中,均占本属种菌株总数50%以上。在白酒酿造过程中,曲霉属被广泛认为主要产淀粉酶、蛋白酶等酶类,青霉属主要代谢产纤维素酶,这些酶水解产生的糖、多肽或氨基酸可用作酵母菌生长的营养物质和风味化合物形成的前体物质。说明在参与白酒酿造过程中,青霉属和曲霉属对原料利用与降解方面发挥着重要作用,也再次印证青霉属和曲霉属在白酒核心酿造区域中的重要性。
本研究以浓香型白酒核心酿造区域空气中可培养霉菌和其所产酶活性种类为对象,比较不同酿造场地空气中霉菌种群结构差异性,有助于后期系统地开展浓香型白酒酿造微生态及代谢调控研究。同时,通过研究霉菌所产几种与实际生产相关联的功能酶的情况,对酿造微生态中真菌资源的开发利用具有积极的指导作用。
[1] 五粮液入选“中欧地理标志产品清单”[J].酒·饮料技术装备, 2020(1):42.
Wuliangye included in the list of China-Europe geographical indication products[J].Brew & Beverage Technology and Equipment, 2020(1):42.
[2] 曾碧涛, 魏明英, 闫景丽, 等.五粮液产地自然环境研究进展[J].江苏农业科学, 2017, 45(15):21-24.
ZENG B T, WEI M Y, YAN J L, et al.Research progress on natural environment of Wuliangye producing area[J].Jiangsu Agricultural Sciences, 2017, 45 (15):21-24.
[3] 朱治宇, 黄永光.茅台镇酱香白酒不同轮次主酿区可培养霉菌种群结构多样性[J].食品科学, 2020, 41(22):184-192.
ZHU Z Y, HUANG Y G.Structure and diversity of culturable mold communities in different fermentation rounds in main Maotai-flavored liquor-brewing areas of Maotai town[J].Food Science, 2020, 41(22):184-192.
[4] 张亚丽. 贵州省仁怀地区茅台空气微生物的鉴定与分析[D].北京:北京化工大学, 2014.
ZHANG Y L.Analysis of microbial tracking in Maotai town Guizhou Provence[D].Beijing:Beijing University of Chemical Technology, 2014.
[5] 车路萍, 任志强, 郑若欣, 等.基于PLFA分析中温和高温大曲及其曲房空气微生物群落相关性[J].食品工业科技, 2020, 41(5):124-129;135.
CHE L P, REN Z Q, ZHENG R X, et al.Analysis of correlation between microbial communities in medium and high temperature daqu and the workshop air based on PLFA technology[J].Science and Technology of Food Industry, 2020, 41 (5):124-129;135.
[6] 陈泽军, 周瑞平, 田文, 等.多粮浓香型酒厂空气中霉菌多样性研究[J].酿酒科技, 2009, 176(2):60-62.
CHEN Z J, ZHOU R P, TIAN W, et al.Study on aerial mildew diversity in multiple-grains Luzhou-flavor distillery[J].Liquor-Making Science & Technology, 2009, 176 (2):60-62.
[7] 李兵. 浓香型白酒大曲中五种主要酶产生菌的多样性及变化规律研究[D].成都:西华大学, 2020.
LI B.Study on the diversity and variation of five major enzyme-producing bacteria in Luzhou-flavor liquor Daqu[D].Chengdu:Xihua University, 2020.
[8] 杨俊, 李丽, 张文学, 等.黄芪药曲酱油的制备及其质量评价[J].中国调味品, 2014, 39(9):61-64.
YANG J, LI L, ZHANG W X, et al.Preparation and quality evaluation of Astragalus Yaoqu soy sauce[J].China Condiment, 2014, 39(9):61-64.
[9] 雷学俊, 张霞, 刘多涛, 等.包包曲及制曲环境中可培养霉菌的分离与鉴定[J].酿酒科技, 2019(12):17-22.
LEI X J, ZHANG X, LIU D T, et al.Isolation and identification of cultivable mold strains from bulgy Daqu and Daqu-making environment[J].Liquor-Making Science & Technology, 2019(12):17-22.
[10] 张瑞蕊, 薛梅, 李宁宁, 等.天山一号冰川表面冰尘和底部沉积层中可培养酵母菌系统发育类群的分布及生态生理特征[J].微生物学报, 2019, 59(2):334-348.
ZHANG R R, XUE M, LI N N, et al.Phylogeny and diversity of culturable yeasts in supraglacial cryoconite and subglacial sediments of the Glacier No.1 in Tianshan Mountains[J].Acta Microbiologica Sinica, 2019, 59(2):334-348.
[11] 车鑫. 高产酸性果胶酶霉菌的选育[D].杨凌:西北农林科技大学, 2018.
CHE X.Breeding of high-yield acid pectinase strain[D].Yangling:Northwest A & F University, 2018.
[12] 王鹏昊, 关统伟, 邓奥宇, 等.酒曲中高产蛋白酶和α-淀粉酶霉菌菌株的筛选与分子鉴定[J].酿酒科技, 2016(6):61-64;71.
WANG P H, GUAN T W, DENG A Y, et al.Screening and molecular identification of fungal strains with high-yield of protease and α-amylase[J].Liquor-Making Science & Technology, 2016(6):61-64;71.
[13] 吴静. 高产纤维素酶霉菌的筛选及纤维素酶系的分离纯化[D].贵阳:贵州大学.2020.
WU J.Isolation of molds with high-activity of cellulase and the purification of cellulase system[D].Guiyang:Guizhou University, 2020.
[14] 班世栋. 酱香大曲中霉菌类群和酶系研究[D].贵阳:贵州大学.2015.
BAN S D.Study on mould group and enzyme system in Maotai flavor Daqu[D].Guiyang:Guizhou University, 2015.
[15] YANG S, CHOI S J, KWAK J, et al.Aspergillus oryzae strains isolated from traditional Korean Nuruk:Fermentation properties and influence on rice wine quality[J].Food Science and Biotechnology, 2013, 22(2):425-432.
[16] 朱治宇. 茅台镇酱香型白酒酿造区域霉菌多样性特征研究[D].贵阳:贵州大学, 2020.
ZHU Z Y.Study on the characteristics of mold diversity in Maotai town sauce-flavor liquor brewing area[D].Guiyang:Guizhou University, 2020.
[17] 王雪山. 不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D].无锡:江南大学, 2018.
WANG X S.Microbial community structure and microbial source tracking of Chinese light-flavor liquor fermentation in different environments[D].Wuxi:Jiangnan University, 2018.
[18] LI X R, MA E B, YAN L Z, et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].International Journal of Food Microbiology, 2011, 146(1):31-37.
[19] YANG J G, DOU X, HAN P J, et al.Microbial diversity in daqu during production of Luzhou flavored liquor[J].Journal of the American Society of Brewing Chemists, 2017, 75(2):136-144.
[20] ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor baijiu ecosystem:A review[J].Frontiers in Microbiology, 2018, 9:671.
[21] 王柏文, 吴群, 徐岩, 等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报, 2021, 48(5):1 737-1 746.
WANG B W, WU Q, XU Y, et al.Recent advances and perspectives in study of microbiome in Chinese Jiuqu starter[J].Microbiology China, 2021, 48(5):1 737-1 746.
[22] DING X F, WU C D, HUANG J, et al.Interphase microbial community characteristics in the fermentation cellar of Chinese Luzhou-flavor liquor determined by PLFA and DGGE profiles[J].Food Research International, 2015, 72:16-24.
[23] 刘莹莹, 刘颖, 张光, 等.毛霉高产中性蛋白酶发酵培养基的优化[J].食品工业科技, 2014, 35(6):166-170.
LIU Y Y, LIU Y, ZHANG G, et al.Optimum fermentation medium of high-yielding neutral protease of Mucor[J].Science and Technology of Food Industry, 2014, 35(6):166-170.
[24] KASHYAP D R, VOHRA P K, CHOPRA S, et al.Applications of pectinases in the commercial sector:A review[J].Bioresource Technology, 2001, 77(3):215-227.
[25] 邓加聪, 郭伟灵, 周文斌, 等.不同类型丝状真菌发酵产酶性能比较及其混菌发酵性能研究[J].中国食品学报, 2020, 20(1):101-108.
DENG J C, GUO W L, ZHOU W B, et al.Comparison of enzymes production of different types of filamentous fungi and studies on the fermentation characteristics of mixed cultures based on glutinous rice[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(1):101-108.