白酒酿造的过程实质上是酿酒微生物的生长和代谢过程[1],其微生物来源丰富,酒曲、酒醅、窖泥等所携带的微生物均可能参与独特风味基酒的生产。而白酒发酵过程中微生物主要来源于酒曲[2],素有“曲为酒之骨”的美誉[3]。大曲是一种富含微生物菌群、菌系及复合曲香的微生态制品,具有糖化、发酵、生香等功能,是中国曲酒的主要糖化发酵剂和生香剂[4-6],其质量直接影响着酒质的好坏[7-8]。
长期以来,酿酒行业中判定大曲质量多以感官指标评分为主[9],或趋向于某些特定的理化及微生物指标[10]。邢钢等[11]对目前大曲中微生物的种类做了系统的总结,并对不同温度大曲制曲过程中的理化指标进行分析研究;宋瑞滨等[12]对浓香型大曲贮存期间理化指标的变化进行了研究;沈才洪等[13]以评分的方式设定了大曲质量标准体系。而目前从大曲品质差异分析出发,全面分析大曲感官指标与理化指标的相关性,以及不同品级大曲挥发性物质的对比研究较少。本研究通过对高温优级大曲和高温普级大曲的理化指标检测、高通量测序及挥发性物质进行分析,探究不同品级高温大曲的差异性,以期为大曲感官评价提供可靠的数据支撑,为提升大曲质量奠定基础,为浓酱兼香型白酒高温大曲质量标准体系的建立及应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
发酵45 d高温大曲,由湖北某著名白酒生产企业提供。
1.1.2 仪器与设备
7890B—5977B气相色谱质谱联用仪,美国Agilent公司;DB-WAX UI毛细管气相色谱柱(60 m×0.32 mm×0.25 μm),美国Agilent公司;DVB/CAR/PDMS固相微萃取头(50/30 μm),美国Supelco公司;STARTER2100精密酸度计,上海毅畅实业有限公司;DNP-9082恒温培养箱,上海精宏实验设备有限公司;UV-5900PC紫外可见分光光度计,上海元析仪器有限公司。
1.1.3 主要试剂
土壤DNA提取试剂盒(DNeasy PowerSoil Kit),德国QIAGEN公司;2×Taq PCR Master Mix,宝日医生物公司;异戊醇(分析纯),天津凯通有限公司;十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)、氯仿、NaCl、无水乙酸钠,均为分析纯,国药集团有限公司。
1.1.4 主要培养基
细菌培养基:牛肉膏蛋白胨培养基;霉菌培养基:PDA培养基;酵母培养基:孟加拉红培养基;乳酸菌培养基:MRS培养基。
1.2 实验方法
1.2.1 取样方法及样品前处理
每天跟随大曲品质检验员选取10间曲房,每间曲房随机选取10块大曲,共计100块。分别挑选出感官评分最高和最低的3块大曲,将当天所取样品粉碎后过20目筛,四分法取样2 kg用无菌袋编号保存,分别置于-80 ℃冰箱和室温备用。共取样3 d,得到高温优级大曲混合样3例(编号YH1、YH2、YH3),高温普级大曲混合样3例(编号LH1、LH2、LH3)。将-80 ℃冰箱内3 d所取优级曲样品混匀后得到1例综合样编号YH,3 d所取普级曲样品混匀后得到另1例综合样编号LH,用于高通量测序分析。
1.2.2 大曲感官评价方法
样品由5名专业人员共同评价,参照大曲感官检验标准打分,详见表1。平均分>90分的为优级曲,70~90分为中级曲,<70分的为普级曲。
表1 大曲感官检验标准表
Table 1 Sensory scoring standard of Daqu

样品评分外观(20分)曲香(40分)断面(30分)高温优级大曲>90分多为棕黄色,穿衣好,表面光洁且无裂口有浓厚的复合曲香味且无异味断面整齐且呈灰白色,菌丝生长丰满,泡气整齐高温中级大曲70~90分多为灰白色,穿衣略差,表面欠光滑曲香较浓或有酱香味,无明显异味断面较整齐,少量菌斑,泡气较整齐高温普级大曲<70分灰白或小麦本色,穿衣差,表面粗糙或有杂菌菌斑曲香味淡薄,有霉味和土腥味等异味断面不整齐,霉变,生心,泡气不整齐
1.2.3 大曲理化指标检测方法
水分、酸度、液化力、糖化力、发酵力等理化指标参照文献[14]和QB/T 4257—2011《酿酒大曲通用分析方法》进行测定。
1.2.4 大曲微生物含量检测方法
微生物计数参照GB 4789.15—2016《食品微生物学检验 霉菌和酵母计数》和《现代白酒酿造微生物学》[15]。取10 g样品置于装有90 mL无菌水的三角瓶中,加入数颗玻璃珠,室温振荡30 min,取菌液1 mL与9 mL无菌水梯度稀释,取1×10-2、10-3、10-4、10-5梯度稀释菌液各1 mL进行涂布。细菌37 ℃恒温静置培养48 h,霉菌和酵母菌28 ℃恒温静置培养72 h后计数。
1.2.5 大曲的高通量测序
样品用液氮研磨后置于2 mL离心管中,加入600 μL CTAB提取缓冲液,65 ℃水浴1 h,每隔15 min颠倒混匀数次,再加入等体积的氯仿异戊醇混合溶液[V(氯仿)∶V(异戊醇)=24∶1],混匀后12 000 r/min离心10 min,将上清液转移至新的无菌离心管中,加入1/10体积的醋酸钠溶液和2倍体积的无水乙醇,混匀后-20 ℃沉淀45 min,12 000 r/min离心10 min,弃上清液保留沉淀,用DNeasy PowerSoil Kit 试剂盒对DNA进行纯化,步骤参考说明书,并用1%(质量分数)琼脂糖凝胶电泳检测所提DNA的完整性[16-17]。
细菌16S rDNA全长扩增引物为515F和806R,真菌ITS区扩增引物为ITS1和ITS2。PCR扩增反应体系(50 μL):1 μL模板DNA,上下游引物各1 μL,2×Taq PCR Master Mix 25 μL,22 μL双蒸水。反应条件:94 ℃预变性 3 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸45 s,30个循环,72 ℃延伸10 min。扩增序列由上海美吉生物有限公司进行测序。
1.2.6 大曲挥发性物质的检测方法
挥发性物质采用顶空固相微萃取-气质联用(headspace solid-phase microextraction-GC-MS,HS-SPME-GC-MS)检测。将5 g曲粉样品置于20 mL 8.5 g/L NaCl和10 g/L CaCl2的水溶液中,振荡混匀后冰浴超声波处理30 min,然后将混合液于4 ℃、8 000 r/min离心5 min,取上清液。在20 mL顶空进样瓶中,加入8 mL上清液,预先加入3 g NaCl使其饱和,最后加入10 μL内标(丙酸辛酯,终质量浓度为60.44 μg/L;L-薄荷醇,终质量浓度为125.41 μg/L), 使用双内标法定量保留时间在丙酸辛酯之前的物质以丙酸辛酯为内标,保留时间在丙酸辛酯之后的物质以L-薄荷醇为内标。HS-SPME条件:三相萃取头(DVB/CAR/PDMS,50/30 μm),50 ℃预热5 min,吸附萃取45 min,GC解吸20 min[18-19]。
气相色谱条件:样品通过DB-FFAP(60 m×0.25 mm×0.25 μm,Agilent J&W)色谱柱进行分离,进样口温度250 ℃;载气He,流速2 mL/min,不分流;升温程序:50 ℃保持2 min, 以4 ℃/min的速率升至230 ℃, 保持15 min。质谱条件:电子轰击电离,离子源230 ℃,电子能量70 eV,四极杆温度150 ℃,全扫描模式,扫描范围35~350 m/z。
1.2.7 数据处理
微生物计数和理化指标均用3次测定结果的平均值±标准差表示,采用SPSS 20软件单因素方差分析,Origin 9.0作图。
待测物峰面积采用SIM模式进行积分,积分结果带入标准曲线计算,得到化合物最终浓度。
2 结果与分析
2.1 不同品级大曲理化指标差异分析
根据大曲感官检验标准对收集到的大曲进行评分(表2),优级曲样品YH1、YH2、YH3的评分均大于90,而普级曲样品LH1、LH2、LH3的评分小于70,说明获得的大曲样品具有代表性,可进行后续研究。
表2 不同品级大曲感官评分
Table 2 Sensory score of Daqu with different grades
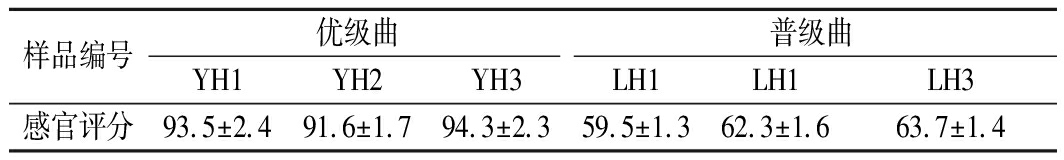
样品编号优级曲普级曲YH1YH2YH3LH1LH1LH3感官评分93.5±2.491.6±1.794.3±2.359.5±1.362.3±1.663.7±1.4
大曲各项理化指标如图1所示。大曲的水分含量与发酵温度和高温发酵时间直接相关,酸度则主要由产酸菌的有机酸代谢产生[20]。由图1-a和1-b可知,3例优级曲样品的水分含量均低于普级曲,酸度和氨态氮含量均高于普级曲。可能由于在发酵过程中普级曲曲块内部发酵温度不足,高温发酵时间过短导致曲胚成熟时水分含量偏高;正因为普级曲发酵不够彻底且产酸菌数量低于优级曲,所以其酸度偏低。
大曲发酵力代表着将发酵基质中可利用的糖转化为酒精的能力,酯化力则是自身经发酵后固有的催化生酯能力,而酯类化合物正是白酒的主体香味成分。由图1-c可知,优级曲的发酵力和酯化力均强于普级曲,说明优级曲能一定程度提高原酒的品质和出酒率;普级曲的液化力和糖化力相较于优级曲更强。大曲液化力和糖化力的强弱与微生物数量有直接的相关性[21],分析原因为普级曲中产淀粉酶和糖化酶的微生物数量高于优级曲。

a-水分含量、酸度;b-糖化力、氨基酸态氮;c-发酵力、酯化力、液化力
图1 大曲理化指标柱形图
Fig.1 Physiochemical index of Daqu
2.2 不同品级大曲可培养微生物差异分析
不同品级高温大曲中可培养微生物的数量存在显著性差异且与理化指标有一定的相关性。如表3所示,普级曲样品LH1、LH2、LH3可培养细菌和霉菌数均高于优级曲样品YH1、YH2、YH3且差异显著。
表3 大曲可培养微生物数量 单位:CFU/g
Table 3 Number of culturable microorganisms in Daqu

样品细菌数×10-6霉菌数×10-4乳酸菌数×10-4酵母菌数×10-2YH11.6±0.26a1.7±0.20a3.4±0.29a4.7±0.42aYH21.2±0.19a0.8±0.09a-6.0±0.54aYH30.9±0.11a1.1±0.13a-5.2±0.51aLH12.3±0.27b6.7±0.58b1.9±0.24b-LH22.9±0.21b5.3±0.37b25.0±1.80c-LH33.7±0.41b4.9±0.42b10.5±0.96d-
注:“-”代表在相应稀释梯度未检出该微生物, 同列标注的不同字母表示差异性显著(P<0.05)
普级曲细菌总数最高达3.7×106 CFU/g是优级曲的2倍以上,霉菌总数最高达6.7×104CFU/g是优级曲的3倍以上。大曲发酵过程中,高温和偏酸性的环境会抑制不耐热及不耐酸的微生物生长繁殖,使曲块的微生物环境更加稳定,故优级曲发酵完成后可培养微生物数量较少。
大曲中可培养乳酸菌数量在不同的样品间均存在着显著差异,3例优级曲样品中只有YH1在10-4稀释梯度内检出乳酸菌,分析原因为大曲在发酵过程中多种理化因素的共同作用下导致乳酸菌数量呈不规律变化。酵母菌的数量和大曲发酵力呈正相关,在优级曲样品中均能检出少量酵母菌,而普级曲样品在10-2稀释梯度内均未检出酵母菌,该结果进一步印证了优级曲的产酒精能力更强。
2.3 不同品级大曲微生物群落组成差异分析
2.3.1 α多样性分析
采用高通量测序技术,通过细菌16S rDNA全长区和真菌 ITS区测序分析了优级曲和普级曲的微生物组成。由表4可知,样品的序列覆盖度均>0.999,再次证明本次测序的结果能够真实地反映所有样本微生物的菌群结构。样品YH细菌的操作分类单位(operational taxonomic unit,OTU)总数(58)是样品LH(22)的2.6倍,Chao指数和Shannon指数均高于LH,即优级曲中细菌的种类更加丰富,细菌群落的多样性更高;2个样品的真菌群落则没有显著性差异。
表4 α多样性指数
Table 4 α diversity index
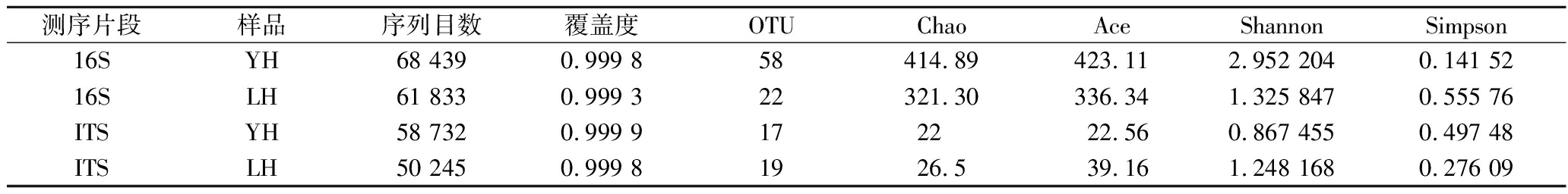
测序片段样品序列目数覆盖度OTUChaoAceShannonSimpson16SYH68 4390.999 858414.89423.112.952 2040.141 5216SLH61 8330.999 322321.30336.341.325 8470.555 76ITSYH58 7320.999 9172222.560.867 4550.497 48ITSLH50 2450.999 81926.539.161.248 1680.276 09
2.3.2 大曲细菌群落组成差异分析
由图2可知,优级曲样品YH中的芽孢杆菌属(Bacillus)和糖多孢菌属(Saccharopolyspora)是主要细菌属,普级曲样品LH中枝芽孢杆菌属(Virgibacillus)和芽孢杆菌属(Bacillus)是主要细菌属,且枝芽孢杆菌属细菌占比高达73.87%。优级曲中乳杆菌属细菌(Lactobacillus)占比1.46%,而普级曲中仅为0.1%,这说明优级曲中乳酸菌的数量实际是高于普级曲的,优级曲的酸度更高可能是乳酸菌产酸造成。

图2 属水平大曲细菌群落柱状图
Fig.2 Histogram of bacterial community at genus level in Daqu
2.3.3 大曲真菌组成群落差异分析
由图3可知,YH和LH样品均由嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)和曲霉属(Aspergillus)3个属的真菌组成,即优级曲真菌微生物的组成种类与普级曲相同,但组成两者真菌微生物的比例有明显差异。优级曲中嗜热真菌总占比高达98.89%,分别为Thermoascus aurantiacus(63.33%)、Thermomyces lanuginosus(33.44%)、Thermoascus crustaceus(2.12%),而普级曲中曲霉属(Aspergillus)微生物占比达18.24%,优级曲仅为0.57%。嗜热真菌是最高生长温度为50 ℃及以上的特殊真菌类群,而曲霉属真菌多不耐高温,上述结果进一步证明了优级曲发酵时的温度更高,高温发酵时间长,高温抑制了其他不耐热的微生物,给嗜热真菌的生长繁殖提供了良好的环境。
2.4 不同品级大曲挥发性物质含量差异分析
大曲风味物质是白酒香气的重要来源,通过对样本挥发性物质的测定和分析,共检测到23种挥发性组分,其中酸类7种,酯类3种,醇类7种,醛类4种,吡嗪类1种,酚类1种。优级高温大曲YH1挥发性物质的总离子流图如图4所示,说明GC条件可以将大曲挥发性物质很好地分离。
由表5可知,3例优级曲样品中酯类、酸类、吡嗪类和酚类物质总量均高于普级曲,醇类化合物总量相近,醛类化合物则是普级曲较高。样品YH2中酸类(11 918.65 μg/kg)和吡嗪类(3 975.09 μg/kg)物质含量最高;YH1中酯类物质含量最高(5 894.04 μg/kg);LH3中醛类物质含量最高(1 719.69 μg/kg)。
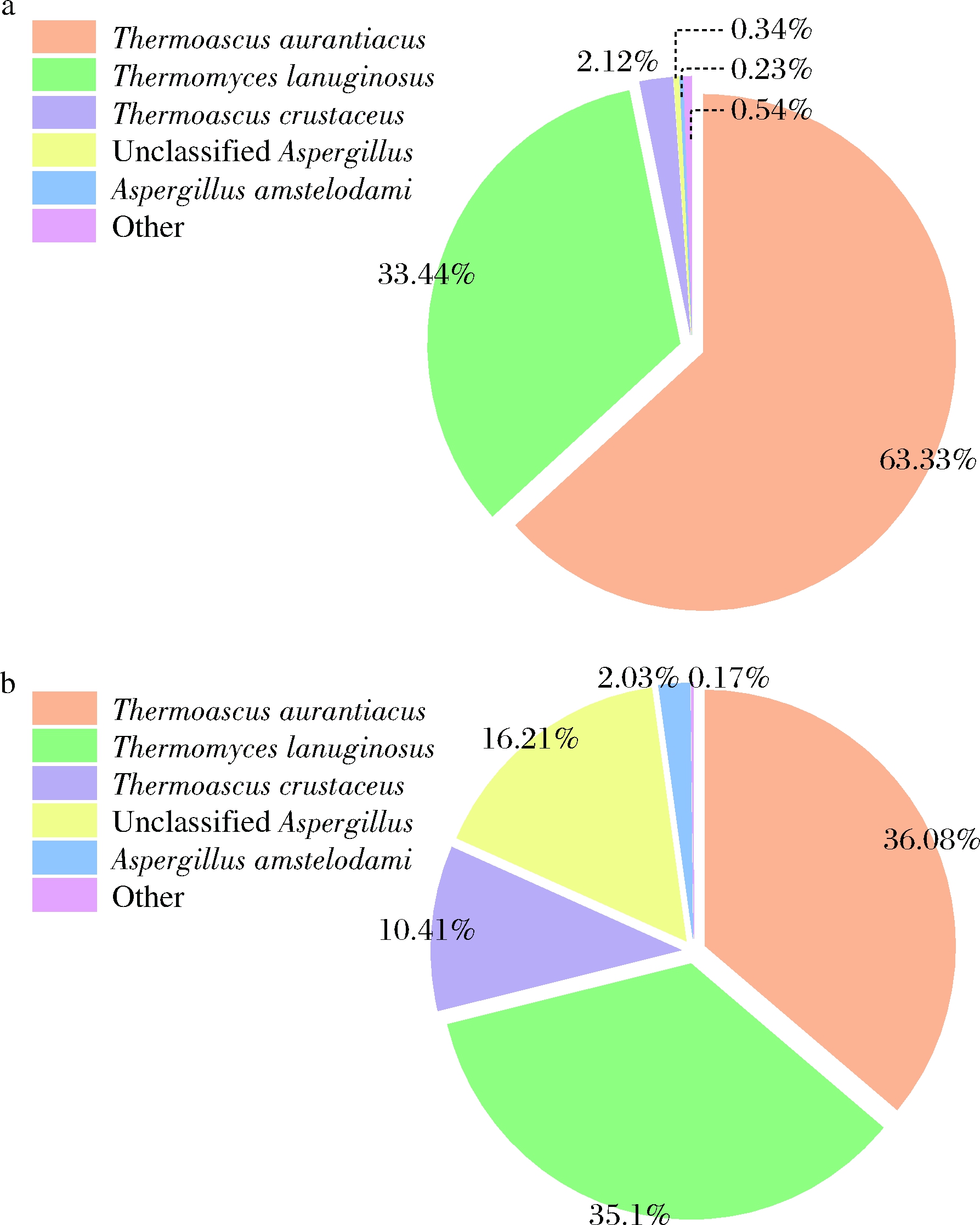
a-优级曲样品YH;b-普级曲样品LH
图3 种水平大曲真菌群落饼状图
Fig.3 Pie chart of fungal community at species level in Daqu
优级曲与普级曲样品相比较,酯类物质中己酸乙酯差值最大(1 970.59 μg/kg),己酸乙酯通常由己酸和乙醇经微生物酯化而成,优级曲中酵母菌数量高且酯化力强,所以其酯类化合物更为丰富;酸类物质中异戊酸差值最大(2 689.51 μg/kg),大曲中酸类物质与乙酸菌、乳酸菌等微生物的代谢作用有关,优级曲中细菌种类丰富,乳酸菌含量高正是其酸类化合物含量高的原因;优级曲中四甲基吡嗪含量较高,样品YH2和LH3的差值最大(1 970.59 μg/kg),吡嗪类化合物是大曲生产过程中发生美拉德反应所形成的[22],由于优级曲的发酵温度更高,高温有利于美拉德反应的进行,促使大量含氮类化合物生成,所以吡嗪类化合物含量远高于普级曲。

图4 优级高温大曲YH1挥发性物质离子流图
Fig.4 Total ion current map of volatile compounds
from superior high-temperature Daqu YH1
表5 不同品级大曲挥发性物质的含量
Table 5 Content of volatile compounds in different grades

编号特征风味物质挥发性物质浓度/(μg·kg-1)YH1YH2YH3LH1LH2LH3A1异戊酸4 160.41±683.145 036.54±398.394 563.56±491.952 347.03±135.423 210.11±540.262 471.84±374.98A2丁酸3 484.48±336.253 517.53±86.533 446.1±275.693 396.99±102.253 461.99±406.843 378.48±172.64A3异丁酸1 135.7±171.381 491.01±50.141 266.04±44.69877.8±172.58971.35±177.95812.29±22.34A4戊酸930.12±167.51939.55±37.68936.57±142.45920.32±171.27924.43±117.13924.16±154.52A5己酸536.79±26.14647.48±69.28596.46±53.56501.98±97.79555.36±25.05546.53±28.31A6庚酸218.96±8.80226.78±35.36223.55±38.18215.96±41.59223.51±1.18225.91±24.51A7辛酸60.13±2.2659.75±2.4259.98±5.2660.62±8.0361.13±7.6860.02±2.69B1己酸乙酯3 702.16±420.943 699.13±122.073 716.65±132.682 153.81±75.171 746.06±210.751 944.15±152.81B2丙酸乙酯2 093.03±23.652 089.08±99.442 035.8±223.941 805.45±259.081 864.77±179.391 912.44±35.57B3十二酸乙酯98.85±3.0198.74±18.7998.8±18.7598.69±1.4598.75±9.8198.78±4.85C1正丁醇4 559.01±276.284 571.56±900.144 601.72±876.174 643.95±643.654 586.14±621.424 621.1±351.2C2正己醇1 246.42±171.511 236.85±155.471 270.42±236.431 265.95±213.951 293.96±48.911 373.48±241.46C3苯甲醇279.4±21.51268.72±22.01394.55±77.77286.88±42.83239.66±39.98291.95±10.92C42-庚醇42.53±4.1845.11±6.1249.99±4.8351.54±5.7749.27±6.6751.96±4.06C51-辛烯-3-醇35.29±4.8531.51±4.6234.02±4.4060.33±10.2842.36±1.5357.54±3.26C6正庚醇19.88±1.0321.33±1.2926.65±3.2325.06±2.7024.36±3.4729.53±4.56C72-辛醇6.71±0.447.05±0.978.55±1.0813.91±0.0915.04±1.9210.51±1.39D1糠醛405.16±66.28588.84±62.71851.96±59.8175.74±4.33181.29±4.71146.5±26.09D2异丁醛325.12±2.67359.45±43.96409.48±27.841 063.57±25.53987.32±51.041 121.95±116.68D3异戊醛193.15±31.46257.27±6.17185.53±31.35386.7±47.25318.88±29.66313.22±4.79D4苯甲醛61.63±3.1676.31±5.90132.2±6.25173.96±12.35102.33±11.73138.01±22.44E1四甲基吡嗪3 175.87±147.683 975.09±792.243 443.45±258.602 443.45±202.322 369.15±406.312 037.21±46.65F1苯酚23.82±4.0921.03±2.7040.64±5.0228.11±1.8012.13±0.165.84±0.83
续表5
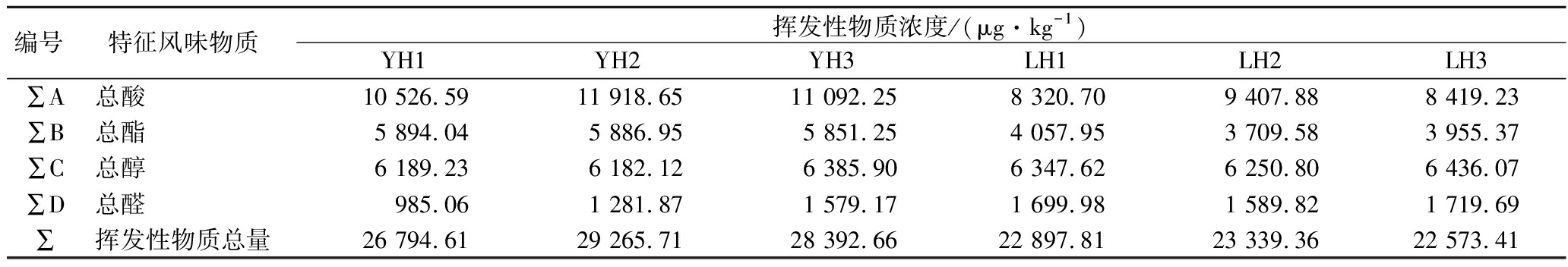
编号特征风味物质挥发性物质浓度/(μg·kg-1)YH1YH2YH3LH1LH2LH3∑A总酸10 526.59 11 918.65 11 092.25 8 320.70 9 407.88 8 419.23 ∑B总酯5 894.04 5 886.95 5 851.25 4 057.95 3 709.58 3 955.37 ∑C总醇6 189.23 6 182.12 6 385.90 6 347.62 6 250.80 6 436.07 ∑D总醛985.06 1 281.87 1 579.17 1 699.98 1 589.82 1 719.69 ∑挥发性物质总量26 794.6129 265.7128 392.6622 897.8123 339.3622 573.41
注:定量参数(丙酸辛酯 60.44 μg/L,保留时间21.636 min;L-薄荷醇125.41 μg/L,保留时间24.321 min)
由图5不同大曲样品挥发性物质含量分布热图可看出,优级曲和普级曲挥发性物质含量差异显著,优级曲暖色区主要集中在A、B、E、F组化合物,而普级曲暖色区主要集中在C、D组化合物。结合表5可知,优级曲样品中异戊酸、己酸乙酯、糠醛、四甲基吡嗪的含量明显高于普级曲,异丁醛和异戊醛含量则明显较低。

图5 大曲挥发性物质热图
Fig.5 Heat map of volatile compounds in Daqu
主成分分析显示了大曲样品中挥发性物质组成的相似性和差异性。基于大曲发酵后挥发性物质的构成,通过主成分分析模型从整体上反映不同品级高温大曲样品间的差异,所提取主成分累计贡献率达77.3%,说明信息提取较完整。如图6所示,6例大曲样品形成独立的4簇,样品YH1和YH2距离较近,形成1簇;样品LH1和LH3形成1簇;样品YH3和LH2分别形成1簇。结果表明,优级曲样品YH1、YH2、YH3与普级曲样品LH1、LH2、LH3的挥发性物质组成在PC1方向有显著性差异。将大曲挥发性物质分成2组,优级曲样品的挥发性物质组成与Group Ⅰ(异戊酸、异丁酸、己酸乙酯、丙酸乙酯、四甲基吡嗪、糠醛等)有较高的相关性,而普级曲样品与Group Ⅱ(正丁醇、正己醇、异丁醛、异戊醛、苯甲醛等)相关性较高。
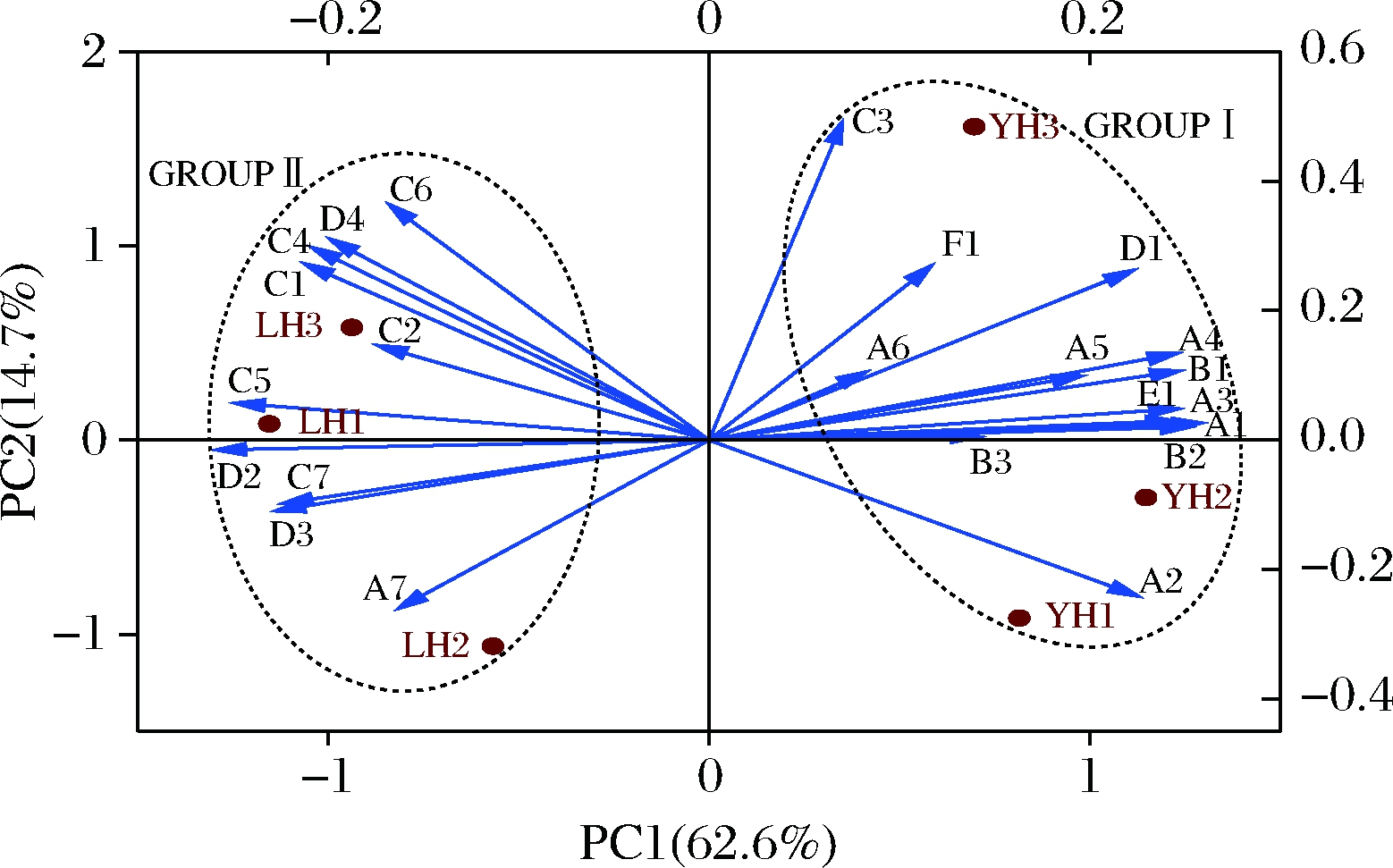
图6 大曲挥发性物质组成主成分分析
Fig.6 Principal components analysis of volatile
compounds in Daqu
3 结论与讨论
大曲的传统感官评价是酿造大曲酒不可或缺的工艺流程之一,本文以感官评分作为衡量大曲质量的基础,通过对不同感官得分样品生化指标,微生物群落结构和挥发性物质含量的分析,来比较不同品级高温大曲的差异。结果表明,优级曲的酸度、氨态氮含量、发酵力和酯化力更高,水分含量、液化力和糖化力则低于普级曲;在微生物群落结构上,普级曲中可培养微生物数量更多,细菌和霉菌数均高于优级曲,但优级曲中酵母菌数量较多且细菌群落的多样性更为丰富;两者真菌组成种类相同,普级曲中曲霉属(Aspergillus)微生物占比达18.24%,优级曲中仅为0.57%且嗜热真菌高达98.89%,说明优级曲发酵时的温度更高;在挥发性物质上,优级曲样品中酯类、酸类、吡嗪类和酚类物质含量均高于普级曲,其中异戊酸、己酸乙酯、糠醛和四甲基吡嗪这4种化合物的差异最为显著。
白酒中挥发性物质主要来源于多种微生物代谢产物的相互转化,酯类化合物是白酒风味的主要组成部分,酸类物质是生成酯类化合物的前驱物质,可以增长后味,消除白酒中的苦味并增加醇和感,而四甲基吡嗪也与酱香型白酒的品质密切相关。由此可见无论是从生化指标还是特征挥发性物质含量上,优级曲均更满足大曲酒酿造的工艺需求。
大曲挥发性物质的变化与微环境差异和微生物分布密切相关,为了更深入地揭示高温大曲挥发性物质与微生物之间的关系,需要结合现代分子生物学方法对大曲功能微生物进行分离鉴定与代谢分析,还有待后续研究。本研究结果为大曲的传统感官评价提供了可靠的数据支撑,为高温大曲质量标准体系的建立及应用提供了一定的理论参考。
[1] 邱并生. 混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报, 2014, 41(7):1 477-1 478.
QIU B S.Effect of mixed culture on fermentation efficiency and flavor compounds in Chinese liquor[J].Microbiology China, 2014, 41(7):1 477-1 478.
[2] 李静心, 王艳丽, 何宏魁, 等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业, 2018, 44(12):52-59.
LI J X, WANG Y L, HE H K, et al.High-throughput sequencing revealed fungal community structures at high temperature Daqu and medium temperature Daqu[J].Food and Fermentation Industries, 2018, 44(12):52-59.
[3] 庄名扬. “浓酱结合型”白酒生产中几个值得注意的问题[J].酿酒科技, 2003(2):22-23.
ZHUANG M Y.Some problems in the production of “Luzhou-flavor & Maotai-flavor combined” liquor[J].Liquor-Making Science & Technology, 2003(2):22-23.
[4] LIU P H, ZHANG L H, DU X W, et al.Dynamic analysis of physicochemical and biochemical indices and microbial communities of light-flavor Daqu during storage[J].Journal of the American Society of Brewing Chemists, 2019, 77(4):287-294.
[5] LI P, LIN W F, LIU X, et al.Effect of bioaugmented inoculation on microbiota dynamics during solid-state fermentation of Daqu starter using autochthonous of Bacillus, Pediococcus, Wickerhamomyces and Saccharomycopsis[J].Food Microbiology, 2017, 61:83-92.
[6] ZHENG X W, YAN Z, NOUT M J R, et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu, a Chinese industrial fermentation starter[J].International Journal of Food Microbiology, 2014, 182-183:57-62.
[7] SHANQIMUGE, LIANG H Z, ZHANG C X, et al.A DGGE marker-mediated fast monitoring of bacterial diversity and comprehensive identification of high-temperature Daqu starter[J].Journal of Food Science, 2015, 80(7):M1519-M1525.
[8] 王玉霞, 李兵, 申孟林, 等.浓香型白酒大曲在发酵和成熟过程中主要功能酶活力分析[J].食品工业科技, 2018, 39(11):270-274;286.
WANG Y X, LI B, SHEN M L, et al.Activities analysis of main functional enzymes from strong-flavour Daqu of Chinese liquor during fermentation and storage stages[J].Science and Technology of Food Industry, 2018, 39(11):270-274;286.
[9] 董大伟, 王晓慧, 苏葛, 等.中高温大曲存储后的感官质量研究[J].酿酒科技, 2018(12):39-44.
DONG D W, WANG X H, SU G, et al.Research on sensory quality of medium/high-temperature Daqu after storage[J].Liquor-Making Science & Technology, 2018(12):39-44.
[10] 敖宗华, 陕小虎, 沈才洪, 等.国内主要大曲相关标准及研究进展[J].酿酒科技, 2010(2):104-108.
AO Z H, SHAN X H, SHEN C H, et al.Domestic related quality standards of Daqu & its research progress[J].Liquor-Making Science & Technology, 2010(2):104-108.
[11] 邢钢, 敖宗华, 邓波.大曲中微生物研究和检测进展[J].酿酒科技, 2012(12):86-89.
XING G, AO Z H, DENG B.Research & detection progress of microbes in Daqu[J].Liquor-Making Science & Technology, 2012(12):86-89.
[12] 宋瑞滨, 邵泽良, 宋军.浓香型大曲贮存过程中部分理化指标及微生物变化[J].酿酒科技, 2017(1):59-61.
SONG R B, SHAO Z L, SONG J.Change in physiochemical indexes and microbial quantity of Nongxiang Daqu during the storage process[J].Liquor-Making Science & Technology, 2017(1):59-61.
[13] 沈才洪, 应鸿, 许德富, 等.大曲的理化特征指标探讨[J].酿酒科技, 2005(9):20-22.
SHEN C H, YING H, XU D F, et al.Study on Daqu quality standards (IV): Investigation on physiochemical property indexes of Daqu[J].Liquor-Making Science & Technology, 2005(9):20-22.
[14] 周斐成, 吴生文, 朱庆圣, 等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造, 2019, 38(4):58-64.
ZHOU F C, WU S W, ZHU Q S, et al.Physicochemical indexes and dynamic analysis of main enzymes in different layers of Te-flavor Daqu during fermentation process[J].China Brewing, 2019, 38(4):58-64.
[15] 徐岩. 现代白酒酿造微生物学[M].北京:科学出版社, 2019.
XU Y.Modern Baijiu Brewing Microbiology[M].Beijing:Science Press, 2019.
[16] 葛媛媛, 姚粟, 刘洋, 等.芝麻香型白酒高温大曲微生物总 DNA 提取的改良方法[J].酿酒, 2012, 39(4):33-37.
GE Y Y, YAO S, LIU Y, et al.A modified method for DNA extraction from high temperature Daqu of Zhima-flavor Chinese liquor[J].Liquor Making, 2012, 39(4):33-37.
[17] 李豆南, 邱树毅.酱香大曲微生物菌群结构及微生物功能研究概述[J].中国酿造, 2017, 36(1):5-11.
LI D N, QIU S Y.Overview of microbial community structure and function in Moutai-flavor Daqu[J].China Brewing, 2017, 36(1):5-11.
[18] 苏俊霞. 镇江香醋醋醅中醋酸菌多样性及Gluconacetobacter intermedius特性的研究[D].无锡:江南大学, 2014.
SU J X.Biodiversity of acetic acid bacteira in the vinegar Pei of Zhenjiang aromatic vinegar and the propetries of Gluconacetobacter intermedius[D].Wuxi:Jiangnan University, 2014.
[19] 郎召伟. 泸型酒酿造过程中风味物质变化分析[D].无锡:江南大学, 2015.
LANG Z W.Analysis of flavor compounds in the production of Luzhou-flavor liquor[D].Wuxi:Jiangnan University, 2015.
[20] ZHANG W X, WU Z Y, ZHANG Q S, et al.Combination of newly developed high quality Fuqu with traditional Daqu for Luzhou-flavor liquor brewing[J].World Journal of Microbiology and Biotechnology, 2009, 25(10):1 721-1 726.
[21] 李显, 蔡琼慧, 吴凤智.影响酱香型大曲糖化力的因素[J].酿酒科技, 2017(4):79-81;87.
LI X, CAI Q H, WU F Z.Influencing factors of saccharifying power of Jiangxiang Daqu[J].Liquor-Making Science & Technology, 2017(4):79-81;87.
[22] YU H, ZHANG R Y, YANG F W, et al.Control strategies of pyrazines generation from Maillard reaction[J].Trends in Food Science & Technology, 2021, 112:795-807.