随着工业发展,砷被越来越多地释放到环境中,进入食物链和生物圈,对人类、动物和环境造成严重威胁[1-3]。砷酸盐[arsenate,As(Ⅴ)]是海水中主要的砷化合物,能被浮游植物、藻类、甲壳动物、软体动物等海洋生物吸收[4],并通过多种方式进入食物链,影响食品安全。研究人员对昆山市农贸市场及超市所售食品随机抽样,211份检测食品中,砷的检出率是21.33%;其中发现3份海鱼样本砷超标,最高超过国家标准近3倍[5]。因而急需建立一种安全、高效、适用范围广的食品砷脱除方法,安全经济的微生物脱除法已成为砷脱除的优选方法之一。
一些关于酵母的研究显示了它们在砷生物修复方面的潜力[6-8]。库德毕赤酵母(Pichia kudriavzevii)作为一种多抗性酵母,可以抵抗高盐、高温和低pH值[9-10],已从果汁、浆果、茶啤酒和一些非洲发酵乳制品中被分离出来[11-14]。常被用来生产乳酸[10]、琥珀酸[15]和乙醇[16]等物质,在食品工业中有着广泛的应用前景。前期对P.kudriavzevii A16的研究表明,其对镉、锌等多种重金属离子具有良好的抗性和脱除能力[17-18],具有从食品中脱除有害物质的应用潜能。
非靶向代谢组学技术可以尽可能多地定性以及相对定量生物体系中的代谢物,最大程度来反映总代谢物信息,常用于代谢表型的区分和差异代谢物的发现[19]。代谢组学是更接近于表型的组学,能够更直接、更准确地反映生物体的生理状态。因此,非靶向代谢组学技术有利于更直观地研究As(Ⅴ)胁迫下P.kudriavzevii A16代谢物的变化。
本研究着眼于微生物脱砷技术在行业中广阔的应用前景,以P.kudriavzevii A16为研究对象,基于非靶向代谢组学方法探讨As(Ⅴ)暴露24 h后P.kudriavzevii A16细胞中代谢物的变化及可能的通路分析,该研究为如何提高生物体的砷脱除能力提供有益思路,并更好地应用于食品中砷的脱除。
1 材料与方法
1.1 试验菌株
P.kudriavzevii A16为本实验室保藏菌株,分离自高温白酒酒醅[20]。
1.2 试剂与仪器
1.2.1 主要试剂
Na2HAsO4·7H2O(分析纯),湖北楚盛威化工有限公司;硝酸(优级纯);高氯酸(优级纯);砷标准液(GSB 04-1714—2004),国家有色金属及电子材料分析测试中心。
1.2.2 主要仪器
QYC 211型恒温振荡培养箱,上海福玛实验设备有限公司;LD5-10型低速离心机,北京雷勃尔离心机有限公司;LDZX-50KBS型高压蒸汽灭菌锅,上海申安医疗器械厂;Powerwave XS型酶标仪,美国BioTek仪器公司;EHD-24电热消解仪,北京东航科仪仪器有限公司;8800电感耦合等离子体质谱仪,安捷伦科技有限公司。
1.3 主要培养基
YPD培养基(g/L):20葡萄糖、20蛋白胨、10酵母浸粉。固体培养基添加20 g/L琼脂。含砷培养基中砷的浓度根据实验需要而定。
1.4 菌种活化
P.kudriavzevii A16菌种先后进行固体活化及液体活化。首先将4 ℃保存的菌种接种到YPD斜面固体培养基上,28 ℃恒温培养24 h。从固体斜面上取少量菌体接种到50 mL YPD液体培养基中,在28 ℃恒温振荡(180 r/min)条件下培养24 h[20]。
1.5 As(Ⅴ)对P.kudriavzevii A16生长的影响和砷脱除率
取1 mL经过液体活化后的P.kudriavzevii A16菌悬液接种于含不同质量浓度As(Ⅴ)(Na2HAsO4·7H2O 0、5、10、15、20 mg/L)的YPD培养基中,28 ℃、180 r/min恒温培养24 h。取酵母培养液稀释10倍后600 nm处测定吸光值,即用OD600来描述酵母菌生长情况。酵母培养液5 000 r/min离心5 min,取1 mL上清液加入到消化管中,并加入4 mL浓硝酸与1 mL高氯酸,加热使其充分消化,超纯水适当稀释后,使用电感耦合等离子体质谱仪测定总砷含量,砷脱除率R按照公式(1)计算[20]。
(1)
式中:ρ0,生物积累前YPD培养基中总砷的质量浓度,mg/L;ρt,生物积累后YPD培养基中总砷的质量浓度,mg/L。
1.6 代谢组学分析样品的制备
液体活化后的P.kudriavzevii A16接种到YPD培养基(空白对照组,BK组);液体活化后的P.kudriavzevii A16接种到含12 mg/L As(Ⅴ) YPD培养基(砷胁迫组,As组);P.kudriavzevii A16的接种量均为4×108个,28 ℃、180 r/min恒温振荡培养24 h。
采用离心法收集菌体(保证离心后各样品菌体体积一致),用预冷的PBS快速冲洗2~3次,每次清洗后4 ℃、5 000 r/min离心5 min;弃去上清液,菌体收集在2 mL离心管中,液氮速冻15 min,-80 ℃保存。P.kudriavzevii A16代谢物的提取及后续分析均委托北京Novogene生物信息科技有限公司完成。主要实验流程图如图1所示。

图1 主要实验流程图
Fig.1 Main experiment flow chart
1.7 数据处理及分析
使用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(https://www.genome.jp/kegg/pathway.html)对鉴定到的代谢物进行注释。多元统计分析部分,使用代谢组学数据处理软件metaX对数据进行转换,再进行主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析(partial least square discriminant analysis,PLS-DA),进而得到每个代谢物在PLS-DA模型中第一主成分的变量投影重要度(variable importance in projection,VIP)。单变量分析部分,基于t检验来计算各代谢物在两组间统计学显著性(P值),并计算代谢物在两组间的差异倍数(fold change,FC)。差异代谢物的筛选设定阈值为VIP>1.0,FC>1.5或FC<0.667且P<0.05。
2 结果与分析
2.1 As(Ⅴ)对P.kudriavzevii A16生长及砷脱除率的影响
不同浓度As(Ⅴ)对P.kudriavzevii A16毒性有较大差异,P.kudriavzevii A16培养液OD600及砷脱除率如表1所示。
正常培养条件下,P.kudriavzevii A16的OD600为0.606,而5 mg/L As(V)胁迫下P.kudriavzevii A16的OD600降低到0.502,10 mg/L As(V)胁迫下P.kudriavzevii A16的OD600仅有0.063。随着砷质量浓度升高,生物量降低很多,这说明As(V)抑制了P.kudriavzevii A16的生长。在As(V)的质量浓度为5 mg/L培养基中接种P.kudriavzevii A16培养24 h后,该组砷的脱除率为61.84%。随着As(V)质量浓度的增加,培养液OD600值逐渐降低,同时各组砷脱除率也逐渐降低。P.kudriavzevii A16的砷脱除率与P.kudriavzevii A16的生长密切相关。
表1 不同质量浓度As(Ⅴ)条件下P.kudriavzevii A16培养液OD600及砷脱除率
Table 1 OD600 and arsenic removal rate of P.Kudriavzevii A16 culture under different concentrations of As(Ⅴ)

项目As(Ⅴ)质量浓度/(mg·L-1)05101520OD6000.606±0.0330.502±0.0460.063±0.0030.060±0.0010.058±0.001R/%-61.84±5.32 24.76±5.00 14.27±3.84 9.22±1.75
2.2 PCA
通过PCA图可以观察到不同处理组间的差异。如图2所示,正负离子模式下As与BK组组内均平行性较好,组间均相隔较远,分离明显,这表明每个不同区域中的样本具有特定的代谢谱。与BK组相比,在As(Ⅴ)胁迫下的As组,P.kudriavzevii A16产生了生物响应,代谢产物发生了明显的变化。
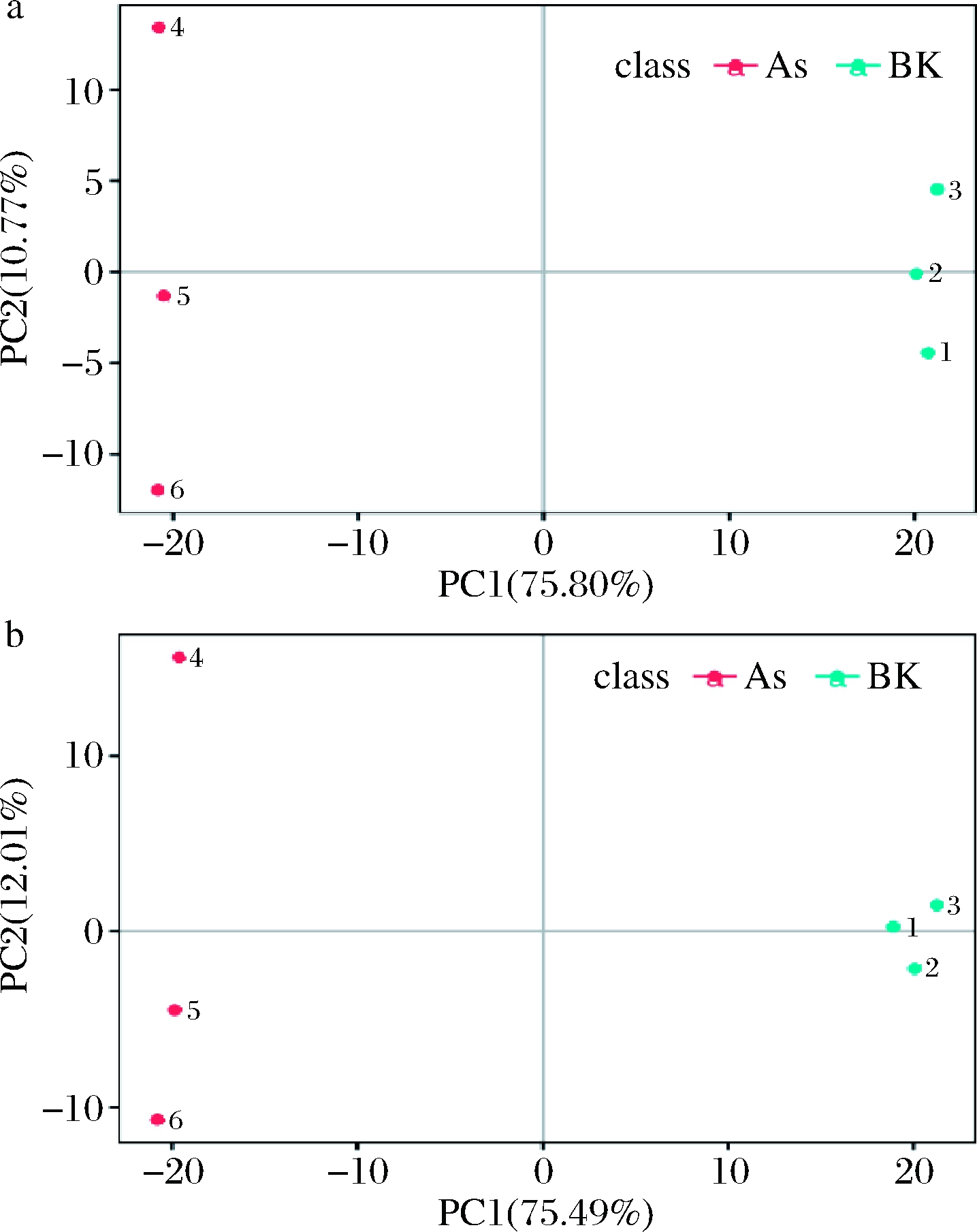
a-正离子模式;b-负离子模式
图2 主成分分析图
Fig.2 Principal component analysis
2.3 PLS-DA
PLS-DA是一种有监督的判别分析统计方法。![]() 表示模型的解释率,
表示模型的解释率,![]() 用于评价PLS-DA模型的预测能力,且
用于评价PLS-DA模型的预测能力,且![]() 时表示模型建立良好。如图3所示,正、负离子模式下,As、BK组
时表示模型建立良好。如图3所示,正、负离子模式下,As、BK组![]() 表明该模型建立具有可靠的预测能力。
表明该模型建立具有可靠的预测能力。
a-正离子模式;b-负离子模式
图3 PLS-DA得分散点图
Fig.3 PLS-DA dispersion point diagram
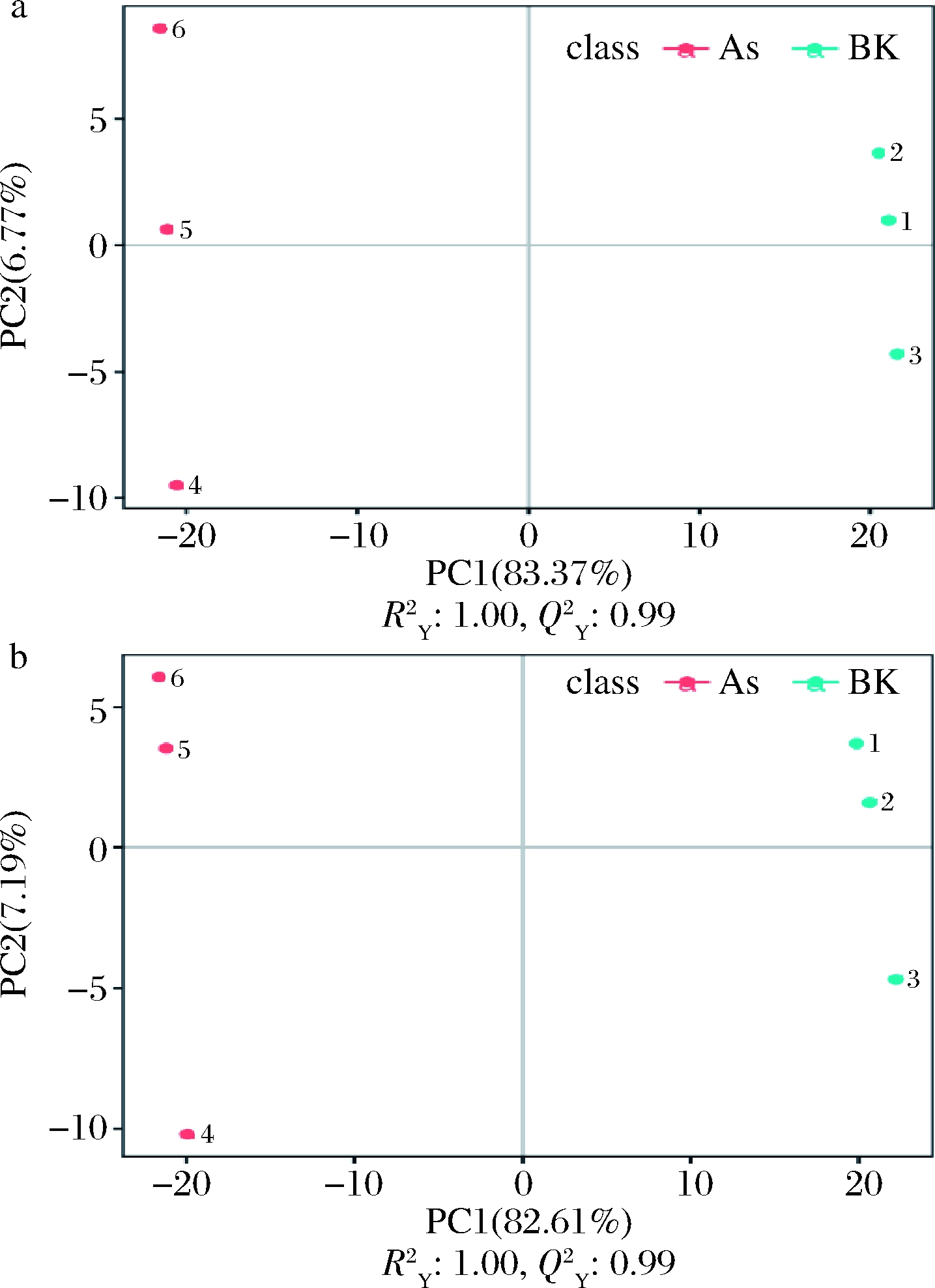
R2和Q2通常用来衡量模型是否过拟合。如图4所示,正负离子模式下,As、BK组与POAs、As组,R2>Q2且Q2回归线与Y轴截距<0,可知该模型未“过拟合”,稳定性高。

a-正离子模式;b-负离子模式
图4 PLS-DA排序验证图
Fig.4 PLS-DA sorting verification diagram
2.4 差异代谢物热图分析
不同样品中代谢物的积累模式差异可以通过聚类热图进行分析,图5显示了正、负离子模式下As组与BK组的显著性差异代谢物层次聚类结果。说明两组样本中差异代谢物可明显区分,并且As(Ⅴ)胁迫P.kudriavzevii A16下的代谢物与正常培养组BK组相比发生了显著变化。
2.5 差异代谢物的筛选与鉴定
搜库结果(mzCloud Results, mzVault Results,MassList Results)设定为full match,选择差异代谢物TOP 35进行列表,如表2和表3所示。
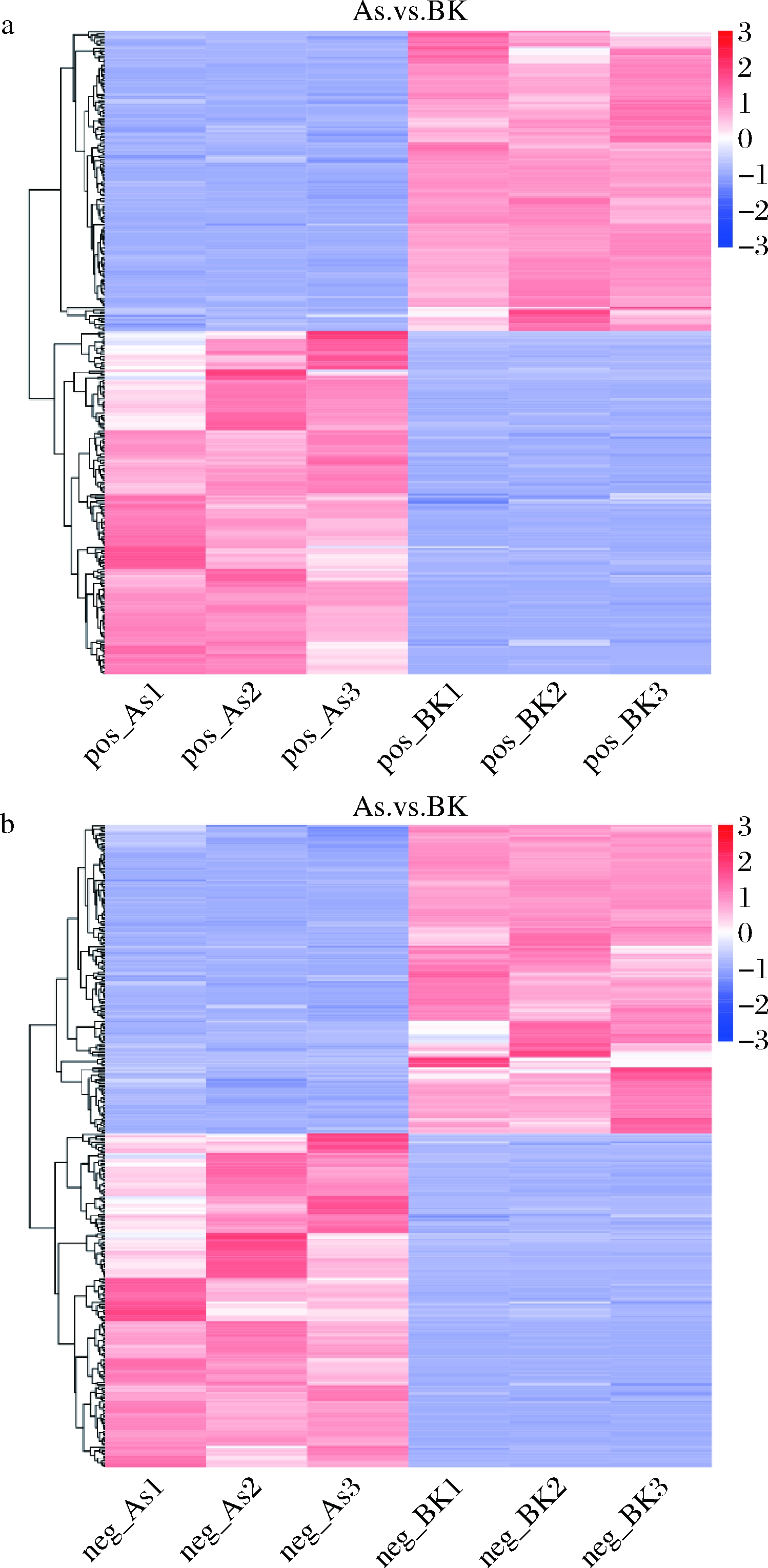
a-正离子模式;b-负离子模式;As1、As2、As3为As组中平行样品;
BK1、BK2、BK3为BK组中平行样品
图5 差异代谢物聚类分析图
Fig.5 Cluster analysis of differential metabolites
注:纵向是样品的聚类,横向是代谢物的聚类,
聚类枝越短代表相似性越高
表2 正离子模式下As组与BK组差异代谢物
Table 2 The significantly differential metabolites in the As group and BK group in positive ion modes

序号名称FC值P值VIP值Up/Down1guanine鸟嘌呤23.900 143.84E-071.217 396up23′-adenosine monophosphate (3′-AMP)3′-磷酸腺苷(3′-AMP)36.316 099.09E-071.360 191up3D- (+)-pipecolinic acidD-(+)-哌啶酸3.578 8694.14E-061.366 908up4DL-lysineDL-赖氨酸3.583 9385.54E-061.222 767up52′-deoxyadenosine2′-脱氧腺苷2.733 8141.56E-051.051 439up6DL-glutamineDL-谷氨酰胺0.259 5612.10E-051.260 126down7DL-2-(acetylamino)-3-phenylpropanoic acidDL-2-(乙酰氨)-3-苯丙酸0.311 0762.58E-051.373 317down8N6, N6, N6-trimethyl-L-lysineN6,N6,N6-三甲基-L-赖氨酸0.374 6012.85E-051.108 562down9L-cysteineL-半胱氨酸2.638 3953.34E-051.385 517up
续表2

序号名称FC值P值VIP值Up/Down10cytidine 5′-monophosphate (hydrate)胞嘧啶核苷-5′-单磷酸酯(水合物)7.423 4293.62E-051.311 068up11methyl indole-3-acetate甲基吲哚-3-醋酸酯37.443 114.88E-051.420 172up12L- (-)-methionineL-(-)-甲硫氨酸2.5847 296.85E-051.150 839up135-hydroxyindole-3-acetic acid5-羟基吲哚-3-乙酸24.769 010.000 1251.408 34up14pipecolic acid哌啶酸3.497 8980.000 1371.389 169up15L-pyroglutamic acidL-焦谷氨酸0.403 9970.000 1871.246 22down16N-acetylornithineN-乙酰鸟氨酸0.318 4610.000 3011.401 14down17N-acetyl-L-leucineN-乙酰-L-亮氨酸0.419 3830.000 4731.369 401down18cytosine胞嘧啶7.611 9110.000 621.328 067up19acetyl-L-carnitine乙酰-L-肉毒碱0.380 570.000 6961.137 793down20L-phenylalanineL-苯丙氨酸0.514 8320.000 781.377 267down21L-kynurenineL-犬尿氨酸20.006 260.001 0341.403 254up22creatinine肌酸酐0.378 4050.001 0671.120 726down23L-threonineL-苏氨酸2.277 5460.001 3311.215 358up24nicotinamide adenine dinucleotide (NAD+)烟酰胺腺嘌呤二核苷酸(NAD+)0.535 8620.001 6511.351 482down25D- (+)-prolineD-(+)-脯氨酸0.413 7240.001 9161.285 944down263-(3-methylbut-2-en-1-yl)-3H-purin-6-amine3-(3-甲基2-丁烯基)-3H-嘌呤-6-胺0.233 1630.002 5181.220 475down271-methylhistidine1-甲基组氨酸0.216 9660.002 7181.387 628down28DL-tryptophanDL-色氨酸2.836 2710.002 9231.348 404up29pyridoxine吡哆醇6.820 850.004 3391.404 897up30thymine胸腺嘧啶1.669 3640.005 0121.219 641up31S-adenosylmethionineS-腺苷甲硫氨酸0.468 2090.005 1291.198 031down32spermine精胺0.076 6760.005 4291.254 376down33inosine肌苷2.664 3740.006 6151.081 721up34paracetamol醋氨酚0.542 470.006 8551.305 701down35N6-acetyl-L-lysineN6-乙酰-L-赖氨酸0.464 5010.009 7931.228 902down
表3 负离子模式下As组与BK组差异代谢物
Table 3 The significantly differential metabolites in the As group and BK group in negative ion modes
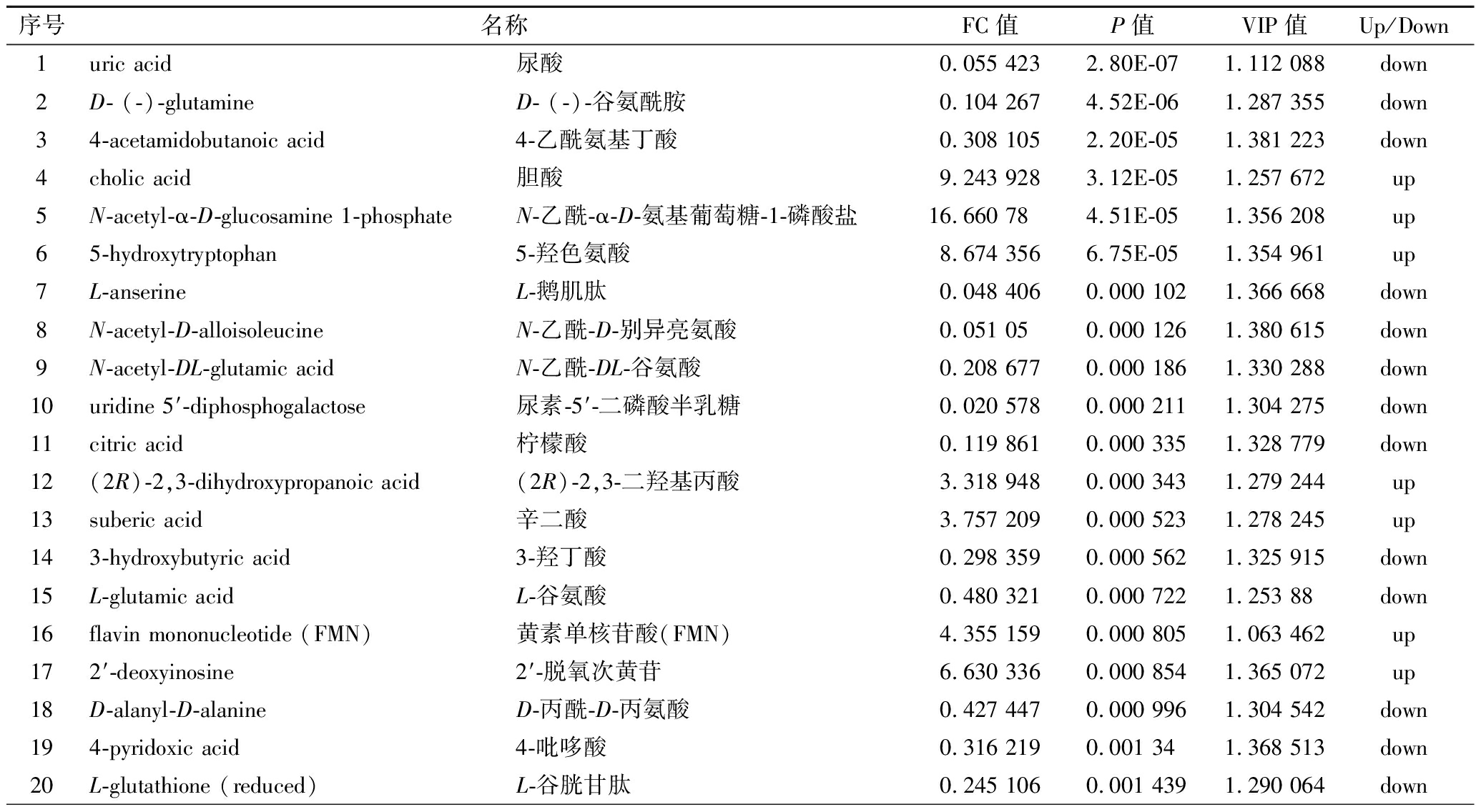
序号名称FC值P值VIP值Up/Down1uric acid尿酸0.055 4232.80E-071.112 088down2D- (-)-glutamineD- (-)-谷氨酰胺0.104 2674.52E-061.287 355down34-acetamidobutanoic acid4-乙酰氨基丁酸0.308 1052.20E-051.381 223down4cholic acid胆酸9.243 9283.12E-051.257 672up5N-acetyl-α-D-glucosamine 1-phosphateN-乙酰-α-D-氨基葡萄糖-1-磷酸盐16.660 784.51E-051.356 208up65-hydroxytryptophan5-羟色氨酸8.674 3566.75E-051.354 961up7L-anserineL-鹅肌肽0.048 4060.000 1021.366 668down8N-acetyl-D-alloisoleucineN-乙酰-D-别异亮氨酸0.051 050.000 1261.380 615down9N-acetyl-DL-glutamic acidN-乙酰-DL-谷氨酸0.208 6770.000 1861.330 288down10uridine 5′-diphosphogalactose尿素-5′-二磷酸半乳糖0.020 5780.000 2111.304 275down11citric acid柠檬酸0.119 8610.000 3351.328 779down12(2R)-2,3-dihydroxypropanoic acid(2R)-2,3-二羟基丙酸3.318 9480.000 3431.279 244up13suberic acid辛二酸3.757 2090.000 5231.278 245up143-hydroxybutyric acid3-羟丁酸0.298 3590.000 5621.325 915down15L-glutamic acidL-谷氨酸0.480 3210.000 7221.253 88down16flavin mononucleotide (FMN)黄素单核苷酸(FMN)4.355 1590.000 8051.063 462up172′-deoxyinosine2′-脱氧次黄苷6.630 3360.000 8541.365 072up18D-alanyl-D-alanineD-丙酰-D-丙氨酸0.427 4470.000 9961.304 542down194-pyridoxic acid4-吡哆酸0.316 2190.001 341.368 513down20L-glutathione (reduced)L-谷胱甘肽0.245 1060.001 4391.290 064down
续表3

序号名称FC值P值VIP值Up/Down21trans-aconitic acid反式乌头酸0.087 9870.001 6831.322 127down22D-α-hydroxyglutaric acidD-α-羟基戊二酸3.614 3350.002 0081.013 054up23phosphoenolpyruvic acid磷酸烯醇式丙酮酸4.315 410.002 3071.220 122up24pantothenic acid泛酸0.240 8610.002 3651.323 789down25kynurenic acid犬尿酸5.688 7390.003 1171.128 411up262-hydroxyvaleric acid2-羟基戊酸0.075 9030.003 3791.370 123down27sucrose蔗糖0.020 6450.003 4481.293 259down282-aminoadipic acid2-氨基己二酸0.141 1890.004 2551.281 433down29adenosine腺苷0.130 3850.004 4471.253 706down303-phenyllactic acid3-苯乳酸0.019 990.004 7191.373 142down31D-(+)-malic acidD-(+)-苹果酸0.474 6890.005 7761.217 893down32N-acetylvalineN-乙酰缬氨酸0.314 5010.005 8081.010 839down335-hydroxylysine5-羟赖氨酸0.439 9940.006 8261.117 348down34succinic acid琥珀酸0.194 5890.006 8591.228 819down35α, α-trehaloseα, α-海藻糖0.010 9560.011 6651.253 381down
通过火山图可以直观显示代谢物在两组样品中含量的差异,以及差异的统计学显著性。火山图中每个点代表一个代谢物,显著上调的代谢物用红色点表示,显著下调的代谢物用绿色点表示,圆点的大小代表VIP值,如图6所示。
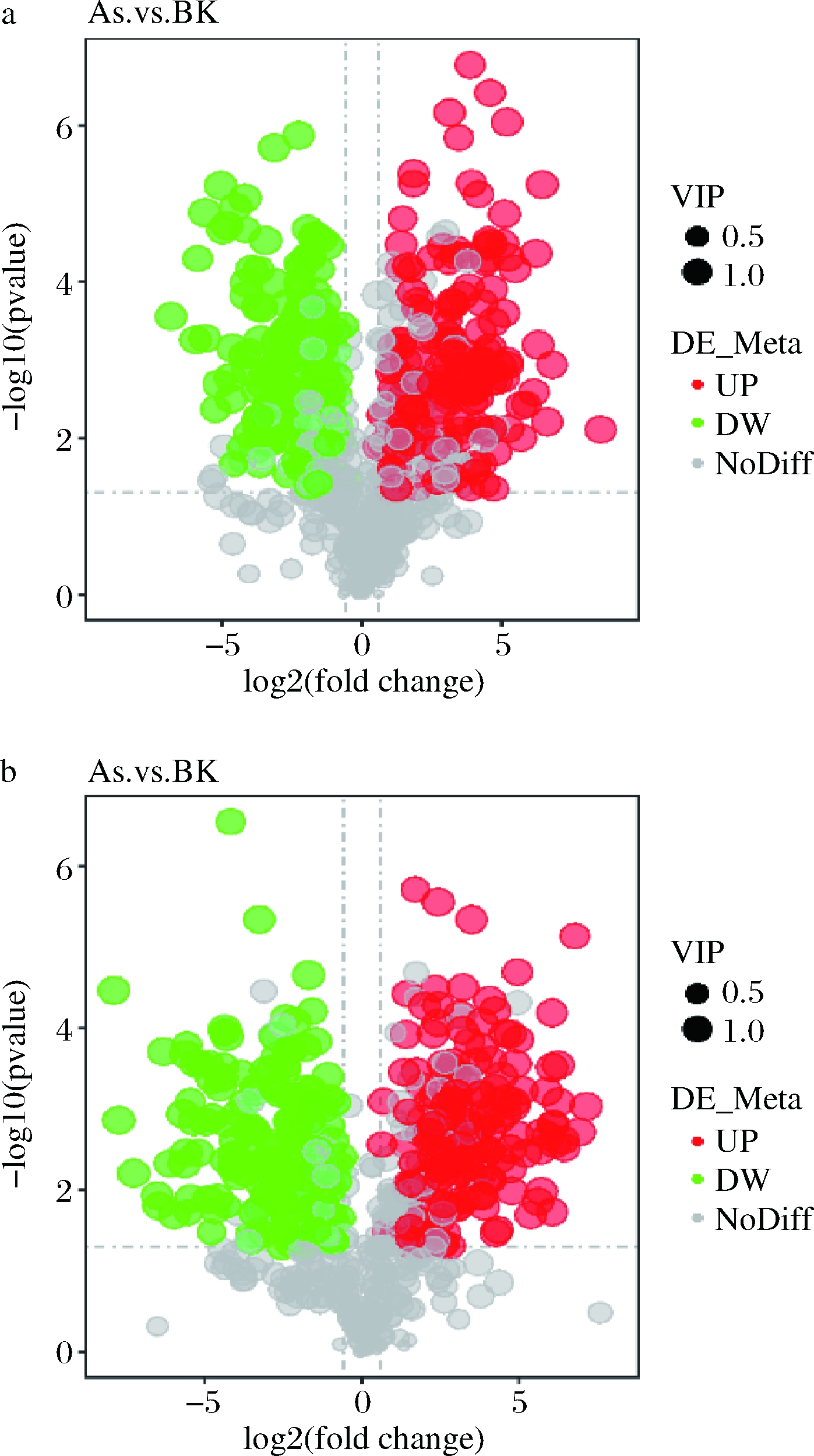
a-正离子模式;b-负离子模式
图6 差异代谢物火山图
Fig.6 Volcanic map of differential metabolites
正离子模式下,在As、BK两组样本之间共检测到差异代谢物317种,其中,有169种显著上调表达,其中包括鸟嘌呤、3’-磷酸腺苷、L-半胱氨酸、肌苷等,有148种代谢物显著下调表达,包括DL-谷氨酰胺、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、D-(+)-脯氨酸、精胺等;负离子模式下,在As、BK两组样本之间检测到差异代谢物329种,其中,有171种显著上调表达,其中包括胆汁酸、黄素单核苷酸(flavin mononucleotide,FMN)、磷酸烯醇式丙酮酸等,有158种代谢物显著下调表达,包括D-(-)-谷氨酰胺、柠檬酸、3-羟基丁酸、L-谷胱甘肽、琥珀酸、α, α-海藻糖等。
2.6 差异代谢物KEGG富集通路
将不同比较组中所有的差异代谢物匹配KEGG的数据库从而获得代谢物参与的通路信息。对注释完的结果进行富集分析,获得差异代谢物富集较多的通路。如图7所示,正离子模式下,As组与BK组差异代谢物主要注释和富集在谷胱甘肽代谢通路,氨酰tRNA生物合成代谢通路,甘氨酸、丝氨酸和苏氨酸代谢通路、氰基氨基酸代谢通路等;负离子模式下As与BK差异代谢物主要注释和富集在柠檬酸循环,乙醛酸和二羧酸代谢通路,丙酮酸代谢通路,谷胱甘肽代谢通路,丙氨酸、天冬氨酸和谷氨酸代谢通路等。

a-正离子模式;b-负离子模式
图7 KEGG富集通路气泡图
Fig.7 KEGG enrichment pathway bubble map
3 讨论
本研究采用先进的非靶向代谢组学技术对正常培养与砷酸盐胁迫条件下P.kudriavzevii A16的代谢物进行比对,并筛选出关键的差异代谢物,研究As(Ⅴ)胁迫下P.kudriavzevii A16的代谢物变化。
磷酸烯醇式丙酮酸等代谢物在P.kudriavzevii A16中的下调表达,说明As(Ⅴ)可能促进了P.kudriavzevii A16的糖酵解反应;脂肪酸羟基化可生成羟基丁酸,而在3-羟基丁酸脱氢酶的作用下羟基丁酸氧化生成乙酰辅酶A,进入三羧酸循环(tricarboxylic acid cycle,TCA)[21]。As(Ⅴ)胁迫使得3-羟基丁酸等物质的下调表明As(Ⅴ)可能会促进P.kudriavzevii A16的脂肪酸代谢,上调TCA循环,同时3′-磷酸腺苷的表达量上调,可为细胞提供更多的能量供应。
位于线粒体的内膜上的电子传递链是氧化磷酸化反应及ATP合成的主要位点,As(Ⅴ)胁迫下P.kudriavzevii A16胞内NAD+表达量的下调及FMN表达量的上调,表明As(Ⅴ)可能促进了P.kudriavzevii A16细胞的氧化磷酸化反应。
氨基酸通过TCA循环可以为生物体供能[22],在本研究中,As(Ⅴ)胁迫下P.kudriavzevii A16胞内甘氨酸、丝氨酸和丝氨酸代谢通路,氰基氨基酸代谢通路,丙氨酸、天冬氨酸和谷氨酸代谢通路显著上调,说明As(Ⅴ)胁迫导致了酵母细胞的能量代谢发生紊乱。LI等[23]以甘氨酸等氨基酸的含量变化阐明了斑马鱼受到砷胁迫会导致其能量代谢异常。另外有研究表明,生物体可以通过提高氨基酸的代谢速率来为机体提供应对外界胁迫所需的能量[24]。此外,氨酰基tRNA可以通过转运氨基酸影响核糖体蛋白的生物合成,氨酰tRNA生物合成代谢通路显著上调表达,表明As(Ⅴ)胁迫对P.kudriavzevii A16胞内的蛋白质合成/降解产生干扰。这与当砷质量浓度大于5 mg/L时生长受到明显抑制的现象一致。
谷胱甘肽(glutathione,GSH)是防御细胞氧化应激关键因素,具有抗氧化的作用,可以缓解细胞的氧化应激;除此之外GSH可与蛋白质上的活性巯基结合,从而使其免于不可逆的氧化损伤[25]。GSH被认为是细胞抵抗有毒物质的一个重要组成部分,是无机砷氧化还原及砷解毒的重要物质[22],作为一种金属螯合剂,它在细胞抗砷毒性中发挥着重要作用[26]。谷胱甘肽代谢通路的显著富集表明GSH可能被催化为氧化型谷胱甘肽,参与细胞砷的解毒。因此GSH与P.kudriavzevii A16的生长和对培养基中砷脱除率关系密切,提示今后可以通过基因工程手段或者发酵工艺优化来提高GSH的表达。
4 结论
砷酸盐对P.kudriavzevii A16的生长有抑制作用;随着培养液中As(Ⅴ)浓度升高,P.kudriavzevii A16对砷的脱除率下降。P.kudriavzevii A16通过调节体内糖酵解反应、TCA循环、脂肪酸氧化代谢、氧化磷酸化和氨基酸代谢提高能量供给以应对As(Ⅴ)胁迫导致的毒性效应;此外,谷胱甘肽代谢通路的显著富集也表明P. kudriavzevii A16胞内GSH参与As(Ⅴ)的解毒作用,以减轻As(Ⅴ)胁迫带来的细胞氧化损伤,降低As(Ⅴ)毒性。后续将利用其他组学联合分析,厘清关键性差异代谢物并进行验证性研究,为建立P.kudriavzevii A16砷脱除技术提供有益参考。
[1] CARLIN D J, NAUJOKAS M F, BRADHAM K D, et al.Arsenic and environmental health:State of the science and future research opportunities[J].Environmental Health Perspectives, 2016, 124(7):890-899.
[2] ROSEN B P.Biochemistry of arsenic detoxification[J].FEBS Letters, 2002, 529(1):86-92.
[3] BERTIN P N, CROGNALE S, PLEWNIAK F, et al.Water and soil contaminated by arsenic:The use of microorganisms and plants in bioremediation[J].Environmental Science and Pollution Research International, 2022, 29(7):9 462-9 489.
[4] 张金羽. 莱茵衣藻对砷酸盐的富集分配和形态转化研究[D].南京:南京农业大学, 2020.
ZHANG J Y.Accumulation, distribution and transformation of arsenate by Chlamydomonas reinhardtii[D].Nanjing:Nanjing Agricultural University, 2020.
[5] 胡朝友, 袁华平.昆山市2014年市售食品中铅砷汞检测结果分析[J].江苏预防医学, 2016, 27(3):357-358.
HU Z Y, YUAN H P.Analysis on the detection results of lead, arsenic and mercury in food sold in Kunshan in 2014 [J].Jiangsu Journal of Preventive Medicine, 2016, 27(3):357-358.
[6] SHILEV S.Arsenate tolerance in Saccharomyces cerevisiae is associated with efflux capability[J].Acta Microbiologica Bulgarica, 2020, 36(2):63-67.
[7] MENEZES R A, AMARAL C, BATISTA-NASCIMENTO L, et al.Contribution of Yap1 towards Saccharomyces cerevisiae adaptation to arsenic-mediated oxidative stress[J].Biochemical Journal, 2008, 414(2):301-311.
[8] GHOSH M, SHEN J, ROSEN B P.Pathways of as(III) detoxification in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(9):5 001-5 006.
[9] ZHANG D D, MA N, GUO Z, et al.Improved cadmium resistance and removal capacity in Pichia kudriavzevii A16 by sucrose preincubation[J].Journal of Basic Microbiology, 2019, 59(9):867-878.
[10] PARK H J, BAE J H, KO H J, et al.Low-pH production of d-lactic acid using newly isolated acid tolerant yeast Pichia kudriavzevii NG7[J].Biotechnology and Bioengineering, 2018, 115(9):2 232-2 242.
[11] KURTZMAN C P, SMILEY M J.Heterothallism in Pichia kudriavzevii and Pichia terricola[J].Frontiers in Microbiology, 1976, 42(3):355-363.
[12] HELLSTRÖM A M, ALMGREN A, CARLSSON N G, et al.Degradation of phytate by Pichia kudriavzevii TY13 and Hanseniaspora guilliermondii TY14 in Tanzanian togwa[J].International Journal of Food Microbiology, 2012, 153(1-2):73-77.
[13] GREPPI A, SAUBADE F, BOTTA C, et al.Potential probiotic Pichia kudriavzevii strains and their ability to enhance folate content of traditional cereal-based African fermented food[J].Food Microbiology, 2017, 62:169-177.
[14] AKABANDA F, OWUSU-KWARTENG J, TANO-DEBRAH K, et al.Taxonomic and molecular characterization of lactic acid bacteria and yeasts in nunu, a Ghanaian fermented milk product[J].Food Microbiology, 2013, 34(2):277-283.
[15] XI Y Y, ZHAN T, XU H T, et al.Characterization of JEN family carboxylate transporters from the acid-tolerant yeast Pichia kudriavzevii and their applications in succinic acid production[J].Microbial Biotechnology, 2021, 14(3):1 130-1 147.
[16] NDUBUISI I A, QIN Q J, LIAO G Y, et al.Effects of various inhibitory substances and immobilization on ethanol production efficiency of a thermotolerant Pichia kudriavzevii[J].Biotechnology for Biofuels, 2020, 13:91.
[17] LI C S, YANG X Q, XU Y, et al.Cadmium detoxification induced by salt stress improves cadmium tolerance of multi-stress-tolerant Pichia kudriavzevii[J].Environmental Pollution, 2018, 242:845-854.
[18] LI C S, YU J Z, WANG D F, et al.Efficient removal of zinc by multi-stress-tolerant yeast Pichia kudriavzevii A16[J].Bioresource Technology, 2016, 206:43-49.
[19] 赵春霞, 许国旺.基于液相色谱-质谱技术的代谢组学分析方法新进展[J].分析科学学报, 2014, 30(5):761-766.
ZHAO C X, XU G W.Progress of metabonomics technique based on liquid chromatography-mass spectrometry[J].Journal of Analytical Science, 2014, 30(5):761-766.
[20] 李春生. 库德毕赤酵母重金属积累特性及高盐/低pH下镉抗性提高机理研究[D].青岛:中国海洋大学, 2015.
LI C S.Heavy metal bioaccumulation characteristics and mechanisms of the improved cadmium tolerance at high NaCl concentrations or low pH in Pichia kudriavzevii[D].Qingdao:Ocean University of China, 2015.
[21] SAITO N, ROBERT M, KOCHI H, et al.Metabolite profiling reveals yihu as a novel hydroxybutyrate dehydrogenase for alternative succinic semialdehyde metabolism in Escherichia coli[J].Journal of Biological Chemistry, 2009, 284(24):16 442-16 451.
[22] 刘鸽. 镉和无机砷对三疣梭子蟹毒性作用机制研究[D].上海:上海海洋大学, 2021.
LIU G.Studies on the toxicity mechanism of cadmium and inorganic arsenic in Portunus trituberculatus[D].Shanghai:Shanghai Ocean University, 2021.
[23] LI C X, LI P, TAN Y M, et al.Metabolomic characterizations of liver injury caused by acute arsenic toxicity in zebrafish[J].PLoS One, 2016, 11(3):e0151225.
[24] PALANIAPPAN P R, VIJAYASUNDARAM V.The effect of arsenic exposure and the efficacy of DMSA on the proteins and lipids of the gill tissues of Labeo rohita[J].Food and Chemical Toxicology, 2009, 47(8):1 752-1 759.
[25] 李丽杰, 贺敏, 贺银凤, 等.酵母菌对重金属的吸附与抗性和解毒重金属的胞内分子机制研究进展[J].食品科学, 2019, 40(3):330-337.
LI L J, HE M, HE Y F, et al.Recent advances in understanding the adsorption and resistance of yeast to heavy metals and molecular mechanism for intracellular detoxification of heavy metals[J].Food Science, 2019, 40(3):330-337.
[26] SCOTT N, HATLELID K M, MACKENZIE N E, et al.Reactions of arsenic(III) and arsenic(V) species with glutathione[J].Chemical Research in Toxicology, 1993, 6(1):102-106.