能源一直是人类社会高速发展的驱动力,随着化石能源的逐渐枯竭,寻求获取新能源的途径是当下迫切需要解决的问题。微藻作为第三代新生物质能源,基于其环保、可再生等特性,受到了广泛的关注。然而,要想实现微藻中生物柴油的大规模生产,首先要解决的是其养殖、收获和提取步骤中的低产量和高成本限制的问题[1]。基于这个出发点考虑,微藻的生物量和油脂生产率的优化将是藻类生物燃料生产中的研究重点[2]。微藻的生物质积累常发生在胁迫环境下,常见的例如高光照、营养限制、pH胁迫、高温、高盐度、重金属等[3]。在这些胁迫环境中,盐胁迫已被证明是刺激各种微藻油脂积累的较为有效的途径[4]。然而,逆境胁迫又可能会抑制微藻的生长代谢,并且代谢产物的产生会降低微藻的整体生长力,增加生物燃料生产的成本[5]。
有研究表明,在非生物胁迫的条件下,植物激素能够在一定程度上促进微藻的生长,并且能够在胁迫环境中进一步促进藻体内油脂的积累,提高微藻对逆境的耐受能力[6]。2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)是一种植物生长调节剂,对于促进微藻的生长,提高微藻的油脂、叶绿素及蛋白质含量等方面作用显著,在郝宗娣等[7]的研究中发现2,4-D为调控小球藻生长及油脂贮存的最理想添加物。同时,2,4-D还可通过提高微藻细胞内抗氧化酶的活性,保护微藻细胞免受过氧化的损害[8]。由此说明,植物激素可能会提高微藻在非生物胁迫下氧化应激能力,调节它的生物量和其他高价值代谢物的生产[9]。但是,目前利用植物激素与非生物胁迫的组合来共同促进微藻的生长与油脂合成的研究很少[10]。本研究以原始小球藻为研究对象,首先优化了在一系列NaCl浓度下小球藻的油脂含量,并在优化后的NaCl处理下应用了一定浓度范围的2,4-D以获得更高的油脂生产力。随后研究了2,4-D联合NaCl处理对小球藻其他生化成分以及脂肪酸成分的影响。通过利用植物激素联合盐胁迫的方法来提高小球藻的生物量及油脂含量,为工业化大规模培养微藻提出了一个有效的新策略。
1 材料与方法
1.1 材料与试剂
1.1.1 微藻及培养
本试验所用藻种(普通小球藻FACHB-8)由中国科学院淡水藻种库提供,所用的培养基为培养微藻常用到的BG11,在120 ℃高温灭菌后使用。在温度为(25±1) ℃、光照强度为5 000 lx、光暗比为16∶8的培养条件下连续培养6 d,通过曝气使小球藻均匀分布在培养基中。每组设置3个平行。
1.1.2 药品与试剂
试验所用试剂均为分析纯级,购自国药集团化学试剂有限公司。
1.1.3 仪器与设备
UV-1800PC紫外-可见分光光度计,上海美谱达仪器有限公司;SHZ-C水浴恒温振荡器、YXQ-LS-50S立式蒸汽灭菌锅,上海博讯实业有限公司;TG-16台式高速离心机,长沙英泰仪器有限公司;LGJ-10N真空冷冻干燥机,北京亚星仪科科技有限公司;Trace1310 ISQ气相色谱-质谱分析仪,ThermoFisher Scientific。
1.2 试验方法
1.2.1 影响因素试验
1.2.1.1 盐浓度对微藻生物量及油脂含量的影响
将不同含量的NaCl(0、5、10、20 g/L)分别加入到BG11培养基中,每1个浓度设置3个平行组,培养温度为(25±1) ℃、光照强度为5 000 lx、光暗比为16∶8,连续培养6 d。
1.2.1.2 2,4-D对微藻生物量以及油脂含量的影响
将不同含量的2,4-D(0、0.1、0.5、1、2 mg/L)分别加入到含有一定NaCl的BG-11培养基中,与1.2.1.1相同的培养条件,定期测小球藻的生物量及油脂含量。
1.2.2 生物量及油脂含量的测定
生物量的测定:小球藻的生物量测定采用干重法,首先用紫外-可见分光光度计在680 nm处测定不同稀释倍数下小球藻的吸光度(OD680)值,再测定藻液的干重并绘制藻生物量-OD680值标准曲线[11],R2=0.998 7,如公式(1)所示:
生物量/(g·L-1)=0.391 5×OD680-0.004 6
(1)
微藻油脂的测定:采用氯仿-甲醇法测定小球藻中的油脂含量[12]。将小球藻冷冻干燥后精确称取50 mg藻体粉末与5 mL V(氯仿)∶V(甲醇)=2∶1混合,在室温的条件下超声破碎30 min,然后在150 r/min下振荡3 h,萃取充分后溶剂相通过离心机7 000 r/min离心10 min获得,同样的过程重复1遍后将收集到的溶剂相于干燥称量好的称量杯中(m1),将装有溶剂相的称量杯(m2)放入80 ℃的烘箱中烘干至恒重并计算其油脂含量,油脂含量的计算如公式(2)所示:
油脂含量![]()
(2)
1.2.3 叶绿素a、类胡萝卜素含量的测定
取1.5 mL小球藻藻液于2 mL离心管中,13 400 r/min离心5 min,去上清液后加入1.5 mL甲醇,振荡使藻渣分离完全,于45 ℃水浴避光热提30 min,13 400 r/min离心5 min得上清液,稀释后用分光光度计在480、652、665、750 nm下测其吸光度。其中A480、A652、A665需用A750校正,即减去A750的值,相关计算公式(3)、公式(4)所示:
叶绿素a/(mg·L-1)=
(3)
类胡萝卜素![]()
(4)
式中:n,稀释倍数;V,所取小球藻藻液体积。
1.2.4 碳水化合物含量的测定
在20 mL试管中加入稀释后的小球藻藻液2 mL、蒽酮乙酸乙酯溶液0.5 mL和浓硫酸(相对密度1.84)5 mL,充分振荡,摇匀,立即置沸水浴中准确计时1 min,取出冷却至室温后,在625 nm处检测其吸光度,根据国标蒽酮-乙酸乙酯法绘制标准曲线,对照标准曲线即可得小球藻碳水化合物含量[11]。
1.2.5 可溶性蛋白含量的测定
精密称取3个20 mg藻粉于10 mL离心管中,分别加入3 mL PBS溶液,经超声波破碎(功率为240 W,40%),破碎时间为2 min,破碎后,将其倒入50 mL离心管,并用17 mL PBS冲洗多次至无残留,10 000 r/min离心10 min后,取离心后的藻液备用,并按照考马斯亮蓝G-250染色法测定小球藻细胞内可溶性蛋白含量[13]。
1.2.6 脂肪酸成分及含量的测定
向所提取的油脂中加入2 mL 3%(体积分数)的硫酸/甲醇溶液,在70 ℃的水浴中回流3 h进行脂肪酸甲酯化,加入2 mL正己烷,振荡提取4 h,吸取正己烷相进行气相色谱-质谱联用(gas chromatography-mass spectrometry,GS-MS)分析。
1.2.7 数据统计分析
试验所有数据均用平均值±标准偏差表示,采用Origin绘图,SPSS 18.0统计软件进行单因素ANOVA分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 NaCl胁迫对小球藻生物量及油脂含量的影响
由图1-a可知,对照组与实验组在前4 d的生物量没有明显差异,从第4天开始出现较显著的差异。对照组的小球藻在接种第4天开始进入对数生长期,而实验组随着NaCl的加入抑制了小球藻的生长,并随着培养基中NaCl浓度升高,微藻的生长越趋缓慢。与对照组相比,在添加5、10、20 g/L NaCl的实验组中,小球藻生物量分别下降了17.72%、30.70%、40.74%。然而,油脂含量的积累情况与生物量的趋势相反。如图1-b所示,在一定浓度NaCl的胁迫下,随着NaCl浓度的升高,油脂含量也逐渐增加,添加10 g/L NaCl的实验组在培养至第6天时油脂含量达到峰值,约为(24.35±2.50)%,比对照组显著高了35%,而此时小球藻的生物量仅为对照组的59.55%。这种实验现象可能归因于NaCl处理过程中的活性氧(reactive oxygen species,ROS)积累,ROS通过上调与油脂生物合成的相关基因来促进油脂的积累[14]。但过量的ROS会破坏细胞中的大分子物质,同时盐胁迫带来的高渗透失水效应也会对小球藻细胞造成损伤,降低小球藻对光能的吸收与转化,从而抑制微藻的生长[15]。当盐浓度过高时,油脂含量的增长出现抑制(如图1-b,第6天)可能是由于在长时间的高盐胁迫环境下,微藻细胞的呼吸作用加强从而导致储存能量的化合物(如淀粉和脂质等)降解[16]。
综上,NaCl的添加可以增加小球藻的油脂含量,但由于其对生物量的抑制,导致小球藻的油脂生产力随着NaCl浓度升高由(147.74±0.57) mg/(L·d)下降至(87.56±0.38) mg/(L·d)(表1)。当NaCl质量浓度为20 g/L时,小球藻的油脂生产力仅约为对照组的70%。综合考虑下,本实验选择10 g/LNaCl的实验组后续添加2,4-D,以期降低NaCl对小球藻生长的抑制作用,能够在提高油脂含量的同时增加小球藻的生物量。

a-生物量;b-油脂含量
图1 不同浓度NaCl对小球藻的生物量与油脂含量的影响
Fig.1 The biomass and oil content of Chlorella vulgaris under the condition of adding different concentrations of NaCl
注:不同小写字母表示差异显著(P<0.05)
表1 NaCl处理下小球藻的生物量、生物生产力、油脂产量与油脂生产力
Table 1 The biomass, biomass productivity, oil production and oil production of Chlorella vulgaris under NaCl treatment

培养方式生物量/(g·L-1)生物生产力/[(mg·(L·d)-1]油脂产量/(g·L-1)油脂生产力/[(mg·(L·d)-1]BG-110.89±0.01a147.7±0.57a0.16±0.02a26.57±0.10a5 g/L NaCl0.73±0.01b121.54±0.26b0.15±0.01a25.59±0.20b10 g/L NaCl0.61±0.01c102.36±0.12c0.15±0.01a24.92±0.03c20 g/L NaCl0.53±0.01d87.56±0.38d0.12±0.01a18.64±0.12d
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 2,4-D与NaCl联合培养对小球藻生物量及油脂含量的影响
如图2-a所示,2,4-D的添加显著增加了小球藻的生物量,在第6天时,添加了0.1、0.5、1、2 mg/L的2,4-D联合实验组与单独2,4-D实验组的生物量比单独盐胁迫组分别提高了45.60%、55.45%、55.00%、53.70%与57.93%。此外,2,4-D的添加也增加了小球藻的油脂含量,从图2-b中可以看到随着所添加的2,4-D浓度的增大,小球藻的油脂含量也不断提高。添加2 mg/L 2,4-D的联合实验组在第4天时油脂含量达到了(26.90±0.50)%,分别比单独盐胁迫组(24.35±2.50)%与对照组(19.20±1.21)%获得的最高油脂含量显著高出10.47%与40.10%,其油脂生产力也达到了(41.32±0.59) mg/(L·d),是单盐胁迫时的1.66倍(表2)。试验说明了2,4-D与NaCl的组合不但可以提高小球藻的生物量,提高它对盐的耐受能力,其对油脂的积累也优于单盐胁迫下的小球藻。
2.3 2,4-D与NaCl联合培养对小球藻生化指标的影响
在2,4-D与NaCl的联合培养下,还测定了小球藻的叶绿素a、类胡萝卜素、碳水化合物和可溶性蛋白的含量。当微藻处于胁迫环境下,细胞的氧化应激能力会发生改变,以应对不适环境下产生的大量ROS。此前已经有研究表示色素对于各种胁迫条件下微藻细胞的抗氧化能力有着至关重要的作用,因此可以通过定量测定色素中的叶绿素a含量与类胡萝卜素含量来评估2,4-D和NaCl联合培养的小球藻对其脂质积累的潜在影响。如图3-a所示,小球藻的叶绿素a含量随培养时间增长均上升,而对照组与添加了2,4-D的小球藻中叶绿素a含量的上升速度显著高于只添加NaCl的小球藻,这与上述实验中的生物量变化(图2-b)趋势相似。2,4-D与NaCl联合培养下的小球藻中叶绿素a含量在第6天达到(12.19±0.08) mg/L,仅次于单独2,4-D实验组中的叶绿素a含量,比单盐胁迫时高18%。之前有研究表示,在高盐胁迫的过程中叶绿素a的降低与脂质的合成增强有关,这是由于光合作用中的碳源被用于生成脂质、碳水化合物和蛋白质等生物大分子,从而使小球藻从快速生长阶段过渡到了生物质合成阶段[17]。由此说明,2,4-D的添加能够改变小球藻细胞中碳源的转化,提高叶绿素a含量,增强其光合作用效率从而提高了小球藻的生物量。图3-b中的类胡萝卜素含量在不同培养条件下的变化与叶绿素a的变化类似,2,4-D与NaCl联合培养下比单盐胁迫时高17.77%。类胡萝卜素是一种天然抗氧化剂,因此2,4-D的添加对小球藻在盐胁迫下清除过量的ROS也有着重要意义。
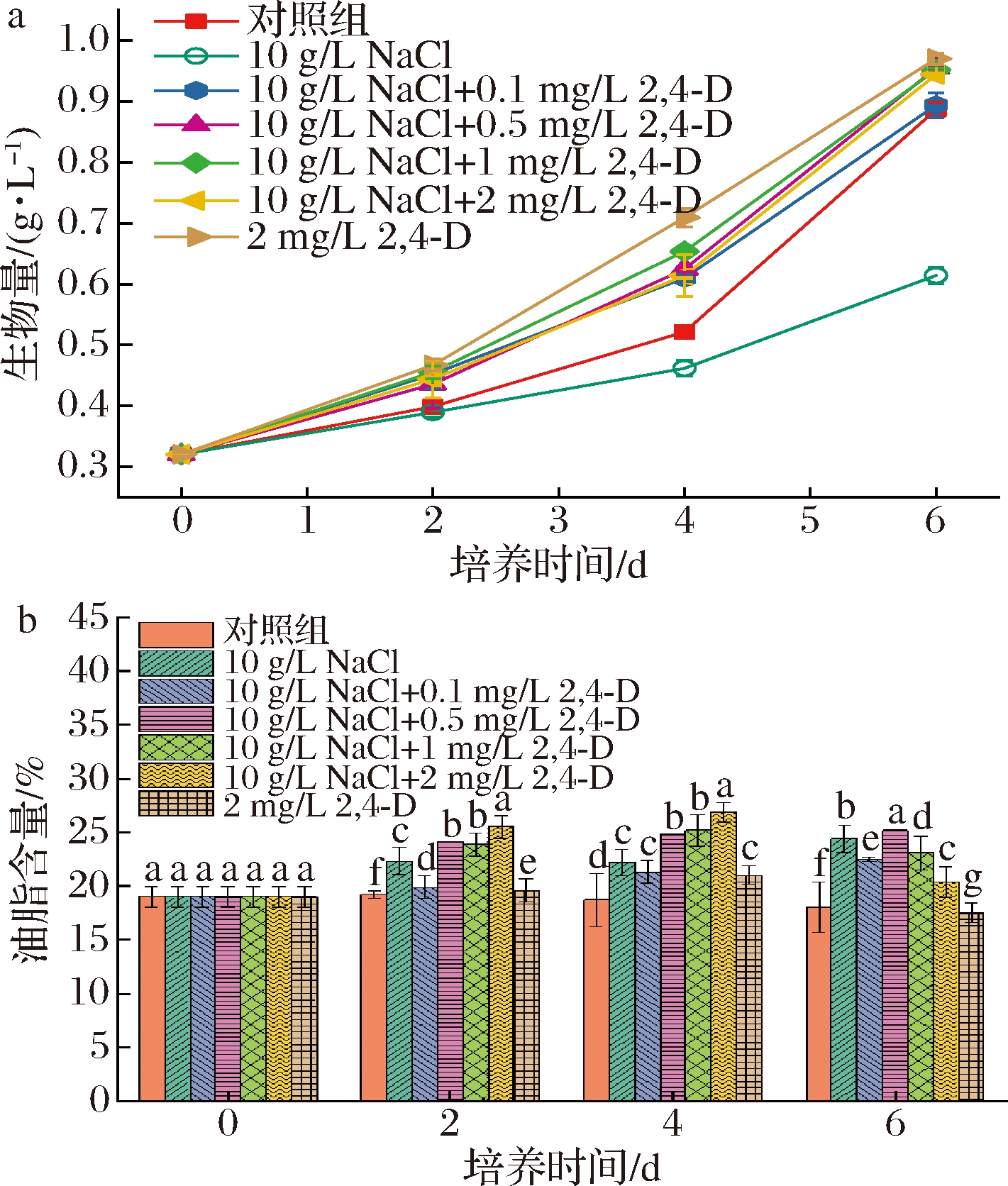
a-生物量;b-油脂含量
图2 不同浓度2,4-D对小球藻的生物量与油脂含量的影响
Fig.2 The biomass and lipid content of Chlorella vulgaris under the condition of adding different concentrations of 2,4-D
表2 2,4-D与NaCl联合处理下小球藻的生物量、生物生产力、油脂产量与油脂生产力
Table 2 The biomass, biomass productivity, oil production and oil production of Chlorella vulgaris under the combined treatment of 2,4-D and NaCl

培养方式生物量/(g·L-1)生物生产力/[mg·(L·d)-1]油脂产量/(g·L-1)油脂生产力/[mg·(L·d)-1]10 g/L NaCl0.46±0.01d102.36±0.57f0.13±0.01bc24.92±0.11f10 g/L NaCl +0.1 mg/L 2,4-D0.61±0.01c152.49±0.12e0.13±0.01bc33.83±0.10d10 g/L NaCl +0.5 mg/L 2,4-D0.62±0.01bc156.18±0.56c0.15±0.01abc33.32±0.03e10 g/L NaCl +1 mg/L 2,4-D0.65±0.01b163.43±0.73b0.16±0.01ab41.18±0.12b10 g/L NaCl +2 mg/L 2,4-D0.61±0.01c153.59±0.37d0.17±0.01a41.32±0.59a2 mg/L 2,4-D0.71±0.01a177.25±1.2a0.12±0.01c37.22±0.09c
图3-c为在不同培养条件下碳水化合物含量随时间的变化趋势。如图所示,单独2,4-D实验组的小球藻细胞中的碳水化合物在第2天迅速下降至(13.28±0.02)%,随后缓慢上升。这可能是因为在2,4-D的刺激下,培养初期细胞的快速生长活动会消耗大量的葡萄糖、淀粉等初级能源物质,因此造成了碳水化合物的减少。随着2,4-D的消耗,微藻生长变慢,碳水化合物开始积累[18]。单独NaCl实验组和2,4-D与NaCl联合实验组的小球藻细胞中的碳水化合物含量下降速度显著小于单独2,4-D实验组,并分别在第6天与第4天达到最低,而它们在这一天均获得了各自培养条件下的最高油脂含量[分别为(24.35±2.50)%和(26.90±0.50)%]。HO等[19]也在实验中发现高盐胁迫下微藻细胞内碳水化合物的含量会减少,并且减少的碳水化合物以碳源及能量的形式转移到脂质中。因此,盐胁迫下的碳水化合物含量的降低与油脂积累有着密切的关联。图3-d为培养过程中小球藻细胞中可溶性蛋白含量的趋势图,单独添加2,4-D的实验组中可溶性蛋白含量由(6.82±0.04)%逐渐增加到(9.40±0.09)%,2,4-D与NaCl联合实验组中可溶性蛋白含量也达到(9.32±0.22)%,它们分别比单盐胁迫实验组中的可溶性蛋白含量高29.66%与28.55%,2,4-D的添加显著增加了小球藻在盐胁迫中的可溶性蛋白的合成。
2.4 2,4-D与NaCl联合培养对小球藻脂肪酸组成的影响
微藻细胞内脂肪酸的构成是判断其是否可以作为生物柴油原料的重要指标。表3所示为通过几种不同的方式培养后的小球藻细胞中的脂肪酸组成,所有实验组的脂肪酸均分布约16~18个碳原子,适合生物柴油的生产。与对照组相比,2,4-D与NaCl联合处理的实验组中,饱和脂肪酸(saturated fatty acid,SFA)含量达到最高,为37.79%,比对照组高出15.50%。单不饱和脂肪酸(monounsaturated fatty acid,MUFA)也比对照组提高了22.12%,而它的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)显著下降,从而使得不饱和度(degree of unsaturation,DU)下降至102.79,比对照组低了约12%。微藻的油脂作为生物柴油,较低的PUFA会使其生产的柴油品质更好,较低的DU也会使小球藻的氧化稳定性有显著的提高[20]。因此,2,4-D联合NaCl处理后的小球藻可以获得更具有市场价值的生物柴油。
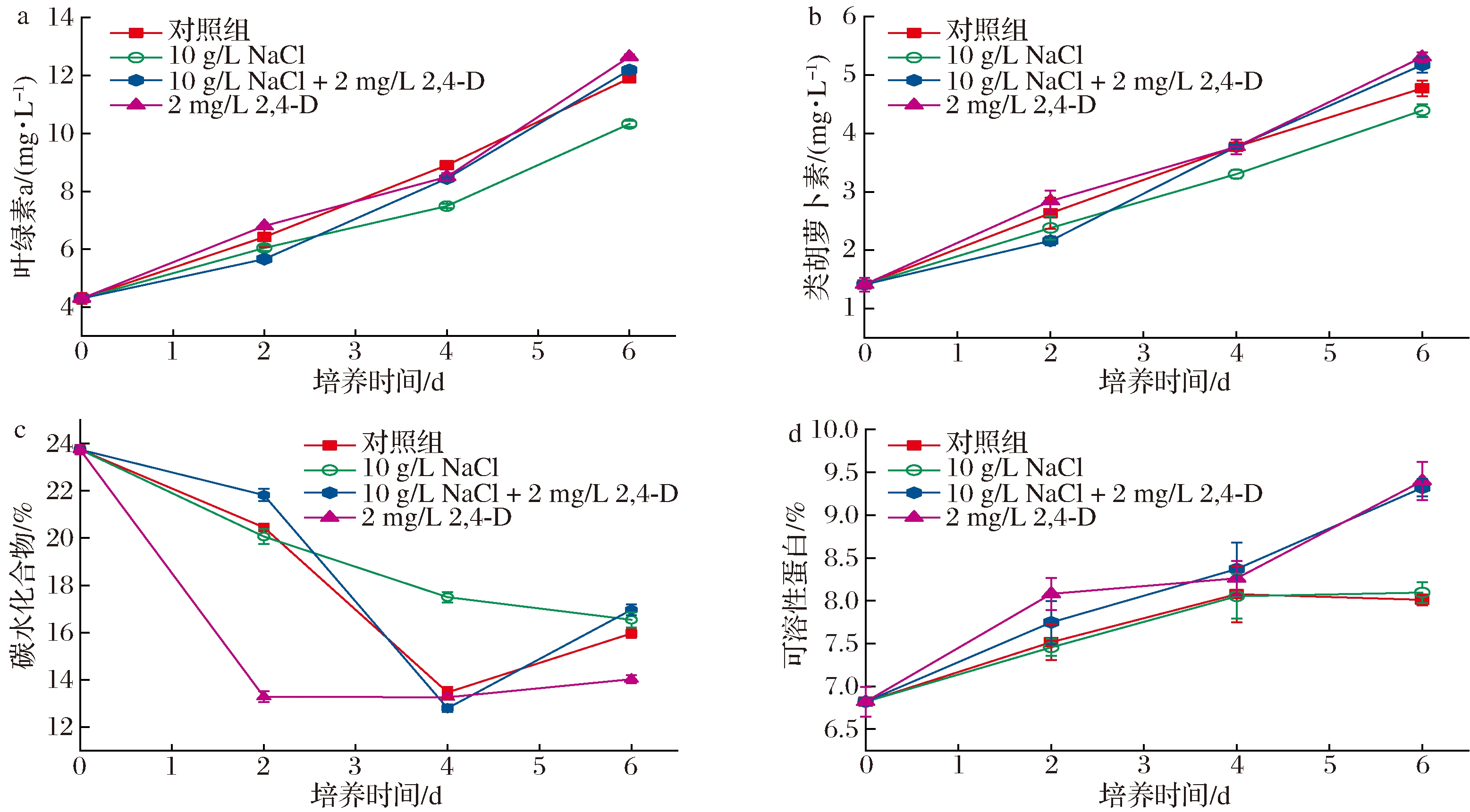
a-叶绿素a含量;b-类胡萝卜素含量;c-碳水化合物含量;d-可溶性蛋白含量
图3 不同处理条件对小球藻的叶绿素a、类胡萝卜素、碳水化合物和可溶性蛋白含量的影响
Fig.3 Effects of different treatment conditions on chlorophyll a content, carotene content, carbohydrate content and soluble protein content of Chlorella vulgaris
表3 不同条件下小球藻的脂肪酸组成
Table 3 Fatty acid composition of Chlorella vulgaris under different conditions
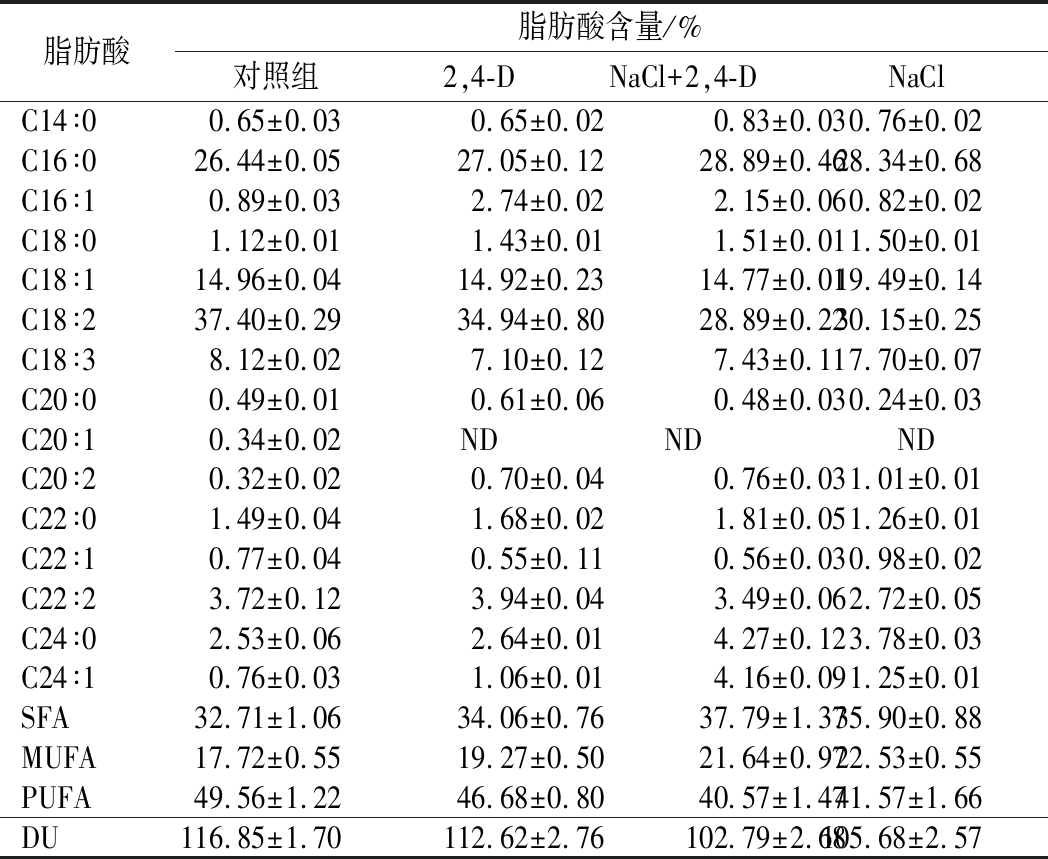
脂肪酸脂肪酸含量/%对照组2,4-DNaCl+2,4-DNaClC14∶00.65±0.030.65±0.020.83±0.030.76±0.02C16∶026.44±0.0527.05±0.1228.89±0.4628.34±0.68C16∶10.89±0.032.74±0.022.15±0.060.82±0.02C18∶01.12±0.011.43±0.011.51±0.011.50±0.01C18∶114.96±0.0414.92±0.2314.77±0.0119.49±0.14C18∶237.40±0.2934.94±0.8028.89±0.2230.15±0.25C18∶38.12±0.027.10±0.127.43±0.117.70±0.07C20∶00.49±0.010.61±0.060.48±0.030.24±0.03C20∶10.34±0.02NDNDNDC20∶20.32±0.020.70±0.040.76±0.031.01±0.01C22∶01.49±0.041.68±0.021.81±0.051.26±0.01C22∶10.77±0.040.55±0.110.56±0.030.98±0.02C22∶23.72±0.123.94±0.043.49±0.062.72±0.05C24∶02.53±0.062.64±0.014.27±0.123.78±0.03C24∶10.76±0.031.06±0.014.16±0.091.25±0.01SFA32.71±1.0634.06±0.7637.79±1.3735.90±0.88MUFA17.72±0.5519.27±0.5021.64±0.9722.53±0.55PUFA49.56±1.2246.68±0.8040.57±1.4741.57±1.66DU116.85±1.70112.62±2.76102.79±2.68105.68±2.57
注:ND为未检出
3 结论
本研究在盐胁迫的条件下添加植物激素2,4-D,探究这种培养条件对小球藻的生物量及油脂积累的影响。研究结果表明,小球藻在2 mg/L 2,4-D 与10 g/L NaCl 联合培养的条件下能够获得最高油脂生产力。同时实验证实了2,4-D的添加不仅提高了小球藻的总脂含量还进一步改善了其脂肪酸的构成,提高了微藻作为生物柴油的品质,对实际中生产微藻生物柴油具有一定的指导意义。另外,根据分析结果推测小球藻细胞内的叶绿素a、类胡萝卜素、碳水化合物等生理生化指标的变化与油脂的积累可能存在潜在关系,而对于这种潜在关系以及油脂积累的原因还需以后从分子水平进一步分析。
[1] ZHAO Y T, WANG H P, HAN B Y, et al.Coupling of abiotic stresses and phytohormones for the production of lipids and high-value by-products.by microalgae:A review[J].Bioresource Technology, 2019, 274:549-556.
[2] RUIZ J, OLIVIERI G, DE VREE J, et al.Towards industrial products from microalgae[J].Energy & Environmental Science, 2016, 9(10):3 036-3 043.
[3] HANG L T, MORI K, TANAKA Y, et al.Enhanced lipid productivity of Chlamydomonas reinhardtii with combination of NaCl and CaCl2 stresses[J].Bioprocess and Biosystems Engineering, 2020, 43(6):971-980.
[4] QIAO T S, ZHAO Y T, ZHONG D B, et al.Hydrogen peroxide and salinity stress act synergistically to enhance lipids production in microalga by regulating reactive oxygen species and calcium[J].Algal Research, 2021, 53:102017.
[5] 韩飞. 高温胁迫与超声刺激促进微藻油脂积累的过程及机理[D].济南:山东大学, 2016.
HAN F.The mechanism of microalgae lipid accumulation induced by high-temperature stress and ultrasonic stimulation[D].Jinan:Shandong University, 2016.
[6] LI D F, ZHAO Y T, DING W, et al.A strategy for promoting lipid production in green microalgae Monoraphidium sp.QLY-1 by combined melatonin and photoinduction[J].Bioresource Technology, 2017, 235:104-112.
[7] 郝宗娣, 刘平怀, 时杰, 等.不同植物激素对原始小球藻生长及油脂含量的影响[J].广东农业科学, 2012, 39(8):104-107.
HAO Z D, LIU P H, SHI J, et al.Effects of phytohormone on growth and fatty acid composition of Chlorella vulgaris[J].Guangdong Agricultural Sciences, 2012, 39(8):104-107.
[8] 史成颖, 蔡为荣, 甘旭华, 等.6种植物生长调节剂对钝顶螺旋藻生长的影响[J].安徽农业大学学报, 2004, 31(1):26- 29.
SHI C Y, CAI W R, GAN X H, et al.Effects of six plant growth regulators on the growth of Spirulina platensis A9[J].Journal of Anhui Agricultural University, 2004, 31(1):26- 29.
[9] ZHANG L J, PEI H Y, CHEN S Q, et al.Salinity-induced cellular cross-talk in carbon partitioning reveals starch-to-lipid biosynthesis switching in low-starch freshwater algae[J].Bioresource Technology, 2018, 250:449-456.
[10] BABU A G, WU X G, KABRA A N, et al.Cultivation of an indigenous Chlorella sorokiniana with phytohormones for biomass and lipid production under N-limitation[J].Algal Research, 2017, 23:178-185.
[11] 崔演斌. 胁迫条件下蛋白核小球藻产油过程生理生化及油脂合成关键基因表达规律的研究[D].上海:华东理工大学, 2013.
CUI Y B.The physiological features and expression patterns of key genes in lipid synthesis pathway of Chlorella pyrenoidosa under stress conditions[D].Shanghai:East China University of Science and Technology, 2013.
[12] 张磊. 胁迫条件下蛋白核小球藻胞内活性氧介导油脂生物合成的机制研究[D].重庆:重庆大学, 2019.
ZHANG L.Regulatory mechanism of cellular reactive oxygen species on lipid biosynthesis in Chlorella pyrenoidosa under stress conditions[D].Chongqing:Chongqing University, 2019.
[13] 焦洁. 考马斯亮蓝G-250染色法测定苜蓿中可溶性蛋白含量[J].农业工程技术, 2016, 36(17):33-34.
JIAO J.Determination of soluble protein content in alfalfa by Coomassie brilliant blue G-250 staining method[J].Agricultural Engineering Technology, 2016, 36(17):33-34.
[14] LI X M, LI X Y, HAN B Y, et al.Improvement in lipid production in Monoraphidium sp.QLY-1 by combining fulvic acid treatment and salinity stress[J].Bioresource Technology, 2019, 294:122179.
[15] SRIVASTAVA G, NISHCHAL GOUD V V.Salinity induced lipid production in microalgae and cluster analysis (ICCB 16-BR_O47)[J].Bioresource Technology, 2017, 242:244-252.
[16] ZHAO Y, LI D, DING K, et al.Production of biomass and lipids by the oleaginous microalgae Monoraphidium ap.QLY-1 through heterotrophic cultivation and photo-chemical modulator induction[J].Bioresource Technology, 2016, 211:669-676.
[17] 王涛. 原壳小球藻筛选/异养培养优化及盐胁迫下油脂积累机理研究[D].上海:华东理工大学, 2016.
WANG T.Specie screening/heterotrophic culture optimization of Chlorella protothecoides and research on mechanisms of lipid accumulation under salt stress[D].Shanghai:East China University of Science and Technology, 2016.
[18] YU X J, SUN J, SUN Y Q, et al.Metabolomics analysis of phytohormone gibberellin improving lipid and DHA accumulation in Aurantiochytrium sp.[J].Biochemical Engineering Journal, 2016, 112:258-268.
[19] HO S H, NAKANISHI A, KATO Y, et al.Dynamic metabolic profiling together with transcription analysis reveals salinity-induced starch-to-lipid biosynthesis in alga Chlamydomonas sp.JSC4[J].Scientific Reports, 2017, 7(1):45471.
[20] GOUR R S, GARLAPATI V K, KANT A.Effect of Salinity Stress on lipid accumulation in Scenedesmus sp.and Chlorella sp.:Feasibility of stepwise culturing[J].Current Microbiology, 2020, 77(5):779-785.