食品级乳化剂可分为天然大分子乳化剂和小分子表面活性剂,天然大分子乳化剂主要有大豆分离蛋白、阿拉伯胶、酪蛋白酸钠等,小分子表面活性剂主要有蔗糖酯、司盘、吐温等[1]。目前,食品工业比较常用乳化剂有酪蛋白酸钠、蔗糖酯。酪蛋白酸钠(sodium caseinate, SC)是一种具有特定亲水基团和疏水基团的线性蛋白[2],具有良好的乳化活性和乳化稳定性[3],但是由于我国奶源紧缺以及复杂的加工工艺,造成SC价格昂贵,在食品工业中很难得到广泛的应用。蔗糖脂肪酸酯(sugar esters, SE)是一种小分子表面活性剂,是由脂肪酸和蔗糖经过酯化反应化学合成的食品添加剂[4],由于亲水性的蔗糖基团和亲脂性的脂肪酸基团,其拥有良好的乳化性,并且具有无毒和不过敏的潜力,被人们广泛应用于食品、医药和化妆品领域[5]。与之相比,大豆分离蛋白(soybean protein isolate, SPI)是通过在低温条件下将豆粕中的油脂、水溶性非蛋白质成分除去后的大豆蛋白[6],是一种价格低廉、资源丰富、品质优良[7]的天然乳化剂,因其具有良好的乳化和凝胶性能[8],受到了人们越来越多的关注。
目前,食品安全问题和食品加工技术的不断发展,食品产业倾向于采用天然的乳化剂来代替传统化学合成、成本较高的一些常用乳化剂。由于SPI具有良好的价格优势和潜在的乳化性能,近几年来一直是国内外学者的研究热点。KEERATI-U-RAI等[9]研究了大豆分离蛋白稳定水包油乳液在75、95 ℃两种不同温度下加热前后的理化性质,结果表明加热会引起液滴的聚集,导致乳液粒径和体积黏度的增加。HUANG等[10]研究了超声波和酸对大豆分离蛋白聚集性、结构和乳化性能的影响,发现超声和酸的协同作用可以显著提高大豆分离蛋白的乳化性能。肖连冬等[11]研究发现大豆分离蛋白浓度、pH、加热温度、NaCl浓度等因素与大豆分离蛋白的乳化性和起泡性有着密切关系。对于SPI与其他常用食品乳化剂乳化能力的差异以及在不同条件下发生不稳定现象的机理差异等研究较少。鉴于此,本文在借鉴前人研究的基础上,通过试验确定了3种不同乳化剂(SPI、SC、SE)制备出稳定乳液的最低质量浓度,并在最低质量浓度下研究了外界环境因素对其乳析、粒径、微观结构的影响规律,以评估SPI、SC、SE 3种食品乳化剂的乳化性能的差异,有助于对食品工业中乳化剂的选择提供较全面的理论支持。
1 材料与方法
1.1 材料与试剂
葵花籽油,江西青龙高科油脂有限公司;SPI,山东禹王集团;SC,恒天然乳品有限公司;SE(S1170),日本三菱;尼罗蓝、尼罗红(分析纯),上海阿拉丁生化科技股份有限公司;1,2-丙二醇(分析纯),源叶生物科技有限公司。
1.2 仪器与设备
FS-2可调高速匀浆机,常州国华电器有限公司;HJ-6A多头磁力搅拌器、DF-101S集热式磁力搅拌器,金坛市城东新瑞仪器厂;超高压纳米均质机AH-NANO,ATS工业系统有限公司;电热恒温水浴锅,上海博泰实验设备有限公司;FA2204B电子天平,上海天美天平仪器有限公司;Mastersizer3000激光粒度仪,英国马尔文仪器有限公司;
1.3 实验方法
1.3.1 乳状液的制备
将SPI以1.0~50 g/L、SC以5.0~25 g/L、SE以0.1~5.0 g/L的浓度分散于去离子水中,然后于室温下搅拌2 h使其充分水合。乳化剂溶液中加入10%(体积分数)的葵花籽油,用高速匀浆机10 000 r/min转速下搅拌2 min,得到预乳液。预乳液在ATS高压均质机30 MPa条件下均质3次,得到乳液样品,用于进一步分析,筛选出稳定乳液的最低浓度。
1.3.2 环境压力对乳状液稳定性的影响
1.3.2.1 NaCl的添加对乳状液稳定性的影响
准确称取一定质量的NaCl分别添加至3种稳定乳液样品中,于室温下搅拌2 h使其充分溶解,以获得最终乳液样品浓度为0~0.3 mol/L的NaCl。然后将乳液样品(25 g)分别转移到玻璃试管(内径22 mm,高度100 mm)中,并在分析前在室温下储存24 h。
1.3.2.2 热处理对乳状液稳定性的影响
将3种稳定乳液样品(25 g)转移到玻璃试管(内径22 mm,高度100 mm)中,在70~100 ℃的水浴中加热20 min。对乳液样品121 ℃加热则是通过装有乳液样品的玻璃试管在高压灭菌锅中加热20 min。在分析之前,将乳液样品在室温下储存24 h。
1.3.3 乳状液粒径测定
用Mastersizer3000激光粒度仪测定乳状液中液滴的粒径d4,3。参照刘丽娅等[12]分析方法,参数设置为:分析模式-通用;进样器名称:Hydro LV;折射率:1.472;颗粒吸收率:0.001;分散剂:水;分散剂折射率:1.330;转速:3 000 r/min。本文主要采用d4,3即体积加权平均直径来表征液滴的平均粒径大小。每个样品重复测量3次,结果取平均值。粒径d4,3的大小从一定程度上反映乳状液的稳定性,粒径d4,3越小,表明乳状液越稳定。
1.3.4 乳析测定
参考刘丽娅等[12]的方法。取25 mL新鲜制备的乳液样品置于乳析管中,通过添加0.01%(质量分数)叠氮钠抑制微生物生长,将乳液样品储存在4 ℃环境下,定期对样品进行观察,拍照记录乳液样品分层的情况。
1.3.5 显微结构
乳状液样品的微观结构采用LSM800激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察。将制备好的乳状液样品,用去离子水稀释5倍,然后用尼罗红和尼罗蓝对蛋白质和油滴进行染色。尼罗红用于乳液中油相的染色,当油相被染色后,在显微照片中呈现出绿色;尼罗蓝用于乳液中蛋白质染色,当蛋白被染色后,在显微照片中呈现出红色。将1 mL等分试样放在有凹槽的载玻片上,盖上盖玻片,以防止液滴流动,倒置,分别使用2个激光激发源(488、633 nm)和两个接收通道对尼罗蓝和尼罗红进行分析[13]。
1.3.6 数据统计分析
为保证实验数据的准备性,每组实验都进行3次平行,并将实验数据进行误差分析。采用Origin 8.5软件绘图。
2 结果与分析
2.1 乳化剂质量浓度对不同乳液初始平均粒径和稳定性的影响
本试验测定了SPI、SC和SE在相同的均质乳化条件下制备的乳状液平均粒径d4,3随质量浓度增加的变化,以评估分析这3种常用食品乳化剂乳化性能的差异。如图1所示,随着乳化剂质量浓度的增加,SPI、SC和SE所制备乳状液的平均粒径d4,3逐渐减小;在分别达到一定细度后,d4,3不再随质量浓度的增加而有显著变化,说明浓度对这3种乳化剂的乳化能力都有显著影响。本试验发现SPI、SC和SE所制备的乳液达到最小细度的最低质量浓度分别为20、12、2.0 g/L,此时对应的平均粒径d4,3分别为(0.724±0.238)、(0.451±0.003)、(0.541±0.003) μm。通过CLSM观察分析发现(图2-a1、图2-b1、图2-c1),在上述浓度下所制备的乳液中液滴粒径细小且分布均匀,说明乳化形成的液滴已基本都被稳定了。乳化剂的乳化能力取决于其在乳化过程中形成和稳定细小液滴的能力[14],因此在本试验中3种乳化剂的乳化能力大小为:SE>SC>SPI。这一发现与文献报道一致[15-16]。这些结果表明,与蛋白类乳化剂相比,小分子表面活性剂能够在较低的浓度下制备出粒径细小并且稳定的乳状液。这是因为小分子表面活性剂的吉布斯-马兰戈尼效应[17],即液滴的表面张力随溶液中表面活性剂浓度的增加而降低(吉布斯弹性收缩),以及界面中的表面活性分子会自动向表面张力高的位置移动(马兰戈尼效应),在这种表面张力梯度的引发下,只需少量的SE即可制备出粒径细小且稳定的乳液。另外,SPI的乳化能力弱于SC是因为SC是线性蛋白,能够暴露出更多的疏水基团[18],乳化过程中可快速吸附到油水界面,而SPI主要含有β-伴大豆球蛋白和大豆球蛋白[19],乳化过程中球蛋白无法迅速展开,充分覆盖在油滴表面,因此制备出稳定乳液所需SPI的量高于SC。
另外,SPI、SC和SE在低浓度下所制备的乳液平均粒径都很大,但是乳液发生不稳定现象的机理却不时一样。如图2-a2所示,SPI乳液质量浓度为1.0 g/L,与SPI稳定乳液(20 g/L)相比,其粒径分布图发生了右移,并且观察到液滴之间发生桥联絮凝(图2-a3),而当SC、SE质量浓度分别为1.0、0.1 g/L时制备的乳液,通过CLSM观察到乳液滴只发生了聚结(图2-b3、图2-c3),而不存在絮凝的现象。这可能是因为SPI不足以包裹油滴,导致乳液滴的粒径增大;并且球状蛋白在油水界面上吸附和缓慢展开时相互交联在一起,加上商品化SPI中含有不溶性蛋白颗粒,使蛋白质与蛋白质之间相互交联,从而导致SPI乳液发生桥联絮凝,而分子柔性较高的线性蛋白SC和小分子表面活性剂因其疏水基团能够充分的吸附在油滴界面,当乳化剂不足以包裹油滴时,乳液滴发生聚结。
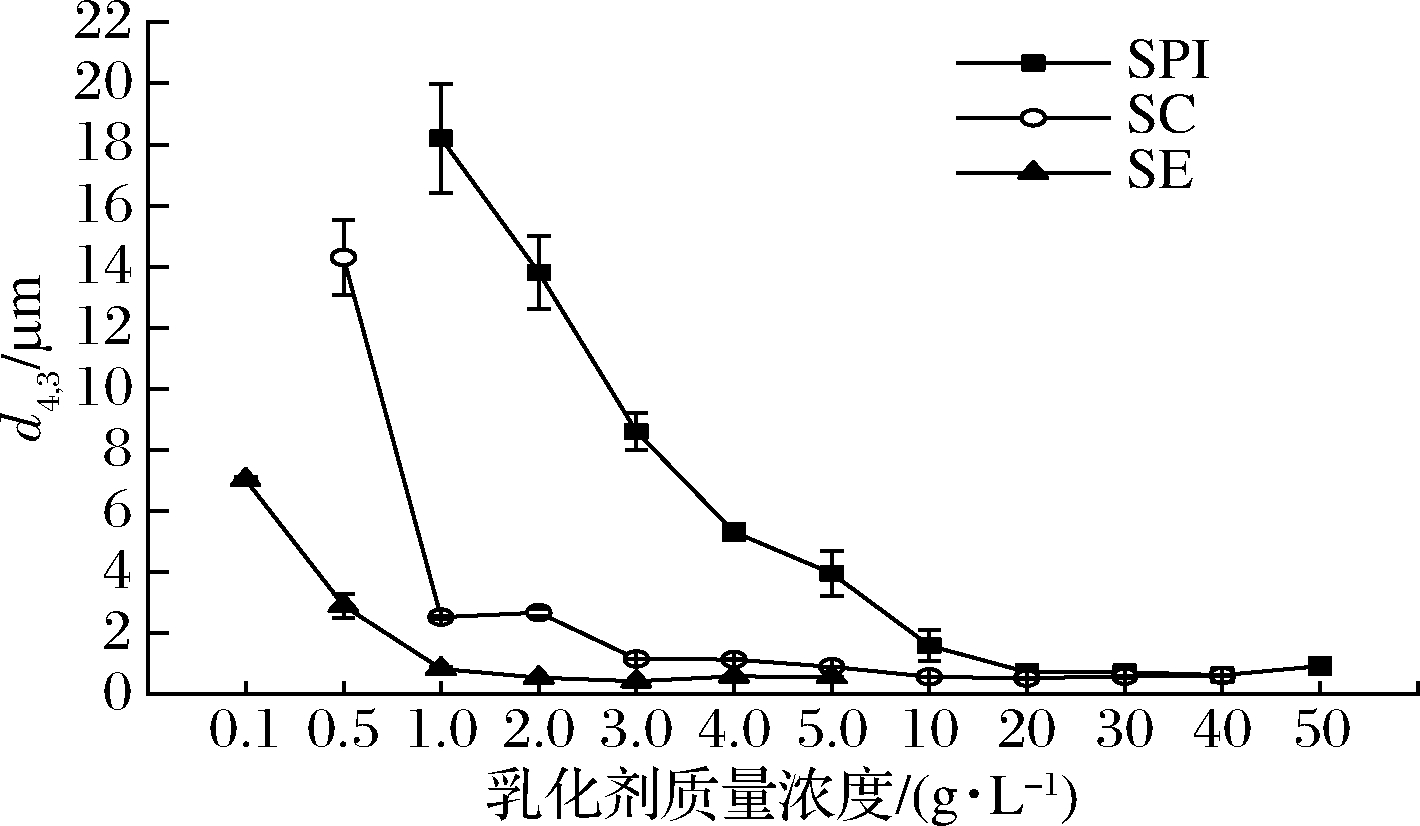
图1 不同乳化剂质量浓度对乳液粒径的影响
Fig.1 Effect of different emulsifier concentration on the particle size of emulsion

a1~3分别为SPI 20 g/L油相、1.0 g/L油相、1.0 g/L水相;b1~3 分别为SC 12 g/L油相、1.0 g/L油相、1.0 g/L水相;c1~3分别为SE 2.0 g/L油相、0.1 g/L油相、0.1 g/L水相
图2 浓度对乳液粒径分布、显微结构的影响
Fig.2 Effect of concentration on the particle size distribution and microstructure of emulsion
2.2 NaCl对不同乳液稳定性的影响
本试验研究了NaCl的添加对SPI乳液(SPI=20 g/L)、SC乳液(SC=12 g/L)和SE乳液(SE=2.0 g/L)平均粒径、乳析稳定性和微观结构的影响。如图3所示,随着NaCl浓度的升高,SPI乳液的粒径d4,3从0.678 μm增大至1.140 μm。而SC、SE稳定乳液粒径d4,3随NaCl浓度的增加不发生显著变化。然而在添加NaCl后,这3种乳化剂制备的稳定乳液在贮藏过程中都发生了明显的乳析现象。通过CLSM进一步观察发现,在添加NaCl后,SPI乳液、SC乳液和SE乳液都发生了不同程度的乳液滴絮凝,这可能是因为乳液滴之间的静电排斥作用对这3种乳液的稳定性都有非常重要的影响,而NaCl的添加使乳化剂发生了静电屏蔽作用,降低了乳液滴之间的静电排斥力[20],乳液滴因此发生聚集,并在静置贮藏过程中出现乳析现象。在添加NaCl后,SC乳液和SE乳液发生了明显的乳析现象,但是通过激光粒度分析仪所测定的乳液平均粒径d4,3却没有出现显著(P>0.05)变化,这一结果与文献报道一致[21],因为NaCl的静电屏蔽作用只能使SC和SE乳液发生比较弱的乳液滴絮凝,这种絮凝体在激光粒度分析仪测定分析时会被样品分散系统搅散,因此无法测定出絮凝体的真实大小。另一方面,值得注意的是在添加NaCl后,SPI乳液在静置贮藏过程中发生了乳析现象,而且平均粒径d4,3显著增大,这很可能是因为SPI是大分子球蛋白,在吸附到乳液滴表面后会缓慢展开并发生构象变化,原本位于球蛋白结构内部的疏水基团暴露出来,但由于大分子蛋白的空间位阻,这些暴露的疏水基团无法吸附到油滴表面;当乳液滴由于静电屏蔽作用发生絮凝,乳液滴之间相互接触,此时界面膜上暴露的蛋白疏水基团会由于疏水相互作用而紧密结合在一起,不会被激光粒度分析仪的样品分散系统搅散。
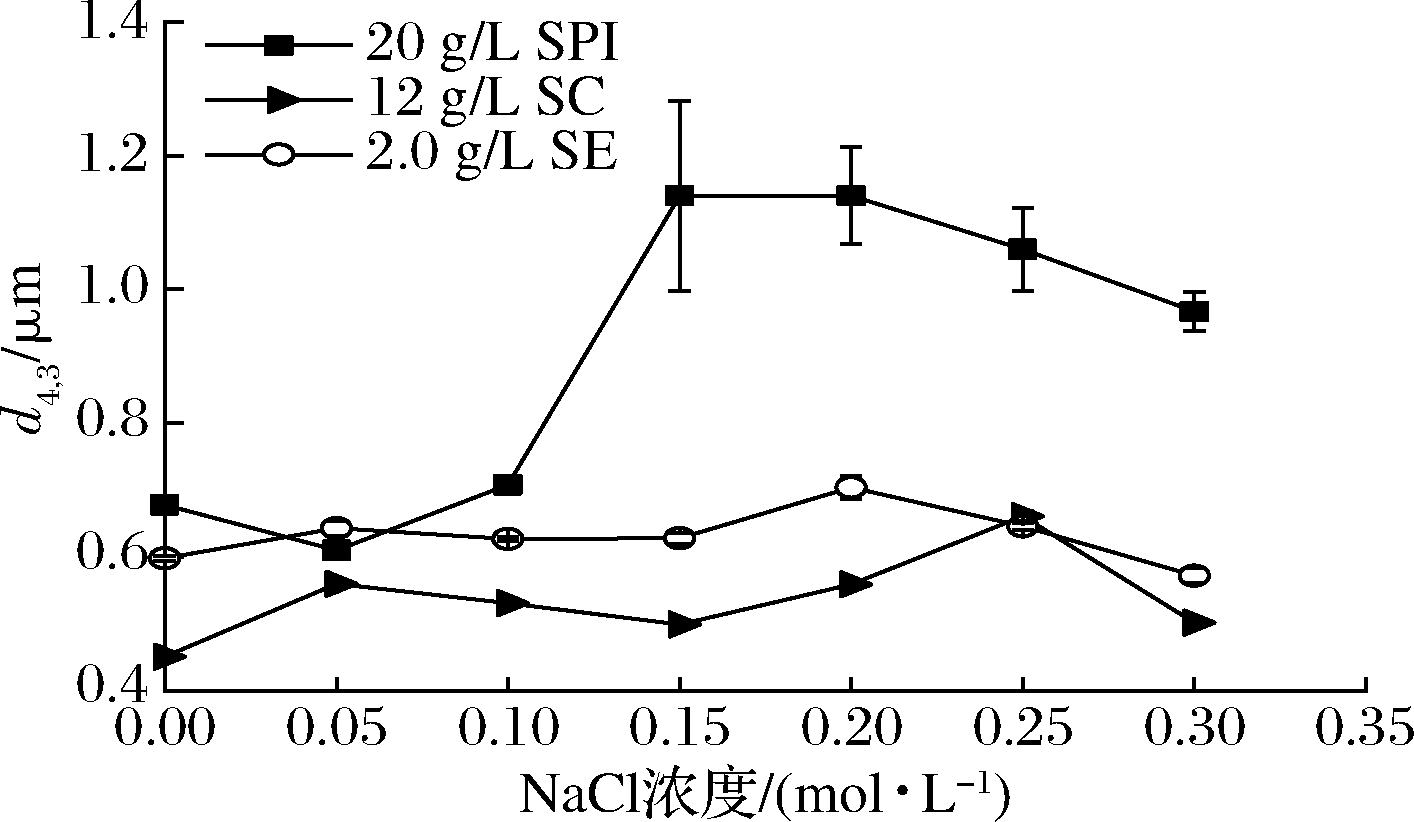
图3 NaCl浓度对乳液粒径d4,3的影响
Fig.3 Effect of NaCl concentration on emulsion particle size d4,3
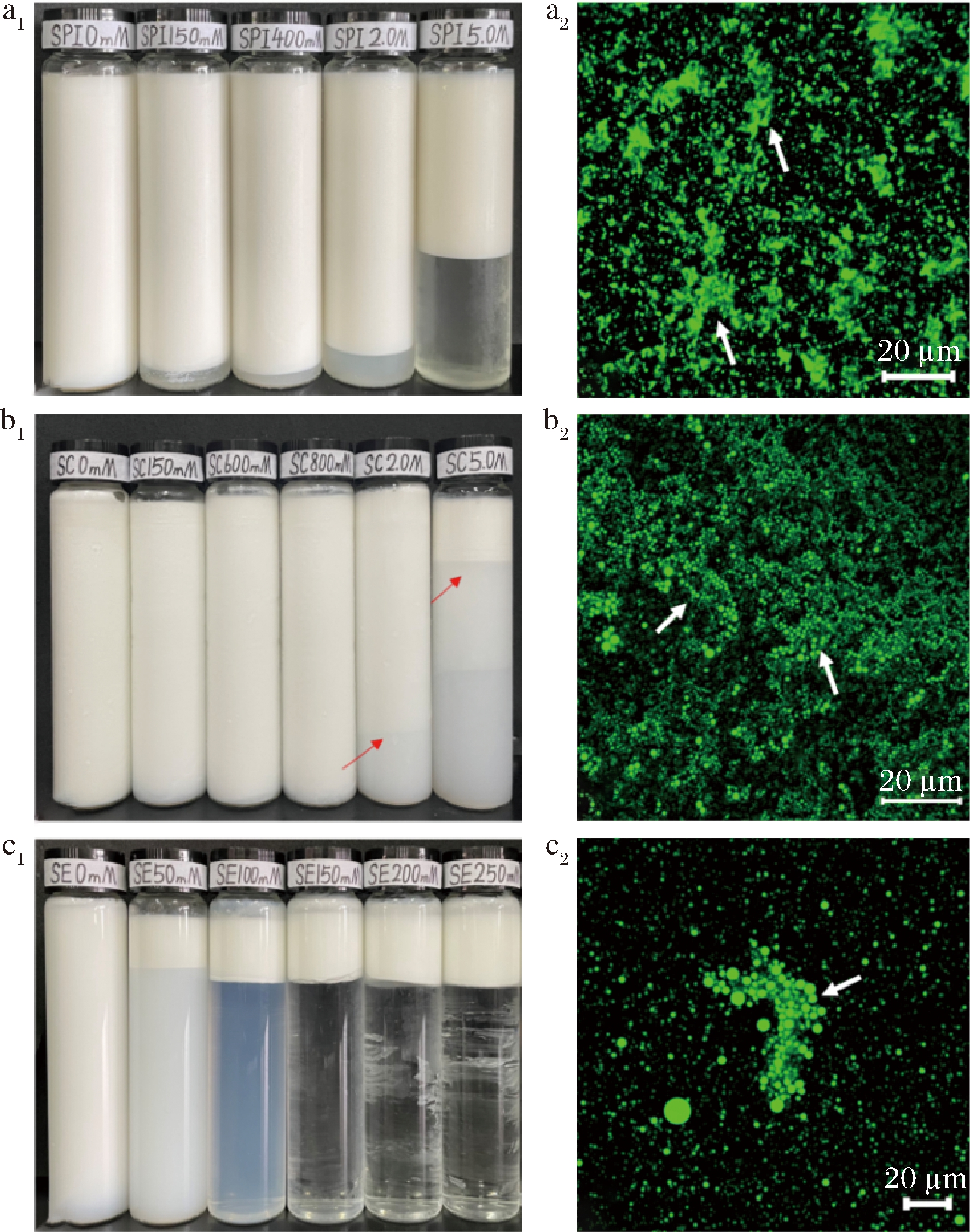
a~c1~2分别是SPI、SC、SE乳液的乳析现象、CLSM图
图4 NaCl浓度对乳析和显微结构的影响
Fig.4 Effect of NaCl concentration on emulsion precipitation and microstructure
2.3 高温加热对不同乳液稳定性的影响
本试验研究了热处理对SPI乳液(SPI=20 g/L)、SC乳液(SC=12 g/L)和SE乳液(SE=2.0 g/L)平均粒径、微观结构的影响。随着加热温度的升高,SPI乳液的粒径d4,3从1.14 μm增大至2.86 μm。而SC、SE稳定乳液粒径d4,3随温度的增加不发生显著变化(P>0.05)。90 ℃水浴加热后的3种乳液通过CLSM观察发现,SPI乳液发生了絮凝(图6-a1),并且粒径分布图出现明显的“拖尾”现象,这是因为热处理导致β-伴大豆球蛋白的解离,以及大豆球蛋白的有限变性[9],变性后的SPI多肽链打开,有更多的疏水基团和亲水基团暴露出来,乳液滴之间发生絮凝,导致粒径d4,3增大。而SC、SE乳液滴则均匀分布(图6-b1、图6-c1),表现出较好的热稳定性,这一发现与文献报道一致[22-23]。
进一步研究了添加0.15 mol/L NaCl条件下,热处理对3种稳定乳液粒径、微观结构的影响,以评估经过静电屏蔽作用后,3种乳液的热稳定性差异。如图5所示,SPI乳液粒径d4,3从1.14 μm增大至2.17 μm,SC乳液、SE乳液的粒径d4,3均没有显著变化(P>0.05)。在盐离子存在下,通过CLSM观察到,与未加热的乳液对比,90 ℃水浴加热导致3种乳液絮凝加剧(图6-a3、图6-b3、图6-c3)。这是因为乳液滴静电屏蔽作用后,加热引起SPI原有的四级结构被破坏,并导致亚基的解离,多肽链之间的相互作用,导致乳液絮凝的程度增大;另外,SPI、SC这些蛋白类乳化剂在油水界面会形成具有黏弹性的界面膜[24],所以乳液滴不容易破裂而发生聚结,而SE乳液是因为小分子表面活性剂在乳化过程中产生马兰戈尼效应,并且其空间位阻小[20],加热使液滴间的布朗运动速度加快,在加热过程中液滴之间相互碰撞加剧而加速絮凝。
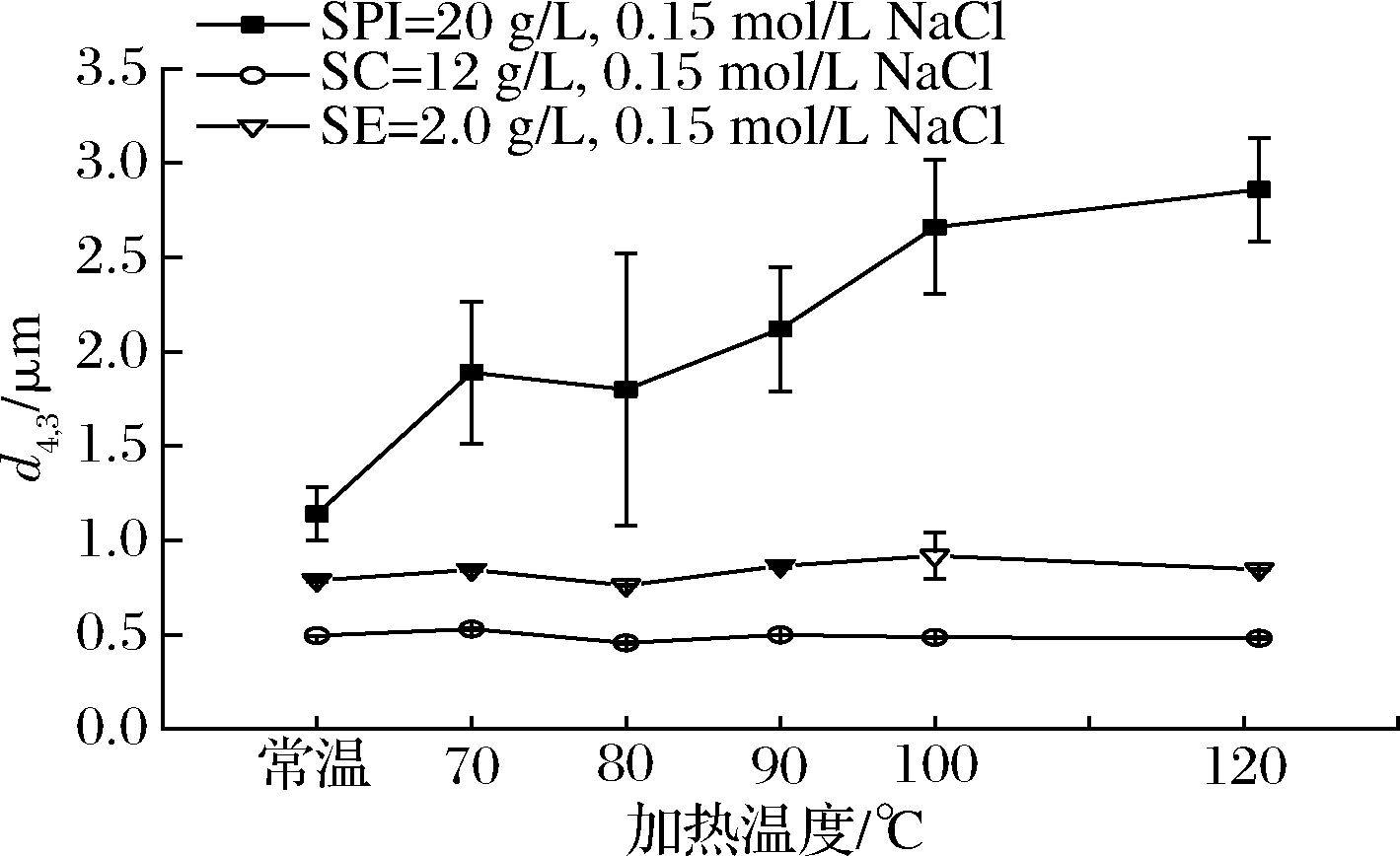
图5 一定离子强度下温度对乳状液粒径d4,3的影响
Fig.5 Effect of temperature on particle size d4,3of emulsion under certain ionic strength

图6 温度、NaCl对乳状液显微结构的影响
Fig.6 Effects of temperature and NaCl on microstructure of emulsion
3 结论
本文研究SPI和2种常用乳化剂(SC、SE)制备的乳液在不同浓度、离子强度、温度条件下对粒径、乳析、微观结构的影响。结果表明:
(1)SPI质量浓度为20 g/L,SC质量浓度为12 g/L,SE质量浓度为2.0 g/L均可以制备稳定的乳液,说明3种乳化剂的乳化能力依次为:SE>SC>SPI;并且在低浓度下,SPI乳液主要发生桥联絮凝,而SC、SE乳液则以聚结为主。
(2)由于受到静电屏蔽作用,3种稳定乳液在不同浓度的NaCl存在下,都发生了乳析;并且NaCl对液滴的静电屏蔽作用只能使SC和SE乳液发生比较弱的乳液滴絮凝,这种絮凝体无法通过激光粒度分析仪测定出真实大小,需要结合乳析和微观结构进行观察分析;而SPI的球蛋白会在液滴表面缓慢展开并发生构象变化,使蛋白质与蛋白质之间交联在一起,导致絮凝体更大,不会被激光粒度分析仪的样品分散系统搅散。
(3)90 ℃水浴加热使SPI构象发生变化,导致多肽链相互交联在一起,导致SPI乳液发生了絮凝,而SC、SE乳液热稳定性较好。SPI乳液静电屏蔽作用后,90 ℃水浴加热会导致SPI构象变化并且球蛋白在油水界面缓慢展开,使更多的疏水基团暴露并发生疏水相互作用,导致絮凝加剧,表明SPI乳液在环境压力下对抗聚结的稳定性好。
[1] 杨雷, 仇丹, 王佐杨, 等.食品级水包油型乳状液的研究进展[J].宁波工程学院学报,2013,25(1):43-48.
YANG L, QIU D, WANG Z Y, et al.Research progress in food-grade oil-in-water emulsion[J].Journal of Ningbo University of Technology, 2013,25(1):43-48.
[2] DICKINSON E, GOLDING M.Depletion flocculation of emulsions containing unadsorbed sodium caseinate[J].Food Hydrocolloids, 1997, 11(1):13-18.
[3] ZHAO Q Z, LONG Z, KONG J, et al.Sodium caseinate/flaxseed gum interactions at oil-water interface:Effect on protein adsorption and functions in oil-in-water emulsion[J].Food Hydrocolloids, 2015, 43:137-145.
[4] 郑立夫, 叶妍悦.蔗糖脂肪酸酯在食品加工中的应用研究[J].浙江化工, 2019, 50(8):14-15;27.
ZHENG L F, YE Y Y.Study on the application of sucrose fatty acid ester in food processing[J].Zhejiang Chemical Industry, 2019, 50(8):14-15,27.
[5] CHENG J J, CUI J, MA Y, et al.Effects of soy-to-milk protein ratio and sucrose fatty acid ester addition on the stability of ice cream emulsions[J].Food Hydrocolloids, 2016, 60:425-436.
[6] 刘汝萃, 袁伟岗, 王洪彩, 等.低NSI新豆粕对大豆分离蛋白工艺及产品功能性的影响[J].食品工业, 2019, 40(6):110-113.
LIU R C, YUAN W G, WANG H C, et al.Effect of low NSI new soybean meal on soy protein isolate technology and its functional properties[J].The Food Industry, 2019, 40(6):110-113.
[7] 王晴, 钱玉梅, 李红侠, 等.响应面法优化大豆分离蛋白物理改性工艺研究[J].宿州学院学报, 2019,34(8):81-84.
WANG Q, QIAN Y M, LI H X, et al.Optimization of physical modification technology of soybean protein isolation by response surface method[J].Journal of Suzhou University, 2019,34(8):81-84.
[8] LIN D Q, KELLY A L, MAIDANNYK V, et al.Effect of structuring emulsion gels by whey or soy protein isolate on the structure, mechanical properties, and in-vitro digestion of alginate-based emulsion gel beads[J].Food Hydrocolloids, 2021, 110:106165.
[9] KEERATI-U-RAI M, CORREDIG M.Heat-induced changes in oil-in-water emulsions stabilized with soy protein isolate[J].Food Hydrocolloids, 2009, 23(8):2 141-2 148.
[10] HUANG L R, DING X N, LI Y L, et al.The aggregation, structures and emulsifying properties of soybean protein isolate induced by ultrasound and acid[J].Food Chemistry, 2019, 279:114-119.
[11] 肖连冬, 程爽, 李杰.大豆分离蛋白起泡性和乳化性影响因素的研究[J].中国酿造, 2014,33(4):83-86.
XIAO L D, CHENG S, LI J.Influence factors of foaming properties and emulsifying properties of soybean protein isolate[J].China Brewing, 2014,33(4):83-86.
[12] 刘丽娅, 赵强忠, 孔静, 等.黄原胶对酪蛋白酸钠乳状液稳定性的影响[J].食品工业科技, 2012, 33(5):83-86.
LIU L Y, ZHAO Q Z, KONG J, et al.Effect of xanthan gum on the stability of sodium caseinate emulsion[J].Science and Technology of Food Industry, 2012, 33(5):83-86.
[13] ZHU Y Q, CHEN X, MCCLEMENTS D J, et al.pH-, ion- and temperature-dependent emulsion gels:Fabricated by addition of whey protein to gliadin-nanoparticle coated lipid droplets[J].Food Hydrocolloids, 2018, 77:870-878.
[14] MCCLEMENTS D J.Critical review of techniques and methodologies for characterization of emulsion stability[J].Critical Reviews in Food Science & Nutrition, 2007, 47(7):611-649.
[15] 殷军, 华欲飞, 陆健健, 等.大豆蛋白乳化性能比较及机理探讨[J].中国油脂, 2005, 30(5):35-38.
YIN J, HUA Y F, LU J J, et al.Comparison of emulsifying properties and mechanisms of soy proteins[J].China Oils and Fats, 2005, 30(5):35-38.
[16] LAM R S H, NICKERSON M T.Food proteins:A review on their emulsifying properties using a structure-function approach[J].Food Chemistry, 2013, 141(2):975-984.
[17] WALSTRA P.Principles of emulsion formation[J].Chemical Engineering Science, 1993, 48(2):333-349.
[18] DICKINSON E.Caseins in emulsions:Interfacial properties and interactions[J].International Dairy Journal, 1999, 9(3-6):305-312.
[19] PALAZOLO G G, SOBRAL P A, WAGNER J R.Impact of sample aging on freeze-thaw stability of oil-in-water emulsions prepared with soy protein isolates[J].International Journal of Food Properties, 2016, 19(10):2 322-2 337.
[20] 谷月, 刘道林, 赵强忠.NaCl浓度对蔗糖酯-黄原胶乳浊液稳定性的影响[J].食品工业科技,2015,36(5):113-117;122.
GU Y, LIU D L, ZHAO Q Z.Influence of NaCl concentration on the stability of sucrose ester-xanthan gum emulsion[J].Science and Technology of Food Industry, 2015,36(5):113-117;122.
[21] SRINIVASAN M, SINGH H, MUNRO P A.The effect of sodium chloride on the formation and stability of sodium caseinate emulsions[J].Food Hydrocolloids, 2000, 14(5):497-507.
[22] LIANG Y C, GILLIES G, MATIA-MERINO L, et al.Structure and stability of sodium-caseinate-stabilized oil-in-water emulsions as influenced by heat treatment[J].Food Hydrocolloids, 2017, 66:307-317.
[23] STUBENRAUCH C.Sugar surfactants-aggregation, interfacial, and adsorption phenomena[J].Current Opinion in Colloid & Interface Science, 2001, 6(2):160-170.
[24] PALAZOLO G G, SORGENTINI D A, WAGNER J R.Coalescence and flocculation in o/w emulsions of native and denatured whey soy proteins in comparison with soy protein isolates[J].Food Hydrocolloids, 2005, 19(3):595-604.