生姜(Zingiber Officinale Roscoe)属姜科植物,是世界广泛应用的香辛保健类蔬菜,也是我国卫生部首批颁布的药食兼用资源之一[1],在食品加工生产中常作为重要原料。中国生姜资源丰富,分布广泛,栽培面积和产量均位居世界第一[2]。生姜中富含姜辣素、黄酮、多酚、姜黄素、挥发性化合物和蛋白质等多种特征成分,是其生物活性功能的主要来源[2]。生姜常被加工成高价值的姜油树脂和精油,姜油树脂只占根茎总干重的4%~10%,因此而产生的蒸馏液、姜渣等副产物数量可观。这些副产物通常被直接丢弃或堆肥处理,造成资源浪费和环境污染。生姜副产物中仍然含有大量的植物化学物质和营养成分,因此利用副产物进行高值化产品开发是实现加工产业可持续发展的有利途径之一。
近年来,乳酸菌发酵是解决各种果蔬生产过剩、促进果蔬及其副产物综合利用的最佳途径[3]。其中,乳杆菌是食品加工中最常见的益生菌,如嗜酸乳杆菌、植物乳杆菌和副干酪乳杆菌等因具有优良的发酵特性已被广泛应用于果蔬发酵[4-5]。果蔬发酵过程中,乳杆菌可通过酶系代谢将复杂分子分解成更加自由和简单的化合物形式或者通过脱糖基化从植物细胞壁中释放更多活性物质,从而提高发酵产品的生物利用度和生物活性,增强其营养特性[6-7]。LI等[8]研究发现植物乳杆菌通过发酵去除酚类化合物的糖基和水解没食子醇基,导致酚谱发生变化,产生羟基较多的游离苷元,从而提高苹果汁的抗氧化活性。YAN等[4]研究发现鼠李糖乳杆菌和植物乳杆菌混合发酵可以诱导蓝莓渣植物细胞壁的结构分解,进而释放总酚、黄酮类化合物,增加了蓝莓渣的抗氧化活性。此外,乳酸菌本身还具有抗氧化活性,许多乳酸菌具有酶促和非酶促抗氧化机制,可以最大限度地减少活性氧的产生[7]。
因此,乳杆菌发酵是改善食品营养品质、强化其生物活性的重要加工技术手段,且其发酵效率高、成本低,具有广阔的开发应用前景。目前有关生姜副产物再利用的研究较少,尤其是利用生物发酵技术实现生姜蒸馏液高值化利用的研究尚未见报道。基于此,本研究采用植物乳杆菌和嗜酸乳杆菌作为发酵剂分别对生姜精油副产物蒸馏液进行发酵,分析发酵对蒸馏液主要活性成分和抗氧化活性的影响,旨在为研发生姜副产物高值化利用技术和发酵姜茶饮料等生姜发酵食品提供研究基础,促进生姜加工产业的可持续发展。
1 材料与方法
1.1 材料与试剂
生姜品种为舒城黄姜,由安徽谷瑞农业科技开发有限公司提供。植物乳杆菌CICC 22699(Lactobacillus plantarum,Lp)、嗜酸乳杆菌GIM 1.132(Lactobacillus acidophilus,La)分别购自中国工业微生物菌种保藏中心、广东省微生物菌种保藏中心。
6-姜酚、8-姜酚、10-姜酚、6-姜烯酚、姜酮标准品,上海阿拉丁生化科技股份有限公司;没食子酸、芦丁、ABTS,上海源叶生物科技有限公司;DPPH、维生素C、福林-酚、钼酸铵、乙腈(色谱纯),北京索莱宝科技有限公司;铁氰化钾、亚硝酸钠,上海麦克林生化科技有限公司;邻菲罗啉,北京酷来博科技有限公司;MRS培养基,青岛海博生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BL1036A破壁料理机,美的集团;PHS-3C pH计,上海雷磁仪器有限公司;DNP-9022电热恒温培养箱,上海三发科学仪器有限公司;JA5003B电子天平,上海越平科学仪器有限公司;UV-5200紫外可见分光光度计,上海元析仪器有限公司;SC-3610低速离心机,安徽中科中佳科学仪器有限公司;LC-20A高效液相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 生姜蒸馏液的制备
干姜粉碎后,按姜粉∶蒸馏水以1∶40的质量比加水蒸馏5 h,油水分离后,将剩余的残渣和液体用4层纱布过滤,得到生姜蒸馏液。
1.3.2 菌悬液制备
将La、Lp冻干菌粉分别接入MRS液体培养基进行活化,活化2代后,3 000 r/min离心10 min,弃去上清液,用0.85%的无菌生理盐水清洗、离心2~3次,再用生理盐水重悬沉淀得到活菌数为5.0×109 CFU/mL的菌悬液。
1.3.3 生姜蒸馏液发酵工艺
取30 mL生姜蒸馏液于发酵瓶中,添加10%(质量分数)的果葡糖浆作为碳源,80 ℃灭菌10 min。冷却后,按照2%(体积分数)的接种量分别接种La、Lp菌悬液,使生姜蒸馏液中的初始乳杆菌浓度≥1×108 CFU/mL,于(37±1) ℃培养24 h。每隔一段时间收集样品,置于-20 ℃保存待测。
1.3.4 pH值与总酸的测定
pH值:采用pH计测定;总酸:按照GB/T 12456—2021《食品安全国家标准 食品中总酸的测定》pH计电位滴定法测定(以乳酸计)。
1.3.5 总酚和总黄酮含量的测定
采用Folin-Ciocalteu法测定总酚的含量[4],结果以没食子酸当量(mg GAE/mL)表示,标准曲线方程为y=5.811x+0.018 9,R2=0.998。采用NaNO2-Al(NO3)3法测定总黄酮的含量[4],结果以芦丁当量(mg RE/mL)表示,标准曲线方程为y=6.143 6x-0.232,R2=0.997 3。
1.3.6 姜辣素含量的测定
取适量发酵液过0.22 μm微孔滤膜后进行高效液相色谱分析。标准品6-姜酚、8-姜酚、6-姜烯酚、姜酮制备成混合标准液,稀释为不同浓度梯度。
高效液相色谱检测条件:色谱柱:InertSustain C18(250 mm×4.6 mm,5 μm);流动相:乙腈(B)-超纯水(A),梯度洗脱(0~10 min:45%~50% B;10~20 min:50%~65% B;20~40 min:65%~100% B;40~45 min:100%~45% B;45~48 min:45% B);柱温45 ℃;检测波长280 nm;流速1.0 mL/min;进样量10 μL。
1.3.7 抗氧化能力的测定
1.3.7.1 DPPH自由基清除能力
参考周颖等[9]所述方法。取适量发酵液,蒸馏水稀释5倍。将2.0 mL样品稀释液加入2.0 mL的DPPH无水乙醇溶液(0.2 mmol/L)中,振荡混匀,室温避光反应30 min后,4 500 r/min离心3 min,取上清液测定其在517 nm处的吸光值。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A1,样品吸光值;A0,以无水乙醇代替DPPH溶液的吸光值;A2,以无水乙醇代替样品的吸光值。
1.3.7.2 ABTS阳离子自由基清除能力
参考范金波等[10]所述方法。将20 mL ABTS溶液(7 mmol/L)与350 μL的过硫酸钾溶液(140 mmol/L),混合均匀,于室温下避光静置14 h,制成ABTS阳离子自由基储备液。使用前,将ABTS阳离子自由基储备液用无水乙醇稀释,直至其在734 nm处的吸光值为0.7±0.02。取适量发酵液,蒸馏水稀释5倍。分别取0.4 mL样品稀释液与4.6 mL稀释后的ABTS阳离子自由基溶液混合均匀,30 ℃避光水浴3 min后,4 500 r/min离心3 min,取上清液测定其在734 nm处的吸光值。以稀释后的ABTS阳离子自由基溶液为空白对照。ABTS阳离子自由基清除率计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A1,样品与ABTS阳离子自由基溶液反应后的吸光值;A2,样品溶液本底吸光值;A0,空白对照的吸光值。
1.3.7.3 羟自由基(·OH)清除能力
参考周颖等[9]所述方法。吸取3.8 mL的PBS溶液(0.2 mol/L,pH 7.4)于试管中,依次加入1.0 mL邻菲罗啉(0.75 mmol/L),1.5 mL硫酸亚铁(0.75 mmol/L),1.0 mL发酵液和1.0 mL 0.1%(体积分数)的过氧化氢,混匀后置于37 ℃反应60 min。反应完成后,4 500 r/min离心5 min,取上清液测定其在536 nm处的吸光值。·OH清除率计算如公式(3)所示:
·OH清除率![]()
(3)
式中:A1,样品吸光值;A2,不加样品的吸光值;A3,不加样品和过氧化氢的吸光值。
1.3.7.4 亚硝基![]() 清除率
清除率
参考李米等[11]所述方法。准确吸取2 mL 5 mg/L亚硝酸钠溶液,加入2.0 mL发酵液,37 ℃水浴10 min后,立即加入2 mL 0.4%(质量分数)对氨基苯磺酸,摇匀静置4 min,加入1 mL 0.2%(质量分数)盐酸萘乙二胺溶液,摇匀静置15 min。反应完成后,4 500 r/min离心5 min,取上清液于540 nm处测定吸光值。![]() 清除率计算如公式(4)所示:
清除率计算如公式(4)所示:
![]() 清除率
清除率![]()
(4)
式中:A0,未添加样品的吸光度;A1,样品的吸光度;A2,样品本底吸光度。
1.3.7.5 还原力
参考YAN等[4]所述方法。取1 mL发酵液与2.5 mL PBS溶液(0.2 mol /L,pH 6.6)、2.5 mL 1%(质量分数)铁氰化钾混合均匀,50 ℃水浴反应20 min后迅速冷却,加入2.5 mL 10%(质量分数)三氯乙酸终止反应。然后在4 500 r/min离心10 min,取2.5 mL上清液与2.5 mL蒸馏水、0.5 mL 0.1%三氯化铁混合,静置反应10 min后在700 nm处测定吸光值,蒸馏水作为参比溶液。结果以维生素C当量表示,标准曲线方程为y=0.006 4x-0.040 4,R2=0.993。
1.3.7.6 总抗氧化能力
参考范金波等[10]所述方法。分别称取四水合钼酸铵、浓硫酸、磷酸三钠溶于蒸馏水中,使其浓度分别为4 mmol/L、0.6 mol/L和28 mmol/L,混合均匀,制成钼酸铵反应试剂。取适量发酵液,蒸馏水稀释100倍。取0.5 mL样品稀释液与3 mL钼酸铵反应试剂混匀,90 ℃水浴反应90 min,待冷却至室温后,在695 nm处测定吸光值,以不加样品的空白试剂为参比溶液。总抗氧化能力以维生素C当量表示,标准曲线方程为y=0.006 4x+0.017 1,R2=0.999 1。
1.4 数据统计与分析
每组实验重复3次,实验数据以平均值±标准偏差形式表示。采用Origin 9.0软件绘制图表,采用SPSS 25软件进行显著性和Pearson相关性分析。
2 结果与分析
2.1 生姜蒸馏液发酵特性动态研究
pH和总酸可以反映乳酸菌发酵过程中微生物的生长代谢情况。从图1可以看出,生姜蒸馏液接种两种乳杆菌后发酵情况均正常,随着发酵时间的延长,pH呈现下降的趋势,总酸呈现上升的趋势。Lp、La发酵生姜蒸馏液的pH在发酵10 h内下降幅度较大,由5.7分别降至3.32、3.94;10 h之后下降幅度减小,最终Lp、La发酵液的pH值分别为3.09、4.06。乳酸菌在无氧条件下利用碳源产生乳酸等有机酸,降低发酵液中的pH[12]。发酵的0~10 h,Lp发酵液的pH下降速率显著大于La发酵液;10 h之后,La发酵液的pH值趋于稳定,Lp发酵液pH仍缓慢降低,说明植物乳杆菌在低pH条件下仍能进行生长代谢。从图1-B中可以看出,La发酵液的总酸含量在发酵的0~10 h快速积累,从0.18 g/kg上升至0.74 g/kg。然而,随着发酵时间的延长,总酸和次级代谢产物的不断累积以及营养物质的消耗,使得这种酸性环境不适宜乳酸菌的大量生长[12]。10 h之后,La发酵速度减慢,产酸量减少,环境中的总酸趋于稳定。Lp发酵液的产酸量则在发酵24 h内呈现持续上升的趋势,在24 h达到最大酸度2.89 g/kg。由pH值和总酸含量变化程度来看,植物乳杆菌发酵生姜蒸馏液的速率明显优于嗜酸乳杆菌,能更好的利用生姜蒸馏液中的营养物质。虽然研究表明生姜具有一定的抗菌活性,但也有研究证实了生姜汁适宜乳酸菌的生长,嗜酸乳杆菌、干酪乳杆菌等菌种可使发酵生姜汁的pH值由5.5降至3.0[13],这与我们的研究结果一致。
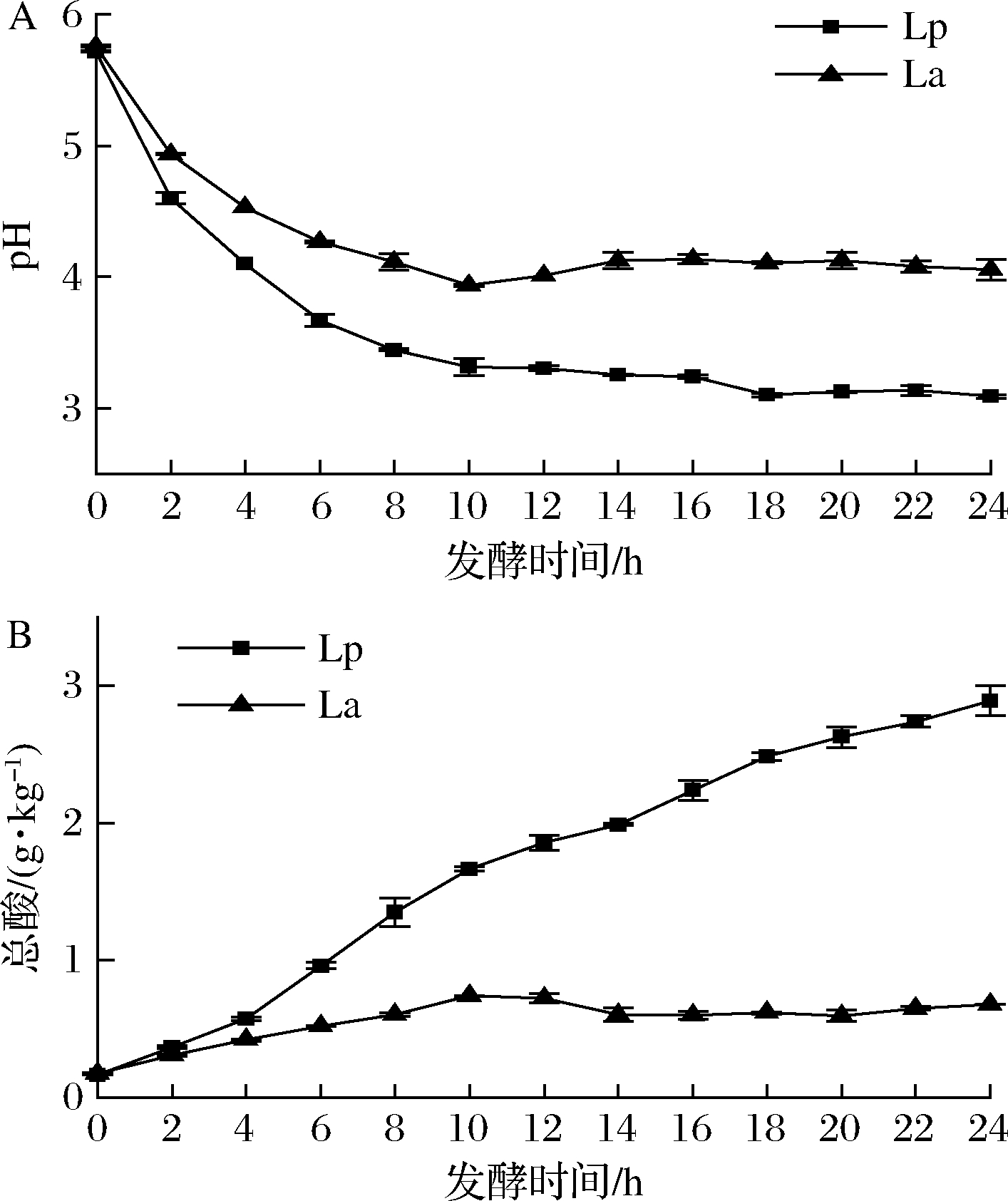
A-pH;B-总酸
图1 生姜蒸馏液发酵过程中pH和总酸含量的变化
Fig.1 Changes in the pH value and total acid content of ginger distillate during fermentation
2.2 乳酸菌发酵对生姜蒸馏液中活性成分的影响
2.2.1 乳酸菌发酵对生姜蒸馏液中总酚和总黄酮的影响
由图2可知,在0~24 h连续发酵过程中,Lp、La发酵液中的总酚和总黄酮含量均随发酵时间的延长呈现先降低后升高的趋势,其中,总酚含量变化显著。在发酵的0~12 h,Lp发酵液中总酚含量由0.200 mg/mL下降至0.174 mg/mL。发酵的0~8 h,La发酵液中总酚含量由0.206 mg/mL下降至0.181 mg/mL。发酵24 h后,Lp、La发酵液中总酚含量均升高至0.193 mg/mL。随着发酵时间的延长,24 h后Lp和La发酵液中总黄酮的含量由初始的0.126 mg/mL分别降至0.111 mg/mL、0.115 mg/mL。发酵24 h后,Lp和La发酵液中的总酚和总黄酮含量均显著低于初始含量。以往的一些研究显示出了相似的变化趋势[5, 14]。MUSTAFA等[14]采用干酪乳杆菌发酵石榴汁24 h后总酚含量减少了30%。植物乳杆菌发酵苹果汁的总酚含量由115.6 g/mL降至89.3 g/mL,总黄酮含量由119 g/mL降至77.7 g/mL[8]。番木瓜发酵饮料的总酚含量在发酵期间显著降低,从0 h的32.06 mg/100g下降到48 h的28.96 mg/100g[15]。
发酵液中总酚和总黄酮含量的降低,一方面可能是多酚、黄酮类物质被乳杆菌降解,乳杆菌的存在促进了简单酚类物质的转化和高分子质量酚类化合物的解聚[8],另一方面酚类化合物可以与葡萄糖、蛋白质等组合或吸附,导致含量降低[9]。发酵后期总酚和总黄酮含量呈现逐渐上升的趋势,可能是植物乳杆菌和嗜酸乳杆菌能够分泌一些有利于细胞壁降解的酶系,提高胞内物质的释放效率[16-17],从而进一步提高蒸馏液中多酚、黄酮的含量。

A-总酚;B-总黄酮
图2 生姜蒸馏液发酵过程中总酚和总黄酮含量的变化
Fig.2 Changes in the contents of total phenols and total flavonoids of ginger distillate during fermentation
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2.2 乳酸菌发酵对生姜蒸馏液中姜辣素类化合物的影响
姜辣素是由多种成分组成的混合物,是生姜中重要的活性物质,具有较强的抗氧化能力[1]。由表1可知,发酵前生姜蒸馏液中的主要姜辣素成分为6-姜酚、8-姜酚、6-姜烯酚和姜酮,其中6-姜酚含量最高,为68.589 mg/L。随着发酵时间的延长,Lp、La发酵液中6-姜酚含量呈现先减少后增加的趋势,姜酮含量无显著性变化;发酵2 h后,8-姜酚、6-姜烯酚含量减少,低于检测限。罗松明[18]采用5种乳酸菌剂发酵仔姜时也发现姜辣素含量呈现不同程度的减少趋势。周颖等[9]研究酵母菌、副干酪乳杆菌和醋酸杆菌混合发酵制备生姜酵素时发现6-姜酚含量从130.02 mg/L降至81.09 mg/L,而姜辣素总量基本不变,可能是6-姜酚与其他姜辣素类化合物在发酵过程中发生了相互转化。CHOI等[19]研究发现裂殖酵母发酵可以促进生姜提取物中6-姜烯酚向6-姜酮酚的生物转化。发酵过程中,姜辣素类化合物可能被乳杆菌作为营养物质消耗降解,且发酵产酸导致的低酸环境可能催化姜辣素结构改变,从而转化成其他物质。
表1 生姜蒸馏液发酵过程中姜辣素类化合物含量的变化
Table 1 Changes in the contents of gingerol compounds of ginger distillate during fermentation
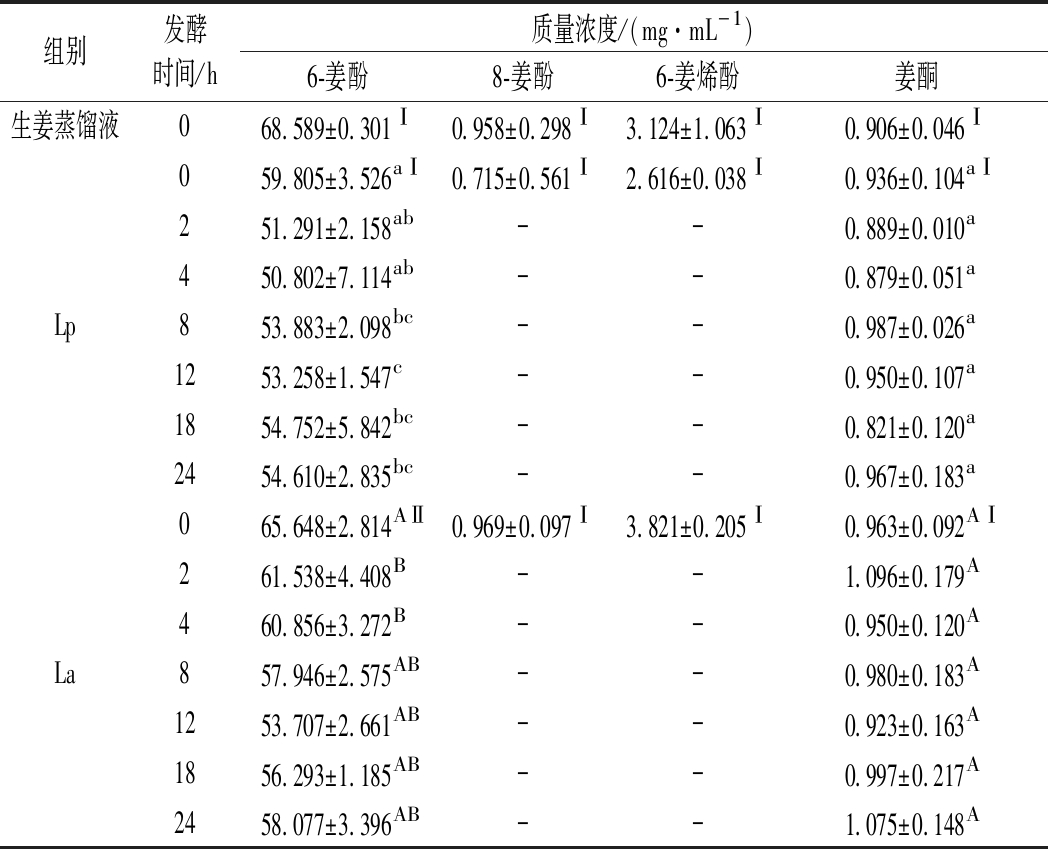
组别发酵时间/h质量浓度/(mg·mL-1)6-姜酚8-姜酚6-姜烯酚姜酮生姜蒸馏液068.589±0.301Ⅰ0.958±0.298Ⅰ3.124±1.063Ⅰ0.906±0.046Ⅰ059.805±3.526aⅠ0.715±0.561Ⅰ2.616±0.038Ⅰ0.936±0.104aⅠ251.291±2.158ab--0.889±0.010a450.802±7.114ab--0.879±0.051aLp853.883±2.098bc--0.987±0.026a1253.258±1.547c--0.950±0.107a1854.752±5.842bc--0.821±0.120a2454.610±2.835bc--0.967±0.183a065.648±2.814AⅡ0.969±0.097Ⅰ3.821±0.205Ⅰ0.963±0.092AⅠ261.538±4.408B--1.096±0.179A460.856±3.272B--0.950±0.120ALa857.946±2.575AB--0.980±0.183A1253.707±2.661AB--0.923±0.163A1856.293±1.185AB--0.997±0.217A2458.077±3.396AB--1.075±0.148A
注:“-”表示未检出;同列字母、罗马数字不同表示差异显著(P<0.05);小写字母代表Lp组;大写字母代表La组;罗马数字代表同一发酵时间
2.3 乳酸菌发酵对生姜蒸馏液抗氧化活性的影响
Lp、La发酵过程中,发酵液的DPPH自由基清除率、ABTS阳离子自由基清除率、·OH清除率、![]() 清除率、还原力和总抗氧化能力的变化情况如图3所示。
清除率、还原力和总抗氧化能力的变化情况如图3所示。
2种乳杆菌发酵均显著提高了生姜蒸馏液的DPPH自由基清除能力和总抗氧化能力(图3-A、图3-F)。在发酵的0~4 h,Lp、La发酵液的自由基清除率迅速上升,发酵12 h之后趋于稳定,最终DPPH自由基清除率分别达到93.35%、93.73%。发酵2 h时,Lp发酵液的总抗氧化能力达到了78.396 μg/mL,相较于发酵前提高了10.50%,之后基本稳定。在0~24 h发酵过程中,La发酵液总抗氧化能力持续上升,在24 h达到了85.635 μg/mL,相较于发酵前提高了41.72%。范金波等[10]研究表明总抗氧化能力与酚类物质的乙烯基和羟基等活性基团有关。
如图3-C和图3-D所示,发酵过程中,Lp发酵液的·OH清除率和![]() 清除率均呈逐渐上升后稳定的趋势。发酵的0~12 h,Lp发酵液的·OH清除率从24.16%升高至
清除率均呈逐渐上升后稳定的趋势。发酵的0~12 h,Lp发酵液的·OH清除率从24.16%升高至![]() 清除率从13.08%升高至17.35%;而La发酵液的·OH清除率和
清除率从13.08%升高至17.35%;而La发酵液的·OH清除率和![]() 清除率与发酵前均无显著性差异。李萍[20]采用植物乳杆菌发酵也提高了生姜提取液的·OH 清除能力,可能是乳杆菌产酸使得有机酸等物质增加的结果[21]。李米等[11]研究表明生姜中的姜辣素提取物等活性成分可以有效清除食品中的亚硝酸盐,清除率高达98.74%。Lp发酵液的·OH清除能力和
清除率与发酵前均无显著性差异。李萍[20]采用植物乳杆菌发酵也提高了生姜提取液的·OH 清除能力,可能是乳杆菌产酸使得有机酸等物质增加的结果[21]。李米等[11]研究表明生姜中的姜辣素提取物等活性成分可以有效清除食品中的亚硝酸盐,清除率高达98.74%。Lp发酵液的·OH清除能力和![]() 清除能力显著高于La发酵液,可能是因为植物乳杆菌发酵代谢产生了能高效清除·OH和
清除能力显著高于La发酵液,可能是因为植物乳杆菌发酵代谢产生了能高效清除·OH和![]() 的活性物质。与·OH清除率和
的活性物质。与·OH清除率和![]() 清除率变化不同的是,相较于植物乳杆菌,嗜酸乳杆菌发酵能显著提高生姜蒸馏液的还原力(图3-E)。24 h 发酵过程中,La发酵液的还原力呈逐渐上升的趋势,相较于发酵前提高了13.36%,这可能是因为还原力的大小不仅与自由基的清除有关,还与过氧化物降解等因素有关[21]。
清除率变化不同的是,相较于植物乳杆菌,嗜酸乳杆菌发酵能显著提高生姜蒸馏液的还原力(图3-E)。24 h 发酵过程中,La发酵液的还原力呈逐渐上升的趋势,相较于发酵前提高了13.36%,这可能是因为还原力的大小不仅与自由基的清除有关,还与过氧化物降解等因素有关[21]。
未发酵样品经过稀释后仍具有较强的ABTS阳离子自由基清除能力,清除率高达98.91%。由图3-B可知,ABTS阳离子自由基清除率随发酵时间呈现先降低后稳定的趋势。在发酵的0~12 h,Lp、La发酵液的自由基清除率从98.91%迅速降低到78.06%、85.17%,之后不再发生显著性变化。ABTS自由基为阳离子自由基,可从抗氧化剂分子中获得1个电子形成稳定的中性分子[22]。发酵后清除率降低,可能与提供电子的姜辣素类化合物、酚类物质减少有关。
结果表明适当的乳酸发酵可显著提高生姜蒸馏液的抗氧化活性,而植物乳杆菌和嗜酸乳杆菌发酵液中抗氧化能力的差异可能与发酵过程中乳酸菌的代谢产物和生姜蒸馏液中活性物质的变化有关。
2.4 抗氧化能力与主要活性物质的相关性分析
植物乳杆菌和嗜酸乳杆菌发酵生姜蒸馏液过程中抗氧化能力与活性成分的相关性分析如表2所示,活性成分与抗氧化能力之间存在一定的量效关系。
2种乳杆菌发酵过程中,DPPH自由基清除能力均与6-姜酚、8-姜酚、6-姜烯酚含量呈极显著负相关(P<0.01),La发酵过程中DPPH自由基清除能力与总酚、黄酮呈显著负相关(P<0.05),说明6-姜酚、8-姜酚、6-姜烯酚、总酚和黄酮含量的变化是导致发酵过程中DPPH自由基清除能力变化的重要原因。
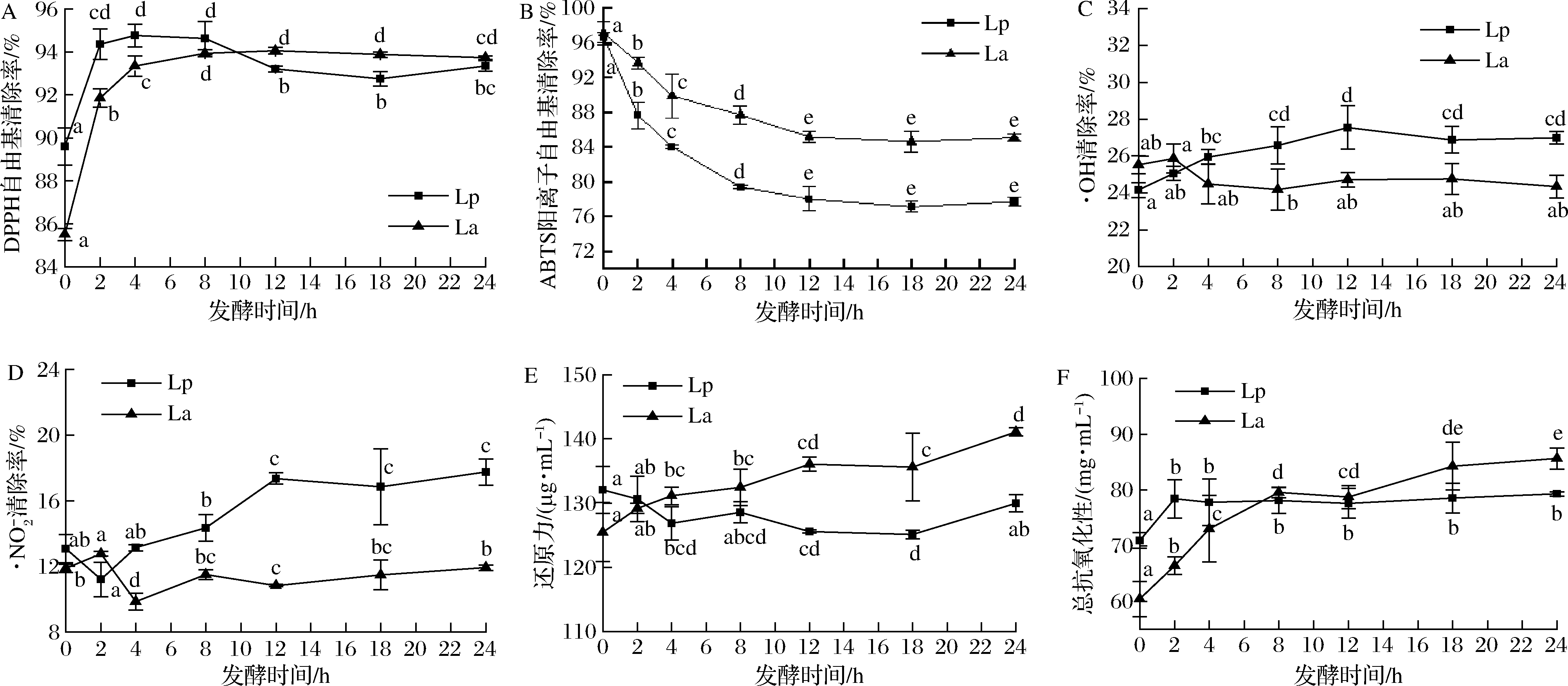
A-DPPH自由基清除率;B-ABTS阳离子自由基清除率;C-·OH清除率;![]() 清除率;E-还原力;F-总抗氧化能力
清除率;E-还原力;F-总抗氧化能力
图3 生姜蒸馏液发酵过程中抗氧化活性的变化
Fig.3 Changes in the antioxidant activities of ginger distillate during fermentation
表2 生姜蒸馏液发酵过程中抗氧化能力与活性成分相关性分析
Table 2 Correlation analysis of the antioxidant activity and active components of ginger distillate during fermentation
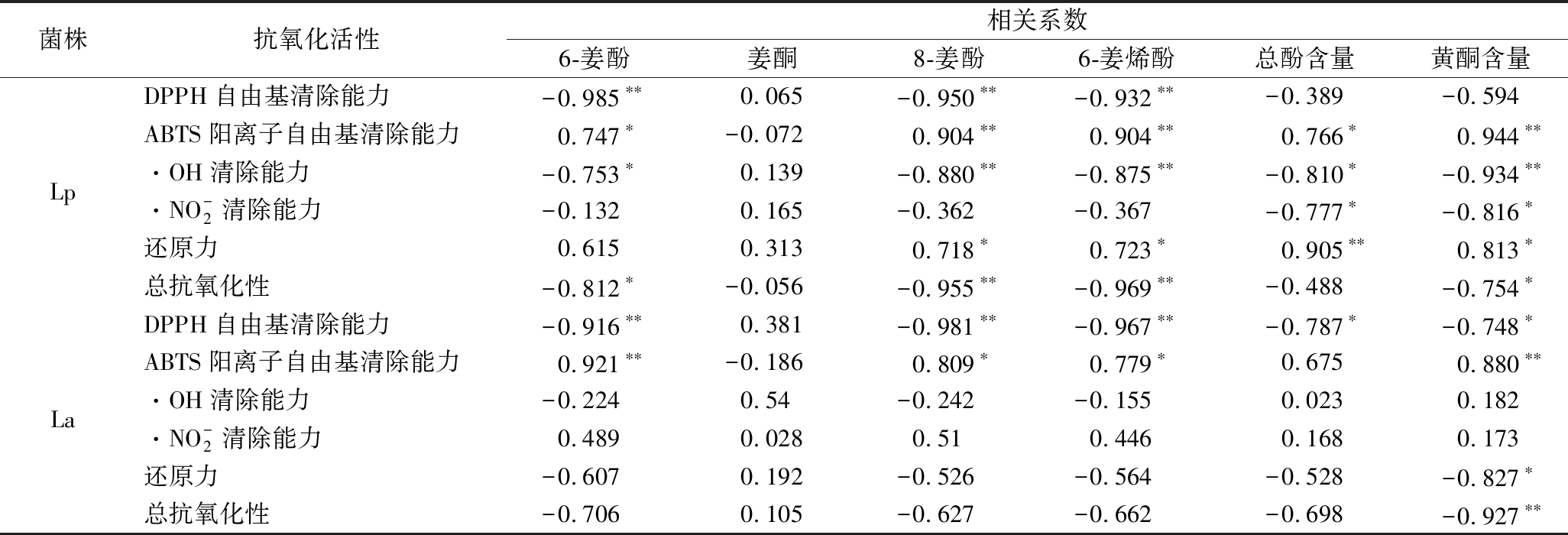
菌株抗氧化活性相关系数6-姜酚姜酮8-姜酚6-姜烯酚总酚含量黄酮含量DPPH自由基清除能力-0.985∗∗0.065-0.950∗∗-0.932∗∗-0.389-0.594ABTS阳离子自由基清除能力0.747∗-0.0720.904∗∗0.904∗∗0.766∗0.944∗∗Lp·OH清除能力-0.753∗0.139-0.880∗∗-0.875∗∗-0.810∗-0.934∗∗·NO-2清除能力-0.1320.165-0.362-0.367-0.777∗-0.816∗还原力0.6150.3130.718∗0.723∗0.905∗∗0.813∗总抗氧化性-0.812∗-0.056-0.955∗∗-0.969∗∗-0.488-0.754∗DPPH自由基清除能力-0.916∗∗0.381-0.981∗∗-0.967∗∗-0.787∗-0.748∗ABTS阳离子自由基清除能力0.921∗∗-0.1860.809∗0.779∗0.6750.880∗∗La·OH清除能力-0.2240.54-0.242-0.1550.0230.182·NO-2清除能力0.4890.0280.510.4460.1680.173还原力-0.6070.192-0.526-0.564-0.528-0.827∗总抗氧化性-0.7060.105-0.627-0.662-0.698-0.927∗∗
注:*表示在0.05 水平上(双侧)显著相关;**表示在0.01 水平上(双侧)显著相关
Lp发酵过程中,·OH清除能力与8-姜酚、6-姜烯酚、黄酮呈极显著负相关(P<0.01),与6-姜酚、总酚含量呈显著负相关(P<0.05),总抗氧化性与8-姜酚、6-姜烯酚呈极显著负相关(P<0.01),与6-姜酚、黄酮含量呈显著负相关![]() 清除能力与总酚、黄酮含量呈显著负相关(P<0.05);而La发酵过程中总抗氧化性仅与黄酮含量呈极显著负相关(P<0.01),·OH清除能力
清除能力与总酚、黄酮含量呈显著负相关(P<0.05);而La发酵过程中总抗氧化性仅与黄酮含量呈极显著负相关(P<0.01),·OH清除能力![]() 清除能力与各活性成分之间均无显著相关性。结果表明,乳杆菌可能通过发酵代谢生姜蒸馏液中的6-姜酚、8-姜酚、6-姜烯酚、总酚和黄酮化合物产生更具活性的物质,从而提高其抗氧化活性。这与LI等[8]关于植物乳杆菌发酵改善苹果汁的酚类成分,提高其整体抗氧化能力的研究结论相似。谈诗文[23]研究发酵姜汁黑豆奶时也发现,乳酸菌代谢生成的糖苷水解酶可以将酚类物质中葡萄糖苷键断掉,获得更多的活性酚羟基,进而提高姜汁的抗氧化性。发酵过程中,乳杆菌通过消耗酚类化合物中的葡萄糖分子,产生羟基数目较多的游离苷元或使羟基的空间位阻降低,这些苷元等代谢物具有更强的自由基清除能力[7-8]。但不同乳杆菌的发酵代谢产物存在较大差异,植物乳杆菌发酵生姜蒸馏液产生的低酸环境,可能会导致酚类化合物的结构发生改变,从而影响其抗氧化活性[7]。两种乳杆菌发酵过程中,ABTS阳离子自由基清除能力与6-姜酚、8-姜酚、6-姜烯酚、总酚、黄酮之间存在显著的正相关(P<0.05);Lp发酵过程中,还原力与总酚含量呈极显著正相关(P<0.01),与8-姜酚、6-姜烯酚、黄酮含量呈显著正相关(P<0.05);而La发酵液中还原力与黄酮含量呈显著负相关(P<0.05)。这说明生姜蒸馏液中主要活性成分(除姜酮外)具有一定抗氧化作用,而嗜酸乳杆菌发酵过程中还原力的变化可能是酚类物质的代谢产物、过氧化物的降解等其他因素共同作用的结果[7, 22]。
清除能力与各活性成分之间均无显著相关性。结果表明,乳杆菌可能通过发酵代谢生姜蒸馏液中的6-姜酚、8-姜酚、6-姜烯酚、总酚和黄酮化合物产生更具活性的物质,从而提高其抗氧化活性。这与LI等[8]关于植物乳杆菌发酵改善苹果汁的酚类成分,提高其整体抗氧化能力的研究结论相似。谈诗文[23]研究发酵姜汁黑豆奶时也发现,乳酸菌代谢生成的糖苷水解酶可以将酚类物质中葡萄糖苷键断掉,获得更多的活性酚羟基,进而提高姜汁的抗氧化性。发酵过程中,乳杆菌通过消耗酚类化合物中的葡萄糖分子,产生羟基数目较多的游离苷元或使羟基的空间位阻降低,这些苷元等代谢物具有更强的自由基清除能力[7-8]。但不同乳杆菌的发酵代谢产物存在较大差异,植物乳杆菌发酵生姜蒸馏液产生的低酸环境,可能会导致酚类化合物的结构发生改变,从而影响其抗氧化活性[7]。两种乳杆菌发酵过程中,ABTS阳离子自由基清除能力与6-姜酚、8-姜酚、6-姜烯酚、总酚、黄酮之间存在显著的正相关(P<0.05);Lp发酵过程中,还原力与总酚含量呈极显著正相关(P<0.01),与8-姜酚、6-姜烯酚、黄酮含量呈显著正相关(P<0.05);而La发酵液中还原力与黄酮含量呈显著负相关(P<0.05)。这说明生姜蒸馏液中主要活性成分(除姜酮外)具有一定抗氧化作用,而嗜酸乳杆菌发酵过程中还原力的变化可能是酚类物质的代谢产物、过氧化物的降解等其他因素共同作用的结果[7, 22]。
由此可以看出,两种乳杆菌发酵过程中6-姜酚、8-姜酚、6-姜烯酚、总酚和黄酮对生姜蒸馏液抗氧化活性起决定性作用,但在不同乳杆菌发酵体系和不同抗氧化体系中,它们的影响程度不完全一致。此外,生姜蒸馏液发酵液中抗氧化活性物质来源较复杂,除姜辣素、总酚、黄酮外,乳杆菌发酵产生的有机酸及其他代谢物也可能通过直接淬灭或抑制自由基、提供质子或电子等方式,共同发挥抗氧化作用[24-25]。
3 结论
本研究采用提取精油后的废弃物生姜蒸馏液作为发酵底物,对比分析了植物乳杆菌和嗜酸乳杆菌发酵过程中生姜蒸馏液的发酵特性、主要活性成分及抗氧化活性的变化规律。研究结果表明植物乳杆菌和嗜酸乳杆菌在生姜蒸馏液中均生长良好,其中,植物乳杆菌在产酸方面表现最佳。虽然发酵后总酚、黄酮和姜辣素类化合物的含量有所下降,但发酵液清除自由基的活性得到了一定程度的提高。抗氧化活性的提高与6-姜酚、8-姜酚、6-姜烯酚、总酚、总黄酮含量的变化显著相关(P<0.05)。因此,生姜蒸馏液可作为乳杆菌特别是植物乳杆菌良好的益生菌载体且具有较高的抗氧化活性,通过发酵达到了提质增效的目的,为高抗氧化活性的发酵姜茶饮料、生姜风味发酵食品的开发及生姜副产物的高值化利用提供了研究基础。但乳杆菌发酵生姜蒸馏液过程中活性物质的代谢途径及其与抗氧化活性之间的关系有待进一步研究。
[1] 张芳. 铜陵白姜姜酚的制备、抗癌活性及机理[D].合肥:合肥工业大学, 2017.
ZHANG F.Gingerols from white ginger:Purification, anti-cancerous potential and the molecular mechanism[D].Hefei:Hefei University of Technology, 2017.
[2] 张文焕. 生姜质量安全标准比对分析及特征成分差异研究[D].北京:中国农业科学院, 2019.
ZHANG W H.Comparative analysis of ginger quality safety standards and difference study on characteristic components[D].Beijing:Chinese Academy of Agricultural Sciences, 2019.
[3] RUIZ RODR GUEZ L G, ZAMORA GASGA V M, PESCUMA M, et al.Fruits and fruit by-products as sources of bioactive compounds.Benefits and trends of lactic acid fermentation in the development of novel fruit-based functional beverages[J].Food Research International(Ottawa,Ont), 2021, 140:109854.
GUEZ L G, ZAMORA GASGA V M, PESCUMA M, et al.Fruits and fruit by-products as sources of bioactive compounds.Benefits and trends of lactic acid fermentation in the development of novel fruit-based functional beverages[J].Food Research International(Ottawa,Ont), 2021, 140:109854.
[4] YAN Y H, ZHANG F, CHAI Z Y, et al.Mixed fermentation of blueberry pomace with L.rhamnosus GG and L.plantarum-1:Enhance the active ingredient, antioxidant activity and health-promoting benefits[J].Food and Chemical Toxicology, 2019, 131:110541.
[5] ISAS A S,MARIOTTI CELIS M S, PÉREZ CORREA J R, et al.Functional fermented cherimoya (Annona cherimola Mill.) juice using autochthonous lactic acid bacteria[J].Food Research International, 2020, 138:109729.
[6] PONTONIO E, MONTEMURRO M, PINTO D, et al.Lactic acid fermentation of pomegranate juice as a tool to improve antioxidant activity[J].Frontiers in Microbiology, 2019, 10:1550.
[7] HUR S J, LEE S Y, KIM Y C, et al.Effect of fermentation on the antioxidant activity in plant-based foods[J].Food Chemistry, 2014, 160:346-356.
[8] LI Z X, TENG J, LYU Y L, et al.Enhanced antioxidant activity for apple juice fermented with Lactobacillus plantarum ATCC14917[J].Molecules(Basel,Switzerland), 2018, 24(1):51.
[9] 周颖, 韦仕静, 葛亚中, 等.生姜酵素发酵过程中生物活性成分含量及其抗氧化活性的变化[J].食品工业科技, 2018, 39(18):39-44.
ZHOU Y, WEI S J, GE Y Z, et al.Changes of bioactive components and antioxidant activities about ginger jiaosu during the fermentation process[J].Science and Technology of Food Industry, 2018, 39(18):39-44.
[10] 范金波, 蔡茜彤, 冯叙桥, 等.5种天然多酚类化合物抗氧化活性的比较[J].食品与发酵工业, 2014, 40(7):77-83.
FAN J B, CAI X T, FENG X Q, et al.The comparison of five natural phenolic compounds on antioxidant activity in vitro[J].Food and Fermentation Industries, 2014, 40(7):77-83.
[11] 李米, 陈尚龙, 张建萍, 等.姜辣素提取工艺及其对亚硝酸盐的清除作用研究[J].安徽农业科学, 2021, 49(13):175-179.
LI M, CHEN S L, ZHANG J P, et al.Study on extraction process of gingerols and its nitrite scavenging effect[J].Journal of Anhui Agricultural Sciences, 2021, 49(13):175-179.
[12] 黄豪, 周义, 陈佳慧, 等.乳酸菌发酵对山楂汁理化性质、酚类化合物、抗氧化性及风味的影响[J].食品科学, 2022,43(10):97-106.
HUANG H, ZHOU Y, CHEN J H, et al.Effect of lactic acid bacteria fermentation on the physicochemical property, phenolic compounds, antioxidant activity and volatile components of hawthorn juice[J].Food Science, 2022,43(10):97-106.
[13] CHEN I N, NG C C, WANG C Y, et al.Lactic fermentation and antioxidant activity of Zingiberaceae plants in Taiwan[J].International Journal of Food Sciences and Nutrition, 2009, 60(S2):57-66.
[14] MUSTAFA S M, CHUA L S, EL-ENSHASY H A, et al.Effect of temperature and pH on the probiotication of Punica granatum juice using Lactobacillus species[J].Journal of Food Biochemistry, 2019, 43(4):e12805.
[15] 陈荣豪, 陈文学, 陈海明, 等.乳酸菌发酵过程中番木瓜饮料的主要成分分析与抗氧化活性变化[J].食品科学, 2018, 39(6):222-229.
CHEN R H, CHEN W X, CHEN H M, et al.Changes in major components and antioxidant activity of papaya beverage during fermentation with lactic acid bacteria[J].Food Science, 2018, 39(6):222-229.
[16] KWAW E, MA Y K, TCHABO W, et al.Effect of Lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chemistry, 2018, 250:148-154.
[17] 刘金龙, 危晶晶, 白敬, 等.植物乳杆菌发酵强化贝母-雪梨汁抗氧化性能的研究[J].食品研究与开发, 2020, 41(23):117-123.
LIU J L, WEI J J, BAI J, et al.Study on enhancement of antioxidant activity of Fritillaria-pear juice by Lactobacillus plantarum fermentation[J].Food Research and Development, 2020, 41(23):117-123.
[18] 罗松明. 乳酸菌发酵对泡仔姜品质的影响[D].雅安:四川农业大学, 2019.
LUO S M.Effect of Lactobacillus fermentation on the quality of pickled baby-ginger[D].Ya’an:Sichuan Agriculture University, 2019.
[19] CHOI J W, PARK H Y, OH M S, et al.Neuroprotective effect of 6-paradol enriched ginger extract by fermentation using Schizosaccharomyces pombe[J].Journal of Functional Foods, 2017, 31:304-310.
[20] 李萍. 植物乳杆菌发酵对生姜品质及功能影响的研究[D].南昌:南昌大学, 2014.
LI P.Effect of Lactobacillus plantarum fermentation on the quality and function of ginger[D].Nanchang:Nanchang University, 2014.
[21] 方晟, 陈俊沲, 周瑾, 等.金佛手酵素发酵过程中有机酸及其体外抗氧化性能分析[J].食品工业科技, 2020, 41(10):68-74.
FANG S, CHEN J D, ZHOU J, et al.Analysis of organic acids and antioxidant activity in vitro of Citrus medica jiaosu during fermentation process[J].Science and Technology of Food Industry, 2020, 41(10):68-74.
[22] LI X, OUYANG X, CAI R, et al.3′,8″-dimerization enhances the antioxidant capacity of flavonoids:Evidence from acacetin and isoginkgetin[J].Molecules, 2019, 24(11):E2039.
[23] 谈文诗. 潜在益生菌发酵姜汁黑豆奶的风味及抗氧化活性研究[D].广州:华南理工大学, 2018.
TAN W S.Study on flavor and antioxidant activity of potential probiotics fermented ginger flavored black soy yogurt[D].Guangzhou:South China University of Technology, 2018.
[24] 蒋鹏飞, 高海东, 赵丽丽, 等.不同采收期香椿茶发酵前后活性成分、降糖活性及其挥发性成分比较分析[J].食品科学, 2021, 42(2):262-270.
JIANG P F, GAO H D, ZHAO L L, et al.Comparative analysis of bioactive ingredients, hypoglycemic activity and volatile components of unfermented and fermented tea made from Toona sinensis buds at different harvest periods[J].Food Science, 2021, 42(2):262-270.
[25] HASHEMI S M B, JAFARPOUR D.Fermentation of bergamot juice with Lactobacillus plantarum strains in pure and mixed fermentations:Chemical composition, antioxidant activity and sensorial properties[J].LWT-Food Science and Technology, 2020, 131:109803.