溃疡性结肠炎(ulcerative colitis,UC)是一种症状为体重下降、血便和腹泻,出现肠黏膜受损、结肠组织溃烂、炎症严重的肠道疾病[1-2]。其发病机制由多种因素共同引起,涉及不健康饮食习惯、遗传因素、上皮屏障受损、免疫反应失调、肠道微生物失调等[3]。特别是UC早期引起炎症细胞因子过度表达,而促炎因子可通过NF-κB上调,加重结肠组织受损。通过抑制NF-κB信号通路的激活以减少炎症因子的释放是缓解UC的一种有效方法[4]。UC具有反复发作、难治愈、病程漫长的特点,对患者的正常生活有很大影响[5]。UC患者的常规药物主要有抗生素、免疫抑制药物,以及生物制品等[6]。其药物短期疗效好,但价格昂贵且长期使用副作用大、复发率高。因此,选用膳食中的天然活性成分对防治结肠炎具有重要意义。
刺梨(Rose roxburghii Tratt)一种广泛分布于西南地区的蔷薇科野生植物,刺梨具有优良的食疗效果,已被用于降血糖[7]、降血脂[8]、解酒护肝[9-10]、抗氧化[11]和缓解便秘[12]等方面。刺梨中含有丰富的多糖和黄酮成分[13-15]。研究表明,多糖、黄酮具有抗氧化、抗炎等功能。张潘等[16]研究刺梨多糖能降低非酒精性脂肪肝诱导的小鼠结肠炎症因子和氧化应激水平,改善脂质代谢紊乱状况;詹继红等[17]研究刺梨黄酮能增加丙二醛(malondialdehyde, MDA)含量并降低超氧化物歧化酶(superoxide dismutase, SOD)含量,保护受损肾小管上皮细胞。目前,针对刺梨总多糖(Rosa roxburghii Tratt total polysaccharide, RP)和总黄酮(Rosa roxburghii Tratt total flavonoids, RF)对结肠炎小鼠的相关研究鲜有报道。
因此,本试验采用3%(质量分数)葡聚糖硫酸钠(dextran sulfate sodium,DSS)溶液构建UC小鼠模型,研究刺梨多糖和黄酮对DSS诱导UC小鼠的缓解效果及其相关机理,为进一步筛选有效缓解结肠炎的饮食干预提供科学依据,及为开发相关刺梨功能性食品奠定基础。
1 材料与方法
1.1 材料与试剂
刺梨多糖,刺梨黄酮由本实验室自制[18],其中多糖标准曲线为y=8.074 3x+0.071 6(R2=0.991 1),经标准曲线计算刺梨中多糖相对含量为71%,黄酮标准曲线为y=17.56x-0.036 7(R2=0.999 2),经标准曲线计算得刺梨中黄酮相对含量为51%。
葡聚糖硫酸钠,MP biomedical公司;粪便隐血试剂盒,北京雷根生物有限公司;肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-10(interleukin-10,IL-10)、SOD、髓过氧化物酶(myeloperoxidase, MPO)、MDA、BCA试剂盒,泉州市睿信生物科技有限公司;RNA分离试剂盒,Foregene;反转录试剂盒、EvaGreen Express 2×qPCR、MasterMix-NoDye,abm;BCA蛋白浓度试剂盒,biosharp;MyD88、NF-κB p50、IκBα、NF-κB p65抗体,四川赛因斯特生物科技有限公司。
1.2 仪器与设备
JA1003C型电子天平,上海越平科学仪器(苏州)制造有限公司;H1-16KR型离心机,湖南可成仪器设备有限公司;Pannormic SCAN Ⅱ型病理切片扫描仪,3DHISTECH Kft;酶标仪、HM325切片机,赛默飞;超声波清洗器,上海冠特超声仪器有限公司;IKA 研磨仪,德国Janke&Kunkel公司;恒流泵,苏州辰傲电子科技有限公;UV9000S紫外分光光度计,上海元析仪器有限公司;LGJ-10 真空冷冻干燥机,北京松源华兴科技发展有限公司;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;荧光定量PCR仪,ABI公司。
1.3 实验动物
C57BL/6J雄性小鼠,8周龄,体重(22±2) g,SPF 级,购于斯贝福(北京)生物技术有限公司,生产许可证 SCXK(京)2019-0010。饲养在温度 22~24 ℃,湿度 60%~80%,12 h/12 h明暗交替的环境中。实验经贵州大学动物实验伦理委员会批准(编号:EAE-GZU-2020-P003),符合动物实验伦理。
1.4 实验方法
1.4.1 小鼠模型建立
将40只8周龄C57BL/6J雄鼠小鼠经适应性喂养7 d后,随机分成4组(n=10),即空白组、模型组、RP组(200 mg/kg BW)、RF组(200 mg/kg BW) [18]。动物实验设计如图1所示。除空白组自由饮用水外,其余各组饮用3%(质量分数)DSS溶液建立UC小鼠(7 d),于建模后第4天,进行给药干预,其中空白组和模型组按照小鼠体重灌胃生理盐水,连续干预10 d[1]。饲养期间每天观察小鼠粪便情况,记录疾病活动指数(disease activity index,DAI)评分,定时称重,并根据体重(10 mL/kg)调整灌胃剂量。实验末期,各组小鼠禁食不禁水12 h,摘眼球取血后脱颈处死,迅速取出小鼠结肠,量取结肠长度。随后将其分成3段,2段置于离心管放在-80 ℃冰箱保存,1段结肠组织浸泡于4%中性甲醛溶液。

图1 动物实验设计
Fig.1 Design of animal experiment
1.4.2 小鼠体重变化、结肠长度及DAI评分
实验期间,每日灌胃前称量小鼠体重,小鼠处死后,测量各组小鼠结肠长度。小鼠体重变化如公式(1)所示。每日收集小鼠粪便,采用粪便隐血试剂盒测定粪便隐血评分,根据表1计算DAI。
体重变化率![]()
(1)
表1 DAI评分
Table 1 DAI score

体重下降率/%大便性状大便隐血评分/分0正常2 min内不显色01~5松散10 s后浅绿渐变成绿色16~10半成形带黏液大便加入试剂初显浅绿逐渐呈褐色211~15稀便加入试剂呈蓝褐色,逐渐呈蓝黑褐色3>15腹泻加入试剂立即呈蓝黑褐色4
1.4.3 结肠组织病理学观察
取固定于4%中性甲醛溶液中的结肠组织,经脱水、包埋、切片、染色、封片制作切片,然后进行苏木精-伊红染色(hematoxylin-eosin staining,HE染色)。在光学显微镜下观察切片,分析结肠的病理损伤。
1.4.4 血清指标测定
解剖后的小鼠血液在室温下放置30 min,以3 500 r/min,离心10 min,取上清液按照试剂盒方法测定血清内毒素(lipopolysaccharide, LPS)和D-乳酸(D-lactic acid, D-lac)的含量。
1.4.5 结肠组织炎症因子的测定
称取适量结肠样本,向其中加入预冷PBS,匀浆离心获得结肠上清液,严格按照ELISA试剂盒说明书检测各组小鼠结肠组织中 IL-1β、TNF-α、IL-6、IL-10的含量变化。
1.4.6 结肠组织氧化应激水平的测定
称取适量结肠样本,向其中加入预冷PBS,匀浆离心获得结肠上清液,按照生化试剂盒说明书检测小鼠结肠组织中MDA、SOD、MPO活力。
1.4.7 免疫组织化学检测紧密连接蛋白的表达
将结肠组织进行切片脱蜡水化,抗原修复,切片放入3%(体积分数)过氧化氢溶液,室温避光孵育15 min,置于PBS中脱色摇床洗涤3次;血清封闭,加一抗4 ℃孵育过夜;复温10 min,置于PBS中脱色摇床洗涤3次,加二抗37 ℃孵育30 min;3,3-二氨基联苯胺(3,3-N-diaminobenzidine tertrahydrochloride,DAB)显色,复染细胞核,脱水封片,显微镜镜检,图像采集分析。
1.4.8 荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测
按照试剂盒说明书提取小鼠结肠组织的总RNA,检测RNA浓度及纯度。按照试剂盒方法将RNA反转录为cDNA,进行PCR扩增。引物如表2所示,以GAPDH作为对照,进行相对定量。引物序列由四川赛因斯特生物科技有限公司进行设计。
表2 荧光PCR引物序列
Table 2 Primer sequences used for fluorescence qPCR
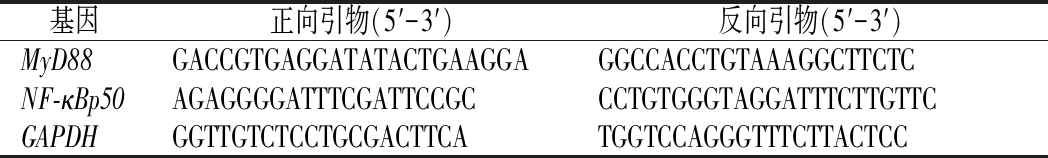
基因正向引物(5′-3′)反向引物(5′-3′)MyD88GACCGTGAGGATATACTGAAGGAGGCCACCTGTAAAGGCTTCTCNF-κBp50AGAGGGGATTTCGATTCCGCCCTGTGGGTAGGATTTCTTGTTCGAPDHGGTTGTCTCCTGCGACTTCATGGTCCAGGGTTTCTTACTCC
1.4.9 蛋白质免疫印迹分析
将结肠组织切成小块,加入适量磷酸化蛋白酶抑制剂匀浆,离心后收集上清液,提取总蛋白。BCA法测定蛋白浓度。将等量蛋白于适宜浓度的凝胶上电泳分离后,电转至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上。加入5%(体积分数)脱脂牛奶封闭1 h,稀释一抗,4 ℃孵育过夜,用TBST洗涤。二抗用TBST稀释,将膜和二抗一起室温孵育30 min后,用TBST将其在摇床上洗涤3次。将膜和化学发光试剂(enhanced chemiluminescence,ECL)溶液充分接触,在化学发光成像系统下采集图像。以β-actin作为对照。
1.5 数据处理与分析
通过SPSS 22.0进行数据分析,组间分析比较用单因素方差分析,并采用 LSD、Duncan 法进行比较,实验数据用平均值±标准偏差![]() 表示,P<0.05为统计学上有显著差异。Origin 2021画图。
表示,P<0.05为统计学上有显著差异。Origin 2021画图。
2 结果与分析
2.1 RP、RF对UC小鼠体重及体重变化率的影响
体重减轻、精神不济、血便是UC小鼠建模成功的典型性状之一。如图2所示,空白组小鼠体重基本保持不变。模型组小鼠自由饮用3%DSS溶液7 d,从第4天开始,体重发生明显减轻,逐渐有血便。第14天,与空白组相比,模型组小鼠的体重显著降低(30.13%)(P<0.01)。在实验期间,模型组小鼠死亡3只,原因可能是小鼠个体差异,过多饮用DSS水溶液,小鼠结肠损伤过重,体重显著下降,拉血便等导致死亡。经RP和RF干预后,与模型组相比,RP组、RF组小鼠体重均分别显著增加25.11% 和20.48%(P<0.01)。结果表明,RP、RF均能够抑制UC小鼠的体重下降,效果为RP>RF。
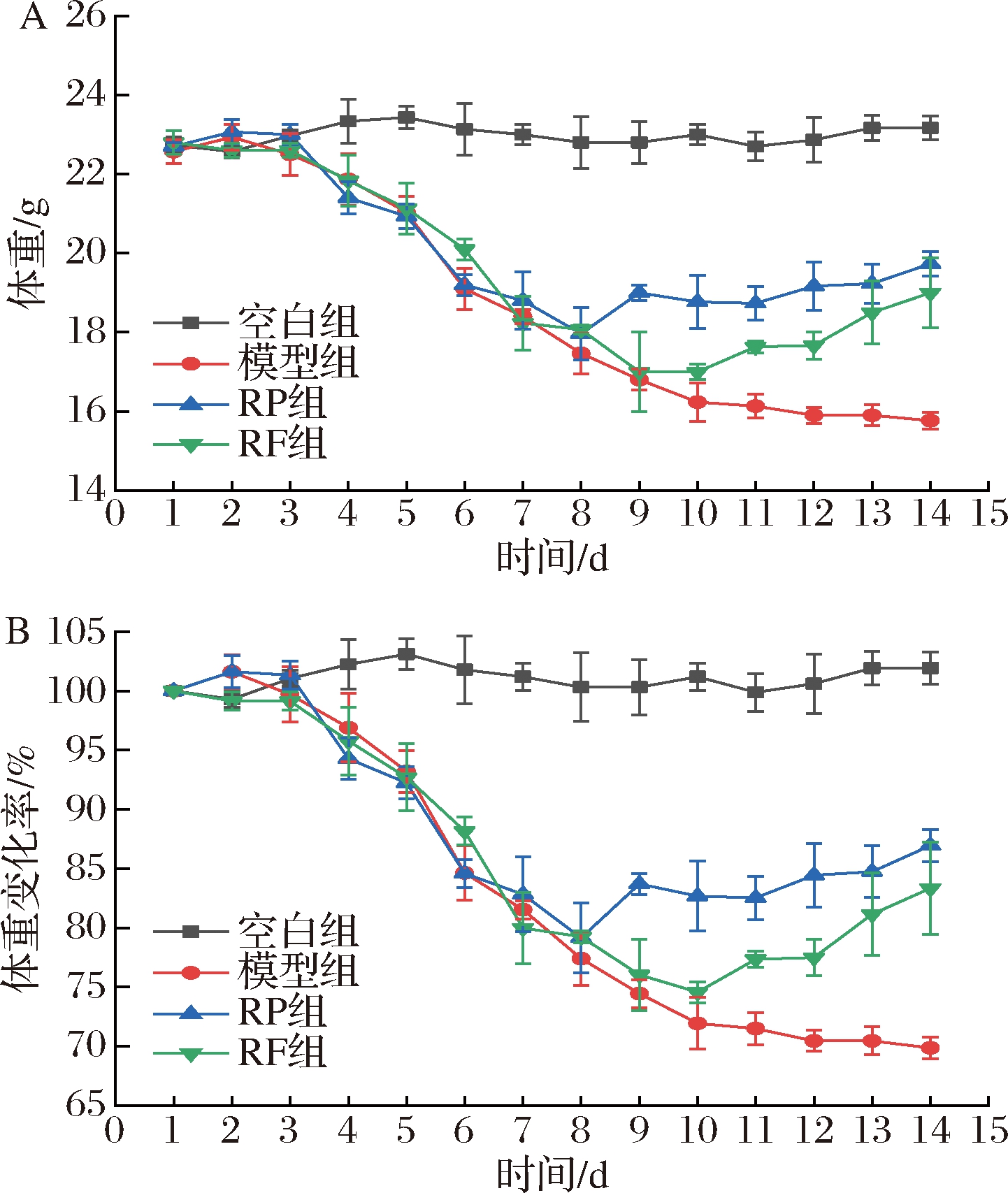
A-小鼠体重变化;B-小鼠体重变化率
图2 RP、RF对小鼠体重及体重变化率的影响
Fig.2 Effects of RP and RF on body weight and body weight change rate of mice
2.2 RP、RF对UC小鼠DAI评分的影响
DAI升高是判断UC小鼠患病严重程度的一个重要指标之一。如图3所示,空白组小鼠在整个实验期间,DAI为0。第14天,与模型组相比,经RP和RF干预后的UC小鼠DAI下降,RP组和RF组小鼠DAI评分显著降低(51.9% 和41.67%)(P<0.01)。结果表明,RP和RF均能降低UC小鼠的DAI,效果为RP>RF。
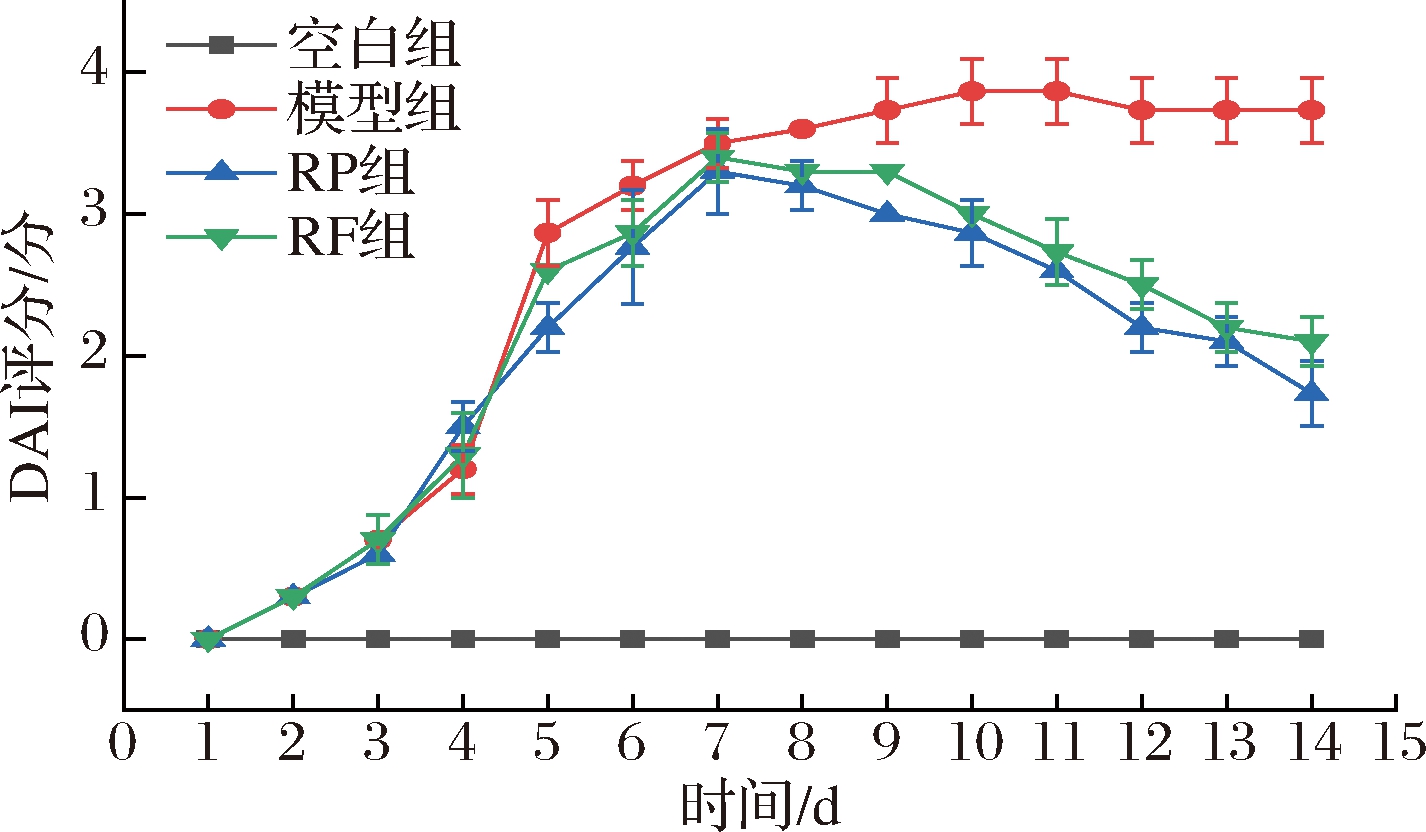
图3 RP、RF对UC小鼠DAI评分的影响
Fig.3 Effects of RP and RF on DAI score of UC mice
2.3 RP、RF对UC小鼠结肠长度及病理学的影响
UC小鼠会发生结肠长度明显缩短,肠壁充血,大便黏稠不成形出血甚至稀便的情况[1]。如图4-A所示,正常小鼠的结肠长度约为 5.93 cm,肠壁光滑均匀,大便正常。与空白组相比,模型组小鼠的结肠长度为4.50 cm,显著减少24.1%(P<0.01),肠壁明显萎缩。经RP、RF干预后,与模型组相比,RP组结肠长度上升22.22%,RP组结肠长度上升9.56%(P<0.01)。结果表明,RP和RF均能改善UC小鼠结肠长度减少的现象,效果为RP>RF。
为评价RP和RF对UC小鼠结肠组织形态结构的影响,对小鼠结肠组织进行HE染色。如图4-C所示,空白组小鼠结肠组织结构完整,黏膜层肠腺丰富,排列规则均匀;黏膜下层结构紧密,未出现病理损伤。模型组小鼠结肠黏膜层大面积坏死,出现大量的炎症,损伤严重。经RP和RF干预后,RP组结肠局部可见小灶性坏死,少量上皮细胞坏死以及肠腺坏死消失,炎性细胞浸润明显减少。RF组效果不明显,结肠黏膜层仍大面积坏死,肠上皮脱落,肠腺坏死消失,大量的炎性细胞浸润。与RF组相比,RP组能明显减少DSS引起的炎性细胞浸润结肠的程度,改善黏膜层坏死的结果,效果为RP>RF。

A~B-小鼠结肠长度;C~F-小鼠结肠HE染色(依次为空白组、模型组、RP组、RE组) 图4 RP、RF对UC小鼠结肠长度及结肠HE染色的影响
Fig.4 Effects of RP and RF on colonic length and colonic HE staining in UC mice
注:与空白组相比,*P<0.05,** P<0.01;与模型组相比,#P<0.05,##(P<0.01)(下同)
2.4 RP、RF对UC小鼠肠黏膜屏障损伤的影响
肠黏膜是影响UC的一个关键因素,肠黏膜屏障受损时,细菌及其代谢物侵入肠道和血液,LPS和D-lac水平上升[19]。如图5所示,与空白组相比,模型组LPS和D-lac分别极显著升高64%、43.48%(P<0.01),表明UC小鼠肠黏膜屏障受损。经RP和RF干预后,与模型组相比,RP组和RF组的LPS含量分别下降24.24%、13.88%(P<0.01);RP组和RF组的D-lac含量分别下降36.36%、21.23%(P<0.01)。效果为RP>RF。
2.5 RP、RF对UC小鼠炎症因子的影响
促炎因子与抗炎因子之间的失衡是UC发病的重要原因。巨噬细胞过量释放TNF-α 引发UC,随后IL-1β、IL-6浓度升高及IL-10浓度降低[20]。如图6所示,与空白组相比,模型组中促炎因子TNF-α、IL-1β和IL-6分泌水平极显著升高(P<0.01),含量分别升高77.21%、66.06%、59.93%,抑炎因子IL-10分泌水平极显著降低51.10%(P<0.01)。经RP和RF干预后,与模型组相比,RP组和RF组的TNF-α含量分别极显著下降38.86%、30.61%(P<0.01);RP组和RF组的 IL-1β 含量分别极显著下降46.54%、16.58%(P<0.01);RP组和RF组的IL-6 含量分别下降28.66%(P<0.01)、9.00%,但是RF未能显著下降UC小鼠的IL-6含量,与模型组相比无显著差异。RP组和RF组的 IL-10含量分别极显著升高35.69%、21.88 %(P<0.01)。结果表明,RP组和RF组均能降低促炎因子 TNF-α、IL-1β和IL-6分泌水平,提高抗炎因子IL-10分泌水平,说明RP和RF均降低UC小鼠的炎症反应,保护结肠组织。促炎因子和抗炎因子的效果都是RP>RF。
2.6 RP、RF对UC小鼠氧化应激的影响
通过检测抗氧化指标(MPO和SOD)和脂质过氧化物标志物(MDA)来评估样品对UC小鼠氧化应激的影响[21]。如图7所示,与空白组相比,模型组的MPO活性极显著升高72%(P<0.01),MDA含量极显著升高147.92%(P<0.01),SOD活性极显著下降54.12%(P<0.01)。经RP和RF干预后,与模型组相比,RP组和RF组的MPO活性分别极显著下降30.3%、22.86%(P<0.01),RP组和RF组的MDA含量分别极显著下降53.31%、16.12%(P<0.01),RP组和RF组的SOD活性分别极显著增加76.60%、58.46%(P<0.01)。结果表明,RP组和RF组均能抗氧化应激,在一定程度上有效改善UC,3个指标的效果都是RP>RF。
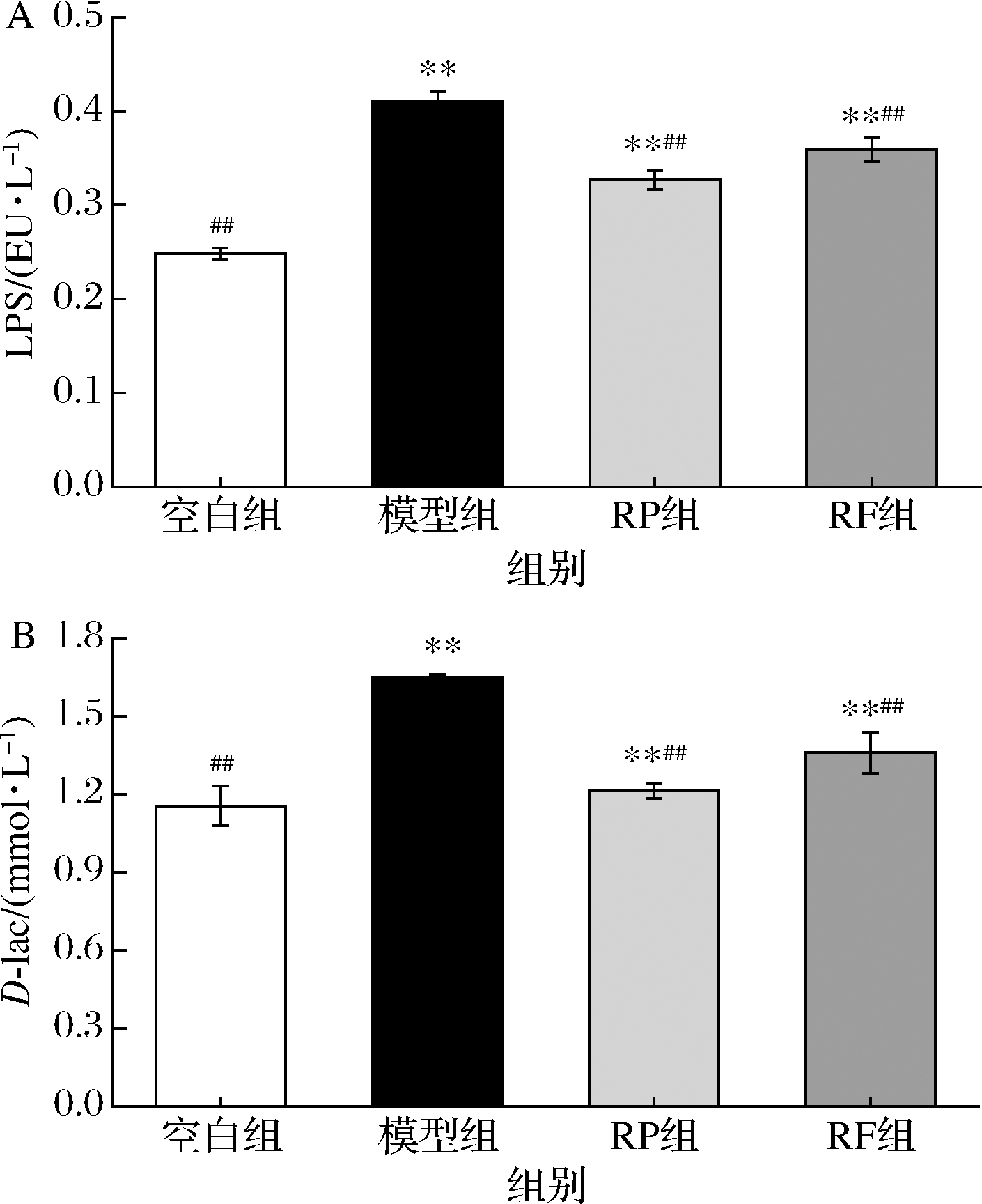
A-LPS水平;B-D-lac水平
图5 RP、RF对UC小鼠肠黏膜屏障损伤的影响
Fig.5 Effects of RP and RF on intestinal mucosal barrier injury in UC mice
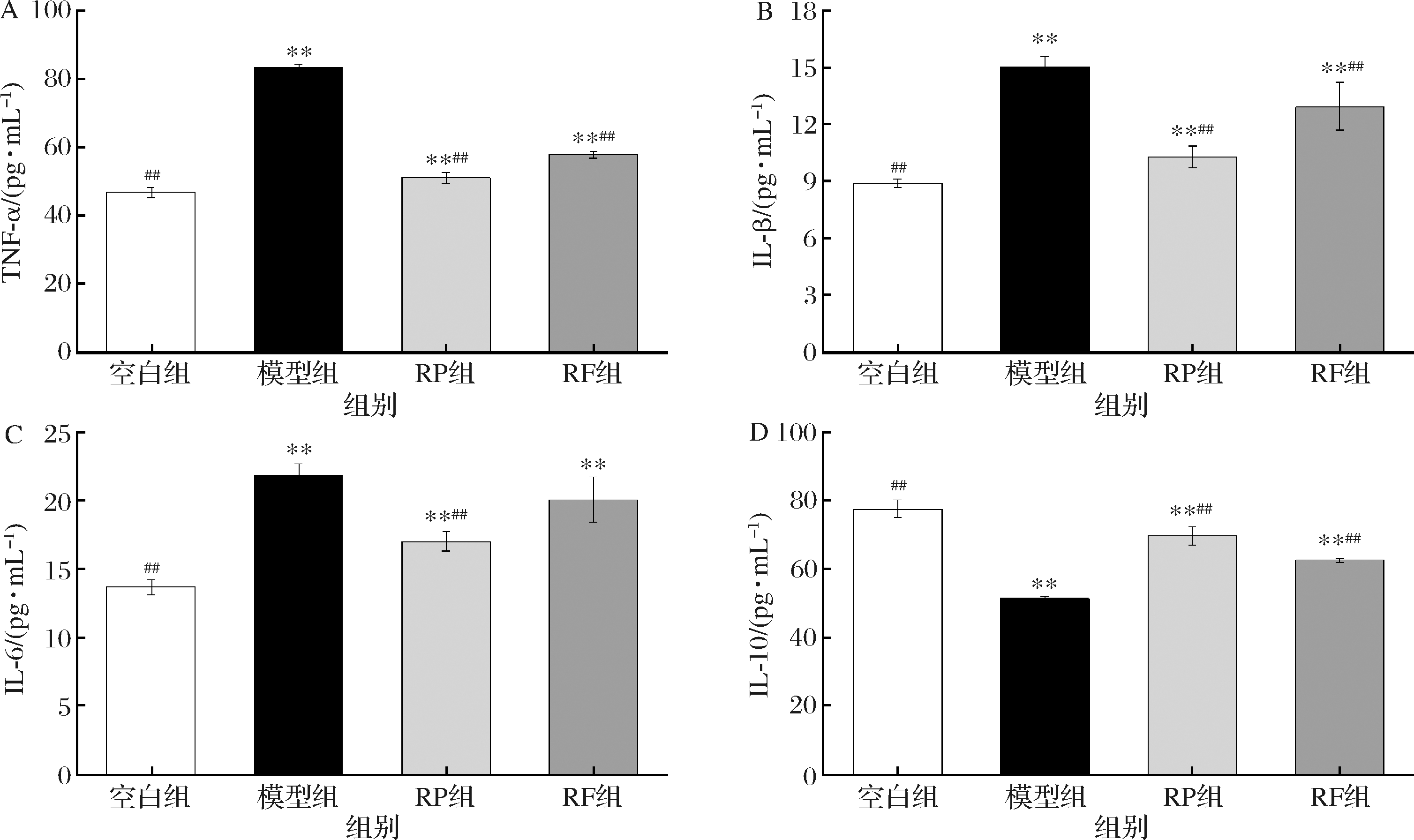
A-TNF-α含量;B-IL-1β含量;C-IL-6含量;D-IL-10含量
图6 RP、RF对UC小鼠炎症因子的影响
Fig.6 Effects of RP and RF on inflammatory factors in UC mice
2.7 RP、RF对UC小鼠紧密连接蛋白的影响
DSS诱导的UC小鼠会诱导肠道上皮功能障碍,导致肠道通透性增加和肠内细菌易位,进而引发肠道炎症[22]。因此采用免疫组化染色检测紧密连接蛋白ZO-1和Occludin在结肠中的分布。如图8所示,空白组中细胞间的棕黄色区域较多,表示ZO-1和Occludin表达较高,均匀分布在隐窝之间。与空白组相比,模型组中的阳性细胞减少,分布紊乱,部分隐窝缺失,ZO-1和Occludin表达明显减少。经RP和RF干预后,与模型组相比,RP组和RF组的ZO-1和Occludin表达明显增加,棕黄色区域占比显著提升。结果表明,RP和RF均能增加UC小鼠的紧密连接蛋白表达量,结果表明,RP和RF能有效改善UC小鼠结肠黏膜屏障受损,从而缓解UC症状,效果RP>RF。
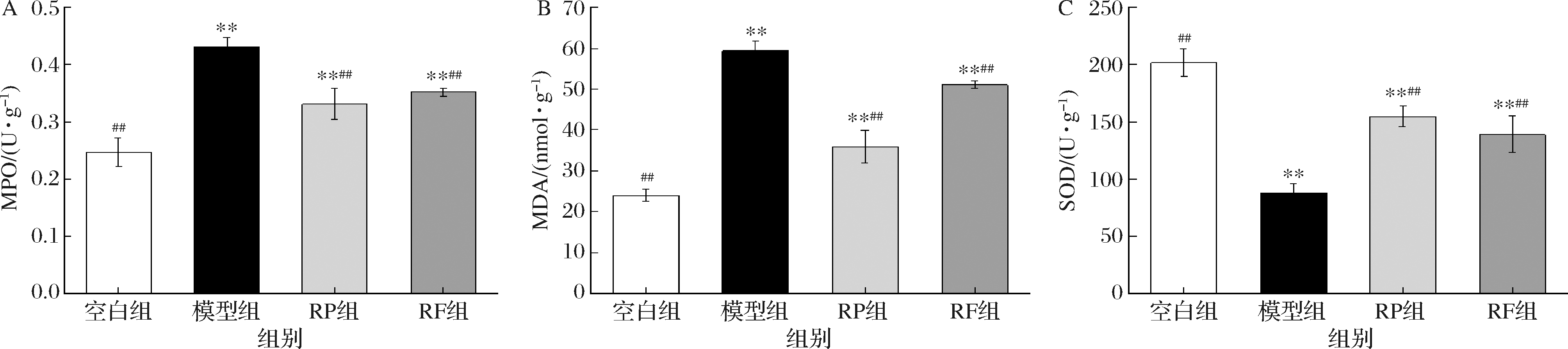
A-MPO活性;B-MDA含量;C-SOD活性
图7 RP、RF对UC小鼠氧化应激的影响
Fig.7 Effects of RP and RF on oxidative stress in UC mice

A-ZO-1蛋白;B-Occludin蛋白
图8 RP、RF对UC小鼠紧密连接蛋白的影响
Fig.8 Effects of RP and RF on tight junction protein in UC mice
2.8 RP、RF对NF-κB信号通路的影响
UC小鼠会造成炎症细胞因子过度表达,NF-κB信号通路是调节炎症反应的关键开关,可控制炎症细胞因子的表达,通过抑制NF-κB信号通路激活能防止UC[23]。RP、RF对NF-κB信号通路的影响如图9所示。
如图9所示,与空白组相比,模型组MyD88 mRNA和NF-κB p50 mRNA表达量分别升高 2.93、15.23倍(P<0.01)。经RP和RF干预后,与模型组相比,RP组和RF组MyD88的mRNA表达量分别降低47.04%(P<0.01)、29.74 %(P<0.01)。RP组和RF组NF-κB p50的mRNA表达量分别降低3.66倍(P<0.01)、0.81倍(P<0.01)。
与空白组相比,模型组小鼠体内的MyD88、NF-κB p50、p-IκBα和p-NF-κB p65蛋白水平表达均极显著升高(P<0.01),说明DSS激活小鼠体内的NF-κB信号通路。经RP组和RF干预后,与模型组相比,RP组极显著下调MyD88、NF-κB p50、p-IκBα和p-NF-κB p65蛋白的表达量,分别为66.27%、30.43%、63.86%、23.16%(P<0.01)。RF组极显著下调MyD88、NF-κB p50、p-IκBα和p-NF-κB p65蛋白的表达量分别是18.97%、9.1%、19.30%、5.41%(P<0.01)。结果表明,RF组更能下调NF-κB信号通路中各蛋白的表达量。提示RP和RF可能通过调控NF-κB信号通路有效拮抗炎症细胞因子引起的损伤,减轻UC症状。
3 讨论与结论
近年来,天然植物生物活性化合物,如多糖和黄酮,因其强大的抗炎能力和安全性的优势在缓解UC损伤方面受到越来越多的关注[24-25]。因此,本实验研究RP和RF缓解溃疡性结肠炎的效果及可能机制。

A-MyD88 mRNA表达量;B-NF-κB p50 mRNA表达量;C-蛋白印迹图;D-MyD88、NF-κB p50、p-IκBα和p-NF-κB p65蛋白相对表达量
图9 RP、RF对NF-κB信号通路的影响
Fig.9 Effects of RP and RF on NF-κB signaling pathway
肠道屏障受损被认为是UC的主要特征。当紧密连接蛋白(ZO-1和Occludin)的表达量减少,分布不均匀时会导致“肠漏”发生,大量细菌及其代谢物(如D-lac和LPS)进入肠道和血液,引起各种细胞炎症因子的释放导致肠道炎症[26]。RP、RF能明显降低血清中LPS和D-Lac的含量,增加ZO-1和Occludin的表达并均匀分布。但RP效果更佳,说明RP对肠道屏障完整性更具有保护作用进而缓解UC。这与CHEN等[27]研究发现茶多糖能通过上调UC小鼠中Occludin和Claudin-1表达,修复肠道上皮细胞中黏膜屏障的结果相同。
UC小鼠的结肠黏膜会遭到大量炎性细胞浸润,激发促炎细胞因子在结肠组织中过度表达,引发肠道炎症,促进UC的发生。TNF-α是由淋巴细胞和巨噬细胞释放的主要的炎症内源性介质,可调节促炎细胞因子的起始和扩散炎症[28]。IL-1β可促进炎症细胞的激活和集聚,增加肠道上皮屏障的通透性。促炎因子IL-6过度表达可激活NF-κB 信号通路并加重肠道炎症。IL-10是能抑制嗜中性粒细胞、减少促炎因子的表达、保护组织和器官不受损伤重要的抗炎细胞因子[29]。RP和RF均能减少促炎因子TNF-α、IL-1β和IL-6的表达,增加抗炎因子IL-10的含量。结肠病理结果表明,RP和RF均能改善炎性细胞浸润结肠组织,一定程度上保护结肠黏膜,RP的效果较佳。
NF-κB 信号通路的活化是UC发病的重要特征,能产生更多的促炎因子,如TNF-α,IL-1β,IL-6,进一步加剧炎症反应[30]。抑制NF-κB活化是减少炎性细胞因子产生的有效策略。基于以上结果表明RP、RF的干预能使炎症细胞因子尽量保持平衡,属于抗炎物质。因此本研究进一步关注RP、RF是否可通过抑制NF-κB 信号通路减少促炎细胞因子的产生,从而缓解UC。模型组中结肠MyD88、pIkBα和NF-κBp65的蛋白表达量上调,说明NF-κB通路激活,经RP、RF处理后显著下调MyD88、P-IκBα和NF-κBp65的蛋白表达量,同时炎症因子TNF-α,IL-1β,IL-6的水平降低,表明RP、RF可抑制NF-κB信号通路,RP的效果较佳。因此,推断RP可能通过抑制NF-κB信号通路来调节UC小鼠的炎症。
综上所述,RP和RF均具有缓解DSS诱导的UC小鼠的作用。与RF相比,相同剂量的RP对UC小鼠的体重减轻、结肠长度缩短、结肠组织病理损伤、炎症因子表达、氧化应激和抑制NF-kB信号通路具有更高的抑制作用。基于研究数据显示,较RF而言,RP在缓解溃疡性结肠炎方面表现出更大的潜力。
[1] 邓代霞, 李凤兰, 李潮云, 等.鱼腥草对葡聚糖硫酸钠诱导溃疡性结肠炎小鼠的缓解及保护作用[J/OL].食品科学,2022.http://kns.cnki.net/kcms/detail/11.2206.TS.20220414.1438.122.html.
DENG D X, LI F L, LI C Y, et al.Palliative and protective effects of Houttuynia cordata on mice with ulcerative colitis induced by dextran sulfate sodium[J/OL].Food Science, 2022.http://kns.cnki.net/kcms/detail/11.2206.TS.20220414.1438.122.html.
[2] NIU W, CHEN X Q, XU R L, et al.Polysaccharides from natural resources exhibit great potential in the treatment of ulcerative colitis:A review[J].Carbohydrate Polymers, 2021, 254:117189.
[3] 吴苹, 刘晋倩, 陈芳.天然多糖对溃疡性结肠炎的治疗作用概述[J].生物学教学, 2021, 46(11):2-4.
WU P, LIU J Q, CHEN F.Summary of the therapeutic effect of natural polysaccharides on ulcerative colitis[J].Biology Teaching, 2021, 46(11):2-4.
[4] KANG J H, CHOI S, JANG J E, et al.Wasabia japonica is a potential functional food to prevent colitis via inhibiting the NF-κB signaling pathway[J].Food & Function, 2017, 8(8):2 865-2 874.
[5] 薛明松, 郑玉玉, 张宇峰, 等.黄连粗多糖协同小檗碱改善溃疡性结肠炎肠黏膜屏障损伤的作用[J].中国实验方剂学杂志, 2022,28(13):71-76.
XUE M S, ZHENG Y Y, ZHANG Y F, et al.Coptidis rhizoma crude polysaccharide and berberine synergistically restore intestinal mucosal barrier damage in ulcerative colitis[J].Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(13):71-76.
[6] UNGARO R, MEHANDRU S, ALLEN P B, et al.Ulcerative colitis[J].Lancet (London, England), 2017, 389(10 080):1 756-1 770.
[7] CHEN C, TAN S M, REN T Y, et al.Polyphenol from Rosa roxburghii Tratt fruit ameliorates the symptoms of diabetes by activating the P13K/AKT insulin pathway in db/db mice[J].Foods (Basel, Switzerland), 2022, 11(5):636-636.
[8] JI J C, ZHANG S, TANG L, et al.Integrative analysis of fecal metabolome and gut microbiota in high-fat diet-induced hyperlipidemic rats treated with Rosa roxburghii Tratt juice[J].Journal of Functional Foods, 2022, 90:104978.
[9] NI H Y, YU L, ZHAO X L, et al.Seed oil of Rosa roxburghii Tratt against non-alcoholic fatty liver disease in vivo and in vitro through PPARα/PGC-1α-mediated mitochondrial oxidative metabolism[J].Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 98:153919.
[10] 周宏炫, 黄颖, 谭书明, 等.刺梨多酚对急性酒精中毒大鼠的解酒和护肝作用[J].食品科学, 2021, 42(17):163-169.
ZHOU H X, HUANG Y, TAN S M, et al. Anti-alcoholic and hepatoprotective effects of polyphenols from the fruit of Rosa roxburghii Tratt in rats with acute alcoholism[J].Food Science, 2021, 42(17):163-169.
[11] 杨笙, 谭书明, 陈超, 等.刺梨多酚的纯化工艺及体外抗氧化研究[J].食品与发酵科技, 2022, 58(1):7-14.
YANG S, TAN S M, CHEN C, et al.Study on purification technology and in vitro antioxidant activity of Rosa roxburghii polyphenols[J].Food and Fermentation Science & Technology, 2022, 58(1):7-14.
[12] 涂永丽, 谭书明, 周宏炫, 等.刺梨口服液对消化不良小鼠胃肠动力的促进作用[J].现代食品科技, 2021,37(1):17-23.
TU Y L, TAN S M, ZHOU H X, et al.Effect of Rose roxburghii Tratt oral liquid on gastrointestinal motility in dyspepsia mice[J].Modern Food Science and Technology, 2021,37(1):17-23.
[13] ZENG F, GE Z, LIMWACHIRANON J, et al.Antioxidant and tyrosinase inhibitory activity of Rosa roxburghii fruit and identification of main bioactive phytochemicals by UPLC-Triple-TOF/MS[J].International Journal of Food Science & Technology, 2017,52(4):897-905.
[14] 王振伟, 郑黎静.刺梨多糖的提取纯化及生物活性研究进展[J].农业技术与装备,2021(11):105-107.
WANG Z W, ZHENG L J.Research progress on extraction purification and biological activity of prickly pear polysaccharide[J].Agricultural Technology & Equipment, 2021(11):105-107.
[15] 孙红艳, 戚晓阳, 王国辉, 等.不同处理对刺梨黄酮含量及其抑菌活性的影响[J].食品研究与开发, 2016,37(5):1-4.
SUN H Y, QI X Y, WANG G H,et al.Influence of different treatment on the total flavonoid content and its antibacterial activity in the fruits of Rosa roxburghii Tratt[J].Food Research and Development, 2016,37(5):1-4.
[16] 张潘, 汪磊, 陈洁, 等.刺梨多糖对非酒精性脂肪肝小鼠回肠粘膜屏障功能的影响[J/OL].食品科学, 2022. http://kns.cnki.net/kcms/detail/11.2206.TS.20220621.1730.051.html.
ZHANG P, WANG L, CHEN J, et al.Effects of Rosa roxburghii Tratt polysaccharide on ileal mucosal barrier function in mice with non-alcoholic fatty liver[J/OL].Food Science, 2022. http://kns.cnki.net/kcms/detail/11.2206.TS.20220621.1730.051.html.
[17] 詹继红, 刘铭洁, 郭银雪.刺梨黄酮抗氧化应激抑制模型大鼠TGF-β1、TGF-βRⅠ延缓肾间质纤维化的实验研究[J].中华中医药学刊, 2018,36(6):1 291-1 293.
ZHAN J H, LIU M J,GUO Y X, et al.Experimental study of Rosa roxburghii flavones oxidation stress inhibition rats′ TGF-β1 and TGF-βRⅠ delaying renal interstitial fibrosis[J].Chinese Archives of Traditional Chinese Medicine, 2018,36(6):1 291-1 293.
[18] 陈超, 谭书明, 王画, 等.刺梨及其活性成分对2型糖尿病小鼠糖脂代谢的影响[J].食品科学,2022,43(13):146-154.
CHEN C, TAN S M, WANG H, et al.Effects of Rosa roxburghii Tratt fruit and its active ingredients on glucose and lipid metabolism in type 2 diabetic mice[J].Food Science,2022,43(13):146-154.
[19] YE Y J, LU Y S, ZHOU X, et al.Protective effects of acupuncture intervention against damage of intestinal mucosal barri er induced by 5-fluorouracil in rats[J].Acupuncture Research, 2016,41(2):95-99.
[20] ZHANG Y K, LU F, ZHANG H, et al.Polysaccharides from Agaricus blazei Murrill ameliorate dextran sulfate sodium-induced colitis via attenuating intestinal barrier dysfunction[J].Journal of Functional Foods, 2022,92:105072.
[21] CHEN Z X, YI L, PAN Y N, et al.Lactobacillus fermentum ZS40 ameliorates inflammation in mice with ulcerative colitis induced by dextran sulfate sodium[J].Frontiers in Pharmacology, 2021,12:700217.
[22] CHEN X Y, LI X, SUN-WATERHOUSE D, et al.Polysaccharides from Sargassum fusiforme after UV/H2O2 degradation effectively ameliorate dextran sulfate sodium-induced colitis[J].Food & function, 2021, 12(23):11 747-11 759.
[23] LI S,CHEN Y,ZHANG Y, et al.Polyphenolic extracts of coffee cherry husks alleviated colitis-induced neural inflammationvia NF-κB signaling regulation and gut microbiota modification[J].Journal of Agricultural and Food Chemistry, 2022,70(21):6 467-6 477.
[24] 王翠芳, 王特日格乐, 杜红喜, 等.沙葱总黄酮水洗组分的体外抗炎活性[J].食品科学,2019,40(23):163-169.
WANG C F, WANG T, DU H X, et al.Anti-inflammatory activity in vitro of water-eluted fraction of total flavonoids extracted from Allium mongolicum Regel[J].Food Science, 2019,40(23):163-169.
[25] 陈国伟, 邱春红, 田灵敏, 等.食源性天然产物中多糖干预炎症性肠病的研究进展[J].食品科学, 2019,40(13):281-287.
CHEN G W, QIU C H, TIAN L M, et al.Recent progress in food-derived natural polysaccharide intervention in inflammatory bowel disease[J].Food Science, 2019,40(13):281-287.
[26] WANG L, ZHANG P, LI C, et al.A polysaccharide from Rosa roxburghii Tratt fruit attenuates high-fat diet-induced intestinal barrier dysfunction and inflammation in mice by modulating the gut microbiota[J].Food & function, 2022,13(2):530-547.
[27] CHEN C H, WANG H, HONG T, et al.Effects of tea polysaccharides in combination with polyphenols on dextran sodium sulfate-induced colitis in mice[J].Food Chemistry:X, 2021,13:100190.
[28] 蒯云逸, 蒋和浩, 红雷, 等.岩藻多糖对大鼠肾脏氧化应激、炎症和细胞凋亡的缓解作用[J].动物营养学报, 2022,34(8):5 393-5 403.
KUAI Y Y, JIANG H H, HONG L, et al.Alleviating effects of fucoidan on oxidative stress, inflammation and apoptosis in kidney of rat[J].Chinese Journal of Animal Nutrition, 2022,34(8):5 393-5 403.
[29] LI S, CHEN Y, ZHANG Y, et al.Polyphenolic extracts of coffee cherry husks alleviated colitis-induced neural inflammation via NF-κB signaling regulation and gut microbiota modification[J].Journal of Agricultural and Food Chemistry,2022, 70(21):6 467-6 477.
[30] GUO X X, XU Y, GENG R X, et al.Curcumin alleviates dextran sulfate sodium-induced colitis in mice through regulating gut microbiota[J].Molecular Nutrition & Food Research, 2022,66(8):e2100943.