二十二碳六烯酸(docosahexaenoic acid, DHA)是一种对人体十分重要的ω-3多不饱和脂肪酸,具有促进脑细胞发育、增强视力、防治心血管疾病等生理功能[1],广泛用于食品医药行业。DHA的传统来源是深海鱼油,但由于受到鱼类资源过度捕捞、海洋环境污染、产品腥味较大等限制,产量和质量难以满足人们对DHA日益增长的需求,寻求一条可持续的替代生产途径迫在眉睫[2]。近年来人们开展了利用海洋真菌包括裂殖壶菌(Schizochytrium sp.)、破囊壶菌(Aurantiochytrium sp.)、隐甲藻(Cryptheconidium cohnii)等发酵生产DHA油脂的研究[3-5]。
裂殖壶菌又称裂壶藻,是一种异氧单细胞海洋真菌,具有生长速度快、易培养、DHA含量高和油脂食用安全等优点,是替代深海鱼油生产DHA的极具潜力微生物[6]。2010年国家卫生部将裂殖壶菌油脂批准为新资源食品。利用裂殖壶菌发酵产DHA油脂已成为研究热点[7],研究主要集中在菌株选育[8-9]、发酵底物[10]、发酵工艺[11]、油脂提取分析[12]等方面。裂殖壶菌培养过程一般可分为细胞增殖期、油脂积累期、油脂反耗期3个阶段,而氮、磷等营养物质通过参与并调控细胞代谢,对细胞生长、油脂合成启动、油脂产量、脂肪酸组成等产生重要影响[13-16]。REN等[13]发现添加氮源谷氨酸钠促进了裂殖壶菌细胞生长但抑制了油脂积累,而添加硫酸铵则提高了总脂肪酸中DHA含量但抑制了细胞生长和油脂积累;LING等[14]采用挡板摇瓶中补加谷氨酸钠工艺提高了裂殖壶菌生物量和DHA产量;本实验室研究发现酵母浸粉和谷氨酸钠的有机氮源组合能够提高裂殖壶菌生物量、油脂产量和DHA含量,而添加无机氮源则降低了生物量和油脂产量[15]。磷源方面,REN等[16]研究了KH2PO4浓度对裂殖壶菌油脂产量和DHA合成的影响,发现磷限制条件下更有利于油脂积累和DHA生成。上述研究表明,氮、磷源作为裂殖壶菌生长所需的重要营养物质,其种类和浓度会显著影响细胞生长和油脂积累。本文利用一株裂殖壶菌DP-16发酵产DHA油脂,进一步研究了氮源(酵母浸粉+谷氨酸钠)和磷源(KH2PO4)浓度对菌体生长和油脂积累的影响,以期为裂殖壶菌发酵生产DHA油脂工业化提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种
裂殖壶菌Schizochytrium sp.DP-16,本实验室保藏于-80 ℃冰箱的甘油管中。
1.1.2 试剂
葡萄糖、硫酸镁,天津市大茂化学试剂厂;酵母浸粉、蛋白胨,北京奥博星生物技术有限责任公司;谷氨酸钠,国药集团化学试剂有限公司;KH2PO4,天津市科密欧化学试剂有限公司;海水晶,山东强隆海水晶厂。
1.1.3 培养基
种子培养基(g/L):葡萄糖30,酵母浸粉10,蛋白胨2,海水晶15,pH 6.0,121 ℃灭菌20 min;对照发酵培养基C(g/L):葡萄糖80,酵母浸粉10,谷氨酸钠10,KH2PO4·H2O 7,MgSO4·7H2O 5,海水晶15,pH 6.0,121 ℃灭菌20 min;低氮发酵培养基N-(g/L):酵母浸粉1,谷氨酸钠1,其余同对照;高氮发酵培养基N+(g/L):酵母浸粉30,谷氨酸钠30,其余同对照;低磷发酵培养基P-(g/L):KH2PO4·H2O 1,其余同对照;高磷发酵培养基P+(g/L):KH2PO4·H2O 20,其余同对照;低氮低磷发酵培养基N-P-(g/L):酵母浸粉1,谷氨酸钠1,KH2PO4·H2O 1,其余同对照;高氮高磷发酵培养基N+P+(g/L):酵母浸粉30,谷氨酸钠30,KH2PO4·H2O 20,其余同对照。
1.2 仪器与设备
SYQ-DSK-20B高压蒸汽灭菌锅,上海申安医疗器械厂;SWCCL-2FD超净工作台,上海博讯实业有限公司医疗设备厂;SL-202 N电子天平,上海长桥精密科学仪器有限公司;PHS-3C精密pH计,上海精密科学仪器有限公司;ZHWY-2102C全温度恒温摇床,上海智城分析仪器制造有限公司;GL-21M高速离心机,长沙市湘仪离心机仪器有限公司;SH420F石墨消解仪、K9860全自动凯氏定氮仪,济南海能仪器股份有限公司。
1.3 实验方法
1.3.1 种子液制备
取甘油管菌种,接种于装有30 mL种子培养基的250 mL三角瓶中,置于25 ℃、160 r/min恒温摇床上振荡培养48 h。
1.3.2 摇瓶发酵
按10%(体积分数)接种量将种子液接入装有30 mL发酵培养基的250 mL三角瓶中,于25 ℃、160 r/min 条件下振荡培养,定时取样测定总氮、溶磷、葡萄糖浓度、生物量、油脂产量,并计算油脂含量。
1.3.3 分析方法
采用DNS法测定葡萄糖浓度;采用细胞干重法测定生物量:取2 mL发酵液加入预先称重的离心管中,加入3 mL去离子水,10 000 r/min离心10 min,弃上清液,沉淀用去离子水洗涤2次,置于60 ℃烘干至恒重,称重;采用磷酸香草醛法测定油脂产量[17];采用凯氏定氮法测定总氮含量:发酵液离心后,取3 mL 上清液于消化管中,加入0.3 g硫酸铜、3 g硫酸钾和10 mL浓硫酸进行消化,然后采用凯氏定氮仪测定;溶磷浓度测定:发酵液离心后,取0.1 mL上清液至试管中,加2.9 mL去离子水和3 mL定磷试剂[V(3 mol/L硫酸溶液)∶V(水)∶V(25 g/L钼酸铵溶液)∶V(100 g/L抗坏血酸溶液)=1∶2∶1∶1]摇匀,45 ℃水浴20 min,冷却至室温,660 nm测吸光值,对照溶磷标准曲线,计算发酵液中溶磷浓度。
1.3.4 数据处理
每组试验3个平行,结果表示为平均值±标准偏差,采用Origin软件绘制图表。
2 结果与分析
2.1 裂殖壶菌发酵产油脂过程分析
Schizochytrium sp.DP-16在对照发酵培养基中培养,发酵时间进程如图1所示。在发酵初期(0~24 h),葡萄糖浓度开始降低,生物量逐渐上升,而油脂产量和油脂含量均保持在很低水平,此阶段为菌体消耗营养物质(包括碳、氮、磷源)用于细胞增长繁殖的增殖期;在发酵过程的第二阶段(24~84 h),葡萄糖被快速消耗利用,细胞生物量、油脂产量和油脂含量快速增加,在72 h左右葡萄糖基本耗尽,生物量达42.3 g/L,油脂产量和油脂含量在84 h达到最高,分别为14.1 g/L 和33.5%,此阶段为菌体细胞代谢葡萄糖生成油脂(主要为甘油三酯)贮存在胞内的油脂积累期;在发酵后期(84~96 h),培养基中碳源葡萄糖已耗尽,菌体开始消耗利用细胞内贮存的油脂来维持其必需的生命代谢活动,油脂产量和油脂含量开始下降,进入了油脂反耗期。
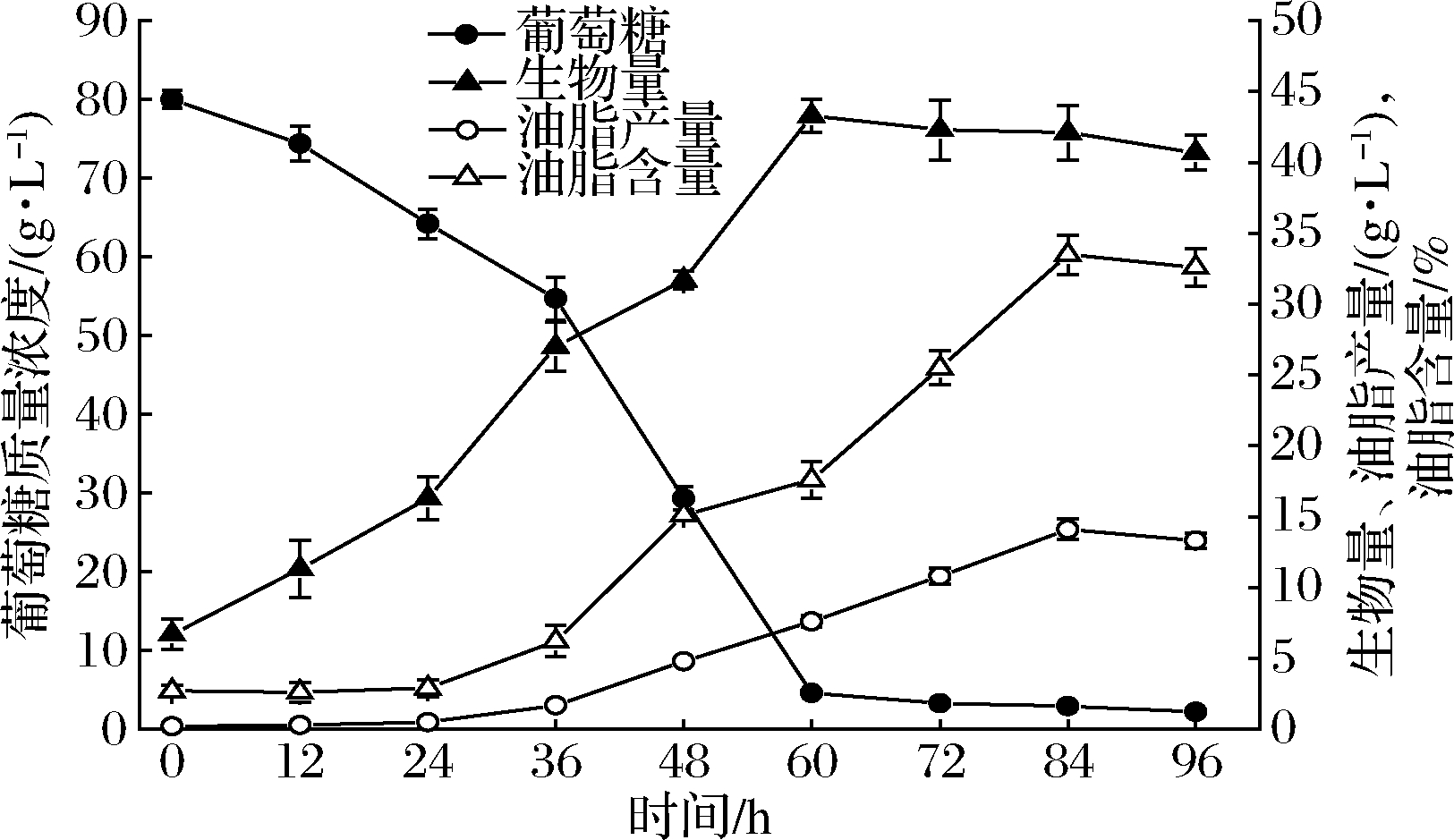
图1 Schizochytrium sp.DP-16在对照发酵培养基中的发酵时间进程
Fig.1 Time course of fermentation by Schizochytrium sp.DP-16 in control fermentation medium
2.2 氮源浓度对裂殖壶菌生长和油脂积累的影响
Schizochytrium sp.DP-16在低氮(N-)、对照(C)、高氮(N+)3个不同氮源浓度下培养,葡萄糖浓度、生物量、油脂产量和油脂含量变化情况如图2所示。在1 g/L酵母浸粉和1 g/L谷氨酸钠的低氮源浓度(N-)条件下,菌株消耗利用葡萄糖较慢,96 h残留葡萄糖浓度高达35.8 g/L,远高于对照(C)和高氮(N+)组,而低氮(N-)条件下的生物量则显著低于对照(C)和高氮(N+)组,说明氮源浓度过低导致严重限制菌体生长增殖。从油脂产量和油脂含量变化来看,低氮(N-)组从12 h开始油脂含量快速增加,高于对照(C)和高氮(N+)组,说明低氮条件下氮源被菌体快速耗尽使得更早进入油脂积累期,但受限于生物量过低导致最终油脂产量低于对照(C)。30 g/L酵母浸粉和30 g/L谷氨酸钠的高氮源浓度(N+)虽然有利于Schizochytrium sp.DP-16的增殖,84 h 生物量达到45.2 g/L,但由于营养物质(通常为氮源)耗尽是产油微生物油脂积累启动的先决条件,氮源浓度过高导致难以启动油脂积累,并不有利于油脂生成,96 h的油脂产量仅为9.4 g/L,油脂含量仅为23.3%,均明显低于对照(C)。由上述结果可知,氮源浓度对裂殖壶菌生长和油脂积累产生重要影响,氮源浓度过低或过高均不利于油脂生成。为提高油脂产量,通常采用的策略是在发酵初期提供充足的营养物质(包括氮源)供细胞大量增殖,以提高菌体细胞密度,然后通过氮饥饿(即氮源匮乏而碳源量充足)促使裂殖壶菌细胞合成油脂[6]。JU等[18]采用限量补加氮源策略促进裂殖壶菌产油脂,60 h油脂产量达25.4 g/L,油脂含量达生物量的39.0%。
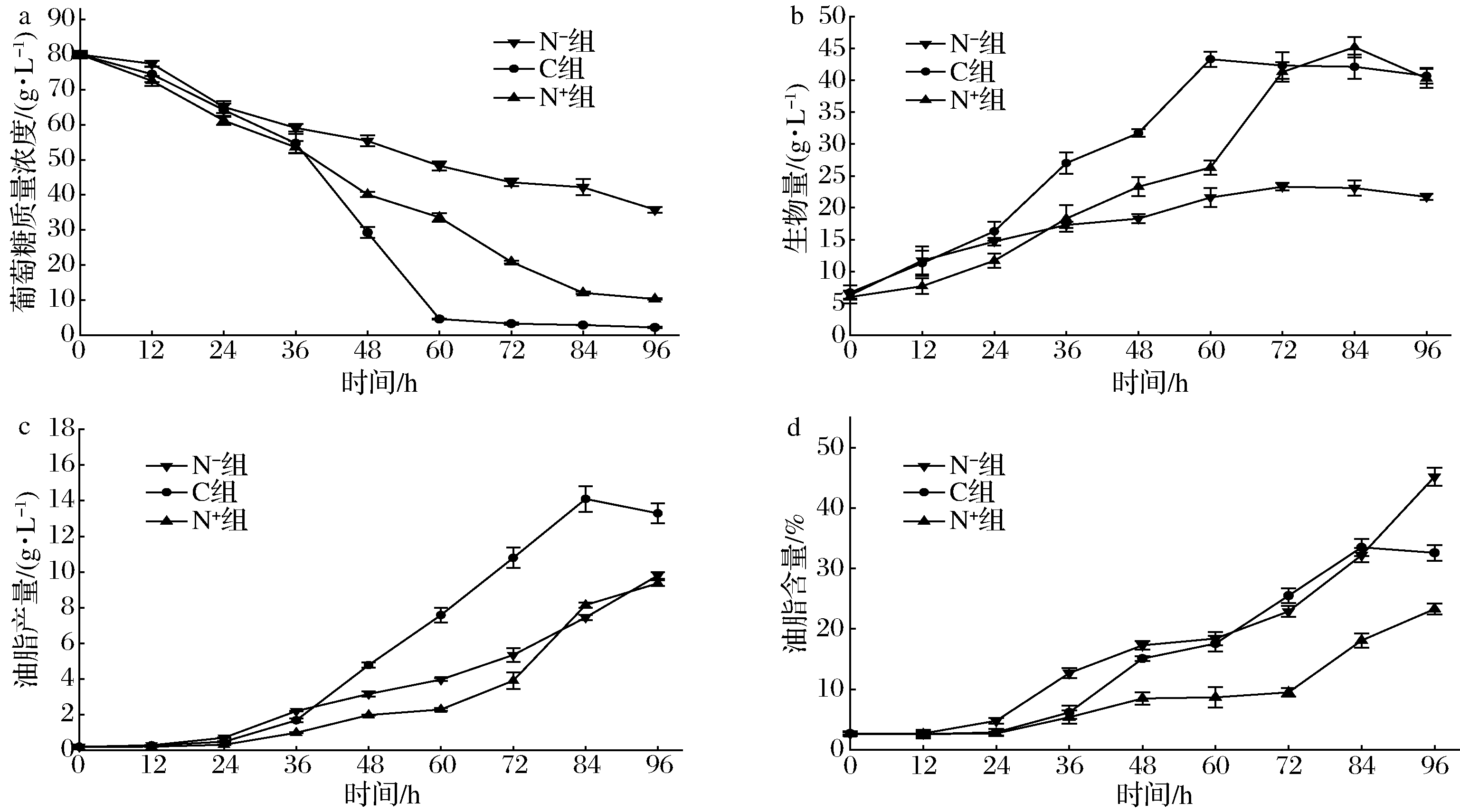
a-葡萄糖质量浓度;b-生物量;c-油脂产量;d-油脂含量
图2 氮源浓度对Schizochytrium sp.DP-16发酵产油脂的影响
Fig.2 Effects of nitrogen source concentration on fermentation by Schizochytrium sp.DP-16 for lipid production
2.3 磷源浓度对裂殖壶菌生长和油脂积累的影响
Schizochytrium sp.DP-16在低磷(P-)、对照(C)、高磷(P+)3个磷源浓度下的发酵进程如图3所示。在1 g/L KH2PO4·H2O的低磷(P-)条件下,葡萄糖消耗利用速度最快,48 h基本耗尽,快于对照(C)和高磷(P+)组,生物量在48 h达到峰值35.3 g/L,之后缓慢下降,并低于对照(C),说明磷源浓度较低同样对菌体生长增殖产生不利影响。低磷(P-)组的油脂产量和油脂含量从12 h开始快速增加,明显高于对照(C)组和高磷(P+)组,表明在磷限制条件下磷源被菌体快速耗尽,从12 h即进入油脂积累期,葡萄糖被代谢转化成油脂(以甘油三酯为主),贮存在菌体细胞内,72 h油脂产量和油脂含量分别达到14.8 g/L 和44.3%,均高于对照(C)和高磷(P+)组,在磷限制条件下72 h的油脂产量和油脂含量与对照组84 h的结果相比分别提高了5.0%和32.2%。20 g/L KH2PO4·H2O的高磷(P+)条件对Schizochytrium sp.DP-16细胞生长和油脂积累均产生不利影响,可能是培养基中磷酸盐浓度过高引起的高渗透压对细胞代谢活动影响所致。磷限制能够促进产油微生物细胞内油脂(主要为甘油三酯)的积累,在其他文献中也得到证实[16,19]。

a-葡萄糖质量浓度;b-生物量;c-油脂产量;d-油脂含量
图3 磷源浓度对Schizochytrium sp.DP-16发酵产油脂的影响
Fig.3 Effects of phosphorus source concentration on fermentation by Schizochytrium sp.DP-16 for lipid production
2.4 高氮高磷浓度下裂殖壶菌发酵特性
进一步探究了Schizochytrium sp.DP-16在高氮高磷发酵培养基(N+P+)中发酵特性,结果如图4所示。
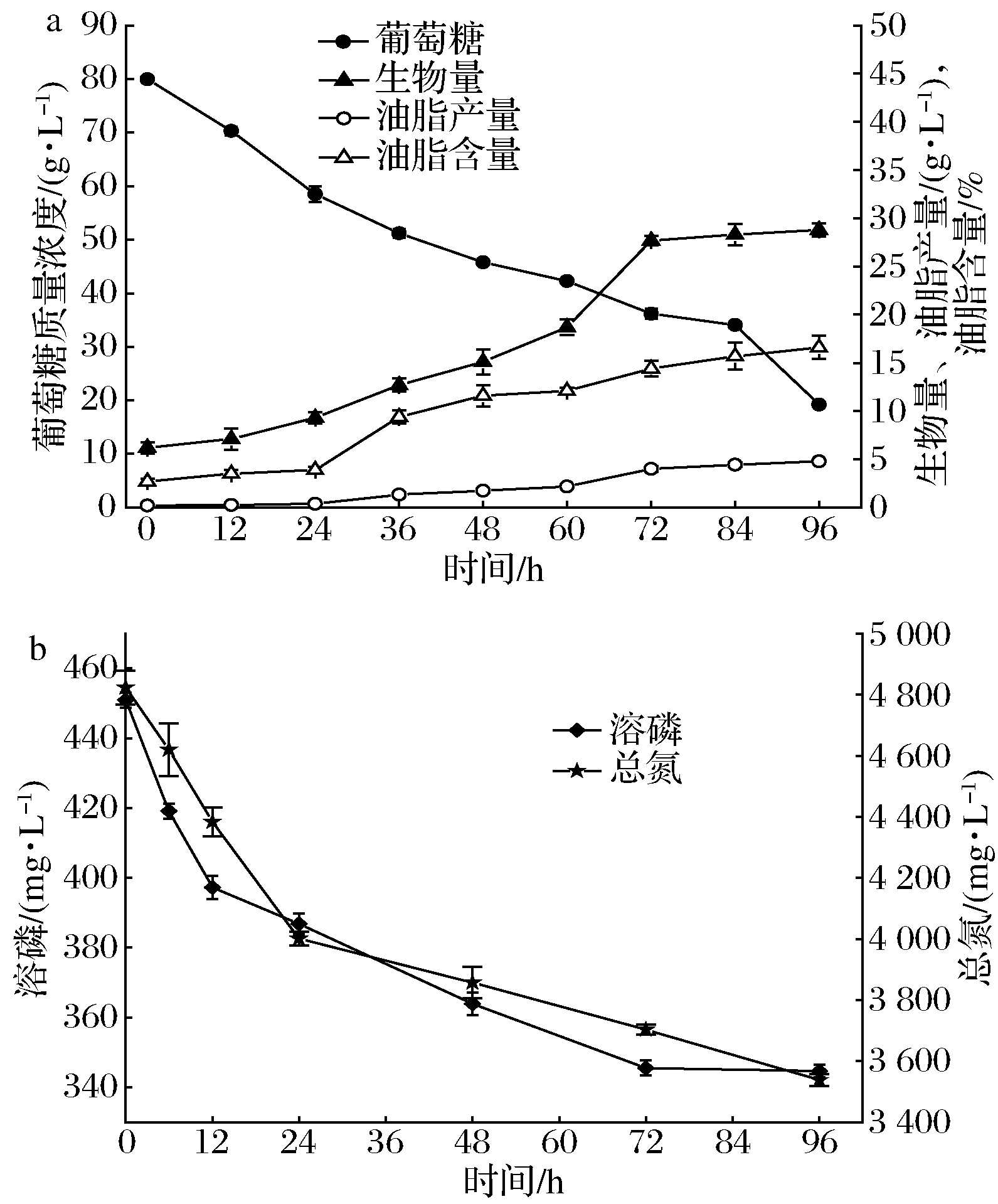
a-碳源、生物量、油脂产量和油脂含量变化;b-总氮、溶磷变化
图4 Schizochytrium sp.DP-16在高氮高磷发酵培养基中的发酵时间进程
Fig.4 Time course of fermentation by Schizochytrium sp.
DP-16 in high nitrogen and high phosphorus fermentation medium
可以看出,在培养基中氮源和磷源浓度均过高的条件下,Schizochytrium sp.DP-16仅能消耗利用少量的氮源和磷源,在96 h发酵液中仍有较高浓度的氮源和磷源残留。碳源葡萄糖被缓慢消耗利用,96 h残留葡萄糖质量浓度为19.2 g/L。氮源和磷源浓度过高对细胞生长繁殖并无明显的促进作用,相反还产生了一定程度的抑制,96 h的生物量仅为28.8 g/L,此结果远低于对照(C)和高氮(N+)组,亦低于高磷(P+)组。高氮高磷浓度下整个发酵过程中油脂产量和油脂含量一直处于很低水平,96 h的油脂产量仅为4.8 g/L,油脂含量则仅为16.8%,说明氮源和磷源浓度过高严重影响到Schizochytrium sp.DP-16细胞正常代谢,抑制了胞内油脂生物合成,对细胞生长和油脂产量均产生了非常不利的影响。
2.5 低氮低磷浓度下裂殖壶菌发酵特性
同时降低培养基中氮源和磷源浓度,探究了Schizochytrium sp.DP-16在低氮低磷发酵培养基(N-P-)中发酵特性,结果如图5所示。可见,在氮源和磷源浓度均较低情况下,培养基中氮源和磷源被菌体快速消耗利用,可利用氮源在6 h左右即耗尽,而溶磷在12 h后处于较低水平。在低氮低磷条件下,Schizochytrium sp.DP-16消耗利用葡萄糖较为缓慢,96 h残留葡萄糖浓度仍高达31.2 g/L,与低氮(N-)组结果相当。从生物量来看,在84 h达到最高值,但仅为18.3 g/L,比低氮(N-)组、低磷(P-)组结果更低,这是因为氮、磷元素是蛋白质、核酸等生物合成的必需元素,氮、磷源浓度过低将严重抑制Schizochytrium sp.DP-16细胞增殖。从油脂产量和油脂含量变化来看,接种后细胞油脂含量急剧上升,在60 h达到最高值47.7%,说明低氮低磷条件下任一营养物质(氮源或磷源)的快速耗尽使得菌体快速启动油脂生物合成,但受限于低氮低磷条件下细胞生物量过低,导致最终油脂产量不高,84 h的油脂产量仅为8.4 g/L,低于低氮(N-)组、低磷(P-)组和对照(C)组结果。上述结果表明,氮限制或磷限制作为促进产油微生物油脂积累的常用策略,但如果氮源或磷源浓度过低,菌体过早进入氮饥饿或磷饥饿,会严重限制细胞增殖,细胞生物量太低将直接导致总油脂产量不高。因此,确定适宜的氮、磷源浓度需要在获得高细胞浓度(生物量)和达到高油脂含量之间找到一个合适的平衡,氮、磷源浓度过高或过低均不利于油脂生产[6]。

a-碳源、生物量、油脂产量和油脂含量变化;b-总氮、溶磷变化
图5 Schizochytrium sp.DP-16在低氮低磷发酵培养基中的发酵时间进程
Fig.5 Time course of fermentation by Schizochytrium sp.
DP-16 in low nitrogen and low phosphorus fermentation medium
3 结论
本研究利用一株海洋真菌Schizochytrium sp.DP-16发酵产油脂,以葡萄糖为碳源,以酵母浸粉和谷氨酸钠为氮源,以KH2PO4为磷源,探究了氮、磷源浓度对菌体生长、葡萄糖消耗和油脂积累的影响。结果显示,Schizochytrium sp.DP-16在适量氮、磷源浓度的对照发酵培养基中培养,0~24 h为细胞增殖期,此阶段菌体消耗碳、氮源等营养物质用于细胞生长繁殖;24~84 h为油脂积累期,此阶段氮源耗尽,碳源充足,菌体转化葡萄糖为胞内油脂;84~96 h进入油脂反耗期,此阶段碳源耗尽,需消耗胞内油脂来维持细胞代谢活动。研究表明,当培养基中碳源充足,氮源或磷源任一营养物质的耗尽均能使菌体由增殖期转入油脂积累期。裂殖壶菌的油脂产量取决于菌体生物量和细胞内油脂含量的乘积,为提高总油脂产量,需要在获得高细胞浓度(生物量)和达到高油脂含量之间找到一个合适的平衡,以确定适宜的氮、磷源浓度。本研究对裂殖壶菌发酵产油脂过程中控制适宜的氮磷源浓度,缩短发酵周期,提升油脂生产效率具有重要参考价值。
[1] HORROCKS L A, YEO Y K.Health benefifits of docohexaenoic acid (DHA)[J].Pharmacological Research, 1999, 40(3):211-225.
[2] BAO Z D, ZHU Y M, FENG Y M, et al.Enhancement of lipid accumulation and docosahexaenoic acid synthesis in Schizochytrium sp.H016 by exogenous supplementation of sesamol[J].Bioresource Technology, 2022, 345:126527.
[3] DAI K X, ZHAO J, CHENG Y, et al.Inulin as a promising alternative feedstock for docosahexaenoic acid production by Schizochytrium sp.ATCC 20888[J].European Journal of Lipid Science and Technology, 2020, 122(9):2000079.
[4] YU X J, LIU J H, SUN J, et al.Docosahexaenoic acid production from the acidic hydrolysate of Jerusalem artichoke by an effificient sugar-utilizing Aurantiochytrium sp.YLH70[J].Industrial Crops and Products, 2016, 83:372-378.
[5] LIU L S, WANG F Z, PEI G S, et al.Repeated fed-batch strategy and metabolomic analysis to achieve high docosahexaenoic acid productivity in Crypthecodinium cohnii[J].Microbial Cell Factories, 2020, 19(1):91.
[6] CHI G X, XU Y Y, CAO X Y, et al.Production of polyunsaturated fatty acids by Schizochytrium (Aurantiochytrium) spp.[J].Biotechnology Advances, 2022,55:107897.
[7] 胡学超, 任路静, 胡耀池, 等.裂殖壶菌制备二十二碳六烯酸油脂的研究历程及发展前景[J].食品发酵与工业, 2018, 44(11):307-312.
HU X C, REN L J, HU Y C, et al.Research progress and prospect of docosahexaenoic acid-rich oil production by Schizochytrium sp.[J].Food and Fermentation Industries, 2018, 44(11):307-312.
[8] 段光前, 李硕硕, 李鑫, 等.裂殖壶菌高产油突变体的高通量筛选[J].生物工程学报, 2019, 35(7):1 335-1 347.
DUAN G Q, LI S S, LI X, et al.Screening for hyper-accumulating lipid mutants in Aurantiochytrium limacinum using high-throughput fluorescence-based method[J].Chinese Journal of Biotechnology, 2019, 35(7):1 335-1 347.
[9] 岳秀宏, 李翔宇, 刘鹏阳, 等.优化尼罗红荧光染色法简便快速筛选高油脂裂殖壶菌[J].中国油料作物学报, 2019, 41(5):796-803.
YUE X H, LI X Y, LIU P Y, et al.Simplified and rapid lipid determination of Schizochytrium sp.by optimized Nile red fluorescence staining[J].Chinese Journal of Oil Crop Sciences, 2019, 41(5):796-803.
[10] BAO D Z, ZHU Y M, ZHANG K, et al.High-value utilization of the waste hydrolysate of Dioscorea zingiberensis for docosahexaenoic acid production in Schizochytrium sp.[J].Bioresource Technology, 2021, 336:125305.
[11] CHANG M, ZHANG T, GUO X, et al.Optimization of cultivation conditions for efficient production of carotenoid-rich DHA oil by Schizochytrium sp.S31[J].Process Biochemistry, 2020, 94:190-197.
[12] REN L J, SUN G N, JI X J, et al.Compositional shift in lipid fractions during lipid accumulation and turnover in Schizochytrium sp.[J].Bioresource Technology, 2014, 157:107-113.
[13] REN L J, SUN L N, ZHUANG X Y, et al.Regulation of docosahexaenoic acid production by Schizochytrium sp.:Effect of nitrogen addition[J].Bioprocess and Biosystems Engineering, 2014, 37(5):865-872.
[14] LING X P, GUO J, LIU X T, et al.Impact of carbon and nitrogen feeding strategy on high production of biomass and docosahexaenoic acid (DHA) by Schizochytrium sp.LU310[J].Bioresource Technology, 2015, 184:139-147.
[15] JIANG X, ZHANG J, ZHAO J, et al.Regulation of lipid accumulation in Schizochytrium sp.ATCC 20888 in response to different nitrogen sources[J].European Journal of Lipid Science & Technology, 2017, 119(10):1700025.
[16] REN L J, FENG Y, LI J, et al.Impact of phosphate concentration on docosahexaenoic acid production and related enzyme activities in fermentation of Schizochytrium sp.[J].Bioprocess and Biosystems Engineering, 2013, 36(9):1 177-1 183.
[17] 黎丽, 窦光鹏, 霍文严, 等.裂殖壶菌发酵产DHA油脂的生产工艺优化[J].中国油脂, 2015, 40(6):77-81.
LI L, DOU G P, HUO W Y, et al.Optimization of fermentation process for production of DHA oil by Schizochytrium sp.[J].China Oils and Fats, 2015, 40(6):77-81.
[18] JU J H, KO D J, HEO S Y, et al.Regulation of lipid accumulation using nitrogen for microalgae lipid production in Schizochytrium sp.ABC101[J].Renewable Energy, 2020, 153:580-587.
[19] JAKOBSEN A N, AASEN I M, JOSEFSEN K D, et al.Accumulation of docosahexaenoic acid-rich lipid in thraustochytrid Aurantiochytrium sp.strain T66:Effects of N and P starvation and O2 limitation[J].Applied Microbiology and Biotechnology, 2008, 80(2):297-306.