莲藕(lotus roots)是重要的水生植物,富含碳水化合物、蛋白质、维生素C等多种对人体有益的成分[1]。在鲜切果蔬产品市场前景广阔的今天[2],鲜切莲藕因其天然、新鲜、营养和方便的特点备受国内外市场青睐。然而,由于鲜切莲藕在加工过程中极易发生褐变、营养价值降低和微生物腐败等品质劣变。通常使用热处理的方法使食品原料中天然存在的酶及微生物失活以防止变质反应,但热处理会导致香气损失,并对与质地和颜色相关的感官特性产生负面影响,同时也会破坏食物中的热敏型营养成分(如维生素、多酚等),使新鲜果蔬营养成分降低[3]。而降低热处理温度则无法达到灭酶和灭菌的要求,达不到保鲜效果。
超声(ultrasound,US)技术是一种高效绿色的加工技术,具有处理条件温和、易于控制和安全性高等优势。US导致植物细胞快速压缩和膨胀,产生空化气泡并剧烈坍塌,破坏活细胞及酶[4]。超声不仅能抑制微生物的生长和灭活多种氧化酶,还能产生高能量的![]() 和H2O2等中间产物,提高果蔬的抗氧化能力。为解决上述热处理的负面影响,可将其与上述具有保鲜优势的US技术联合(Heat+US)使用。超声-热引起机械和空化效应的“加成效应”是酶变性、细胞结构改变、植物组织孔隙形成的主要原因[5]。与纯超声和热烫相比,它在更有效灭活微生物和酶方面有更低的温度和更短的工艺时间,还能减少产品水分和养分损失,同时适当的温度能更好地诱导超声空化,最大限度地减少莲藕品质的恶化。因此,超声-热处理可被视为传统低温处理的有利替代方案。
和H2O2等中间产物,提高果蔬的抗氧化能力。为解决上述热处理的负面影响,可将其与上述具有保鲜优势的US技术联合(Heat+US)使用。超声-热引起机械和空化效应的“加成效应”是酶变性、细胞结构改变、植物组织孔隙形成的主要原因[5]。与纯超声和热烫相比,它在更有效灭活微生物和酶方面有更低的温度和更短的工艺时间,还能减少产品水分和养分损失,同时适当的温度能更好地诱导超声空化,最大限度地减少莲藕品质的恶化。因此,超声-热处理可被视为传统低温处理的有利替代方案。
目前超声-热处理技术在果蔬饮料中应用较多,例如LIAO等[6]发现较于传统热处理,超声-热处理可以保护火龙果果汁内的生物活性成分。但超声-热处理技术应用于鲜切果蔬保鲜的研究较少,因此应用该技术处理鲜切莲藕能更好地减少莲藕劣变,更好地保持原有品质,延长货架期。本实验采用水浴式超声设备,具有操作简便、经济实惠等优点,更适合工业化使用。
1 材料与方法
1.1 材料与试剂
鄂莲7号莲藕,购自芜湖当地一家蔬菜超市,大小和成熟度一致的无瑕莲藕被选购作为实验原料。
试验所需药品、试剂均为分析纯,主要有邻苯二酚、愈创木酚、β-巯基乙醇、L-苯丙氨酸、没食子酸、福林酚、三氯乙酸、硫代巴比妥酸等,国药集团化学试剂有限公司;DPPH试剂,美国Sigma公司。
1.2 仪器与设备
KS-500DE型液晶超声波清洗器,昆山洁力美超声仪器有限公司;UV-5800PC型紫外可见分光光度计,上海元析仪器有限公司;CF15RN型冷冻离心机,日本工机控股株式会社;TA.new plus质构仪,上海保圣实业发展有限公司;HP-C210-精密型手持色差仪,上海米远电气有限公司;S-4800型冷场发射扫描电子显微镜,日本Hitachi公司;GCMS-2020 NX型气相色谱-质谱联用仪,日本岛津公司。
1.3 实验方法
1.3.1 实验方法
(1)预处理 将莲藕清洗去皮后切成0.3 cm的薄片。去皮器、切刀、和切板在使用前应消毒。
(2)处理方法 将所有莲藕片混合并随机选择,样品与去离子水按样品∶水=1∶3(g∶mL)的比例置于烧杯中。试验条件的设置如表1所示,Heat+US的处理条件由前期护色实验结果优化得出,同时与单一Heat和US处理一同比较。US及Heat+US处理通过使用台式超声波清洗仪(500 mm×300 mm×150 mm)进行,并对作用参数(功率强度、作用时间、作用温度)进行调节,超声恒定频率为40 kHz。通过恒温装置来保持超声浴的温度不变。以无菌蒸馏水处理作为对照(CK)。处理后取出藕片晾干表面水分,置于聚乙烯密封袋(8 cm×12 cm)中包装,后放入4 ℃环境中模拟冷藏货架。每隔3 d测定1次相关的生理指标。
表1 不同处理方式
Table 1 Different processing methods

处理组别处理方式CK蒸馏水清洗9 minHeat50 ℃,0 W蒸馏水清洗9 minUS25 ℃,300 W超声清洗9 minHeat+US50 ℃,300 W超声清洗9 min
1.3.2 色差测定
使用色差仪测定鲜切莲藕切片的L*、a*、b*值,并计算贮藏期间L*、a*、b*值的变化值(ΔL*、Δa*、Δb*),ΔE表示样品总色差,计算如公式(1)所示:
(1)
1.3.3 硬度测定
采用质构仪的P5圆柱型测试探头。测定参数为:压缩比30%;2次间隔时间2 s;触发力5 g;测前速度2 mm/s,测试速度2 mm/s,测后速度2 mm/s,位移10 mm,硬度单位用g表示。
1.3.4 失重率测定
采用称量法,莲藕失重率计算如公式(2)所示:
失重率![]()
(2)
式中:m1为贮藏前质量,g;m2为取样时质量,g。
1.3.5 气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)分析
固相微萃取样品制备:参照韩小苗等[7]的方法称取100 g预处理过的莲藕,与30 g氯化钠一起搅拌成泥状。称取30 g藕泥放入带盖螺口瓶中。加入正戊烷振荡过滤;取滤液放入80 ℃冰箱中冰冻。在冻好的滤液中加入适量无水硫酸钠,摇晃静置过滤后,使用氮吹仪将滤液吹至0.5 mL,得到莲藕的风味物质提取液。
色谱和质谱条件:色谱柱(DB-5,30 m×0.5 mm×0.5 mm),始温40 ℃,保持5 min,后以5 ℃/min升温至70 ℃,保持5 min,再以3 ℃/min升温至180 ℃,保持3 min,最后以5 ℃/min升温至240 ℃,保持10 min。汽化室温度250 ℃;载气He;流速1 mL/min;分流比10∶1。质谱条件设置:电离方式为EI;电子能量70 eV;离子源温度200 ℃;发射电流200 μA;接口温度250 ℃;检测电压350 V。
1.3.6 氧化酶及总酚含量测定
多酚氧化酶(polyphenol oxidases,PPO)活性采用邻苯二酚法,参照YEOH等[8]并稍作改动。PPO活性用U/g表示;过氧化物酶(peroxidase,POD)活性采用采用愈创木酚法,参照KOCHBA等[9]的方法略做修改。PPO活性用U/g表示;L-苯丙氨酸解氨酶(L-phenylalanin ammonia lyase,PAL)活性采用采用苯丙氨酸法,按照WU等[10]的方法对PAL进行测定。PAL活性用U/g表示;总酚含量采用采用Folin-Ciocalteu法测定[11]。以没食子酸(0~1.6 μg/mL)作为标准物建立标准曲线y=0.096x-0.002 4(R2=70.999 4),结果以每毫升溶液中没食子酸当量(gallicacide quivalents,GAE)表示测定样品中总酚含量。
1.3.7 丙二醛(malondialdehyde,MDA)含量测定
MDA含量测定采用硫代巴比妥酸比色法,参照QIAO等[12]的方法测定。
1.3.8 DPPH自由基清除率测定
DPPH自由基清除能力根据FALGUERA等[13]的方法略作修改:用0.1 mL ddH2O代替0.1 mL多酚提取物作空白,测定在517 nm处吸光值。
1.3.9 扫描电镜(scanning electron microscope,SEM)分析
参照王远等[14]的方法略作修改,取5 mm3大小的莲藕组织块,用体积分数为2.5%戊二醛(0.2 mol/L磷酸缓冲液,pH 7.2)4 ℃下固定20 h,再用体积分数为20%~100%乙醇梯度脱水,冷冻干燥。镀金后扫描电镜观察。
1.4 数据分析
每组实验重复3次,采用Origin 8及SPSS 22进行数据统计分析,结果用平均值±标准差表示。
2 结果与分析
2.1 不同处理对鲜切莲藕感官品质的影响
图1-a显示CK样品中的褐变随着贮存时间的延长而变强,且Heat+US处理莲藕外观优于单一处理和CK组。表2得到CK和处理组的L*值均随贮存时间的延长而降低,贮藏第9天,Heat+US处理样品的L*值显著高于其他处理且是对照的1.15倍(P<0.05)。L*值被认为是反映褐变的度量,较低的L*值通常代表较深的颜色。a*和b*值都呈增加趋势,但Heat+US处理能延迟增加,CK组则增加最快。同时,Heat+US处理的ΔE值(表2)及褐变度(图1-b)显著低于其他处理(P<0.05),贮存9 d后鲜切莲藕的总色差比对照低55.22%(P<0.05)。单一US和热处理也能抑制莲藕褐变,但显著低于联合处理(P<0.05)。这可能是由于超声空化与热效应的结合,可以更好地破坏多肽链的氢键,抑制氧化酶活性。研究表明,单一热处理不能很好地延缓褐变[3]。由此,Heat+US处理比单一Heat或US处理具有更好的褐变控制和颜色保持能力。
由图1-c可知,莲藕经切分后受到机械损伤,呼吸加快,细胞结构被破坏,内部汁液溢出,水分蒸发,失重率增加[15]。贮藏前3 d,CK与处理组间没有显著差异(P>0.05),贮藏第6~9天,Heat和对照组的失重率明显低于US和Heat+US组(P<0.05)。单一的热处理会导致莲藕完整性丧失和失水过多。本研究发现超声处理能够抑制鲜切莲藕的呼吸作用,这与葛枝等[16]的研究结果一致。因此超声-热处理能很好地减少莲藕的失水。由于细胞呼吸和蒸腾作用的影响,组织失水,加强水解作用,进而对细胞壁造成破坏,导致莲藕细胞结构特性改变和硬度下降,因此鲜切莲藕的硬度在各处理中均逐渐降低(图1-d)。第3天起,Heat+US处理样品的硬度值显著高于对照组(P<0.05),与失重率相似。单一热处理失水过多,细胞结构破坏较大,硬度进一步下降。Heat+US处理抑制莲藕硬度的下降,可能因为是超声-热处理能加大对果胶酯酶的灭活作用[17],从而减缓果蔬原果胶的水解,延缓老化。
表2 不同处理鲜切莲藕贮藏期间色差变化
Table 2 Changes in color difference of fresh-cut lotus roots with different treatments during storage
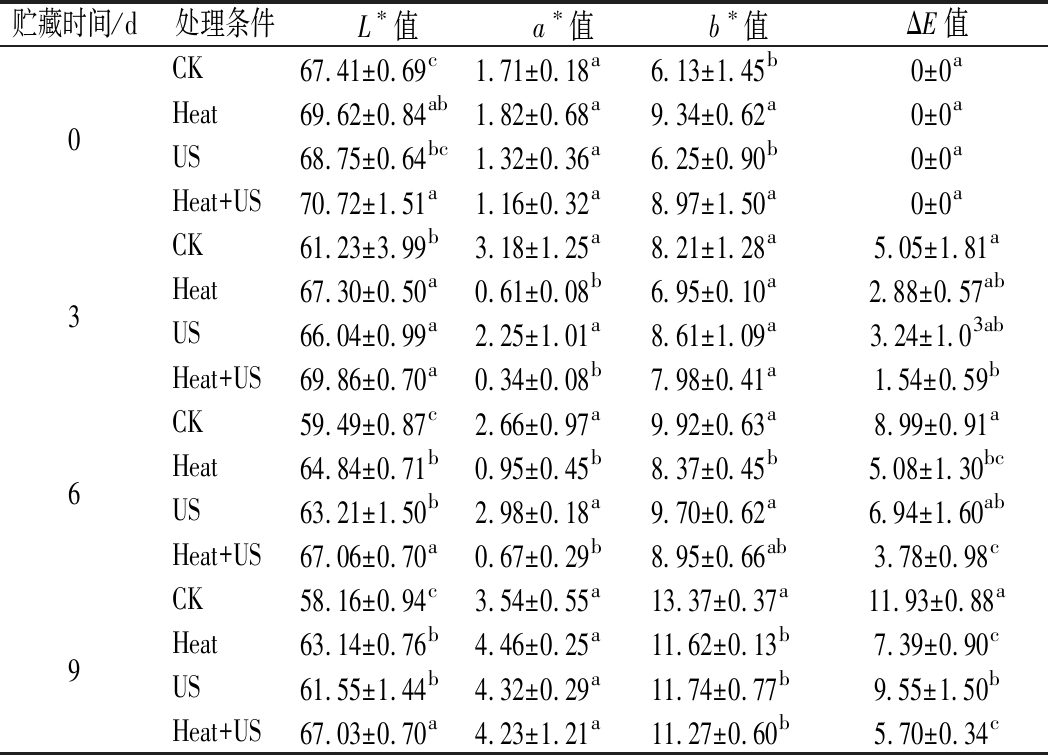
贮藏时间/d处理条件L∗值a∗值b∗值ΔE值CK67.41±0.69c1.71±0.18a6.13±1.45b0±0a0Heat69.62±0.84ab1.82±0.68a9.34±0.62a0±0aUS68.75±0.64bc1.32±0.36a6.25±0.90b0±0aHeat+US70.72±1.51a1.16±0.32a8.97±1.50a0±0aCK61.23±3.99b3.18±1.25a8.21±1.28a5.05±1.81a3Heat67.30±0.50a0.61±0.08b6.95±0.10a2.88±0.57abUS66.04±0.99a2.25±1.01a8.61±1.09a3.24±1.03abHeat+US69.86±0.70a0.34±0.08b7.98±0.41a1.54±0.59bCK59.49±0.87c2.66±0.97a9.92±0.63a8.99±0.91a6Heat64.84±0.71b0.95±0.45b8.37±0.45b5.08±1.30bcUS63.21±1.50b2.98±0.18a9.70±0.62a6.94±1.60abHeat+US67.06±0.70a0.67±0.29b8.95±0.66ab3.78±0.98cCK58.16±0.94c3.54±0.55a13.37±0.37a11.93±0.88a9Heat63.14±0.76b4.46±0.25a11.62±0.13b7.39±0.90cUS61.55±1.44b4.32±0.29a11.74±0.77b9.55±1.50bHeat+US67.03±0.70a4.23±1.21a11.27±0.60b5.70±0.34c
注:表中小写字母上标表示显著性(表3同)
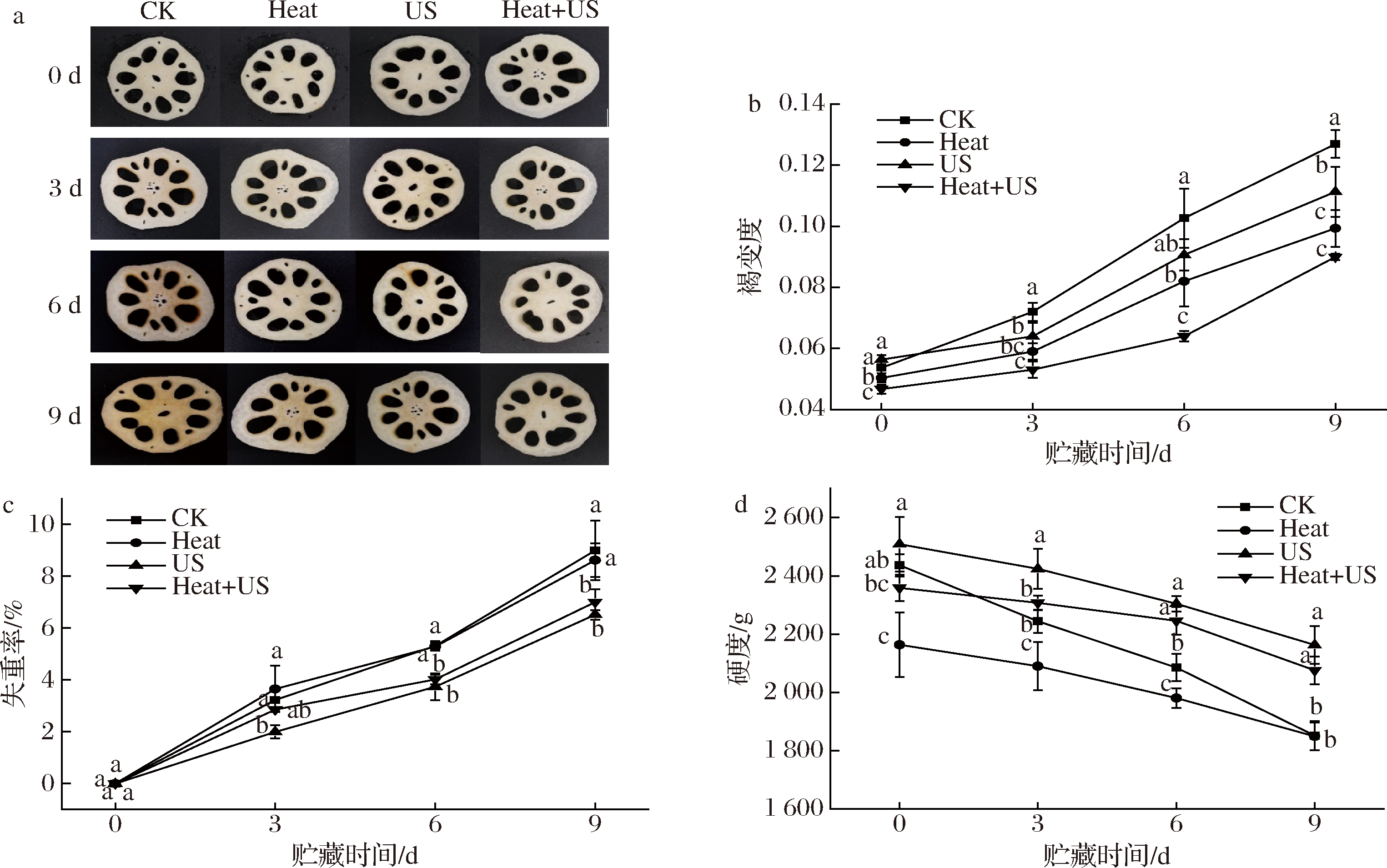
a-外观;b-褐变度;c-失重率;d-硬度
图1不同处理莲藕贮藏期内外观、褐变度、失重率和硬度变化
Fig.1 Changes in appearance, browning degree, weight loss, and hardness of lotus roots with different treatments during storage
注:不同字母代表差异显著(P≤0.05)(下同)
2.2 不同处理对鲜切莲藕风味物质的影响
莲藕的风味是决定莲藕品质的主要因素之一。通过GC-MS分析得到处理后的鲜切莲藕其香气物质成分见表3。莲藕的香气成分十分复杂,不同处理的相对含量差异较大。已鉴定出34种风味物质成分(表3),主要包括烷烃类13种、酯类10种、醛类2种、酮2类、醚类2种及其他种类。由表3可知,各组风味物质中烷烃类物质种类最多且相对含量最高,但在风味物质中,烃类物质对风味的贡献率最小。莲藕中的醛类、酯类、酮类等成分相对含量及种类均较少,但对莲藕的风味影响很大,在莲藕的香气中起重要作用,阈值较低且敏感[18]。酯类物质的相对含量仅低于烷烃类物质,经Heat、US及Heat+US处理后酯类物质含量从15.05%降低到1.81%、5.99%、12.52%,但经Heat+US处理后降低的最少,同时其醛类物质相对含量最高为3.66%(P<0.05)。酮类物质的相对含量在有超声参与的处理中得到增加。酯类、醛类、酮类成分在CK组检出8种,占总检出物质的19.72%,Heat处理组中检出2种,占总检出物质的3.24%,US处理中检出5种,占总检出物质的11.64%;Heat+US处理中检出6种,占总检出物的18.21%。联合处理下酯类、醛类和酮类成分损失较少,相对含量是对照组的92.34%。事实证明,单一较高的温度导致莲藕主要挥发性香气成分的损失更大,但是US能够在很大程度上减少食品中热敏性香气物质的损失,适当的温度耦合US能更好地保持莲藕的原始香气[19]。莲藕中风味成分的变化,间接影响了食品中芳香物质的含量,从而影响香气,这可能归因于超声空化产生的自由基加速羟醛缩合等化合反应[20]。
2.3 不同处理对鲜切莲藕氧化酶活和多酚含量的影响
PPO是负责酶促褐变的关键酶。图2-a显示PPO活性随时间增加,在Heat+US处理下活性最低。第9天,超声-热处理中的PPO活性为22.97 U/g,比对照组低41.64%(P<0.05)。US和Heat单一处理在一定程度上控制了PPO的积累,但减少效果不如联合处理。与SULAIMAN等[21]实验结果一致,超声结合热处理能够有效灭活梨、苹果和草莓果泥中氧化酶活性,抑制果蔬病害的发生,提高果蔬品质。说明超声-热处理能够通过抑制PPO活性来提升莲藕品质。
由图2-b可知,随着贮藏时间的延长,不同处理的莲藕POD活性先升高后降低。莲藕在切割后,酚-酶的区域化分布遭到破坏,酚类与酶反应,POD活性增强,褐变加速[22],而后PPO活性呈降低趋势,可能是由于冷抑制酶活性。第3天,Heat+US处理组的POD活性显著低于其他处理(P<0.05),是对照组的56%。单一使用US和热处理可降低POD活性,而联合处理可增强降低POD活性的能力,可能是超声诱导水分解形成的自由基在POD灭活中起重要作用,而超声-热能加强这种分解。与GUO等[23]的实验结果相似,超声-热处理显著降低了鲜切胡萝卜POD活性。
PAL通过催化苯丙氨酸途径中底物的生成在酶促褐变中起着重要作用[24]。图2-c显示PAL活性首先迅速增加至峰值,然后缓慢下降。不同处理组PAL活性均在第3天时达最大,Heat+US处理组PAL活性最高,是CK组的1.22倍;单一US和Heat处理在贮藏3 d时也显示出更高含量,但低于Heat+US处理(P<0.05)。在随后的贮藏期间,各处理样品的PAL活性均高于对照,但差异不显著(P>0.05)。鲜切莲藕PAL活性在贮藏初期呈上升趋势,可能是由于切割和超声对植物细胞造成的损害,产生应激反应;PAL活性在贮存3 d后下降,可能是由于总酚的过度积累所致。
贮藏期间酚类物质含量呈下降趋势(图2-d)。第6天Heat+US处理组显著高于其他处理(P<0.05),与CK相比,其总酚含量增加了22.39%。与CK相比,Heat处理后总酚含量显著减少,可能是因为热敏酚类化合物的热降解。贮藏6 d后,不同处理的总酚含量趋于相似。PPO活性在贮藏过程中趋于增加,因此总酚消耗量逐渐增加,故贮藏过程总酚含量呈现下降趋势。与DO NASCIMENTO等[25]的研究相似,超声处理降低百香果皮的总酚损失并提高抗氧化性能。研究表明经超声处理后的样品显示较高的酚类含量[23]。
PPO催化醌类化合物的生产以导致POD介导的多酚褐变,而超声-热联合处理产生的物理和化学效应破坏了范德华力和多肽链的氢键,导致酶蛋白结构破坏更大[26]。因此,超声-热联合处理对莲藕褐变的控制可能归因于PPO和POD活性的降低。事实也证明,PPO和POD活性的抑制趋势与总体抗褐变效果一致。尽管US对PPO和POD的完全失活效率有限,但这种处理在温和温度的漂烫下是有利的。同时PAL参与莲藕对细胞内活性氧的防御机制。O′DONNELL等[27]证实,US分解水产生的自由基会引起植物细胞系统的氧化应激,诱导PAL活性升高。PAL活性升高能够诱导次生代谢物(如类黄酮等酚类化合物)在植物中的积累。酚类化合物含量越高,清除自由基越多,抗氧化能力越强。通常PAL活性的增加会导致植被褐变,主要是由于酚类化合物的积累增加,然而,由于超声-热联合处理造成的PPO和POD活性低,使得褐变反应难以继续。因此发现超声结合低温热处理是保护鲜切莲藕感官和营养特性的有效方法。
表3 不同处理鲜切莲藕挥发性成分
Table 3 Volatile components of fresh-cut lotus roots with different treatments
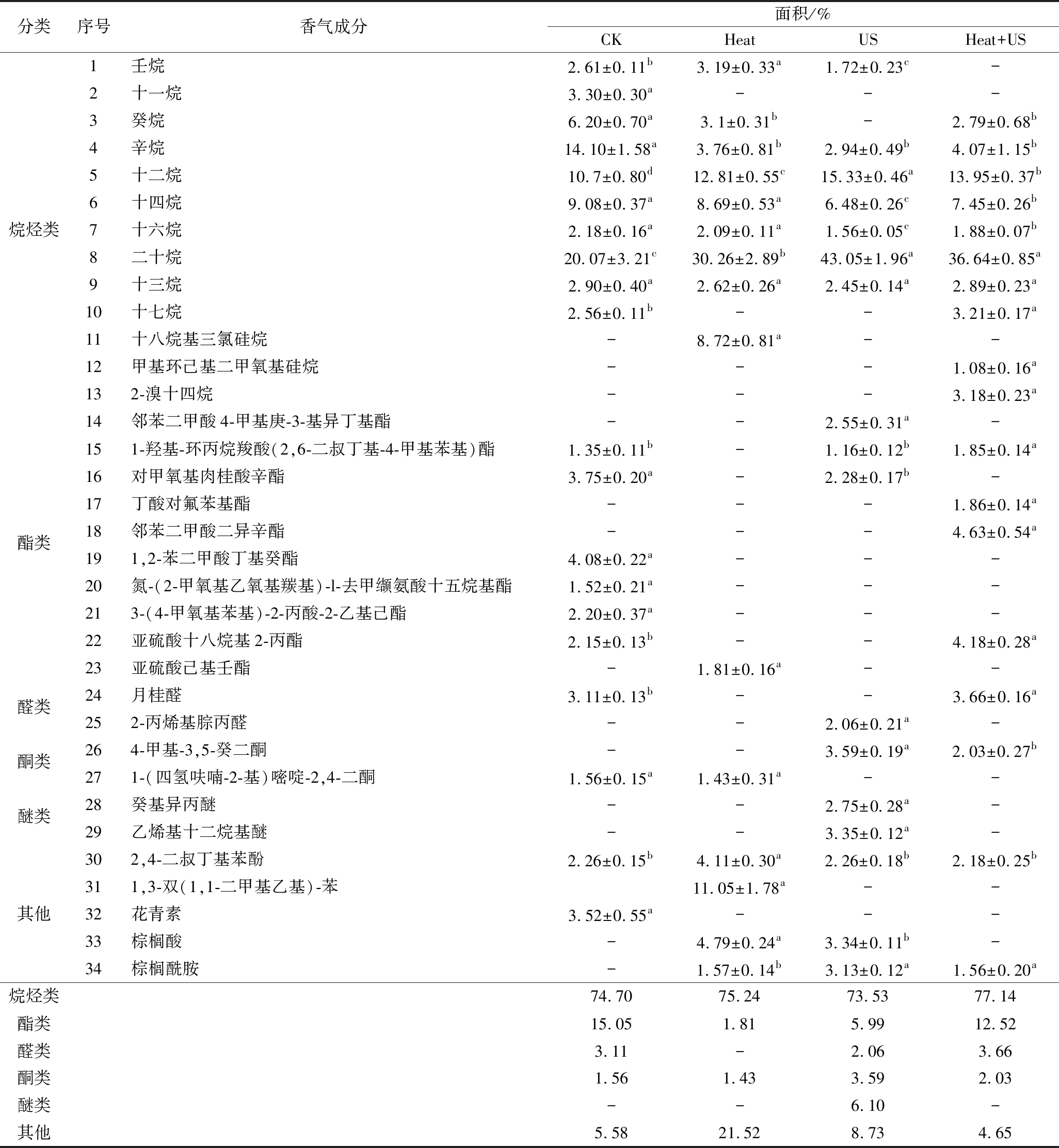
分类序号香气成分面积/%CKHeatUSHeat+US1壬烷2.61±0.11b3.19±0.33a1.72±0.23c-2十一烷3.30±0.30a---3癸烷6.20±0.70a3.1±0.31b-2.79±0.68b4辛烷14.10±1.58a3.76±0.81b2.94±0.49b4.07±1.15b5十二烷10.7±0.80d12.81±0.55c15.33±0.46a13.95±0.37b6十四烷9.08±0.37a8.69±0.53a6.48±0.26c7.45±0.26b烷烃类7十六烷2.18±0.16a2.09±0.11a1.56±0.05c1.88±0.07b8二十烷20.07±3.21c30.26±2.89b43.05±1.96a36.64±0.85a9十三烷2.90±0.40a2.62±0.26a2.45±0.14a2.89±0.23a10十七烷2.56±0.11b--3.21±0.17a11十八烷基三氯硅烷-8.72±0.81a--12甲基环己基二甲氧基硅烷---1.08±0.16a132-溴十四烷---3.18±0.23a14邻苯二甲酸4-甲基庚-3-基异丁基酯--2.55±0.31a-151-羟基-环丙烷羧酸(2,6-二叔丁基-4-甲基苯基)酯1.35±0.11b-1.16±0.12b1.85±0.14a16对甲氧基肉桂酸辛酯3.75±0.20a-2.28±0.17b-17丁酸对氟苯基酯---1.86±0.14a酯类18邻苯二甲酸二异辛酯---4.63±0.54a191,2-苯二甲酸丁基癸酯4.08±0.22a---20氮-(2-甲氧基乙氧基羰基)-l-去甲缬氨酸十五烷基酯1.52±0.21a---213-(4-甲氧基苯基)-2-丙酸-2-乙基己酯2.20±0.37a---22亚硫酸十八烷基2-丙酯2.15±0.13b--4.18±0.28a23亚硫酸己基壬酯-1.81±0.16a--醛类24月桂醛3.11±0.13b--3.66±0.16a252-丙烯基腙丙醛--2.06±0.21a-酮类264-甲基-3,5-癸二酮--3.59±0.19a2.03±0.27b271-(四氢呋喃-2-基)嘧啶-2,4-二酮1.56±0.15a1.43±0.31a--醚类28癸基异丙醚--2.75±0.28a-29乙烯基十二烷基醚--3.35±0.12a-302,4-二叔丁基苯酚2.26±0.15b4.11±0.30a2.26±0.18b2.18±0.25b311,3-双(1,1-二甲基乙基)-苯11.05±1.78a--其他32花青素3.52±0.55a---33棕榈酸-4.79±0.24a3.34±0.11b-34棕榈酰胺-1.57±0.14b3.13±0.12a1.56±0.20a烷烃类74.7075.2473.5377.14酯类15.051.815.9912.52醛类3.11-2.063.66酮类1.561.433.592.03醚类--6.10-其他5.5821.528.734.65
注:-表示未检出

a-PPO活性;b-POD活性;c-PAL活性;d-总酚含量
图2 不同处理鲜切莲藕贮藏期内PPO、POD、PAL活性和总酚含量的变化
Fig.2 Changes of PPO, POD, PAL activity, and total phenol content of lotus root with different treatments during storage
2.5 不同处理对鲜切莲藕膜完整性和抗氧化能力的影响
MDA含量是评价氧化程度的指标。一般而言,MDA含量越高,细胞膜损伤就越严重。如图3-a所示,前3 d由于不同处理的莲藕受到共同的切割损伤,导致MDA含量增加但无明显区别,3 d后MDA含量迅速上升且不同处理间差异明显。CK组在后续贮藏期间MDA含量最高(P<0.05),Heat和US及联合处理在不同程度上延缓了莲藕细胞的后续损伤,降低MDA含量增加及对膜完整性的破坏。其中,Heat+US处理的MDA含量始终最低,贮藏第9天MDA含量比对照低38.78%(P<0.05)。而Heat处理的细胞损伤较大[23],细胞膜的稳定性对鲜切莲藕保鲜起着重要作用。上述结果表明,Heat+US处理可以通过控制MDA积累来保持更好的膜完整性,从而可以抑制鲜切莲藕品质的下降。
DPPH自由基清除能力大致反映了总抗氧化能力。由图3-b可知,莲藕片在4 ℃整个贮存时间内抗氧化能力呈下降趋势,但在整个贮藏期间Heat+US处理的自由基清除率始终显著高于单一处理及对照组(P<0.05)。第9天,联合处理下莲藕的自由基清除率为40.85%,是CK组的1.24倍。通常,DPPH自由基清除能力越高,鲜切产品的褐变越少。通过DPPH自由基清除能力反映鲜切莲藕的抗氧化能力得到,Heat+US处理可以通过增强抗氧化能力来减少褐变。主要原因使US会产生![]() 和H2O2等高能中间体,这些中间体会诱发新鲜莲藕的抗氧化潜能。QIAO等[28]证实单独或作为联合处理的一部分,US处理保持了鲜切土豆更高的抗氧化能力。总的来说,Heat+US处理可以延缓MDA的积累,减少对细胞膜的损伤,并提高抗氧化能力。
和H2O2等高能中间体,这些中间体会诱发新鲜莲藕的抗氧化潜能。QIAO等[28]证实单独或作为联合处理的一部分,US处理保持了鲜切土豆更高的抗氧化能力。总的来说,Heat+US处理可以延缓MDA的积累,减少对细胞膜的损伤,并提高抗氧化能力。
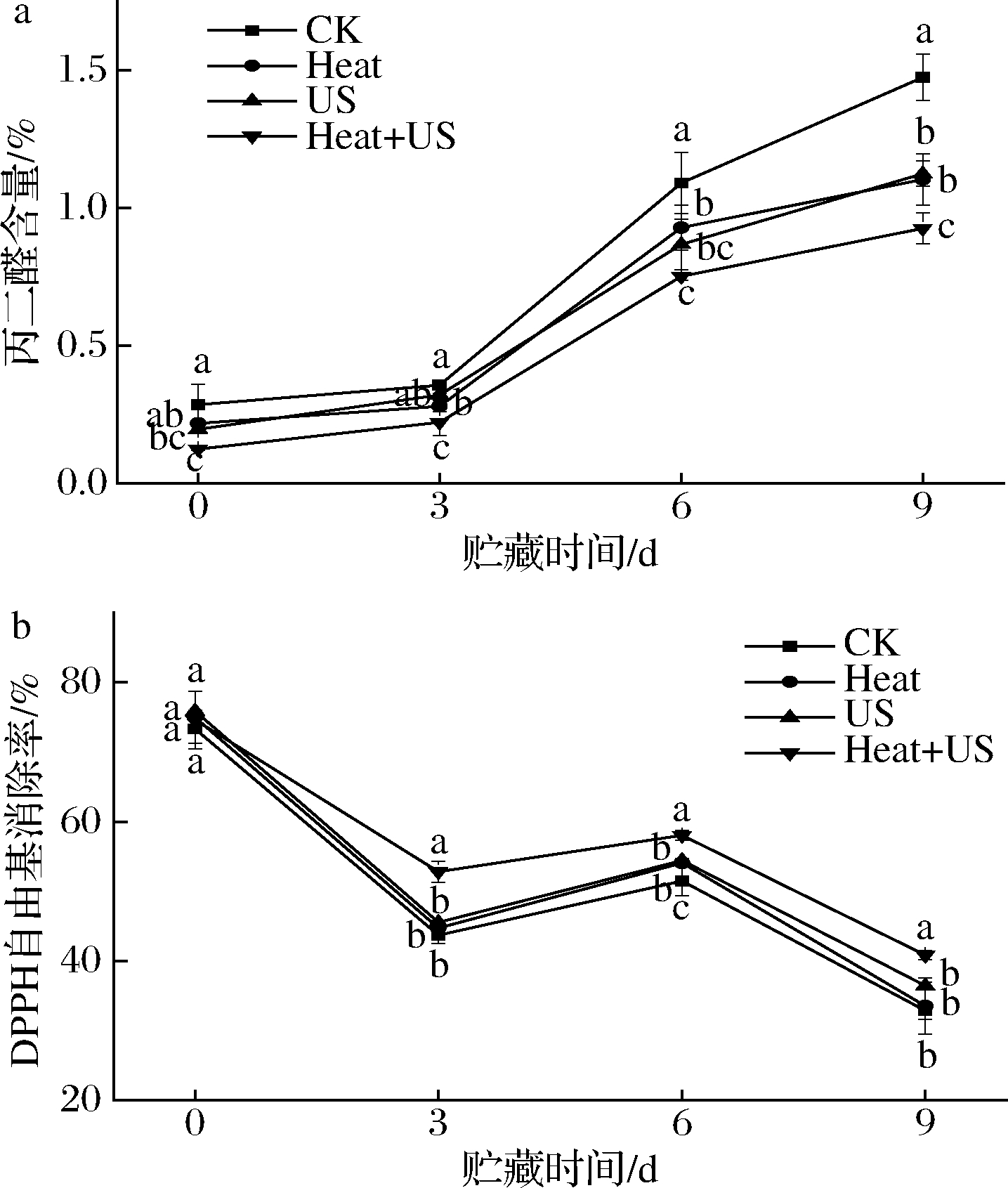
a-丙二醛含量;b-DPPH自由基清除率
图3 不同处理莲藕贮藏期内MDA含量和DPPH
自由基清除能力的变化
Fig.3 Changes of MDA content and DPPH free radical scavenging ability of lotus roots under different treatments during storage
2.6 不同处理对鲜切莲藕微观结构的影响
图4显示了对照及经过热烫、US和超声-热处理后的冻干莲藕在不同倍数下扫描电子显微镜图像。冷冻干燥过程保留了组织的结构,允许进一步探索莲藕的微观结构。CK组的莲藕组织具有高密度和规则形状,细胞结构完整,但部分细胞膜受损,这可能是样品前处理对莲藕组织造成的影响;热处理后莲藕细胞结构严重受损,细胞壁收缩,细胞变形,细胞质溶出。主要原因是较高温度对细胞产生破坏作用,使细胞变形破裂,导致组织结构明显损伤;经超声处理样品细胞形状发生扭曲变形,细胞完整性逐渐丧失,许多细胞受损或合并在一起形成更大空间,形成明显的通道。超声产生的空化效应改变了对细胞结构的影响,研究表明,US可能会产生微通道[29];超声所产生的变化尤其在超声-热处理中被观察到,但是超声-热处理的样品细胞结构更加扭曲变形,细胞间空隙增多,这是热作用施加的影响。
综上,热处理工艺对莲藕片的质地影响最大,严重破坏细胞结构和细胞壁,胞质裂解导致质地降低和营养流失。与热处理相比,超声能够在相同的剪切应力下同时提供更大的抗变形能力,并且热超声比单独超声产生更高的致畸性。细胞壁和组织结构完整性对果蔬的质地起主导作用。有研究认为,US处理材料中产生的气泡坍塌导致的强烈能量波和湍流是导致聚合物分子破裂的原因[30]。该结果也支持了DE LAFUENTE-BLANCO等[31]的观察结果,US预处理影响水果组织,使水半透膜更容易形成,也影响水果孔隙度。

图4 不同处理对鲜切莲藕微观结构的影响
Fig.4 The effect of different treatments on the microstructure of fresh-cut lotus root
3 结论
从研究结果中得到,超声-热具有对鲜切莲藕护色保鲜的作用,并且是一种高效且绿色的处理方法,以非常合理的成本节省时间和能源。超声-热处理与对照组相比,不仅延缓了莲藕感官品质的下降,还降低了氧化酶PPO、POD的活性。此外还证明PAL活性以及总酚含量受Heat、US及其组合的控制。同时较低的MDA含量可能意味着更好的膜完整性,这有助于褐变消除,并且抗氧化能力得到增强。单独或联合使用热和超声处理也可以保鲜鲜切莲藕,但是两者联合处理达到了最好的保鲜效果。因此超声和热处理联合使用有望在鲜切果蔬等加工领域中广泛应用。
[1] 刘晓燕, 李洪怡, 苏燕, 等.臭氧和超声波对鲜切莲藕品质影响的主成分分析[J].食品与发酵工业, 2018, 44(5):148-155.
LIU X Y, LI H Y, SU Y, et al.Principal component analysis of the effect of ozone and ultrasound on the quality of fresh-cut lotus root[J].Food and Fermentation Industries, 2018, 44(5):148-155.
[2] 解梦梦, 赵武奇, 贾梦科, 等.低温等离子体处理对鲜切猕猴桃片质构及理化特性的影响[J].中国食品学报, 2021,21(10):133-142.
XIE M M, ZHAO W Q, JIA M K, et al.Effects of low temperature plasma treatment on texture and physicochemical properties of fresh-cut kiwi slices[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):133-142.
[3] SICARI V, ROMEO R, LEPORINI M, et al. Comparison of traditional hot water and vacuum assisted blanching methods on the physico-chemical quality parameters and antioxidant activity of zucchini (Cucurbita pepo L.) slices[J]. Journal of Food Measurement and Characterization, 2022, 16(1):281-294.
[4] NOWACKA M, WEDZIK M.Effect of ultrasound treatment on microstructure, colour and carotenoid content in fresh and dried carrot tissue[J].Applied Acoustics, 2016, 103:163-171.
[5] ANAYA-ESPARZA L M, VEL ZQUEZ-ESTRADA R M, ROIG A X, et al.Thermosonication:An alternative processing for fruit and vegetable juices[J].Trends in Food Science&Technology, 2017, 61:26-37.
ZQUEZ-ESTRADA R M, ROIG A X, et al.Thermosonication:An alternative processing for fruit and vegetable juices[J].Trends in Food Science&Technology, 2017, 61:26-37.
[6] LIAO H M, ZHU W X, ZHONG K, et al.Evaluation of colour stability of clear red pitaya juice treated by thermosonication[J].LWT, 2020, 121:108997.
[7] 韩小苗, 罗庆, 吴苏喜.3种鲜藕的质构特性及风味物质测定与评价[J].食品与机械, 2017, 33(9):64-68.
HAN X M, LUO Q, WU S X, et al.Evaluation of textural properties and flavor substances of three varieties of fresh lotus root[J].Food and Machinery, 2017, 33(9):64-68.
[8] YEOH W K, ALI A.Ultrasound treatment on phenolic metabolism and antioxidant capacity of fresh-cut pineapple during cold storage[J].Food Chemistry, 2017, 216:247-253.
[9] KOCHBA J, LAVEE S, SPIEGEL-ROY P.Differences in peroxidase activity and isoenzymes in embryogenic ane non-embryogenic 'Shamouti' orange ovular callus lines[J].Plant & Cell Physiology, 1977, 18(2):463-467.
[10] WU Z S, ZHANG M, ADHIKARI B.Effects of high pressure Argon and xenon mixed treatment on wound healing and resistance against the growth of Escherichia coli or Saccharomyces cerevisiae in fresh-cut apples and pineapples[J].Food Control, 2013, 30(1):265-271.
[11] DU G R, LI M J, MA F W, et al.Antioxidant capacity and the relationship with polyphenol and vitamin C in Actinidia fruits[J].Food Chemistry, 2009, 113(2):557-562.
[12] QIAO L P, GAO M, ZHENG J X, et al.Novel browning alleviation technology for fresh-cut products:Preservation effect of the combination of Sonchus oleraceus L.extract and ultrasound in fresh-cut potatoes[J].Food Chemistry, 2021, 348:129132.
[13] FALGUERA V, FOLCH A, GARV N A, et al.Protective effect of melanoidins from fructose-glutamic acid on polyphenol oxidase inactivation by ultraviolet-visible irradiation[J].Food & Bioprocess Technology, 2013, 6(11):3 290-3 294.
N A, et al.Protective effect of melanoidins from fructose-glutamic acid on polyphenol oxidase inactivation by ultraviolet-visible irradiation[J].Food & Bioprocess Technology, 2013, 6(11):3 290-3 294.
[14] 王远, 刘春菊, 刘春泉, 等.冻结方式对莲藕片品质及微观结构的影响[J].江苏农业学报, 2015, 31(4):924-928.
WANG Y, LIU C J, LIU C Q, et al.Effect of different freezing methods on the quality and microstructure of lotus-root slices[J].Jiangsu Journal of Agricultural Sciences, 2015, 31(4):924-928.
[15] 刘晓燕. 鲜切莲藕保鲜技术及货架期预测模型的建立[D].雅安:四川农业大学, 2018.
LIU X Y.Study on fresh-keeping technology and the predictive model construction of the shelf-life of fresh-cut lotus root[D].Yaan:Sichuan Agricultural University, 2018.
[16] 葛枝. 超声波、弱酸性电位水在果蔬表面除菌、保鲜中应用[D].杭州:浙江大学, 2014.
GE Z.Investigation of slightly acidic electrolyzed water and ultrasonic treatment on surface decontamination and preservation of fresh fruits and vegetables[D].Hangzhou:Zhejiang University, 2014.
[17] KULDILOKE J, ESHTIAGHI M, ZENKER M, et al.Inactivation of lemon pectinesterase by thermosonication[J].International Journal of Food Engineering, 2007, 3(2).
[18] 唐小闲, 董明琴, 罗杨合, 等.莲藕片汽蒸加工工艺及其挥发性风味物质变化研究[J].食品工业科技, 2021, 42(12):61-69.
TANG X X, DONG M Q, LUO Y H, et al.Steam processing technology of lotus root slices and the changes of its volatile flavoring substances[J].Science and Technology of Food Industry, 2021, 42(12):61-69.
[19] 陈书蓓. 热耦合超声灭活黄豆酱中微生物及其对黄豆酱品质的影响[D].镇江:江苏大学, 2020.
CHEN S B.Effects of thermosonication treatment on microbial inactivation and the quality of soybean paste[D].Zhenjiang:Jiangsu University, 2020.
[20] RATOARINORO N, WILHELM A M, BERLAN J, et al.Effects of ultrasound emitter type and power on a heterogeneous reaction[J].The Chemical Engineering Journal, 1992, 50(1):27-31.
[21] SULAIMAN A, SOO M J, FARID M, et al.Thermosonication for polyphenoloxidase inactivation in fruits:Modeling the ultrasound and thermal kinetics in pear, apple and strawberry purees at different temperatures[J].Journal of Food Engineering, 2015, 165:133-140.
[22] 唐金蕾, 陈媛媛, 程代, 等.复合保鲜液对鲜切山药的护色保鲜作用[J].食品与发酵工业, 2020, 46(3):212-220.
TANG J L, CHEN Y Y, CHENG D, et al.Effect of compound preservation liquid on color protection and preservation of fresh-cut yam[J].Food and Fermentation Industries, 2020, 46(3):212-220.
[23] GUO Y T, WU B G, GUO X Y, et al.Ultrasonication and thermosonication blanching treatments of carrot at varying frequencies:Effects on peroxidase inactivation mechanisms and quality characterization evaluation-sciencedirect[J].Food Chemistry, 2021, 343:128524.
[24] ZHU Y X, DU X R, ZHENG J X, et al.The effect of ultrasonic on reducing anti-browning minimum effective concentration of purslane extract on fresh-cut potato slices during storage-sciencedirect[J].Food Chemistry, 2021, 343:128401.
[25] DO NASCIMENTO E M G C, MULET A, ASCHERI J L R, et al.Effects of high-intensity ultrasound on drying kinetics and antioxidant properties of passion fruit peel[J].Journal of Food Engineering, 2016, 170:108-118.
[26] ISLAM M N, ZHANG M, ADHIKARI B.The inactivation of enzymes by ultrasound—A review of potential mechanisms[J].Food Reviews International, 2014, 30(1):1-21.
[27] O′DONNELL C P, TIWARI B K, BOURKE P, et al.Effect of ultrasonic processing on food enzymes of industrial importance[J].Trends in Food Science & Technology, 2010, 21(7):358-367.
[28] QIAO L P, GAO M, ZHENG J X, et al.Novel browning alleviation technology for fresh-cut products:Preservation effect of the combination of Sonchus oleraceus L.extract and ultrasound in fresh-cut potatoes[J].Food Chemistry, 2021, 348(5):129132.
[29] TARLETON E S, WAKEMAN R J.Ultrasonically Assisted Separation Processes[M].New York:Blackie Academic and Professional, 1998.
[30] SESHADRI R, WEISS J, HULBERT G J, et al.Ultrasonic processing influences rheological and optical properties of high-methoxyl pectin dispersions[J].Food Hydrocolloids, 2003, 17(2):191-197.
[31] DE LAFUENTE-BLANCO S, RIERA-FRANCO DE SARABIA E, ACOSTA-APARICIO V M, et al. Food drying process by power ultrasound[J]. Ultrasonics, 2006, 44(Suppl 1): e523-e527.