食醋是兼有营养和保健功能的酸性调味品之一。除永春老醋外,中国谷物醋以固态酿造工艺为主,如山西老陈醋、镇江香醋和四川麸醋,其工艺特点是淀粉转化、酒精发酵及醋酸发酵等多边代谢速率协调进行[1-2]。作为中国四大名醋之一,四川麸醋以麸皮为原料,因采用回糟生料、分层翻醅的独特发酵工艺而独树一帜[3]。长期以来,操作者缺乏对其微生物群落及代谢机制的认识,仅凭经验调控品质,严重地阻碍其技术进步和生产规模的扩大。
随着分子生物学和现代检测技术的快速发展,功能菌群对发酵产品风味的贡献逐渐被揭示。选育优良功能菌株并开发强化工艺是提高产率和改善品质的有效措施之一。例如,将Aspergillus niger强化的麸曲应用于保宁醋的生产,可提高总酸、有机酸含量以及淀粉利用率,并在连续三轮发酵中保持相对稳定的品质[4-5]。接种Bacillus amyloliquefaciens的强化曲用于同一类型食醋的发酵,可显著提高四甲基吡嗪及乙偶姻的含量[3]。类似地,将Lactobacillus sp.和Acetobacter pasteurianus进行原位生物共培,二者的协同作用也可促进乙偶姻等关键组分的积累[6]。此外,非丰富物种Komagataeibacter europaeus应用于镇江香醋的发酵,可有效调节细菌的组成,增强原位共生网络的鲁棒性,同时上调了与糖和酒精代谢相关基因的丰度[7]。因此,生物强化是调控微生物群落及其功能和改善中国传统谷物醋质量的有效策略。据报道,乙醇是食醋发酵过程中关键的中间代谢产物,也是驱动微生物群落演替的环境因子[8-9]。然而,与生物强化模式相比,乙醇对微生物群落及代谢相关作用机制仍不清楚。
本文主要研究生物强化和中间代谢产物扰动对微生物群落和代谢组分的影响规律,并探讨二者对食醋风味贡献的差异,预测其对特征风味形成途径中关键酶的调控作用。旨在科学地揭示传统食醋固态工艺蕴藏的酿造机理,为规模化生产过程参数的调控奠定理论基础。
1 材料与方法
1.1 材料与试剂
强化醋曲(QHCQ),接种Bacillus velezensis和Bacillus subtilis组成的功能菌群,参照HE等[10]所述的工艺生产,由泸州老窖股份有限公司提供;传统醋曲(LZCQ),由四川阆州醋业有限公司生产;麸皮和次粉购于当地农贸市场。
草酸(≥99.99%)、柠檬酸(≥99.50%)、酒石酸(≥99.50%)、L-苹果酸(≥99.00%)、L-焦谷氨酸(≥99.50%)、琥珀酸(≥99.50%)、乙酸(≥99.70%)、乳酸(≥98.00%)、辛酸甲酯(≥99%)等,Sigma公司;其他化学试剂均为分析纯,购于本地化学试剂公司。
1.2 仪器与设备
Trace 1300-TSQ 9000气相色谱-质谱联用仪,美国Thermo Fisher Electron公司;配备VF-WAX-MS毛细管色谱柱(30 m×0.25 mm×0.25 μm),美国Bellefonte公司;Agilent 1260 infinity高效液相色谱仪,美国Agilent Technologies公司;配备Alltech OA-1000有机酸柱(300 mm×7.8 mm),美国Alltech公司。
1.3 实验方法
1.3.1 麸醋醋醅的发酵及取样
所有的醋醅均按照传统的四川麸醋固态酿造技术生产(图1),但发酵剂和乙醇浓度存在差异。添加20%(质量分数)LZCQ发酵的醋醅记为LX,而分别使用10%(质量分数)的LZCQ和10%(质量分数)的QHCQ酿造的醋醅记为LS。LJ则是在发酵起始使用3°食用酒精溶液代替自来水,发酵剂的添加方式与LX相同。以上3种醋醅在作坊石槽池中发酵,规模为400 kg/批。添加20% LZCQ在大槽中发酵得到的醋醅记为LD,规模为10 000 kg/批。主发酵45 d后,将醋醅压实,在其表面完全覆盖一层塑料薄膜以提供厌氧环境,以实现后熟增香(45 d),相应的熟醅分别记为LXYP、LSYP、LJYP及LDYP。在主发酵和陈酿结束时,根据5点采样法分别从醋池上、中、下层各取50 g醋醅,混合均匀后装入无菌自封袋,一式3份。取样结束立即转运至实验室,随即每份样品分别进行理化指标和挥发性组分的检测,取3次结果的平均值。保藏于-80 ℃ 的样品用于微生物群落等分析检测。
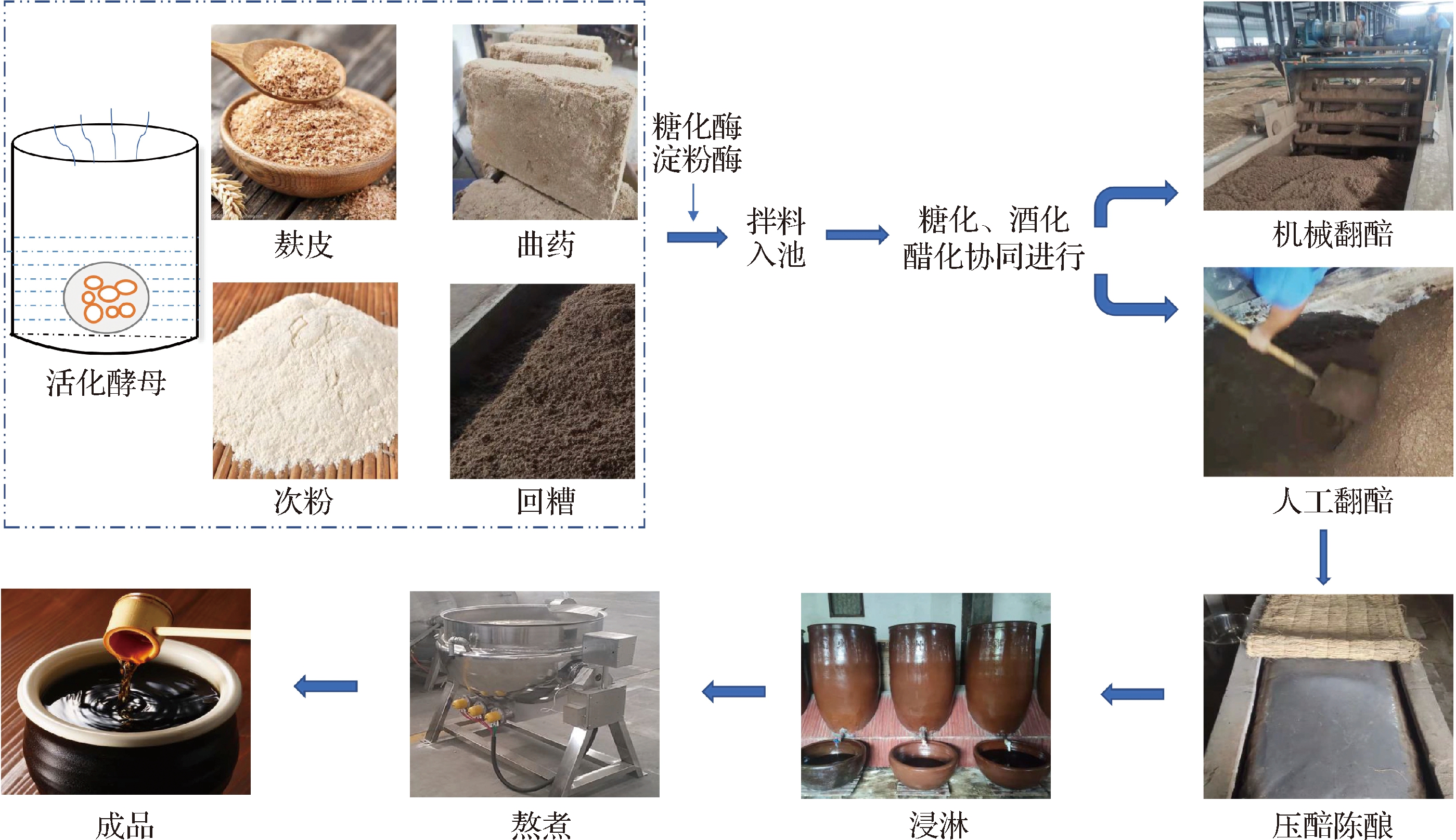
图1 四川麸醋固态酿造工艺流程
Fig.1 Solid-state fermentation process of Sichuan bran vinegar
1.3.2 微生物群落检测
样品总DNA提取:用于Fast DNA SPIN试剂盒(MP Biomedicals,CA)提取醋醅的总DNA。操作步骤:按照供应商提供的操作指令提取总DNA,用NanoDropDN-1000微量分光光度仪(Thermo Fisher Scientific,Waltham,MA)分别测定A260和A280,其A260/A280应在1.8~2.0,并使用1%琼脂糖凝胶电泳验证其纯度。
PCR扩增及测序:分别使用引物338F和806R及ITS5F和ITS1R分别扩增细菌16S rRNA基因高变区V3~V4区和真菌ITS1区。PCR扩增体系:5×reaction buffer和5×GC buffer各5 μL,0.25 μL DNA聚合酶(5 U/μL,Q5 High-Fidelity),2 μL dNTPs(2.5 mmol/L),正反引物各1 μL(10 μmol/L),2 μL DNA模板,8.75 μL ddH2O。使用PCR扩增仪(S1000TM Thermal Cycler,Bio-Rad),操作程序按照HE等[10]所述步骤。扩增的PCR经Agencourt AMPure Beads核酸纯化试剂盒(Beckman Coulter,Indianapolis,IN)纯化后,委托上海派森诺生物科技股份有限公司在Illumina Miseq 2×300 flat form测序。应用QIME处理测序结果,经DATA2完成质控、去噪、拼接和去嵌合体后,用UCLUST把相似长度≥150 bp及相似度>97%的序列聚类成可操作性单元(operational taxonomic unit, OTU)。通过Greengenes数据库及UNITE数据库分别搜寻比对真菌和细菌确定其分类。
1.3.3 理化指标检测
1.3.3.1 残余淀粉含量测定
称取2.00 g醋醅于250 mL三角瓶中,加入100 mL 2%(体积分数)的盐酸溶液,在121 ℃下水解20 min,用20%(质量分数)氢氧化钠溶液中和后,定容至250 mL,过滤。滤液用菲林试剂法滴定其总还原糖含量,还原糖与淀粉间换算系数为0.9。
1.3.3.2 水分含量测定
精确称取醋醅5.000 0 g,置于105 ℃下恒重,按照GB/T 5009.238—2016规定的方法测定。
1.3.3.3 总酸、还原糖和氨态氮含量测定
醋醅经如下所述的预处理得到滤清液,总酸、还原糖和氨态氮分别按照GB 12456—2021、GB 50097—2016和GB/T 18186—2000规定的方法测定。样品预处理:准确称取25 g醋醅,用适量蒸馏水浸泡1 h,15 min搅拌1次,定容至250 mL后过滤,得滤清液。
1.3.4 代谢组分的分析
1.3.4.1 非挥发性组分
采用高效液相色谱法,样品的预处理及检测条件如COCCHI等[11]所述。主要步骤如下:称取2.00 g醋醅,用适量9.00 mmol/L H2SO4溶液浸泡并超声萃取1 h,随后离心10 min(12 000 r/min,4 ℃),收集上清液。C18 SPE小柱(Swell科学仪器有限公司)纯化后的滤液经0.22 μm滤膜过滤,待上机检测。建立标准曲线及计算方法:将标准试剂分别配制成不同浓度的溶液,建立标准曲线,并通过外标法计算有机酸含量。
1.3.4.2 挥发性组分
顶空固相微萃取结合气相-质谱色谱联用仪测定挥发性组分,样品的预处理及色谱条件如ZHANG等[12]所述。主要步骤如下:称取1.0 g醋醅于顶空瓶,加入10 μL 0.007 9 g/100mL的辛酸甲酯溶液,在(60±1) ℃下平衡15 min,将50/30 μm DVB/CAR/PDMS萃取头(美国Supelco公司)插入并吸附45 min后,在进样口解析5 min。定性及定量方法:将质谱数据与NIST2017数据库通过比对鉴定挥发性组分,对于匹配度>800的物质予以分析。采用内标法确定挥发性组分的相对定量。
1.4 数据处理
本研究使用SPSS 24.0软件的单因素方差分析(one-way ANOVA)中Duncan检验法分析其显著性(P<0.05, n=3)。使用Simca 14.1软件对风味物质进行主成分分析(principal components analysis, PCA)。采用Origin 2018软件作图。应用R语言Vegan和ggplot2等软件包计算Spearman相关系数、绘制热图及主坐标分析图(principal co-ordinates analysis, PCoA)。利用Cytoscape 3.8.2软件对数据可视化。
2 结果与分析
2.1 微生物群落多样性分析
如表1所示,LX与LS间细菌Chao1和Simpson指数较为接近,但与LJ、LD间存在差异。该结果表明,乙醇扰动降低了细菌的α-多样性,而强化曲对其影响较小。乙醇对细胞膜的损伤作用较大,会导致部分细菌的形态或膜通透性的改变,而真菌具有较为致密的细胞壁结构,对其毒性具有一定的抵抗力[13-14]。LX(LXYP)的细菌类群Chao1指数高于LD(LDYP)的,故作坊式生产的醋醅微生物的丰富度高于工业规模的。
表1 微生物群落的α-多样性指数
Table 1 Differences of α-diversity indexes among samples

样品细菌真菌Chao1SimpsonChao1SimpsonLX328.250.6146.030.89LS323.620.6748.500.90LJ153.510.3345.500.93LD217.540.8558.230.90LXYP1 892.920.8743.120.81LSYP1 927.100.8489.330.90LJYP918.960.7387.510.92LDYP1 298.280.9075.420.94
如图2所示,发酵结束时各醋醅群落间分布距离较远,故扰动及生产模式均显著影响细菌和真菌的群落结构。作坊和工业化操作模式的差异则会导致温度和溶氧的不同,使其群落结构呈显著差异[15]。除LDYP细菌群落及LSYP真菌群落外,其余熟醅则聚为一簇。这可能是由于高酸度、厌氧以及营养物质匮乏的陈酿环境对微生物群落具有定向驯化作用。
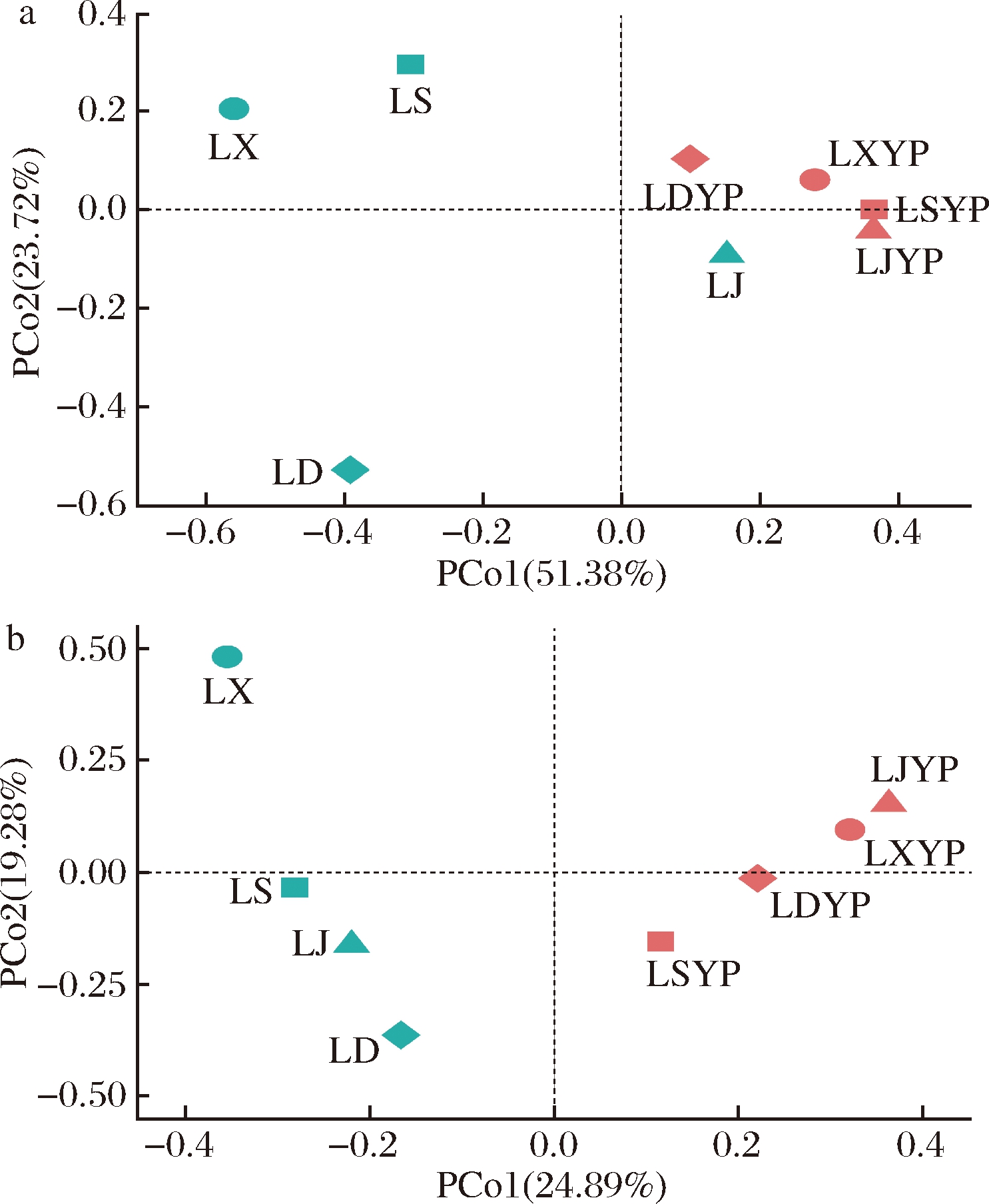
a-细菌;b-真菌
图2 微生物群落的PCoA
Fig.2 Principal co-ordinates analysis of microbial community
2.2 不同醋醅群落结构组成的差异
如图3-a和图3-b所示,醋醅微生物主要由Firmicutes、Proteobacteria、Ascomycota、Basidiomycota和Mucoromycota组成。陈酿后,Proteobacteria和Mucoromycota的丰度显著提高,但Firmicutes和Ascomycota的丰度显著降低。主发酵结束时,这些醋醅均以Lactobacillus和Acetobacter为绝对优势细菌(图3-c),与其他谷物醋一致[5,16-17]。Lactobacillus对食醋风味的形成具有重要作用,产生乳酸、乙酸、苹果酸等有机酸,也可合成2,3-丁二醇、乙偶姻等作为四甲基吡嗪的前体物质[18]。LS与LX微生物同一菌属间丰度差异显著,仅在前者中检出的Sphingomonas和Komagataeibacter等低丰度菌属可通过增加冗余性以维持生态系统的稳定性[7]。Lactobacillus和Acetobacter在LJ中的丰度分别为91.50%和7.41%。值得注意的是,强化曲及乙醇扰动分别将Lactobacillus的丰度提高了17.91%和25.27%。曾报道在酒精发酵阶段,乙醇可能具有促进Lactobacillus繁殖的作用[9]。LD以Acetobacter为绝对优势细菌,而Lactobacillus丰度显著低于LX。这是由于工业化生产中机械倒醅强度和频率均更高,醅间溶氧浓度高于作坊式的,故有利于Acetobacter的生长。此外,工业化醋醅中Oceanobacillus和Bacillus的丰度分别是12.53%和12.13%,二者在作坊式醋醅中丰度均较低。
类似地,扰动和生产模式显著影响了优势真菌属的组成(图3-d)。LX以Thermomyces、Pichia和Trichosporon为优势真菌,LD中Aspergillus、Monascus和Pichia则是优势菌。LS的Aspergillus和Rhizopus丰度显著高于LX,这可能是源于强化曲的贡献。此外,Phaeosphaeria、Monascus和Xeromyces也是LS的优势真菌。Monascus的丰度在LS、LJ及LD中分别提高了11.99%、7.65%和19.98%,该菌属被广泛用于福建米酒和食醋的酿造,可产生多种生物活性物质[19]。相较于LX,Alternaria、Aspergillus和Acremonium丰度在乙醇扰动下增强,并成为LJ的优势菌。其中,Acremonium丰度为10.10%,分泌纤维素酶和半纤维素酶的能力较强[20]。
这些醋醅与醋曲的细菌组成存在明显的差异,推测其优势菌属可能源于原料、微生态环境及生产设施等。陈酿后,Lactobacillus(38.86%~79.06%)丰度有所降低,但仍为绝对优势菌,Acetobacter丰度在该厌氧环境中显著降低,在作坊生产的醋醅中均<0.5%。此外,Sphingomonas、Pseudeurotium、Rhizopus和Lichtheimia的丰度都提高,可能与该过程挥发性组分含量变化密切相关。

a-细菌门组成;b-真菌门组成;c-细菌属组成;d-真菌属组成
图3 门及属水平上细菌和真菌的相对丰度(OTU>0.5%) Fig.3 Relative abundance of bacterial and fungal community at phylum and genus level (OTU>0.5%)
2.3 发酵过程和陈酿前后理化性质的差异
如图4所示,除总酸外,水分、残余淀粉及还原糖含量的动态变化在主发酵阶段存在差异。发酵末期,LS淀粉转化率略高于LX和LJ,三者分别为50.81%、48.73%和45.10%。值得注意的是,LD因Bacillus、Oceanobacillus和Aspergillus的丰度较高,分泌淀粉酶、纤维素酶的能力较强[21-22],故其残淀含量显著低于LX的(表2)。陈酿过程淀粉和还原糖含量分别减少了0.80%~7.59%及14.68%~50.00%,总酸呈增加的趋势,这表明碳水化合物的水解和利用在该阶段仍缓慢进行。

a-水分;b-总酸;c-残余淀粉;d-还原糖
图4 手工醋醅发酵过程理化参数的变化规律
Fig.4 The changes of physicochemical parameters in manual Cupei during the fermentation
表2 醋醅间理化性质的差异
Table 2 Differences on physicochemical properties of Cupei
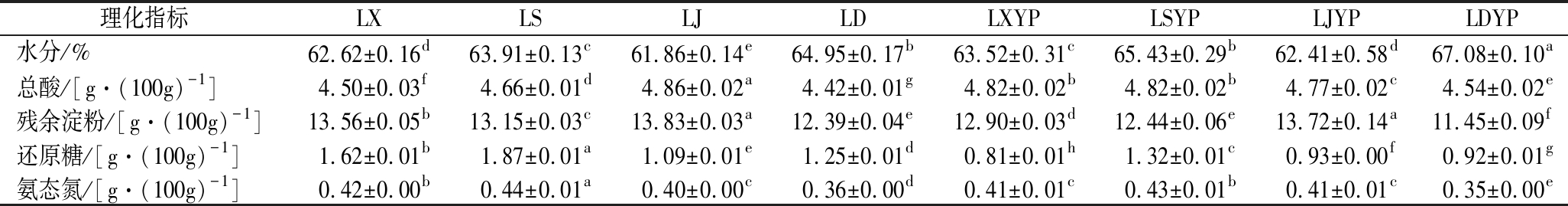
理化指标LXLSLJLDLXYPLSYPLJYPLDYP水分/%62.62±0.16d63.91±0.13c61.86±0.14e64.95±0.17b63.52±0.31c65.43±0.29b62.41±0.58d67.08±0.10a总酸/[g·(100g)-1]4.50±0.03f4.66±0.01d4.86±0.02a4.42±0.01g4.82±0.02b4.82±0.02b4.77±0.02c4.54±0.02e残余淀粉/[g·(100g)-1]13.56±0.05b13.15±0.03c13.83±0.03a12.39±0.04e12.90±0.03d12.44±0.06e13.72±0.14a11.45±0.09f还原糖/[g·(100g)-1]1.62±0.01b1.87±0.01a1.09±0.01e1.25±0.01d0.81±0.01h1.32±0.01c0.93±0.00f0.92±0.01g氨态氮/[g·(100g)-1]0.42±0.00b0.44±0.01a0.40±0.00c0.36±0.00d0.41±0.01c0.43±0.01b0.41±0.01c0.35±0.00e
注:不同小写字母代表同一指标不同样品之间的差异显著(P<0.05)(下同)
2.4 扰动对代谢组分的影响
优势有机酸为乙酸、乳酸、焦谷氨酸及琥珀酸,其中乳酸和乙酸含量之和占比高达89.99%~95.09%,构成了食醋风味的主要骨架(表3)。曾报道乳酸/乙酸是四川麸醋的潜在特征指标[23],因为丰富的乳酸可平衡乙酸的刺激性,赋予麸醋口感柔和、回味悠远的特色。该比值在作坊模式生产的醋醅中为0.51~0.73,而工业化醋醅为0.91~0.93。尽管LJ中Acetobacter丰度显著低于LX,但其乙酸含量提高了10.42%。这可能是添加的乙醇扰动了淀粉、酒精和乙酸三者间的转化平衡,更高效地推动了乙醇氧化为乙酸。陈酿后,乳酸含量略有下降,这与其被转化为乳酸乙酯有关。再者,高乙酸浓度的胁迫亦能使乳酸通过D-乳酸脱氢酶作用逆向转化为丙酮酸,合成2,3-丁二醇等风味物质[24]。
这些样品中检出的酯、酸、酮及酚类为优势挥发性成分(图5-a和图5-b)。此外,尽管吡嗪类物质含量仅为754.91~4 670.02 ng/g,但它为食醋贡献令人愉快的坚果香和烘焙的面包味道[25]。其中,四甲基吡嗪是重要的生物活性物质,不仅可由美拉德反应合成,Bacillus等微生物亦能代谢产生[25-26]。熟醅中四甲基吡嗪含量大小顺序如下:LSYP[(3 687.14±318.36) ng/g]>LJYP[(1 863.55±282.88) ng/g]>LXYP[(1 559.40±238.80) ng/g]>LDYP[(588.08±52.70) ng/g]。该结果表明,2种扰动方式均提高了四甲基吡嗪的含量,其中强化曲扰动的效果更显著。此外,LSYP乙偶姻、2,3-丁二酮、2,3-丁二醇的含量分别提高了3.64、3.41、1.27倍。乙偶姻可由Lactobacillus和Acetobacter利用双乙酰还原酶催化转化2,3-丁二酮产生,是评价谷物醋重要的质量指标[6,18]。可推测强化曲中优势菌Bacillus和Lactobacillus对四甲基吡嗪、乙偶姻等关键组分的合成具有较大的贡献。
表3 不同醋醅有机酸含量 单位:mg/g
Table 3 Contents of organic acids in Cupei
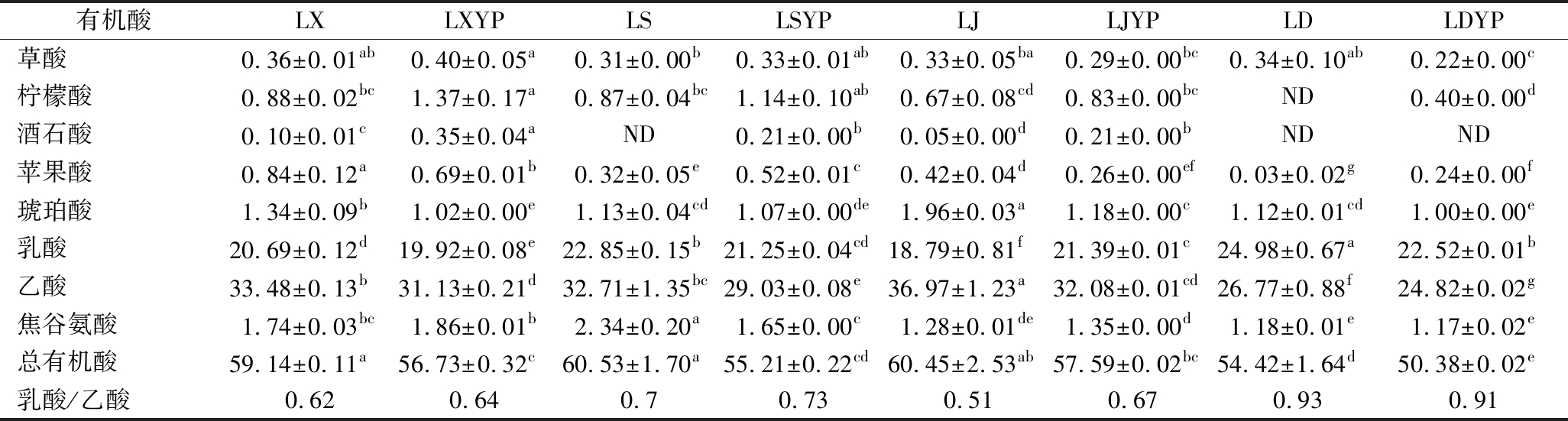
有机酸LXLXYPLSLSYPLJLJYPLDLDYP草酸0.36±0.01ab0.40±0.05a0.31±0.00b0.33±0.01ab0.33±0.05ba0.29±0.00bc0.34±0.10ab0.22±0.00c柠檬酸0.88±0.02bc1.37±0.17a0.87±0.04bc1.14±0.10ab0.67±0.08cd0.83±0.00bcND0.40±0.00d酒石酸0.10±0.01c0.35±0.04aND0.21±0.00b0.05±0.00d0.21±0.00bNDND苹果酸0.84±0.12a0.69±0.01b0.32±0.05e0.52±0.01c0.42±0.04d0.26±0.00ef0.03±0.02g0.24±0.00f琥珀酸1.34±0.09b1.02±0.00e1.13±0.04cd1.07±0.00de1.96±0.03a1.18±0.00c1.12±0.01cd1.00±0.00e乳酸20.69±0.12d19.92±0.08e22.85±0.15b21.25±0.04cd18.79±0.81f21.39±0.01c24.98±0.67a22.52±0.01b乙酸33.48±0.13b31.13±0.21d32.71±1.35bc29.03±0.08e36.97±1.23a32.08±0.01cd26.77±0.88f24.82±0.02g焦谷氨酸1.74±0.03bc1.86±0.01b2.34±0.20a1.65±0.00c1.28±0.01de1.35±0.00d1.18±0.01e1.17±0.02e总有机酸59.14±0.11a56.73±0.32c60.53±1.70a55.21±0.22cd60.45±2.53ab57.59±0.02bc54.42±1.64d50.38±0.02e乳酸/乙酸0.620.640.70.730.510.670.930.91
注:ND表示未检出

a-挥发性组分含量变化;b-重要风味物质热图;c-风味物质的主成分分析;d-风味物质与菌属(OTU>0.5%)的相关性分析(P<0.05) 图5 不同扰动下醋醅间风味组分的差异
Fig.5 Differences of volatile components among Cupei under different disturbances
除有机酸以外,乙醇扰动还主要影响了部分醇、酸和吡嗪类物质的含量。例如,LJYP中2,3-丁二醇含量是LXYP的2.40倍,前者异丁酸、正己酸、辛酸及壬酸含量也都显著高于后者,吡嗪类组分的含量提高了36.89%。2,4,5-三甲基恶唑的含量提高了9.52倍,该物质可由丁二酮和氨基酸经美拉德反应生成[27]。由于乳酸含量较高,LDYP的乳酸乙酯含量显著高于LXYP,该酯可为食醋贡献果香。
陈酿后,LXYP、LSYP及LJYP酸类和醇类组分含量都显著增加,吡嗪类物质含量分别提高了38.64%、187.48%及99.58%。因3-羟基-2-丁酮、2,3-丁二酮转化为其他物质,酮类组分含量降低。乙酸苯乙酯、乳酸乙酯、乙酸糠酯等酯类组分含量增加,糠醇、苯乙酸、苯乙醛、2,3,5-三甲基吡嗪、2,3-二甲基-5-丙基吡嗪及2,3,5-三甲基-6-乙基吡嗪等物质在陈酿过程中合成。
2.5 基于风味物质的PCA
如图5-c所示,主成分1和2的解释率分别为36.90%和25.20%。LX、LS及LJ聚为一簇,与LD的距离较远。前者的特征组分包括乙偶姻、α-雪松烯、桃醛和琥珀酸等,而后者庚酸乙酯、乙酸庚酯、壬酸乙酯含量较高。该分析结果揭示了主发酵结束时作坊和工业模式生产的醋醅间风味轮廓存在显著差异,LSYP和LJYP聚为一簇,其特征组分主要是辛酸、3-乙酰基-2-丁酮、2,3-二甲基吡嗪和四甲基吡嗪。二者与LXYP间较为离散,这表明熟醅的特征风味受强化曲和乙醇扰动的影响较为显著。陈酿前后相应的醋醅聚在不同象限,故该过程的各种物理和生化反应对其风味轮廓的形成和发展起到至关重要的作用。
2.6 微生物与风味物质的关联分析
如图5-d所示,基于Spearman相关系数揭示了微生物(OTU>0.5%)与重要风味物质显著关联的结果(P<0.05)。有机酸主要与Lactobacillus、Acetobacter、Aspergillus和Pseudomonas相关。已有研究表明,乙酸主要由Acetobacter和Pseudomonas等菌属代谢产生[28]。Aspergillus分泌的淀粉酶及纤维素酶等水解酶将原料水解为小分子糖,进而通过EMP途径合成乳酸,故乳酸与Aspergillus显著正相关。多种乙酯类(如苯乙酸乙酯、乳酸乙酯)和醇类(如异戊醇、2,3-丁二醇、苯乙醇)与Sphingomonas、Virgibacillus、Hyphopichia、Rhizomucor和Rhizopus呈正相关。
2.7 扰动对特征风味组分代谢途径的影响
不同醋醅间吡嗪类、乳酸及苯乙醇等组分含量存在显著差异,与细菌的代谢密切相关,故利用PICRUSt2对样品代谢功能进行预测(图6)。

图6 特征风味物质的代谢途径分析
Fig.6 The metabolic pathways of characteristic flavor compounds
生物扰动后,双乙酰还原酶(EC:1.1.1.304和EC:1.1.1.76)的表达上调有助于四甲基吡嗪、三甲基吡嗪及2,3-丁二醇的积累,因此,上述风味组分含量显著提高。三甲基吡嗪由苏氨酸脱羧反应生成的氨基丙酮中间体与乙偶姻经缩合氧化产生,而四甲基吡嗪则是由乙偶姻经氨化及环化缩合反应生成[25]。乙醇脱氢酶(EC:1.1.1.1)是提高食醋产率理想的调控位点[29],在乙醇扰动后显著上调。同样地,负责苯乙醇合成的芳基醇脱氢酶(EC:1.1.1.90)也表达上调。调控乳酸合成的关键酶在强化曲和乙醇扰动后表达上调,包括D-乳酸脱氢酶(EC:1.1.1.28)和L-乳酸脱氢酶(EC:1.1.1.27),这与其乳酸含量较高的结果一致。
3 结论
本研究基于高通量测序及色谱等多种现代检测技术揭示了强化曲及乙醇扰动对四川麸醋微生物及代谢组分的影响。结果表明,2种扰动方式均提高了Lactobacillus、Aspergillus、Rhizopus和Monascus等功能菌属的丰度,并显著影响了熟醅的风味轮廓。生物扰动显著提高了四甲基吡嗪、乙偶姻及2,3-丁二酮等功能组分的含量,这与合成相关的关键酶表达上调有关,有助于增强四川麸醋特征性风味。而乙醇扰动使2,4,5-三甲基恶唑的含量提高了9.52倍,并增强了苯乙醇、乳酸等相关代谢途径关键酶的表达。本研究结果为开发提高四甲基吡嗪等关键功能组分的调控技术奠定了理论基础,为控制关键因素优化四川麸醋酿造的管理提供了思路。
[1] XIA T, ZHANG B, DUAN W H, et al.Nutrients and bioactive components from vinegar:A fermented and functional food[J].Journal of Functional Foods, 2020, 64:103681.
[2] KANDYLIS P, BEKATOROU A, DIMITRELLOU D, et al.Health promoting properties of cereal vinegars[J].Foods(Basel,Switzerland), 2021, 10(2):344.
[3] ZHANG L Q, HUANG J, ZHOU R Q, et al.Evaluating the feasibility of fermentation starter inoculated with Bacillus amyloliquefaciens for improving acetoin and tetramethylpyrazine in Baoning bran vinegar[J].International Journal of Food Microbiology, 2017, 255:42-50.
[4] LIU A P, PENG Y, AO X L, et al.Effects of Aspergillus niger biofortification on the microbial community and quality of Baoning vinegar[J].LWT, 2020, 131:109728.
[5] LIU A P, WANG R, LI J L, et al.Multiple rounds of Aspergillus niger biofortification confer relatively stable quality with minor changes of microbial community during industrial-scale Baoning vinegar production[J].Food Research International, 2021, 150:110768.
[6] CHAI L J, QIU T, LU Z M, et al.Modulating microbiota metabolism via bioaugmentation with Lactobacillus casei and Acetobacter pasteurianus to enhance acetoin accumulation during cereal vinegar fermentation[J].Food Research International, 2020, 138:109737.
[7] PENG M Y, ZHANG X J, HUANG T, et al.Komagataeibacter europaeus improves community stability and function in solid-state cereal vinegar fermentation ecosystem:Non-abundant species plays important role[J].Food Research International, 2021, 150:110815.
[8] JO Y, BAEK J Y, JEONG I Y, et al.Physicochemical properties and volatile components of wine vinegars with high acidity based on fermentation stage and initial alcohol concentration[J].Food Science and Biotechnology, 2015, 24(2):445-452.
[9] ZHENG Y, MOU J, NIU J W, et al.Succession sequence of lactic acid bacteria driven by environmental factors and substrates throughout the brewing process of Shanxi aged vinegar[J].Applied Microbiology & Biotechnology, 2018, 102(6):2 645-2 658.
[10] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 111:1-8.
[11] COCCHI M, DURANTE C, GRANDI M, et al.Simultaneous determination of sugars and organic acids in aged vinegars and chemometric data analysis[J].Talanta, 2006, 69(5):1 166-1 175.
[12] ZHANG L Q, ZHOU R Q, CUI R Y, et al.Characterizing soy sauce moromi manufactured by high-salt dilute-dtate and low-salt solid-state fermentation using multiphase analyzing methods[J].Journal of Food Science, 2016, 81(11):C2 639-C2 646.
[13] CHEN X Q, WANG T T, JIN M, et al.Metabolomics analysis of growth inhibition of Lactobacillus plantarum under ethanol stress[J].International Journal of Food Science & Technology, 2020, 55(11):3 441-3 454.
[14] LOURENÇO A B, ROQUE F C, TEIXEIRA M C, et al.Quantitative 1H-NMR-metabolomics reveals extensive metabolic reprogramming and the effect of the aquaglyceroporin FPS1 in ethanol-stressed yeast cells[J].PLoS One, 2013, 8(2):e55439.
[15] ZHANG Q, FU C X, ZHAO C M, et al.Monitoring microbial succession and metabolic activity during manual and mechanical solid-state fermentation of Chinese cereal vinegar[J].LWT, 2020, 133:109868.
[16] WANG Z M, LU Z M, SHI J S, et al.Exploring flavour-producing core microbiota in multi species solid-state fermentation of traditional Chinese vinegar[J].Scientific Reports, 2016, 6:26818.
[17] NIE Z Q, ZHENG Y, XIE S K, et al.Unraveling the correlation between microbiota succession and metabolite changes in traditional Shanxi aged vinegar[J].Scientific Reports, 2017, 7(1):1-12.
[18] LU Z M, LIU N, WANG L J, et al.Elucidating and regulating the acetoin production role of microbial functional groups in multi species acetic acid fermentation[J].Applied and Environmental Microbiology, 2016, 82(19):5 860-5 868.
[19] PATAKOVA P.Monascus secondary metabolites:Production and biological activity[J].Journal of Industrial Microbiology and Biotechnology, 2013, 40(2):169-181.
[20] DE ALMEIDA M N, GUIMAR ES V M, BISCHOFF K M, et al.Cellulases and hemicellulases from endophytic Acremonium species and its application on sugarcane bagasse hydrolysis[J].Applied Biochemistry and Biotechnology, 2011, 165(2):594-610.
ES V M, BISCHOFF K M, et al.Cellulases and hemicellulases from endophytic Acremonium species and its application on sugarcane bagasse hydrolysis[J].Applied Biochemistry and Biotechnology, 2011, 165(2):594-610.
[21] CHEN L, ZHAO Z J, YU W, et al.Nutritional quality improvement of soybean meal by Bacillus velezensis and Lactobacillus plantarum during two-stage solid- state fermentation[J].AMB Express, 2021, 11(1):23.
[22] D SANTOS A F, PACHECO C A, VALLE R S, et al.Enzymes produced by halotolerant spore-forming gram-positive bacterial strains isolated from a resting habitat (Restinga de Jurubatiba) in Rio de Janeiro, Brazil:Focus on proteases[J].Applied Biochemistry and Biotechnology, 2014, 174(8):2 748-2 761.
[23] 余宁华, 陆震鸣, 许伟, 等.基于主成分分析的中国发酵食醋有机酸含量差异性分析[J].食品与发酵工业, 2010, 36(10):144-148.
YU N H, LU Z M, XU W, et al.Regional difference of organic acid contents in Chinese fermented vinegar based on principal component analysis[J].Food and Fermentation Industries, 2010, 36(10):144-148.
[24] WU Y F, XIA M L, ZHAO N, et al.Metabolic profile of main organic acids and its regulatory mechanism in solid-state fermentation of Chinese cereal vinegar[J].Food Research International, 2021, 145:110400.
[25] ZHANG L J, CAO Y L, TONG J N, et al.An alkylpyrazine synthesis mechanism involving l-threonine-3-dehydrogenase describes the production of 2,5-dimethylpyrazine and 2,3,5-trimethylpyrazine by Bacillus subtilis[J].Applied and Environmental Microbiology, 2019, 85(24):e01807-e01819.
[26] MENG W, DING F, WANG R M, et al.Enhanced production of tetramethylpyrazine in Bacillus licheniformis BL1 through aldC over-expression and acetaldehyde supplementation[J].Scientific Reports, 2020:3544.
[27] 孙宗保, 尹俊玲, 赵杰文, 等.杂环化合物在镇江香醋陈酿过程中的变化[J].中国食品学报, 2015, 15(6):199-205.
SUN Z B, YIN J L, ZHAO J W, et al.The changes of heterocyclic compounds in Zhenjiang aromatic vinegar during ageing[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(6):199-205.
[28] LI S, LI P, LIU X, et al.Bacterial dynamics and metabolite changes in solid-state acetic acid fermentation of Shanxi aged vinegar[J].Applied Microbiology and Biotechnology, 2016, 100(10):4 395-4 411.
[29] YIN X Y, ZHONG W K, HUO J, et al.Production of vinegar using edible alcohol as feedstock through high efficient biotransformation by acetic acid bacteria[J].Food Science and Biotechnology, 2017, 27(2):519-524.