灵芝(Ganoderma)又名神芝、瑞草,是多孔菌科真菌赤芝[Ganoderma lucidum (Leyss.ex Fr.) Karst.]或紫芝(Ganoderma sinense Zhao, Xu et Zhang)的干燥子实体,作为我国药食两用传统名贵中药,是我国最知名的药用真菌物种之一[1-2]。《本草纲目》中记载“灵芝性平,味苦,无毒,主胸中结,益心气,补中,增智慧,不忘,久服轻身不老,延年神仙”。现代药理学研究证实灵芝含有灵芝多糖、灵芝三萜类化合物、氨基酸等多种生物活性成分,具有抗病毒、抗肿瘤、抗衰老、保肝护肝等药理作用[3-5],还可以减轻氧化应激,阻止紫外线对皮肤细胞造成光损伤[6-7]。
子实体的灵芝原料成本普遍较高,产品质量不稳定,将灵芝的菌丝体接种于液体培养基中,以一定转速和温度进行培养,菌丝体在培养基中获得合成代谢产物或生长繁殖所需营养物质的培养方式称为灵芝液体深层发酵培养。液体深层发酵技术因其生产周期短、效率高、产量大、品质稳定,已经成为开发利用灵芝资源的重要途径[6,8-9]。添加玉竹、桦树茸、人参等药材既可以为菌丝体提供大量营养活性成分,同时其药效成分又可被菌丝体产生的酶催化产生大量新的活性物质[10]。
中波紫外线(ultraviolet radiation b,UVB),波长290~320 nm,是诱发皮肤损伤的主要因素之一,UVB能够作用于皮肤表面的角质形成细胞,引起皮肤的光损伤,激活细胞产生白细胞介素-1α(interleukin-1α,IL-1α)、前列腺素E2(prostaglandin E2,PGE2)等炎症因子,造成日晒红斑、水疱等皮肤损伤[11-13]。IL-1α是一个典型的炎症促进分子,属于白细胞介素-1(IL-1)的成员范围,可以诱导炎症基因转录,产生的炎症信号可诱导白细胞介素-1β(IL-1β)的释放和活化,激发和维持炎症特性,在炎症和免疫反应的发生中起重要作用[14-15]。PGE2是前列腺素(prostaglandin,PG)中作用最强的一种,广泛存在于动物和人体中,手术的应激和损伤刺激均可使PGE2水平上升[16]。PGE2可以直接激活伤害性感受器,提高痛觉感受器对缓激肽和其他致痛因子的敏感性,从而引起或放大疼痛[17-18]。人角质形成细胞(human immortalized keratinocytes,HaCaT)是一种来自成年人类的永生化角质形成细胞,具有与正常人角质形成细胞相似的特征,在研究中常作为细胞炎症模型[19-20]。
因此,本研究利用液体深层发酵技术对灵芝进行培养,通过添加玉竹[Polygonatum odoratum(Mill.) Druc]、桦树茸(Inonotus obliquus)、人参(Panax ginseng C.A.Mey.)及三七[Panax notoginseng(Burk.)F.H.Chen]药材粉末,发酵制备灵芝(S1)、灵芝-玉竹(S2)、灵芝-桦树茸(S3)、灵芝-人参(S4)以及灵芝-三七(S5)发酵液冻干粉,利用UVB照射HaCaT细胞产生光损伤模拟皮肤表皮组织中角质形成细胞的光损伤,建立UVB诱导的HaCaT细胞光损伤模型,通过检测样品S1~S5对HaCaT细胞炎症因子IL-1α及PGE2分泌的抑制作用,探究S1~S5修复UVB光损伤的能力,进而筛选出最优的灵芝发酵组合方式,为灵芝组合发酵的工业化生产提供前提和基础。
1 材料与方法
1.1 材料与试剂
本次实验所用菌种为灵芝[Ganoderma lucidum(Leyss.ex Fr.)Kars,CICC14024],购自中国工业微生物菌种保藏中心(China Center of Industrial Culture Collection,CICC);玉竹(P.odoratum),购自中国北京同仁堂有限责任公司;桦树茸(I.obliquus)、人参(P.ginseng)、三七(P.notoginseng),购自河北安国东方药城。
本次实验所用细胞为角质形成细胞(批次:EP200708;代次:P7),由广东博溪生物科技有限公司通过细胞原代、传代培养获得。
PBS,博士德生物工程有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、二甲基亚砜(dimethylsulfoxide,DMSO)、地塞米松,默克化工技术(上海)有限公司;人IL-1α ELISA试剂盒、人PGE2 ELISA试剂盒,艾博抗(上海)贸易有限公司。
1.2 仪器与设备
Heracell 150i CO2培养箱,美国Thermo公司;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;CKX41倒置显微镜,日本Olympus公司;MH-1微量振荡器,海门市其林贝尔仪器制造有限公司;Epoch酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1 发酵液冻干粉制备工艺
二级种子液培养,首先配制发酵基础培养基(g/L):在S1~S5发酵罐中加入葡萄糖35、蛋白胨5、酵母粉2.5、KH2PO4 1、七水硫酸镁0.5,维生素B1 0.05,然后在S2、S3、S4、S5发酵罐中分别加入玉竹、桦树茸、人参及三七药材粉末10,121 ℃,灭菌20 min,按照10%的接种量接种,在28 ℃,150 r/min的摇床中发酵7 d后,超声30 min后灭菌处理,4 ℃冰箱中静置1~2 d,抽滤,收集滤液,制备冻干粉。
1.3.2 HaCaT细胞模型建立
1.3.2.1 细胞毒性实验
细胞接种:按1×104个/孔的接种密度接种细胞至96孔板,培养箱(37 ℃、5% CO2)中孵育过夜。
实验分组:实验设置调零组、溶剂对照组、阳性对照组与样品组。样品组中,每个样品设置8个浓度梯度,每个浓度梯度下设置3个重复孔。
配液:按照设定的测试浓度,使用样品S1~S5冻干粉配制不同浓度的受试物工作液(表1)。
表1 MTT细胞毒性实验样品测试质量浓度 单位:mg/mL
Table 1 Sample test concentration of MTT cytotoxicity test

样品名称(1)(2)(3)(4)(5)(6)(7)(8)S10.007 80.015 60.031 30.062 50.1250.250.51S20.007 80.015 60.031 30.062 50.1250.250.51S30.007 80.015 60.031 30.062 50.1250.250.51S40.078 10.156 30.312 50.6251.252.5510S50.078 10.156 30.312 50.6251.252.5510
给药:待96孔板中细胞铺板率达到40%~60%时进行给药。调零组无细胞接种,仅加入200 μL的细胞培养液;溶剂对照组每孔加入200 μL的培养液;阳性对照组每孔加入200 μL含10%(体积分数)DMSO的培养液;样品组每孔加入200 μL含有相应浓度受样品的培养液。给药完成后将96孔板放置在培养箱(37 ℃、5% CO2)中培养。
检测:细胞孵育培养24 h后,弃掉上清液,加入MTT工作液(0.5 mg/mL,现配现用),37 ℃避光孵育4 h,孵育结束后,弃掉上清液,每孔加150 μL DMSO,在490 nm处读取OD值。根据公式(1)计算细胞相对活力。
细胞相对活力![]()
(1)
1.3.2.2 细胞形态学检测
细胞接种:按4.5×104个/孔的密度接种细胞至24孔板中,培养箱(37 ℃、5% CO2)中孵育过夜。
配液:根据MTT检测结果,选取细胞活力拐点附近浓度,进行形态学观察,确定检测样品的形态学观察浓度。
给药:待24孔板细胞铺板率达到40%~60%时,进行给药。样品组加入含相应浓度样品的细胞培养液,溶剂对照组加入细胞培养液,培养箱(37 ℃、5% CO2)中孵育培养24 h。
形态观察:孵育结束后,倒置显微镜下观察细胞形态并拍照(20×)。
1.3.2.3 UVB辐射建模
接种:按2.5×105个/孔的接种密度接种细胞至6孔板,培养箱(37 ℃、5% CO2)中孵育过夜。
实验分组:实验设置空白对照组(BC)、阴性对照组(NC)、阳性对照组[PC,0.01%(质量分数)的地塞米松]与样品组。按照MTT及细胞形态学测试结果,使用样品S1~S5冻干粉配制受试物工作液,S1~S3样品质量浓度为0.0313 mg/mL,S4及S5样品质量浓度为0.156 3 mg/mL。
给药:待6孔板中细胞铺板率达到30%~40%时,进行分组给药,每孔给药量为2 mL,每组设3个复孔。BC组及NC组加入培养液,PC组加入0.01%的地塞米松,样品组加入相应的受试工作液。37 ℃,5%CO2培养箱继续培养24 h。
UVB辐照:给药24 h后,弃掉培养液,并在每孔加入1 mL PBS溶液,清洗细胞,重复清洗3次。按测试分组对样品组、NC组和PC组分别进行UVB辐照(辐照剂量为300 mJ/cm2)。
后孵育及收集上清液:UVB辐照结束后,每孔加入1 mL PBS溶液清洗,重复3次,清洗结束后,每孔加入2 mL细胞培养液,培养24 h后,收集细胞培养上清液于EP管中,置于-80 ℃冰箱冷冻保存,待用。
1.3.3 炎症因子检测
根据人IL-1α、PGE2 ELISA试剂盒的操作说明书进行ELISA检测。
1.4 分析方法
细胞毒性检测、IL-1α含量检测及PGE2含量检测结果采用GraphPad Prism Program软件作图,样品组与阴性对照组比较,采用t-test统计分析,样品组间采用单因素ANOVA分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 细胞毒性实验结果
以S1、S2、S3、S4、S5所选8个浓度为横坐标,细胞相对活力值为纵坐标,绘制细胞相对活力曲线(图1)。基于MTT测试结果,选择5个浓度进行形态学检测。

a-S1~S3;b-S4~S5
图1 S1~S5不同浓度细胞相对活力曲线
Fig.1 Cell relative viability curve at different concentration of S1-S5
根据MTT和细胞形态学结果,认为S1、S2、S3在0.031 3 mg/mL质量浓度内对角质形成细胞未表现出细胞毒性;S4、S5在0.156 3 mg/mL的质量浓度内无细胞毒性(图2)。
2.2 IL-1α检测结果
依据ELISA试剂盒说明书,使用样品S1、S2、S3(0.031 3 mg/mL)及S4、S5(0.156 3 mg/mL)开展IL-1α含量的检测,检测结果表明,与空白对照组(BC)相比,NC组的IL-1α含量极显著升高(P<0.01),说明本次实验UVB刺激条件有效。与NC组相比,PC组IL-1α分泌水平极显著降低(P<0.01),表明本次阳性对照检测有效(表2、图3)。
与NC组相比,样品S1、S3在0.031 3 mg/mL、S5在0.156 3 mg/mL时有显著的抑制作用(P<0.05),并且S3、S5在其相应浓度对IL-1α分泌的抑制作用强于S1,但没有显著差异(表2、图3)。

a-S1;b-S2;c-S3;d-S4;e-S5
图2 S1~S5不同浓度细胞形态观察结果
Fig.2 Cell morphology observation results at different concentration of S1-S5
表2 IL-1α含量检测结果
Table 2 Results of IL-1α content test

组别含量/(pg·mL-1)标准差P值BC8.340.37NC23.000.640.000##PC12.100.430.000∗∗S117.521.520.005∗∗S222.330.560.241S316.190.520.000∗∗S422.130.910.631 4S515.741.300.015 7∗
注:用t-test方法进行统计分析时,##表示与BC对比,P<0.01;*表示与NC对比,P<0.05;**表示与NC对比,P<0.01(下同)
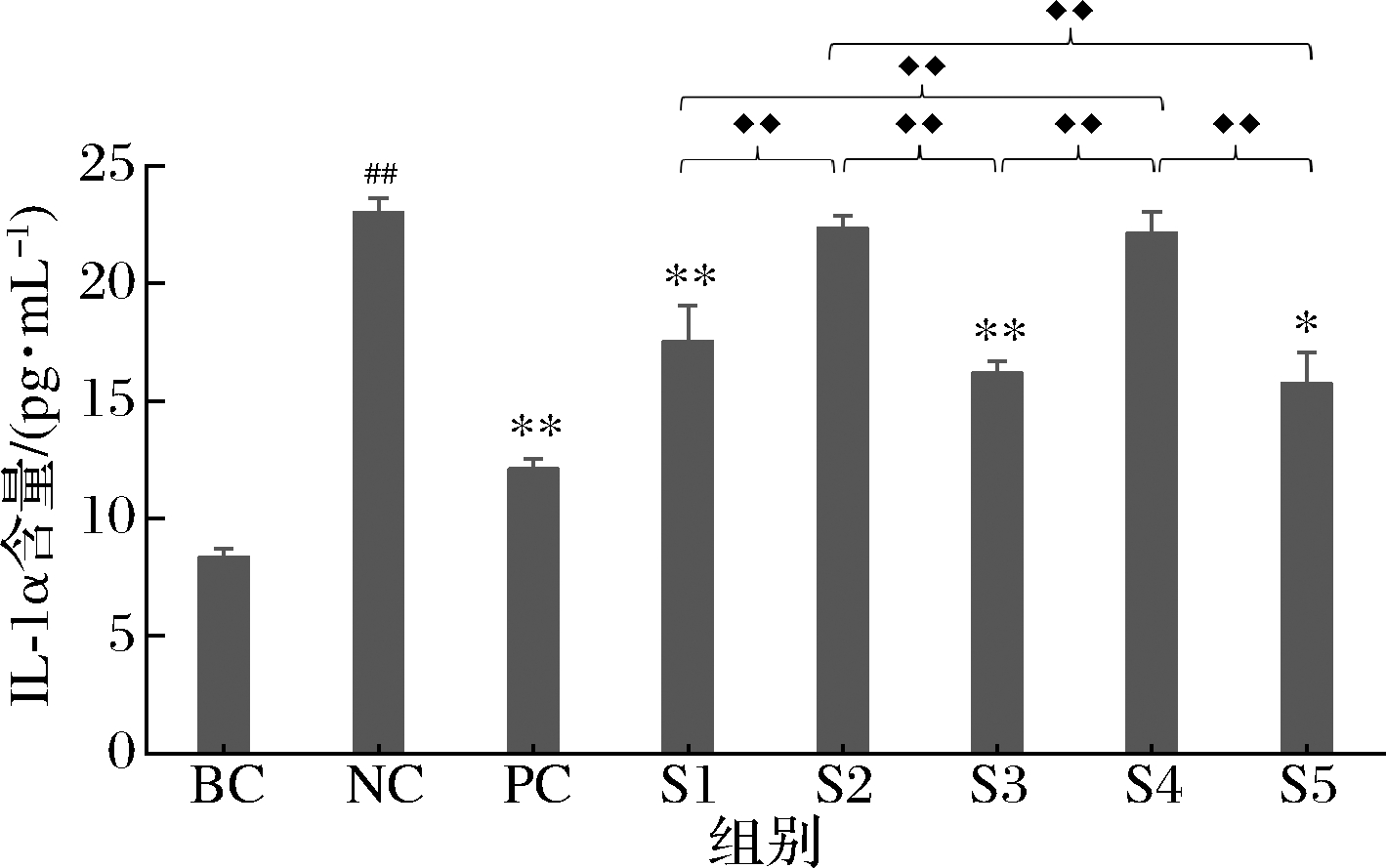
图3 S1~S5对IL-1α分泌含量的影响
Fig.3 Effects of S1-S5 on IL-1α secretion
注:用t-test方法进行统计分析时,#表示与BC对比,P<0.05;##表示与BC对比,P<0.01;*表示与NC对比,P<0.05;**表示与NC对比,P<0.01;样品S1~S5间采用单因素ANOVA分析,◆◆表示P<0.01(下同)
2.3 PGE2检测结果
依据ELISA试剂盒说明书,使用样品S1、S2、S3(0.031 3 mg/mL)及S4、S5(0.156 3 mg/mL)开展PGE2含量的检测,检测结果表明:与空白对照组(BC)相比,NC组的PGE2分泌水平极显著升高(P<0.01),说明本次实验UVB刺激条件有效。与NC组相比,PC组PGE2分泌水平极显著降低(P<0.01),表明本次阳性对照检测有效(表3、图4)。
表3 PGE2检测结果
Table 3 Results of PGE2 content test
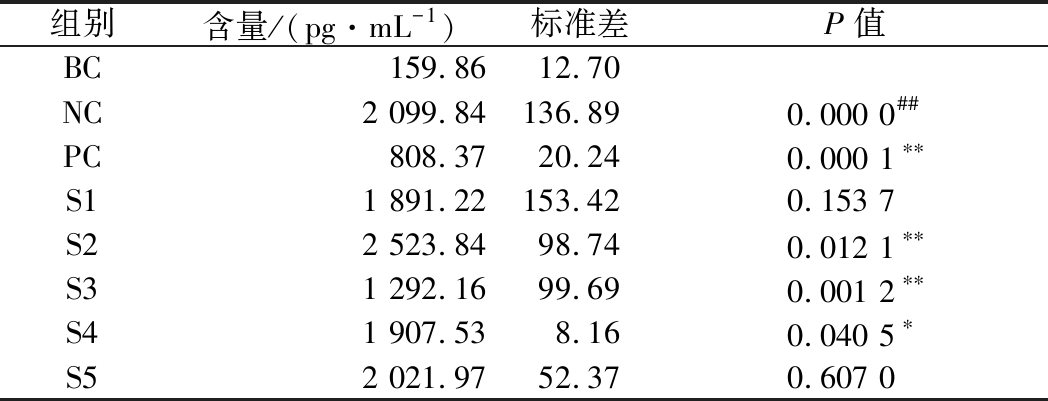
组别含量/(pg·mL-1)标准差P值BC159.8612.70NC2 099.84136.890.000 0##PC808.3720.240.000 1∗∗S11 891.22153.420.153 7S22 523.8498.740.012 1∗∗S31 292.1699.690.001 2∗∗S41 907.538.160.040 5∗S52 021.9752.370.607 0
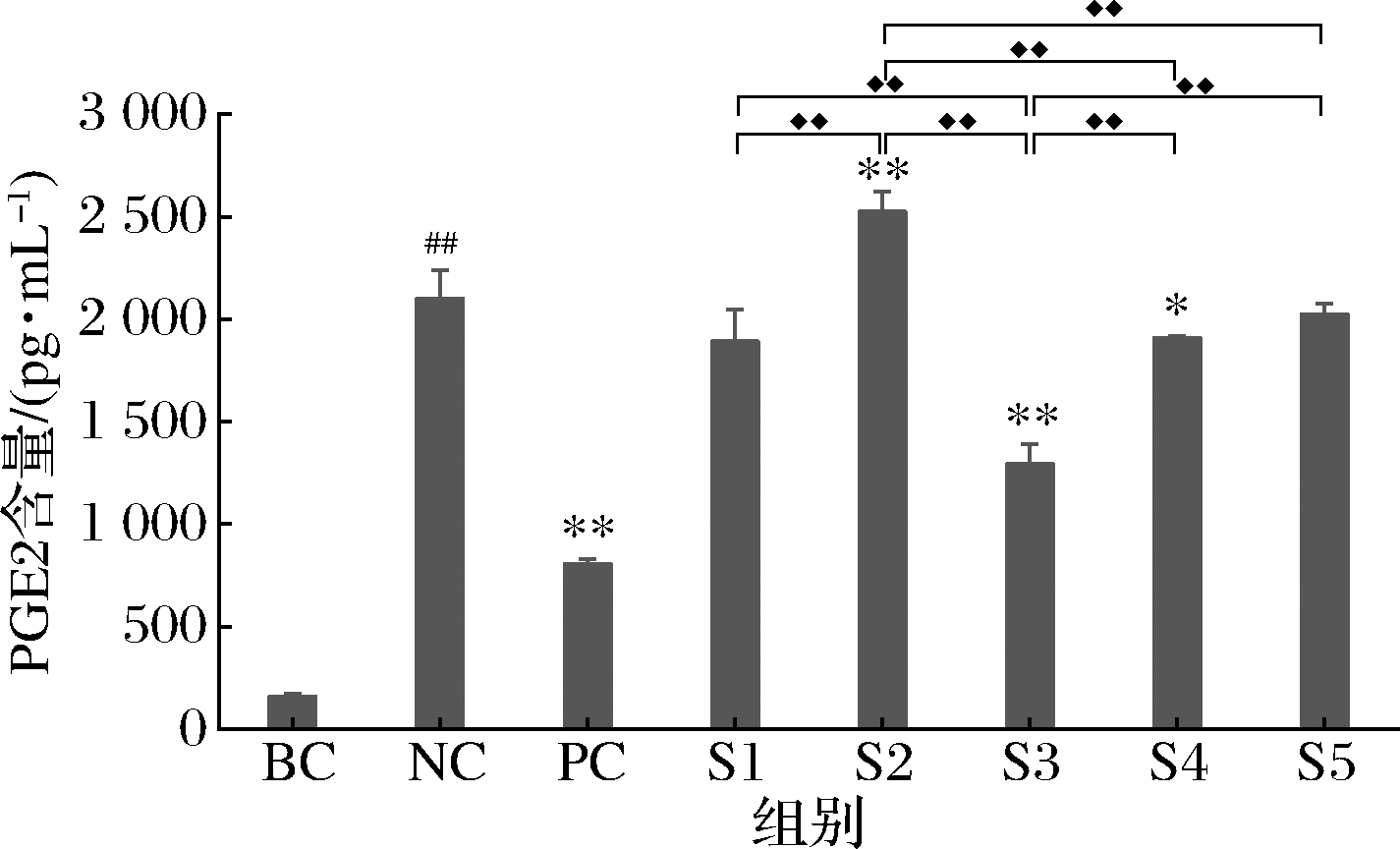
图4 S1~S5对PGE2分泌含量的影响
Fig.4 Effects of S1-S5 on PGE2 secretion
与NC组相比,样品S1在0.031 3 mg/mL时对UVB辐照引起PGE2的分泌没有抑制作用,样品S3在0.031 3 mg/mL、S4在0.156 3 mg/mL时对UVB辐照引起PGE2的分泌有显著抑制作用(P<0.05),且相比于S1,S3在相应浓度对PGE2分泌的抑制作用显著增强(P<0.01)(表3、图4)。
3 结论与讨论
本研究通过液体深层发酵技术对灵芝进行培养,通过添加玉竹、桦树茸、人参及三七药材粉末,发酵制备灵芝、灵芝-玉竹、灵芝-桦树茸、灵芝-人参以及灵芝-三七发酵液冻干粉,利用UVB照射HaCaT细胞产生光损伤模拟皮肤表皮组织中角质形成细胞的光损伤,建立UVB诱导的HaCaT细胞光损伤模型。通过检测样品对HaCaT细胞炎症因子IL-1α及PGE2分泌的抑制作用发现,灵芝-桦树茸发酵液冻干粉在其相应浓度对IL-1α及PGE2的分泌有显著抑制作用(P<0.01),且相较于灵芝发酵液冻干粉,灵芝-桦树茸发酵液冻干粉在相应浓度对PGE2分泌的抑制作用显著增强(P<0.01)。因此添加了桦树茸的灵芝发酵组合具有较强的修复HaCaT细胞UVB光损伤的能力,是最优的发酵组合方式。
综上所述,通过本研究筛选出了抗UVB损伤能力最强的灵芝发酵组合方式——灵芝-桦树茸发酵,这为后续灵芝-桦树茸发酵的进一步研究奠定了基础,也为研究抗UVB光损伤的原料提供了新的思路,为灵芝组合发酵的工业化生产提供了前提和基础。
[1] 罗云, 陈霖, 张雪涟, 等.灵芝三萜类成分药理活性研究进展[J].中国药理学通报, 2021, 37(9):1 185-1 188.
LUO Y, CHEN L, ZHANG X L, et al.Research progress on pharmacological activities of triterpenes from Ganoderma lucidum[J].Chinese Pharmacological Bulletin, 2021, 37(9):1 185-1 188.
[2] LASTOWIECKA-MORAS E, BUGAJSKA J, M YNARCZYK B.Occupational exposure to natural UV radiation and premature skin ageing[J].International Journal of Occupational Safety and Ergonomics, 2014, 20(4):639-645.
YNARCZYK B.Occupational exposure to natural UV radiation and premature skin ageing[J].International Journal of Occupational Safety and Ergonomics, 2014, 20(4):639-645.
[3] WANG P Y, ZHU X L, LIN Z B.Antitumor and immunomodulatory effects of polysaccharides from broken-spore of Ganoderma lucidum[J].Frontiers in Pharmacology, 2012, 3:135.
[4] NGOC T M, PHUONG N T T, KHOI N M, et al.A new naphthoquinone analogue and antiviral constituents from the root of Rhinacanthus nasutus[J].Natural Product Research, 2019, 33(3):360-366.
[5] CÖR D, KNEZ Ž, ![]() M K.Antitumour, antimicrobial, antioxidant and antiacetylcholinesterase effect of Ganoderma lucidum Terpenoids and polysaccharides:A review[J].Molecules (Basel, Switzerland), 2018, 23(3):649.
M K.Antitumour, antimicrobial, antioxidant and antiacetylcholinesterase effect of Ganoderma lucidum Terpenoids and polysaccharides:A review[J].Molecules (Basel, Switzerland), 2018, 23(3):649.
[6] 张周美, 谢纯良, 颜少慰, 等.不同菌株灵芝发酵液抗氧化和美白活性差异比较分析[J].中国食用菌, 2021, 40(8):43-48;56.
ZHANG Z M, XIE C L, YAN S W, et al.Comparative analysis on anti-oxidative and whitening activities of fermentation broth from different Ganoderma lucidum strains[J].Edible Fungi of China, 2021,40(8):43-48;56.
[7] YUEN J W M, MAK D S Y, CHAN E S, et al.Tumor inhibitory effects of intravesical Ganoderma lucidum instillation in the syngeneic orthotopic MB49/C57 bladder cancer mice model[J].Journal of Ethnopharmacology, 2018,223:113-121.
[8] 魏滔, 张长生, 陈琼华, 等.灵芝真菌液体发酵及其产物应用的研究进展[J].微生物学通报, 2022, 49(1):336-351.
WEI T, ZHANG C S, CHEN Q H, et al.Liquid Fermentation of Ganoderma and Application of Its Products[J].Microbiology China, 2022, 49(1):336-351.
[9] 罗钦, 徐军伟.液体发酵灵芝胞外多糖和胞内多糖的单糖组成及抗氧化活性[J].食用菌学报, 2021, 28(6):135-142.
LUO Q, XU J W.Monosaccharide composition and antioxidant activity of extracellular polysaccharides and intracellular polysaccharides in liquid ferment of Ganoderma lucidum[J].Acta Edulis Fungi, 2021, 28(6):135-142.
[10] WU J Y, KAEWNARIN K, NIE X M, et al.Biological activities of a polysaccharide from the coculture of Ganoderma lucidum and Flammulina velutipes mycelia in submerged fermentation[J].Process Biochemistry, 2021, 109:10-18.
[11] 陈默, 赵亚, 孙懿.杜仲预防UVB致人成纤维细胞光老化的作用及基因水平的机制探讨[J].日用化学工业, 2016, 46(1):35-38;57.
CHEN M, ZHAO Y, SUN Y.Action of Eucommia ulmoides extract for prevention of photo-aging damage of human skin fibroblast cells induced by UVB and exploration of its mechanism at genetic level[J].China Surfactant Detergent & Cosmetics, 2016, 46(1):35-38;57.
[12] 赵乐, 武慧敏, 张莉, 等.泥鳅多糖对UVB诱导HaCaT细胞光损伤的保护作用[J].中医学报, 2020, 35(8):1 732-1 736.
ZHAO L, WU H M, ZHANG L, et al.Protective effect of Niqiu (Misgurnus anguillicaudatus) polysaccharides on UVB induced HaCaT cell photodamage[J].Acta Chinese Medicine, 2020,35(8):1 732-1 736.
[13] 刘园园, 赵心明, 杨珍, 等.肉苁蓉多糖对UVB诱导皮肤急性光损伤的保护作用[J].农业与技术, 2021, 41(21):36-39.
LIU Y Y, ZHAO X M, YANG Z, et al.Protective effect of Cistanche deserticola polysaccharide on UVB induced acute skin light injury[J].Agriculture and Technology, 2021, 41(21):36-39.
[14] BALLAK D B, STIENSTRA R, TACK C J, et al.IL-1 family members in the pathogenesis and treatment of metabolic disease:Focus on adipose tissue inflammation and insulin resistance[J].Cytokine, 2015, 75(2):280-290.
[15] CAVALLI G, COLAFRANCESCO S, EMMI G,et al.Interleukin 1α:A comprehensive review on the role of IL-1α in the pathogenesis and treatment of autoimmune and inflammatory diseases[J].Autoimmunity Reviews, 2021, 20(3):102763.
[16] 谭剑, 巫志国, 漆招, 等.腹腔镜下胆囊切除术患者应用帕瑞昔布钠对血清前列腺素E2的影响及术后镇痛效果分析[J].中国当代医药, 2017, 24(21):47-49.
TAN J, WU Z G, QI Z, et al.Effect of postoperative analgesia and influence on PGE2 of parecoxib sodium in patients with laparoscopic cholecystectomy[J].China Modern Medicine, 2017, 24(21):47-49.
[17] 冯予希, 李五生, 蒋青峰, 等.肿痛熏洗液对肛肠手术后疼痛模型大鼠血清一氧化氮、前列腺素E2及白细胞介素-10水平的影响[J].广西医学, 2019, 41(3):344-346.
FENG Y X, LI W S, JIANG Q F, et al.Effects of Zhongtong Xvnxi lotion on serum nitric oxide, prostaglandinE-2 and interleukin-10 levels in anorectal postoperative pain model rats[J].Guangxi Medical Journal, 2019, 41(3):344-346.
[18] LEE H H, MOON Y H, SHIN J S, et al.A novel mPGES-1 inhibitor alleviates inflammatory responses by downregulating PGE2 in experimental models[J].Prostaglandins and Other Lipid Mediators, 2019, 144:106347.
[19] 朱燕, 黄真, 钟晓明.姬松茸不同提取物对UVB致HaCaT细胞光损伤的保护作用研究[J].浙江中医药大学学报, 2017, 41(6):458-463.
ZHU Y, HUANG Z, ZHONG X M.Protective effect of different extraction of Agaricus blazei Murrill on HaCaT cells damaged by UVB[J]. Journal of Zhejiang Chinese Medical University, 2017, 41(6):458-463.
[20] 苏牧楠, 倪芳, 张卫红, 等.纳豆提取物对UVB诱导HaCaT细胞炎症因子表达的影响[J].香料香精化妆品, 2020(5):56-59.
SU M N, NI F, ZHANG W H, et al.Influence of Natto extract on the expression of inflammatory cytokines in HaCaT cells irradiated with UVB[J].Flavour Fragrance Cosmetics, 2020(5):56-59.