近年来,由于疯牛病、口蹄疫等陆生动物传染病以及宗教信仰的影响[1],哺乳动物明胶的使用受到限制。水产明胶因来源广泛,性能与猪皮或牛皮明胶相近,而且营养价值比哺乳动物更丰富,成为替代传统明胶较为理想的选择[2]。鱼明胶中亚氨基酸(脯氨酸和羟脯氨酸)的含量较哺乳动物明胶的低[3],使得鱼明胶的凝胶点和熔化点均比较低,热稳定性较差。这在一定程度上阻碍了鱼明胶的应用发展,因此如何改善鱼明胶的凝胶性及热稳定性已成为研究热点。
2020年我国罗非鱼淡水养殖产量为165.5万t[4],罗非鱼在加工过程中会产生大量的废弃物,既浪费资源又污染环境,若能对鱼皮明胶进行加工再利用,既可实现鱼皮副产物的高值化利用,提高经济效益,又可减少对环境的污染。
据报道,添加多糖可有效提高鱼明胶的凝胶特性和热稳定性,如海藻多糖、κ-卡拉胶、结冷胶等的加入可显著提高鱼皮明胶的凝胶点、熔化点和凝胶强度。SINTHUSAMRAN等[5]发现,琼脂和κ-卡拉胶可有效提高石斑鱼皮明胶的凝胶点和熔化点,添加20%的琼脂和20%的κ-卡拉胶可将其凝胶点和熔化点分别提高至36、43 ℃。MORRISON等[6]认为,高酰基结冷胶经部分脱酰基后形成的网络结构与明胶的类似,其典型特征就是高熔点,非常有利于凝胶的快速形成以及热稳定性的保持。
鱼明胶的流变性质是其加工利用的重要参考指标。鱼明胶溶胶和凝胶具有一定的黏弹性,表现为同时具有储能模量G′和损耗模量G″。加工条件对鱼明胶的流变特性具有一定的影响,通过考查不同条件鱼明胶体系的溶胶-凝胶转变过程的G′和G″的变化情况,可全面反映胶体的流变行为,进而反映出不同加工条件对鱼明胶蛋白分子结构微观变化的影响。
本文旨在探讨不同溶胶温度、溶胶时间,鱼明胶浓度及多糖对罗非鱼皮明胶流变特性、质构特性及微观结构的影响,探索可改善罗非鱼皮明胶凝胶特性和热稳定性的因素及条件,为常温流通鱼明胶产品的开发提供理论依据和技术支持,更好地满足食品加工多样化的需求。
1 材料与方法
1.1 材料与试剂
罗非鱼皮明胶(冻力200,食品级),上海鑫汐生物科技有限公司;刺槐豆胶、低/高酰结冷胶、瓜尔豆胶、果胶、可得然胶、魔芋胶、黄原胶、琼脂(食品级),旺鑫生物科技有限公司;κ-卡拉胶,连云港友进食品添加剂技术开发有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
CT3-10K质构仪,美国博勒飞公司;AR1000型流变仪,美国TA仪器公司;JSM-840电子扫描显微镜,日本JEOL株式会社。
1.3 实验方法
1.3.1 鱼明胶溶胶的制备
用去离子水配制浓度为66.7、100、150、200 g/L(质量浓度)的鱼明胶溶液,室温下溶胀1 h,然后在不同温度(60、70、80、90 ℃)的恒温水浴中溶解不同时间(0.5、2.5、4.5 h),待测。
1.3.2 多糖-鱼明胶复配体系的制备
称取一定量的鱼明胶和不同种类多糖,加入蒸馏水,室温下溶胀1 h,然后在80 ℃恒温水浴中溶解30 min,待测。复配体系中鱼明胶浓度为100 g/L(质量浓度),多糖的浓度为10 g/L(质量浓度)。
1.3.3 流变性质的测定
鱼明胶体系的动态黏弹性通过流变仪进行测定,选用平行板夹具[7],直径40 mm,上下板间距离1 mm,扫描频率1 Hz,应力3.0 Pa,温度扫描程序设定:初始温度65 ℃,以2 ℃/min的速率降温至10 ℃,稳定5 min后以2 ℃/min 的速率升温至65 ℃。储能模量G′与损耗模量G″降温和升温过程第一次相交的点分别为鱼明胶的凝胶点和熔化点。
1.3.4 质构特性的测定
鱼明胶体系的质构特性通过质构仪进行测定[8],测定前样品在4 ℃条件下凝冻16~18 h。测量时选用TPA模式,探头为直径12.7 mm 的TA5圆柱形探头[9],触发点负载为5 g,测试速度为1.0 mm/s,测试距离为5 mm,测试循环次数为2。
1.3.5 扫描电镜(scanning electron microscope,SEM)观察
采用扫描电镜观察微观结构[10]。样品切块后,经戊二醛溶液(体积分数为3%)固定24 h、磷酸盐缓冲液(0.1 mol/L,pH 7.2)漂洗数次、锇酸溶液(体积分数1%)固定 2 h、磷酸盐缓冲液(0.1 mol/L,pH 7.2)漂洗数次后进行梯度脱水(乙醇溶液体积分数依次为30%、50%、70%、90%、100%),然后用醋酸异戊酯脱除乙醇,临界点干燥后,用离子溅射仪喷金。扫描电镜的加速电压为15 kV。
1.3.6 数据处理
采用Microsoft Excel 2013软件对数据进行处理分析。
2 结果与分析
2.1 不同溶胶温度对鱼明胶流变性质的影响
图1显示了不同溶胶温度(60、70、80、90 ℃)对降温过程和升温过程中鱼明胶G′和G″的影响,结果表明,溶胶温度不同,鱼明胶的G′和G″在降温过程和升温过程中呈现相同的变化趋势,即在降温过程中,随着温度的降低,鱼明胶的G′和G″逐渐升高,当温度降低至一定温度时,G′与G″出现交汇点,这说明体系中的弹性成分增加,鱼明胶开始凝胶,随着温度的继续降低,G′始终大于G″;在升温过程中,随着温度的升高,鱼明胶的G′和G″逐渐降低,当温度升高至一定温度时,G′与G″出现交汇点,这说明体系中的黏性成分增加,鱼明胶开始熔化,随着温度的继续升高,G″始终大于G′。
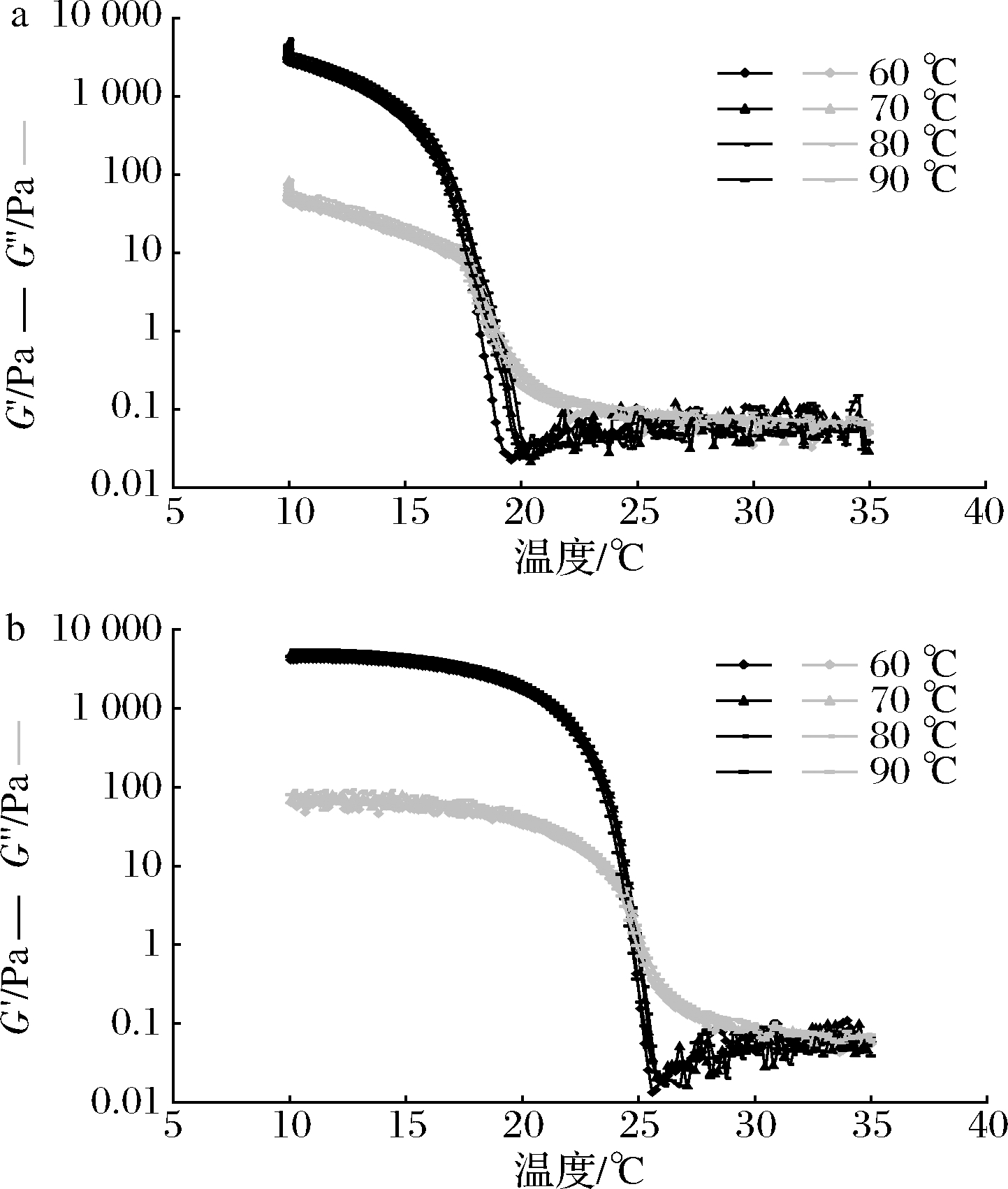
a-降温过程;b-升温过程
图1 不同溶胶温度对降温过程和升温过程中
鱼明胶G′和G″的影响
Fig.1 Effects of different dissolving temperature on the G′ and G″ of fish gelatin during cooling and heating process
以上结果表明,罗非鱼皮明胶为热可逆凝胶,不同的溶胶温度对鱼明胶的溶胶和凝胶过程影响不显著。鱼明胶的溶胶和凝胶过程就是α链由单链重构成螺旋结构或由螺旋结构解旋成单链的一个可逆过程[11]。在鱼明胶产品的加工过程中,可根据实际需要及经济性选取合适的溶胶温度。
温度扫描测试中,通常以G′和G″的交汇点作为动态黏弹性分析中凝胶或溶胶的转折点[12],CHO等[13]利用温度扫描测定了明胶的凝胶点和熔化点。因此,图1中降温过程G′和G″的交点为凝胶点,升温过程G′和G″的交点为熔化点。溶胶温度对罗非鱼皮明胶凝胶点和熔化点的影响如图2所示,罗非鱼皮明胶的凝胶点为19 ℃左右,熔化点为25 ℃左右,凝胶点和熔化点受溶胶温度的影响不显著。研究表明鱼明胶凝胶点和熔化点的大小与其形成凝胶的α链的含量有关[14],亦与其中亚氨基酸的含量呈正相关[15],亚氨基酸含量高的明胶具有较高的热转变温度和凝胶性能[16],由于哺乳动物中的亚氨基酸含量通常为24%,而对大多数鱼类而言仅为16%~18%[17],因此,罗非鱼皮明胶的凝胶点和熔化点较哺乳动物的低,较低的亚氨基酸含量降低了分子间螺旋形成的可能性[18]。
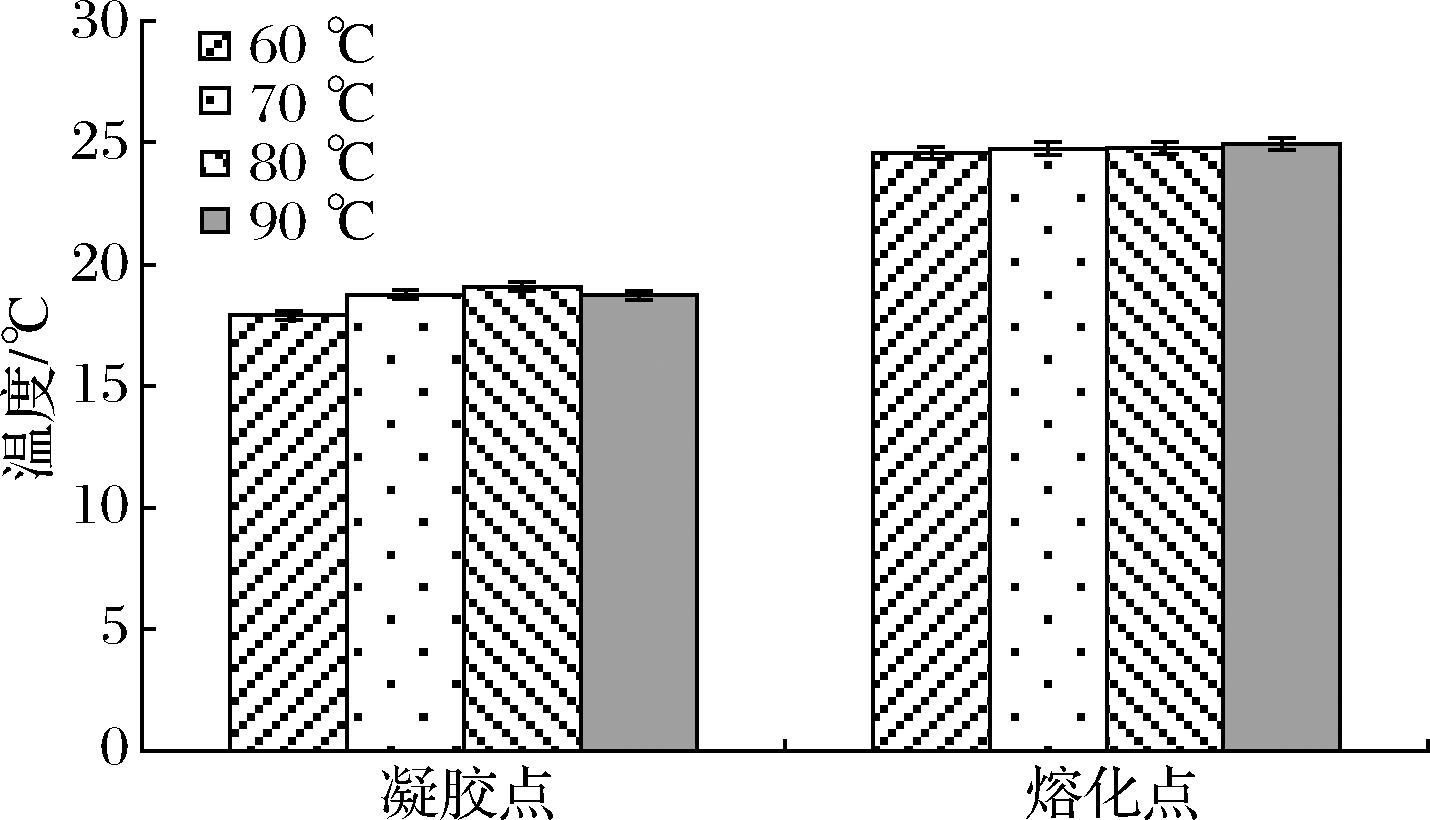
图2 不同溶胶温度对鱼明胶凝胶点和熔化点的影响
Fig.2 Effects of different dissolving temperatures on the gel point and melting point of fish gelatin
以上结果表明,罗非鱼皮明胶凝胶在4~10月份室温下不易保存,仅适用于低温保藏食品,这在一定程度上限制了鱼明胶的应用;熔化温度和凝胶温度之间有一段温度差,可用于某些特定食物的研究,例如果冻和蛋奶冻等;溶胶温度对罗非鱼皮明胶凝胶点和熔化点的影响不大,因而食品加工过程中可不作为主要影响因素考虑。
2.2 不同溶胶时间对鱼明胶流变性质的影响
图3显示了不同溶胶时间(0.5、2.5、4.5 h)对降温过程和升温过程中鱼明胶G′和G″的影响,结果表明,溶胶时间不同,鱼明胶的G′和G″在降温过程和升温过程中呈现相同的变化趋势,即溶胶时间对罗非鱼皮明胶的溶胶和凝胶过程影响不大。
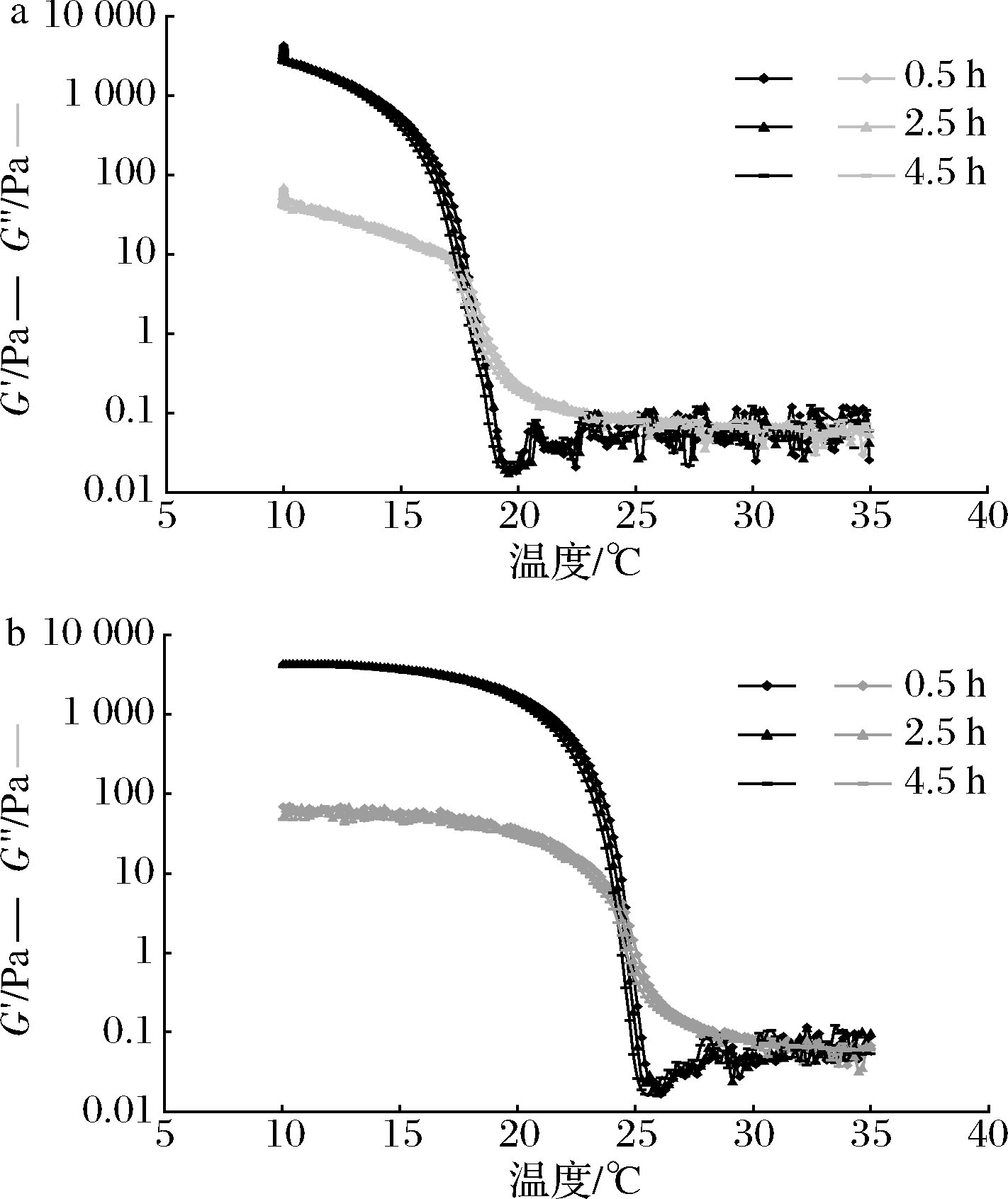
a-降温过程;b-升温过程
图3 不同溶胶时间对降温过程和升温过程中鱼明胶G′和G″的影响
Fig.3 Effects of different dissolving time on the G′ and G″ of fish gelatin during cooling and heating process
溶胶时间对罗非鱼皮明胶凝胶点和熔化点的影响如图4所示。凝胶点和熔化点随溶胶时间的不同变化不显著,即溶胶时间对罗非鱼皮明胶凝胶点和熔化点的影响不大,因而食品加工过程中可根据生产需求选取溶胶时间。
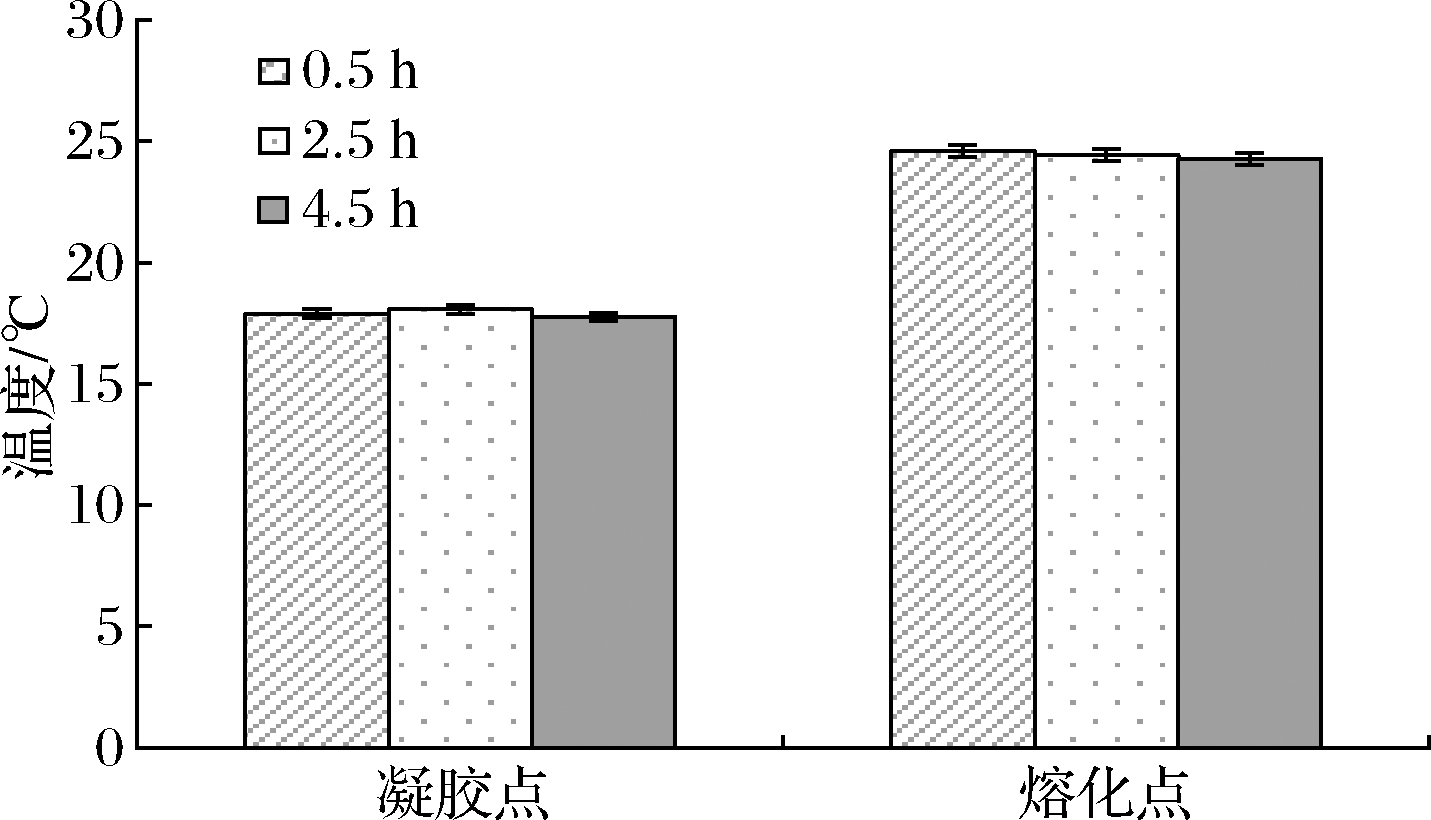
图4 不同溶胶时间对鱼明胶凝胶点和熔化点的影响
Fig.4 Effects of different dissolving time on the gel point and melting point of fish gelatin
2.3 不同鱼明胶浓度对鱼明胶流变性质的影响
图5显示了不同的鱼明胶浓度(66.7、100、150、200 g/L)对降温过程和升温过程中鱼明胶G′和G″的影响,结果表明,不同浓度鱼明胶的G′和G″在降温过程和升温过程中变化趋势基本相同。在同一温度条件下,随着鱼明胶浓度的增加,无论是降温过程还是升温过程,G′和G″均呈现增大的趋势。如在10 ℃条件下,不同浓度的明胶均形成稳定的凝胶,明胶浓度越大,G′值越大,鱼明胶凝胶的凝冻强度就越大,这是因为明胶溶液浓度越大,整个体系形成多聚肽链的三维网状体的能力越强,凝胶网络结构更加致密[19],使破坏凝胶体系所需应力更大,从而使得凝冻强度更大。
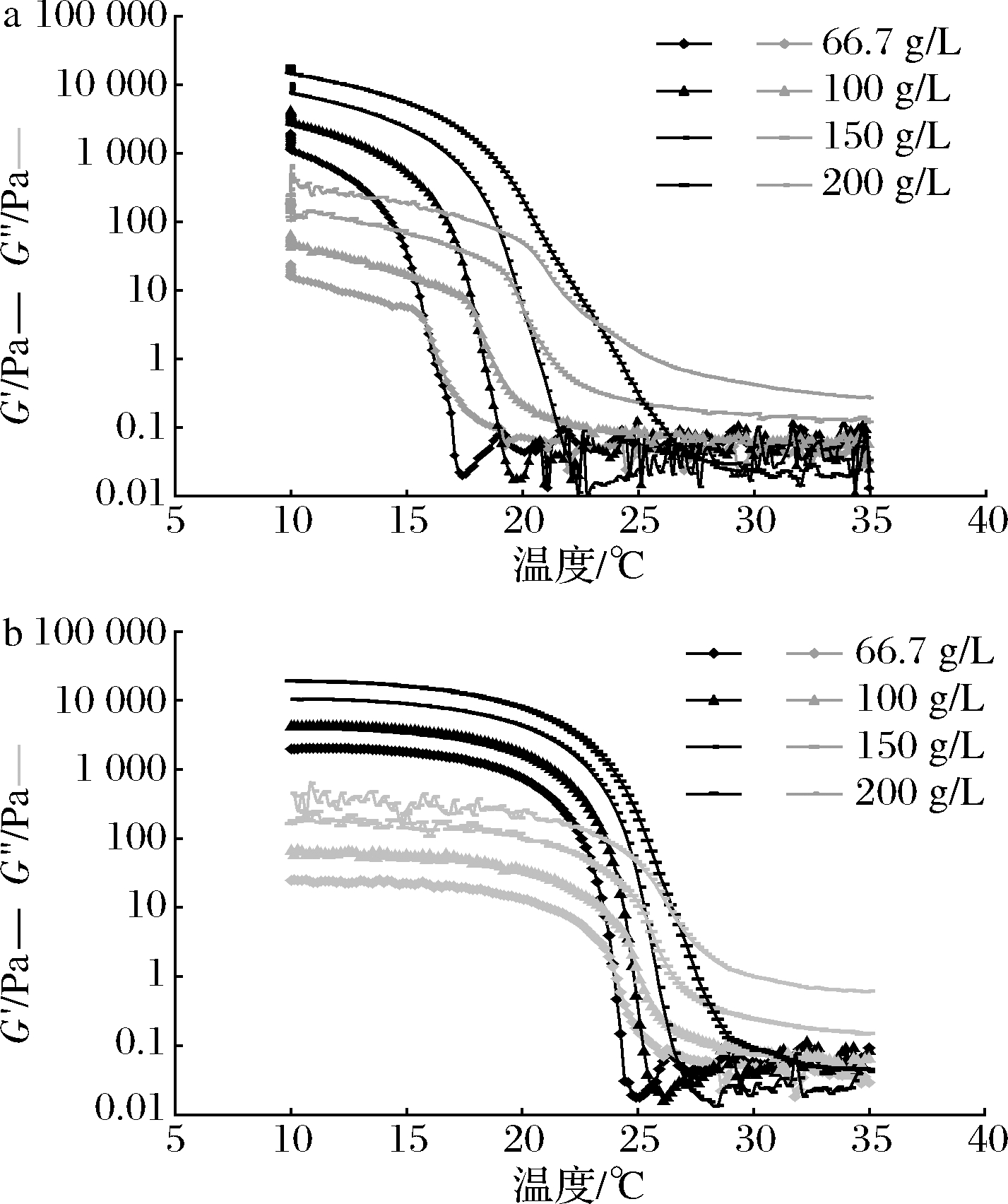
a-降温过程;b-升温过程
图5 不同鱼明胶浓度对降温过程和升温过程中鱼明胶G′和G″的影响
Fig.5 Effects of different fish gelatin concentration on the G′ and G″ of fish gelatin during cooling and heating process
鱼明胶浓度对罗非鱼皮明胶凝胶点和熔化点的影响如图6所示,鱼明胶的凝胶点和熔化点均随其浓度的增大而升高,故而增大鱼明胶浓度可有效提高其凝胶点和熔化点,这是由于分子的碰撞与缠结使得高分子溶液流变学特性发生改变,通常随着溶液中高分子浓度的增加而增加[20]。因此在食品加工过程中,在不影响产品风味口感的前提下,适当增加鱼明胶浓度可以达到更高的熔化点(仍低于人口腔的温度),既可保持鱼明胶入口即化的特性,又可提高鱼明胶产品的热稳定性。然而,增加鱼明胶浓度对其熔化点的提高具有一定的限制,仍低于30 ℃,不利于常温流通鱼明胶产品的开发,另外,鱼明胶浓度过高会导致体系的流动性降低,不利于操作工艺的进行。
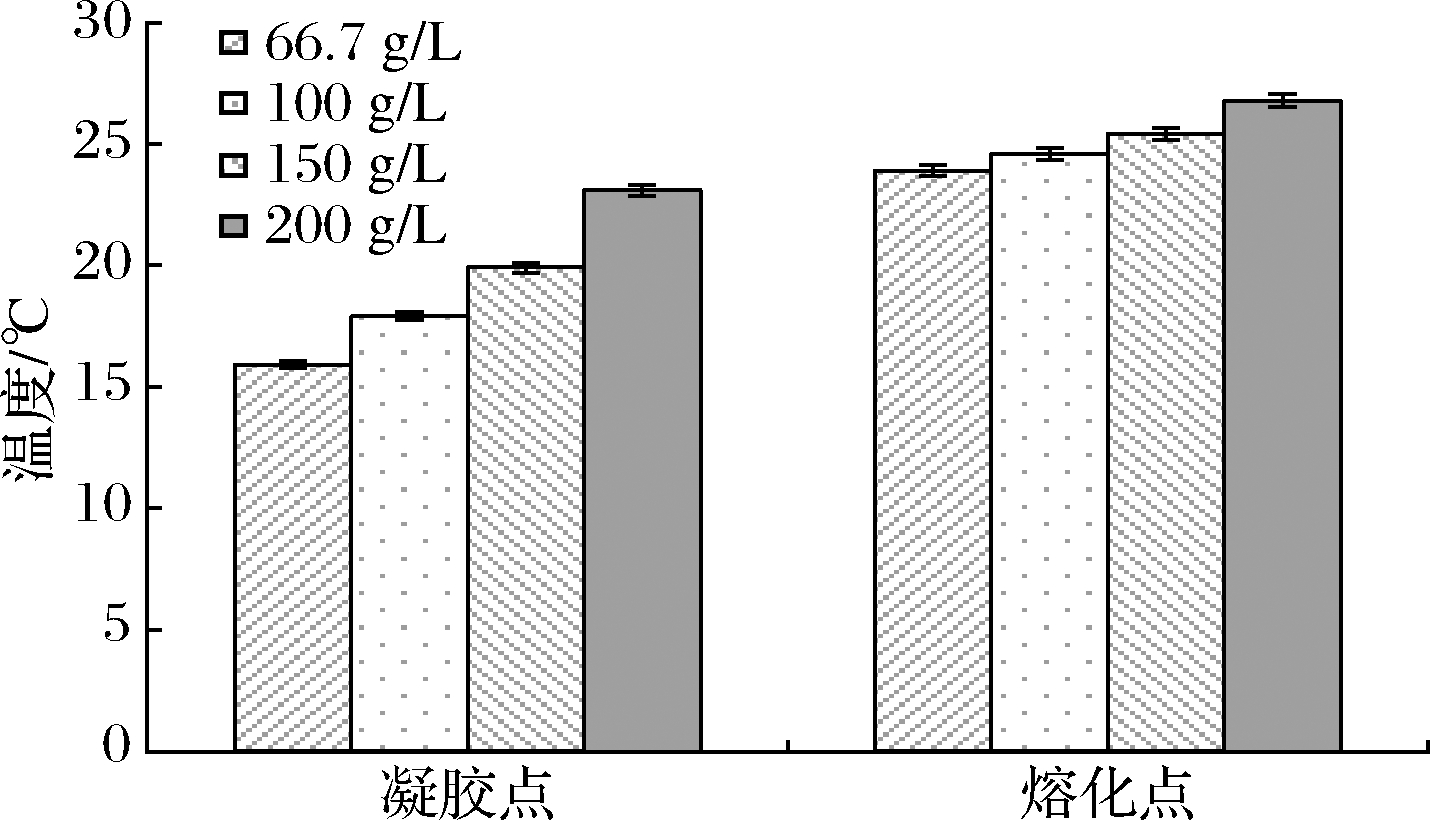
图6 不同鱼明胶浓度对鱼明胶凝胶点和熔化点的影响
Fig.6 Effects of different fish gelatin concentration on the gel point and melting point of fish gelatin
2.4 添加不同多糖对鱼明胶复配体系流变性质的影响
图7显示了添加不同种类多糖对鱼明胶复配体系G′和G″的影响。添加1%黄原胶的复配体系黏性大,无法搅拌均匀,溶胶中含有大量气泡,无法测定其流变特性。由图7可知,添加刺槐豆胶、瓜尔豆胶、果胶、魔芋胶及琼脂对复配体系的G′和G″影响不显著,而添加结冷胶、卡拉胶和可得然胶可有效提高复配体系的G′和G″,如在10 ℃ 条件下结冷胶和卡拉胶对G′和G″的提高效果最显著,可得然胶次之。通常认为G′、G″的增加对应着复配体系内部新结构的形成,可以认为随着G′、G″的上升,体系内部由无序的卷曲逐渐转变为有序的铰链,所以G′、G″会增大[21]。多糖与罗非鱼皮明胶蛋白质可形成大量的氢键,使复配体系的溶胶-凝胶过程发生改变,即黏性和弹性均得到了很大提高。多糖赋予了复配体系较好的黏弹性,复配体系的网络结构更加致密,也就是说复配体系的孔隙越小,凝胶强度越大,即储能模量越大。结冷胶、卡拉胶和可得然胶的加入,使得复配体系形成的有序的三维网络结构更致密,从而使体系中水分子的流动受阻,所以复配体系表现出较好的固体特征,即弹性增强。前期研究结果表明,1%的高酰结冷胶、卡拉胶、可得然胶随着扫描温度的降低可形成凝胶,而1%的低酰结冷胶在扫描温度降低到10 ℃时仍呈现溶液的状态。因此,多糖-明胶复配体系的相互作用机制仍有待于进一步研究。
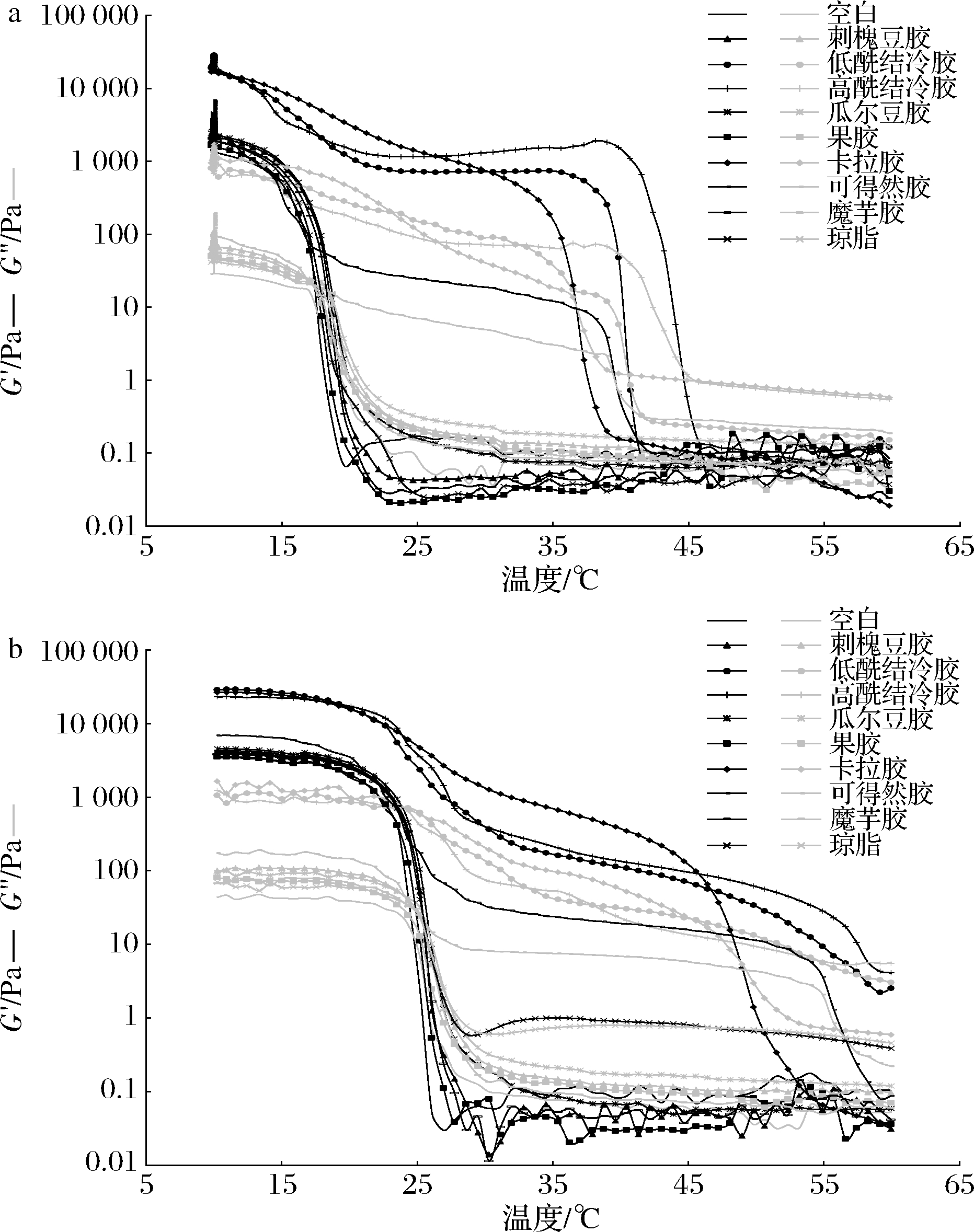
a-降温过程;b-升温过程
图7 添加不同多糖对降温过程和升温过程中鱼明胶复配体系G′和G″的影响
Fig.7 Effects of different polysaccharide on the G′ and G″ of fish gelatin complex system during cooling and heating process
图8显示了添加不同种类多糖对鱼明胶复配体系凝胶点和熔化点的影响。结果表明,添加刺槐豆胶、瓜尔豆胶、果胶、魔芋胶及琼脂对明胶体系的凝胶点和熔化点影响不显著,而添加结冷胶、卡拉胶和可得然胶可显著提高明胶体系的凝胶点和熔化点。复配体系内形成三维网状结构的交联点增多,从而使得体系内结构更致密,所以凝胶强度增加,进而熔化点升高。结冷胶、卡拉胶和可得然胶与鱼明胶形成的复配体系熔化点均在45 ℃以上,因而适合常温鱼明胶产品的开发,另外,实验发现添加了结冷胶和卡拉胶的复配体系均呈现均一透明的状态,而添加可得然胶的复配体系呈现均一不透明的状态,因此在实际生产中可根据不同的保存条件选择加入不同的多糖来满足需要。
2.5 添加不同多糖对鱼明胶TPA质构特性的影响
TPA质构通过模拟人口腔对食品的咀嚼过程对食品质构进行感官评价,对样品进行2次压缩测试[22],获得质构特性参数。由图7和图8可知,添加刺槐豆胶、瓜尔豆胶、果胶、魔芋胶、琼脂,对鱼明胶复配体系G′、G″的影响不大,添加可得然胶的复配体系呈现均一不透明的状态,使用受限,因此在质构实验中,仅测定低酰结冷胶、高酰结冷胶和卡拉胶3种多糖对鱼明胶复配体系TPA质构特性的影响。
图9显示了3种多糖(低/高酰结冷胶、卡拉胶)对鱼明胶复配体系的质构特性的影响。结果表明,3种多糖对鱼明胶体系的硬度和咀嚼性均具有显著提高作用,对其弹性和内聚性的影响均不显著。多糖对罗非鱼皮明胶TPA质构的影响主要是因为多糖与鱼皮明胶分子间的交联作用。加入多糖后与水分子结合形成紧密的网状结构的能力越强,硬度增大,咀嚼性增强,而弹性和内聚性与交联作用及网状结构使凝胶体系自行恢复的能力有关,变化不显著。
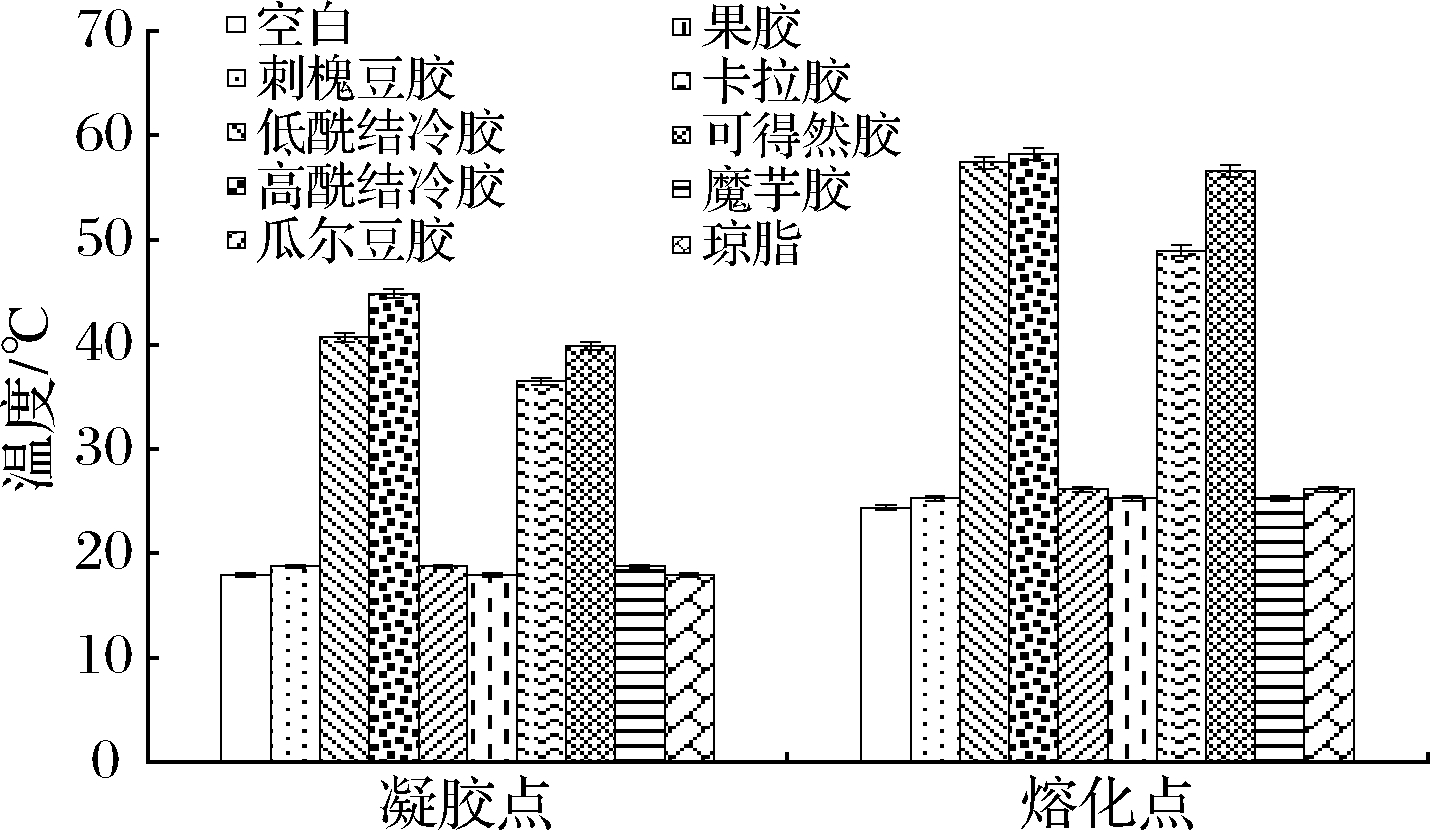
图8 添加不同多糖对鱼明胶复配体系凝胶点和熔化点的影响
Fig.8 Effects of different polysaccharide on the gel point and melting point of fish gelatin complex system

a-硬度;b-弹性;c-内聚性;d-咀嚼型
图9多糖对鱼明胶复配体系硬度、弹性、内聚性和咀嚼性的影响
Fig.9 Effects of different polysaccharide on the hardness, springiness, cohesiveness, and chewiness of fish gelatin complex system
2.6 添加不同多糖对鱼明胶微观结构的影响
明胶是胶原蛋白部分水解的产物,是多肽链的混合物。明胶的凝胶过程被认为是由无序的明胶单链线性分子部分折叠恢复有序的胶原自然结构的过程。图10显示了多糖对鱼明胶微观结构的影响结果。由图10-a可知,随着温度的降低,多肽链形成椭圆形或圆形的球状聚集体。球形聚集体通过氢键恢复部分三螺旋交联点,形成空间网络结构。由图10-b~图10-d可知,低/高酰结冷胶、卡拉胶分子均可与水分子结合形成紧密的网络结构,形成连续的相,明胶多肽链形成的球状聚集体均匀分布其中。LAU等[23]认为在结冷胶明胶复配体系中,明胶分子形成不连续的网络结构,分布在结冷胶分子形成的连续相中,使复配体系凝胶特性提高。多糖的加入改变了凝胶网络结构的形成机制,故对其流变特性和质构特性产生了显著的影响。

a-空白;b-低酰结冷胶;c-高酰结冷胶;d-卡拉胶
图10 添加不同多糖对鱼明胶复配体系微观结构的影响
(SEM,×10 000) Fig.10 Effects of different polysaccharide on the microstructure of fish gelatin complex system (SEM, ×10 000)
3 结论
溶胶温度和溶胶时间对罗非鱼皮明胶流变特性的影响不显著,生产过程中可根据实际需要及经济性综合考虑选取合适的溶胶温度和时间。提高鱼明胶浓度可显著提高鱼明胶体系的凝胶点和熔化点,但二者仍低于30 ℃,不利于常温流通产品的开发。低酰结冷胶、高酰结冷胶和卡拉胶改变了罗非鱼皮明胶复配体系的凝胶形成机制,从而对其流变特性和质构特性产生了显著性的影响,3种多糖均可将复配体系的熔化点提高至45 ℃以上,使得以鱼明胶为主要原料的产品,如鱼明胶冻、明胶软糖等,可以在常温条件下流通及贮存,即使夏季也不会因为温度太高而发生产品熔化的情况,另外,3种多糖的成本均低于鱼明胶且用量很少,综合考虑,在鱼明胶溶胶之前,将其与适量多糖复配,操作工艺简单,而且可以显著改善鱼明胶的热稳定性,降低流通及贮存成本,因此可为常温流通鱼明胶产品的开发提供理论依据和技术支持。
[1] ZHANG T, SUN R, DING M Z, et al.Effect of extraction methods on the structural characteristics, functional properties, and emulsion stabilization ability of Tilapia skin gelatins[J].Food Chemistry, 2020, 328:127114.
[2] NITSUWAT S, ZHANG P Z, NG K, et al.Fish gelatin as an alternative to mammalian gelatin for food industry:A meta-analysis[J].LWT - Food Science and Technology, 2021, 141:110899.
[3] IAKUBOVA O S, BEKESHEVA A A, ALEKSANIAN I I, et al.Thermal structuring of fish gelatin[J].IOP Conference Series:Earth and Environmental Science, 2021, 640(3):032011.
[4] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴[M].北京:中国农业出版社, 2021.
Ministry of Agriculture and Rural Affairs of the People′s Republic of China, Fisheries and Fisheries Administration, Nation Fishes Technology Extension Center, China Society of Fisheries.China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press, 2021.
[5] SINTHUSAMRAN S, BENJAKUL S, HEMAR Y.Physical and sensory properties of gelatin from seabass (Lates calcarifer) as affected by agar and κ-carrageenan[J].Journal of Texture Studies, 2018, 49(1):47-55.
[6] MORRISON N A, CLARK R C, CHEN Y L, et al.Progress in Colloid and Polymer Science[M]. Berlin, Heidelberg: Springer Berlin Heidelberg, 1999:127-131.
[7] 孙哲浩. 明胶与卡拉胶共凝胶体的热力学特性及微观结构的研究[J].现代食品科技, 2008, 24(7):649-651;663.
SUN Z H.Thermodynamic properties and microstructure of gelatin-carrageenan co-gels[J].Modern Food Science and Technology, 2008, 24(7):649-651;663.
[8] SOW L C, TOH N Z Y, WONG C W, et al.Combination of sodium alginate with tilapia fish gelatin for improved texture properties and nanostructure modification[J].Food Hydrocolloids, 2019, 94:459-467.
[9] 黄华双. 罗非鱼鱼鳞明胶改性及其应用研究[D].湛江:广东海洋大学, 2012.
HUANG H S.Study on modification and application of gelatin from scales of tilapia (Oreochromis spp.) scales[D].Zhanjiang:Guangdong Ocean University, 2012.
[10] 陈海华, 薛长湖.淀粉对竹荚鱼鱼糜流变性质和凝胶特性的影响[J].农业工程学报, 2009, 25(5):293-298.
CHEN H H, XUE C H.Effects of starch on rheological and gel properties of horse-mackerel surimi[J].Transactions of the Chinese Society of Agricultural Engineering, 2009, 25(5):293-298.
[11] 高玲玲, 侯成立, 高远, 等.胶原蛋白热稳定性研究进展[J].中国食品学报, 2018, 18(5):195-207.
GAO L L, HOU C L, GAO Y, et al.Research advances of thermal stability of collagen[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(5):195-207.
[12] 韩霜, 马良, 杨晖, 等.大目金枪鱼皮明胶的理化性质及结构分析[J].食品科学, 2018, 39(10):40-45.
HAN S, MA L, YANG H, et al.Physicochemical properties and structural analysis of bigeye tuna skin gelatin[J].Food Science, 2018, 39(10):40-45.
[13] CHO S H, JAHNCKE M L, CHIN K B, et al.The effect of processing conditions on the properties of gelatin from skate (Raja Kenojei) skins[J].Food Hydrocolloids, 2006, 20(6):810-816.
[14] 彭帅. 罗非鱼皮明胶的流变、质构及其成膜性[D].上海:上海海洋大学, 2015.
PENG S.Rheological, textural and film-forming properties of tilapia skin gelatin[D].Shanghai:Shanghai Ocean University, 2015.
[15] DERKACH S R, KOLOTOVA D S, VORON′KO N G, et al.Rheological properties of fish gelatin modified with sodium alginate[J].Polymers, 2021, 13(5):743.
[16] JAMILAH B, HARVINDER K G.Properties of gelatins from skins of fish-black tilapia (Oreochromis mossambicus) and red tilapia (Oreochromis nilotica)[J].Food Chemistry, 2002, 77(1):81-84.
[17] LYU L C, HUANG Q Y, DING W, et al.Fish gelatin:The novel potential applications[J].Journal of Functional Foods, 2019, 63:103581.
[18] DERKACH S R, VORON'KO N G, KUCHINA Y A, et al.Modified fish gelatin as an alternative to mammalian gelatin in modern food technologies[J].Polymers, 2020, 12(12):3 051.
[19] 王锴. 结冷胶以及结冷胶/明胶共混凝胶特性的研究及其在水晶肴肉中的应用[D].南京:南京农业大学, 2012.
WANG K.Gel properties of gellan and gellan/gelatin mixed gels and application of gellan/gelatin mixed gels on jellied meat[D].Nanjing:Nanjing Agricultural University, 2012.
[20] 纪执立. 明胶/羟丙基甲基纤维素共混体系相容性与相行为的研究[D].广州:华南理工大学, 2020.
JI Z L.Study on the compability and phase behavior of gelatin/hydroxypropyl methycellulose complex system[D].Guangzhou:South China University of Technology, 2020.
[21] 洪伦波. 结冷胶流变行为与凝胶特性的研究[D].杭州:浙江工商大学, 2007.
HONG L B.Studies on the rheological behavior and gelation properties of gellan gum[D].Hangzhou:Zhejiang Gongshang University, 2007.
[22] 黄丽燕, 张强, 刘文营, 等.不同热处理方式对卤蛋蛋白的质构影响[J].食品工业, 2012, 33(9):75-78.
HUANG L Y, ZHANG Q, LIU W Y, et al.Effect of different heat treatments on texture of stewed egg white[J].The Food Industry, 2012, 33(9):75-78.
[23] LAU M H, TANG J, PAULSON A T.Texture profile and turbidity of gellan/gelatin mixed gels[J].Food Research International, 2000, 33(8):665-671.