小麦是世界上最主要的粮食作物之一,富含淀粉、蛋白质、脂肪和其他营养物质。小麦醇溶蛋白(gliadin,G)通常被认为是富含脯氨酸的蛋白质,表面含有疏水和亲水结构域[1]。先前的研究结果表明,醇溶蛋白可以通过超声自组装和反溶剂沉淀转化为球形胶体纳米粒子[2]。在食品工业中,麦醇溶蛋白纳米粒子已被开发用于微量营养素传递体系,该体系易受环境变化的影响(如温度[2],溶剂[2]等)。这些变化可能导致在加工和贮存过程中递送的生物活性化合物的降解。多酚可以通过非共价相互作用(疏水效应和氢键)与蛋白质相互作用,这可能导致蛋白质的热稳定性、溶解度和消化率的变化[3]。目前,大多数研究聚焦于水溶性蛋白质与酚类化合物之间的相互作用,如牛血清白蛋白和氰基-3-葡萄糖苷[4],关于黄酮类化合物与醇溶性蛋白质之间的相互作用研究较少。芦丁(rutin,R)是植物和多酚类化合物的次生代谢产物,被认为是由槲皮素和二糖芦丁糖(鼠李糖和葡萄糖)组成的糖苷。芦丁在荞麦中含量丰富,其结构与槲皮素相似,因此对蛋白质具有很强的亲和力[5]。研究表明高浓度芦丁可防止肌原纤维蛋白侧链基团的氧化[6]。蛋白质的结构和功能性质在提取、制备、加工和贮存过程中对涉及到的环境条件敏感,可能引起蛋白质的展开,聚集和变性。
动态高压微流化(dynamic high-pressure microfluidization, DHPM)作为最先进的均质化技术之一,有连续操作条件下高速冲击、高频振动、空化和剪切的联合处理机制。目前,DHPM已应用于医药、化妆品工业和牛奶加工,赋予其较长的保质期[7]。已有研究表明DHPM处理大豆蛋白后,增加了大豆蛋白中某些亚基(α′-7S、A-11S和B-11S)对胰酶水解的可及性,蛋白质溶解度、表面疏水性和分子质量分布发生变化,乳化性能提高[8]。
在现有的光谱方法中,傅里叶红外变换光谱和拉曼光谱都可以确定蛋白质二级结构的变化(酰胺Ⅰ和Ⅲ条带的分析)。但拉曼光谱也提供了肽骨架、二硫键的几何形状,以及某些侧链的环境,如酪氨酸、色氨酸和蛋氨酸。拉曼光谱学是一种新兴且强大的光学技术,它已被广泛用于识别分子结构以及蛋白质的定性和定量分析[9]。拉曼带的变化通常与酰胺构象区域的改变和C—C拉伸振动有关。事实上,在DHPM过程中形成的蛋白网络的稳定性可归因于非共价或疏水键,以及分子间和分子内的二硫化物键。
因此,本文采用反溶剂法制备了麦醇溶蛋白-芦丁(gliadin-rutin,G-R)复合物,以麦醇溶蛋白为对照,旨在探讨DHPM对G-R复合物二级结构的影响。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白,美国Sigma公司;芦丁,北京索莱宝科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2450紫外可见分光光度计,日本岛津公司;LGJ-10真空冷冻干燥机,北京松原华兴科技有限公司;M-110EH-30超微流动态高压纳米分散机,加拿大Microfluidics公司;MiLLi-Qbiocel超纯水机,美国密理博公司;DXR2激光拉曼光谱仪,美国Thermo Fisher公司;85-2A数显恒温磁力搅拌器,金坛市科析仪器有限公司。
1.3 实验方法
1.3.1 复合物的制备
采用反溶剂法制备G-R分散液,参考FILIPPIDI等[10]的方法略作修改。在磁力搅拌下将0.1 g麦醇溶蛋白和0.01 g芦丁分别溶解于50 mL 10 mmol/L乙酸溶液和50 mL 60%(体积分数)乙醇水溶液中,在4 ℃下贮存过夜以完全水合然后等体积混匀。水相体积:醇相体积比为3∶1。将100 mL G-R溶液逐滴滴入300 mL水溶液中,边滴边均质(10 000 r/min, 4 min)。均质完成后,所得溶液在0、40、80、120、160 MPa下均质2次。经上述步骤后的样液一部分留样用作部分指标测定,另一部分于45 ℃水浴下旋蒸后冻干进行固体样测定。在没有芦丁添加的情况下相同条件制备麦醇溶蛋白溶液。
1.3.2 游离巯基含量变化测定
参照WU等[11]的研究方法做适当修改。在1 mL蛋白质溶液中加入4 mL Tris-Gly缓冲液。之后,加入0.05 mL Ellman试剂,Ellman试剂配制方法为:将溶于水中的2 mmol/L 5,5′-二硫代双(2-硝基苯甲酸)(5,5′-dithiobis-2-nitrobenzoic acid, DTNB)和50 mmol/L乙酸钠混合。最后将混合溶液在室温下孵育20 min,然后在412 nm处测量吸光度。游离巯基(sulfhydryl,SH)含量计算如公式(1)所示:
(1)
式中:A代表吸光度;D代表稀释倍数;C代表样品浓度,mg/mL。
1.3.3 拉曼光谱测定
将冻干后的样品置于玻璃载玻片上,用激光拉曼显微镜在785 nm的激发波长下进行实验。实验参数为:显微镜物镜为20倍,光斑尺寸为1 μm,狭缝宽度为50 μm,激光能量为15 mW,背景曝光时间为4.2 s,曝光次数为38,背景曝光次数为512,光栅400刻度/nm,扫描范围为500~4 000 cm-1。使用OMNIC 8.2(Thermo Fisher Scientific Inc., Waltham, MA, USA)软件进行光谱基线校正,平滑和原始数据归一化处理[以苯丙氨酸(1 003 cm-1)为内标进行归一化处理]。分析二级结构变化、二硫键的构象(500~550 cm-1)以及酪氨酸(I850/830)和色氨酸(I760)的环境。
1.4 数据统计及分析
每组数据3次重复,利用Origin 9.0软件处理数据与作图。使用SPSS 19.0软件对数据进行ANOVA差异显著性分析与t检验。
2 结果与分析
2.1 游离巯基含量
巯基含量的变化是蛋白质去折叠和S—S键形成的标志,也与蛋白质的三级和四级结构的改变有关[12]。本研究测定的巯基含量[(22.69±0.55) μmol/g]比王启明[13]的研究结果[(13.24±0.00) μmol/g]相似,这些数据的差异可以归因于不同的蛋白质来源与研究方法的差异。如图1所示,随着处理压力的增加,活性巯基含量显著增加,这可能是由于在高压处理过程中蛋白质分子的去折叠,QIN等[14]也报道了类似的结果。高压处理引发了内部疏水基团和巯基的暴露,增强了表面疏水性和二硫键的形成,因此这些蛋白质很有可能被吸附到油滴表面。这些相互作用可能提供一种高黏弹性薄膜,以抵抗聚结,从而提高空间稳定性,防止油滴的絮凝和聚结。各微射流处理组可能被芦丁作为抗氧化剂保护,因此其游离巯基含量增加。以上结果表明微射流对麦醇溶蛋白中游离巯基的作用受微射流压力的影响。
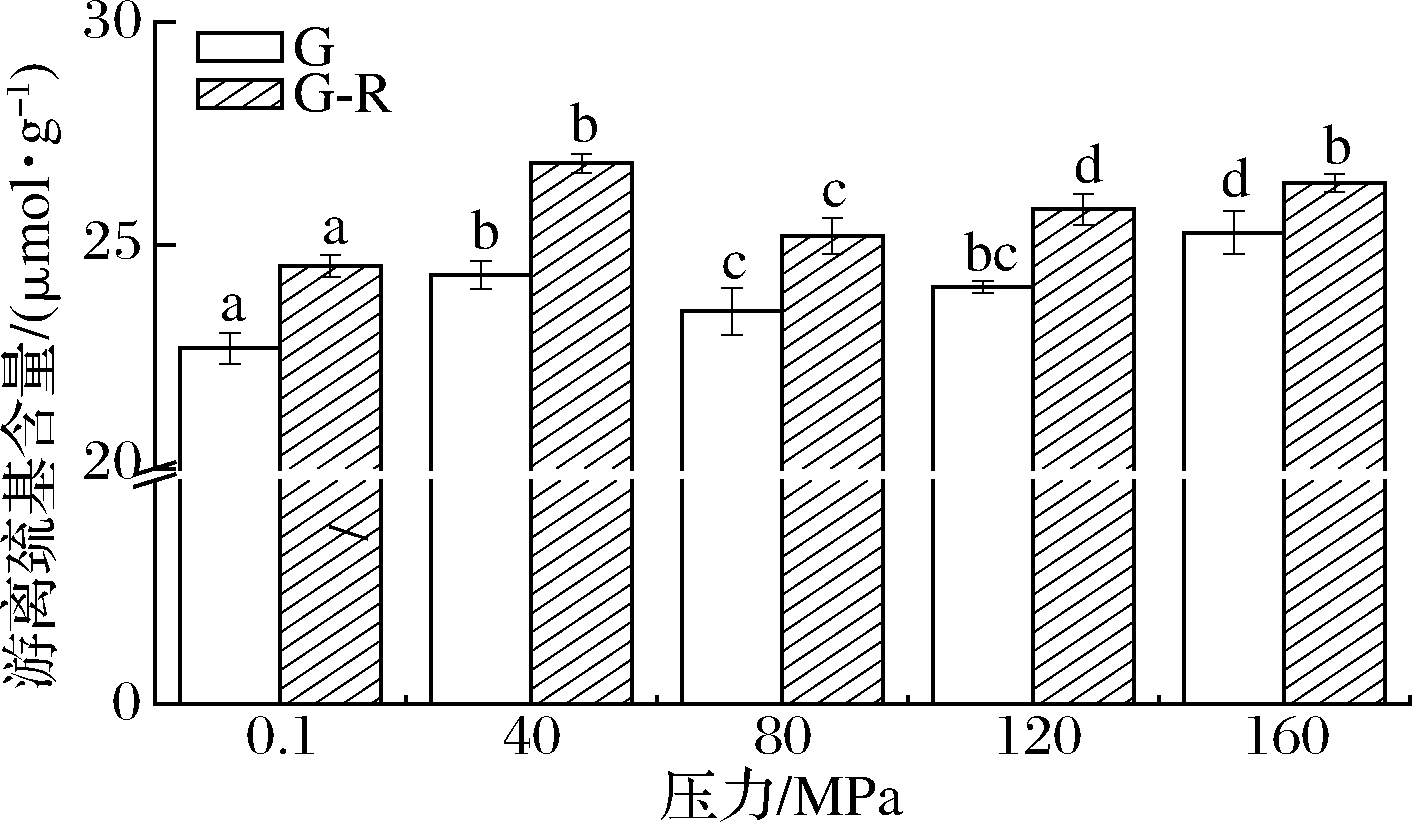
图1 微射流处理后麦醇溶蛋白与芦丁复合物的游离巯基含量
Fig.1 Free sulfhydryl content of the complex of gliadin and rutin after DHPM treatment
注:图中不同小写字母表示显著性差异(P<0.05,n=3)
2.2 氨基酸微环境分析
图2为400~1 700 cm-1的拉曼光谱。氨基酸侧链芳香族基团在拉曼光谱中具有特征条带。这些条带可以用来测量氨基酸所在的微环境的极性及其参与氢键的程度[15]。在830 cm-1和850 cm-1处观察到的拉曼光谱峰对应于蛋白质中酪氨酸残基中对位取代苯基的振动,这与酚羟基之间形成的氢键相互作用有关,830 cm-1和850 cm-1处2个峰的拉曼强度比值(I850/I830)称为费米共振[16]。费米共振的值表明酪氨酸残基在微环境中嵌入或暴露的程度。I850/I830值的减少,表明酪氨酸残基埋藏在蛋白质中并参与氨基酸间分子内和分子间氢键的形成。该值的增加表明酪氨酸残基暴露于水相或极性微环境[17]。利用760 cm-1附近的拉曼带的归一化强度来测量色氨酸残基的疏水性并反映蛋白质的疏水相互作用[18]。表1列出了麦醇溶蛋白的几个残基的归一化强度。
表1 高压微射流处理后麦醇溶蛋白与芦丁复合物的氨基酸(酪氨酸、色氨酸、脂肪族氨基酸)微环境分析
Table 1 Side chain group band strength of gliadin and rutin after DHPM treatment

微射流压力/MPaGG-R酪氨酸费米共振色氨酸伸缩振动脂肪族氨基酸酪氨酸费米共振色氨酸伸缩振动脂肪族氨基酸01.04±0.02b0.32±0.02h1.02±0.01g1.20±0.01a0.35±0.00g1.79±0.04f400.90±0.03e0.48±0.02d1.77±0.03f1.01±0.03bc0.56±0.01c5.18±0.06b800.95±0.01d0.42±0.02f1.93±0.01e1.00±0.02c0.50±0.02d6.13±0.10a1200.86±0.01e0.45±0.01e2.00±0.07e0.90±0.02e0.62±0.00b4.62±0.02c1600.96±0.03d0.54±0.00c1.79±0.02f0.87±0.03e0.77±0.02a4.41±0.03d
注:上标字母表示同一指标不同样品之间的显著性差异(P<0.05,n=3)

a-麦醇溶蛋白-芦丁复合物;b-麦醇溶蛋白
图2 微射流处理后麦醇溶蛋白与芦丁复合物的拉曼光谱
Fig.2 Raman spectra of the complex of gliadin and rutin after DHPM treatment
2.2.1 酪氨酸残基
酪氨酸双峰带比率(I850/830)被认为是反映酚羟基氢键的指标。该比率表示酪氨酸侧链是埋藏还是暴露在蛋白质表面。当I850/830>1.0时,酪氨酸残基暴露在水中,能够参与中度或较弱的氢键。相反,低比率表明酪氨酸残基被埋在疏水环境中,并倾向于作为氢键供体来增强内部氢键[18]。I850/830的降低反映了酪氨酸残基埋葬的增加,这表明酪氨酸残基参与了分子间或分子内的相互作用,或相互作用增强。当酪氨酸残基暴露时,850 cm-1带比830 cm-1带更强烈。与此同时,I850/830在相同的160 MPa压力下呈上升趋势,这也表明高压力条件下酪氨酸残基更容易暴露于水中,暴露的酪氨酸残基可能有助于蛋白质的静电相互作用[15]。
2.2.2 色氨酸残基
如表1所示,与未处理组相比,当微射流处理后,麦醇溶蛋白的I760不同程度地增加,当压力达80 MPa时,光谱强度开始有所下降,先前嵌入的色氨酸残基在较高的压力条件下重新暴露,但由于疏水效应更强,进一步强制暴露很困难[15]。当微射流压力达到160 MPa时,强度增加最为明显,从0.32增加到0.54。与芦丁形成复合物后,I760增加至0.35。这些数据表明,在DHPM和芦丁的作用下,麦醇溶蛋白的色氨酸微环境残基趋于掩埋,而DHPM处理后的G-R的I760同样表现出不同程度的增加,在微射流压力为40、80、120、160 MPa时,分别增加至0.54、0.55、0.63、0.83,表明色氨酸残基进一步嵌入在疏水微环境中[19]。
2.3 C—H、—CH2、—CH3弯曲振动变化
1 450 cm-1处的拉曼光谱带主要是由脂肪族残基C—H、—CH2和—CH3的弯曲振动形成的。疏水基团暴露于极性环境中,导致脂肪族残基在1 450 cm-1处的弯曲带强度增加[20]。在1 450 cm-1时,强度的降低可能表明脂肪族氨基酸残基又埋藏在分子内部。表1显示了G处理组与G-R处理组在1 450 cm-1时的拉曼光谱强度。在相同的处理压力下,微射流处理的G-R组拉曼光谱强度明显高于微射流处理的G组,这是由于芦丁的加入引起的脂肪族残基通过氢键产生的内部交联减弱[15]。在不同的微射流压力处理情况下,G与G-R组在1 450 cm-1处的光谱强度从显著增加(P>0.05),光谱强度分别从1.02、1.79显著增加到2.00、6.13。由此可知,微射流处理促进了脂肪族残基暴露于极性环境中[21]。G-R处理组在1 450 cm-1处的光谱强度随着压力的增加而显著增加,说明芦丁和一定的压力处理对麦醇溶蛋白的脂肪族残基均有影响,且具有协同作用。
2.4 二级结构分析
拉曼带的频率和强度反映了蛋白质二级结构(α-螺旋、β-折叠、β-转角、无规则卷曲)和蛋白的局部环境的变化[22]。光谱的峰和位置都有不同程度的变化,表明蛋白质-蛋白质和蛋白质-水之间的氢键发生了变化[18]。一般来说,酰胺I带中蛋白质二级结构的特征条带分别位于1 645~1 660 cm-1(α-螺旋)、1 670~1 680 cm-1(β-折叠)、1 640~1 645 cm-1;1 680~1 690 cm-1(β-转角)和1 660~1 665 cm-1(无规则卷曲)处[23-24]。如图3所示,在微射流压力为40、80、120、160 MPa时,麦醇溶蛋白的α-螺旋含量相较于未经微射流处理分别减低了6.93%,9.38%,6.58%,5.39%。而β-折叠含量的变化趋势与之相反,从 27.71%分别增加至28.42%,28.56%,28.73%,28.83%。β-转角与无规则卷曲含量也呈现了不同程度的增加趋势。这些结果表明,微射流通过减少α-螺旋,增加β-折叠、β-转角、无规则卷曲的含量来修饰麦醇溶蛋白的结构。这些修饰与蛋白质折叠有关,表明构象的变化导致了一个更无序的结构的出现。更具体地说,DHPM通过破坏内部氢键展开α-螺旋,诱导β-折叠、β-转角、无规则卷曲的形成,导致二级结构的改变,并导致水和蛋白质之间的牢固结合。与相同压力下的麦醇溶蛋白组相比,DHPM处理的G-R组具有更高的α-螺旋与β-转角以及更少的β-折叠、无规则卷曲结构。产生这一结果的原因可能是,芦丁确实影响了蛋白质的二级结构。DHMP条件下,G-R组的α-螺旋、无规则卷曲含量减少,β-折叠、β-转角含量增加。

a-麦醇溶蛋白;b-麦醇溶蛋白-芦丁复合物
图3 不同微射流条件下麦醇溶蛋白与芦丁复合物的二级结构图
Fig.3 Secondary structure of gliadin-rutin complex under DHPM conditions
2.5 二硫键构象
在共价键和非共价键中,二硫键(S—S)在蛋白结构中起着关键作用,或在蛋白质内形成分子内二硫键,或在蛋白质链之间形成分子间二硫键[25]。二硫键在分析蛋白质的三级结构中起着不可或缺的作用。一般在文献中,二硫化物条带几乎完全基于500~550 cm-1的频率值。这些频率值之间的差异通常归因于二面角Cα-Cβ-S—S′-Cβ′-Cα′的构象不同。二硫键的条带可大致分为3个构象区域,分别为gauche-gauche-gauche(g-g-g)(500~510 cm-1)、gauche-gauche-trans(g-g-t)(515~525 cm-1)和trans- gauche-trans(t-g-t)(535~545 cm-1)。通过曲线拟合获得的定量数据(图4)可知,麦醇溶蛋白的主要二硫键构象为g-g-g(44.66%),与王启明[13]的研究结果一致。g-g-g构象被认为比其他2种构象更稳定,其与497 cm-1左右的带之间存在区别。g-g-g属于分子间的S—S键,带位于514 cm-1左右。g-g-t和g-g-g构象分别与链内和链间二硫键相关。随着DHPM处理压力的增加,g-g-t和 t-g-t构象含量增加,但g-g-g构象含量降低,这表明DHPM可以破坏链间二硫键,t-g-t构象含量增加表明麦醇溶蛋白分子间作用力增强,进而形成一种趋于更稳定的结构。荷载芦丁后,g-g-g和t-g-t构象转变为g-g-t构象,这表明芦丁在二硫桥的构象中起重要作用。芦丁的加入似乎阻止了二硫化合物分子间S—S链的形成,相反,有利于被认为不太稳定的g-g-t构象的增加。王启明[13]用槲皮素修饰麦醇溶蛋白也观察到了类似的现象。由此可以得出结论,DHPM与芦丁决定着蛋白微环境和构象的显著变化。

a-麦醇溶蛋白;b-麦醇溶蛋白-芦丁复合物
图4 不同微射流条件下麦醇溶蛋白与芦丁复合物的二硫键构象图
Fig.4 Disulfide bond conformation of gliadin-rutin complex under DHPM conditions
3 结论
本研究是首次探究DHPM引起的麦醇溶蛋白-芦丁复合物的结构变化,并直接用拉曼光谱分析的研究。在不同的DHPM阶段可以观察到特定的行为。拉曼光谱研究证实,DHPM处理后的G-R,其分子间g-g-g二硫键构象明显增加,与β-折叠与β-转角结构的增加以及色氨酸和酪氨酸残基的疏水埋藏有关。这些变化意味着一个更有序的结构,有利于麦醇溶蛋白-芦丁复合物网络结构的稳定性。事实上,微射流处理的样品组t-g-t含量增加,分子间作用力增强。芦丁的添加似乎减少了分子间g-g-g构象、β-折叠结构的形成,而不改变氢键。因此,分子间二硫键构象在蛋白多酚复合过程中的结构演化和麦醇溶蛋白网络的稳定性方面起着决定性的作用。需要进一步研究以确定二硫键构象的变化是所观察到的二级蛋白结构变化的原因或影响因素。
[1] 陈雨桐. 小麦醇溶蛋白/单宁酸复合物稳定的皮克林乳液体系的构建及应用[D].武汉:华中农业大学, 2019.
CHEN Y T.Fabrication of Pickering emulsions system stabilized by gliadin/tannic acid complexes and its application[D].Wuhan:Huazhong Agricultural University, 2019.
[2] PENG D F, JIN W P, ZHOU P Y, et al.Foaming and surface rheological behaviors of gliadin particles:Effect of solvent and concentration of gliadin stock solution[J].Food Hydrocolloids, 2020, 106:105868.
[3] ZHANG Q Z, CHENG Z Z, WANG Y B, et al.Dietary protein-phenolic interactions:Characterization, biochemical-physiological consequences, and potential food applications[J].Critical Reviews in Food Science and Nutrition, 2021, 61(21):3 589-3 615.
[4] HOSSEIN RAZAVIZADEGAN JAHROMI S, FARHOOSH R, HEMMATEENEJAD B, et al.Characterization of the binding of cyanidin-3-glucoside to bovine serum albumin and its stability in a beverage model system:A multispectroscopic and chemometrics study[J].Food Chemistry, 2020, 311:126015.
[5] COTIN S, CALLISTE C A, MAZERON M C, et al.Eight flavonoids and their potential as inhibitors of human Cytomegalovirus replication[J].Antiviral Research, 2012, 96(2):181-186.
[6] 邵晓, 张宁, 孙乐彤, 等.槲皮素和芦丁对猪肉肌原纤维蛋白结构的影响[J].食品研究与开发, 2019, 40(2):26-30.
SHAO X, ZHANG N, SUN L T, et al.Effect of quercetin and rutinum on the constructure of pork myofibrillar protein[J].Food Research and Development, 2019, 40(2):26-30.
[7] PEREDA J, FERRAGUT V, QUEVEDO J M, et al.Effects of ultra-high-pressure homogenization treatment on the lipolysis and lipid oxidation of milk during refrigerated storage[J].Journal of Agricultural and Food Chemistry, 2008, 56(16):7 125-7 130.
[8] CHEN L, CHEN J S, YU L, et al.Improved emulsifying capabilities of hydrolysates of soy protein isolate pretreated with high pressure microfluidization[J].LWT-Food Science and Technology, 2016, 69:1-8.
[9] ABREU G F, BORÉM F M, OLIVEIRA L F C, et al.Raman spectroscopy:A new strategy for monitoring the quality of green coffee beans during storage[J].Food Chemistry, 2019, 287:241-248.
[10] FILIPPIDI E, PATEL A R, BOUWENS E C M, et al.Microcapsules:All-natural oil-filled microcapsules from water-insoluble proteins[J].Advanced Functional Materials, 2014, 24(38):5 962-5 968.
[11] WU L, ZHAO W, YANG R J, et al.Aggregation of egg white proteins with pulsed electric fields and thermal processes[J].Journal of the Science of Food and Agriculture, 2016, 96(10):3 334-3 341.
[12] HIGUERA-BARRAZA O A, TORRES-ARREOLA W, EZQUERRA-BRAUER J M, et al.Effect of pulsed ultrasound on the physicochemical characteristics and emulsifying properties of squid (Dosidicus gigas) mantle proteins[J].Ultrasonics Sonochemistry, 2017, 38:829-834.
[13] 王启明. 基于pH/氯化钠调控的麦醇溶蛋白-槲皮素复合物制备及其Pickering乳液特性研究[D].重庆:西南大学, 2020.
WANG Q M.Research on the fabrication of gliadin-quercetin complex and their characteristics of Pickering emulsion based on pH/sodium chloride regulation[D].Chongqing:Southwest University, 2020.
[14] QIN Z H, GUO X F, LIN Y, et al.Effects of high hydrostatic pressure on physicochemical and functional properties of walnut (Juglans regia L.) protein isolate[J].Journal of the Science of Food and Agriculture, 2013, 93(5):1 105-1 111.
[15] YANG K, ZHOU Y H, GUO J J, et al.Low frequency magnetic field plus high pH promote the quality of pork myofibrillar protein gel:A novel study combined with low field NMR and Raman spectroscopy[J].Food Chemistry, 2020, 326:126896.
[16] LIN X P, YANG W G, XU D L, et al.Effect of electron irradiation and heat on the structure of hairtail surimi[J].Radiation Physics and Chemistry, 2015, 114:50-54.
[17] NAWROCKA A, KREKORA M, NIEWIADOMSKI Z, et al.Effect of moisturizing pre-treatment of dietary fibre preparations on formation of gluten network during model dough mixing—A study with application of FT-IR and FT-Raman spectroscopy[J].LWT, 2020, 121:108959.
[18] GUO J J, ZHOU Y H, YANG K, et al.Effect of low-frequency magnetic field on the gel properties of pork myofibrillar proteins[J].Food Chemistry, 2019, 274:775-781.
[19] ZHUANG X B, HAN M Y, BAI Y, et al.Insight into the mechanism of myofibrillar protein gel improved by insoluble dietary fiber[J].Food Hydrocolloids, 2018, 74:219-226.
[20] HERRERO A M.Raman spectroscopy for monitoring protein structure in muscle food systems[J].Critical Reviews in Food Science and Nutrition, 2008, 48(6):512-523.
[21] 李杨, 和铭钰, 吴长玲, 等.空化微射流对生物酶法豆渣蛋白结构影响的拉曼光谱分析[J].食品科学, 2020, 41(1):105-111.
LI Y, HE M Y, WU C L, et al.Raman spectroscopy analysis of the effect of cavitation microjet on the structure of soybean dreg protein from aqueous enzymatic extraction of soybean oil[J].Food Science, 2020, 41(1):105-111.
[22] XIA M Q, CHEN Y X, GUO J J, et al.Water distribution and textual properties of heat-induced pork myofibrillar protein gel as affected by sarcoplasmic protein[J].LWT, 2019, 103:308-315.
[23] TADDEI P, ZANNA N, TOZZI S.Raman characterization of the interactions between gliadins and anthocyanins[J].Journal of Raman Spectroscopy, 2013, 44(10):1 435-1 439.
[24] TOZZI S, ZANNA N, TADDEI P.Study on the interaction between gliadins and a coumarin as molecular model system of the gliadins-anthocyanidins complexes[J].Food Chemistry, 2013, 141(4):3 586-3 597.
[25] LANCELOT E, FONTAINE J, GRUA-PRIOL J, et al.Study of structural changes of gluten proteins during bread dough mixing by Raman spectroscopy[J].Food Chemistry, 2021, 358:129916.