口臭是指在呼吸时会出现臭味气体的症状。口臭作为第三大口腔健康问题,严重影响人们的身心健康以及生活质量[1]。流行病学研究显示中国人群口臭的患病率约为27.5%[2]。80%~90%的口臭与口腔因素相关,主要成因是口腔内的微生物分解含硫氨基酸或血清从而产生了以挥发性硫化物(volatile sulfur compounds, VSCs)为主的代谢产物,其中90%的VSCs是H2S和甲硫醇,还有二甲基硫醚等[3]。
具核梭杆菌(Fusobacterium nucleatum, Fn)在口腔中的丰度高,可以产生半胱氨酸脱氢酶以降解L-半胱氨酸从而产生H2S。此外它还可以利用谷胱甘肽等生成H2S[4],并降解蛋氨酸生产甲硫醇[5]。H2S是主要的VSCs,在多达90%的患病牙周袋中发现,浓度高达2 mmol/L,而Fn产H2S的浓度可达3 mmol/L,是产H2S的主力军[6]。此外,Fn作为口腔的中间“桥梁”菌,在口腔中主要以生物膜形式存在,它在口腔中形成生物膜是口臭不易治疗的主要原因之一。
目前治疗口臭的方法主要有物理方式如刮舌、洗牙或化学疗法如使用洗必泰、精油等漱口水产品,但没有从本质上降低VSCs的浓度,效果不佳[7-8]。对于由微生物引起的口源性口臭,应“对症下药”,用微生物的方法解决。因此益生菌凭借其可以减少致病菌的定植、与病原菌共聚、维持口腔微生态的平衡等优势,逐步应用于口腔领域[9]。已有研究报道唾液链球菌、嗜热链球菌、唾液乳杆菌等能抑制病原菌或VSCs的产生[10-12],但上清液用量大时才起效果,且没有综合评价抑制生长、生物膜形成和VSCs产生的能力。
本研究通过H2S、VSCs、产气基因、生物膜等评价指标,综合筛选到2株乳杆菌,植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215。这2株乳杆菌能够显著抑制Fn产VSCs、抑制其生物膜的形成,且有良好的口腔益生特性。
1 材料与方法
1.1 实验菌株
具核梭杆菌(Fusobacterium nucleatum)ATCC25586购于广东省菌种保藏中心。唾液链球菌K12分离自产品BLIS K12TM。150株乳杆菌均来自江南大学食品学院生物技术中心菌种保藏中心。
1.2 材料与试剂
1.2.1 试剂
Sorfa进口无菌tc处理96孔平底细胞培养板,无锡恒康医疗科技有限公司;甲醇、结晶紫、冰醋酸、氯化血红素,国药集团化学试剂有限公司;辣根过氧化物酶、3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine, TMB),生工生物工程(上海)股份有限公司;亚碲酸钾溶液,青岛博生物技术有限公司;维生素K1,阿拉丁;无菌脱纤维羊血,杭州新锐生物工程有限公司;反转录试剂盒、Bacteria RNA Extraction Kit,诺唯赞生物科技有限公司。
1.2.2 培养基
(1)MRS培养基(g/L):葡萄糖20,胰蛋白胨10,牛肉浸膏10,酵母提取物5,三水合磷酸氢二钾2.6,柠檬酸氢二铵2,乙酸钠2,七水合硫酸镁0.1,一水合硫酸锰0.05,吐温80 1 mL,pH 6.2~6.4,115 ℃高压灭菌20 min;用于乳杆菌的分离和培养。
(2)BHI培养基:购自青岛海博,液体培养基另外添加0.05%(体积分数)的氯化血红素和0.1%的维生素K1,固体培养基添加5%(体积分数)的无菌脱纤维羊血,pH 7.2~7.4;用于Fn的培养。
(3)MSA培养基:购自青岛海博,另每100 mL添加过滤除菌1%(体积分数)亚碲酸钾溶液0.28 mL;用于唾液链球菌的分离和培养。
1.3 仪器与设备
台式冷冻离心机,德国Eppendorf公司;高温高压灭菌锅,日本三洋电机株式会社;Multiscan Go全波长酶标仪,赛默飞士尔科技有限公司;隔水式恒温培养箱,上海森信实验仪器有限公司;DG250厌氧培养箱,华粤行仪器;聚合酶链式反应(polymerase chain reaction,PCR)仪、电泳装置、凝胶成像仪、实时荧光定量PCR仪,美国Bio-Rad公司;生物安全柜、超净工作台,苏州安泰空气技术有限公司;Infinite® F50,德国Tecan公司;Model 4170BLU Halimeter口臭仪,美国Interscan公司。
1.4 实验方法
1.4.1 菌悬液与上清液的制备
冻存甘油管中的Fn、唾液链球菌K12、以及150株乳杆菌分别用BHI、MSA、MRS固体培养基活化,挑取单菌落于BHI、MRS、MRS液体培养基活化2代,其中Fn于37 ℃厌氧培养24 h,唾液链球菌K12和乳杆菌于37 ℃恒温培养箱中培养24 h。收集菌体制备菌悬液,调整菌液浓度为107 CFU/mL。
乳杆菌和唾液链球菌K12于37 ℃培养24 h后,于12 000 r/min、4 ℃、离心10 min,取上清液经0.22 μm无菌滤膜过滤后存于-20 ℃,备用。
1.4.2 基于抑制具核梭杆菌产H2S的定性筛选
通过H2S与FeSO4反应产生黑色的FeS沉淀初步判断乳杆菌抑制Fn产生H2S的能力[6]。具体做法为配制母液,使培养基中含0.02%(体积分数)的硫酸亚铁和0.03%(体积分数)的硫代硫酸钠,现配现用,经0.22 μm的无菌滤膜过滤后加入BHI培养基中,随后加入2%的109 CFU/mL Fn菌悬液,再加入5%的上清液或MRS培养基,37 ℃厌氧培养36 h,根据沉淀情况判断:“-”表示无沉淀,“+”有一点沉淀,“++”有较多沉淀,“+++”有大量沉淀。
1.4.3 挥发性硫化物的测定
参考王小玉[13]的方法并进行了改动:将107CFU/mL的Fn菌悬液与15%(体积分数)的乳杆菌上清液共2 mL加至亨盖特试管中,共培养9 h,用2个50 mL注射器针头插入试管中,一头连接Halimeter口臭仪,一头用来平衡气压,边用振荡器振荡,边测量。由于对照组超出Halimeter的检出上限2 000,故对照组气体需稀释后进行测量。具体操作为振荡混匀后,用1 mL注射器吸取1 mL气体,立即加入一管空的亨盖特试管中,边振荡边测量,数值稳定后并开始下降时,读取最高值,再代入标准曲线中得到数值,重复3次。
1.4.4 RNA提取,cDNA合成及实时荧光定量PCR
将107CFU/mL的Fn菌悬液与15%的乳杆菌上清液共2 mL加至亨盖特试管中,培养9 h。以诺唯赞Bacteria RNA Extraction Kit试剂盒提取总RNA,并根据诺唯赞反转录试剂盒反转录成cDNA,将合成的cDNA模板于-20 ℃保存备用。采用表1中设计获得的引物进行荧光定量PCR,并以16S rRNA基因作内参基因。
表1 引物序列
Table 1 Primer sequence

引物名称引物序列16S rRNA-fwAGAGTTTGATCCTGGCTCAG16S rRNA-rvGTCATCGTGCACACAGAATTGCTGFn1220-fwTGCTTCATCTCCATTGCTTTCAFn1220-rvATCATAAACTGCTGGAATACCACCTA
1.4.5 生物膜形成的测定
利用BHI液体培养基将活化好的Fn菌液浓度调整到107 CFU/mL,静置培养9 h。在96孔板中每孔加入菌悬液190 μL,随后加入10 μL过滤后的乳杆菌上清液,每种上清液设置6个平行孔。阴性对照组以添加的上清液的同体积的MRS代替乳杆菌上清液。
37 ℃厌氧培养48 h后,去掉上清液,以PBS清洗2遍,接着用99%的甲醇固定15 min。弃上清液,室温干燥完全后,每孔加入100 μL的0.1%(体积分数)结晶紫溶液,染色5 min,染色结束后以无菌水清洗2次,然后于室温下放置至完全干燥。最后加入33%(体积分数)的乙酸溶液200 μL进行溶解,用枪吹打混匀后,每孔移取175 μL至一个新的96孔板中,于酶标仪570 nm处读取吸光值。生物膜减少量的计算如公式(1)所示:
抑制率![]()
(1)
1.4.6 益生菌对具核梭杆菌生长的影响
在96孔板每孔中加入107CFU/mL Fn菌悬液190 μL,随后加入过滤后的乳杆菌上清液10 μL,用Tecan infinite F50仪器37 ℃厌氧培养,每隔30 min在600 nm处测定吸光值,绘制生长曲线。
1.4.7 自聚、共聚能力的测定
参考KOS等[14]的方法,将乳杆菌菌悬液与Fn菌悬液等体积混合,分别培养2、4、8 h,在600 nm 下测定混合菌悬液吸光度,记录此时的吸光值为Ax。共聚率的计算如公式(2)所示:
共聚率![]()
(2)
式中:A1,乳杆菌的初始OD600值;A2,Fn的初始OD600值;Ax,静止孵育x h后细菌悬液上清液的吸光值。
自聚率的计算如公式(3)所示:
自聚率![]()
(3)
式中:A0,初始的吸光值;Ax,静止孵育x h后细菌悬液上清液的吸光值。
1.4.8 乳杆菌产H2O2的能力测定
参考王江[15]的方法,用100 mmol/L哌嗪-N,N′-二-乙磺酸(piperazine-N,N_-bis 2-ethanesulfonic acid, PIPES)将质量分数为30%的H2O2稀释至1 mol/L,再用100 mmol/L PIPES将1 mol/L H2O2分别稀释成0、20、25、35、40、50 umol/L工作液;然后分别取100 μL 上述H2O2工作液与100 μL 20 mmol/L的TMB混合,最后向混合溶液中加入2 μL 1 mg/mL辣根过氧化物酶并混匀,16 ℃孵育10 min,测量OD600值作出相应标准曲线。然后取乳杆菌上清液100 μL代替H2O2工作液根据标准曲线做法测OD600值,代入标准曲线得到H2O2的浓度。
1.5 数据统计及分析
本文中的所有图形均采用GraphPad Prism 8.0进行绘制。所有数据采用SPSS Statistics 20.0进行统计学分析,多组间的显著性差异采用单因素方差分析;实验结果以平均数±标准差表示,P<0.05表明数据分析结果呈显著性差异。
2 结果与分析
2.1 乳杆菌上清液抑制具核梭杆菌产H2S的能力
根据沉淀的量进出初步的筛选,150株乳杆菌中有52株有一点沉淀,67株沉淀较多,3株有大量沉淀,有28株乳杆菌无沉淀,无沉淀产生的乳杆菌结果如表2所示。
表2 抑制具核梭杆菌产H2S的乳杆菌
Tab.2 Lactobacillus that inhibits H2S production by Fusobacterium nucleatum

菌株名菌株编号唾液链球菌 K12植物乳杆菌 CCFM1214植物乳杆菌 PCQLP6M2唾液乳杆菌 E61唾液乳杆菌 CCFM1215唾液乳杆菌 FXJWS6M4发酵乳杆菌 HN23发酵乳杆菌 HN286干酪乳杆菌 ATCC334干酪乳杆菌 VCQYB6170M3干酪乳杆菌 VCQYoY1157M2罗伊氏乳杆菌 51罗伊氏乳杆菌 DYNDL216罗伊氏乳杆菌 FHNXY67L4罗伊氏乳杆菌 FSH2M2罗伊氏乳杆菌 95罗伊氏乳杆菌 FSH40M1罗伊氏乳杆菌 FSH6M1罗伊氏乳杆菌 FXJCJ4M2罗伊氏乳杆菌 FXJKS17M8德氏乳杆菌保加利亚亚种M4D2A49德氏乳杆菌保加利亚亚种DQHXNS1L21德氏乳杆菌保加利亚亚种DQHXNS2L1德氏乳杆菌保加利亚亚种DQHXNS5L6德氏乳杆菌保加利亚亚种DQHXNS11M10德氏乳杆菌保加利亚亚种DQHXNS17M6德氏乳杆菌保加利亚亚种DQHXNS18M41德氏乳杆菌保加利亚亚种DXJLHTS3M1德氏乳杆菌保加利亚亚种DQHXNS12L4
2.2 乳杆菌上清液抑制具核梭杆菌产VSCs的能力
根据H2S的抑制初步筛选到28株乳杆菌,进一步通过Halimeter仪器对Fn产生的VSCs进行定量。用1 mL的注射器将亨盖特管中的气体分别吸出0.2、0.4、0.5、0.6、0.8、1.0 mL注入新的亨盖特试管中,进行测量得到对应的VSCs值,绘制标准曲线如图1所示。
VSCs是口臭的主要元凶,不仅反映了口臭的程度,还会破坏牙龈组织,是非常重要的指标。根据图1的标准曲线得到28株乳杆菌抑制Fn产VSCs的能力,结果如表3所示,其中7株乳杆菌的抑制能力高于80%,且高于阳性对照唾液链球菌K12的71.16%,其余的乳杆菌都低于80%,甚至低于60%。因此选择植物乳杆菌CCFM1214、唾液乳杆菌CCFM1215、发酵乳杆菌HN23、干酪乳杆菌ATCC334、干酪乳杆菌VCQYoY1157M2、干酪乳杆菌VCQYB6170M3和罗伊氏乳杆菌51共7株乳杆菌研究其对产VSCs基因的表达量以及生物膜形成量的影响。
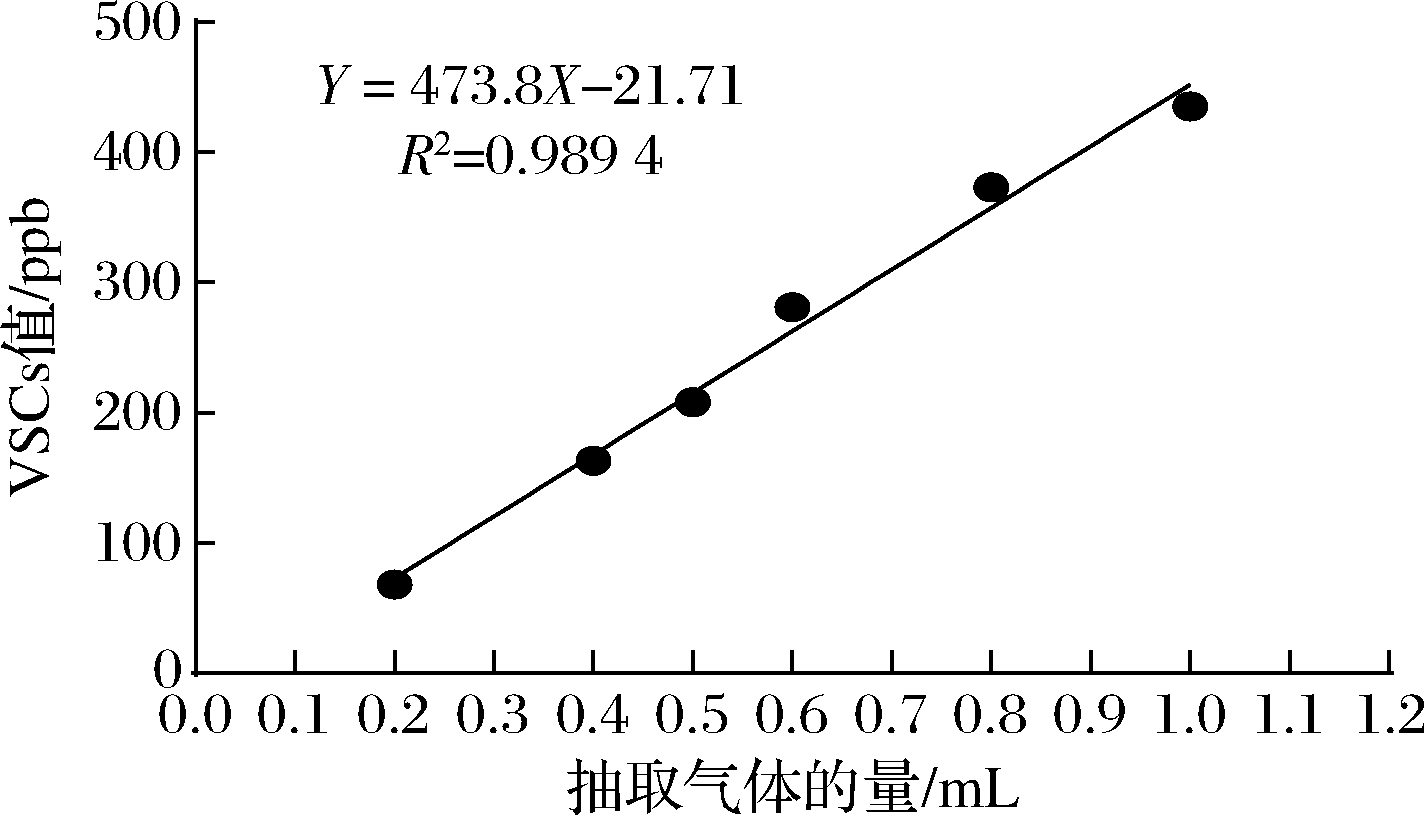
图1 Halimeter仪标准曲线
Fig.1 Standard curve of Halimeter
表3 乳杆菌对具核梭杆菌产VSCs的影响
Table 3 Effect of Lactobacillus on VSCs production by Fusobacterium nucleatum

菌株名菌株编号VSCs值/ppb抑制率/%阴性对照(MRS)-5 683±592 -唾液链球菌K121 639±17971.16植物乳杆菌CCFM1214515±10990.94唾液乳杆菌CCFM1215557±3690.19发酵乳杆菌HN23827±8585.45干酪乳杆菌ATCC334832±12485.36干酪乳杆菌VCQYoY1157M2929±5083.65干酪乳杆菌VCQYB6170M31 057±6581.39罗伊氏乳杆菌511 080±3681.00罗伊氏乳杆菌FHNXY67L41 186±14079.13唾液乳杆菌FXJWS6M41 199±11177.91植物乳杆菌PCQLP6M21 402±9575.33罗伊氏乳杆菌DYNDL2161 422±6474.98发酵乳杆菌HN2861 432±25174.80罗伊氏乳杆菌951 501±23773.59罗伊氏乳杆菌FSH2M21 605±32271.76德氏乳杆菌保加利亚亚种DQHXNS12L41 611±3671.65德氏乳杆菌保加利亚亚种DQHXNS5L61 754±11769.13罗伊氏乳杆菌FSH6M11 924±9166.14唾液乳杆菌E612 054±4663.76罗伊氏乳杆菌FXJCJ4M22 244±86960.52罗伊氏乳杆菌FXJKS17M82 461±11656.69德氏乳杆菌保加利亚亚种M4D2A492 461±6056.69德氏乳杆菌保加利亚亚种DQHXNS17M62 640±5753.54德氏乳杆菌保加利亚亚种DQHXNS11M102 931±6848.43德氏乳杆菌保加利亚亚种DXJLHTS3M13 133±17744.88罗伊氏乳杆菌FSH40M13 401±39840.16德氏乳杆菌保加利亚亚种DQHXNS18M413 535±14137.80德氏乳杆菌保加利亚亚种DQHXNS2L14 250±32325.22德氏乳杆菌保加利亚亚种DQHXNS1L214 286±41624.58
注:-表示无菌编号,无抑制率(下同)
2.3 乳杆菌上清液对Fn1220基因的影响
Fn在口腔中产生大量的H2S,这是由4种酶(Fn0625、Fn1055、Fn1220和Fn1419)介导的,其中Fn1220贡献87.6%的作用[16-17]。采用荧光定量PCR方法分别考察Fn中与产VSCs相关的基因Fn1220在有无乳杆菌上清液存在的情况下的表达差异情况。结果如图2所示,所有乳杆菌均能显著降低Fn1220的表达量(P<0.05),其中植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215的抑制能力最佳,分别是95.32%和90.45%,优于阳性对照唾液链球菌K12。
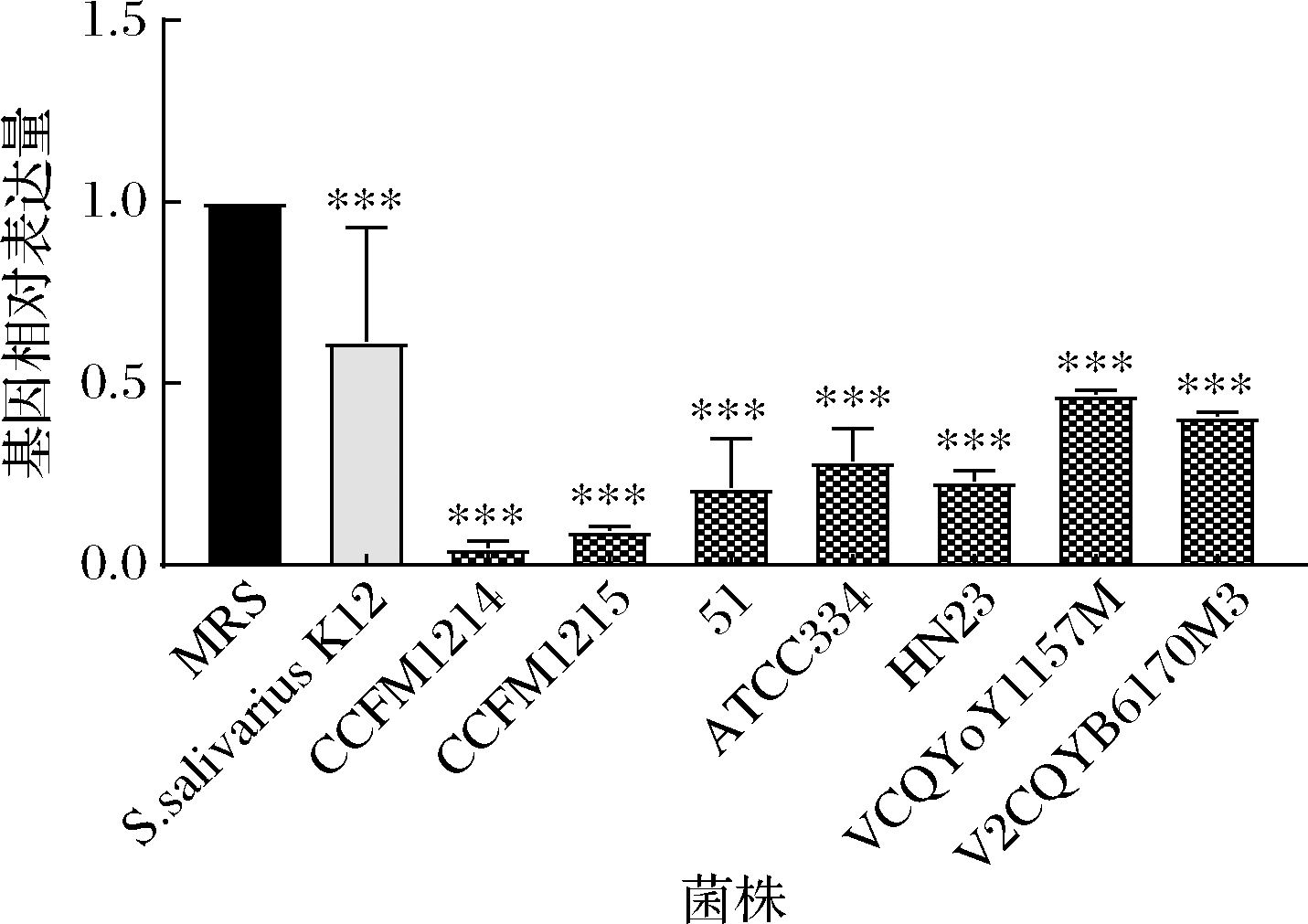
图2 乳杆菌对Fn1220基因的影响
Fig.2 Effect of Lactobacillus on the expression of Fn1220
注:***表示P<0.001,与MRS组相比
2.4 乳杆菌上清液抑制具核梭杆菌生物膜的能力
牙周袋和舌苔是口臭的危险因素,因为它们为产生VSCs和其他气味分子的细菌提供了理想的生长环境[18-19]。而微生物通常以生物膜的形式存在于牙周袋和舌苔中,Fn作为牙菌斑形成的中间桥梁菌,其生物膜的形成是造成口臭的关键,因此抑制其生物膜为缓解口臭提供了可能性[20]。采用结晶紫染色法测定乳杆菌抑制Fn形成生物膜的能力,结果如表4所示,仅添加5%的乳杆菌上清液时,植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215的抑制效果最佳,超过了30%,分别是34.6%和39.98%,而大部分文献都是添加25%~50%[13,20]才有效。综合抑制Fn1220基因以及抑制生物膜的结果,植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215的体外效果较好,有一定的潜力。因此这2株菌可作为潜在口腔益生乳杆菌,进一步对其进行益生特性评价分析。
2.5 乳杆菌上清液对具核梭杆菌生长的影响
口腔疾病很多都是由于口腔菌群失调引起的,一定的抑菌能力有助于乳杆菌调节口腔的菌群。结果如图3所示,2株乳杆菌都有抑制Fn生长的能力。到达稳定期时,唾液乳杆菌CCFM1215对Fn生长的抑制率为23.06%,植物乳杆菌CCFM1214的抑制率为13.32%。
表4 乳杆菌对具核梭杆菌生物膜的抑制作用
Table 4 Inhibitory effect of Lactobacillus on the biofilm of Fusobacterium nucleatum

菌株名菌株编号OD570值抑制率/%阴性对照(MRS)-3.22±0.14-唾液链球菌K122.72±0.4415.61植物乳杆菌CCFM12142.10±0.5434.60唾液乳杆菌CCFM12151.93±0.4839.98发酵乳杆菌HN232.29±0.6628.73干酪乳杆菌ATCC3342.35±0.6726.78干酪乳杆菌VCQYoY1157M22.41±0.4524.86干酪乳杆菌VCQYB6170M32.43±0.2724.18罗伊氏乳杆菌512.27±0.4129.31
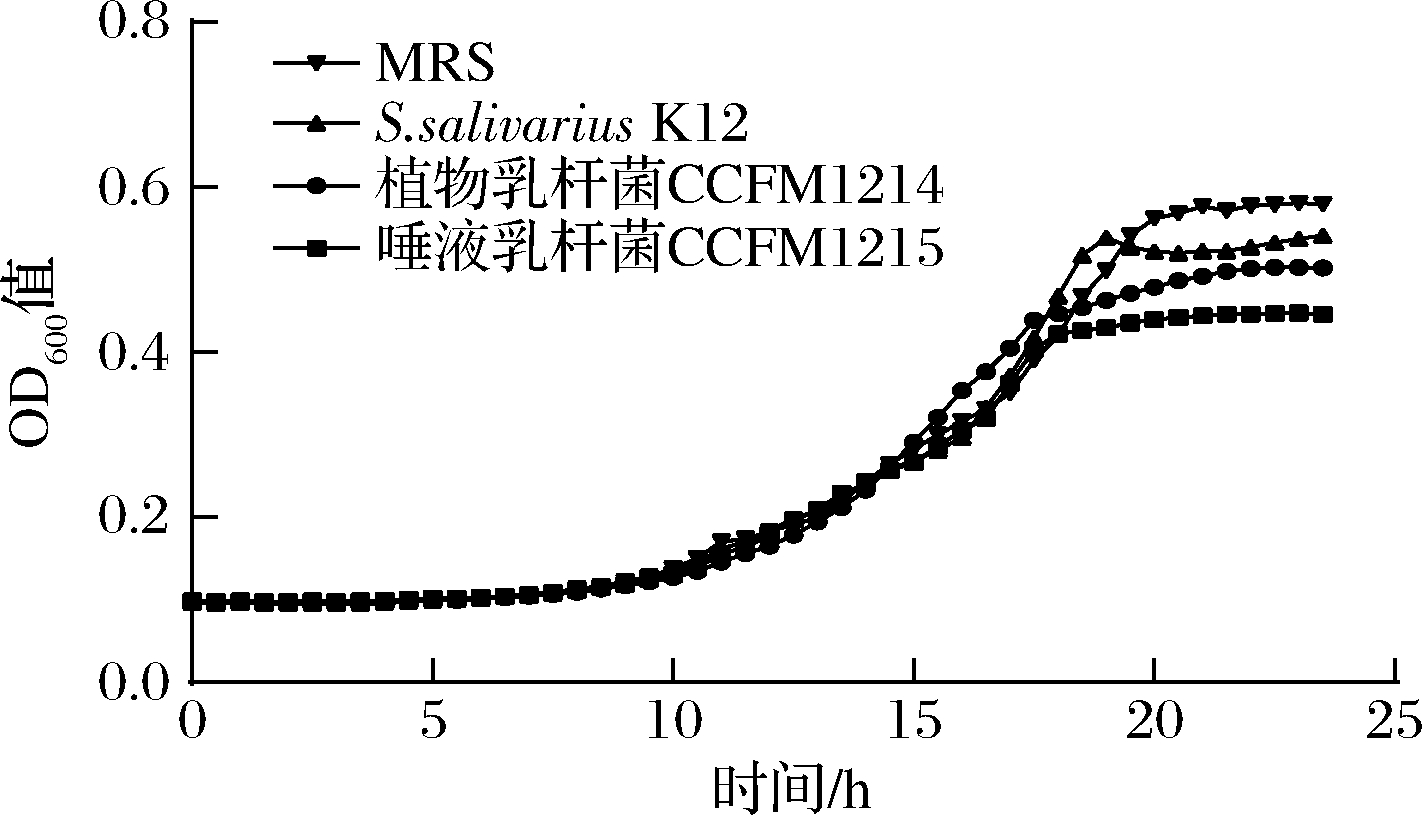
图3 植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215对
具核梭杆菌生长的影响
Fig.3 Effects of L.plantarum CCFM1214 and L.salivarius CCFM1215 on the growth of Fusobacterium nucleatum
2.6 乳杆菌与具核梭杆菌的共聚能力
乳杆菌通过自身聚集,利用自身产生的胞外物质形成保护膜,保护菌株免受环境变化的影响,有利于自身的定植[21]。此外,有研究认为乳杆菌抑制病原菌生物膜的能力与它们共聚集病原菌的能力有关[22]。因此,自聚集和共聚集能力也是评价乳杆菌口腔益生特性的一个指标。如图4所示,唾液乳杆菌CCFM1215在2 h时自聚率为9.21%,4 h时突破至33.47%,8 h达到41.79%。总体来说,唾液乳杆菌CCFM1215的自聚能力优于植物乳杆菌CCFM1214(8 h时27.99%)。植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215都显示出了与Fn良好的共聚能力,均优于阳性对照唾液链球菌K12。2株乳杆菌在2 h时与Fn的共聚率就超过了50%,在8 h时,植物乳杆菌CCFM1214与Fn的共聚率为71.44%,唾液乳杆菌CCFM1215为72.95%。
2.7 乳杆菌产H2O2能力
乳杆菌可以产生H2O2,而H2O2则可通过抑制对其敏感的微生物,使得自身获得竞争优势,从而在生物膜形成过程中发挥重要的菌群调节作用[23-24]。此外H2O2不仅能杀灭口腔内产生VSCs的厌氧菌,还能有效降低口腔异味唾液硫醇前体水平,因此有改善口臭的潜力。H2O2浓度测定的标准曲线如图5所示。
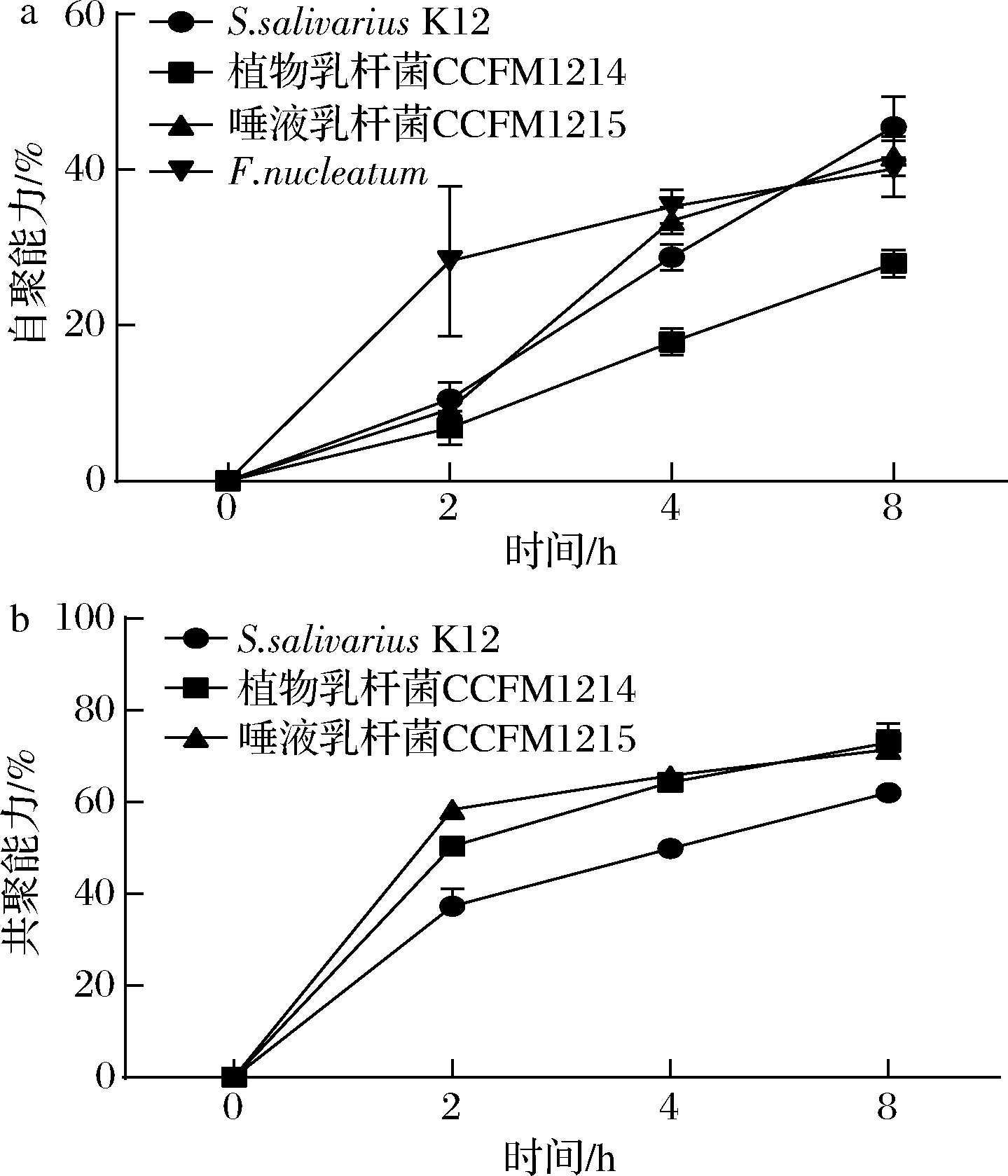
a-自聚能力;b-共聚能力
图4 植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215的自聚和共聚能力
Fig.4 Self-aggregation and co-aggregation ability of L.plantarum CCFM1214 and L.salivarius CCFM1215

图5 H2O2浓度测定标准曲线
Fig.5 Standard curve for determination of hydrogen peroxide concentration
乳杆菌产生的H2O2在辣根过氧化物酶的催化下与TMB发生显色反应,通过吸光值反应浓度的高低。根据图5的标准曲线,得到了植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215产H2O2的浓度,结果如图6所示。2株乳杆菌产H2O2的能力都极显著高于唾液链球菌K12(P<0.01),表明这2株乳杆菌有通过H2O2拮抗其他菌的潜力,有望在调控口腔微生态平衡中发挥重要作用。

图6 植物乳杆菌CCFM1214和唾液乳杆菌CCFM1215产H2O2的能力
Fig.6 The ability of CCFM1214 and CCFM1215 to produce H2O2
注:**表示P<0.01,***表示P<0.001,与唾液链球菌K12比
3 结论
80%~90%的口臭都是由微生物引起的口腔疾病,近3成的中国人都患有口臭。乳杆菌作为益生菌,近年来在口腔疾病方面的应用逐步受到重视。本研究筛选得到1株植物乳杆菌CCFM1214和1株唾液乳杆菌CCFM1215不仅可以抑制具核梭杆菌产生VSCs,而且在仅添加5%的上清液时即可其抑制生物膜的形成,还可以显著下调产生VSCs的基因Fn1220,抑制其生长,综合达到改善口臭的效果。此外这2株乳杆菌产H2O2能力显著高于唾液链球菌K12,且都与具核梭杆菌有良好的共聚能力,抑制病原菌在口腔中的生长和生物膜的形成等,为益生菌在改善口臭方面的应用提供了理论基础。
[1] LU H X, CHEN X L, WONG M C M, et al.Oral health impact of halitosis in Chinese adults[J].International Journal of Dental Hygiene, 2017, 15(4):e85-e92.
[2] LIU X N, SHINADA K, CHEN X C, et al.Oral malodor-related parameters in the Chinese general population[J].Journal of Clinical Periodontology, 2006, 33(1):31-36.
[3] PERSSON S, EDLUND M B, CLAESSON R, et al.The formation of hydrogen sulfide and methyl mercaptan by oral bacteria[J].Oral Microbiology and Immunology, 1990, 5(4):195-201.
[4] BASIC A, BLOMQVIST M, DAHLÉN G, et al.The proteins of Fusobacterium spp.involved in hydrogen sulfide production from L-cysteine[J].BMC Microbiology, 2017, 17(1):61.
[5] PIANOTTI R, LACHETTE S, DILLS S.Desulfuration of cysteine and methionine by Fusobacterium nucleatum[J].Journal of Dental Research, 1986, 65(6):913-917.
[6] OOI X J, TAN K S.Reduced glutathione mediates resistance to H2S toxicity in oral Streptococci[J].Applied and Environmental Microbiology, 2016, 82(7):2 078-2 085.
[7] LODHIA P, YAEGAKI K, KHAKBAZNEJAD A, et al.Effect of green tea on volatile sulfur compounds in mouth air[J].Journal of Nutritional Science and Vitaminology, 2008, 54(1):89-94.
[8] BOSY A, KULKARNI G V, ROSENBERG M, et al.Relationship of oral malodor to periodontitis:Evidence of independence in discrete subpopulations[J].Journal of Periodontology, 1994, 65(1):37-46.
[9] HAUKIOJA A.Probiotics and oral health[J].European Journal of Dentistry, 2010, 4(3):348-355.
[10] MOUSQUER C R, DELLA BONA A, MILANI D C, et al.Are Lactobacillus salivarius G60 and inulin more efficacious to treat patients with oral halitosis and tongue coating than the probiotic alone and placebo? A randomized clinical trial[J].Journal of Periodontology, 2020, 91(6):775-783.
[11] LEE S H, BAEK D H.Effects of Streptococcus thermophilus on volatile sulfur compounds produced by Porphyromonas gingivalis[J].Archives of Oral Biology, 2014, 59(11):1 205-1 210.
[12] YOO H J, JWA S K, KIM D H, et al.Inhibitory effect of Streptococcus salivarius K12 and M18 on halitosis in vitro[J].Clinical and Experimental Dental Research, 2020, 6(2):207-214.
[13] 王小玉. 柠檬精油对口臭抑制作用的研究[D].天津:天津医科大学, 2017.
WANG X Y.Inhibitation of lemon essential oil on halitosis[D].Tianjin:Tianjin Medical University, 2017.
[14] KOS B, ![]() S, et al.Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92[J].Journal of Applied Microbiology, 2003, 94(6):981-987.
S, et al.Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92[J].Journal of Applied Microbiology, 2003, 94(6):981-987.
[15] 王江. 健康妇女阴道乳杆菌多样性分析及具有益生菌特征菌株的筛选[D].重庆:重庆医科大学, 2012.
WANG J.Diversity analysis of Lactobacillus in vagina and screening of particular strains with probiotic properties in healthy women[D].Chongqing:Chongqing Medical University, 2012.
[16] SUWABE K, YOSHIDA Y, NAGANO K, et al.Identification of an L-methionine γ-lyase involved in the production of hydrogen sulfide from L-cysteine in Fusobacterium nucleatum subsp.nucleatum ATCC 25586[J].Microbiology (Reading, England), 2011, 157(Pt10):2 992-3 000.
[17] YOSHIDA Y, SUWABE K, NAGANO K, et al.Identification and enzymic analysis of a novel protein associated with production of hydrogen sulfide and L-serine from L-cysteine in Fusobacterium nucleatum subsp.Nucleatum ATCC 25586[J].Microbiology, 2011, 157(7):2 164-2 171.
[18] ABDULLAH M A, ALASQAH M, SANAA M S, et al.The relationship between volatile sulfur compounds and the severity of chronic periodontitis:A cross-sectional study[J].Journal of Pharmacy & Bioallied Sciences, 2020, 12(Suppl 1):S268-S273.
[19] BERNARDI S, KARYGIANNI L, FILIPPI A, et al.Combining culture and culture-independent methods reveals new microbial composition of halitosis patients’ tongue biofilm[J].MicrobiologyOpen, 2020, 9(2):e958
[20] 钟焱婷, 杨虹.植物乳杆菌UD01对具核梭杆菌生物膜形成的抑制[J].生物学杂志, 2021, 38(1):36-40.
ZHONG Y T, YANG H.Inhibition of Lactobacillus plantarum UD01 on biofilm formation of Fusobacterium nucleatum[J]. Journal of Biology, 2021, 38(1):36-40.
[21] FONSECA H C, DE SOUSA MELO D, RAMOS C L, et al.Probiotic properties of Lactobacilli and their ability to inhibit the adhesion of enteropathogenic bacteria to Caco-2 and HT-29 cells[J].Probiotics and Antimicrobial Proteins, 2021, 13(1):102-112.
[22] GRAF K, LAST A, GRATZ R, et al.Keeping Candida commensal:How Lactobacilli antagonize pathogenicity of Candida albicans in an in vitro gut model[J].Disease Models & Mechanisms, 2019, 12(9):dmm039719.
[23] REDANZ S, CHENG X, GIACAMAN R A, et al.Live and let die:Hydrogen peroxide production by the commensal flora and its role in maintaining a symbiotic microbiome[J].Molecular Oral Microbiology, 2018, 33(5):337-352.
[24] 章可可, 周学东, 徐欣.口腔中过氧化氢的来源及在微生态平衡中的作用[J].华西口腔医学杂志, 2017, 35(2):215-220.
ZHANG K K, ZHOU X D, XU X.The origin of hydrogen peroxide in oral cavity and its role in oral microecology balance[J]. West China Journal of Stomatology, 2017, 35(2):215-220.