受新冠疫情与暴雨等极端天气的影响,国际粮价指数飙升,粮食安全问题受到了人们格外的关注。粮食中真菌毒素的检测是食品安全的一大防线,近年来,玉米中真菌毒素污染严重,GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》中尚未限量的伏马毒素污染率与污染水平不容乐观[1]。但玉米中多种毒素分析的研究报道[2-3]中鲜有包含伏马毒素的多种毒素同时分析方法,行业标准LS/T 6133—2018《粮油检验 主要谷物中16种真菌毒素的测定 液相色谱-串联质谱法》给出了黄曲霉毒素B1(aflatoxin B1,AFB1)、玉米赤霉烯酮(zearalenone,ZEA)、赭曲霉毒素A(ochratoxins A,OTA)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、伏马菌素B1(fumonisin B1,FB1)的同位素内标液质联用同时检测方法。确定一种包含伏马毒素的经济、简单的多种毒素同时分析方法对粮食监管和食品安全意义重大。
真菌毒素是一种耐热的低分子质量次生代谢物(300~700 Da),主要由链格孢霉(Alternaria)、曲霉(Aspergillus)、棒曲霉(Clavatus)、镰刀菌(Fusarium)和青霉(Penicillium)等真菌产生,是其防御机制的一部分[4-5]。真菌毒素是最重要的慢性饮食危险因素,高于食品添加剂和农药残留[6],世界卫生组织估计全世界每年受真菌毒素污染的粮食作物约占25%,但最新统计显示,这一比率高达60%~80%[7-8]。真菌毒素分子质量低并且具有多种化学结构,这制约了分析标准技术的开发[9]。传统的真菌毒素检测包括薄层色谱法(thin layer chromatography,TLC)、液相色谱-质谱联用法、高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection,HPLC-FLD)、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)等方法,液质联用技术具有高分辨率、高灵敏度,是多种毒素同时分析的最佳方案[10-11]。多种毒素同时分析的主要障碍是基质干扰和分析物的化学多样性以及可能存在的分析物之间的交叉干扰。液质分析中,共提取的样品基质会降低或提高分析物的电离效率,对响应值造成信号抑制或增强,这是由于电喷雾电离(electrospray ionization,ESI)过程中液滴表面张力的变化,或是由于化合物之间竞争液相中的电荷[12]。目前去除基质干扰的方法主要有基质匹配校准、内标法以及对提取液进行稀释或者净化。内标物一般使用同位素标记的分析物或者与分析物结构相似的化学物质,但都难以商业化,并且合成标记真菌毒素需要熟练的操作人员以维持合成过程稳定的同位素比率。真菌毒素检测中常用的净化方法有免疫磁珠,免疫亲和柱法和QuEChERS[13-14],但可能存在操作复杂、成本高、准确性低的问题。本文将玉米粉粗提液稀释后进行低温高速离心,以去除色素、脂质、蛋白等基质的干扰,然后进入液相色谱质谱联用仪检测分析,并与QuEChERS方法进行比较,确定一种准确、经济、高效的多种毒素分析检测方法。
1 材料与方法
1.1 材料与试剂
玉米样品购买自2020年收获河南省新乡市农家玉米,搅拌器混匀后取2 kg,分样器缩分至500 g,万能粉碎机研磨至40目筛网筛上物<5%,混合筛上物筛下物,-20 ℃保存待测。
从网上和收粮点购买河南和东北不同地区2021年收获的玉米样品各50 kg,按上述进行处理,-20 ℃保存,用于自然发病玉米样品中真菌毒素的检测。
AFB1、ZEA、OTA、FB1标准品(规格1 mg,纯度≥99%),百灵威科技有限公司;色谱级甲醇、甲酸、乙腈、乙酸铵,美国赛默飞世尔科技有限公司;分析纯乙腈,天津市科密欧化学试剂有限公司;N-丙基乙二胺(primary secondary amine,PSA),天津博纳艾杰尔科技有限公司。
1.2 仪器与设备
DC-12氮吹仪,上海安谱实验科技股份有限公司;HJ-6A恒温磁力搅拌器,金坛市华峰仪器有限公司;5810R高速离心机,德国Eppendorf仪器有限公司;Ultimate 3000-Q Exactive超高效液相色谱-质谱联用仪,美国赛默飞世尔科技有限公司;A10超纯水系统,Millipore生命科学有限公司。
1.3 实验方法
1.3.1 混合标准储备液与混合标准工作液配制
AFB1、ZEA、OTA、FB1标准品1 mg分别使用10 mL色谱级乙腈溶解,配制100 μg/mL标准储备液,贮存于-20 ℃冰箱中。制备混合标准储备液,并系列稀释配制混合标准工作液,贮藏于4 ℃冰箱,每周更新,其中,AFB1、ZEA、OTA、FB1系列梯度分别为0.2、0.5、1、2、3、4、5 μg/L,1、2.5、5、10、15、20、25 μg/L,0.1、0.25、0.5、1、1.5、2、2.5 μg/L,100、250、500、1 000、1 500、2 000、2 500 μg/L。
1.3.2 玉米中真菌毒素提取
取50 g玉米粉加入200 mL提取液,室温提取,4 000 r/min离心20 min,取0.5 mL上清液加入0.5 mL超纯水涡旋混匀,低温高速离心15 min脱脂(12 000 r/min,3 ℃),取澄清部分于进样瓶中待测。每个提取样设置6个平行。
1.3.3 色谱条件
C18色谱柱(150 mm×2.1 mm, 3 μm, Thermo Scientific Syncronis),柱温35 ℃,流动相A:含5 mmol/L乙酸铵和0.1%(体积分数)甲酸的水,流动相B:甲醇,流速0.3 mL/min, 进样量10 μL,流动相梯度如表1所示。
表1 流动相梯度
Table 1 Mobile phase gradient

时间/minA/%B/%075251.55954.25954.375256.07525
1.3.4 质谱条件
ESI离子源,轨道阱质谱,扫描模式一级全扫,质谱参数设置如表2所示。
表2 质谱参数
Table 2 Mass spectrum parameters

参数名称参数值鞘气压力/arb25辅助气压力/arb5吹扫气压力/arb0喷雾电压/kV3.00离子传输管温度/℃320辅助气温度/℃300扫描范围(m/z)200~800分辨率70 000
1.3.5 基质干扰评估
使用空白基质提取液配制的标准品与乙腈溶剂配制的标准品进行比较,评估蛋白、脂质、色素等对毒素检测的干扰效果。用玉米阴性样品的基质提取液配制4种真菌毒素的混合标准工作液,其中AFB1、ZEA、OTA、FB1的质量浓度梯度分别为0.2、0.5、1、2、3、4、5 μg/L,1、2.5、5、10、15、20、25 μg/L,0.1、0.25、0.5、1、1.5、2、2.5 μg/L,100、250、500、1 000、1 500、2 000、2 500 μg/L,基质的信号抑制或增强作用按公式(1)计算,>1表示信号增强,<1表示信号抑制。
基质效应![]()
(1)
式中:k基质提取液表示系列浓度梯度标准品在玉米基质提取溶液中的斜率;k有机溶剂表示系列浓度梯度标准品在有机溶剂中的斜率。
1.3.6 方法验证
对方法进行验证,测定方法的检测限、定量限、线性范围、重现性、重复性以及加标回收率。检测限和定量限通过逐级稀释获得,同一天内测定多次和不同天内多次测定评价方法的重现性和重复性。添加低浓度和高浓度的4种标准品测定方法的加标回收率,并与QuEChERS方法进行比较。
1.4 数据统计与分析
所有样品均测试6次,实验数据以均值±标准差(x±s)表示,使用Microsoft Office Excel 2019和IBM SPSS Statistics 26进行统计学分析,Origin 2021绘图。使用单因素ANOVA检验进行多组间比较,邓肯分析进行两两比较。P<0.05表示在统计学上具有显著性差异,P<0.01表示在统计学上具有极显著性差异。
2 结果与分析
2.1 提取方式的优化
不同提取方式的提取效率决定了检测方法的准确度。常见的谷物中真菌毒素提取方式有振荡、搅拌、超声、涡旋等,也有部分使用温度、微波、磁场等辅助提取。本文研究了室温条件下回旋振荡(调速中等)和磁力搅拌(最大转速300 r/min)2种提取方式的差异,使用含1%(体积分数)乙酸的79%(体积分数)乙腈作为提取剂,2种方法分别提取阴性加标样品20 min,经同样处理后进样检测。如图1所示,回旋振荡对ZEA和OTA提取效果较差,可能是由于振荡时间不充分导致[15-16],或是由于振荡提取过程中玉米粉部分沉积于溶剂底部,与提取溶液接触不充分。而磁力搅拌过程中由于磁力转子的作用,样品与提取剂始终处于涡旋状态,对4种真菌毒素能达到很好的萃取效果[16],回收率为90%~110%。

图1 不同提取方式的回收率
Fig.1 Recovery of different extraction methods
注:每种毒素类别的不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)(下同)
2.2 提取时间的优化
基于2.1研究结果,选择磁力搅拌作为提取方式。为确定最佳的提取时间,分析比较了提取10、20、30 min时的提取效果。如图2所示,过长的提取时间对提取效率并没有显著提高,甚至会降低对目标分析物的提取效果,这可能是由于提取时间过长时会大量溶出基质中的杂质,干扰了分析物的检测[3,17]。提取时间10 min对ZEA和OTA的提取率较低,仅能达到70%左右的回收率;提取时间20 min时,4种毒素均有很好的提取效果,回收率均为80%~100%,提取时间30 min时,AFB1和OTA的回收率出现降低,OTA的回收率仅为60%。综合以上研究结果,提取20 min时,4种真菌毒素回收率均能达到80%~120%,因此,后续实验选择磁力搅拌的提取时间为20 min。

图2 不同提取时间的回收率
Fig.2 Recovery at different extraction times
2.3 提取剂的优化
真菌毒素常见的提取剂为酸化水与有机溶剂的混合溶液,本文比较了50%乙腈、75%乙腈、含1%乙酸的74%乙腈和含1%乙酸的79%乙腈4种溶剂对玉米中4种真菌毒素提取效果的差异。如图3所示,50%乙腈对AFB1、ZEA和OTA的提取效果较差,回收率为60%~80%,增加有机溶剂的比例时,回收率有显著提高。这可能是由于AFB1、ZEA和OTA都是弱极性化合物,增加有机相比例可以显著提升萃取效果,而水溶性的FB1由于极性较强,表现出相反的结果[18-19]。pH变化对AFB1、ZEA和OTA的回收率没有显著影响,加入冰乙酸后FB1的回收率有显著提升,这可能与FB1具有多个羧基,有一定酸性有关[20]。含1%乙酸的74%乙腈和含1% 乙酸的79%乙酸对4种毒素均能达到很好的提取效果,回收率在80%以上,但后者更高的有机相比例对AFB1和ZEA有更好的萃取效果,因此,选择含1%乙酸的79%乙腈作为提取溶剂。

图3 不同提取剂的回收率
Fig.3 Recovery of different extractants
2.4 分析方法的验证
2.4.1 基质效应和回收率
国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)在“IUPAC Recommendations 2002”中提出了表观回收率(apparent recovery,RA)与回收率(recovery,RE)的概念,表观回收率即常见的方法回收率,用来表征方法的可行性,表观回收率受两因素影响——基质干扰和提取效率,表观回收率去除基质的干扰效果后即为回收率,其中表观回收率计算过程如公式(2)所示:
表观回收率![]()
(2)
式中:k加标样品表示系列浓度梯度加标样品的斜率;k有机溶剂表示系列浓度梯度标准品在有机溶剂中的斜率。
实验结果表明,AFB1的定量检测有很强的基质效应,表现出明显的信号抑制(图4),OTA存在较弱的信号抑制,但低温高速离心净化后取得了很好的回收率,说明低温高速离心能取得很好的基质净化作用。在添加低浓度和高浓度的标准品时(表3),方法的回收率均>90%,相对误差为0.7%~2.2%,说明本方法可行。

a-AFB1;b-FB1;c-ZEA;d-OTA
图4 四种毒素标准溶液在不同溶剂环境下的色谱峰面积
Fig.4 Chromatographic peak areas of four toxin standard solutions in different solvent environments
表3 添加不同浓度标准品时
方法的回收率
Table 3 Recovery of the method when different concentrations of standards are added
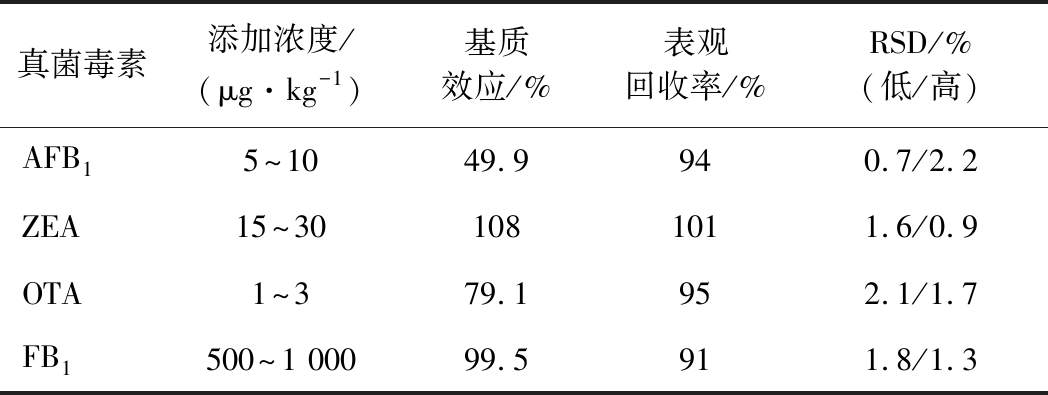
真菌毒素添加浓度/(μg·kg-1)基质效应/%表观回收率/%RSD/%(低/高)AFB15~1049.9940.7/2.2ZEA15~301081011.6/0.9OTA1~379.1952.1/1.7FB1500~1 00099.5911.8/1.3
2.4.2 线性范围和检测限
梯度稀释混合标准工作液至本仪器能检测到的最低浓度,采用逐级稀释的方法测定本方法的检出限和定量限(表4),定量限为0.42~314 μg/kg,均在限量值之内,可以满足检测需求。
2.4.3 方法的重现性和重复性
AFB1、FB1、ZEA和OTA 4种真菌毒素的质量浓度分别为1、250、2.5、0.25 μg/L,一天内连续进样5次,计算5次峰面积平均值,测定重现性;3 d连续进样,计算峰面积平均值,测定重复性。相对误差为0.4%~6.7%(表5),方法精密度良好。
表4 方法的线性范围和检测限、定量限
Table 4 Linear range, detection limit and quantitation limit of the method

真菌毒素线性范围/(μg·kg-1)线性回归方程相关系数r2检测限/(μg·kg-1)定量限/(μg·kg-1)AFB11.6~40Y=-18 124.2+1.807 16×106X0.999 80.130.42FB1800~20 000Y=-2 495 280+2.070 49×108X0.996 492.4314ZEA8~200Y=16 159.7+830 85.4X0.990 61.063.6OTA0.8~20Y=-20 265.4+283 808X0.993 60.140.47
表5 方法的重现性和重复性
Table 5 reproducibility and repeatability of the method
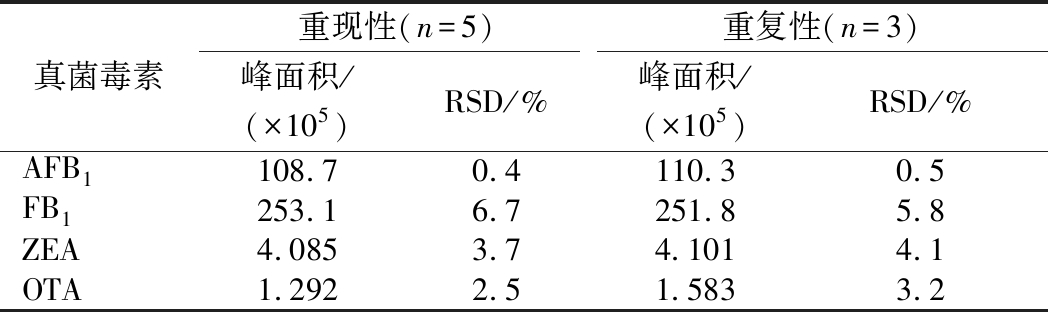
真菌毒素重现性(n=5)重复性(n=3)峰面积/(×105)RSD/%峰面积/(×105)RSD/%AFB1108.70.4110.30.5FB1253.16.7251.85.8ZEA4.0853.74.1014.1OTA1.2922.51.5833.2
2.4.4 方法与QuEChERS比较
QuEChERS作为一种经济、简单、适应性强的前处理方法,不仅广泛应用于果蔬的农残检测,在真菌毒素检测领域也有广泛应用。将此方法与QuEChERS前处理方法相比较[21],发现两者对AFB1、ZEA和OTA均能达到很好的萃取效果,回收率均能达到80%以上(图5)。但对于包含FB1的多种毒素检测,本方法具有优势,因为QuEChERS的盐析过程可能会导致亲水性FB1的萃取较差,并且常用的吸附净化剂PSA也会通过离子交换作用吸附FB1,对FB1的定量分析造成干扰[17]。范志辰等[17]在不使用吸附净化剂的条件下,饲料玉米中FB1回收率可以达到(104.8±10.7)%;胡文彦等[22]不使用净化剂检测婴幼儿谷基辅助食品中9种真菌毒素,FB1回收率可以达到(88.9±6.3)%,说明此方法可以达到与QuEChERS一致的多种毒素同时检测效果。

图5 与QuEChERS方法的回收率比较
Fig.5 Comparison of recovery between QuEChERS method and QuEChERS method
2.4.5 自然感染毒素玉米样品检测
采用上述优化后的方法检测2021年新收获河南、东北不同产地的自然感染真菌毒素玉米样品,结果如表6所示。分析结果可知,自然发病玉米中,FB1和AFB1污染较为普遍,部分样品检测出ZEA,但OTA均未检出。采集自河南省的玉米样品,AFB1和FB1污染严重,这可能与河南地区2021年7月长期暴雨天气有关;由于东北地区气温较低,玉米中真菌毒素污染并不严重。本研究所优化的提取检测技术可以很好的对自然发病玉米样品中多种真菌毒素进行定性定量测定,检测方法简单,所需耗材少,经济成本低,可以满足粮食收储及加工企业的需求。
表6 玉米样品真菌毒素污染情况
Table 6 Mycotoxin contamination of corn samples

产地样品编号真菌毒素含量/(μg·kg-1)AFB1FB1ZEA河南新乡A-370-B81 600-C30.44 08327.2河南原阳D1.21 10112.8E51.215 8539.6辽宁盘锦F-340-
注:表中A~F代表天然发病玉米样品编号;“-”代表未检出
3 结论
本研究通过对提取方式、提取剂和提取时间进行优化,确定了一种经济、高效、简单的液质联用多种毒素分析方法,能同步检测玉米中的AFB1、ZEA、OTA和FB1含量。该方法使用酸化水与有机溶剂的混合溶液提取玉米样品,通过稀释和低温高速离心去除玉米基质的干扰,使用液质联用仪进行定量分析,对4种真菌毒素的回收率为90%~105%,定量限为0.42~314 μg/kg。该方法具有很好的准确度和精密度,稳定性好,并且不需要使用免疫亲和柱、净化剂等材料,大大降低了多种真菌毒素同时分析的经济成本。
[1] 王娟, 王改琴, 李钒, 等.2020年底各地新玉米霉菌毒素风险分析[J].中国饲料, 2021(9):93-97.
WANG J, WANG G Q, LI F, et al.Risk analysis of mycotoxin in new maize from different producing areas at the end of 2020[J].China Feed, 2021(9):93-97.
[2] NUNES M, PIZZUTTI I R, BRACKMANN A, et al.Multimycotoxin determination in grains:A comprehensive study on method validation and assessment of effectiveness of controlled atmosphere storage in preventing mycotoxin contamination[J].Journal of Agricultural and Food Chemistry, 2021, 69(38):11 440-11 450.
[3] 何卓霖, 李子琨, 穆蕾, 等.同位素内标-高效液相色谱-串联质谱法同时测定小麦和玉米中19种真菌毒素[J].中国粮油学报,2022,37(7):150-157.
HE Z L, LI Z K, MU L, et al.Simultaneous determination of isotope internal standard-high performance liquid chromatography-tandem mass spectrometry 19 mycotoxins in wheat and corn[J].Journal of the Chinese Cereals and Oils Association,2022,37(7):150-157.
[4] ESKOLA M, KOS G, ELLIOTT C T, et al.Worldwide contamination of food-crops with mycotoxins:Validity of the widely cited ‘FAO estimate’ of 25%[J].Critical Reviews in Food Science and Nutrition, 2020, 60(16):2 773-2 789.
[5] MOUSAVI KHANEGHAH A, FAKHRI Y, GAHRUIE H H, et al.Mycotoxins in cereal-based products during 24 years (1983—2017):A global systematic review[J].Trends in Food Science & Technology, 2019, 91:95-105.
[6] TURNER N W, SUBRAHMANYAM S, PILETSKY S A.Analytical methods for determination of mycotoxins:A review[J].Analytica Chimica Acta, 2009, 632(2):168-180.
[7] STREIT E, NAEHRER K, RODRIGUES I, et al.Mycotoxin occurrence in feed and feed raw materials worldwide:Long-term analysis with special focus on Europe and Asia[J].Journal of the Science of Food & Agriculture, 2013, 93(12):2 892-2 899.
[8] KOVALSKY P, KOS G, N EHRER K, et al.Co-occurrence of regulated, masked and emerging mycotoxins and secondary metabolites in finished feed and maize-An extensive survey[J].Toxins, 2016, 8(12):363.
EHRER K, et al.Co-occurrence of regulated, masked and emerging mycotoxins and secondary metabolites in finished feed and maize-An extensive survey[J].Toxins, 2016, 8(12):363.
[9] CHAUHAN R, SINGH J, SACHDEV T, et al.Recent advances in mycotoxins detection[J].Biosensors & Bioelectronics, 2016, 81:532-545.
[10] WALL-MART NEZ H A, PASCARI X, RAMOS A J, et al.Frequency and levels of mycotoxins in beer from the Mexican market and exposure estimate for deoxynivalenol mycotoxins[J].Mycotoxin Research, 2019, 35(2):207-216.
NEZ H A, PASCARI X, RAMOS A J, et al.Frequency and levels of mycotoxins in beer from the Mexican market and exposure estimate for deoxynivalenol mycotoxins[J].Mycotoxin Research, 2019, 35(2):207-216.
[11] GONZ LEZ-JART
LEZ-JART N J M, ALFONSO A, RODR
N J M, ALFONSO A, RODR GUEZ I, et al.A QuEChERS based extraction procedure coupled to UPLC-MS/MS detection for mycotoxins analysis in beer[J].Food Chemistry, 2019, 275:703-710.
GUEZ I, et al.A QuEChERS based extraction procedure coupled to UPLC-MS/MS detection for mycotoxins analysis in beer[J].Food Chemistry, 2019, 275:703-710.
[12] VAN HOUT M W J, NIEDERL NDER H A G, DE ZEEUW R A, et al.Ion suppression in the determination of clenbuterol in urine by solid-phase extraction atmospheric pressure chemical ionisation ion-trap mass spectrometry[J].Rapid Communications in Mass Spectrometry:RCM, 2003, 17(3):245-250.
NDER H A G, DE ZEEUW R A, et al.Ion suppression in the determination of clenbuterol in urine by solid-phase extraction atmospheric pressure chemical ionisation ion-trap mass spectrometry[J].Rapid Communications in Mass Spectrometry:RCM, 2003, 17(3):245-250.
[13] PINTO L, SANTOS A, VARGAS E, et al.Validation of an analytical method based on QuEChERS and LC-MS/MS to quantify nine mycotoxins in plant-based milk[J].World Mycotoxin Journal, 2021, 14(3):339-346.
[14] 刘远晓, 关二旗, 卞科, 等.QuEChERS法在食品有机污染物检测中的研究进展[J].食品科学, 2017, 38(19):294-300.
LIU Y X, GUAN E Q, BIAN K, et al.A review of the application of QuEChERS in the determination of organic contaminants in foods[J].Food Science, 2017, 38(19):294-300.
[15] 张新娜, 马丽艳, 潘赛超, 等.高效液相色谱-串联质谱法测定杂粮豆类中11种真菌毒素[J].食品科学, 2019, 40(8):306-310.
ZHANG X N, MA L Y, PAN S C, et al.Simultaneous determination of 11 mycotoxins in minor food legumes by high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS)[J].Food Science, 2019, 40(8):306-310.
[16] 吴宇, 辛媛媛, 叶金, 等.全碳标记稳定同位素内标-超高效液相色谱-串联质谱法测定粮食中16种真菌毒素[J].食品科学, 2017, 38(18):297-303.
WU Y, XIN Y Y, YE J, et al.Suitability of fully 13C isotope labeled internal standards for the simultaneous determination of 16 mycotoxins in grains by UPLC-MS/MS[J].Food Science, 2017, 38(18):297-303.
[17] 范志辰, 韩铮, 郭文博, 等.超高效液相色谱-串联质谱法同时测定不同饲料中30种真菌毒素[J].色谱, 2017, 35(6):627-633.
FAN Z C, HAN Z, GUO W B, et al.Simultaneous determination of 30 mycotoxins in different feed products by ultra high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2017, 35(6):627-633.
[18] 郑嘉, 王红旗, 刘继红, 等.轻简化液质联用法检测玉米中的伏马毒素B1、B2和B3[J].河南农业科学, 2021, 50(9):172-180.
ZHENG J, WANG H Q, LIU J H, et al.Simplified liquidmass coupling method for detection of fumonisins B1, B2 and B3 in corn[J].Journal of Henan Agricultural Sciences, 2021, 50(9):172-180.
[19] SULYOK M, BERTHILLER F, KRSKA R, et al.Development and validation of a liquid chromatography/tandem mass spectrometric method for the determination of 39 mycotoxins in wheat and maize[J].Rapid Communications in Mass Spectrometry:RCM, 2006, 20(18):2 649-2 659.
[20] 辛媛媛, 张艳, 王松雪, 等.UPLC-MS/MS法测定玉米中13种真菌毒素[J].中国粮油学报, 2015, 30(12):126-130.
XIN Y Y, ZHANG Y, WANG S X, et al.Determination of 13 mycotoxins in corn by UPLC-MS/MS[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(12):126-130.
[21] VACLAVIK L, ZACHARIASOVA M, HRBEK V, et al.Analysis of multiple mycotoxins in cereals under ambient conditions using direct analysis in real time (DART) ionization coupled to high resolution mass spectrometry[J].Talanta, 2010, 82(5):1 950-1 957.
[22] 胡文彦, 许磊, 杨军, 等.基于QuEChERS提取的快速液相色谱-串联质谱法测定婴幼儿谷基辅助食品中的9种真菌毒素[J].色谱, 2014, 32(2):133-138.
HU W Y, XU L, YANG J, et al.QuEChERS-based extraction procedure and rapid resolution liquid chromatography coupled to triple quadrupole mass spectrometry for the determination of nine mycotoxins in cereal-based complementary foods for infants and young children[J].Chinese Journal of Chromatography, 2014, 32(2):133-138.