人体的必需微量元素中铁的含量最高,在氧的运输和贮存、合成细胞中色素和部分金属酶、增强免疫功能等生理活动方面,发挥着非常重要的作用[1-2]。人体内铁的缺失或过量均会产生疾病,铁缺失会导致血液系统、消化系统、循环系统和神经系统等多个系统脏器的功能障碍。然而,过量的铁也会引起组织的损坏、肝脾功能障碍、肿瘤甚至死亡等严重的状况[3-8]。因此,快速、准确地检测食品及人体中铁的含量非常重要。与电子耦合等离子体-质谱法(electron coupled plasma-mass spectrometry,ICP-MS)、原子吸收光谱法(atomic absorption spectrum,AAS)、循环伏安法(cyclic voltammetry,CV)等传统检测方法相比[9-13],荧光探针操作简单,具有良好的响应性和高灵敏度,是一种检测金属离子快速有效的方法[14-15]。
罗丹明类荧光染料分子经改性后的酰胺部分能进行螺环的“开-闭”功能,闭环时分子无色且无荧光,当遇见某种金属离子后,螺环打开呈现出颜色和荧光,因此作为一类很好的金属离子荧光探针备受关注[16-17]。目前,不少新的罗丹明类荧光探针分子被研究出来,它们多用于Cu2+、Zn2+、Hg2+等的识别,且灵敏度低、抗干扰能力弱[18-19]。为得到性能良好的荧光探针分子,本文设计以罗丹明101、乙二胺和8-羟基久洛尼定为原料,合成了新型结构的探针R[20-22]。通过研究发现,探针R能很好的选择性识别Fe3+,抗干扰能力强,灵敏度高,同时其生物相容性好,荧光发射波长为610 nm,能很好的避免生物体本身的荧光影响,为进一步快速有效地检测生物体内Fe3+的含量提供了可能。
1 材料与方法
1.1 材料与仪器
罗丹明101、乙二胺、8-羟基久洛尼定、金属盐(氯化物,硝酸银除外)等试剂,阿拉丁试剂(上海)有限公司;除乙醇无水处理外,其他试剂均为分析纯,实验用水为超纯净水。
AM-400 MHz型核磁共振仪,德国Brucker公司;UV-2450紫外可见分光光度计、RF-5301PC荧光光谱仪,日本Shimadzu公司;IX71倒置荧光显微镜,日本Olympus公司。
1.2 实验方法
1.2.1 探针R的合成
探针R的合成路线如图1所示。

图1 探针R的合成
Fig.1 Continuous two-step synthesis of R
1.2.1.1 N-氨乙基-罗丹明101酰亚胺的合成
100 mL茄形烧瓶中加入无水乙醇45 mL,继续加入4.066 2 g罗丹明101,搅拌下加热至完全溶解。随后缓慢滴加乙二胺溶液4 mL,110 ℃回流反应。采用薄层色谱(thin-layer chromatography,TLC)实时跟踪反应程度,待反应彻底完成后,将反应液缓慢倒入剧烈搅拌的冰水中,析出大量白色固体,减压抽滤,并用少量无水乙醇进行淋洗,真空干燥后称重为2.323 3 g,产率约为57%。
1.2.1.2 9-羰基-8-羟基久洛尼定的合成
称取5 g 8-羟基久洛尼定于三颈烧瓶中,加入10 mL N,N-二甲基甲酰胺(N,N dimethylformamide,DMF),冰浴搅拌下将4.5 g三氯氧磷和10 mL DMF充分混合,倒入分液漏斗进行滴加,滴完反应30 min后,100 ℃继续反应1.5 h,冷却后缓慢加入25 mL冰水搅拌,减压抽滤干燥,得绿色固体,用石油醚和乙酸乙酯1∶1进行洗脱,最终得到淡黄色晶体,称重得4.132 1 g,产率约为83%。
1.2.1.3 探针R的合成
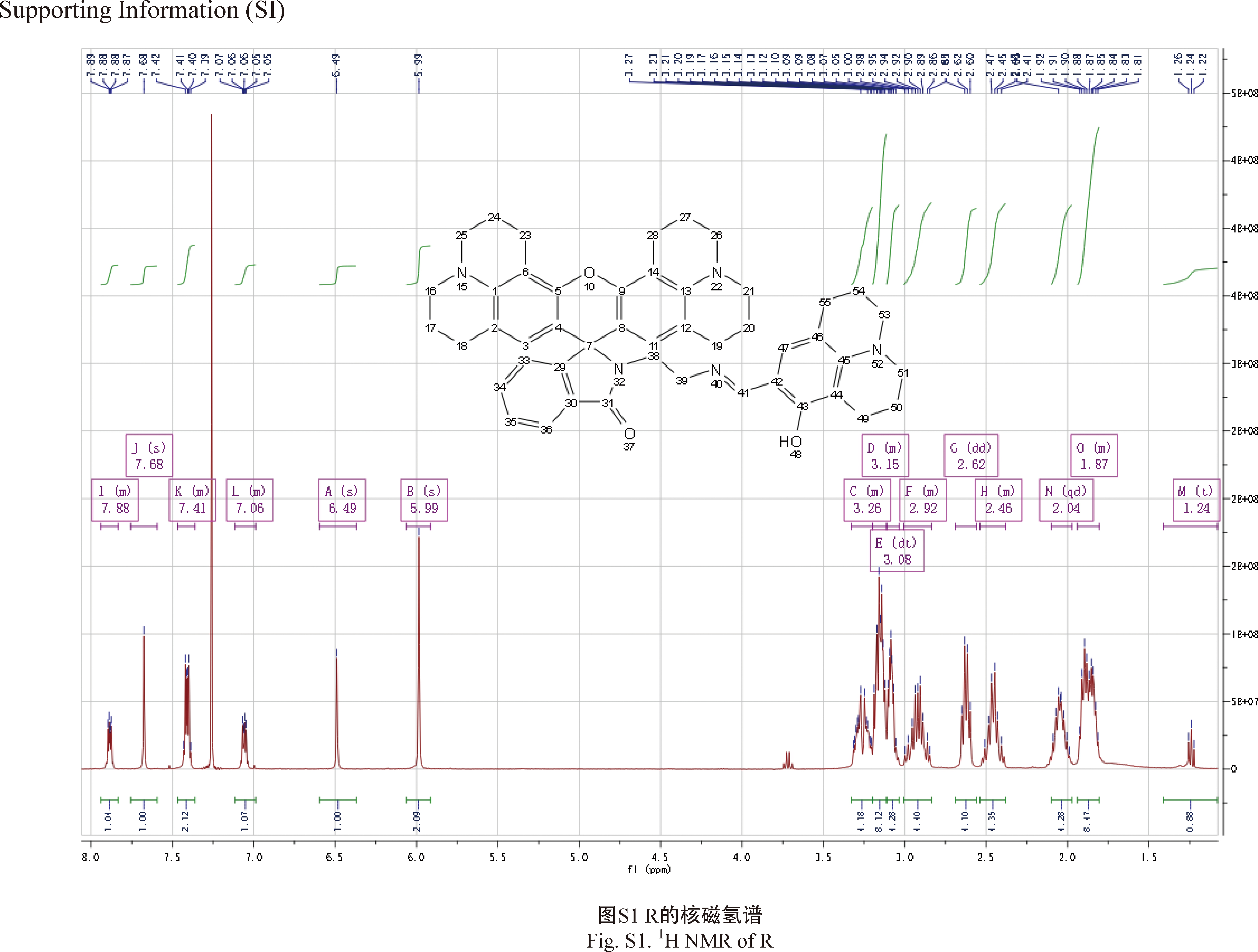
称取N-氨乙基-罗丹明101酰亚胺固体0.538 5 g,溶于10 mL的无水乙醇中,加热搅拌下加入9-羰基-8-羟基久洛尼定0.226 4 g,并滴加1 mL冰醋酸,100 ℃下回流反应,溶液逐渐变黄,采用TLC实时跟踪反应,待反应完成后,浓缩母液,冷却后减压抽滤,固体用少量无水乙醇淋洗,通过重结晶,最终得0.285 5 g黄色固体R,产率约为53%。通过分析产物的核磁谱图(附图1、附图2,https://kns.cnki.net/kcms/detail/11.1802.TS.20220905.1657.010.html,下同)和质谱图(附图3)得:1H NMR(400 MHz,CDCl3,TMS)δ:7.88(m,1H),7.68(s,1H),7.41(m,2H),7.06(m,1H),6.49(s,1H),5.99(s,2H),3.26(m,4H),3.15(m,8H),3.08(dt,4H),2.92(m,4H),2.62(dd,4H),2.46(m,4H),2.04(qd,4H),1.87(m,8H),1.24(t,1H)。13C NMR(100 MHz,CDCl3,TMS)δ:168.34,163.82,163.01,154.17,148.19,146.87,143.60,132.33,130.88,128.78,127.73,124.54,123.94,122.64,117.23,112.19,107.78,106.88,105.26,65.72,53.25,50.11,49.88,49.47,41.38,27.23,22.24,22.02,21.49,21.24,20.29 ppm。MS,m/z:731.00[M]+,理论计算值731.38。
1.2.2 溶液的配制
将NaCl、KCl、ZnCl2、CaCl2、BaCl2、FeCl3、NiCl2、CuCl2、PbCl2、MnCl2、CrCl3、CoCl2、HgCl2、AgNO3、EDTA,用1 mol/L,pH为7.3的2-[4-(2-羟乙基) -1-哌嗪基]乙磺酸缓冲溶液配制成3 mmol/L的溶液。用乙腈水溶液[V(水)∶V(乙腈)=1∶4]配制浓度为0.3 mmol/L的探针R溶液保存备用。
1.2.3 探针离子选择性的研究
取15支洁净的5 mL离心管,用移液枪移取配制好的探针R溶液250 μL、乙腈水溶液[V(水)∶V(乙腈)=1∶4] 2.7 mL于每支离心管中。取1支离心管加入50 μL超纯水作为空白参比,剩下14支离心管中各自加入50 μL不同的金属离子溶液,摇匀静置,待反应一段时间后,观察变化。依次测量紫外吸收和荧光发射,记录好数据[23]。
1.2.4 探针离子干扰性的研究
经实验1.2.3后发现,加入Fe3+后探针溶液有明显的变化。因此在实验1.2.3的基础上,往14支含有不同金属离子的离心管中,分别加入50 μL Fe3+溶液,摇匀静置,反应一段时间,观察实验现象,并依次测量紫外吸收和荧光发射,记录好数据[24]。
1.2.5 探针灵敏度的研究
用移液枪分别移取300 μL的探针溶液于16支离心管中,然后以10 μL为梯度依次加入0~150 μL的Fe3+溶液,同样以10 μL的梯度在上述离心管中加入2.7~2.55 mL的乙腈水溶液,保证每支离心管中溶液总体积为3 mL,摇匀静置待反应充分后,依次测量紫外吸收和荧光发射,记录数据。并用空白样测出标准差σ,从而计算Fe3+的检出限。
1.2.6 探针与铁离子反应机理的研究
在1.2.3实验中加入Fe3+溶液的离心管中加入过量的EDTA溶液,静置一段时间观察溶液颜色的变化,然后测量混合溶液在最强吸收峰582 nm处的吸光度,在最大荧光发射波长610 nm处的荧光强度。然后用移液枪分别移取2.7 mL的乙腈水溶液加入11支离心管中。并以30 μL为梯度交错加入探针R溶液和Fe3+溶液,即Fe3+溶液体积从0 μL到300 μL变化,探针R溶液对应从300 μL到0 μL的体积变化。反应一段时间后,分别测量最大吸收峰582 nm处的吸光度和最大荧光发射波长610 nm处的荧光强度变化[26]。
1.2.7 探针细胞成像的研究
在6孔板上进行HeLa细胞的培养,用加有10% FBS和1%青霉素/链霉素的DMEM培养基,37 ℃,5% CO2氛围培养24 h,待细胞密度达到50%~60%后,用5 μmol/L探针R溶液进行孵育,5 h后取出用PBS溶液进行洗涤,再与10 μmol/L Fe3+溶液继续孵育2 h,取出后用PBS溶液洗涤,在倒置荧光显微镜下进行观察[27]。
2 结果与分析
2.1 探针的离子选择性
图2显示探针R溶液在不同金属离子加入后出现了颜色和荧光的变化。其中加入Fe3+的溶液显示出明显的玫红色,其他溶液无肉眼可见的变化。加入Fe3+的溶液在365 nm的紫外灯光照射下,呈现明亮的粉红色荧光,Al3+、Pb2+、Cr3+有极微弱的粉色荧光,其他金属离子的溶液无明显荧光。

A-可见光照射;B-365 nm紫外光照射
图2 加入不同金属离子的R溶液
Fig.2 R solutions after adding different metal ions
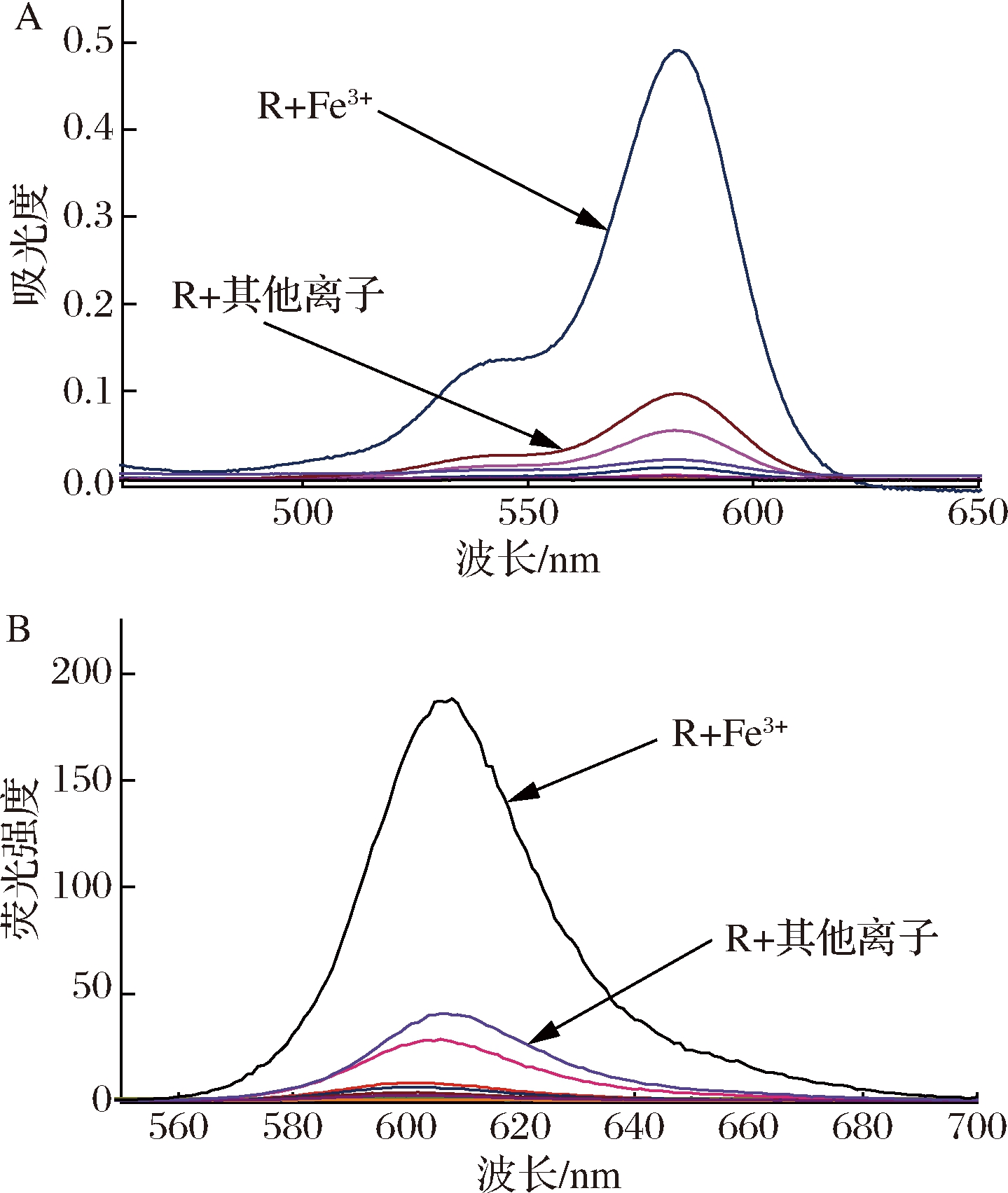
通过紫外可见吸收光谱和荧光发射光谱(图3)可知,加入Fe3+的探针溶液相对其他金属离子有明显的紫外吸收峰和荧光发射峰,最大紫外吸收峰为582 nm,最强荧光发射峰为610 nm,说明探针R对Fe3+具有明显的选择性。
A-紫外可见吸收光谱;B-荧光发射光谱
图3 不同金属离子存在下R溶液的紫外可见吸收光谱和荧光发射光谱
Fig.3 UV-Vis spectra and the fluorescence spectra of R under different metal ions
2.2 探针的离子干扰性
为进一步证明探针R对Fe3+的高选择性,在2.1离子选择性实验中除Fe3+外的14根含其他离子的离心管中加入相同量的Fe3+溶液,静置反应后均呈现出与Fe3+相同的实验现象。由图4可知,各混合体系的吸光度和荧光强度基本一致,说明探针R对Fe3+的响应不受其他金属离子的影响,具有良好的抗干扰性。
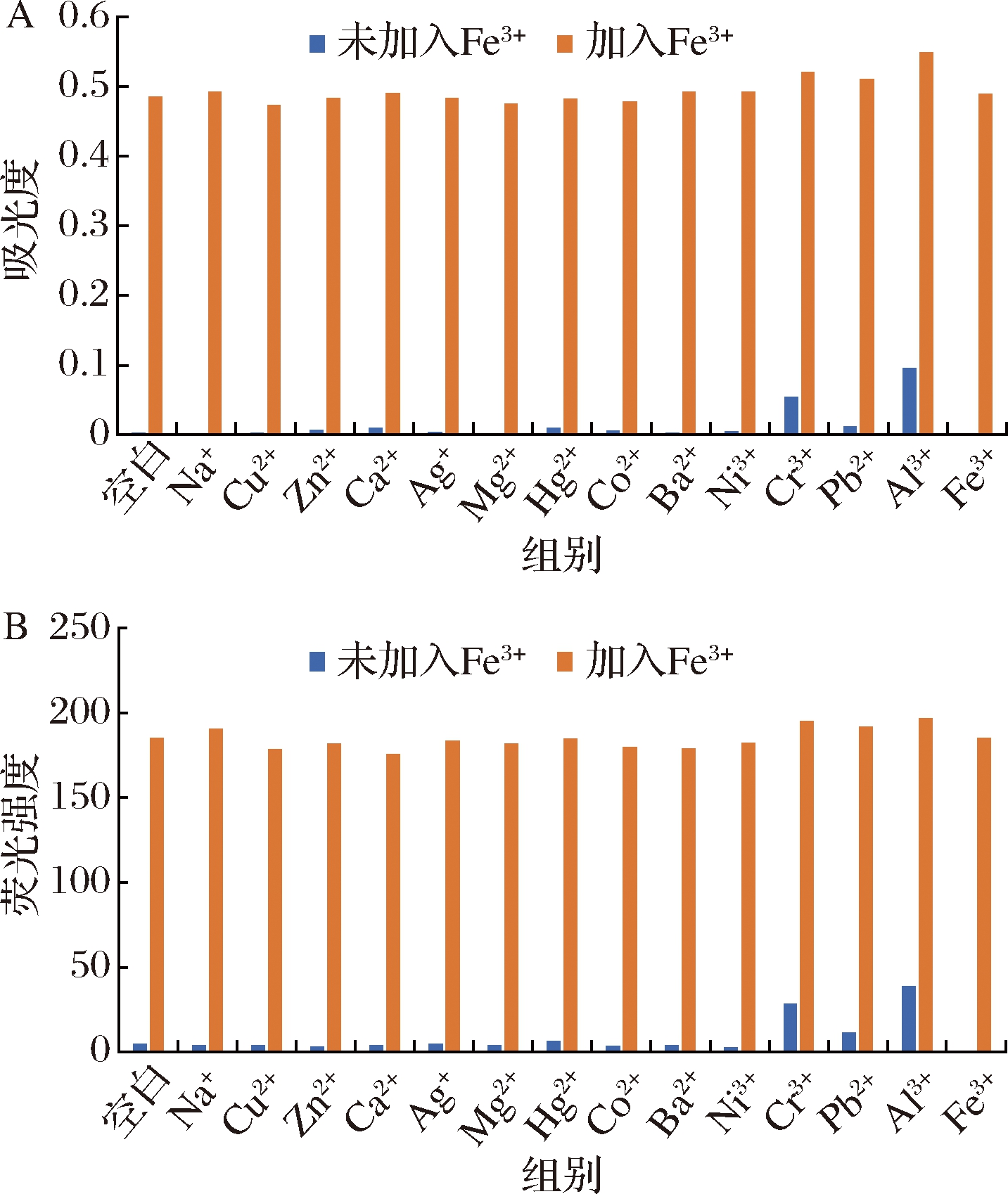
A-可见吸收光谱;B-荧光发射光谱
图4 紫外可见吸收的灵敏度
Fig.4 Sensitivity of UV-Vis spectra
2.3 探针的灵敏度
从图5-A可以看出,随着Fe3+浓度的升高,582 nm 处的吸光度值也在不断的增大,取不同浓度对应的最大吸光度,绘制紫外吸收峰值,如图5-B所示,当Fe3+浓度在40~110 μmol/L时,具有良好的线性关系,对此区间进行线性拟合得回归方程:Y=0.019 5X-0.688 86,R2值为0.999 37。
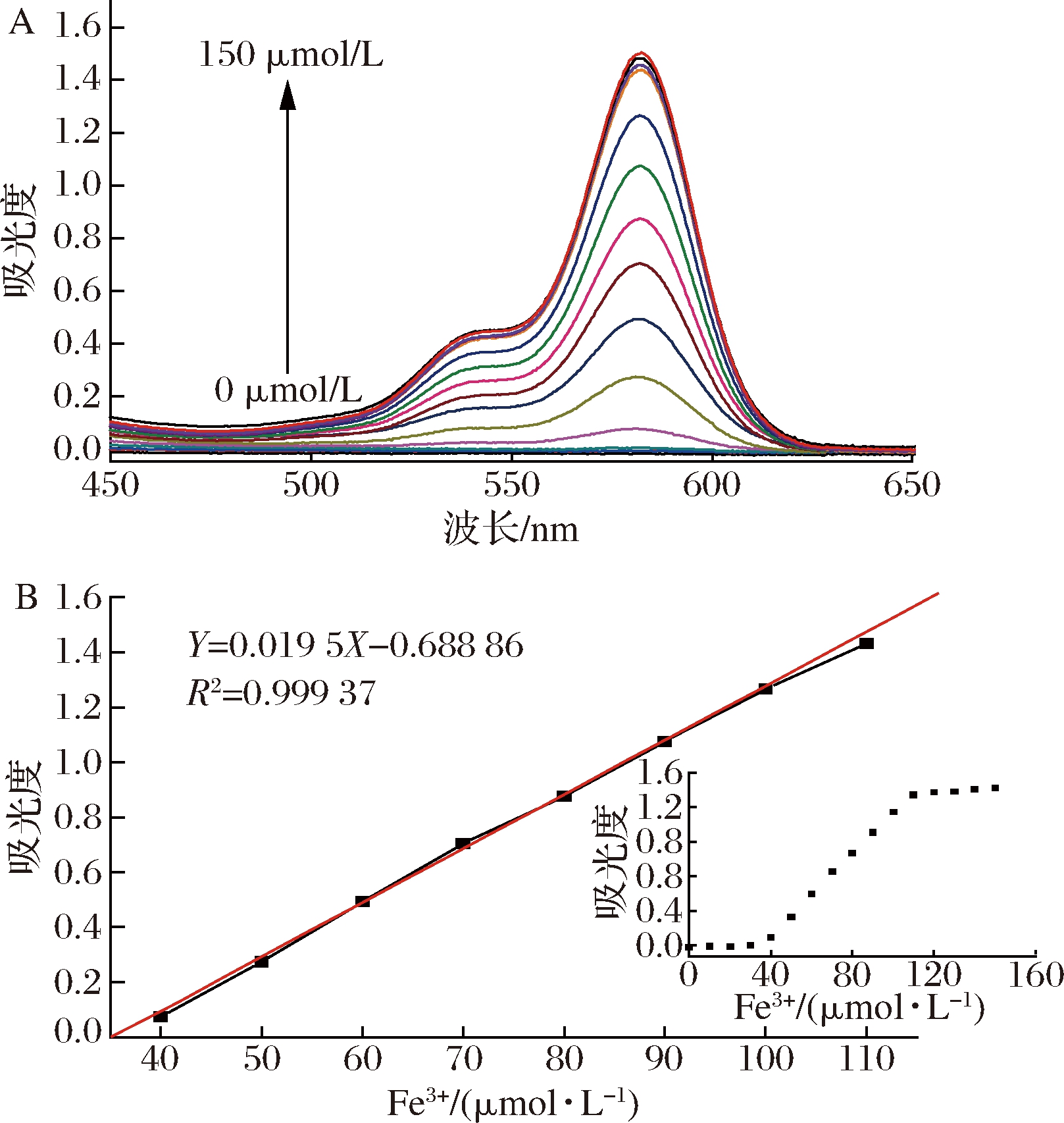
A-不同Fe3+浓度下R溶液的可见吸收光谱;B- R在582 nm处吸光度的线性拟合
图5 R荧光发射的灵敏度
Fig.5 Sensitivity of fluorescence spectra
由图6-A可知,当Fe3+浓度升高,610 nm处的荧光发射强度也在逐渐增强,取不同浓度对应的最大荧光强度,绘制荧光发射峰值(图6-B),同样在 40~110 μmol/L,具有良好的线性关系,对此区间进行线性拟合得回归方程:Y=6.433 02X-201.146 43,R2值为0.996 30。
Fe3+检出限计算如公式(1)所示:
检出限![]()
(1)
式中:σ为空白样的标准差,k为回归方程的斜率。结果表明,该体系中探针对Fe3+的紫外检出限为49.2 nmol/L,荧光检出限为135.7 nmol/L,远低于GB 5749—2006《生活饮用水卫生标准》中含量(0.3 mg/L),说明R能有效的进行食品安全等领域中Fe3+含量的检测。
2.4 探针与铁离子反应机理
探针R与Fe3+溶液混合发生反应后,出现颜色变化,且有荧光响应,如图7所示,在582 nm处出现最大吸收峰,而继续加入EDTA后,静置一段时间,混合液颜色褪去,同时荧光猝灭,582 nm处吸收峰强度明显减弱,且该过程可逆,由此可以推断反应机理是与罗丹明母体结构中环内酰亚胺的开闭环有关。探针R处于螺环状时,溶液为淡黄色,加入Fe3+后发生络合配位,出现颜色反应及荧光响应。由于EDTA与金属离子的结合能力很强,所以当加入EDTA溶液后Fe3+被络合,探针溶液又恢复初始的状态。

A-可见吸收光谱;B-荧光发射光谱
图6 络合反应的紫外可见吸收光谱
Fig.6 UV- Vis spectra of complexation reaction

图7 Fe3+以及含EDTA的Fe3+存在下R溶液的紫外可见吸收光谱
Fig.7 UV-Vis spectra of R after adding Fe3+ with and without EDTA
利用等摩尔连续变化法实验来确定金属离子与探针的络合比例关系。如图8所示,当Fe3+的摩尔分数约0.33时,在582 nm处出现最大紫外可见光吸收峰,同时在610 nm处荧光发射峰出现最大值,因此不论紫外可见吸收光谱还是荧光发射光谱均表明,探针与Fe3+是以2∶1的络合比结合,则可推测出该反应可能的反应机理如图9所示。
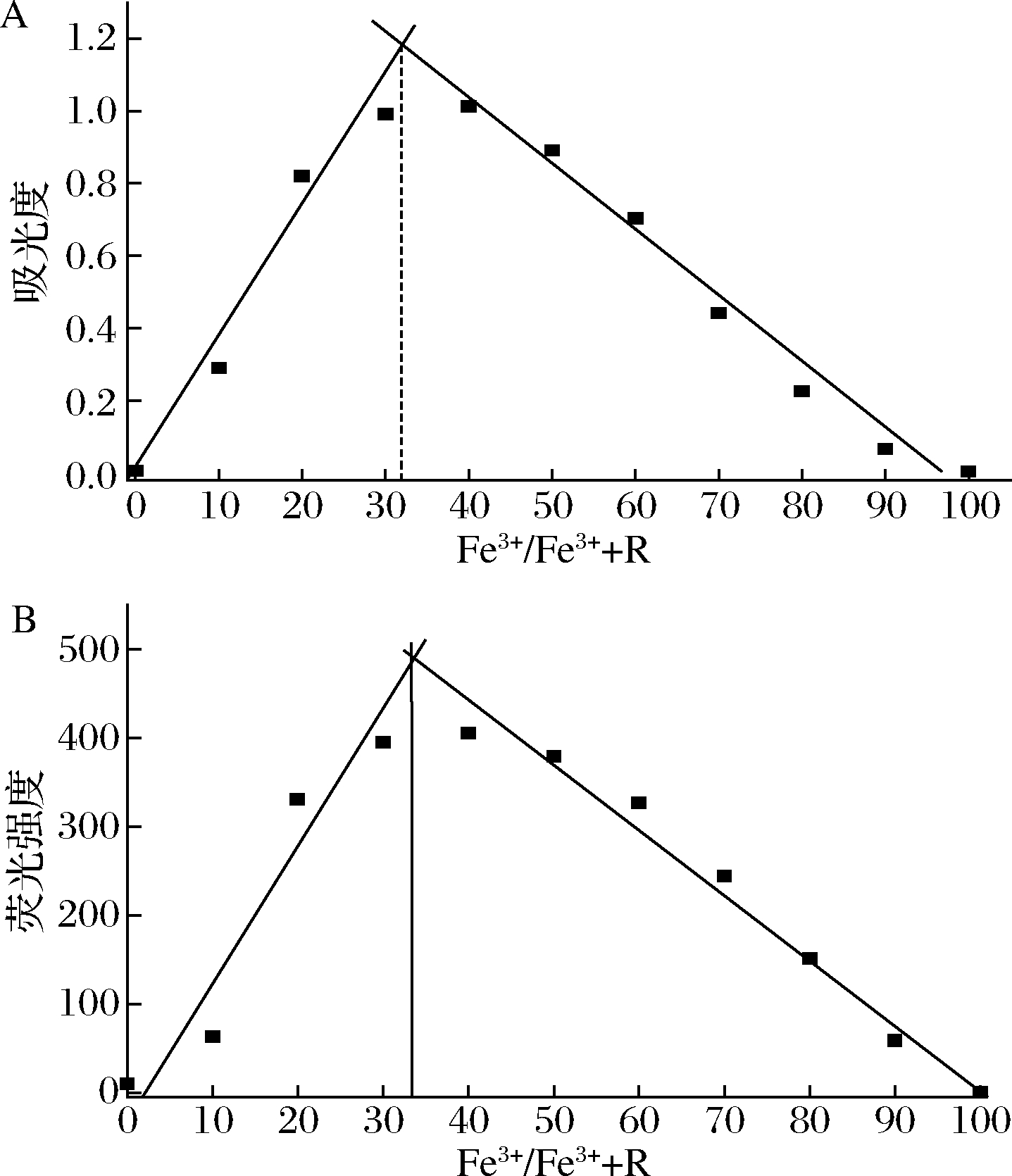
A-紫外吸收;B-荧光发射
图8 R与Fe3+作用络合比例
Fig.8 Combination ratio of R and Fe3+
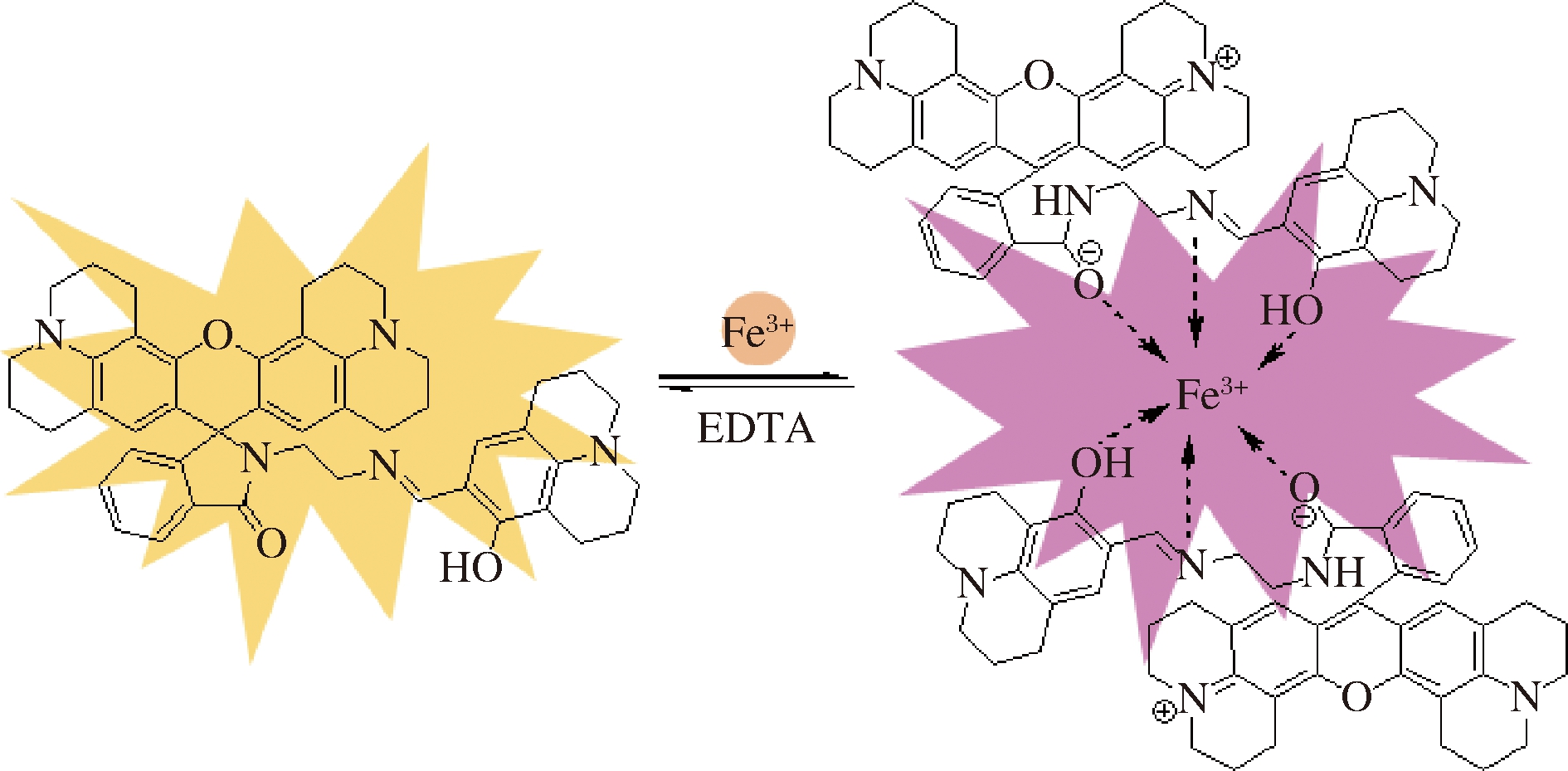
图9 R与Fe3+的反应机理
Fig.9 Reaction mechanism of R and Fe3+
2.5 探针的细胞成像
利用荧光成像技术研究了探针R在细胞内的检测能力。如图10所示,当探针R与Fe3+溶液依次加入到细胞中进行孵育后,可以观察到明显的红色荧光,说明探针R可以顺利被HeLa细胞吸收,同时能与Fe3+在细胞内进行反应,产生具有荧光信号的配合物R-Fe3+。
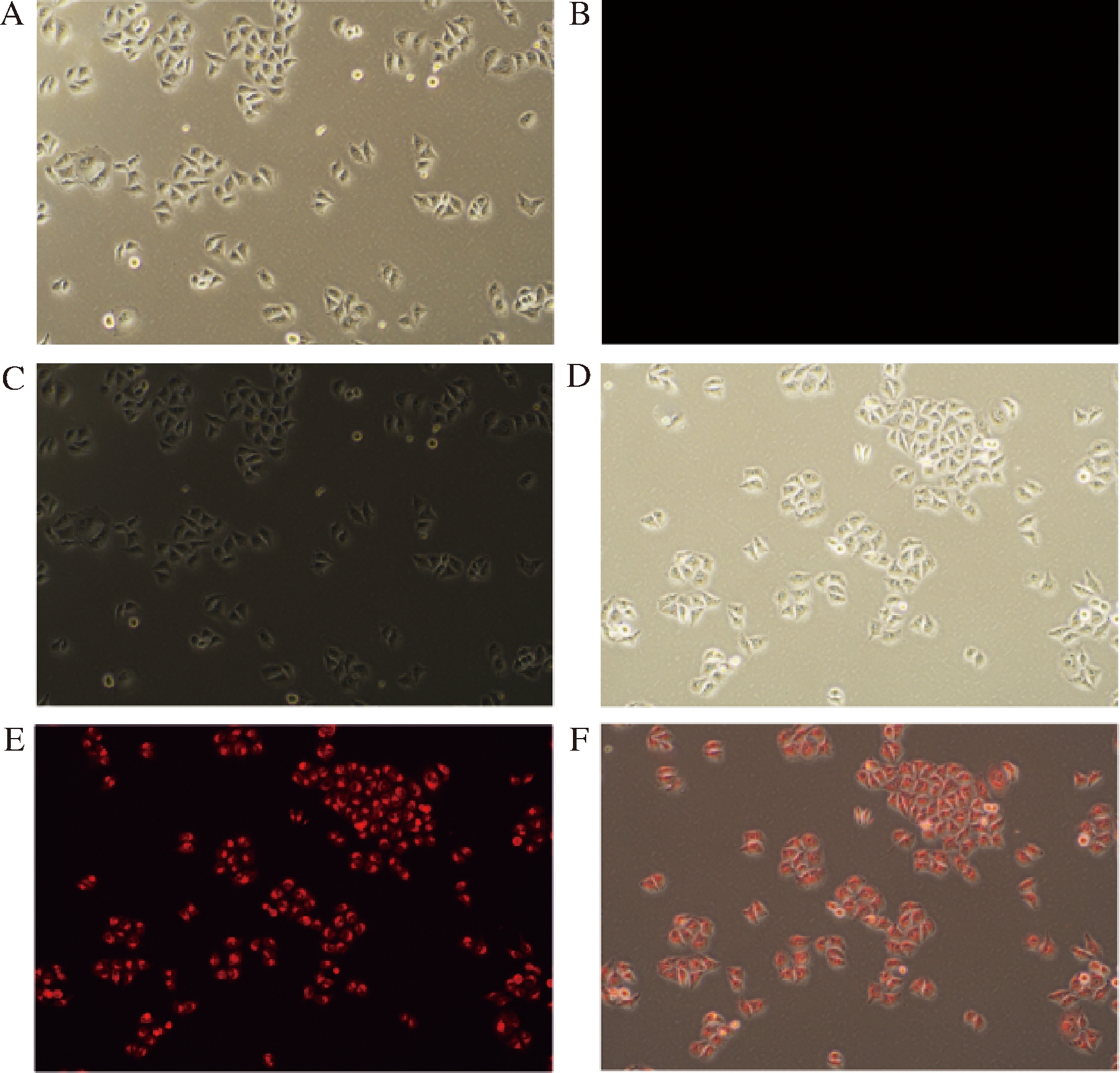
A-用R孵育的Hela细胞的相位对比图像;B-用R孵育的Hela细胞的荧光显微图像;C-A-B重叠图像;D-用R+Fe3+孵育的Hela细胞的相位对比图像;E-用R+Fe3+孵育的Hela细胞的荧光显微图像;F-D-E重叠图像
图10 R的细胞荧光成像
Fig.10 Cell fluorescence imaging of R
3 结论
本实验以罗丹明101、乙二胺和8-羟基久洛尼定为原料,合成了探针R。探针性能实验表明,不论紫外吸收还是荧光发射,R对Fe3+均能有很好的响应,且有较强的抗干扰能力,其紫外可见光谱的检测限为49.2 nmol/L,荧光光谱的检测限为135.7 nmol/L,是一种能有效识别Fe3+的可视化荧光探针。EDTA实验证明R对Fe3+的响应是通过络合原理进行的,等摩尔连续变化法实验确定了R与Fe3+的络合比为2∶1。远低于生活饮用水卫生标准的响应度及活细胞成像,表明该探针在检测食品、环境、生物等领域中Fe3+含量具有潜在的应用前景。
[1] 汪学荣, 郑炯, 阚建全.铁代谢及生理功能研究进展[J].粮食与油脂, 2008,21(11):47-49.
WANG X R, ZHENG J, KAN J Q, Study progress on metabolism and physiological function of iron[J].Journal of Cereals & Oils, 2008,21(11):47-49.
[2] PUIG S, RAMOS A L, ROMERO A M, et al.The elemental role of iron in DNA synthesis and repair[J].Metallomics, 2017, 9(11):1 483-1 500.
[3] 管玲娟, 曹丛丛, 屠飘涵, 等.缺铁对肠道免疫功能的影响及新型补铁剂的研究进展[J].食品与发酵工业, 2020, 46(19):264-270.
GUAN L J, CAO C C, TU P H, et al.Research progress of the effect of iron deficiency on intestinal immune function and new iron supplements[J].Food and Fermentation Industries, 2020, 46(19):264-270.
[4] 陈宣承, 李红领, 李海涛.膳食血红素铁促进结直肠癌变机制初探[J].食品与发酵工业, 2022, 48(1):91-97.
CHEN X C, LI H L, LI H T.A preliminary study on the mechanism of dietary heme in promoting colorectal cancer[J].Food and Fermentation Industries, 2022, 48(1):91-97.
[5] KIETZMANN T.Liver zonation in health and disease:Hypoxia and hypoxia-inducible transcription factors as concert Masters[J].International Journal of Molecular Sciences, 2019, 20(9):2347.
[6] 傅晓颖, 邓晓敏, 彭佳媛, 等.铁离子对视网膜光损伤的毒性作用研究进展[J].中国中医眼科杂志, 2022, 32(2):133-136.
FU X Y, DENG X M, PENG J Y, et al.Research progress of iron ions in retinal light damage[J].Chinese Journal of Chinese Ophthalmology, 2022, 32(2):133-136.
[7] EVERETT J, COLLINGWOOD J F, TJENDANA T V, et al.Nanoscale synchrotron X-ray speciation of iron and calcium compounds in amyloid plaque cores from Alzheimer′s disease subjects[J].Nanoscale, 2018, 10(25):11 782-11 796.
[8] 郭爽, 陈凤燕, 尹香, 等.铁离子失衡在阿尔茨海默病发病机制中的作用研究进展[J].中国全科医学, 2022, 25(3):373-379.
GUO S, CHEN F Y, YIN X, et al.Developments in the role of iron imbalance in the pathogenesis of Alzheimer′s disease[J].Chinese General Practice, 2022, 25(3):373-379.
[9] 胡述容. 食品中铁测定法的研究[J].食品与发酵工业, 1988,14(5):34-40;21.
HU S R.Study on the method for determination of iron in foods[J].Food and Fermentation Industries, 1988,14(5):34-40;21.
[10] 党翠红, 燕群.火焰原子吸收光谱法测定食品中铁的方法学验证[J].食品工业, 2022, 43(2):312-315.
DANG C H, YAN Q.Methodological verification for determination of iron in food by flame atomic absorption spectrometry[J].The Food Industry, 2022, 43(2):312-315.
[11] 张虹艳, 丁武, 吴福祥, 等.自动石墨消解-电感耦合等离子体质谱法监测干制水产品中的铅、砷、铝、铬、铁、铜[J].食品与发酵工业, 2019, 45(3):266-269.
ZHANG H Y, DING W, WU F X, et al.Automatic graphite digestion and inductively coupled plasma mass spectrometry for monitoring lead,arsenic,aluminum,chromium,iron,and copper in dried aquatic products[J].Food and Fermentation Industries, 2019, 45(3):266-269.
[12] 陈双, 朱晨华, 谭亚军, 等.有机溶剂溶解法结合电感耦合等离子体发射光谱法直接测定软胶囊剂型保健食品中的钙和铁[J].食品安全质量检测学报, 2022, 13(5):1 560-1 566.
CHEN S, ZHU C H, TAN Y J, et al.Direct determination of calcium and iron in soft capsule health food by organic solvent dissolution combined with inductively coupled plasma optical emission spectrometry[J].Journal of Food Safety & Quality, 2022, 13(5):1 560-1 566.
[13] 程海星, 郭月英, 任霆, 等.实时荧光定量PCR技术原理及在食品检测中的应用[J].食品与发酵工业, 2015, 41(3):243-247.
CHENG H X, GUO Y Y, REN T, et al.Principle and application of fluorogenic real-time PCR in food detection[J].Food and Fermentation Industries, 2015, 41(3):243-247.
[14] TIAN Z D, LIU Y C, TIAN B Z, et al.Synthesis and proton-induced fluorescence “OFF-ON” switching of a new D-π-A type pyran dye[J].Research on Chemical Intermediates, 2015, 41(2):525-533.
[15] CHEN X Q, PRADHAN T, WANG F, et al.Fluorescent chemosensors based on spiroring-opening of xanthenes and related derivatives[J].Chemical Reviews, 2012, 112(3):1 910-1 956.
[16] 常晓曦, 王佳, 宋杨, 等.纳米金-罗丹明B协同作用在食品安全快速检测中的研究概述[J].食品与发酵工业, 2019, 45(6):243-248.
CHANG X X, WANG J, SONG Y, et al.Research progress on the application of gold nanoparticles together with rhodamine B in rapid detection for food safety[J].Food and Fermentation Industries, 2019, 45(6):243-248.
[17] 李宏达, 周莹健, 吴晓璟, 等.罗丹明B并甘氨酸甲酯Turn-On型Fe3+荧光探针的合成及应用[J].化学研究与应用, 2022, 34(4):795-801.
LI H D, ZHOU Y J, WU X J, et al.Synthesis and application of turn-On Fe3+-fluorescent probe based on rhodamine B-glycine methyl ester[J].Chemical Research and Application, 2022, 34(4):795-801.
[18] 杨俊卿, 吴芳辉, 罗祥瑞, 等.对Zn2+及S2-连续响应的罗丹明B酰肼类荧光探针的研究[J].分析测试学报, 2019, 38(10):1 265-1 269.
YANG J Q, WU F H, LUO X R, et al.Detection of zinc ion and sulfion using a rhodamine B hydrazide fluorescent probe based on sequential response[J].Journal of Instrumental Analysis, 2019, 38(10):1 265-1 269.
[19] 徐海燕, 刘媛.构建碳点-罗丹明B比率探针检测汞离子污染[J].北京师范大学学报(自然科学版), 2019, 55(6):700-708.
XU H Y, LIU Y.A dual emission ratiometric probe for mercury ion[J].Journal of Beijing Normal University(Natural Science), 2019, 55(6):700-708.
[20] 宋方方, 赵岗, 光善仪, 等.一种新型罗丹明基衍生物分子的合成[J].合成化学, 2018, 26(11):833-835.
SONG F F, ZHAO G, GUANG S Y, et al.Synthesis of a novel rhodamine-based derivative molecule[J].Chinese Journal of Synthetic Chemistry, 2018, 26(11):833-835.
[21] 代婉婷, 张军, 杨梅, 等.基于罗丹明B的光“关-开”型Fe3+荧光探针的构建研究[J].化学试剂, 2021, 43(7):963-967.
DAI W T, ZHANG J, YANG M, et al.Construction of a Highly Selective “off-on” Type Fe3+-fluorescent probe derived from rhodamine B[J].Chemical Reagents, 2021, 43(7):963-967.
[22] LI C J, XIANG K Q, LIU Y C, et al.A novel colorimetric chemosensor for Cu2+ with high selectivity and sensitivity based on Rhodamine B[J].Research on Chemical Intermediates, 2015, 41(12):10 169-10 180.
[23] 张玲菲, 赵江林, 曾晞, 等.苯基乙酰丙酮-罗丹明B衍生物的合成及对Fe3+离子的识别性质研究[J].无机化学学报, 2010, 26(10):1 796-1 803.
ZHANG L F, ZHAO J L, ZENG X, et al.Synthesis of phenyl-acetylacetone rhodamine B derivative and recognition properties for Fe3+[J].Chinese Journal of Inorganic Chemistry, 2010, 26(10):1 796-1 803.
[24] 黄怡, 杨美盼, 张卫红, 等.罗丹明类Schiff碱荧光探针对Fe3+的特异性识别研究[J].化学研究与应用, 2018, 30(1):88-94.
HUANG Y, YANG M P, ZHANG W H, et al.The study of a highly selective rhodamine Schiff base probe for Fe3+[J].Chemical Research and Application, 2018, 30(1):88-94.
[25] 李长江, 李晴, 张莉艳, 等.基于“开-闭”环的铁离子探针的合成及性能研究[J].食品与发酵工业, 2020, 46(13):107-113.
LI C J, LI Q, ZHANG L Y, et al.Synthesis and properties of Fe3+ probe based on ring-opening and ring-closing[J].Food and Fermentation Industries, 2020, 46(13):107-113.
[26] ZHOU Q, QIAN L, PAN Q Q, et al.A novel chemosensor for Fe3+ based on open-closed-loop mechanism and imaging in living cells[J].Research on Chemical Intermediates, 2020, 46(1):533-545.
[27] OZDEMIR M, ZHANG Y, GUO M L.A highly selective “off-on” fluorescent sensor for subcellular visualization of labile iron(Ⅲ) in living cells[J].Inorganic Chemistry Communications, 2018, 90:73-77.