桑枝为桑科植物桑(Morus alba L.)的干燥嫩枝[1],地方上也习用同属植物鸡桑(M.australis Poir.)和华桑(M.cathayana Hemsl.)的干燥嫩枝入药作桑枝[2],味微苦,归肝经,具有祛风湿,利关节的功效,常被用于治疗风湿麻痹,关节疼痛以及四肢麻木等症状[1]。在我国早期的医疗书籍中也有大量关于桑枝疗效的记录,如《本草撮要》中就记载“桑枝,功专去风湿拘挛”[3],《本草再新》中记载桑枝具有“壮肺气,燥湿,滋肾水,通经”等疗效[4],是自古以来民间常用的中药材。桑枝中的主要药效成分为黄酮类、生物碱类、有机酸、挥发油,以及氨基酸等[5-7],具有降血糖、降血脂、抗氧化、消炎、抗菌等显著作用[8-9]。
长期以来,关于桑枝入药质量的研究集中在其主要的药效成分[7-9]。近几年来,人们就中医药学的相关理论与药物中微量元素对人体作用之间的关系展开了大量的临床试验与研究,结果表明,中药材的药效与其所含微量元素的含量及种类有较大关系[10]。部分元素是中药材中有效成分的重要组成单元,具有促进药物疗效的功能[11],因此成为了评价中药材质量的重要参数以及中药材疗效的物质基础[12-13]。同时,中药材中重金属超标现象也越来越突出,严重影响了中药材的安全性,成为了制约中药材走出国门并在全世界进行推广的重要因素[14]。
目前对于无机元素的测定方法主要有原子吸收光谱法(atomic absorption spectroscopy,AAS)[15]、原子荧光光谱法(atomic fluorescence spectroscopy,AFS)[16]、电感耦合等离子体原子发射光谱法(inductively coupled plasma atomic emission spectroscopy,ICP-AES)[17]、以及电感耦合原子发射光谱法(inductively coupled plasma optical emission spectroscopy, ICP-OES)[18]、电感耦合等离子体质谱法(inductively coupled plasma-mass spectrometry, ICP-MS)法[19]等。其中AAS法耗时较长、效率低,具有较强的基体效应,对检测结果有一定的影响[20]。AFS法目前被广泛应用于食品中汞和总砷的测定,是我国强制使用的方法。ICP-MS法因具有较高的灵敏度、低检出限(可达ng/mL甚至更低),干扰少,能同时测定不同含量级别的多种元素[21]而被广泛应用。在无机元素测定时待测样品制取过程中,微波消解法相较于灰化法和湿法消解法具有耗时少、操作简单、外来污染小等优点[22]。目前,关于桑枝中主要药效成分以外的矿质元素的研究还鲜有报道,其与桑枝药材中有效活性成分的相互作用以及对桑枝药效及安全性的影响也并不清楚。因此,研究不同种类及产地桑枝中矿质元素含量及组成结构对桑枝药材质量及安全性的评价就显得格外重要。
本研究以采自重庆不同区县9个采样点、3个种类共计18批次的桑枝作为样本,采用凯氏定氮法、AFS法、ICP-MS法与微波消解法相结合,对这18批不同种类桑枝中的25种元素(N、Ca、K、P、Mg、Al、Fe、Zn、Cu、Sr、Ba、Mn、Na、B、Pb、Ni、Cr、Mo、Sn、Co、As、Se、Cd、Sb、Hg)的含量进行测定分析,并进行主成分分析和聚类分析,以此对9个产地、3个种类的18批桑枝进行质量和安全性评价,为桑枝的后期研究及综合利用、资源开发、药用价值开发提供理论数据依据及参考。
1 材料与方法
1.1 材料
实验所用桑枝于2018年10月采集自重庆市9个采样点、3个种类,共计18批次,经鉴定为桑科桑属植物桑(M.alba L.)、鸡桑(M.australis Poir.)和华桑(M.cathayana Hemsl.)的嫩枝。样品具体信息详见表1。将采摘的新鲜桑枝用蒸馏水洗净后切段,置于45 ℃恒温鼓风干燥箱中,烘干至恒重,粉碎后过三号筛,备用。
表1 采样地点及物种信息
Table 1 Sampling location and species information
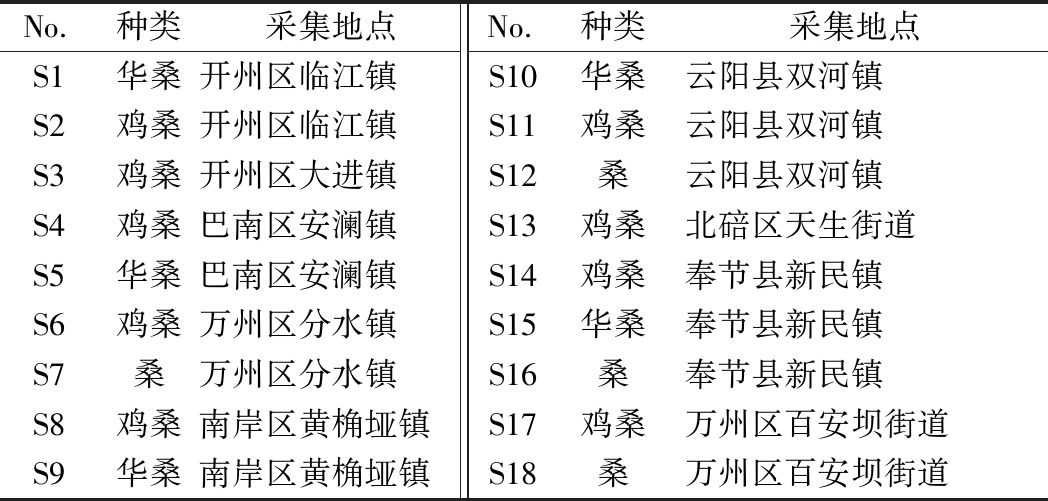
No.种类采集地点No.种类采集地点S1华桑开州区临江镇S10华桑云阳县双河镇S2鸡桑开州区临江镇S11鸡桑云阳县双河镇S3鸡桑开州区大进镇S12桑云阳县双河镇S4鸡桑巴南区安澜镇S13鸡桑北碚区天生街道S5华桑巴南区安澜镇S14鸡桑奉节县新民镇S6鸡桑万州区分水镇S15华桑奉节县新民镇S7桑万州区分水镇S16桑奉节县新民镇S8鸡桑南岸区黄桷垭镇S17鸡桑万州区百安坝街道S9华桑南岸区黄桷垭镇S18桑万州区百安坝街道
1.2 试剂
24种单元素标准溶液(1 000 μg/mL):Hg(B2101079)、Mg(21012)、Al(B21050414)、As(B2103508)、Cd(B21120277)、Fe(B21040025)、Ni(B21060160)、Sr(B21050485)购自坛墨质检科技股份有限公司,K(20102)、Ca(20116)、Na(21061)、P(20041),购自中国计量科学研究院;Cr(217004)、B(210731)、Mn(216004)、Co(217026)、Cu(217008)、Zn(217009)、Se(210818)、Mo(210803)、Sn(210729)、Sb(216021)、Ba(215055),购自国家有色金属及电子材料分析测试中心;Pb(P2-PB684758)购自美国INORGANIC公司;HNO3(MOS级),北京化学试剂研究所;实验用水为去离子超纯水;硫酸(分析纯),重庆川东化工有限公司;实验过程中所用到的玻璃仪器均在10%(体积分数)硝酸溶液中浸泡过夜后用去离子超纯水冲洗干净,于恒温干燥箱45 ℃烘干后冷却至室温备用。
1.3 仪器与设备
MILLI Q Advantage A10超纯水机,美国 MILLIPORE公司;ME204T/02电子天平,梅特勒-托利多仪器有限公司;ICAP-Q电感耦合等离子体质谱仪,德国赛默飞世尔科技有限公司;CEM MARS 6微波消解仪,美国CEM公司;Kjeltec 8400全自动凯氏定氮仪,丹麦FOSS分析仪器公司;赶酸器,上海博通化学科技有限公司;AFS-9730原子荧光分光光度计,北京海光仪器有限公司。
1.4 实验方法
1.4.1 样品溶液的制备
氮元素的测定溶液:精密称取桑枝粉末0.50 g,参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的方法制备样品测定溶液,全自动凯氏定氮仪法测定桑枝样品中的N元素含量。
各元素的测定溶液:精密称取桑枝样品粉末0.20 g于聚四氟乙烯消解管中,加入8 mL浓硝酸后密封,浸泡过夜,对桑枝样品进行预消解,随后将消解管置于微波消解仪中进行消解(消解条件:功率1 600 W,温度180 ℃,升温时间20 min,保持时间10 min,冷却时间20 min)。冷却后取出消解管,汞元素测定溶液是将消解管内的消解液转移至25 mL容量瓶内,用去离子超纯水少量多次冲洗消解管,洗液与容量瓶中的消解液合并后定容至刻度,摇匀,待上机检测。同时做试剂空白。其余元素测定溶液是冷却后将消解管开盖,在通风橱内置于赶酸器中以120 ℃将硝酸挥尽,转移至25 mL容量瓶中并用去离子超纯水定容至刻度,摇匀,待上机检测。同时做试剂空白。其中所有批次样品中K、Ca、P元素的测定需将测定溶液稀释25倍后上机,所有批次样品中Mg元素的测定需将测定溶液稀释3倍后上机,测定Al、Cu、Zn、Sr元素时需将部分批次样品的测定溶液稀释2倍后上机,其余元素无需稀释。
1.4.2 标准工作溶液的制备
分别精密吸取各种元素标准溶液适量,用5%(体积分数)硝酸溶液逐级稀释,配制成质量浓度分别为0、0.4、0.8、1.6、2.4 μg/L的Hg溶液和质量浓度为0、1、5、10、30、50 μg/L的As溶液供原子荧光光度计分析。混合标准工作液1:Cr、Cd、Pb、Co、Ni、Se质量浓度为0、1、5、10、30、50 μg/L,Mg、K、Ca质量浓度为0、80、400、800、2 400、4 000 μg/L,Al质量浓度为0、20、100、200、600、1 000 μg/L;混合标准工作液2:Na、P、Fe质量浓度为0、40、200、400、1 200、2 000 μg/L,B、Mn、Cu、Zn、Sr、Ba质量浓度为0、10、50、100、300、500 μg/L,Mo、Sn、Sb质量浓度为0、0.1、0.5、1、3、5 μg/L,供电感耦合等离子体质谱仪分析。
1.4.3 桑枝中元素的测定
采用全自动凯氏定氮仪测定N元素。全自动凯氏定氮仪工作参数:稀释液纯水体积50 mL,氢氧化钠溶液体积80 mL,接收液体积30 mL,结束蒸馏方式为自动蒸馏,终点体积为200 mL,样品管排空功能打开,盐酸标准滴定溶液浓度0.102 1 mol/L。
原子荧光光度计测定Hg、As。原子荧光光度计工作参数:光电倍增管负高压280 V,灯电流15 mA,原子化器高度10 mm,原子化器载气流量500 mL/min,屏蔽器流量1 000 mL/min,测量方式Std.curve,读数方式Peak Area,读数时间16 s,延迟时间4 s。
电感耦合等离子体质谱仪测定Cr、Cd、Pb、Co、Ni、Se、Mg、K、Ca、Al、Na、P、Fe、B、Mn、Cu、Zn、Sr、Ba、Mo、Sn、Sb。ICP-MS工作参数:射频功率1 550 W,等离子体气流量14 L/min,载气流量1.10 L/min,辅助气流量0.80 L/min,氦气流量4.79 mL/min,雾化室温度2.7 ℃,采样深度9 mm,重复次数为3次。
1.4.4 安全性评价
单项污染指数法按公式(1)进行计算:
(1)
式中:Pn为重金属元素的单项污染指数,Cn为重金属元素的测定值,Sn为重金属元素的限量标准值。其中根据《中华人民共和国药典》(2020版)一部对桑枝等植物药材中重金属及有害物质的限量标准值:Pb≤5.0 μg/g,As≤2.0 μg/g,Cu≤20.0 μg/g,Hg≤0.2 μg/g,Cd≤0.3 μg/g。Pn≤0.7为优良,0.7≤Pn≤1.0为安全,1.0<Pn≤2.0为轻污染,2.0<Pn≤3.0为中污染,Pn>3.0为重污染,Pn值越大,说明受到污染越严重[23]。
内梅罗综合指数法按公式(2)进行计算:
(2)
式中:P综合为综合污染指数,Pave为各单项污染指数的平均值,Pmax为各单项污染指数中的最大值。P综合≤0.7为优良,0.7<P综合≤1.0为安全,1.0<P综合≤2.0为轻污染,2.0<P综合≤3.0为中污染,P综合>3.0为重污染,P综合值越大,说明受到污染越严重[23]。
1.4.5 数据处理
采用WPS 表格软件对测得的数据进行处理,计算各元素的含量以平均值表示。采用SPSS 26.0软件对数据进行主成分分析和聚类分析。
2 结果与分析
2.1 方法学考察
2.1.1 方法的线性关系
将“1.4.2”中的不同质量浓度的标准工作液注入优化后的仪器中进行测定,ICP-MS工作站自动输入待测元素的浓度为横坐标、仪器响应值为纵坐标得出各元素的线性回归方程及线性关系,各元素的相关系数(R2)在0.999 2~1.000 0,结果表明各元素所用测定方法在各自线性范围内线性关系均良好,线性回归方程、线性范围以及相关系数详见表2。
表2 24种元素的线性回归方程、线性范围、相关系数
Table 2 Linear equation, linear rang and correlation coefficient of 24 elements
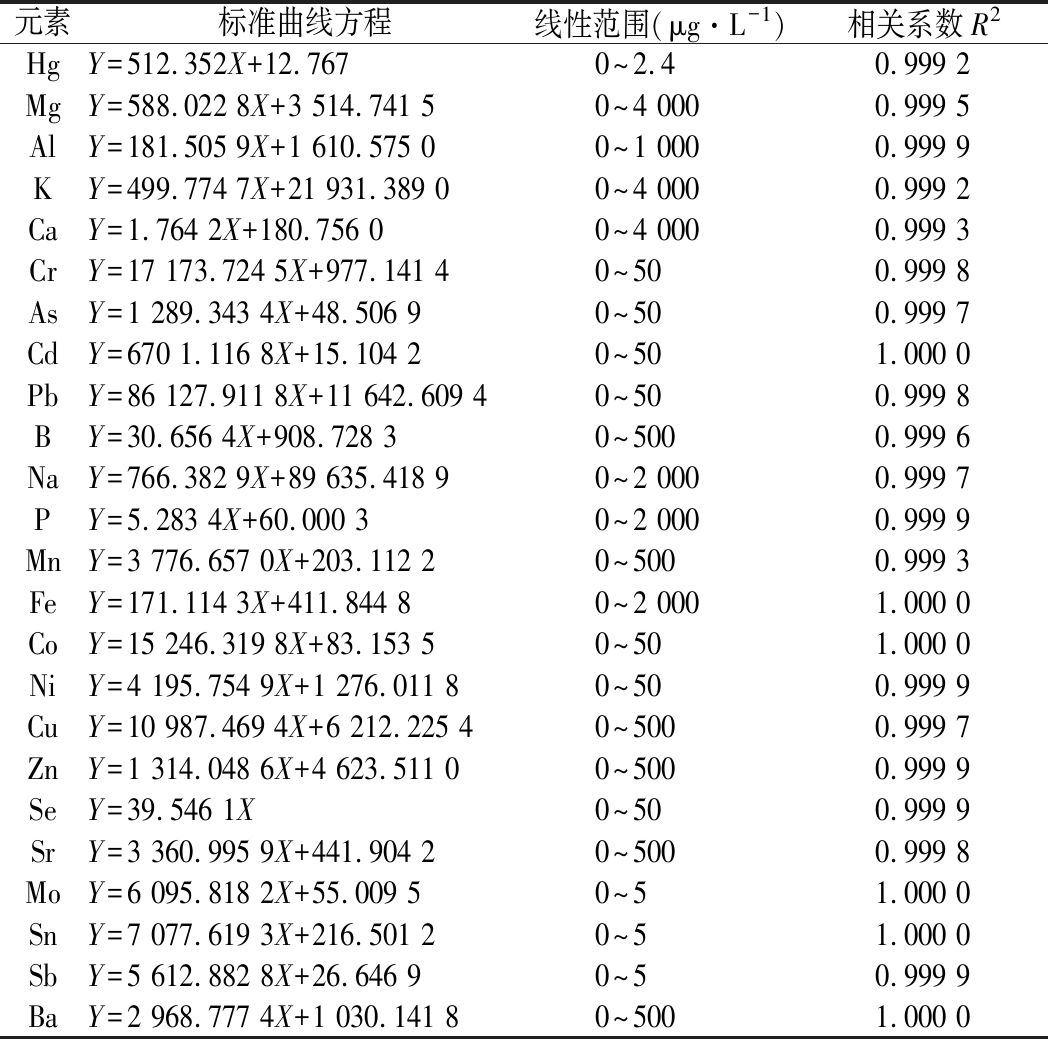
元素标准曲线方程线性范围(μg·L-1)相关系数R2HgY=512.352X+12.7670~2.40.999 2MgY=588.022 8X+3 514.741 50~4 0000.999 5AlY=181.505 9X+1 610.575 00~1 0000.999 9KY=499.774 7X+21 931.389 00~4 0000.999 2CaY=1.764 2X+180.756 00~4 0000.999 3CrY=17 173.724 5X+977.141 40~500.999 8AsY=1 289.343 4X+48.506 90~500.999 7CdY=670 1.116 8X+15.104 20~501.000 0 PbY=86 127.911 8X+11 642.609 40~500.999 8BY=30.656 4X+908.728 30~5000.999 6NaY=766.382 9X+89 635.418 90~2 0000.999 7PY=5.283 4X+60.000 30~2 0000.999 9MnY=3 776.657 0X+203.112 20~5000.999 3FeY=171.114 3X+411.844 80~2 0001.000 0 CoY=15 246.319 8X+83.153 50~501.000 0 NiY=4 195.754 9X+1 276.011 80~500.999 9CuY=10 987.469 4X+6 212.225 40~5000.999 7ZnY=1 314.048 6X+4 623.511 00~5000.999 9SeY=39.546 1X0~500.999 9SrY=3 360.995 9X+441.904 20~5000.999 8MoY=6 095.818 2X+55.009 50~51.000 0 SnY=7 077.619 3X+216.501 20~51.000 0 SbY=5 612.882 8X+26.646 90~50.999 9BaY=2 968.777 4X+1 030.141 80~5001.000 0
2.1.2 精密度试验
取同一标准工作液按照“1.4.3”条件平行测定6次,计算各元素浓度的相对标准偏差(relative standard deviation,RSD)值。结果显示各元素RSD值为0.58%~1.94%,结果表明仪器的精密度良好,适合桑枝中元素的测定分析。
2.1.3 重复性试验
精密称取桑枝样品粉末(S2)0.20 g,平行称取6份,按照“1.4.1”中的方法制备桑枝样品溶液,按照“1.4.3”条件测定并计算各元素含量的RSD值,结果显示各元素RSD值为0.65%~2.90%,结果表明方法重复性良好。
2.1.4 稳定性试验
取同一桑枝样品溶液(S2),按照“1.4.3”条件每隔0.5 h测定一次,结果显示各元素在5 h内RSD值在0.57%~2.96%,表明桑枝样品溶液在5 h内稳定性良好。
2.1.5 加标回收试验
精密称取已知各元素含量的桑枝样品粉末(S2)0.20 g各6份,分别加入各元素标准溶液适量,按照“1.4.1”制备桑枝样品溶液,按照“1.4.3”条件进行测定分析,计算回收率以及RSD值,结果显示各元素的平均回收率为96.32%~104.54%,RSD值为0.86%~2.82%,符合测定要求。
2.2 桑枝样品中25种元素的测定
取18批桑枝样品按照“1.4.1”方法制备桑枝样品溶液,每批平行3份,上机测定,结果详见表3。如表所示,18批桑枝中均检测出25种元素,但各元素的含量以及各样品间元素的含量差异较大。
N元素是生物体内构成蛋白质及核酸的基本元素,也是多种代谢产物的重要组成成分,因此N元素在生物体中的含量较高。18个批次不同产地及种类的桑枝中N元素含量平均为12.75 mg/g,其中含量最高的为巴南区安澜镇的鸡桑(S4),为21.75 mg/g,其次为万州区分水镇的桑(S7)和南岸区黄桷垭镇的鸡桑(S8),含量分别为16.61 mg/g和16.26 mg/g,最低为万州区分水镇的鸡桑(S6),为7.47 mg/g。不同种类桑枝之间N元素含量整体呈现为鸡桑>桑>华桑。
在重金属元素中,Hg的含量最低,含量在0.011 μg/g~0.036 μg/g,平均含量为0.022 μg/g,含量最高的为开州区临江镇的华桑(S1),最低的为开州区大进镇的鸡桑(S3);其次为Cd和As,含量在0.012 μg/g~0.179 μg/g和 0.052 μg/g~0.168 μg/g,平均含量分别为0.052 μg/g和0.099 μg/g,其中Cd元素含量最高的为开州区临江镇的鸡桑(S2),最低的为万州区分水镇的鸡桑(S6),As元素含量最高的为南岸区黄桷垭镇的鸡桑(S8),最低的为万州区分水镇的鸡桑(S6)。重金属元素中含量最高的为Cu,含量为29.20~99.34 μg/g,平均含量高达48.20 μg/g,含量最高的为奉节县新民镇的鸡桑(S14),最低的为巴南区安澜镇的华桑(S5);其次为其次为Pb,含量为1.50~5.10 μg/g,平均含量为2.66 μg/g,含量最高的为巴南区安澜镇的鸡桑(S4),最低的为万州区分水镇的鸡桑(S6)。Cu和Pb的含量在种类间差异较大,规律相同,整体呈华桑>鸡桑>桑。Cr和Cd在种类间含量的规律整体呈鸡桑>华桑>桑,Hg和As的含量在种类间差异不大。
在其余18种无机元素中,含量最高的为Ca,平均含量为13.23 mg/g,其次为K,平均含量为7.99 mg/g,仅次于K的元素为P和Mg,平均含量分别为2.62 mg/g和1.39 mg/g,其中巴南区安澜镇的鸡桑(S4)中的Ca和Mg均为最高的,分别为17.91 mg/g和2.27 mg/g。南岸区黄桷垭镇的鸡桑(S8)中的K最高,为12.70 mg/g。万州区百安坝街道的鸡桑(S17)中的P为最高,为5.28 mg/g。
微量元素中,Al的含量最高,平均含量为92.45 μg/g,18批样品之间Al元素在含量相差较大,最高的为奉节县新民镇的鸡桑(S14),为220.77 μg/g,最低的为万州区分水镇的鸡桑(S6),42.54 μg/g。其次为Fe(平均58.06 μg/g)、Zn(平均57.42 μg/g)、Sr(平均43.83 μg/g)、Ba(平均29.24 μg/g)、Mn(平均28.58 μg/g)、Na(平均22.79 μg/g)、B(平均14.56 μg/g)、Ni(平均1.06 μg/g)、Mo(平均0.34 μg/g)、Sn(平均0.34 μg/g)、Co(平均0.227 μg/g)、Se(平均0.072 μg/g)、Sb(平均0.027 μg/g)。其中奉节县新民镇的鸡桑(S14)中Fe、Sb含量最高,万州区分水镇的桑(S7)中Zn含量最高,南岸区黄桷垭镇的华桑(S9)中Sr、Ba、Se含量最高,南岸区黄桷垭镇的鸡桑(S8)中Mn含量最高,巴南区安澜镇的鸡桑(S4)中Na、B、Sn含量最高,云阳县双河镇的华桑(S10)中Ni含量最高,万州区百安坝街道的鸡桑(S17)中Mo含量最高,开州区临江镇的华桑(S1)中Co含量最高。
2.3 安全性评价
根据《中华人民共和国药典》2020版[1]的规定(Hg≤0.2 μg/g、Cd≤0.3 μg/g、As≤2.0 μg/g、Pb≤5.0 μg/g、Cu≤20.0 μg/g、重金属总量≤20.0 μg/g),18个批次的桑枝样品中Hg、Cd、As含量均符合规定,Pb只有S4(5.10 μg/g)超过规定,其余均符合规定,18批桑枝中Cu和重金属总量均超过标准规定。
表3 桑枝中25种元素测定结果(n=3)
Table 3 Determination of 25 elements in mulberry branches(n=3)

元素S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15S16S17S18N/(mg·g-1)10.9811.6112.3921.7513.367.4716.6116.2612.3812.2611.5310.5513.0614.8610.909.9311.8311.76 Hg/(μg·g-1)0.0360.0130.0110.0210.0220.0200.0230.0180.0350.0210.0270.0170.0290.0210.0170.0220.0220.025 Mg/(mg·g-1)1.161.341.342.271.230.721.622.111.191.331.390.991.391.721.390.891.691.29 Al/(μg·g-1)89.2280.84109.7565.5955.8342.5498.05168.16133.29105.5065.3066.3465.86220.77107.6785.6155.9147.96 K/(mg·g-1)5.627.416.179.448.543.6410.2712.707.777.198.256.4811.279.255.946.718.019.15 Ca/(mg·g-1)12.2210.3017.3817.9115.2210.1910.4916.4914.4012.9914.8913.2713.5211.029.918.8915.3813.73 Cr/(μg·g-1)0.280.460.373.190.260.190.500.671.360.590.910.360.821.370.580.470.510.41 As/(μg·g-1)0.0810.0920.1010.1420.0720.0520.0960.1680.1670.0950.0770.0720.1090.1560.1060.0710.0640.062 Cd/(μg·g-1)0.0320.1790.0370.0970.0730.0120.0410.0710.0950.0530.0340.0210.0510.0410.0330.0180.0260.024 Pb/(μg·g-1)2.122.851.925.102.251.502.423.344.542.992.472.082.183.433.481.861.631.75 B/(μg·g-1)11.4914.2915.3119.2815.0910.5717.0718.6516.4710.1312.7312.5915.3116.0013.2713.3314.9115.58 Na/(μg·g-1)10.7110.7319.3840.1523.4429.5510.3819.0418.6419.0422.0111.2725.9731.3922.6022.4839.4033.97 P/(mg·g-1)2.042.942.423.672.320.852.222.882.152.572.661.883.202.711.762.355.283.23 Mn/(μg·g-1)18.4726.7628.5921.7037.008.9232.9260.7833.9622.8226.5921.5247.8628.6528.5315.1326.7727.42 Fe/(μg·g-1)27.0335.7060.0249.8858.2741.1181.7880.2096.1759.5630.6844.3268.44129.5073.8146.2938.9623.38 Co/(μg·g-1)1.8940.1010.1030.0590.0530.0310.1580.1560.2470.1030.0600.0990.5400.1840.0900.0520.1010.055 Ni/(μg·g-1)0.581.070.581.660.720.490.851.161.442.220.920.571.251.811.200.900.691.03 Cu/(μg·g-1)37.6235.3831.1055.4929.2035.2248.7760.5159.3061.7053.2135.7634.8599.3484.3738.0331.4636.33 Zn/(μg·g-1)51.8243.4036.9447.4939.6930.2996.7564.7066.4872.9063.1938.8939.4396.4881.0771.3746.8545.87 Se/(μg·g-1)0.0440.0220.0960.1140.0750.0570.0570.0590.1230.0620.0910.0580.0910.1150.0440.0450.0760.067 Sr/(μg·g-1)29.0524.7558.7930.5929.4120.5127.0083.5086.7035.2367.9838.9533.9532.8222.6517.6364.8784.48 Mo/(μg·g-1)0.180.250.350.770.080.070.200.150.050.190.760.250.270.540.390.320.860.44 Sn/(μg·g-1)0.220.230.460.690.260.350.410.420.470.360.280.140.240.570.430.260.140.12 Sb/(μg·g-1)0.0240.0230.0150.0420.0250.0260.0320.0280.0360.0310.0290.0230.0240.0370.0360.0230.0170.020 Ba/(μg·g-1)17.4117.105.6316.1930.9021.6231.9545.5654.7423.2128.0923.1146.8735.7026.4919.7635.6146.39
不同产地桑枝中重金属及有害元素安全性评价如表4所示。单项污染指数显示,18批桑枝样品中Hg、Cd和As的单因子污染指数均小于0.7,评价为优良,除巴南区安澜镇的鸡桑(S4)中的Pb单因子指数评价为轻污染外,其余桑枝样品中Pb元素的单因子污染指数评价也均为优良和安全。除巴南区安澜镇的鸡桑(S4)、万州区分水镇的桑(S7)、南岸区黄桷垭镇的华桑(S9)和云阳县双河镇的鸡桑(S11)中Cu单因子污染指数评价为中污染以及南岸区黄桷垭镇的鸡桑(S8)、云阳县双河镇的华桑(S10)、奉节县新民镇的鸡桑(S14)和奉节县新民镇的华桑(S15)中Cu单因子污染指数评价为重污染外,其余桑枝样品中Cu元素单因子污染指数评价均为轻污染。内梅罗综合污染指数评价显示,巴南区安澜镇的鸡桑(S4)、南岸区黄桷垭镇的鸡桑(S8)、南岸区黄桷垭镇的华桑(S9)和云阳县双河镇的华桑(S10)为中污染,奉节县新民镇的鸡桑(S14)和奉节县新民镇的华桑(S15)为重污染,其余样品的评价为轻污染。造成污染的主要原因为桑枝中Cu元素含量超标。
表4 不同产地桑枝中重金属及有害元素安全性评价
Table 4 The safety evaluation results of the contents of heavy metals and harmful elements in mulberry branches from different origins
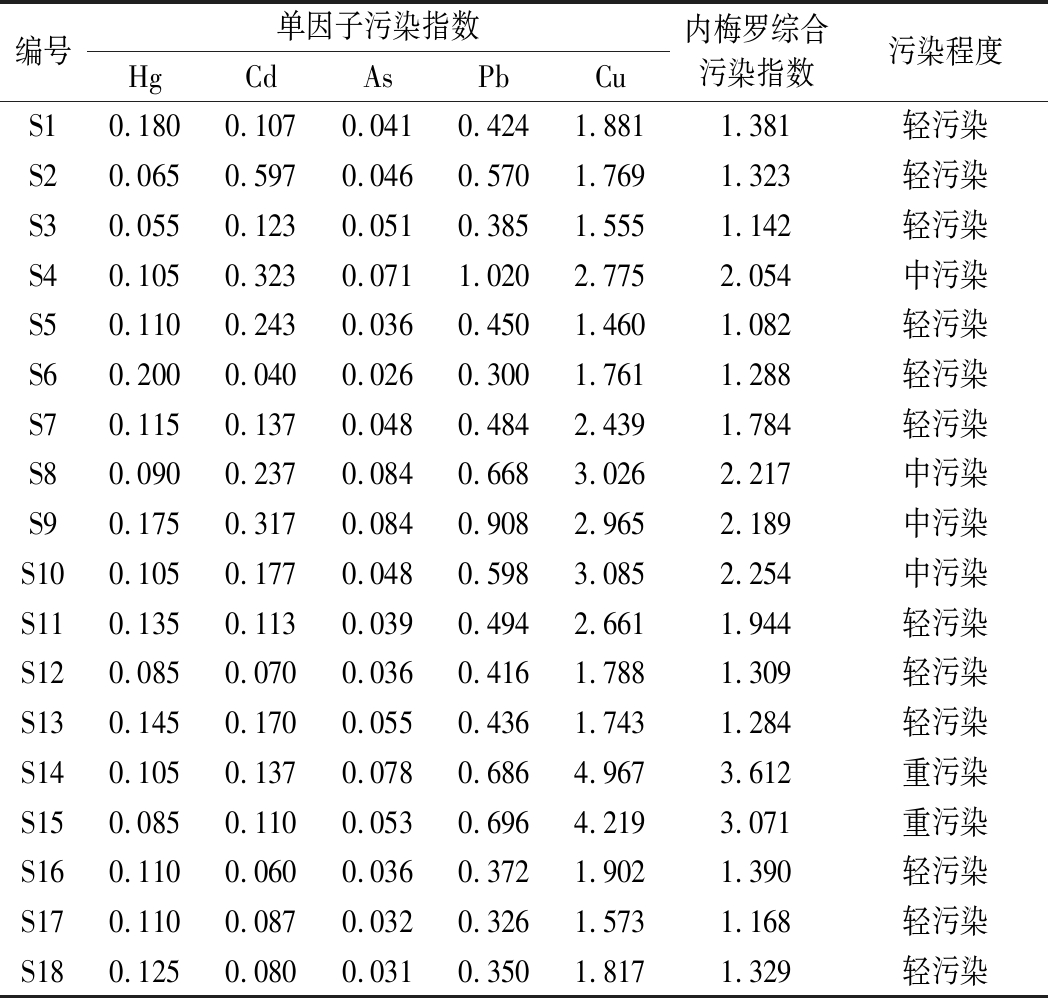
编号单因子污染指数HgCdAsPbCu内梅罗综合污染指数污染程度S10.1800.1070.0410.4241.8811.381轻污染S20.0650.5970.0460.5701.7691.323轻污染S30.0550.1230.0510.3851.5551.142轻污染S40.1050.3230.0711.0202.7752.054中污染S50.1100.2430.0360.4501.4601.082轻污染S60.2000.0400.0260.3001.7611.288轻污染S70.1150.1370.0480.4842.4391.784轻污染S80.0900.2370.0840.6683.0262.217中污染S90.1750.3170.0840.9082.9652.189中污染S100.1050.1770.0480.5983.0852.254中污染S110.1350.1130.0390.4942.6611.944轻污染S120.0850.0700.0360.4161.7881.309轻污染S130.1450.1700.0550.4361.7431.284轻污染S140.1050.1370.0780.6864.9673.612重污染S150.0850.1100.0530.6964.2193.071重污染S160.1100.0600.0360.3721.9021.390轻污染S170.1100.0870.0320.3261.5731.168轻污染S180.1250.0800.0310.3501.8171.329轻污染
2.4 主成分分析
2.4.1 主成分筛选以及贡献率
采用软件SPSS 26.0对18批桑枝样品进行主成分分析,结果如表5所示,从25种元素中提取了7个主成分(特征值>1),前4个主成分累积贡献率达69.038%,第一主成分的特征值为8.753,特征贡献率为35.014%,主要影响因子为As、Pb、Mg、N,第二主成分的特征值为3.971,特征贡献率为15.886%,主要影响因子为Ca、P,第三主成分的特征值为2.720,特征贡献率为10.880%,主要影响因子为Mn,第四主成分的特征值为1.815,特征贡献率为7.258%,主要影响因子为Hg。
表5 主成分的特征值及方差贡献率
Table 5 Eigenvalues and variance contribution of principle components
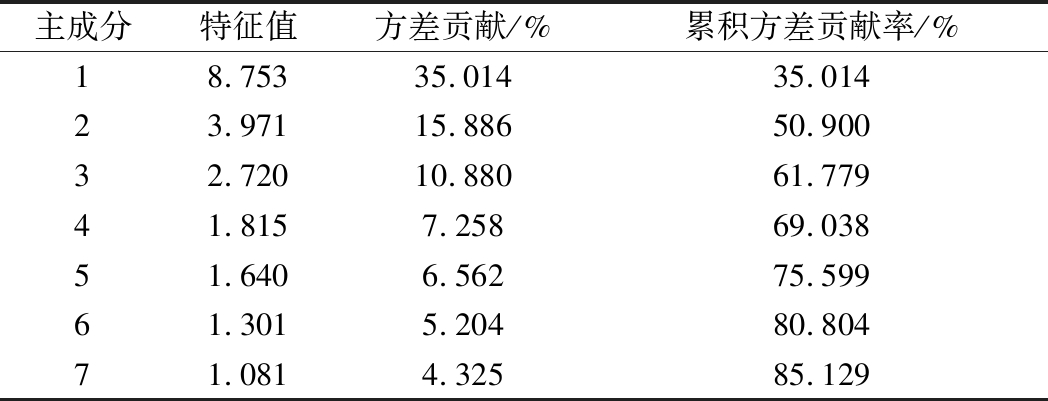
主成分特征值方差贡献/%累积方差贡献率/%18.75335.01435.014 23.97115.88650.900 32.72010.88061.779 41.8157.25869.038 51.6406.56275.599 61.3015.20480.804 71.0814.32585.129
2.4.2 桑枝样品主成分得分、综合得分及排序
采用每个主成分所对应的特征值占所提取主成分总特征值之和的比例作为权重,得到综合主成分表达公式为F综=0.411F1+0.187F2+0.128F3+0.085F4+0.077F5+0.061F6+0.051F7,计算各个主成分得分以及综合得分,并对18批样品的综合得分进行排序,结果如表6所示,在综合得分排名中,巴南区安澜镇的鸡桑(S4)得分最高,其次为南岸区黄桷垭镇的鸡桑(S8)、南岸区黄桷垭镇的华桑(S9)和奉节新民镇的鸡桑(S14)。由此可得出不同品种桑枝在元素含量上存在差异,可为桑枝品种评价以及后续的开发利用提供理论依据及参考。
2.5 聚类分析
采用软件SPSS 26.0对18批不同品种桑枝样品进行聚类分析,以所测的25种元素为变量,如图1所示,可以将18批不同品种的桑枝分为三大类,其中巴南区安澜镇的鸡桑(S4)为一类,南岸区黄桷垭镇的鸡桑(S8)、南岸区黄桷垭镇的华桑(S9)和奉节县新民镇的鸡桑(S14)分为一类,其余的14批桑枝样品聚为一类。聚类分析结果与主成分分析中的主成分综合得分排序结果是一致的,表明本研究中的桑枝样品的无机元素含量结构不能从物种上区分开,而更多地受到产地环境等因素的影响。
表6 主成分得分、综合得分及其排序
Table 6 Principal component score, comprehensive score and their ranking

样品主成分因子F1F2F3F4F5F6F7F综综合排序S1-3.42-1.210.651.23.062.041.91-0.9914S2-1.69-0.34-0.31-3.190.321.3-2.16-1.0815S3-1.181.31-0.37-1.94-0.24-2.32.16-0.512S45.92.1-4.55-0.781.990.13-0.152.321S5-1.20.980.82-0.990.57-0.56-0.62-0.3110S6-4.84-1.44-1.370.530-1.82-0.31-2.5118S71.06-1.491.08-1.04-0.561.440.560.287S84.280.893.31-1.87-0.38-0.030.462.182S93.52-1.271.911.742.1-1.97-1.281.583S100.12-1.96-0.730.29-0.340.26-0.83-0.4411S11-0.371.17-0.651.48-0.27-0.040.180.099S12-3.15-0.120.15-0.62-0.07-0.740.26-1.3916S130.561.521.890.690.650.64-0.520.885S145.14-2.91-0.531.19-1.77-0.160.941.514S150.44-3.05-0.97-0.01-1.220.23-0.09-0.613S16-2.8-1.29-0.730.32-1.080.62-0.04-1.5117S17-0.954.26-0.561.4-1.840.880.370.386S18-1.382.830.961.6-0.90.06-0.820.118
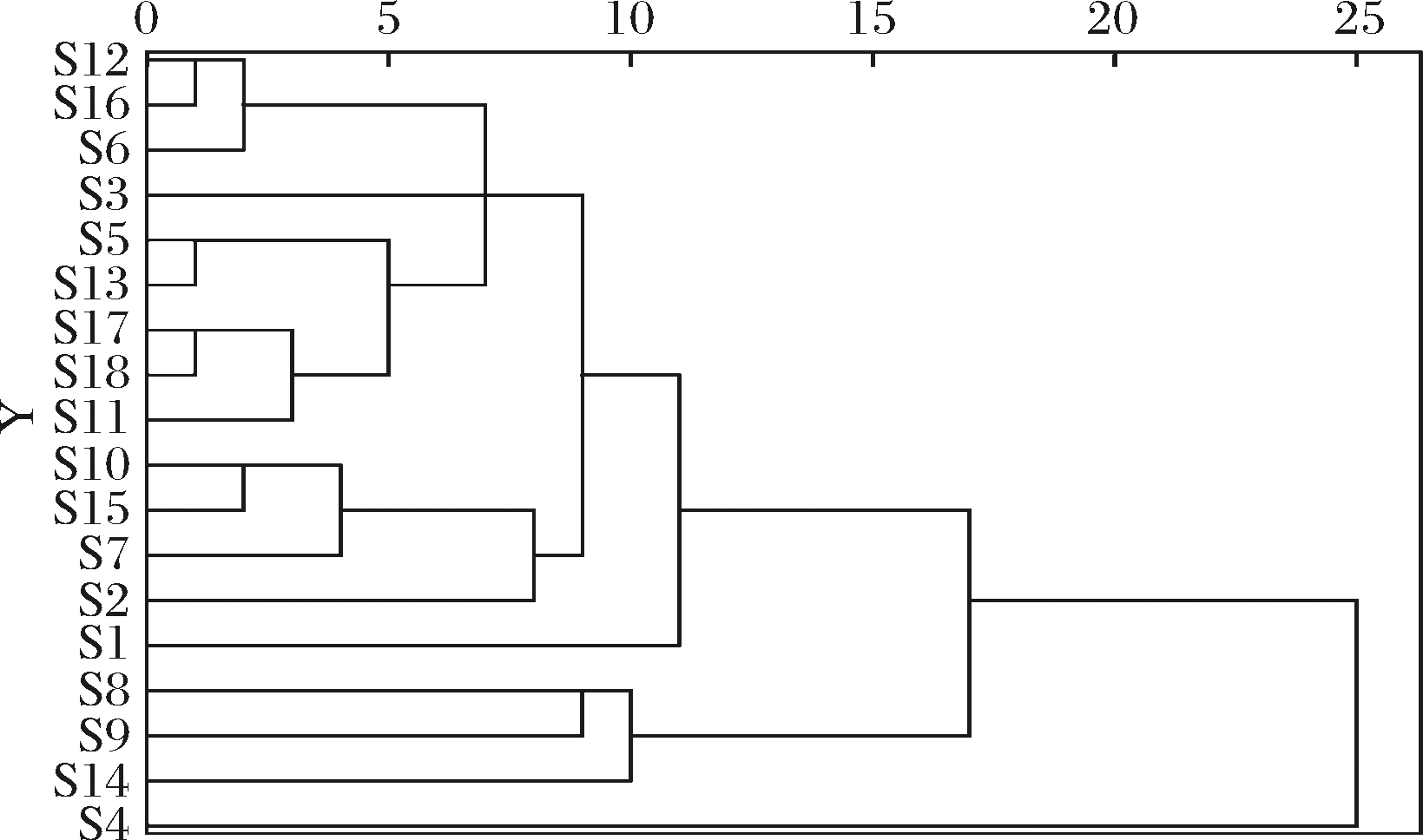
图1 桑枝样品的聚类分析
Fig.1 Cluster analysis of mulberry branch samples
3 结论与讨论
植物中无机元素的含量受到气候、土壤及种植过程中的施肥等因素影响,并且植物体在不同部位、不同生长阶段对无机元素的吸收和富集存在显著差异[24]。本研究结果显示18批桑枝中均检测出25种元素,但各样品间元素含量差异较大,25种元素含量由高到低排序为Ca>N>K>P>Mg>Al>Fe>Zn>Cu>Sr>Ba>Mn>Na>B>Pb>Ni>Cr>Mo>Sn>Co>As>Se>Cd>Sb>Hg。桑枝中的Ca元素在25种测定无机元素中的平均含量最高,Ca元素对于人体有着非常重要的作用,不仅是骨骼和牙齿的重要组成成分,还参与了凝血、神经元信号传导及维持骨骼肌正常兴奋等重要生理过程[19],本研究中所测的桑枝中Ca元素平均含量高达13.23 mg/g,可考虑在未来的药物开发利用中将桑枝作为Ca补充剂的来源。K元素可以调节人体细胞的渗透压及酸碱平衡,参与糖类、蛋白质的能量代谢及维护心肌功能;Mg元素是人体中300多种镁的重要组分,参与了人体内绝大多数代谢活动;Fe元素是血红蛋白的组成成分,参与人体内呼吸作用中O2的运输;Zn元素能够提高人体免疫力,在儿童的生长发育中起着重要的作用[19],因此桑枝中高含量的K、Mg、Fe、Zn等元素在其药用过程中对其主要药用成分可以起到协同增效作用,使其疗效更为显著。Cu元素对人体的免疫系统有着一定的调节作用,但本此检测的18批桑枝样本中Cu元素均超标,过量的铜元素对人体及植物体具有毒害作用。有研究表明,南方红壤区土壤中铜元素含量普遍偏高,其中生长的植物通过富集作用能够在体内积累大量的铜元素[25]。因此,在桑枝药材种植过程中通过对土壤中重金属元素尤其是Cu元素进行监控,并通过技术手段降低种植环境中的重金属元素含量,可以有效控制桑枝药材中重金属含量,使其符合标准规范。聚类分析结果显示桑枝样品的无机元素含量结构不能从物种上区分开,而更多受到产地环境等因素的影响。
本研究采用微波消解法与凯氏定氮法、ICP-MS和AFS相结合测定了不同产地及种类桑枝药材中25种元素的含量,并对其安全性进行了评估,为其药材的道地性及重金属和有害元素的研究提供了一种新的思路,同时也可以为桑枝的质量评价、安全性评价以及药用价值的开发利用提供理论依据和基础资料。
[1] 国家药典委员会. 中华人民共和国药典-二部[M].2020版.北京:中国医药科技出版社, 2020.
Chinese pharmacopoeia Commission.Chinese Pharmacopoeia[M].2020 Edition.Beijing:China Medical Science Press, 2020.
[2] 四川省食品药品监督管理局. 四川省中药材标准(2010年版)[S].成都:四川科学技术出版社, 2011:523-525.
Sichuan Food and Drug Administration.Chinese herbal medicine standard of Sichuan Province (2010 Edition)[S].Chengdu:Sichuan Science and Technology Press, 2011:523-525.
[3] 邢冬杰, 项东宇, 张彩坤.桑枝活性成分提取及药理作用研究进展[J].中国现代中药,2014,16(11):957-960.
XING D J, XIANG D Y, ZHANG C K.A review of the Ramulus mori on its chemical and pharmacological studies[J].Modern Chinese Medicine, 2014, 16(11):957-960.
[4] 刘华瑜. 桑皮粉添食对STZ诱导的糖尿病小鼠的预防和治疗作用[D].苏州:苏州大学, 2016.
LIU H Y.In vivo preventive and hypoglycaemic effect of mulberry branch bark powder on STZ-induced diabetic mice[D].Suzhou:Soochaw University, 2016.
[5] 王秀珍, 石贵荣.桑枝化学成分黄酮的药理作用及其应用研究进展[J].中国社区医师(医学专业), 2012, 14(31):25.
WANG X Z, SHI G R.Research progress on pharmacological action and application of flavonoids from Ramulus Mori[J].Chinese Community Doctors, 2012,14 (31):25.
[6] 韩伟立, 刘利, 张晓琦,等.鲁桑叶化学成分研究[J].中国中药杂志, 2007, 32(8):695-698.
HAN W L, LIU L, ZHANG X Q,et al.Chemical constituents from leaves of Morus multicaulis[J]. China Journal of Chinese Materia Medica, 2007, 32(8):695-698.
[7] 陈震, 汪仁芸, 朱丽莲, 等.桑枝水提取物化学成分的研究[J].中草药, 2000,31(7):24-25.
CHENG Z, WANG R Y, ZHU L L, et al.Study on the chemical constituents of the aqueous extract of mulberry branch[J].Chinese Traditional and Herbal, 2000,31(7):24-25.
[8] 洪德志, 时连根.桑枝多糖对糖尿病模型小鼠的降血糖作用[J].中国药理学与毒理学杂志, 2012, 26(6):806-809.
HONG D Z, SHI L G.Hypoglycemic effect of polysaccharides in Ramulus Mori on diabetic model mice[J]. Chinese Journal of Pharmacology and Toxicology, 2012, 26(6):806-809.
[9] 刘先明, 李琳, 王元净, 等.桑枝皮提取物对急性高血脂症小鼠血脂水平的影响[J].蚕业科学, 2011, 37(4):771-774.
LIU X M, LI L, WANG Y J, et al.Effects of mulberry branch bark extract on serum lipid levels of acute hyperlipidemic mice[J].Science of Sericulture, 2011, 37(4):771-774.
[10] 严寒静, 房志坚.不同产地何首乌无机元素的含量测定和主成分分析[J].中国中药杂志, 2008,33(4):416-419.
YAN H J, FANG Z J.Study on determination and principal component analysis of inorganic elements in Polygonum multiflorum from different areas[J].China Journal of Chinese Materia Medica, 2008,33(4):416-419.
[11] 董顺福, 韩丽琴, 赵文秀, 等.运用模糊聚类方法分析中药微量元素含量与药效的关系[J].中国组织工程研究与临床康复, 2007(40):8 127-8 130.
DONG S F, HAN L Q, ZHAO W X, et al.Fuzzy cluster analysis of trace element content and therapeutic effect in traditional Chinese medicine[J].Journal of Clinical Rehabilitative Tissue Engineering Research, 2007,11(40):8 127-8 130.
[12] 秦俊法, 林宣贤.中国的中药微量元素研究Ⅱ.微量元素:中药有效药成分的核心组分[J].广东微量元素科学, 2010, 17(12):1-12.
QIN J F, LIN X X.The research of trace elements of Chinese medicine in China II. Trace element:The core component of the effective drug components of traditional Chinese medicine[J].Guangdong Trace Elements Science, 2010, 17(12):1-12.
[13] 秦俊法. 中国的中药微量元素研究Ⅴ.微量元素:中药质量控制不可或缺的特征参数[J].广东微量元素科学, 2011, 18(3):1-20.
QIN J F.The research of trace elements of Chinese medicine in China Ⅴ. Trace elements:Eaaential parameters for quality control in traditional Chinese medicine[J].Guangdong Trace Elements Science, 2011, 18(3):1-20.
[14] 何畅. 从英国禁令分析中药出口欧盟的重金属超标问题及对策[J].中草药, 2016, 47(10):1 820-1 824.
HE C.Analysis on excessive heavy metal problem of Chinese materia medica exports to EU from perspective of UK ban[J].Chinese Traditional and Herbal Drugs, 2016, 47(10):1 820-1 824.
[15] 邹婵英. 贵州栽培何首乌与野生何首乌的微量元素分析[J].微量元素与健康研究, 2004(4):64.
ZHOU C Y.Trace element analysis of cultivated and wild Polygonum multiflorum in Guizhou[J].Studies of Trace Elements and Health, 2004,21(4):64.
[16] 林海兰, 朱日龙, 于磊, 等.水浴消解-原子荧光光谱法测定土壤和沉积物中砷、汞、硒、锑和铋[J].光谱学与光谱分析, 2020, 40 (5):1 528-1 533.
LIN H L, ZHU R L, YU L, et al.Determination of arsenic, mercury, selenium, antimony and bismuth in soil and sediments by water bath digestion atomic fluorescence spectrometry[J].Spectroscopy and Spectral Analysis, 2020, 40(5):1 528-1 533.
[17] 陈军, 姚成, 欧阳平凯.ICP-AES法测定猫爪草中常量及微量元素[J].光谱学与光谱分析, 2005, 25(4):560-562.
CHEN J, YAO C, OUYANG P K.Determination of constant and trace elements in Ranunculus ternatus by ICP-AES[J].Spectroscopy and Spectral Analysis, 2005, 25(4):560-562.
[18] 魏永生, 侯雅慧, 郭妮, 等.微波消解ICP-OES法测定4种常见绿叶蔬菜中的22种矿物元素[J].化学工程师, 2018, 32(10):21-24.
WEI Y S, HOU Y H, GUO N, et al.Determination of 22 mineral elements in four green leafy vegetables by microwave digestion-ICP-OES[J].Chemical Engineer, 2018, 32(10):21-24.
[19] 黄小兰, 何旭峰, 周祥德, 等.不同产地地参中22种元素的测定与分析[J].食品与发酵工业, 2020, 46(20):229-235.
HUANG X L, HE X F, ZHOU X D, et al.Determination and analysis of 22 elements in Lycopus lucidus var.hirtus Regel form different habitats[J].Food and Fermentation Industries, 2020, 46(20):229-235.
[20] 胡曙光, 苏祖俭, 蔡文华, 等.石墨炉原子吸收法测定高盐食品中的铅及其干扰消除的研究[J].中国食品卫生杂志, 2015, 27(4):394-398.
HU S G, SU Z J, CAI W H, et al.The determination of lead and interference elimination in high salty food by GFAAS[J].Chinese Journal of Food Hygiene, 2015, 27(4):394-398.
[21] 李冰, 周剑雄, 詹秀春.无机多元素现代仪器分析技术[J].地质学报, 2011, 85(11):1 878-1 916.
LI B, ZHOU J X, ZHAN X C.Modern instrumental analysis technology of inorganic multi-elements[J].Acta Geologica Sinica, 2011, 85(11):1 878-1 916.
[22] 游富英, 刘妍, 毕慧敏.3种红枣消解方法的对比研究[J].安徽农业科学, 2010, 38(10):5 308-5 309.
YOU F Y, LIU Y, BI H M.Comparative study on three methods of jujube digestion[J].Journal of Anhui Agricultural Sciences, 2010, 38(10):5 308-5 309.
[23] 左甜甜, 金红宇, 余坤子, 等.ICP-MS结合化学计量学用于枸杞子道地性的研究及安全性评价[J].药物分析杂志, 2021, 41(3):394-401.
ZUO T T, JIN H Y, YU K Z, et al.Holistic strategy of study on authenticity and safety evaluation of Chinese wolfberry by ICP-MS combined with chemometrics[J].Chinese Journal of Pharmaceutical Analysis, 2021, 41(3):394-401.
[24] 陈宏降, 罗益远, 刘佳楠, 等.ICP-MS分析鱼腥草不同部位中无机元素差异[J].中国新药杂志, 2019, 28(22):2 769-2 775.
CHEN H X, LUO Y Y, LIU J N, et al.Analysis of inorganic elements in different parts of Houttuynia cordata by ICP-MS[J].Chinese Journal of New Drugs, 2019, 28(22):2 769-2 775.
[25] 吴龙华, 骆永明, 黄焕中.铜污染旱地红壤的络合有道植物修复作用[J].应用生态学报, 2001, 12(3):435-438.
WU L H, LUO Y M, HUANG H Z.Chelate-induced phytoextraction of copper contaminated upland red soil[J].Chinese Journal of Applied Ecology, 2001, 12(3):435-438.