梅花鹿是我国多种珍稀药材的来源动物,梅花鹿养殖业是我国新兴的经济产业之一[1]。随着日常生活质量的提高,人们除了食用常见的猪肉、牛肉、鸡肉和鸭肉外,还增加了鹿肉及其肉制品的食用。鹿肉有低脂肪、高蛋白和低胆固醇等优点,梅花鹿肉与马鹿肉的营养成分含量相似,但梅花鹿肉的蛋白质含量明显高于马鹿肉[2-3]。我国的食鹿历史源远流长,从周朝时期就有食用鹿肉的文字记载,《名医别录》中记载鹿肉可治疗中风,李时珍在《本草纲目》中写道“鹿肉味甘,温,无毒,益气力,强五脏,养血生容”[4]。2011年,国家批准鹿肉可作为普通食品供大众食用,鹿肉制品工业开始迅猛发展。各种鹿肉加工制品,如鹿肉酱、鹿肉丸、鹿肉肠等逐渐进入大众的视野[5]。随着鹿肉市场日渐高涨,不法商家以猪肉、牛肉等廉价肉类掺入鹿肉干及鲜鹿肉中,严重扰乱了鹿肉制品市场的秩序,影响鹿肉及其制品的食品安全。
近年来,肉类的鉴别掺假有理化性质分析方法,如近红外光谱法分析样品的特征性光谱区分不同物种的肉,和色谱质谱联用技术分析物种的特异性多肽[6-7];或是以免疫学为基础的酶联免疫法以及胶体金免疫层析法,检测特异性蛋白鉴别掺假,但鹿肉经过加工制作后,蛋白发生变性就难以对其进行鉴别[8]。随着分子生物学技术的发展,DNA检测技术被广泛用于物种的鉴别中[9-10]。本研究采用多重聚合酶链式反应(multiplex polymerase chain reaction, MPCR)对鲜梅花鹿肉或鹿肉干中的猪肉、牛肉进行鉴别与常规PCR相比,多重PCR既有单一PCR的特异性和敏感性,且更为便捷,相较于实时荧光PCR,其价格也更为低廉;并且在引物和设计PCR的反应条件上的灵活性也更强,可实现一步检测出梅花鹿肉、牛肉、猪肉3种动物肉源性成分。选择本方法目的是建立一种高效稳定、简便实用的鉴别方法。
1 材料与方法
1.1 材料与试剂
样品于2020年10月购入,消毒处理后保存于-20 ℃条件下。梅花鹿(Cervus nippon)肉购于长春市双阳区鸿博鹿产品经销公司;猪肉、牛肉、驴肉、狗肉、羊肉、鸡肉、鸭肉购于吉林市江湾农贸市场。
2×Taq Master Mix (Dye Plus)、Ultra GelRed(10 000×),南京诺唯赞生物科技股份有限公司;100 bp DNA Marker、λDNA Hind Ⅲ,天根生物技术有限责任公司;琼脂糖,西班牙Agrose公司。
1.2 仪器与设备
台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;JY300E通用型电泳仪,北京君意东方电泳设备有限公司;ETC811 PCR基因扩增仪,苏州东胜兴业科学仪器有限公司;GeneAmp R PCR System 2700 Applied Biosystem,美国Perkin-Elmer 公司;UV WHITE2020D凝胶成像分析系统,美国Bio-rad公司;Q6000微量紫外分光光度计,美国Quawell公司。
1.3 样品DNA提取
采用碱变性方法提取基因组DNA[11]。将梅花鹿肉样品及其他常见物种样品组织用70%(体积分数)乙醇清洗3 min,37 ℃烘箱中挥发乙醇,用剪刀剪碎至约1 mm3。称取样品0.1 g放入离心管中,加入500 μL裂解液、15 μL蛋白酶K(20 mg/mL)和30 μL 10%(质量分数)十二烷基磺酸钠(sodium dodecyl sulfate,SDS),混匀后置于56 ℃水浴振荡2 h,转速为100 r/min。直接向裂解后的样品中加入500 μL饱和乙酸钠溶液,充分混匀,11 000 r/min、4 ℃离心10 min,取上清液加入等体积的异丙醇,-20 ℃放置1 h,11 000 r/min、4 ℃离心10 min,弃上清液,留沉淀。用洗涤液(主要含有(体积分数)70%的乙醇)洗涤沉淀2~3次,干燥沉淀,加灭菌双蒸水80 μL进行溶解,于-20 ℃下保存,作为DNA模板。将提取的样品DNA用微量紫外分光光度计测定浓度,根据OD260/OD280的值鉴定纯度。
1.4 梅花鹿肉及其它物种肉样品检测
1.4.1 样品DNA纯度及浓度测定
用微量紫外分光光度计测定提取的样品DNA浓度,根据OD260/OD280的比值鉴定所提取DNA的纯度。
1.4.2 样品DNA琼脂糖凝胶电泳
配制质量浓度为8 g/L的胶,胶中加入核酸凝胶染色剂GelRed[1 μL染料/10 mL 1×三羟甲基氨基甲烷-硼酸盐-乙二胺四乙酸(tris-borate-ethylene diamine tetraacetic acid,TBE)];PCR反应溶液的上样量为6 μL,电压85 V/cm。取凝胶于紫外分析仪上进行检视。
1.5 三重PCR引物
根据文献[12-14]选择针对梅花鹿、猪、牛3个物种的PCR特异性引物。
表1 三重PCR引物序列及扩增片段长度
Table 1 Triplex PCR primer sequence and extended segment length

引物名称引物序列(5′→3′)长度/bp梅花鹿正向引物ACACCCTAATCAACTGGC525梅花鹿反向引物AAGAAAGAAGGAGGGAGG猪正向引物 GCCTAAATCTCCCCTCAATGCTA212猪反向引物 GCACGATGTACATAGGGTATTA牛正向引物 CGGAGTAATCCTTCTGCTCACAGT116牛反向引物 GGATTGCTGATAAGAGGTTGGTG
1.6 三重PCR检测
1.6.1 三重PCR引物特异性
单重PCR反应体系为2×Taq PCR Mix 酶12.5 μL,所提取的常见动物样品DNA溶液(100 ng/μL)1 μL,各物种的正向、反向引物(12.5 ng/μL)各0.5 μL,无菌ddH2O补足至25 μL。将PCR反应管放置于PCR仪。PCR反应参数设定为:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃) 5 min,4 ℃保存。
1.6.2 PCR产物琼脂糖凝胶电泳检测
配制质量浓度为15 g/L的胶,胶中加入核酸凝胶染色剂GelRed(1 μL染料/10 mL 1×TBE);PCR反应溶液的上样量为5 μL,6×Loading buffer上样量为1 μL,电压85 V/cm。取凝胶于紫外分析仪上进行检视。
1.6.3 三重PCR退火温度检测
三重PCR反应体系为2×Taq PCR Mix 酶12.5 μL,模板(100 ng/μL)4 μL,牛、猪的正向、反向引物(12.5 ng/μL)各0.2 μL,梅花鹿的正向、反向引物(12.5 ng/μL)各0.6 μL,无菌ddH2O补足至25 μL。将PCR反应管置PCR仪,PCR反应参数:95 ℃预变性3 min,循环反应35次(95 ℃ 30 s,54~63 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃) 5 min,4 ℃保存。用1.6.2的电泳检测方法进行检测。
1.6.4 三重PCR特异性检测
采用1.6.3的体系,同时加入梅花鹿、猪、牛3个物种、两两组合、单一物种以及常见动物DNA进行PCR检测特异性。PCR反应管置PCR仪,PCR反应参数:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃) 5 min,4 ℃保存。用1.6.2的电泳检测方法进行检测。
1.6.5 三重PCR重复性检测
采用1.6.4中的反应体系及反应条件,同一操作人员不同时间重复试验5次。PCR反应管置PCR仪,PCR反应参数:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃)5 min,4 ℃保存。用1.6.2的电泳检测方法进行检测。
1.6.6 三重PCR灵敏度检测
用所提取的DNA先稀释到100 ng/μL,然后按照1∶10倍比稀释作为DNA模板,取单一物种DNA模板和3个物种DNA模板,用1.6.4中的反应体系及反应条件检测三重PCR灵敏性。PCR反应管置PCR仪,PCR反应参数:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃) 5 min,4 ℃保存。用1.6.2的电泳检测方法进行检测。
1.6.7 三重PCR混合DNA验证
提取鹿肉、猪肉、牛肉DNA,然后按比例混合制作成不同鹿肉DNA浓度百分比的模拟混合DNA,用1.6.4中的反应体系及反应条件验证三重PCR。PCR反应管置PCR仪,PCR反应参数:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃) 5 min,4 ℃保存。用1.6.2的电泳检测方法进行检测。
1.6.7 三重PCR混合肉样验证
将鹿肉、猪肉、牛肉切碎至肉糜状后按比例混合制作成不同鹿肉质量百分比的模拟混合肉样,对混合肉进行DNA提取,用1.6.4中的反应体系及反应条件验证三重PCR。PCR反应管置PCR仪,PCR反应参数:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),延伸(72 ℃) 5 min,4 ℃保存。用1.6.2的电泳检测方法进行检测。
2 结果与分析
2.1 动物基因组DNA提取结果
8 g/L(质量浓度)琼脂糖凝胶电泳结果表明,各个泳道都可观察到23 kp左右的条带,且条带清晰明亮,证明本研究提取DNA的方法效率高,质量好,碎片较少,可以高效提取各种动物组织的基因组DNA(图1)。
2.2 提取动物DNA浓度和纯度
将提取的样品DNA用微量紫外分光光度计测定其浓度,结果如表2所示。由表2可知,利用该方法提取DNA效果良好;根据OD260/OD280判断所提取DNA的纯度,所得比值为1.8~2.0时符合进行PCR实验的要求,本方法提取各动物DNA纯度均在理想范围内。
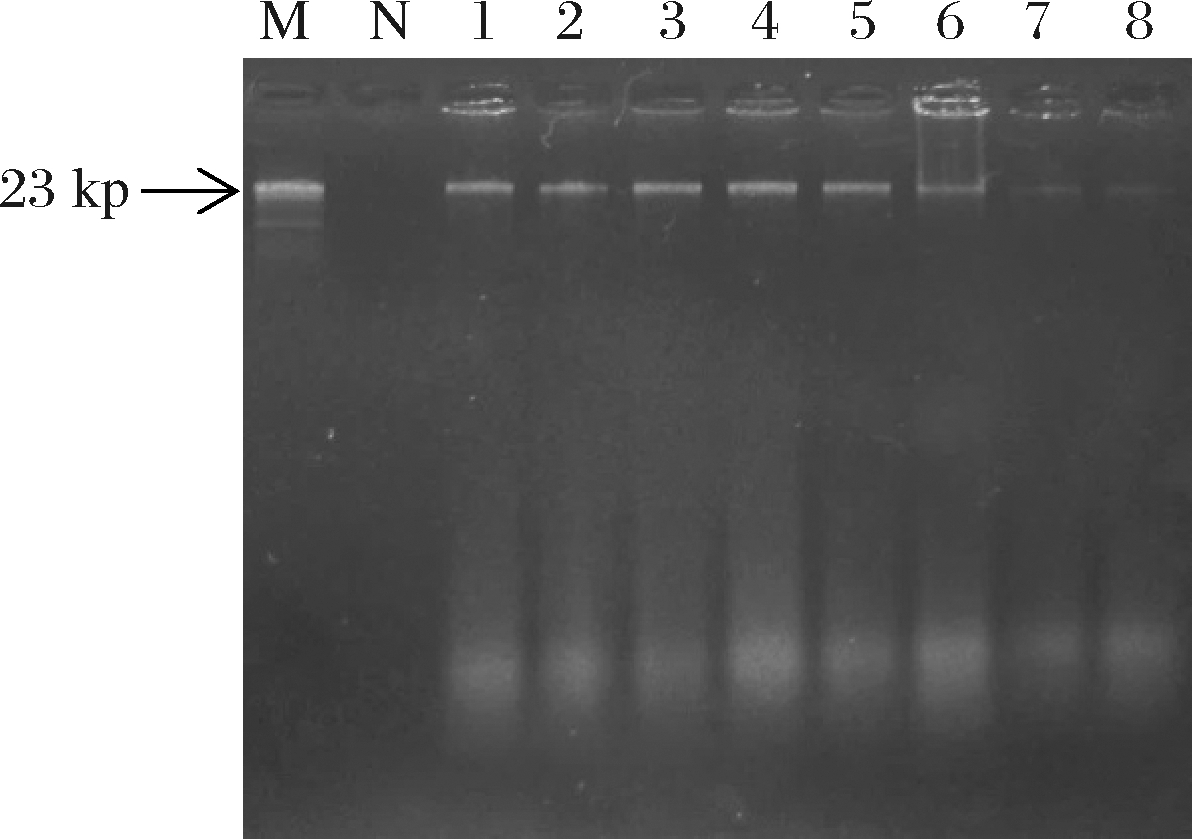
M-Marker;N-阴性对照;1-梅花鹿;2-猪;3-牛;4-驴;5-狗;6-羊;7-鸡;8-鸭
图1 提取动物基因组DNA电泳结果
Fig.1 Agarose gel electrophoresis patterns of various animal DNA
表2 实验用动物样品基因组DNA的浓度及纯度
Table 2 Concentration and purity of genomic DNA of experimental animal samples

样品IDOD260/OD280浓度/(ng·μL-1)空白 1.000-0.20梅花鹿1.80212.959猪 1.81217.853牛 1.99208.893驴 1.84259.586狗 1.82218.239羊 1.94199.651鸡 1.86112.372鸭 1.88108.324
2.3 引物特异性结果
由图2可知,梅花鹿、猪、牛所对应泳道分别在525、212、116 bp处有单一的特异性条带,明亮清晰。结果表明,3对引物均有良好的特异性。

M-Marker;N-阴性对照;1-牛;2-猪;3-梅花鹿;4-驴;5-羊;6-狗;7-鸡;8-鸭
a-牛引物;b-猪引物;c-梅花鹿引物
图2 各引物特异性的PCR反应产物琼脂糖凝胶电泳图谱
Fig.2 Agarose gel electrophoresis pattern of PCR reaction product specific to each primer
2.4 三重PCR检测结果
2.4.1 退火温度结果
退火温度分别为54、55、56、57、58、59、60、61 ℃,由电泳图(图3)可知,在58 ℃时,PCR产物最清晰明亮,且3个条带亮度一致。故选择58 ℃作为三重PCR反应条件的最佳温度。
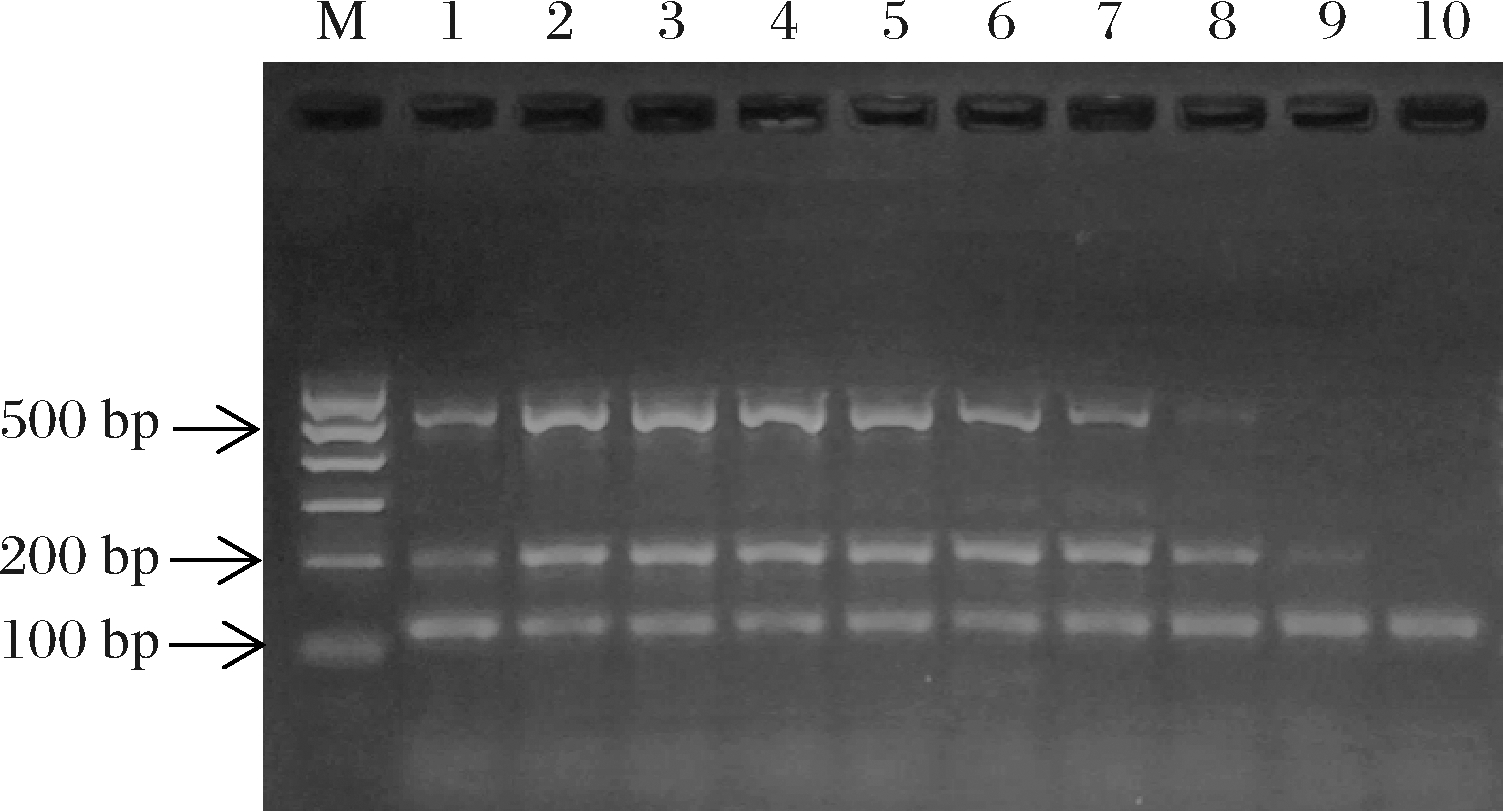
M-Marker;1-54 ℃;2-55 ℃;3-56 ℃;4-57 ℃;5-58 ℃;6-59 ℃;7-60 ℃;8-61 ℃;9-62 ℃;10-63 ℃
图3 不同退火温度PCR反应产物琼脂糖凝胶电泳图谱
Fig.3 Agarose gel electrophoresis patterns of PCR reaction products at different annealing temperatures
2.4.2 特异性结果
由图4可知,梅花鹿、猪、牛三重PCR分别在525、212、116 bp处有清晰明亮的条带,梅花鹿、猪、牛3个物种两两配对及单一物种加入到三重体系中也表现出良好的特异性。
2.4.3 重复性结果
由图5可知,同一体系和反应条件下,同一操作人员不同时间进行的三重PCR产物条带清晰明亮,结果均一致,三重PCR重复性良好。
2.4.4 灵敏度结果
由图6可知,,当三重体系只加入单一物种,梅花鹿DNA质量浓度在10 ng/μL时,牛DNA质量浓度在1 ng/μL时,猪DNA质量浓度在1 ng/μL时,条带清晰;当三重体系中有梅花鹿、牛、猪3个物种时,三者的质量浓度在100 ng/μL时,条带清晰明亮,当质量浓度小于10 ng/μL时,有条带但不清晰。

M-Marker;N-阴性对照;1-梅花鹿+猪+牛;2-梅花鹿+牛;3- 猪+牛;4-梅花鹿+猪;5-牛;6-梅花鹿;7-猪;8-鸡;9-鸭;10-驴;11-羊;12-狗
图4 三重PCR特异性反应产物琼脂糖凝胶电泳图谱
Fig.4 Agarose gel electrophoresis pattern of specific reaction products of triplex PCR
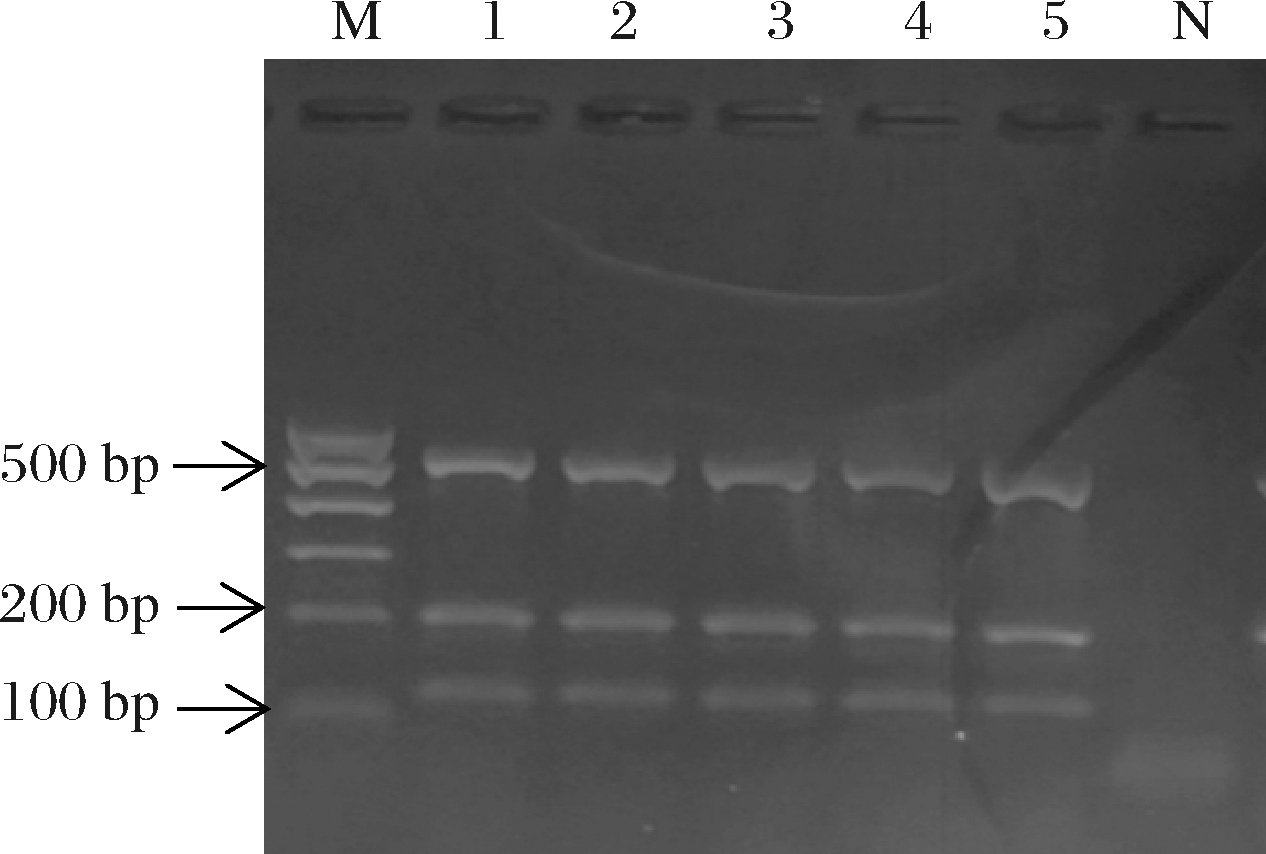
M-Marker;N-阴性对照;1-20201107;2-20201114;3-20201121;4-20201128;5-20201205
图5 三重PCR重复性反应产物琼脂糖凝胶电泳图谱
Fig.5 Agarose gel electrophoresis pattern of repetitive reaction products of triplex PCR

M-Marker;N-阴性对照;1-100 ng/μL;2-10 ng/μL;3-1 ng/μL;4-0.1 ng/μL;5-0.01 ng/μL;6-0.001 ng/μL;7-0.000 1 ng/μL
a-梅花鹿;b-猪;c-牛;d-同时加入3个物种
图6 三重PCR灵敏性反应产物琼脂糖凝胶电泳图谱
Fig.6 Agarose gel electrophoresis pattern of the sensitive reaction product of triplex PCR
2.4.5 三重PCR检测混合DNA结果
由图7可知,DNA掺假量从10%~50%的梅花鹿混合DNA样本,均可检测出掺假的猪肉或牛肉DNA。
2.4.6 三重PCR检测混合肉样结果
由图8可知,掺假量从10%~50%的混合肉样样本,均可检测出掺假的猪肉或牛肉。

a-梅花鹿肉DNA混入牛肉DNA;b-梅花鹿肉DNA混入猪肉DNA;c- 梅花鹿肉DNA混入牛肉DNA、猪肉DNA
M-Marker;N-阴性对照;P-阴性对照;1-10%;2-15%;3-20%;4-25%;5-30%;6-40%;7-50%
图7 三重PCR混合DNA反应产物琼脂糖凝胶电泳图谱
Fig.7 Agarose gel electrophoresis pattern of the mix DNA reaction product of triplex PCR

a-梅花鹿肉掺入猪肉;b-梅花鹿肉掺入牛肉;c-梅花鹿肉掺入牛肉和猪肉
M-Marker;N-阴性对照;P-阴性对照;1-5%;2-10%;3-15%;4-20%;5-25%;6-30%;7-40%;8-50%
图8 三重PCR混合肉样反应产物琼脂糖凝胶电泳图谱
Fig.8 Agarose gel electrophoresis pattern of the mix meat reaction product of triplex PCR
3 结论与讨论
在我国,梅花鹿是传统的药用性动物之一,在东北地区多见。以梅花鹿各部分为原材料的中药产品在临床中并不少见,我国中药学对于梅花鹿的利用有较久的历史依据[15]。如今,梅花鹿也作各种鹿产品中的最佳原料而受到广大人民的喜爱[16]。梅花鹿身体各部位入药,制作成食品和药膳越来越常见,梅花鹿肉营养价值高,可药食两用,可与中草药搭配制作药膳,烹饪方式多种多样。鹿肉在中药材和食用方面有着悠久的历史,但目前没有相关的行业规定和法律法规,导致市场上出现以次充好、以假乱真的现象。所以,研究一种针对鹿肉掺假定性的方法显得尤其重要。
梅花鹿产品的鉴定方法在近些年研究甚广,从对鹿茸[17]、鹿血[18]、鹿胎[19]、鹿鞭[20]等各种部位进行鉴别,到应用PCR、实时荧光定量PCR[21]、限制性片段长度多态性聚合酶链式反应[22]等分子鉴定手段进行鉴别;有基于单核苷酸多态性基因座,设计梅花鹿等位基因特异性PCR鉴定的特异性引物,可用于快速,准确地鉴定梅花鹿源性成分[23];还有通过DNA条形码这种新兴的鉴定体系对梅花鹿进行快速鉴定[24]。以上方法可以准确地鉴定出梅花鹿动物源性成分,但目前没有方法可以同时鉴别出梅花鹿、猪、牛3种成分。
多重PCR是在同一PCR反应体系中加入多对特异性引物,针对不同物种的基因同时扩增出多个核酸片段的一种PCR反应。这种技术能够高效地用一份动物样本或加工炮制的中药或药膳成品同时区分梅花鹿、猪、牛3种动物源性成分,相较于其他鉴定方法,此方法在同一反应管中检出,既节省时间及成本,又可以提供更加准确的鉴定结果。在单一引物PCR和三重PCR实验中,各引物均表现出良好的特异性。通过退火温度实验,摸索出三重PCR反应的最佳条件。本方法表现出了很好的重复性和灵敏性,能在6 h内完成从提取DNA到PCR检测结果的全部过程,特异性高、准确度好、灵敏性强,操作简单易行,能够很大程度上减少质检人员的工作量,在混合DNA和混合肉样检测中,也表现出准确的检测结果。本方法所用试剂及仪器较为常见,适用于各级别质检单位,可以广泛用于梅花鹿、牛、猪的肉源性产品,具有很高的实用性和长远的应用前景。
综上所述,本研究建立了一种快速灵敏、简单易行的鉴定方法,为解决鹿肉中掺假成分的鉴别问题提供新途径。
[1] 李生,郑兴涛,李和平,等.发展肉鹿生产开辟养鹿业的新路[J].特种经济动植物,1999, 2(1):21-22.
LI S, ZHENG X T, LI H P, et al.Develop meat deer production and open up a new way for deer industry[J].Special Economic Animal and Plant, 1999, 2(1):21-22.
[2] 季中梅,赵旭彤,赵岩,等.鹿肉的营养价值与加工研究进展[J].肉类研究,2013,27(2):32-36.
JI Z M, ZHAO X T, ZHAO Y, et al.Recent advances in research on nutritional value and processing of venison[J].Meat Research, 2013, 27(2):32-36.
[3] 应茵,刘静,张立实,等.马鹿鹿产品营养成分分析[J].卫生研究,2013,42(2):290-294.
YING Y, LIU J, ZHANG L S, et al.Analysis on nutritional component of Cervus elaphus products[J].Journal of Hygiene Research, 2013, 42(2):290-294.
[4] 宋胜利,吴宝江,王哲.中国鹿产品药膳食疗的历史、现状及建议[J].特产研究,2005, 27(4):56-59.
SONG S L, WU B J, WANG Z.The history, situation and suggestion on health building-diet and food therapy of Chinese deer product[J].Special Wild Economic Animal and Plant Research, 2005, 27(4):56-59.
[5] 袁琴琴,刘文营.鹿肉及其产品加工现状与趋势[J].食品研究与开发,2020,41(11):219-224.
YUAN Q Q, LIU W Y.Status and trend of venison and its products processing[J].Food Research and Development, 2020, 41(11):219-224.
[6] 赵红波,谭红,史会兵,等.近红外光谱技术鉴别猪肉和牛肉的研究[J].中国农学通报,2011,27(26):151-155.
ZHAO H B, TAN H, SHI H B, et al.Identification of pork and beef by near infrared spectroscopy[J].Chinese Agricultural Science Bulletin,2011,27(26):151-155.
[7] 古淑青,詹丽娜,赵超敏,等.基于液相色谱-串联质谱法的肉类特征肽段鉴别及掺假测定[J].色谱,2018,36(12):1 269-1 278.
GU S Q, ZHAN L N, ZHAO C M, et al.Identification of meat marker peptides and detection of adulteration by liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2018,36(12):1 269-1 278.
[8] LIU L H, CHEN F C, DORSEY J L, et al.Sensitive monoclonal antibody-based sandwich ELISA for the detection of porcine skeletal muscle in meat and feed products[J].Journal of Food Science,2006,71(1):M1-M6.
[9] DEL RIO-LAV N A, JIMÉNEZ E, PARDO M
N A, JIMÉNEZ E, PARDO M  .SYBR-Green real-time PCR assay with melting curve analysis for the rapid identification of Mytilus species in food samples[J].Food Control, 2021,130:108257.
.SYBR-Green real-time PCR assay with melting curve analysis for the rapid identification of Mytilus species in food samples[J].Food Control, 2021,130:108257.
[10] HUANG Y X, WANG S, GAO Y Q, et al.Comparison of mitochondrial genome and development of specific PCR primers for identifying two scuticociliates, Pseudocohnilembus persalinus and Uronema marinum[J].Parasites & Vectors, 2021, 14(1):318.
[11] POTLURI K, MAHAS A, KENT M N, et al.Genomic DNA extraction methods using formalin-fixed paraffin-embedded tissue[J].Analytical Biochemistry, 2015, 486:17-23.
[12] 徐岩,翟英南,段思琪,等.鹿茸DNA检测试剂盒的研制与评价[J].中国药学杂志,2020,55(11):889-894.
XU Y, ZHAI Y N, DUAN S Q, et al.Development and evaluation of antler DNA detection kit[J].Chinese Pharmaceutical Journal, 2020,55(11):889-894.
[13] 张舒亚,吕蓉,刘月明,等.硫酸软骨素中掺假动物成分的检测研究[J].食品工业科技,2009, 30(1):309-310;318.
ZHANG S Y, LYU R, LIU Y M, et al.Identification of animal derived material in chondroitin sulfate[J].Science and Technology of Food Industry, 2009, 30(1):309-310;318.
[14] 石亚新,葛武鹏,张晓旭,等.基于动物基因信息分析的食用油鉴别检测方法研究[J].现代食品科技,2016,32(5):302-308;294.
SHI Y X, GE W P, ZHANG X X, et al.New method based on animal genetic information for identification and detection of edible oil[J].Modern Food Science and Technology, 2016, 32(5):302-308;294.
[15] 兰春.梅花鹿的养殖现状和发展前景探讨[J].当代畜禽养殖业,2020(9):35-36.
LAN C.Discussion on the current situation and development prospects of sika deer breeding[J].Modern Animal Husbandry, 2020(9):35-36.
[16] 董思敏. 鹿茸鹿源及梅花鹿茸品质评价体系的建立[D].长春:吉林农业大学,2016.
DONG S M.Establishment of evaluation system for quality of velvet antler and Cervus nippon Temminck[D].Changchun:Jilin Agricultural University,2016.
[17] 高丽君,何程远,李盈诺,等.基于双重PCR技术的鹿茸及其伪品DNA指纹特征和鉴定[J].吉林大学学报(医学版),2018,44(4):839-844.
GAO L J, HE C Y, LI Y N, et al.Characteristics and identification of DNA fingerprint of velvet antler and its counterfeits based on duplex PCR technique[J].Journal of Jilin University (Medicine Edition), 2018, 44(4):839-844.
[18] 王凤霞,陈媛媛,任贵奇,等.鹿血的PCR-RFLP鉴定研究[J].中草药,2018,49(8):1 914-1 918.
WANG F X, CHEN Y Y, REN G Q, et al.Identification of deer blood by PCR-RFLP method.[J].Chinese Traditional and Herbal Drugs,2018,49(8):1 914-1 918.
[19] 周亭亭,艾金霞,高丽君,等.鹿胎DNA提取方法、PCR参数优化及其快速检测试剂的开发应用[J].中国药学杂志,2019,54(18):1 481-1 485.
ZHOU T T, AI J X, GAO L J, et al.Development and application of DNA extraction methods,PCR parameter optimization and rapid detection reagent for fetus cervi[J].Chinese Pharmaceutical Journal, 2019,54(18):1 481-1 485
[20] 苑广信,李梓僮,张丽华,等.基于毛细管电泳的鹿鞭DNA指纹鉴定方法[J].中成药,2016,38(3):620-624.
YUAN G X, LI Z T, ZHANG L H, et al.DNA fingerprint identification of Penis et Testis Cervi based on capillary electrophoresis[J].Chinese Traditional Patent Medicine,2016,38(3):620-624.
[21] 高明,王海军,王准,等.基于实时荧光PCR技术鉴别梅花鹿[J].食品安全质量检测学报,2020,11(17):6 147-6 151.
GAO M, WANG H J, WANG Z, et al.Identification of Cervus nippon by fluorescent real-time PCR method[J].Journal of Food Safety & Quality, 2020,11(17):6 147-6 151.
[22] 徐岩,邵博宇,徐宁,等.应用PCR-RFLP方法鉴定梅花鹿茸与马鹿茸[J].中国药学杂志,2020,55(24):2 021-2 028.
XU Y, SHAO B Y, XU N, et al.An experimental study on the identification of sika deer antler and Cervus pilose antler by PCR-RFLP[J].Chinese Pharmaceutical Journal, 2020, 55(24):2 021-2 028.
[23] HOU F X, GAO J H.Molecular authentication of sika deer (Cervus nippon) based on allele-specific PCR.[J].Mitochondrial DNA.Part B, Resources, 2019, 4(2):2 231-2 233.
[24] 刘冬,钱齐妮,张红印,等.基于COI条形码的鹿类中药材DNA条形码分子鉴定[J].世界科学技术-中医药现代化,2014,16(2):274-278.
LIU D, QIAN Q N, ZHANG H Y, et al.Molecular identification of the traditional Chinese medicine of the deers using COI barcode sequence[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2014, 16(2):274-278.