肉的食用品质通常包括嫩度、风味、多汁性、肉色和保水性等,安全性包括微生物、兽药残留控制等[1]。随着消费者对食品品质和安全性要求的提高,食品品质和安全检测日益重要[2]。传统的肉品食用品质分析多采用感官分析和仪器分析,微生物检测多采用平板菌落计数[1]。上述传统分析方法通常费时、费力,因此开发快速的品质、安全检测方法至关重要。
拉曼散射效应是印度物理学家C.V.RAMAN于1928年首次发现的。在克服了散射信号弱、荧光干扰强、检测效率低、数据处理慢等问题后[2],拉曼光谱(Raman spectroscopy)技术由于具有快速、原位、无损伤检测等特点,在食品领域的应用研究受到广泛关注。在肉的品质和安全分析中,色散型拉曼光谱[3-4](dispersive Raman,DIS-Raman)和傅立叶变换拉曼光谱[5-6](Fourier transform Raman,FT-Raman)技术均有应用;为了提高在食品致病菌、兽药残留等分析中的检测效率,还有研究使用了表面增强拉曼光谱[7-8](surface-enhanced Raman spectroscopy,SERS)、空间偏移拉曼光谱[9](spatially offset Raman spectroscopy,SORS)等技术。拉曼光谱技术的应用研究日新月异,及时总结、分析最新研究成果,对拉曼光谱技术的发展及其在我国肉类产业中的应用具有重要意义。
因此,本文总结了拉曼光谱在肉与肉制品研究中常用的拉曼位移、信号来源及其与肉品品质、安全的关系,并从拉曼光谱技术预测、分析肉的食用品质、营养成分、食品安全控制和肉的掺假等方面详细论述了拉曼光谱在肉的品质、安全控制中的应用,以及拉曼光谱在肉品研究中常用的光谱处理和数据分析方法,同时分析了影响拉曼光谱预测准确性的因素和解决措施,以期为拉曼光谱在肉的品质控制中的研究提供新思路,并推进拉曼光谱技术在肉类产业中的应用。
1 拉曼光谱的技术原理及其在肉品研究中应
用的理论基础
处于基态的样品分子受到外来光子的激发后,其能量状态变成不稳定的中间状态,样品分子在离开中间能量状态时随机辐射光子。激发光的光子与物质分子相碰撞,可产生弹性碰撞和非弹性碰撞。在弹性碰撞过程中,二者没有发生能量交换,光子频率保持恒定,这种散射现象称为瑞利散射(Rayleigh scattering)[10]。在非弹性碰撞过程中,光子与分子有能量交换,光子转移一部分能量给散射分子,或者从散射分子中吸收一部分能量,从而使其频率改变,由于不同的化学键或基团有不同的能量改变,并产生相应的光子频率变化,因此根据光子频率变化就可以判断出分子中所含有的化学键或基团。这种分子对光子的非弹性散射效应即是拉曼光谱技术的原理[11]。散射光频率与入射光频率差值称为拉曼位移。
肉与肉制品的物质组成、含量及其在加工过程中蛋白质二级结构的变化能通过拉曼位移反映出来,这成为拉曼光谱在肉与肉制品加工和品质、安全控制中应用的基础。图1是典型的生鲜牛肉拉曼光谱,其中的酰胺Ⅰ带(1 645~1 685 cm-1)、酰胺Ⅲ带(1 200~1 235 cm-1)与肉的品质相关性最大。酰胺I带主要包括α-螺旋(1 650~1 658 cm-1),β-折叠(1 665~1 680 cm-1)、β-转角(1 680 cm-1)和无规则卷曲(1 660~1 665 cm-1)结构[12]。
表1概括了肉品研究中常用的拉曼位移、信号来源及其与肉品质的关系。肉品研究中常用的拉曼位移主要处于500~1 800 cm-1,涉及到的信号来源有色氨酸等多种氨基酸;C—CN等基团的拉伸、弯曲、剪振以及α螺旋、β-折叠β-转角等,主要用于肉的品质(嫩度、pH值、保水性、肉色)预测、异质肉[PSE(pale, soft, exudative)肉、DFD(dark, firm, dry)肉]判定、货架期预测和掺假肉的鉴别。
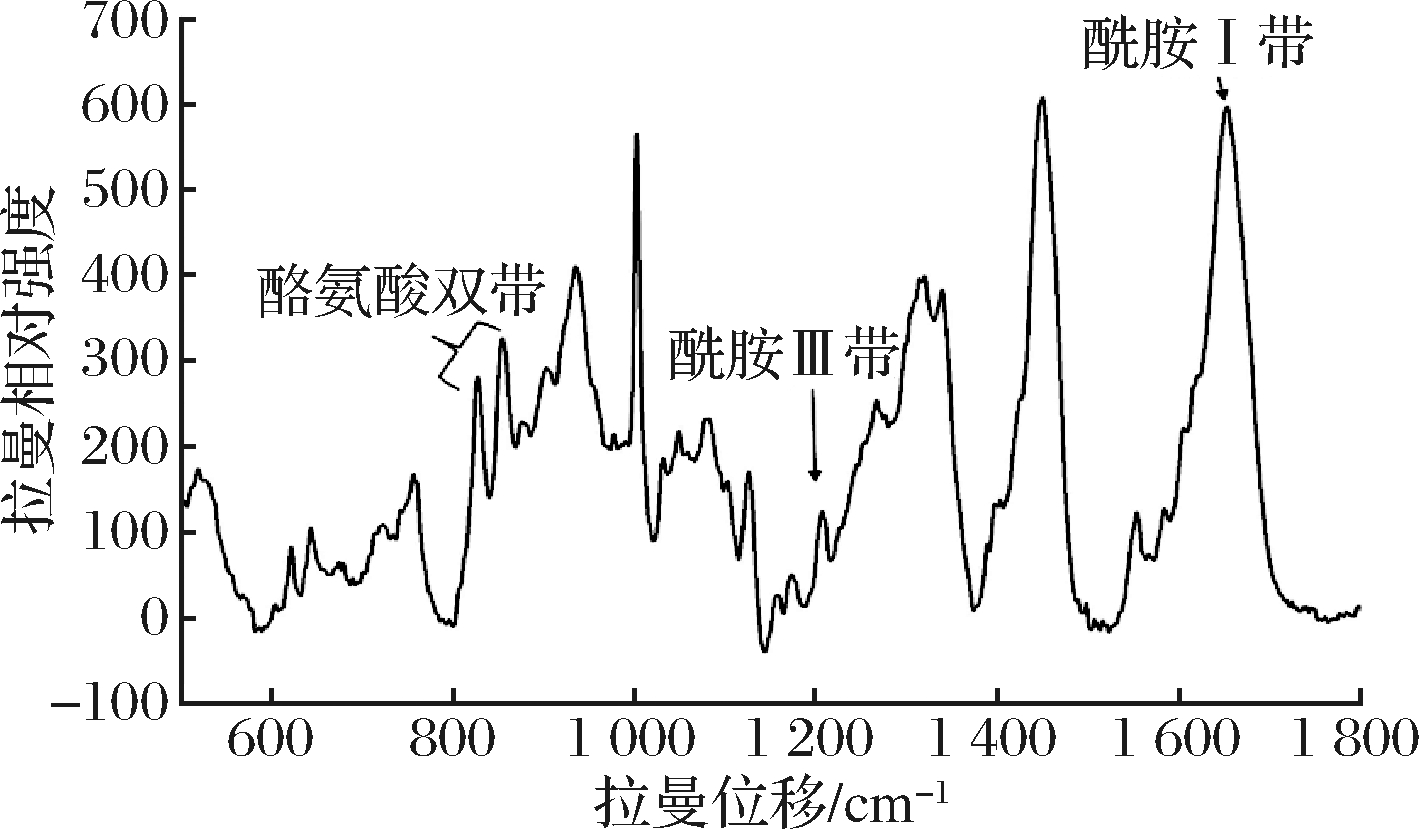
图1 宰后1 d牛肉的拉曼光谱
Fig.1 Raman Spectroscopy of beef 1 day post-mortem
表1 肉品研究中常用的拉曼位移及与肉品质的关系
Table 1 Overview of Raman shift used in meat science and its relationship with meat quality

拉曼位移/cm-1信号来源作用或与肉品质的关系530、640~720ν(S—S)拉伸(半胱氨酸、蛋氨酸)530 cm-1信号强度与加热中心温度呈负相关[13],650 cm-1信号强度与剪切力呈负相关[14]755色氨酸判断肉的货架期[15]760色氨酸与肉制品嫩度呈正相关[16]825、855酪氨酸825 cm-1与855 cm-1并称为酪氨酸双带,两者比值可以监测酪氨酸残基的状态[17]。855 cm-1信号强度与嫩度呈负相关[17],与肉的货架期相关[15]826对称PO2-3拉伸振动与类PSE猪肉呈负相关[18],与肉的保水性呈正相关[4]875无机磷酸盐预测猪肉pH值[19]920~950α-螺旋α-螺旋信号特别是920、930 cm-1信号强度与嫩度呈正相关[14,19]937C—CN拉伸鉴定牛肉掺假[5]970C—H弯曲与脂肪不饱和度呈正相关[20]974C—H离面形变判别牛肉马肉[21]998~1 006β-折叠与肉[14]、肉制品[22]嫩度相关1 003苯丙氨酸常用作内参,对环境变化不敏感,但对蛋白质含量变化敏感[23]1 059、1 061C—C面外振动与肉中脂肪饱和度呈正相关[24]1 124三磷酸腺苷预测宰后24 h pH值[25]1 213反对称磷酰基拉伸判别牛肉马肉[21]1 225~1 350酰胺Ⅲ带提供蛋白质的二级结构信息[26],与加热中心温度相关[13]1 260、1 264C—H形变信号强度与多不饱和脂肪酸呈负相关[24]1 265、1 300、1 312、1 305α-螺旋与肉的嫩度呈正相关[27-28],与肉制品凝胶强度呈负相关[22]1 290C—H扭转震动与肉中脂肪饱和度呈正相关[23]1 296氧合肌红蛋白与肉色相关[18]1 356、1 358脱氧肌红蛋白与肉色相关[29]1 367色氨酸环拉伸与肉的保水性相关[30]1 370高铁肌红蛋白与肉色相关[29]1 377氧合肌红蛋白与肉色相关[29]1 438—CH2剪振与肉中脂肪饱和度呈正相关[24]1 445—CH2形变与脂肪不饱和程度呈正相关[29]1 450—CH2剪振常用作内参,对环境变化和蛋白质含量敏感,与蛋白质水合作用呈负相关[6]1 460~1 483—CH2剪振与多汁性呈正相关[14]1 508脱氧肌红蛋白与肉色相关[18]1 551色氨酸判断肉的货架期[15]。与1 576 cm-1的比值反映三磷酸腺苷向肌苷酸的转化比例[18]1 600~1 700酰胺Ⅰ带提供肉中蛋白质的二级结构信息[26,31],与加热中心温度相关[13],与肉的保水性呈负相关[30]
续表1

拉曼位移/cm-1信号来源作用或与肉品质的关系1 602、1 642脱氧肌红蛋白与肉色相关[18]1 635氧合肌红蛋白与肉色相关[18]1 660~1 665无规则卷曲与肉制品的质构相关,1 660 cm-1与肉的多汁性呈正相关[15]1 645~1 658α-螺旋与嫩度呈正相关[18]1 650、1 655、1 656、1 658CC拉伸与不饱和脂肪酸含量呈正相关[20]1 665~1 680β-折叠与肉制品的质构相关[31-33]1 680β-转角与肉制品的质构相关[31]1 745CO拉伸与1 665 cm-1的比例判断脂肪饱和度[34]
2 拉曼光谱技术在肉与肉制品品质控制中的应用
2.1 拉曼光谱在肉制品品质预测与分析中的应用
2.1.1 pH值
pH值是肉的关键品质指标,pH值过高或过低的肉,品质较差,均为异质肉[1]。肉的极限pH值大于6.1时,为DFD肉,该类肉表面干燥、货架期短且有轻微的肥皂味;极限pH值低于5.4时,为PSE肉,该类肉汁液渗出严重、货架期短[1]。因此,实现pH值的快速预测和异质肉的快速判定,对于保证肉品质的一致性有重要意义。
如表2所示,拉曼光谱能够快速预测宰后初期猪肉、羊肉的pH值。SCHEIER等[38]较早得将拉曼光谱应用于宰后早期预测猪肉品质,研究发现磷酸基团(980 cm-1和1 080 cm-1)拉曼信号可以用于预测宰后早期的pH值(R2=0.71),后续的研究发现宰后初期磷酸化代谢物质与无机磷酸拉曼信号的变化与pH值的降低有关;可以利用磷酸肌酸、三磷酸腺苷、二磷酸腺苷和α-螺旋区分正常和异质肉[18]。之后该研究小组首次将便携式拉曼光谱应用于生猪屠宰线,实现利用糖原、乳酸、肌酸、磷酸肌酸、三磷酸腺苷、二磷酸腺苷的拉曼信号快速预测宰后35 min和24 h肉的pH值[25, 35]。但是相比实验室条件下的预测准确性,在生产条件下pH值预测模型的R2值仅为0.58,预测能力显著下降。随后NACHE等[36-37]利用偏最小二乘回归等多种数据处理方法进一步提高了猪肉pH值在线预测的准确性。FOWLER等[19]将拉曼光谱应用于完整的半膜肌pH值的在线预测,结果发现预测模型的R2为0.35,这一数值与猪肉pH值的预测准确性相比略低。其原因可能与羊肉中含有较少的Ⅱ B型肌纤维有关,也可能与其未合理处理拉曼光谱数据有关。
表2 拉曼光谱技术在预测肉的pH值中的应用
Table 2 Application of Raman spectroscopy in prediction of pH of meat
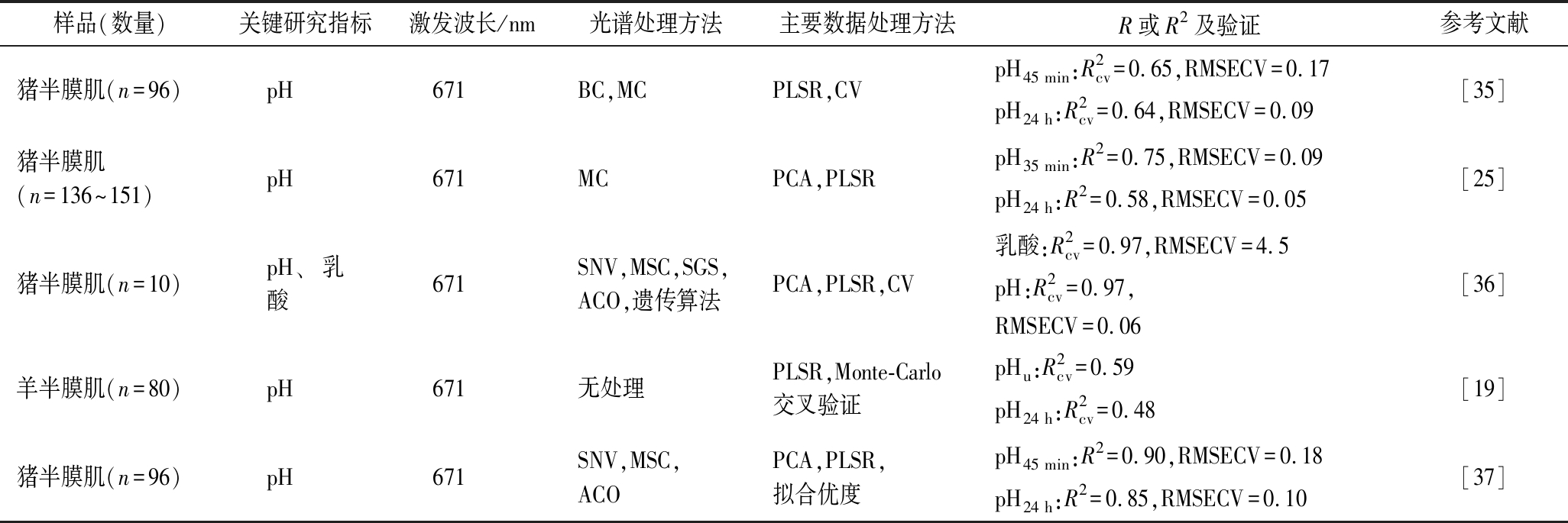
样品(数量)关键研究指标激发波长/nm光谱处理方法主要数据处理方法R或R2及验证参考文献猪半膜肌(n=96)pH671BC,MCPLSR,CVpH45 min:R2cv=0.65,RMSECV=0.17pH24 h:R2cv=0.64,RMSECV=0.09[35]猪半膜肌(n=136~151)pH671MCPCA,PLSRpH35 min:R2=0.75,RMSECV=0.09pH24 h:R2=0.58,RMSECV=0.05[25]猪半膜肌(n=10)pH、乳酸671SNV,MSC,SGS,ACO,遗传算法PCA,PLSR,CV乳酸:R2cv=0.97,RMSECV=4.5pH:R2cv=0.97,RMSECV=0.06[36]羊半膜肌(n=80)pH671无处理PLSR,Monte-Carlo交叉验证pHu:R2cv=0.59pH24 h:R2cv=0.48[19]猪半膜肌(n=96)pH671SNV,MSC,ACOPCA,PLSR,拟合优度pH45 min:R2=0.90,RMSECV=0.18pH24 h:R2=0.85,RMSECV=0.10[37]
注:BC为基线校正,MC为均值中心化,SNV为标准正态变换,MSC为多元散射校正,SGS为Savitzky-Golay平滑,ACO为蚁群优化算法,PLSR为偏最小二乘回归,CV为交叉验证,PCA为主呈分分析,![]() 为交叉验证回归系数,RMSECV为交叉验证的均方根误差(下同),pH45 min为宰后45 min的pH值,pH24 h为宰后24 h的pH值,pHu为极限pH值
为交叉验证回归系数,RMSECV为交叉验证的均方根误差(下同),pH45 min为宰后45 min的pH值,pH24 h为宰后24 h的pH值,pHu为极限pH值
2.1.2 嫩度
嫩度是肉的重要食用品质指标,分析肉的嫩度通常采用感官评定或测定剪切力的方法[1],但测定肉的剪切力费时、费力。因此,开发快速无损预测肉嫩度的方法对于控制肉的品质具有重要意义。
在使用拉曼光谱预测牛米龙[14]、牛背最长肌、半腱肌、臀中肌[39]、羊背最长肌[40]的剪切力时具有较高的准确性,且可以实现对肉感官品质的预测[14, 41](表3)。然而,在FOWLER的研究中,预测羊半膜肌[27]、羊背最长肌[40]、牛背最长肌[42]剪切力时的准确性较差,且在预测模型中增加肌原纤维断裂、粒子直径、肌节长度和pH值均不能提高预测准确性[27, 40]。经分析发现,FOWLER倾向于不处理或少处理光谱数据,这可能是其预测准确性低的原因,也突出了数据分析方法在拉曼光谱技术中的重要性。
表3 拉曼光谱在预测和分析肉的嫩度中的应用
Table 3 Application of Raman spectroscopy in prediction and analysis of meat tenderness
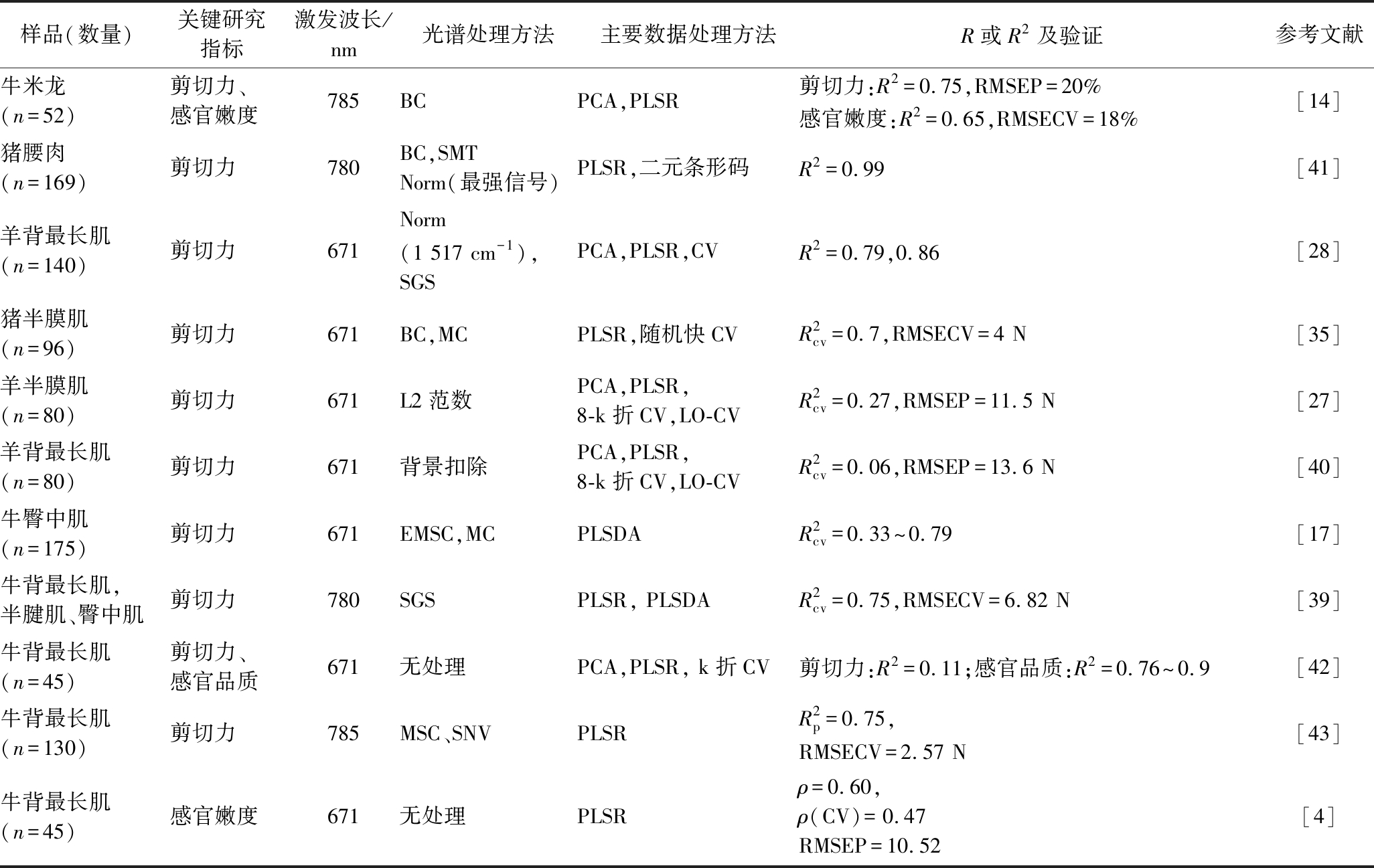
样品(数量)关键研究指标激发波长/nm光谱处理方法主要数据处理方法R或R2及验证参考文献牛米龙(n=52)剪切力、感官嫩度785BCPCA,PLSR剪切力:R2=0.75,RMSEP=20%感官嫩度:R2=0.65,RMSECV=18%[14]猪腰肉(n=169)剪切力780BC,SMTNorm(最强信号)PLSR,二元条形码R2=0.99[41]羊背最长肌(n=140)剪切力671Norm(1 517 cm-1),SGSPCA,PLSR,CVR2=0.79,0.86[28]猪半膜肌(n=96)剪切力671BC,MCPLSR,随机快CVR2cv=0.7,RMSECV=4 N[35]羊半膜肌(n=80)剪切力671L2范数PCA,PLSR,8-k折CV,LO-CVR2cv=0.27,RMSEP=11.5 N[27]羊背最长肌(n=80)剪切力671背景扣除PCA,PLSR,8-k折CV,LO-CVR2cv=0.06,RMSEP=13.6 N[40]牛臀中肌(n=175)剪切力671EMSC,MCPLSDAR2cv=0.33~0.79[17]牛背最长肌,半腱肌、臀中肌剪切力780SGSPLSR, PLSDAR2cv=0.75,RMSECV=6.82 N[39]牛背最长肌(n=45)剪切力、感官品质671无处理PCA,PLSR, k折CV剪切力:R2=0.11;感官品质:R2=0.76~0.9[42]牛背最长肌(n=130)剪切力785MSC、SNVPLSRR2p=0.75,RMSECV=2.57 N[43]牛背最长肌(n=45)感官嫩度671无处理PLSRρ=0.60,ρ(CV)=0.47RMSEP=10.52[4]
注:SMT为平滑,Norm(最强信号)指以信号最强的拉曼位移为参照标准化,Norm(1 517 cm-1)指以1 517 cm-1拉曼位移信号为参照标准化,EMSC为扩展的多元散射校正,RMSEP为预测的均方根标准误差,LO-CV为留一法交叉验证,PLSDA为偏最小二乘判别分析(下同),![]() 为预测相关系数,ρ为为预测值与实测值的相关系数(下同),ρ(CV)为预测值与测定值的交叉验证相关系数,感官品质包括嫩度、风味、多汁性和总体喜好
为预测相关系数,ρ为为预测值与实测值的相关系数(下同),ρ(CV)为预测值与测定值的交叉验证相关系数,感官品质包括嫩度、风味、多汁性和总体喜好
此外,不同物种、不同部位间肌肉的类型不同,以及肌肉内糖原含量、Z线宽度等不同,会导致拉曼光谱的预测准确性不同[19]。颜色较深的肉会增加光吸收导致拉曼信号降低[19],而较韧的肉拉曼信号强于嫩的肉,其原因可能是韧度高的肉蛋白质密度高,增加了散射分子并最终增强了拉曼信号[17]。因此,肌肉僵直期间拉曼光谱信号强,而肌肉成熟后肌纤维结构的降解则降低了拉曼信号[27],导致牛肉宰后1 d拉曼光谱的预测准确性高于其宰后5 d拉曼光谱的预测准确性[40]。
拉曼光谱还可用于分析肉嫩度差异的原因。FOWLER等[24]发现嫩度高和嫩度低的牛肉之间α-螺旋(930 cm-1)和酪氨酸双带(826 cm-1和853 cm-1)的拉曼光谱显著不同。在嫩度差的肉中,α-螺旋的量降低,β-折叠或无规则卷曲含量高[27],而嫩度高的肉酪氨酸双带强,嫩度差的肉酪氨酸双带弱[27-28]。酪氨酸存在于多种蛋白质中,酪氨酸的拉曼位移强度直接反映了肉在成熟过程中蛋白质水解产生的自由酪氨酸的量[44]。拉曼位移830 cm-1信号强度的降低代表酪氨酸酚羟基与氧结合,降低了肌原纤维的降解能力,使肉的嫩度变差[44]。
2.1.3 肉色和保水能力
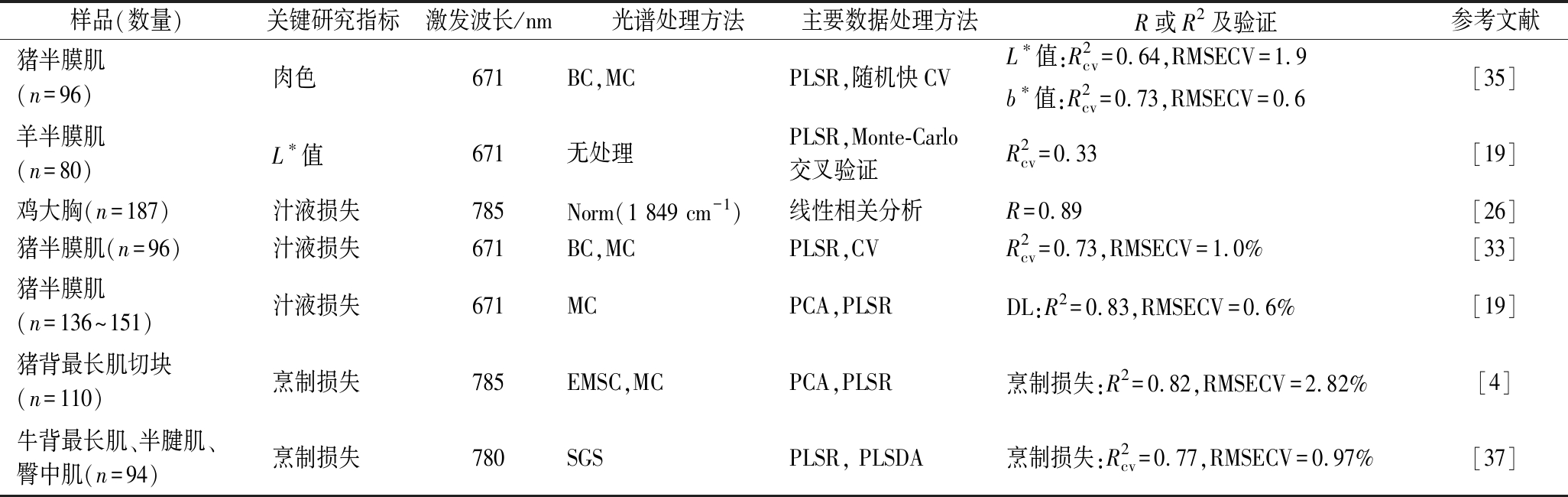
拉曼光谱可以通过1 296、1 356、1 358、1 370、1 377 cm-1等与肌红蛋白相关的拉曼位移,以及1 367、1 600~1 700 cm-1等与保水性相关的拉曼位移预测肉的颜色和保水性(表1)。从表4可以看出,拉曼光谱可以用于预测肉的颜色、汁液损失和烹制损失。肉色是肉的重要商品属性,肉色影响消费者的购买意愿[1],SCHEIER等[35]发现拉曼光谱与猪肉的L*和b*值具有较高的相关性,而FOWLER等[19]发现拉曼光谱与羊肉的L*值相关性较差。由于利用色差计能够实现对肉色的快速测量,拉曼光谱用于预测肉色的实用性较小,因此拉曼光谱在肉色判定领域的研究相对较少。
肉的保水性与产品出品率相关,且肉的保水性测定较为费时,因此研究利用拉曼光谱快速预测肉的保水性具有重要意义。已有的研究发现拉曼光谱能够较好地实现鸡肉、猪肉和牛肉的保水性的快速预测,拉曼光谱与保水性的拟合效果较好(表4)。但是在鸡肉和牛肉的模型中,仍存在样本量较少的问题,因此增加样本量进一步提高拟合效果,是拉曼光谱用于实际生产中进行保水性预测的关键。
表4 拉曼光谱在预测和分析肉色和保水性中的应用
Table 4 Application of Raman spectroscopy in prediction of meat colour and water holding capability
样品(数量)关键研究指标激发波长/nm光谱处理方法主要数据处理方法R或R2及验证参考文献猪半膜肌(n=96)肉色671BC,MCPLSR,随机快CVL∗值:R2cv=0.64,RMSECV=1.9b∗值:R2cv=0.73,RMSECV=0.6[35]羊半膜肌(n=80)L∗值671无处理PLSR,Monte-Carlo交叉验证R2cv=0.33[19]鸡大胸(n=187)汁液损失785Norm(1 849 cm-1)线性相关分析R=0.89[26]猪半膜肌(n=96)汁液损失671BC,MCPLSR,CVR2cv=0.73,RMSECV=1.0%[33]猪半膜肌(n=136~151)汁液损失671MCPCA,PLSRDL:R2=0.83,RMSECV=0.6%[19]猪背最长肌切块(n=110)烹制损失785EMSC,MCPCA,PLSR烹制损失:R2=0.82,RMSECV=2.82%[4]牛背最长肌、半腱肌、臀中肌(n=94)烹制损失780SGSPLSR, PLSDA烹制损失:R2cv=0.77,RMSECV=0.97%[37]
注:Norm(1 849 cm-1)指以1 849 cm-1拉曼位移信号为参照标准化
2.2 拉曼光谱在肉制品营养品质分析中的应用
由表5知,拉曼光谱技术在分析肉中水分含量、蛋白质含量、脂肪含量以及脂肪酸组成上得到应用并取得了较好的结果,较早期的研究首先将拉曼光谱应用于脂肪组织中碘值和脂肪酸含量的测定,且均得到较理想的拟合效果[13,41-42]。近年来,学者们进一步将拉曼光谱应用于肌肉组织中肌内脂肪含量和脂肪酸含量的测定,发现拉曼光谱对多不饱和脂肪酸的预测效果较好,R2达0.93[18],但是对于肌内脂肪含量的预测效果,不同的研究团队所得的研究结果有所差异。WANG等[41]在不同时间、使用不同设备检测拉曼光谱技术预测脂肪含量的有效性和准确性证明了拉曼光谱建立的模型在经过多元散射校正后具有良好的预测能力。脂肪含量和脂肪酸组成是影响肉质量的重要因素[1],建立快速检测原料肉和肉制品中脂肪含量、脂肪酸谱的方法不但对产品质量控制具有重要意义,还能为产品的快速分级奠定基础。但是,目前利用拉曼光谱对脂肪含量和脂肪酸含量进行预测的研究较少,尤其是对肌肉中脂肪酸组成的预测更是少之又少。
2.3 拉曼光谱在肉制品安全控制中的应用
微生物腐败和致病菌污染是影响食品安全的重要因素。由于传统的微生物分析方法费时费力,肉类工业亟需能够快速、无损的肉品腐败和致病菌检测技术。如表6所示,拉曼光谱可以实现对生鲜肉和肉糜货架期的预测,并实现一些重要食源性致病菌的快速检测。
使用拉曼光谱可以准确预测不同包装下肉的细菌总数、乳酸菌、肠杆科菌、假单胞菌、热杀索丝菌及酵母菌和霉菌[3, 47],且其预测准确度较高,或者对不同腐败状态的肉进行分类判断[15, 48],可以实现肉品货架期的预测或快速判定。在致病菌方面,研究发现拉曼光谱可以对单增李斯特菌、沙门氏菌、金黄色葡萄球菌和小肠结肠炎耶尔森氏茵在属、种和株3个层次上进行鉴定,样品处理加拉曼光谱分析总时间少于2 h,属于快速分析方法[49]。此外,研究发现拉曼光谱中拉曼位移1 520、1 330、1 030、875 cm-1 仅存在于生物膜中,可以作为沙门氏菌生物膜的特征光谱[50]。兽药残留也是消费者关注的重要食品安全问题。翟晨等[7]和班晶晶等[8]使用表面增强拉曼光谱分析了肉中的兽药残留,结果表明拉曼光谱在兽药残留分析中具有较高的准确性。由此可见拉曼光谱不但可以对不同微生物进行快速、准确的判定,还能分析微生物的成膜特性进而为开发合理的抑菌杀菌措施奠定基础。需要注意的是,兽药的残留量数量级较小,因此通常采用表面增强拉曼光谱技术进行分析。
表5 拉曼光谱在肉品营养成分中的应用
Table 5 Application of Raman spectroscopy in prediction of nutrient content of meat
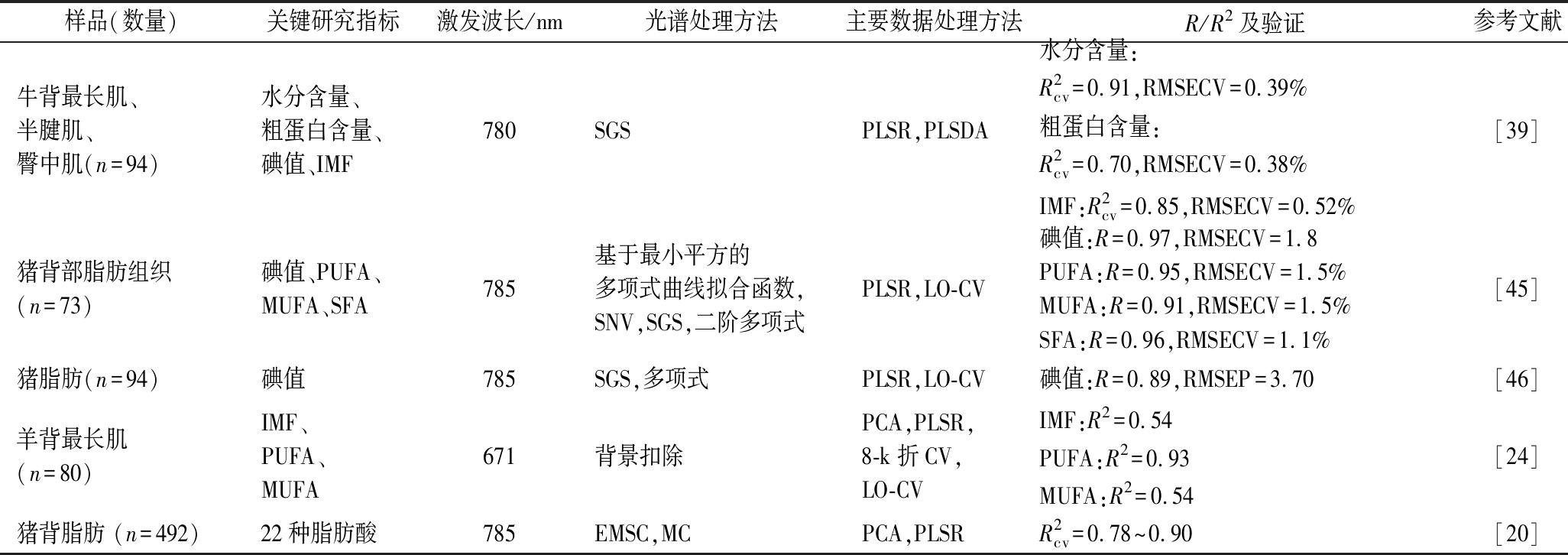
样品(数量)关键研究指标激发波长/nm光谱处理方法主要数据处理方法R/R2及验证参考文献牛背最长肌、半腱肌、臀中肌(n=94)水分含量、粗蛋白含量、碘值、IMF780SGSPLSR,PLSDA水分含量:R2cv=0.91,RMSECV=0.39%粗蛋白含量:R2cv=0.70,RMSECV=0.38%IMF:R2cv=0.85,RMSECV=0.52%[39]猪背部脂肪组织(n=73)碘值、PUFA、MUFA、SFA785基于最小平方的多项式曲线拟合函数,SNV,SGS,二阶多项式PLSR,LO-CV碘值:R=0.97,RMSECV=1.8PUFA:R=0.95,RMSECV=1.5%MUFA:R=0.91,RMSECV=1.5%SFA:R=0.96,RMSECV=1.1%[45]猪脂肪(n=94)碘值785SGS,多项式PLSR,LO-CV碘值:R=0.89,RMSEP=3.70[46]羊背最长肌(n=80)IMF、PUFA、MUFA671背景扣除PCA,PLSR,8-k折CV,LO-CVIMF:R2=0.54PUFA:R2=0.93MUFA:R2=0.54[24]猪背脂肪 (n=492)22种脂肪酸785EMSC,MCPCA,PLSRR2cv=0.78~0.90[20]
注:PUFA为多不饱和脂肪酸,MUFA为单不饱和脂肪酸,SFA为饱和脂肪酸,IMF为肌内脂肪含量
表6 拉曼光谱在肉与肉制品食品安全控制和掺假判定中的应用
Table 6 Application of Raman spectroscopy in safety control and adulteration judgment of meat and meat products

样品(数量)关键研究指标激发波长/nm光谱处理方法主要数据处理方法r/R2及验证、结果参考文献牛背最长肌(n=20)菌落总数乳酸菌数785背景扣除PLSR菌落总数:R2cv=0.90~0.99,RMSEP=0.38~0.61乳酸菌:R2cv=0.75~0.99,RMSEP=0.54~0.60[3]牛肉糜(n=72)货架期633SNVPLSR,SVMR,GP,GA,ANNA菌属总数:R2=0.80,RMSE=0.51假单胞菌:R2=0.70,RMSE=0.56乳酸菌:R2=0.79,RMSE=0.42热杀索丝菌:R2=0.73,RMSE=0.68肠杆菌科:R2=0.72,RMSE=0.44酵母、霉菌:R2=0.63,RMSE=0.55[47]猪背最长肌(n=16)半膜肌(n=14)货架期671BC,SGS,二次多项式,MCPCA区分新鲜与腐败肉(106 CFU/cm2)[15]鸡胸肉(n=84)货架期785SGS,Norm(1 006 cm-1)PCA程序聚类分析可将产品分为新鲜、半新鲜、腐败三组[48]肉源培养基沙门氏菌成膜性514.5背景扣除,BC菌膜与浮游菌化学组成不同[50]以肉为基础的培养基19种肉源微生物532统计敏感的非线性迭代峰截割算法,标准化无监督层次聚类,支持向量机,径向基核函数革兰氏阴性阳性鉴定正确率99.2%属水平鉴定正确率73.5%~100%株水平鉴定正确率89.8%~100%[49]猪肉(n=60)瘦肉精(沙丁胺醇)785SGS,自适应迭代重加权惩罚最小二乘法多元线性ρ=0.912检出限0.01 mg/kg[7]鸡肉(n=15)恩诺沙星780SNVPLSR,竞争性正自适应加权Rp=0.877RMSEP=0.093[8]马肉牛肉糜掺假判定1 064标准化一元线性回归R2=0.94[5]掺入不同比例马肉的牛肉(n=49)掺假判断785求导数,BC,MC,标准化,平滑与自动缩放PCA区别掺入不同比例马肉的牛肉[21]马、绵羊、猪、鱼、禽、山羊和水牛肉及其色拉米制品(n=132)原料分析785BC,求导数,MC,标准化,平滑与自动缩放PCA鉴定肉或肉制品原料的物种[51]牛、羊、鹿肉(n=90)品种判定1 064背景扣除,BC,SNV,SGSPCA,SVMR,PLSDA鉴别牛肉、鹿肉和羊肉[52]
注:Norm(1 006 cm-1)指以1 006 cm-1拉曼位移信号为参照标准化,SVMR为支持向量机回归,GP为基因编程,GA为遗传算法,ANNA为人工神经网络分析
2.4 拉曼光谱在肉与肉制品掺假分析中的应用
掺假肉的快速、准确鉴别和食品原料的来源分析是商品打假的技术基础。如表6所示,ZAJ![]() C等[5]使用傅立叶变换拉曼光谱分析牛肉中掺入马肉,结果表明其预测准确性较高(R2=0.94),而色散型拉曼光谱也可以结合主成分分析准确判定掺入马肉的牛肉[21, 51];拉曼光谱不但能确定牛、绵羊、猪、鱼、禽、山羊和水牛肉鲜肉的物种来源,还能准确区分上述不同来源物种的肉加工的色拉米[51]。拉曼光谱技术为肉的掺假判断提供了新的技术支持,但是该技术在肉掺假领域中的研究还比较有限。
C等[5]使用傅立叶变换拉曼光谱分析牛肉中掺入马肉,结果表明其预测准确性较高(R2=0.94),而色散型拉曼光谱也可以结合主成分分析准确判定掺入马肉的牛肉[21, 51];拉曼光谱不但能确定牛、绵羊、猪、鱼、禽、山羊和水牛肉鲜肉的物种来源,还能准确区分上述不同来源物种的肉加工的色拉米[51]。拉曼光谱技术为肉的掺假判断提供了新的技术支持,但是该技术在肉掺假领域中的研究还比较有限。
拉曼光谱技术在肉品中的应用涵盖了pH值、嫩度、颜色、保水性、营养成分、货架期与致病菌、掺假判断等多个研究领域。除了上述应用外,拉曼光谱技术在肉品中还涉及抗氧化效果鉴定[53]、反复冻融牛肉鉴定[20, 34, 54-55]、判断不同分割部位[9]等方面的研究。
3 总结与展望
拉曼光谱是一种基于拉曼散射效应的光谱分析技术。该技术具有快速、原位、无损检测、无需样品处理等特点,可以在分子水平上提供材料组成和结构变化的信息。目前,拉曼光谱广泛应用于鲜肉和肉制品的研究。研究对象涵盖了猪牛羊禽鱼等多个物种的分割肉或肉制品,研究内容则涵盖测定或预测肉的pH、嫩度、颜色、保水性等食用品质,以及肉的营养成分、货架期、微生物及兽药残留等,且大部分研究得到较准确的分析、预测结果。研究结果明确了拉曼位移与肉品质的关系,确立了某些肉的品质的特征拉曼光谱,这些拉曼位移可以作为一种肉质性状的标记,也可以解释肉质性状发展的内在机制。在本文综述的研究中,应用的激发波长有7种,应用最多的激发波长是671 nm和785 nm。光谱的预处理应用最多的是基线校正、平滑、均值中心化和标准化。在数据处理上,主成分分析、偏最小二乘回归、偏最小二乘判别分析和留一法交叉验证应用较多,且得到良好的分类和预测结果。拉曼光谱在预测肉类pH值、嫩度、颜色、保水性等食用品质时具有较高的预测准确度。但拉曼光谱预测肉类嫩度时,不同的研究之间存在很大的差异。该技术还可以预测肉的营养价值,如肌内脂肪含量、碘值、饱和、不饱和脂肪酸,但仍需要更多的研究来对预测模型进行改进和优化。此外,拉曼光谱在肉类安全领域有着广泛的应用,如预测肉和肉制品的货架期,或通过拉曼光谱检测肉类中的沙门氏菌属。最后,拉曼光谱还可检测肉类掺假,区分肉类来源的种类。总而言之,拉曼光谱是预测肉类品质性状、营养、肉类腐败和病原体污染以及鉴别掺假的有力工具。本文总结了大量研究的样品数量、激发波长、光谱及数据处理方法和结果准确性等,为拉曼光谱技术在肉类研究中的应用提供了技术参数指导和研究思路,并为研究肉制品品质形成的机理提供了拉曼光谱这一新方法。
然而拉曼光谱在肉品中的应用还存在以下问题:第一,每个物种的分割肉块或产品具有独特的拉曼光谱,还需要大量扫描光谱数据并建立其与各品质、安全指标间的关系以待应用。第二,目前拉曼光谱在肉品中的应用研究还处于少量样品的科研阶段,如何保证拉曼光谱在原料和环境复杂多变的生产中保持预测准确性,还需要科研人员努力解决。第三,不同研究在预测生鲜肉嫩度时准确性的差别较大,尚需要大量研究并结合日益发展的数理统计方法以提高拉曼光谱预测生鲜肉嫩度的准确性。虽然拉曼光谱在肉与肉制品中的应用还存在诸多问题,但是拉曼光谱快速、无损的检测能力为工业化在线应用提供了可能,必将成为一个具有广大应用前景的朝阳技术。
[1] HOPKINS D L.Chapter 12-The Eating Quality of Meat:Ⅱ—Tenderness[M]// Lawrie′s Meat Science:Woodhead Publishing,2017:357-381.
[2] QIN J, CHAO K, KIM M S.Introduction to Raman Chemical Imaging Technology[M]// Computer Vision Technology for Food Quality Evaluation.Amsterdam: Elsevier, 2016.
[3] YANG H B, HOPKINS D L, ZHANG Y M, et al.Preliminary investigation of the use of Raman spectroscopy to predict beef spoilage in different types of packaging[J].Meat Science, 2020, 165:108136.
[4] FOWLER S M, SCHMIDT H, VAN DE VEN R, et al.Preliminary investigation of the use of Raman spectroscopy to predict meat and eating quality traits of beef loins[J].Meat Science, 2018, 138:53-58.
[5] ZAJ![]() C A, HANUZA J, DYMI
C A, HANUZA J, DYMI SKA L.Raman spectroscopy in determination of horse meat content in the mixture with other meats[J].Food Chemistry, 2014, 156:333-338.
SKA L.Raman spectroscopy in determination of horse meat content in the mixture with other meats[J].Food Chemistry, 2014, 156:333-338.
[6] HERRERO A M, CAMBERO M I, ORD
 EZ J A, et al.Plasma powder as cold-set binding agent for meat system:Rheological and Raman spectroscopy study[J].Food Chemistry, 2009, 113(2):493-499.
EZ J A, et al.Plasma powder as cold-set binding agent for meat system:Rheological and Raman spectroscopy study[J].Food Chemistry, 2009, 113(2):493-499.
[7] 翟晨, 李永玉, 彭彦昆,等.表面增强拉曼光谱快速检测生鲜肉中的瘦肉精[J].农业工程学报, 2017, 33(7):275-280.
ZHAI C, LI Y Y, PENG Y K, et al.Rapid detection of salbutamol in fresh muscle tissues based on surface enhanced Raman spectroscopy[J].Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(7):275-280.
[8] 班晶晶, 刘贵珊, 何建国, 等.基于表面增强拉曼光谱与二维相关光谱法检测鸡肉中恩诺沙星残留[J].食品与机械, 2020, 36(7):55-58.
BAN J J, LIU G S, HE J G, et al.Detection of enrofloxacin residues in chicken based on surface enhanced Raman spectroscopy and two-dimensional correlation spectroscopy[J].Food & Machinery, 2020, 36(7):55-58.
[9] OSTOVAR POUR S, FOWLER S M, HOPKINS D L, et al.Differentiating various beef cuts using spatially offset Raman spectroscopy[J].Journal of Raman Spectroscopy, 2020, 51(4):711-716.
[10] ANDREWS D L.Rayleigh Scattering and Raman Effect, Theory[M]//Encyclopedia of Spectroscopy and Spectrometry.Amsterdam:Elesvier,2017:924-930.
[11] LI-CHAN E C Y.The applications of Raman spectroscopy in food science[J].Trends in Food Science & Technology, 1996, 7(11):361-370.
[12] YANG H J, ZHANG W G, LI T, et al.Effect of protein structure on water and fat distribution during meat gelling[J].Food Chemistry, 2016, 204:239-245.
[13] BERHE D T, ENGELSEN S B, HVIID M S, et al.Raman spectroscopic study of effect of the cooking temperature and time on meat proteins[J].Food Research International, 2014, 66:123-131.
[14] BEATTIE R J, BELL S J, FARMER L J, et al.Preliminary investigation of the application of Raman spectroscopy to the prediction of the sensory quality of beef silverside[J].Meat Science, 2004, 66(4):903-913.
[15] SOWOIDNICH K, SCHMIDT H, KRONFELDT H D, et al.A portable 671 nm Raman sensor system for rapid meat spoilage identification[J].Vibrational Spectroscopy, 2012, 62:70-76.
[16] XU X L, HAN M Y, FEI Y, et al.Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J].Meat Science, 2011, 87(3):159-164.
[17] BAUER A, SCHEIER R, EBERLE T, et al.Assessment of tenderness of aged bovine gluteus Medius muscles using Raman spectroscopy[J].Meat Science, 2016, 115:27-33.
[18] SCHEIER R, KÖHLER J, SCHMIDT H.Identification of the early postmortem metabolic state of porcine M.semimembranosus using Raman spectroscopy[J].Vibrational Spectroscopy, 2014, 70:12-17.
[19] FOWLER S M, SCHMIDT H, VAN DE VEN R, et al.Predicting meat quality traits of ovine m.semimembranosus, both fresh and following freezing and thawing, using a hand held Raman spectroscopic device[J].Meat Science, 2015, 108:138-144.
[20] BERHE D T, ESKILDSEN C E, LAMETSCH R, et al.Prediction of total fatty acid parameters and individual fatty acids in pork backfat using Raman spectroscopy and chemometrics:Understanding the cage of covariance between highly correlated fat parameters[J].Meat Science, 2016, 111:18-26.
[21] BOYAC
![]() H, TEMIZ H T, UYSAL R S, et al.A novel method for discrimination of beef and horsemeat using Raman spectroscopy[J].Food Chemistry, 2014, 148:37-41.
H, TEMIZ H T, UYSAL R S, et al.A novel method for discrimination of beef and horsemeat using Raman spectroscopy[J].Food Chemistry, 2014, 148:37-41.
[22] CHEN H Y, HAN M Y.Raman spectroscopic study of the effects of microbial transglutaminase on heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristics[J].Food Research International, 2011, 44(5):1 514-1 520.
[23] TELES R C L, FREITAS S M, KAWANO Y, et al.Vibrational spectroscopic analysis of a chymotrypsin inhibitor isolated from Schizolobium parahyba (Vell) Toledo seeds[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 1999, 55(6):1 279-1 289.
[24] FOWLER S M, PONNAMPALAM E N, SCHMIDT H, et al.Prediction of intramuscular fat content and major fatty acid groups of lamb M.longissimus lumborum using Raman spectroscopy[J].Meat Science, 2015, 110:70-75.
[25] SCHEIER R, SCHEEDER M, SCHMIDT H.Prediction of pork quality at the slaughter line using a portable Raman device[J].Meat Science, 2015, 103:96-103.
[26] HERRERO A M.Raman spectroscopy a promising technique for quality assessment of meat and fish:A review[J].Food Chemistry, 2008, 107(4):1 642-1 651.
[27] FOWLER S M, SCHMIDT H, VAN DE VEN R, et al.Predicting tenderness of fresh ovine semimembranosus using Raman spectroscopy[J].Meat Science, 2014, 97(4):597-601.
[28] SCHMIDT H, SCHEIER R, HOPKINS D L.Preliminary investigation on the relationship of Raman spectra of sheep meat with shear force and cooking loss[J].Meat Science, 2013, 93(1):138-143.
[29] WACKERBARTH H, KUHLMANN U, TINTCHEV F, et al.Structural changes of myoglobin in pressure-treated pork meat probed by resonance Raman spectroscopy[J].Food Chemistry, 2009, 115(4):1 194-1 198.
[30] PHONGPA-NGAN P, AGGREY S E, MULLIGAN J H, et al.Raman spectroscopy to assess water holding capacity in muscle from fast and slow growing broilers[J].LWT - Food Science and Technology, 2014, 57(2):696-700.
[31] KANG Z L, WANG P, XU X L, et al.Effect of beating processing, as a means of reducing salt content in frankfurters:A physico-chemical and Raman spectroscopic study[J].Meat Science, 2014, 98(2):171-177.
[32] KANG Z L, WANG P, XU X L, et al.Effect of a beating process, as a means of reducing salt content in Chinese-style meatballs (Kung-wan):A dynamic rheological and Raman spectroscopy study[J].Meat Science, 2014, 96(2):669-674.
[33] SHAO J H, ZOU Y F, XU X L, et al.Evaluation of structural changes in raw and heated meat batters prepared with different lipids using Raman spectroscopy[J].Food Research International, 2011, 44(9):2 955-2 961.
[34] CHEN Q M, XIE Y F, XI J Z, et al.Characterization of lipid oxidation process of beef during repeated freeze-thaw by electron spin resonance technology and Raman spectroscopy[J].Food Chemistry, 2018, 243:58-64.
[35] SCHEIER R, BAUER A, SCHMIDT H.Early postmortem prediction of meat quality traits of porcine semimembranosus muscles using a portable Raman system[J].Food & Bioprocess Technology, 2014, 7(9):2 732-2 741.
[36] NACHE M, SCHEIER R, SCHMIDT H, et al.Non-invasive lactate- and pH-monitoring in porcine meat using Raman spectroscopy and chemometrics[J].Chemometrics & Intelligent Laboratory Systems, 2015, 142:197-205.
[37] NACHE M, HINRICHS J, SCHEIER R, et al.Prediction of the pH as indicator of porcine meat quality using Raman spectroscopy and metaheuristics[J].Chemometrics & Intelligent Laboratory Systems, 2016, 154:45-51.
[38] SCHEIER R, SCHMIDT H.Measurement of the pH value in pork meat early postmortem by Raman spectroscopy[J].Applied Physics B, 2013, 111(2):289-297.
[39] NIAN Y Q, ZHAO M, O'DONNELL C P, et al.Assessment of physico-chemical traits related to eating quality of young dairy bull beef at different ageing times using Raman spectroscopy and chemometrics[J].Food Research International, 2017, 99:778-789.
[40] FOWLER S M, SCHMIDT H, VAN DE VEN R, et al.Raman spectroscopy compared against traditional predictors of shear force in lamb m.longissimus lumborum[J].Meat Science, 2014, 98(4):652-656.
[41] WANG Q, LONERGAN S M, YU C X.Rapid determination of pork sensory quality using Raman spectroscopy[J].Meat Science, 2012, 91(3):232-239.
[42] FOWLER S M, SCHMIDT H, VAN DE VEN R, et al.Preliminary investigation of the use of Raman spectroscopy to predict meat and eating quality traits of beef loins[J].Meat Science, 2018, 138:53-58.
[43] CHEN Q M, ZHANG Y C, GUO Y H, et al.Non-destructive prediction of texture of frozen/thaw raw beef by Raman spectroscopy[J].Journal of Food Engineering, 2020, 266:109693.
[44] KRIMM S, BANDEKAR J.Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins[J].Advances in Protein Chemistry, 1986, 38:181-364.
[45] OLSEN E F, RUKKE E O, FLÅTTEN A, et al.Quantitative determination of saturated-, monounsaturated- and polyunsaturated fatty acids in pork adipose tissue with non-destructive Raman spectroscopy[J].Meat Science, 2007, 76(4):628-634.
[46] OLSEN E F, BAUSTAD C, EGELANDSDAL B, et al.Long-term stability of a Raman instrument determining iodine value in pork adipose tissue[J].Meat Science, 2010, 85(1):1-6.
[47] ARGYRI A A, JARVIS R M, WEDGE D, et al.A comparison of Raman and FT-IR spectroscopy for the prediction of meat;spoilage[J].Food Control, 2013, 29(2):461-470.
[48] JAAFREH S, BREUCH R, GÜNTHER K, et al.Rapid poultry spoilage evaluation using portable fiber-optic Raman spectrometer[J].Food Analytical Methods, 2018, 11(8):2 320-2 328.
[49] MEISEL S,STÖCKEL S, RÖSCH P, et al.Identification of meat-associated pathogens via Raman microspectroscopy[J].Food Microbiology, 2014, 38(2):36-43.
[50] WANG H H, DING S J, WANG G Y, et al.In situ characterization and analysis of Salmonella biofilm formation under meat processing environments using a combined microscopic and spectroscopic approach[J].International Journal of Food Microbiology, 2013, 167(3):293-302.
[51] BOYACI ![]() H, UYSAL R S, TEMIZ T, et al.A rapid method for determination of the origin of meat and meat products based on the extracted fat spectra by using of Raman spectroscopy and chemometric method[J].European Food Research and Technology, 2014, 238(5):845-852.
H, UYSAL R S, TEMIZ T, et al.A rapid method for determination of the origin of meat and meat products based on the extracted fat spectra by using of Raman spectroscopy and chemometric method[J].European Food Research and Technology, 2014, 238(5):845-852.
[52] ROBERT C, FRASER-MILLER S J, JESSEP W T, et al.Rapid discrimination of intact beef, venison and lamb meat using Raman spectroscopy[J].Food Chemistry, 2021, 343:128441.
[53] MOUDACHE M, NER N C, COLON M, et al.Antioxidant effect of an innovative active plastic film containing olive leaves extract on fresh pork meat and its evaluation by Raman spectroscopy[J].Food Chemistry, 2017, 229:98-103.
N C, COLON M, et al.Antioxidant effect of an innovative active plastic film containing olive leaves extract on fresh pork meat and its evaluation by Raman spectroscopy[J].Food Chemistry, 2017, 229:98-103.
[54] BEATTIE R, BELL S E J, BORGAARD C, et al.Multivariate prediction of clarified butter composition using Raman spectroscopy[J].Lipids, 2004, 39(9):897-906.
[55] LYNDGAARD L B, SØRENSEN K M, VAN DEN BERG F, et al.Depth profiling of porcine adipose tissue by Raman spectroscopy[J].Journal of Raman Spectroscopy, 2012, 43(4):482-489.